1.本发明涉及改进的含氟尿嘧啶的局部配制物以及其用途。
背景技术:
2.氟尿嘧啶(国际非专利名称)为化学物质5
‑
氟
‑
2,4(1h,3h)
‑
嘧啶二酮。它可用作抗癌药品,并且已被用于全身治疗各种癌症,包括乳腺癌、膀胱癌和胰腺癌。它还用于局部治疗表浅性基底细胞癌、光化性角化病、日光性角化病和各种形式的瘢痕以及重度痤疮。目前可以获得含氟尿嘧啶的局部配制物,虽然有效,但是它们可引起副作用,主要副作用为皮肤刺激和相关的疼痛、溃疡、红斑等。存在对递送有效透皮剂量的氟尿嘧啶同时最小化这些副作用的改进配制物的需求。
3.us 6,670,335公开由水包油乳液组成的配制物的用途,其中氟尿嘧啶存在于被称为“微海绵”的多孔微颗粒中,并且也存在于乳液中,推测是由于其亲水性而存在于乳液的水相中。
4.仍然持续需要局部施用氟尿嘧啶的改进的递送系统。
5.本发明涉及使用比us 6,670,335的微颗粒具有更好特性的硅纳米颗粒的改进配制物,并且其中氟尿嘧啶基本上完全与具有优异特性的硅纳米颗粒结合。这些纳米颗粒又被包封在包含一种或多种蜡状脂肪酸酯的脂质基质中,该脂质基质基本上不含氟尿嘧啶,并且可被加工成适用于各种局部配制物的粉末,该粉末在施用后具有良好的生物利用度和降低的副作用。
6.硅纳米颗粒
7.已经开发许多以控释或缓释方式递送药物活性成分的方法。然而,以前很少关注载体材料一旦完成其递送和释放活性成分的功能后的命运。本发明使用一种递送系统,其中硅基载体材料在给药后转化为有益物质。
8.为了使得活性成分能够局部递送,大量的研究已经专注于开发以可控方式暂时破坏角质层屏障的策略,使得药品可以足够和可预测的量渗透,从而达到治疗水平。虽然一些技术诸如离子电渗和超声波已经被探索作为皮肤吸收增强剂,但是大部分努力集中于识别无毒的化学渗透增强剂,其可以可逆地与角质层相互作用,以便允许更大量的药品渗透皮肤。早期破坏屏障的尝试使用简单的溶剂或溶剂混合物、表面活性剂和脂肪酸。这些物质虽然能够增加许多化学物质在皮肤上的渗透,但往往伴随着与它们提取皮肤组分或与皮肤组分相互作用的能力相关的不良副作用,从而引起刺激反应。
9.硅为动植物必需的微量元素。硅作为哺乳动物结缔组织基质中发现的蛋白质
‑
糖胺聚糖复合物的组分具有结构作用,并且在生长和成骨中具有代谢作用(硅的存在促进骨骼的矿化过程)。因此,硅对骨骼和结缔组织的正常发育至关重要。众所周知,硅在皮肤健康中也发挥着重要作用,充当胶原蛋白和弹性蛋白的促进剂,并且参与体内的抗氧化过程。它与糖胺聚糖的产生有关,并且依赖硅的酶增加天然组织构建过程的益处。
10.对于医疗应用,硅可制成微颗粒或纳米颗粒,这有助于经由多种途径给药,诸如局
部给药、口服给药、注射给药或植入给药。可生物降解的硅基颗粒也被用于药品靶向。然而,硅的生物利用度通常受到溶解性差的限制和含有机硅的材料往往表现出不可接受的高毒性,限制它们在化妆品、皮肤护理和药物应用中的用途。
11.首先在1956年由arthur ulhir jr.和ingeborg在美国贝尔实验室偶然发现多孔硅。多孔硅的制造范围可从其最初形成到使用浸在氢氟酸(hf)溶液中的单晶硅或多晶硅的染色蚀刻或阳极氧化池的用途。在硅中形成孔允许材料的降解和将活性化合物装载到硅孔中。已经描述使用多孔硅作为其它活性化合物的载体(saffie
‑
siebert r等人,《药品发现世界(drug discovery world)》2005;6:71
‑
6;saffie
‑
siebert,r等人,《欧洲制药技术(pharmaceutical technology europe)》,17(4),21
‑
28(2005);luo,d.,saltzman,w.m.,《基因治疗(gene therapy)》(2006)13,585
‑
586;ahola,m.,kortesuo,p.,kangasniemi,i.,kiesvaara,j.,yli
‑
urpo,a.,《国际药剂学杂志(int.j.pharm.)》195(2000)219 227.ahola.m.,e.s.,raitavuo,m.h.,vaahtio,m.h.,salonen,j.i.,yli
‑
urpo,a.u.o.,《生物材料(biomat.)》(2001),15,2163
‑
2170;lu,j.,liong,m.,zink,j.,tamanoi,f,《small.》2007,3:1341
‑
1346)。然而,这种载体系统的降解产物的重要性也必须受到关注。具体而言,含硅载体系统优选在不聚合的情况下降解以形成硅的有益和生物活性形式原硅酸。
12.硅在水环境内的溶解产物为硅酸。硅酸为元素硅、氢和氧的化合物家族的总称,通式为[sio
x
(oh)4‑
2x
]
n
。在非常稀的水溶液中已识别一些简单的硅酸,诸如偏硅酸(h2sio3)、原硅酸(h4sio4,在25℃下pk
a1
=9.84,pk
a2
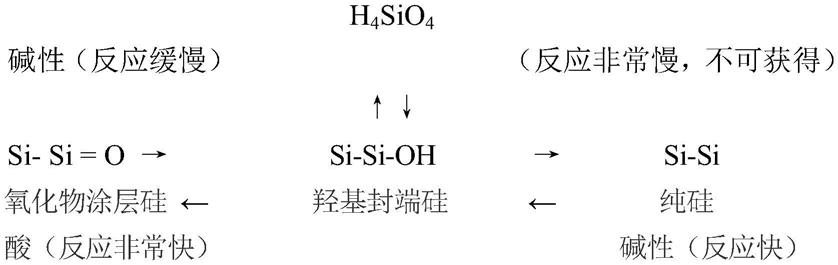
=13.2)、二硅酸(h2si2o5)和焦硅酸(h6si2o7);和另外聚合的硅酸(polysa),其中二氧化硅(sio2)代表完全聚合的终点。硅酸的单体形式,原硅酸(osa),或者称为单硅酸,和二氧化硅代表硅基反应的相反侧,其中二氧化硅代表能量上有利的形式。浓度和ph决定反应的方向以及单体、聚合物和二氧化硅之间的平衡:
[0013]
低浓度/高ph高浓度/低ph
[0014]
h4sio4←→
h
x
sio
y
←→
sio2[0015]
硅酸可被认为是缓冲分子。原硅酸(osa)为一种非常弱的酸,比例如碳酸弱。它根据以下在25℃下以9.84的pk1解离:
[0016]
h3sio4‑
h3o
←→
h4sio4 h2o
[0017]
h4sio4 oh
‑
←→
h3sio4‑
h2o
[0018]
硅酸的pka为约9.8,并且因此代表溶液中电离酸和未解离酸的混合物。电离物种(h3sio4‑
)充当质子清除剂,从溶液中去除质子,并且因此提高溶液的ph。而未解离物种可提供质子来中和氢氧离子,因此提高溶液的ph。以这种方式,硅酸缓冲溶液。值得注意的是,这种缓冲能力在低si浓度下迅速出现。在高si浓度下,低ph促进硅酸发生缩合反应,产生二聚体(h6si2o7)或高级结构,以及水。这些二聚体和高级结构(sio
x
oh
y
)可通过与溶液中存在的氢氧离子反应而解离回单体或低级结构,从而降低ph。同样,这些聚合酸也通过中和氢氧化物而在高ph下解离。因此,这些聚硅酸也可充当缓冲剂,尽管反应要慢得多。
[0019]
二氧化硅[sio2]代表osa完全聚合的终点,这降低其溶解度,从而降低生物利用度、生物降解性和安全性。
[0020]
h4sio4→
2h2o sio2[0021]
由于二聚反应和随后的聚合反应的焓,在环境温度和生物ph下,聚合通常经由以
下进行:
[0022]
h4sio4 h4sio4→
h2o h6si2o7[0023]
[si
n
o
m
]
‑
oh h4sio4→
[si
n 1
o
m 2
]
‑
oh 2h2o
[0024]
这是可逆的过程,因此从二氧化硅到osa的逆反应理论上为可以的;尽管如此,它在生理条件下为热力学不利的,因为它需要ph值高于13和高温。
[0025]
osa与其自身形成二氧化硅的反应可通过将其浓度降低到两个osa分子在溶液中相遇的概率与硅酸二聚体在溶液中遇到oh
‑
离子并且解离的概率相同的程度来限制。仅含硅酸的纯溶液的极限浓度为约10
‑4mol.l
‑1(通过水解和缩合硅醇盐沉淀均匀二氧化硅颗粒的动力学研究(studies of the kinetics of the precipitation of uniform silica particles through the hydrolysis and condensation of silicon alkoxides),《胶体和界面科学杂志(journal of colloid and interface science)》,第142卷,第1期,1991年3月1日,第1
‑
18页g.h bogush和c.f zukoski iv)和超过此浓度,人们不可识别纯osa,因为形成其它polysa物种。然而,在较高的浓度下,可通过添加其它化学物种来防止osa发生聚合。
[0026]
溶解动力学:
[0027][0028]
忽略表面积,溶解动力学取决于ph和活性物种的可用性。溶解过程中的主要反应物种为质子化和去质子化形式的水(关于两个方向反应速率的动力学数据,参见brinker溶胶
‑
凝胶科学与技术)。然而,其它分子的添加可引起副反应,这可极大地将平衡转移到硅酸或氧化硅(玻璃),这取决于这些其它分子的pka值。
[0029]
通过调节ph来控制溶解对于储存应用为可能的,然而体内的ph为由身体严格控制的。因此,在体内使用之前,必须调整通过粒度和表面化学来调节溶解速率。优选增加纯的、质子化的或羟基化的硅的溶解速率。如果期望硅颗粒缓慢溶解,那么合适厚度的氧化物层将在溶解曲线中产生滞后,同时氧化物层缓慢溶解。此氧化物层的厚度将决定水进入硅芯之前的滞后期长度。
[0030]
可需要小心操纵硅表面,因为药品分子的键合将高度依赖于表面能。
[0031]
表面氧化物的生长将增加接触角,有利于疏水性分子的键合,并且降低极性分子的键合。同时表面的羟基化将减少硅表面和入站药品分子之间的接触角,有利于亲水性分子诸如氟尿嘧啶的键合。
[0032]
osa为一种非常弱的酸,在低于9.5的ph水平下不稳定并且迅速从溶液中沉淀出来,或者形成对人体生物利用度不高的溶胶或凝胶。因此,很难制备原硅酸和低聚物的高浓度(>0.5%硅)溶液。此外,由配制物产生的硅酸的类型很大程度上取决于硅酸、硅化合物的浓度以及发生这种溶解的介质的ph。为了在体内获得osa,必须严格控制硅酸浓度。
[0033]
wo 2011/012867提出使用稳定的硅基材料作为有益化合物的递送剂。进行稳定化是为了控制元素硅降解为具有生物活性的原硅酸,同时产生低水平的聚硅酸(polysa),从而提供更好的产物安全性。
[0034]
本发明基于以下认识,即根据wo 2011/012867的方法用稳定剂稳定的硅纳米颗粒不仅提供归因于wo 2011/012867的发明的优点
‑
即改进对生物可利用的osa的降解,而且那些稳定的硅纳米颗粒特别擅长键合和递送氟尿嘧啶,其方式是足够的氟尿嘧啶可装载到稳定的硅纳米颗粒上并且在需要的地方释放,通过包括硅降解的方法,使得稳定的硅纳米颗粒可被包封在蜡状脂质中以产生包含固体颗粒的粉末,其中蜡状脂质和其被配制用于局部给药的任何周围介质基本上不含氟尿嘧啶。这与us 6,670,335的配制物形成对比,其中氟尿嘧啶以不与颗粒结合的显著量存在。本发明允许施用治疗有效剂量,同时减轻初次施用后氟尿嘧啶剂量倾倒在皮肤上引起的皮肤表面灼伤和刺激的副作用。
[0035]
与现有技术的微颗粒相比,使用硅纳米颗粒的优点在于硅材料本身为生物相容的、可生物降解的和高度可调的系统,该系统可制成20至400nm的任选高度多孔的纳米颗粒尺寸,这对于皮肤递送为理想的,因为它太小而不能阻塞毛囊皮脂腺或汗腺管(孔),但是它的小尺寸允许颗粒主动渗透到毛囊的底部,而不仅仅充当表面药品贮库。
[0036]
硅纳米颗粒的使用特别适用于包含氟尿嘧啶的组合物,因为它允许亲水性氟尿嘧啶被配制成疏水性蜡状粉末颗粒,也称为蜡状微球,否则其仅适用于疏水性化合物。
技术实现要素:
[0037]
根据第一方面,本发明提供包含至少50重量%的可水解硅的药物相容纳米颗粒,其表面涂覆有磷脂,其中该涂覆的纳米颗粒与氟尿嘧啶结合。
[0038]
根据第二方面,本发明提供药物相容粉末,其包含其中包封根据本发明第一方面的药物相容纳米颗粒的一种或多种蜡状脂肪酸酯的固体颗粒,其中组合物的超过90重量%的氟尿嘧啶与任选涂覆的纳米颗粒结合。优选地,粉末包含水杨酸盐,例如粉末可包含柳树皮提取物。
[0039]
根据第三方面,本发明提供适于局部施用于皮肤或其它身体表面的药物相容乳膏或凝胶,其包含其中悬浮有根据本发明第二方面的药物相容粉末的乳膏或凝胶基质。
[0040]
根据第四方面,本发明提供包含背衬层和粘合剂膜的粘合贴剂,其中粘合剂膜包含根据本发明第二方面的药物相容粉末或根据本发明第三方面的乳膏或凝胶。
[0041]
根据第五方面,本发明提供根据本发明第一方面的药物相容纳米颗粒、根据本发明第二方面的药物相容粉末、根据本发明第三方面的药物相容乳膏或凝胶或根据本发明第四方面的粘合贴剂,其用作药剂。
[0042]
根据第六方面,本发明提供根据本发明第一方面的药物相容纳米颗粒、根据本发明第二方面的药物相容粉末、根据本发明第三方面的药物相容乳膏或凝胶或根据本发明第四方面的粘合贴剂,其用作治疗表浅性基底细胞癌或光化性角化病、日光性角化病、瘢痕或痤疮的药剂。
[0043]
根据第七方面,本发明提供根据本发明第一方面的药物相容纳米颗粒、根据本发明第二方面的药物相容粉末、根据本发明第三方面的药物相容乳膏或凝胶或根据本发明第四方面的粘合贴剂的用途,其用于制造用于治疗表浅性基底细胞癌或光化性角化病、日光
性角化病、瘢痕或痤疮的药剂。
[0044]
根据第八方面,本发明提供治疗表浅性基底细胞癌或光化性角化病、日光性角化病、瘢痕或痤疮的方法,其包括施用治疗有效量的根据本发明第三方面的药物相容乳膏或凝胶或根据本发明第四方面的粘合贴剂。
具体实施方式
[0045]
定义
[0046]
根据本公开,化合物的衍生物可为具有基本上相同结构但具有一个或多个取代的化合物。例如,一个或多个化学基团可被添加、删除或被另一个基团取代。在某些优选的实施方式中,衍生物保留衍生它的化合物的药物或化妆品活性的至少一部分,例如衍生它的化合物活性的至少90%、80%、70%、60%、50%、40%、30%、20%或10%。在一些实施方式中,与衍生它的化合物相比,衍生物可表现出增加的药物或化妆品活性。
[0047]
例如,在肽的上下文中,肽衍生物可包括其中一个或多个氨基酸残基已被添加、删除或被另一个氨基酸残基取代的肽。在取代的情况下,取代可为非保守取代或保守取代,优选保守取代。
[0048]
根据第一方面,本发明提供包含可水解的至少50重量%的硅的药物相容纳米颗粒,其用磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种)表面涂覆,其中涂覆的纳米颗粒与氟尿嘧啶结合。
[0049]
磷脂涂层优选改性硅的水解速率和/或抑制原硅酸聚合的速率。优选地,它抑制含硅材料的水解速率。
[0050]
在一个实施方式中,含硅材料的水解速率通过磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种)的存在而改性,使得速率小于没有磷脂的相同组合物的水解速率的50%,优选地小于30%,特别是小于10%。
[0051]
通过将水解速率减慢至低于osa被身体吸收或从递送部位移除的速率的水平,例如通过扩散,已经发现可避免或至少减轻osa聚合,并且可实现将osa递送至身体的有益效果。
[0052]
由于单体硅酸降解产物在人体中天然地可利用,因此使用本发明的产物具有非常低的毒性风险,这是优于许多其它递送系统的显著优势。根据本发明的递送系统提供额外的优点,即载体分解以提供已知有益的生物可利用的化合物。例如,已知osa刺激某些细胞类型的细胞增殖和迁移,包括成纤维细胞、内皮细胞和角质形成细胞。
[0053]
有利的是,由根据本发明的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种涂覆的纳米颗粒)降解产生的生物可利用的原硅酸本身作为皮肤、骨骼、毛发、指甲、结缔组织的营养物,以及治疗或预防骨骼或关节疾病诸如关节炎或骨质疏松症可为有益的。
[0054]
已经发现,用磷脂表面涂覆的硅纳米颗粒,特别是如果磷脂涂层呈一个或多个磷脂双层的形式,特别适合与氟尿嘧啶结合。这种结合优选通过相反电荷之间的吸引来实现,
例如,它可为磷脂双层的电荷和/或硅纳米颗粒表面上的电荷与氟尿嘧啶上的电荷之间的静电结合或离子键。根据与本发明所有方面相关的优选实施方式,氨基酸的存在促进结合,并且因此,本发明的所有产物(例如,用磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种表面涂覆的纳米颗粒)也优选包含氨基酸,特别是精氨酸或精氨酸和甘氨酸的混合物。
[0055]
氨基酸(例如,精氨酸和甘氨酸中的一种或多种)的存在也有助于稳定硅纳米颗粒的表面电荷并且改进其与磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种)和氟尿嘧啶的结合。因此,一种或多种氨基酸的存在有助于控制氟尿嘧啶的释放以及硅随时间的稳定性和降解速率。在其最广泛的意义上,术语“氨基酸”包括任何含有胺(
‑
nh2)和羧基(
‑
cooh)官能团的人造或天然存在的有机化合物。它包括α、β、γ和δ氨基酸。它包括任何手性构型的氨基酸。根据一些实施方式,优选天然存在的氨基酸。它可为蛋白原氨基酸或非蛋白原氨基酸(诸如肉碱、左甲状腺素、羟脯氨酸、鸟氨酸或瓜氨酸)。特别优选包含精氨酸或甘氨酸或精氨酸和甘氨酸的混合物。优选地,存在的30%氨基酸为精氨酸。
[0056]
因此,本发明优选的药物相容纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种涂覆的硅纳米颗粒)使得涂覆的纳米颗粒与氟尿嘧啶和氨基酸(优选地选自精氨酸、甘氨酸及其混合物,最优选地精氨酸和甘氨酸两者)结合。
[0057]
与本发明的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且任选地与精氨酸和甘氨酸中的一种或多种结合)结合的柳树皮提取物的存在也有助于改进纳米颗粒与氟尿嘧啶的结合。柳树皮提取物(从黑柳(salix nigra)和/或白柳(salix alba),优选黑柳的树皮中提取)提供基质,氟尿嘧啶可被截留在该基质中,导致氟尿嘧啶与纳米颗粒的结合增加。这将有助于确保在将纳米颗粒递送至治疗部位时氟尿嘧啶的控释,例如当将本发明的纳米颗粒局部递送至皮肤表面时,诸如以乳膏或凝胶的形式。此外,柳树皮提取物典型地包含水杨苷,其被代谢以形成水杨酸,并且已知表现出抗炎和抗氧化活性。
[0058]
根据优选的实施方式,本发明所有方面的产物中存在的至少80重量%,例如至少90重量%的氟尿嘧啶与涂覆的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)结合。
[0059]
氟尿嘧啶和磷脂涂覆的硅纳米颗粒之间的分子结合有利地确保当硅纳米颗粒或其涂层降解时氟尿嘧啶变得生物可利用。因为作为主要降解速率的水解降解速率可控制,所以氟尿嘧啶变为生物可利用的速率也可控制,以便避免剂量倾倒和/或确保仅当纳米颗粒找到远离皮肤表面的位置(例如基底位置)的方式时释放。
[0060]
根据本发明所有方面的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)优选为多孔的。例如,它们的孔隙率可使它们的表面积比同等尺寸的无孔材料的表面积增加至少1.5、2、2.5、3、3.5或4倍。
[0061]
磷脂
[0062]
根据本发明所有方面使用的磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱及其衍生物中的一种或多种)为一种化合物,其任选地改性,例如降低或消除含硅材料在水溶液中,例如在磷酸盐缓冲盐水(pbs)中的水解速率,和/或一旦通过抑制osa的聚合速率从而产生惰性载体而形成,就稳定此类溶液中的osa。因此,磷脂可为例如在含硅材料在水溶液中,特别是在常用的水性缓冲溶液诸如tris或磷酸盐缓冲盐水中水解时,促进osa形成的试剂,和/或在含硅材料水解超过24小时后,抑制osa在水溶液中的聚合速率的试剂。
[0063]
通常,pbs含有以下组分:137mm nacl、2.7mm kcl、10mm磷酸氢二钠、2mm磷酸二氢钾和7.4的ph。pbs被用作在37℃的温度下生理条件的模型。
[0064]
如上所讨论,硅在水性介质中水解成osa,并且然后随后聚合成各种链长和结构的分子实体,最终形成水不溶性硅酸盐。根据本发明的产物优化生物降解过程,使得基本上抑制形成的osa的聚合。以这种方式稳定降解产物,并且控制其特性,特别是溶解度和粘度,以便使生物利用度最大化。这是通过纳米颗粒表面的化学改性来实现的,表面被磷脂稳定剂(例如,磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种)和任选地通过表面缔合的一种或多种氨基酸(例如,精氨酸和甘氨酸中的一种或多种)涂覆。任选地,纳米颗粒也与柳树皮提取物结合。
[0065]
在没有磷脂涂层的情况下,当osa浓度超过10
‑4m,其相当于9.6mg/l或0.48mg/50ml时,聚合迅速进行。在一个实施方式中,磷脂涂层能够稳定浓度高于10
‑4m mg/l,例如0.5mg/50ml或更高的浓度,尤其是0.80mg/50ml或更高的浓度的osa溶液。有利的是,磷脂涂层能够稳定0.90mg/50ml或更高,例如0.95mg/50ml或更高,尤其是1.0mg/50ml或更高的osa溶液。
[0066]
在一个实施方式中,本发明第一方面的产物(其任选地包含柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种)包含基于涂覆的纳米颗粒的总重量的至少5重量%的磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种),例如至少20wt%,典型地至少30wt%,并且尤其是至少50wt%的磷脂。在一个实施方式中,磷脂与硅的摩尔比为至少0.8比1,例如至少1比1,典型地至少1.5比1。已经发现至少2比1的磷脂与硅的摩尔比为特别有利的。
[0067]
在一个实施方式中,磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种)的数均分子量在500至1000的范围内。特别合适的磷脂为甘油磷脂。特别合适的磷脂为其中极性头基连接到季铵部分的那些,诸如磷脂酰胆碱(pc)或氢化磷脂酰胆碱。磷脂的类型可依赖于配制物的性质来选择,中性或负电荷脂质对于非质子配制物为优选的,而正电荷和小ch3链脂质对于质子配制物为优选的。优选地一条或多条侧链为具有15个或更多个碳原子的脂族侧链或具有6个或更多个重复醚单元的醚侧链,例如聚乙二醇或聚丙二醇链。
[0068]
在一个实施方式中,磷脂稳定剂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种)为通过范德华力键合到硅表面的静电吸收物种。优选地,稳定剂的
接触角小于45
°
,更优选小于20
°
,理想地小于10
°
,其通过光密度测定法测量,其中观察和测量硅晶片表面上稳定剂液滴的接触角。接触角越小,表面和稳定剂之间的相互作用越大。产生良好范德华引力的化学特征包括氢饱和分子,诸如饱和脂质。
[0069]
磷脂具有两亲性,具有亲水性的“头”和亲脂性的“一个尾”或“多个尾”。
[0070]
磷脂可自发地形成磷脂双层,其中改变的头基面向外,而脂质尾面向内。根据优选的实施方式(例如,当纳米颗粒用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆时;这种纳米颗粒可任选地与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合),涂覆本发明的纳米颗粒表面的磷脂以磷脂双层的形式存在,例如包含磷脂酰胆碱或氢化磷脂酰胆碱的磷脂双层。
[0071]
除了磷脂酰胆碱之外或作为磷脂酰胆碱的替代物,根据本发明所有方面使用的其它合适的磷脂包括磷脂酰乙醇胺、卵磷脂组分、磷酸肌醇(例如磷脂酰肌醇、磷脂酰肌醇磷酸、磷脂酰肌醇二磷酸和磷脂酰肌醇三磷酸)和鞘磷脂,诸如神经酰胺磷酰胆碱、神经酰胺磷酰乙醇胺和神经酰胺磷酰脂。例如,当纳米颗粒与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合时,可使用这些磷脂中的一种或多种。根据本发明使用的磷脂当然可作为磷脂的混合物使用。例如,当纳米颗粒与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合时,可使用磷脂混合物。磷脂也可用于磷脂和少量非磷脂组分的混合物中
‑
例如,涂层中可包括可用于微调磷脂双层特性的其它脂质或甾醇诸如胆固醇。例如,当纳米颗粒与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合时,可使用磷脂和少量非磷脂组分的混合物。磷脂涂层优选包含至少60%的磷脂,例如至少70%或80%的磷脂。在某些实施方式中,磷脂涂层包含至少60%、70%或80%的磷脂酰胆碱或氢化磷脂酰胆碱(例如,当纳米颗粒与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合时)。优选地,涂层包含由至少80%氢化磷脂酰胆碱组成的双层。
[0072]
因为本发明的纳米颗粒可用于在包括使用熔化的蜡状脂肪酸酯的方法中生产本发明第二方面的粉末,所以磷脂涂层(例如,包含磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种的磷脂涂层)优选能够耐受加热,例如加热至30℃、35℃、40℃、45℃、50℃或55℃
[0073]
优选地,磷脂涂层为磷脂双层(例如,包含磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种的磷脂双层)。例如,磷脂涂层可为包含至少80%氢化磷脂酰胆碱的磷脂双层,当加热至30℃、35℃、40℃、45℃、50℃或55℃保持20分钟时,该磷脂双层保持基本完整。
[0074]
包含可水解硅的纳米颗粒
[0075]
本发明的产物包含硅纳米颗粒。硅纳米颗粒用磷脂表面涂覆,并且与氟尿嘧啶结合。任选地,硅纳米颗粒还与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合。硅纳米颗粒的标称直径在10nm和400nm之间,例如50nm至350nm,例如80nm至310nm,例如100nm至250nm,例如120nm至240nm,例如150nm至220nm,例如约200nm。它们由纯硅或含可水解硅的材料制成。它们优选为多孔的。硅纳米颗粒可通过标准技术制成
多孔的,诸如将颗粒与氢氟酸(hf)/乙醇混合物接触并且施用电流。通过变化hf浓度和电流密度以及暴露时间,可控制孔的密度和它们的尺寸,并且可通过扫描电子显微照相和/或氮吸附解吸体积等温线测量来监测。
[0076]
氟尿嘧啶
[0077]
氟尿嘧啶与硅纳米颗粒和/或磷脂双层(例如,包含磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种的磷脂双层)的表面静电结合。优选地,本发明的产物(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆,并且任选地与柳树皮提取物和/或一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合的硅纳米颗粒)中总氟尿嘧啶的至少90%与硅纳米颗粒和/或磷脂双层表面物理结合或吸附在其上。也就是说,总氟尿嘧啶的不到10%为游离的。
[0078]
柳树皮提取物
[0079]
本发明的产物(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆,与氟尿嘧啶结合并且任选地与一种或多种氨基酸诸如精氨酸和甘氨酸中的一种或多种结合的硅纳米颗粒)可包含柳树皮提取物。柳树皮提取物可从许多来源商购获得。例如,柳树皮提取物可从意大利米兰巴雷焦(bareggio(milano)italy)9via petrolo litta,20010的艾缇公司(active concepts,sri.)获得。柳树皮提取物典型地包含水杨苷,其结构如下所示:
[0080][0081]
水杨苷为β
‑
葡萄糖苷,并且为水杨酸的衍生物。水杨苷在人体内典型地被代谢成水杨酸。当水杨苷被代谢时,其缩醛醚桥分解,产生葡萄糖和水杨醇。水杨酸然后由水杨醇中的醇基氧化产生。
[0082]
柳树皮提取物可从黑柳或白柳的树皮中提取,优选地从黑柳的树皮中提取。柳树皮提取物可以粉末诸如衍生自粉末状柳树皮的粉末的形式在本发明的产物中提供。或者,柳树皮提取物可以溶液诸如水溶液或乙醇溶液的形式在本发明的产物中提供。液态柳树皮提取物典型地为无色至浅琥珀色的。
[0083]
已知柳树皮提取物表现出抗氧化活性以及抗炎活性。因此,柳树皮提取物可用作抗衰老配制物中的活性成分。柳树皮提取物通常因其镇痛特性而被出售,因为它典型地含有8至12wt%的水杨苷(或更一般地,8至12wt%的水杨酸盐)。因此,商购获得的柳树皮提取物的特征通常在于其含有一定wt%的水杨苷、水杨酸盐或水杨酸。
[0084]
粉末
[0085]
根据第二方面,本发明提供药物相容粉末,其包含其中包封根据本发明第一方面
的药物相容纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒,其也可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)的一种或多种蜡状脂肪酸酯的固体颗粒,其中组合物的超过65重量%的氟尿嘧啶与涂覆的纳米颗粒结合。优选组合物的少于10重量%的氟尿嘧啶存在于组合物的蜡状脂肪酸酯部分中。
[0086]
粉末(例如,包含其中包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒的一种或多种蜡状脂肪酸酯的固体颗粒的粉末,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)优选包含最大尺寸在30微米和550微米之间的近似球形颗粒。例如,至少90%的颗粒的最大尺寸可在50微米和500微米(或100微米和500微米或150微米和400微米)之间。因为本发明粉末的固体颗粒显著大于本发明的纳米颗粒,所以每个颗粒典型地将包封本发明的多个纳米颗粒。
[0087]
蜡状脂肪酸酯(例如,其中包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒的蜡状脂肪酸酯,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)的熔点优选在25℃和45℃之间,例如在28℃和42℃之间,例如在30℃和40℃之间。其熔点优选使得其在皮肤接触时熔化。根据某些实施方式(例如,当蜡状脂肪酸酯包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒时,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合),蜡状脂肪酸酯为硬脂醇的酯,尽管也可使用其它脂肪醇的酯,特别是饱和脂肪酸的醇,例如辛醇、癸醇、月桂醇、肉豆蔻醇、棕榈醇和油醇的酯。优选地,酯的脂肪组分为庚酸或辛酸。根据优选的实施方式(例如,当蜡状脂肪酸酯包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒时,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合),蜡状脂肪酸酯为癸酸的酯(即癸酸十六烷酯),和/或硬脂醇庚酸酯和硬脂醇辛酸酯的混合物。组合物可另外包含1
‑
十六醇。在某些优选的实施方式中,组合物包含硬脂醇庚酸酯、硬脂醇辛酸酯和1
‑
十六醇的混合物。优选地,蜡状脂肪酸酯具有润肤特性。
[0088]
相变调节剂
[0089]
示例:柠檬烯和普朗尼克(pluronic)
[0090]
粉末(例如,包含其中包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒的一种或多种蜡状脂肪酸酯的固体颗粒的粉末,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)可任选地包含萜烯诸如柠檬烯和/或替代表面活性剂诸如普朗尼克(聚(乙二醇)
‑
嵌段
‑
聚(丙二醇)
‑
嵌段
‑
聚(乙二醇))。
[0091]
柠檬烯至少有两个作用。首先,它有助于调节蜡状脂肪酸酯的相变温度,从而在调节本发明粉末的固体颗粒的最终熔点方面发挥作用。它还可充当皮肤上的渗透促进剂,并且加速氟尿嘧啶的吸收速率。也可使用其它表面活性剂,诸如普朗尼克(尤其是普朗尼克l
‑
61),优选除柠檬烯之外,而不是作为完全的替代物。柠檬烯还可凭借其乳化剂特性改进本发明的产物的保质期和稳定性。优选使用(r)
‑
( )
‑
柠檬烯(约90%)。也可使用其它纯化形
式较低的柠檬烯,诸如柑橘精油,但可需要更高的浓度才能达到相同的效果。
[0092]
局部乳膏和凝胶
[0093]
根据第三方面,本发明提供适于局部施用于皮肤或其它身体表面的药物相容乳膏或凝胶,其包含其中悬浮根据本发明第二方面的药物相容粉末(例如,包含其中包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒的一种或多种蜡状脂肪酸酯的固体颗粒的粉末,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)的乳膏基质。
[0094]
fda和ema关于局部配制物中氟尿嘧啶最大水平的指南规定总计5重量%为最大推荐水平。因此,根据优选的实施方式,局部乳膏和凝胶包含至多5重量%、至多6重量%、至多4重量%、至多3重量%、至多2重量%、至多1重量%或至多0.5重量%的氟尿嘧啶。
[0095]
治疗基底细胞癌的常用剂量为1%、2%和5%。治疗角化病的常用剂量为0.5%。在5%剂量方案内,推荐的治疗持续时间为3至6周;然而,在病变消失之前,可需要长达10至12周的治疗。
[0096]
药物相容乳膏包含乳膏基质。乳膏基质典型地为油包水或水包油的乳液。优选地,它们为水包油乳液,其中油相含有脂质、甾醇和润肤剂,以及大部分的(例如至少50%、70%或80%)本发明第二方面的粉末的混合物。如上所述的萜烯基本上可在水相中找到。优选地,在乳膏或凝胶的水相中存在非常少的氟尿嘧啶(例如少于氟尿嘧啶总重量的5%或少于2%),并且在乳膏的油相中存在非常少的氟尿嘧啶(例如少于氟尿嘧啶总重量的5%或少于2%)。
[0097]
药物相容凝胶包含分散在油的液相中的本发明第二方面的粉末。凝胶优选为水凝胶(胶体凝胶),其包含交联聚合物,诸如聚环氧乙烷、聚丙烯酰胺或琼脂糖、甲基纤维素、透明质酸、弹性蛋白样多肽、卡波姆(聚丙烯酸)、明胶或胶原蛋白。
[0098]
可优选使用具有亲水性基质的凝胶(例如含有三乙醇胺的卡波姆凝胶),因为一旦蜡状脂肪酸酯包封破裂并且氟尿嘧啶与凝胶基质接触,此类凝胶就可有利于氟尿嘧啶的快速吸收。
[0099]
本发明第三方面的药物相容乳膏或凝胶可包含在0.05重量%和5重量%之间的氟尿嘧啶,诸如在0.05重量%和4重量%之间、在0.05重量%和3重量%之间、在0.05重量%和2重量%之间或在0.05重量%和1重量%之间的氟尿嘧啶。药物相容乳膏或凝胶可包含在1重量%和5重量%之间、在2重量%和5重量%之间、在3重量%和5重量%之间或在4重量%和5重量%之间的氟尿嘧啶。任选地,药物相容乳膏或凝胶另外包含在0.5重量%和20重量%之间的水杨酸盐,诸如在5重量%和15重量%之间、在6重量%和14重量%之间、在7重量%和13重量%之间或在8重量%和12重量%之间的水杨酸盐。
[0100]
粘合贴剂
[0101]
根据第四方面,本发明提供包含背衬层和粘合剂膜的粘合贴剂,其中粘合剂膜包含根据本发明第二方面的药物相容粉末(例如,包含其中包封用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅纳米颗粒的一种或多种蜡状脂肪酸酯的固体颗粒的粉末,涂覆的硅纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)或根据本发明第三方面的乳膏或凝胶(乳膏或凝胶包含其中悬浮有根据本发明第二方面的药物相容粉末的乳膏基质)。
[0102]
根据本发明的贴剂典型地为透皮贴剂,并且由背衬层组成,背衬层可为纺织品、聚合物或纸,并且保护贴剂免受外部环境的影响;任选的膜,例如防止氟尿嘧啶通过背衬层迁移的聚合物膜;和粘合剂。氟尿嘧啶优选存在于根据本发明第二方面的粉末中,或者存在于根据本发明第三方面的凝胶或乳膏中。含氟尿嘧啶的产物可提供在贴剂的粘合剂层或贮库中,或者当氟尿嘧啶含于凝胶中时,凝胶可充当贴剂产物内的贮库(所谓的“单片”装置)。优选地,含氟尿嘧啶的产物存在于粘合剂层中。
[0103]
通过降低最终用户不小心或不适当使用的可能性,贴剂在确保受试者的正确剂量方面可为有用的。此外,贴剂将限制治疗区域,避免无意中扩散到其它区域。
[0104]
医疗
[0105]
本发明的产物(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)适用于治疗包括表浅性基底细胞癌、光化性角化病、日光性角化病和瘢痕的疾病。适合治疗的瘢痕包括瘢痕疙瘩、增生性瘢痕和手术后瘢痕。本发明的产物也可用于治疗痤疮,特别是重度痤疮。
[0106]
基底细胞癌的优选剂量(占产物重量的百分比)为1%、2%和5%。较低的剂量,例如0.25%至1%或0.1%至0.5%可适用于其它状况,例如瘢痕。
[0107]
联合治疗
[0108]
除了氟尿嘧啶产物之外,本发明可包括一种或多种另外的活性药物成分,并且本发明的方法可包括使用另外的活性药物成分(api)。另外的api可方便地与氟尿嘧啶共配制(例如,另外的api可与氟尿嘧啶共配制,用于经由用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒递送;在此类实施方式中,纳米颗粒也可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)。用于基底细胞癌治疗的尤其优选的另外的api包括咪喹莫特(imiquimod)、维莫德吉(vismodegib)和姜黄素(curcumin)。用于治疗角化病的尤其优选的另外的api包括咪喹莫特、巨大戟醇甲基丁烯酸酯(ingenol mebutate)、双氯芬酸(diclofenac)、类视黄醇(retinoids)(例如阿达帕林(adapalene)、他扎罗汀(tazarotene)、视黄醇(retinol)、异维甲酸(isotretinoin)、阿曲汀(acitretin)和维甲酸(tretinoin))。用于治疗瘢痕疙瘩的尤其优选的另外的api包括水杨酸、皮质类固醇和干扰素。用于治疗痤疮的尤其优选的另外的api包括壬二酸、过氧化苯甲酰、水杨酸、抗生素、类视黄醇、烟酰胺和抗组胺药,或者它们各自的天然来源提取物,即柳树皮提取物。
[0109]
治疗方案
[0110]
本发明的产物和方法(例如,包含用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒的产物,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)可根据确定为合适的任何剂量方案使用。例如,治疗可持续直到疾病治愈或直到没有另外的改善产生。用于治疗角化病的典型剂量疗程持续3至20周,例如3至12周、5至15周或5至12周。类似的方案可用于其它状况。
[0111]
含硅材料
[0112]
如本文所用,术语“含可水解硅的材料”为任何含硅材料,其在施用于人类或动物受试者后,可及时水解为osa。典型地,1mg含可水解硅的材料的纳米颗粒在37℃下在一小时
内在100ml生理缓冲液(例如pbs)中水解。本发明的含硅材料包含至少50wt%的硅。例如,本发明的含硅材料可包含至少70wt%的硅。含硅材料可为基本上纯的硅,例如包含至少90wt%硅,优选至少95wt%硅,尤其是至少99wt%硅的材料。含可水解硅的材料典型地为半导体材料,诸如非晶硅。半导体级硅典型地包含非常高纯度的硅,例如至少99.99wt%。基本上纯的硅材料可任选地包括痕量的其它元素,诸如硼、砷、磷和/或镓,例如作为半导体掺杂剂。基本上纯的硅材料可为例如含有痕量硼或另一种第iii族元素的p型掺杂硅晶片,或者是例如含有痕量磷或另一种第vi族元素的n型硅晶片。硅材料的表面典型地包括硅烷醇(si
‑
oh)基团。根据本发明使用的合适的含可水解硅的材料包括但不限于半导体级的纳米硅(单晶或多晶)和纳米硅。
[0113]
合适地,本发明的产物(例如,包含用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合的产物)的硅含量在0.01
‑
50wt%的范围内,优选在0.01
‑
10wt%的范围内,更优选在0.1
‑
10wt%的范围内,并且最优选在0.1
‑
5wt%的范围内。在一个实施方式中,基于组合物的总重量,组合物的硅含量在1wt%至30wt%,例如2wt%至20wt%,优选3wt%至15wt%的范围内。
[0114]
纳米颗粒
[0115]
为了本发明的目的,术语“纳米颗粒”典型地用于描述具有纳米范围内的至少一个尺寸,即300nm或更小,并且具有与纳米颗粒相同的行为和特性的颗粒。根据本发明使用的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的纳米颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)的平均粒径典型地小于300nm,优选小于200nm,尤其是小于100nm。在一个实施方式中,纳米颗粒的平均粒径在10至100nm,优选20至80nm,尤其是10至50nm的范围内。在其它实施方式中,纳米颗粒的平均粒径为50至200nm、60至250nm或80至240nm。在优选的实施方式中(例如,当硅纳米颗粒用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆时,这些纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合),纳米颗粒的平均粒径为30至100nm。平均粒径为平均最大颗粒尺寸,应当理解颗粒不一定为球形的。可以方便地使用常规技术测量颗粒尺寸,诸如显微镜技术,例如扫描电子显微镜。
[0116]
在一些实施方式中,根据本发明使用的硅颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆的硅颗粒,其与氟尿嘧啶结合,并且还可与柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合)的平均粒径可小于1000μm,例如1至1000μm、100至1000μm或500至1000μm。硅颗粒的平均粒径可小于500μm,例如1至500μm或100至500μm。硅颗粒的平均粒径可小于50μm,例如1至50μm或25至50μm。硅颗粒的平均粒径可小于10μm,例如1至10μm或5至10μm。
[0117]
在一些实施方式中(例如,当硅纳米颗粒用磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种涂覆时,这些纳米颗粒与氟尿嘧啶和任选的柳树皮提取物和/或氨基酸诸如精氨酸和甘氨酸中的一种或多种结合),与本发明相关的纳米颗粒具有球形或基本球形的形状。形状可通过传统的光学或电子显微镜技术方便地评估。
[0118]
含硅纳米颗粒的制备
[0119]
与本发明相关的含硅纳米颗粒可通过本领域常规技术方便地制备,例如通过研磨工艺或通过其它已知的减小颗粒尺寸的技术。含硅纳米颗粒由硅酸钠颗粒、胶态二氧化硅或硅晶片材料制成。宏观或微观尺度的颗粒在球磨机、行星球磨机、等离子体或激光烧蚀方法或其它尺寸减小机构中磨削。产生的颗粒被空气分类以回收纳米颗粒。也可以使用等离子体方法和激光烧蚀来生产纳米颗粒。
[0120]
多孔纳米颗粒可通过本领域的常规方法制备,包括本文所述的方法。
[0121]
磷脂的添加
[0122]
在添加稳定磷脂(例如,磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种,特别是磷脂酰胆碱、氢化磷脂酰胆碱以及其衍生物中的一种或多种)之前,优选“活化”多孔纳米颗粒,以便改进磷脂的粘附性。活化可通过任何合适的方式进行。例如,可用挥发性溶剂(例如乙醇、甲醇、丙酮或二甲苯)洗涤多孔纳米颗粒,然后使其蒸发。或者,多孔纳米颗粒可用与水混溶的挥发性溶剂(例如醇诸如乙醇)洗涤,并且然后在水中洗涤并且通过冷冻干燥步骤将水干燥。
[0123]
然后可将磷脂添加到活性纳米颗粒中。优选地,这是通过将磷脂溶解在挥发性溶剂诸如醇像甲醇和乙醇中,将其与纳米颗粒混合,并且然后在搅拌颗粒的同时使溶剂蒸发(例如使用旋转蒸发系统)来完成的。
[0124]
粉末的制备
[0125]
通过将磷脂涂覆的纳米颗粒(例如,用磷脂酰胆碱、氢化磷脂酰胆碱、磷脂酰乙醇胺、卵磷脂组分以及其衍生物中的一种或多种涂覆的纳米颗粒)置于熔融蜡状脂肪酸酯或其混合物中(优选温度不超过30℃、35℃、37℃、40℃、45℃、50℃或55℃)并且混合来制备粉末。蜡状脂肪酸酯然后通过任何合适的方法转化成粉末,例如通过固化然后研磨或者通过乳化然后固化。萜烯诸如柠檬烯的添加可有助于乳化。
[0126]
萜烯也能够辅助整个配制物的相变状态。可构成熔融蜡状脂肪酸酯或其混合物的几种脂质一旦施用于皮肤上就不能熔化(即1
‑
十六醇)。萜烯的使用有助于这些颗粒在施用于皮肤上后,通过在皮肤上摩擦粉末引起的体温/摩擦而融化。
[0127]
乳膏和凝胶的制备
[0128]
乳膏和凝胶可简单地通过将粉末与乳膏或凝胶基质分散(即混合)来配制。例如,可将粉末搅拌成药物乳膏基质。就凝胶而言,粉末可被搅拌成粉末形式的凝胶基质,然后凝胶被水合,或者它可被搅拌成预水合凝胶。
[0129]
贴剂的制备
[0130]
可通过任何合适的方法配制贴剂,例如,可生产含有粘膜粘附性亲水性凝胶的贴剂,凝胶可用本发明的粉末生产,分散在其中,并且凝胶可任选地通过温和蒸发水来干燥,以成为具有所需粘附特性的膜。
[0131]
实施例
[0132]
本发明可通过以下非限制性实施例另外说明。
[0133]
材料
[0134]
蒸馏水、癸酸十六烷酯、柠檬烯、碳酸氢钠、5
‑
氟尿嘧啶(5fu)、1
‑
十六醇、活性硅纳米颗粒(sinp,100nm)、氢化磷脂酰胆碱(phospholipon 90g,淡黄色蜡
‑
氢化磷脂酰胆碱仅完全溶于etoh)、蒸馏水、乙醇。
[0135]
硅制备
[0136]
单面抛光的p型或n型硅晶片购自德国(germany)的si
‑
mat。所有清洁和蚀刻试剂都是洁净室级的。使用电阻率为0.005v
·
cm
‑1的重掺杂p型si(100)晶片作为衬底。通过低压化学气相沉积系统沉积200nm的氮化硅层。使用标准光刻技术,以使用evg 620接触对准器进行图案化。通过施用80ma
·
cm
‑2的电流密度持续25s,在氢氟酸(hf)和乙醇(3:7v/v)的混合物中形成多孔纳米颗粒。通过施用320ma
·
cm
‑2的电流密度持续6s,在比率为2:5(v/v)的49%的hf:乙醇混合物中形成高孔隙率层。通过施用80ma
·
cm
‑2的电流密度持续25s,可在hf(49%)和乙醇(3:7v/v)的混合物中形成更小的孔。在特定情况下,通过施用6ma
·
cm
‑2的电流密度持续1.75min,在hf(49%)和乙醇(1:1v/v)的混合物中形成孔。在用hf去除氮化物层后,通过在异丙醇中超声1min而释放颗粒。通过扫描电子显微照片(sem)确定主要为半球形的形状。孔的尺寸可通过氮气吸附
‑
解吸体积等温线来确定。在蚀刻后,样品用纯乙醇冲洗,并且在使用前在干燥的高纯度氮气流下干燥。
[0137]
使用球磨机和/或研杵和研钵粉碎蚀刻的硅晶片,p 或n
‑
晶片。
[0138]
使用retsch品牌的38μm筛规和as200振动筛筛分细粉末。所选尺寸(20
‑
100μm)的均匀性为通过筛子的孔径实现的。颗粒尺寸由quantachrome系统和马尔文仪器公司(malvern instruments)的pcs测量。样品保存在密闭容器中,直到另外使用。
[0139]
纳米硅粉末也从西格玛(sigma)和中国凯尔(hefei kaier,china)获得。在进行装载和蚀刻之前,通过pcs测量并且记录颗粒尺寸(尺寸范围在20
‑
100nm之间)。使用球磨机或研钵和研杵粉碎硅晶片。使用retsch品牌的38μm筛规和as200振动筛筛分细粉末,收集所需尺寸的均匀纳米颗粒。
[0140]
硅纳米颗粒的活化
[0141]
将250ml乙醇和500mg直径为30
‑
100nm的多孔硅纳米颗粒混合并且搅拌30分钟。然后将溶液以3000rpm离心30分钟。弃去上清液,将纳米颗粒在5ml蒸馏水中洗涤,并且转移到圆底烧瓶中。将烧瓶的内容物冷冻(在
‑
25℃下2小时)。冷冻的纳米颗粒使用冷冻干燥机冷冻干燥过夜。所得干粉为活性硅纳米颗粒。
[0142]
或者,将250ml甲醇和500g直径为30nm的多孔硅纳米颗粒混合并且搅拌120分钟。将获得的糊状物转移到特定的托盘上进行脱水,以便完全蒸发有机溶剂残余物(24小时,室温)。一旦获得固体薄层,就将此层粉碎并且研磨,直到获得粉末。所得干粉为活性硅纳米颗粒。
[0143]
氢化磷脂酰胆碱双层膜的稳定化
[0144]
制备含150mg氢化磷脂酰胆碱的30ml乙醇。将烧瓶连接到在45℃下的旋转蒸发系统,直到样品干燥(至少5分钟)。
[0145]
脂质体的再水合和使用氟尿嘧啶装载
[0146]
将15mg稳定的纳米颗粒转移到烧杯中,还将300mg氟尿嘧啶添加到其中。将20ml蒸馏水添加到混合物中,并且通过在30℃下超声处理5分钟,然后涡旋,将烧杯的内容物均质化。
[0147]
氟尿嘧啶装载稳定颗粒的干燥
[0148]
在前一方法中获得的溶液在冰箱中冷却(4℃持续至少2小时),然后冷冻(
‑
20℃持续至少4小时)。冷冻溶液冷冻干燥过夜以获得粉末,并且储存在冰箱中直到另外使用。这些
稳定颗粒可直接分散到合适的凝胶中,或者任选地另外涂覆,以改性api的释放动力学。任选地,颗粒可另外与柳树皮提取物结合(参见下文的方案,其中根据本发明的颗粒另外与柳树皮提取物结合)。
[0149]
含氟尿嘧啶纳米颗粒粉末的制备
[0150]
将1.00g的1
‑
十六醇和0.7g癸酸十六烷酯转移到250ml的高形烧杯中。将装载氟尿嘧啶的颗粒粉末(即如上制备的)添加到烧杯中。在单独的烧杯中,煮沸120ml蒸馏水,将1.0g碳酸氢钠与2ml相变调节剂一起添加到其中。加热含有含癸酸十六烷酯的1
‑
十六醇以及5fu的烧杯,直到内容物熔化成油状液体。用冰块和丙酮作为其周围夹套中的冷却混合物来制备polimix旋转混合器。将油状液体混合物转移到烧杯中,并且以930rpm放入polimix混合器中。将煮沸的碳酸氢钠/相变调节剂溶液添加到油状液体混合物中。30秒后,混合器速度设定为830rpm,并且在外部冷却下放置15分钟。然后将所得粉末从溶液中过滤出来,并且干燥5至6天。
[0151]
贴剂的制造
[0152]
·
将1.0g羟丙甲纤维素粉末分散在预先加热的40ml蒸馏水中,然后将烧杯放在加热板上(t=40℃,磁力搅拌rpm=7)3小时。
[0153]
·
当所得悬浮液呈现乳白色时,在没有任何磁力搅拌的情况下,将凝胶从加热板中取出,让样品在室温下冷却,然后移动至冰箱中过夜。
[0154]
·
一旦温度达到4℃,就添加0.25g普朗尼克。
[0155]
·
轻轻混合获得的混合物,并且添加50ml纯净水。
[0156]
·
将样品保存在冰箱中直到使用。请注意,这种凝胶需要用另外50ml含有适量5fu的配方进行稀释。称取所需量的本发明粉末,轻轻分散到15ml凝胶中。将获得的混合物均质化,以确保微球均匀分散在凝胶中。
[0157]
·
凝胶的最终浓度为[1.0%羟丙甲纤维素和0.25%普朗尼克l
‑
61]。
[0158]
方法
[0159]
·
称取0.05g edta并且分散到20ml水(之前加热至60℃)中,放入合适的烧杯中。搅拌直到完全溶解。
[0160]
·
称取0.05g pvp(聚乙烯吡咯烷酮)k90并且分散在上述溶液中。搅拌直到完全溶解。
[0161]
·
称取0.80g natrosol(羟乙基纤维素)并且分散在上述溶液中,轻轻搅拌。
[0162]
·
称取0.15g海藻糖并且分散在上述溶液中。轻轻搅拌直到形成均质化的物质。
[0163]
·
当产物达到室温时,添加15ml蒸馏水和0.5ml柠檬烯,然后轻轻搅拌。
[0164]
·
超声处理上述溶液2小时。
[0165]
·
在烧杯中称量5.0g上述粘性溶液
[0166]
·
将0.4g如上所述制备的装载有氟尿嘧啶的本发明粉末添加到获得的粘性凝胶中,然后轻轻搅拌。
[0167]
·
将获得的与粉末混合的粘性溶液转移到硅槽模具(4.5cm
×
4.5cm)中,然后移入恒温室(30℃,15
‑
35%re)中20小时。
[0168]
获得的膜为装载有本发明粉末的粘膜粘合剂膜,准备施用于皮肤,并且可另外提供有合适的背衬层。
[0169]
与柳树皮提取物结合的硅纳米颗粒的制备
[0170]
用于制备包含纳米颗粒装载的0.5wt%氟尿嘧啶和10wt%柳树皮提取物的纳米颗粒的示例性方案如下。
[0171]
材料
[0172][0173][0174]
氢化磷脂酰胆碱(pc)原液(溶液a)的制备
[0175]
·
将624mg pc溶解在250ml乙醇中并且超声处理。最终浓度为2.5mg/ml。
[0176]
pc
‑
柳树皮干泡沫再水合溶液(溶液b)的制备
[0177]
·
将16mg活性硅纳米颗粒(sinp)(30nm)添加到烧杯中。
[0178]
·
将4mg精氨酸添加到烧杯中。然后将2mg甘氨酸添加到烧杯中。
[0179]
·
将1500mg氟尿嘧啶添加到含有sinp、精氨酸和甘氨酸的同一烧杯中。
[0180]
·
通过搅拌15分钟,将此混合物分散在200ml蒸馏水中。
[0181]
使用磷脂酰胆碱和柳树皮提取物形成基于脂质的薄膜pc
‑
柳树皮干泡沫
[0182]
·
将624mg氢化磷脂酰胆碱溶解在250ml乙醇中,然后在45℃下的水浴中超声处理至少10分钟。然后,将此混合物移动到圆底烧瓶中。
[0183]
·
将30ml柳树皮提取物添加到圆底烧瓶中。
[0184]
·
将圆底烧瓶连接到旋转蒸发系统。
[0185]
·
将旋转蒸发在最大速率下维持45分钟(在室温下)。
[0186]
·
将温度降低至
‑
45℃。让样品干燥至少15分钟。
[0187]
·
产物将呈现为厚的白色泡沫。
[0188]
pc
‑
柳树皮干脂质基泡沫的再水合
[0189]
·
将16mg活性硅纳米颗粒(sinp,尺寸为30nm)添加到烧杯中。
[0190]
·
将4mg精氨酸添加到烧杯中。然后将2mg甘氨酸添加到同一烧杯中。
[0191]
·
将1500mg氟尿嘧啶添加到含有sinp、精氨酸和甘氨酸的同一烧杯中。
[0192]
·
通过在30℃下超声处理5分钟,将混合物分散在120ml蒸馏水中。
[0193]
·
涡旋溶液,使组分均质化。
[0194]
·
将溶液添加到含有干泡沫(pc和柳树皮提取物)配制物的圆底烧瓶中。涡旋,直到泡沫完全溶解。
[0195]
·
用10ml蒸馏水洗涤圆底烧瓶。
[0196]
·
将获得的溶解泡沫(总量130ml)在30℃下超声处理30分钟。
[0197]
·
放入冰箱1小时,然后在(
‑
25℃)下移动到冰箱约3小时。
[0198]
·
将管连接到冷冻干燥装置上至少3天,以通过蒸发溶剂获得干粉。
[0199]
获得的粉末可储存以用纯净水重构并且与适当的载剂混合。任选地,可省略冷冻干燥步骤,并且超声处理的溶解泡沫可直接与预期的载剂混合。
16404;第iv组白色念珠菌(c.albicans)atcc10231;第v组大肠杆菌(e.coli)atcc 8739。结果指示细菌和酵母/霉菌计数的pet通过结果。
[0220][0221]
豚鼠皮肤致敏测试(glp研究)
[0222]
对豚鼠进行magnusson
‑
kligman致敏测试,以确定本发明的氟尿嘧啶结合的纳米颗粒是否引起皮肤致敏反应。研究包括皮内和局部诱导阶段和挑战阶段。测试符合以下标准:美国国家标准协会/医疗仪器促进协会/国际标准化组织(american national standards institute/association for the advancement of medical instrumentation/international organization for standardization)(ansi/aami/iso)10993
‑1‑
医疗装置生物学评价
‑
第2部分:动物保护要求(biological evaluation of medical devices
‑
part 2:animal welfare requirements);和ansi/aami/iso10993
‑
10
‑
医疗装置生物学评价
‑
第10部分:刺激和皮肤致敏测试(biological evaluation of medical devices
‑
part 10:tests for irritation and skin sensitization)。
[0223]
结果表明,在挑战贴剂移除后的24小时或48小时,任何测试部位都没有刺激。基于这些发现和使用的评价系统,用氟尿嘧啶配制的本发明的纳米颗粒不被认为是接触敏化剂。
[0224]
皮肤致敏测试的评分系统
[0225][0226]
皮肤致敏测试结果
[0227][0228]
人类皮肤刺激/致敏评价临床安全性研究(重复损伤贴剂测试
‑
ript)
[0229]
所有人类皮肤试验都是在人类患者(n=52)中进行的双盲研究。在与皮肤刺激/致敏评价相关的人类受试者安全性测试(重复损伤贴剂测试
‑
ript)中,将0.2ml测试材料直接分配到受试者皮肤的指定区域并且风干。重复此过程,直到连续三周每周三天连续施用一系列9个贴剂区域。然后,受试者在另外施用材料前有10至14天的休息时间,并且在另外的24和48小时的时段内进行评估。
[0230]
评分系统如下:
[0231]0‑
没有任何效果的证据
[0232]
0.5
‑
(几乎不可察觉到)最小的微弱(浅粉色)均匀或点状红斑
[0233]1‑
(轻度)覆盖大部分接触部位的粉红色均匀红斑
[0234]2‑
(中度)粉红色/红色红斑在整个接触区域中明显均匀
[0235]3‑
(显著)鲜红色红斑,伴有水肿、瘀点或丘疹
[0236]4‑
(重度)深红色红斑,伴有水疱或渗出,伴有或不伴有水肿
[0237]
在使用闭塞贴剂的24小时贴剂测试皮肤刺激评价中,所有52名受试者的评分均为零(0),并且在研究过程期间没有任何不良反应,也没有出现红斑。因此,根据本发明配制的测试材料在施用于皮肤时被认为是
‘
非主要刺激物’。
[0238]
对于重复损伤贴剂测试(ript)皮肤刺激/致敏评价,所有52名受试者在评价时间点0h、24h和48h的评分均为零(0)。在研究过程期间没有任何不良反应。因此,根据本发明配制的测试材料被认为是人类皮肤的
‘
非主要刺激物’和
‘
非主要敏化剂’。
[0239]
与氟尿嘧啶和柳树皮结合的硅纳米颗粒活性的体外渗透测试
[0240]
制备根据本发明的纳米颗粒,其与不同量的氟尿嘧啶和/或柳树皮提取物结合。制备三种此类配制物,参见表1。作为对照样品,使用efudex乳膏,其包含5wt%氟尿嘧啶、硬脂醇、白色软石蜡、聚山梨酯60、丙二醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯和纯净水。
[0241]
表1
‑
测试样品
[0242][0243][0244]
体外渗透测试(ivpt)用于检查每个样品在24小时内通过人体皮肤的渗透曲线。下面的表2示出随时间的推移在受体液体中检测到的氟尿嘧啶的量,即在ivpt期间通过供体室和受体室之间的皮肤膜的氟尿嘧啶的量。在表2中,b.i.q.代表低于量化极限。
[0245]
表2
‑
氟尿嘧啶在ivpt期间随时间的推移渗透到受体液体
[0246]
时间(h)efudexs1s2s30.25b.i.q.b.i.q.b.i.q.b.i.q.1b.i.q.b.i.q.b.i.q.b.i.q.2b.i.q.b.i.q.b.i.q.b.i.q.4b.i.q.b.i.q.b.i.q.b.i.q.2241.637μgb.i.q.9.927μgb.i.q.2454.538μgb.i.q.1.145μgb.i.q.渗透总计%7.090 1.466 [0247]
如表2所示,悬浮在常规efudex乳膏中的氟尿嘧啶能够容易地穿过皮肤膜。然而,与本发明的纳米颗粒结合的氟尿嘧啶以更可控的方式被递送至皮肤,并且不以这种方式穿过皮肤。当柳树皮与本发明的纳米颗粒结合使用时,对皮肤的递送仍然受到控制(与efudex相比),但是与没有柳树皮的本发明的纳米颗粒相比,渗透到皮肤的每一层的速率稍高。
[0248]
在24小时结束时,在皮肤的每一层分析每个样品的渗透曲线。结果在表3中示出。
[0249]
表3
‑
24小时ivpt后氟尿嘧啶渗透到皮肤层
[0250]
皮肤层efudexs1s2s3角质层b.i.q.b.i.q.b.i.q.b.i.q.表皮b.i.q.1.555%5.622%b.i.q.真皮b.i.q.b.i.q.9.505%b.i.q.受体液体7.090%1.555%1.466%b.i.q.
[0251]
如表3所示,悬浮在常规efudex乳膏(5wt%氟尿嘧啶)中的氟尿嘧啶穿过皮肤膜,而不被截留在任何皮肤层中。当氟尿嘧啶与本发明的纳米颗粒(s1,5wt%氟尿嘧啶)结合时,其释放更受控制,并且少量释放到表皮中,没有氟尿嘧啶到达受体液体。在较低浓度的氟尿嘧啶(s3,0.5wt%氟尿嘧啶)下,没有观察到氟尿嘧啶的释放。然而,当柳树皮提取物与本发明的纳米颗粒(s2,0.5wt%氟尿嘧啶)结合时,看到氟尿嘧啶以受控的方式释放到皮肤的每一层中,很少的氟尿嘧啶进入受体液体。
[0252]
体外franz细胞渗透试验
[0253]
在体外franz细胞渗透试验中,还将常规efudex乳膏(5wt%氟尿嘧啶)与s2(10wt%柳树皮提取物,0.5wt%氟尿嘧啶)进行比较。24小时后,采集组织样品,分离皮肤组
织层,然后进行氟尿嘧啶提取和药品的生物分析定量,以确定氟尿嘧啶在皮肤组织层内的定位程度和药品通过皮肤组织样品的渗透。检查的组织样本包括从角质层、表皮和真皮收集的样本。
[0254]
在efudex的情况下,没有发现氟尿嘧啶存在于角质层、表皮或真皮中。发现施用于efudex乳膏中3.55%的氟尿嘧啶完全渗透到皮肤层中。这表明,对于常规efudex乳膏,任何通过角质层的氟尿嘧啶都以不受控制的方式快速穿过剩余的皮肤层。
[0255]
在s2的情况下,在角质层或表皮中没有发现氟尿嘧啶。然而,发现在s2中施加的氟尿嘧啶有10.13%存在于真皮中,而仅有0.73%完全渗透到皮肤中。这表明,当施用与本发明的纳米颗粒结合的氟尿嘧啶时,与仅包含分散在乳膏基质中的氟尿嘧啶悬浮分子的常规乳膏(诸如efudex)相比,它以更可控的方式穿过皮肤。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。