使用重组vwf(rvwf)进行预防性治疗的方法
1.相关申请的交叉引用
2.本技术要求2019年2月1日提交的美国临时专利申请号62/800,370的优先权,所述专利申请特此以引用的方式整体并入。
背景技术:
3.凝血疾病,诸如血管性血友病(von willebrand disease,vwd),通常由凝血级联的缺陷引起。血管性血友病(vwd)是指由血管性血友病因子缺陷引起的疾病群组。血管性血友病因子有助于血小板凝集在一起并粘着到血管壁上,这是正常血凝所必需的。
4.血管性血友病(vwd)是最常见的遗传性出血病症,估计的患病率为1%(veyradier a,等人,medicine(baltimore).2016,95(11):e3038)。然而,除去较轻微的疾病形式,实际上只有约1/10,000患者需要治疗。目前对这些凝血病的治疗包括使用包含正常凝血因子的药物制剂的替代疗法。
5.vwf是在血浆中以大小在约500至20,000kd范围内的一系列多聚体形式循环的糖蛋白。vwf的全长cdna已被克隆;多肽原对应于全长前原vwf(prepro
‑
vwf)的氨基酸残基23至764(eikenboom等人(1995)haemophilia 1,77 90)。vwf的多聚体形式由250kd多肽亚基通过二硫键连接在一起构成。vwf介导初始血小板粘附到损伤的血管壁的内皮下膜,且较大的多聚体展现出增强的止血活性。多聚化的vwf通过vwf的a1结构域中的相互作用与血小板表面糖蛋白gp1bα结合,促进血小板粘附。vwf上的其他位点介导与血管壁的结合。因此,vwf在血小板和血管壁之间形成桥梁,所述桥梁对高剪切应力条件下血小板粘附和初级止血是至关重要的。正常情况下,内皮细胞分泌vwf的较大聚合形式而vwf的具有较低分子量的那些形式由蛋白水解切割产生。具有特大分子质量的多聚体储存于内皮细胞的weibel
‑
pallade小体中并且在受激动剂诸如凝血酶和组胺刺激时被释放。
6.对于vwd患者,考虑到需要长期止血,特别是在大手术和应对其他出血发作时,建议他们采用血管性血友病因子(vwf)替代治疗。然而,预防性治疗没有得到很好的描述或了解。本领域仍需要使用预防性治疗方案在此类出血发作发生之前帮助患者。本发明通过提供用人rvwf预防性治疗vwd的方法来满足这种需要。
技术实现要素:
7.本发明提供了一种用于预防性治疗患有严重血管性血友病(vwd)的受试者的自发性出血发作的方法。所述方法包括每周两次向受试者施用至少一个剂量的重组血管性血友病因子(rvwf),所述剂量的范围为至少约40iu/kg至约80iu/kg,从而降低自发性出血发作的频率和/或持续时间。
8.在一些实施方案中,rvwf的至少一个剂量的范围为至少约50iu/kg至约80iu/kg。
9.在一些实施方案中,受试者具有范围为20iu/dl或更少的基线vwf瑞斯托霉素辅因子活性(vwf:rco)或被诊断为患有1型vwd。在某些实施方案中,受试者被诊断为患有2a、2b或2m型vwd。在特定实施方案中,受试者具有范围为3iu/dl或更多的vwf:抗原含量(vwf:ag)
或被诊断为患有3型vwd。
10.在一些实施方案中,所述受试者在初始施用rvwf之前的过去12个月内已经施用了血浆来源vwf(pdvwf)的预防性治疗。
11.在一些实施方案中,受试者在过去12个月内经历了至少3次自发性出血发作。
12.在所述方法的一些实施方案中,rvwf的施用每3至4天进行一次。在一些实施方案中,施用在7天周期的第1天和第5天、第2天和第6天或第3天和第7天进行。在某些实施方案中,施用至少每24小时、36小时、48小时、72小时或84小时进行一次。在一些实施方案中,施用至少每72小时进行一次。
13.在一些实施方案中,所概述的方法还包括向受试者施用至少一个剂量的重组因子viii(rfviii)。在一些实施方案中,至少一个剂量的rfviii的施用与至少一个剂量的rvwf同时或依序施用。
14.在一些实施方案中,受试者在接受择期手术或口腔手术后恢复预防性治疗。在一些实施方案中,如果择期手术是小手术或口腔手术并且受试者具有至少0.4iu/ml或更多的fviii活性(fviii:c),那么在手术前向受试者施用rvwf而无rfviii。在某些实施方案中,如果择期手术是大手术并且受试者具有至少0.8iu/ml或更多的fviii活性(fviii:c),那么在手术前向受试者施用rvwf而无rfviii。
15.在一些实施方案中,预防性治疗功效由相对于治疗前年出血率(abr),rvwf预防期间自发性出血发作的abr降低≥25%来指示。
16.在一些实施方案中,预防性治疗功效由相对于治疗前年出血率(abr),rvwf预防期间自发性出血发作的abr降低≥25%、≥30%、≥35%、≥40%、≥45%、≥50%、≥55%、≥60%、≥65%、≥70%、≥75%、≥80%、≥85%、≥90%或≥95%来指示。
17.在一些实施方案中,预防性治疗功效通过检测rvwf预防性治疗前后从受试者获得的样品中的vwf:rco和/或fviii活性来测量。
18.在一些实施方案中,预防性治疗功效通过检测rvwf预防性治疗前后从受试者获得的样品中的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性来测量。
19.在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在rvwf预防性治疗后15分钟、30分钟、60分钟、3小时、6小时、12小时、24小时、28小时、32小时、48小时、72小时或96小时获得。
20.在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在rvwf预防性治疗后25至31天获得。
21.在一些实施方案中,预防性治疗功效在出血发作后或期间测定,其中用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在出血发作后获得,并且进一步,其中样品在rvwf施用前、rvwf施用后2小时和接着每12
‑
24小时获得,直到出血发作消退。
22.在一些实施方案中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平的改善来指示。
23.本文还提供了一种用于预防性治疗患有严重血管性血友病(vwd)的受试者的自发性出血发作的方法。所述方法包括向受试者施用周剂量的重组血管性血友病因子(rvwf),
其基本上等同于先前施用于所述受试者的对应周剂量的血浆来源vwf(pdvwf),从而降低自发性出血发作的频率和/或持续时间。
24.在一些实施方案中,rvwf的周剂量比pdvwf的对应周剂量少约10%。在一些实施方案中,rvwf的周剂量比pdvwf的对应周剂量多约10%。
25.在一些实施方案中,rvwf的周剂量是在不同日子施用的两次单独输注。在一些实施方案中,rvwf的周剂量是在不同日子施用的三次单独输注。在一些实施方案中,rvwf的周剂量是单次输注。
26.在一些实施方案中,每次单独输注包含至多达80iu/kg的rvwf。
27.在一些实施方案中,每次单独输注包含80iu/kg的rvwf。
28.在一些实施方案中,每次单独输注包含50iu/kg的rvwf。
29.在一些实施方案中,受试者具有范围为20iu/dl或更少的基线vwf瑞斯托霉素辅因子活性(vwf:rco)或被诊断为患有1型vwd。在一些实施方案中,受试者被诊断为患有2a、2b或2m型vwd。在一些实施方案中,受试者具有范围为3iu/dl或更多的vwf:抗原含量(vwf:ag)或被诊断为患有3型vwd。
30.在一些实施方案中,受试者已接受pdvwf预防性治疗至少12个月。
31.在一些实施方案中,两次单独输注在7天周期的第1天和第5天、第2天和第6天或第3天和第7天施用。在某些实施方案中,三次单独输注在7天周期的第1天、第3天和第6天施用。在一些实施方案中,施用至少每24小时、36小时、48小时、72小时或84小时进行一次。在特定实施方案中,施用至少每72小时进行一次。
32.在一些实施方案中,本文提供的方法还包括向受试者施用至少一个剂量的重组因子viii(rfviii)。
33.在一些实施方案中,至少一个剂量的rfviii的施用与周剂量的rvwf同时或依序施用。
34.在一些实施方案中,受试者在接受择期手术或口腔手术后恢复预防性治疗。在一些实施方案中,如果择期手术是小手术或口腔手术并且受试者具有至少0.4iu/ml或更多的fviii活性(fviii:c),那么在手术前向受试者施用rvwf而无rfviii。在一些实施方案中,如果择期手术是大手术并且受试者具有至少0.8iu/ml或更多的fviii活性(fviii:c),那么在手术前向受试者施用rvwf而无rfviii。
35.在一些实施方案中,预防性治疗功效由相对于治疗前年出血率(abr),rvwf预防期间自发性出血发作的abr降低≥25%来指示。
36.在一些实施方案中,预防性治疗功效由相对于治疗前年出血率(abr),rvwf预防期间自发性出血发作的abr降低≥25%、≥30%、≥35%、≥40%、≥45%、≥50%、≥55%、≥60%、≥65%、≥70%、≥75%、≥80%、≥85%、≥90%或≥95%来指示。
37.在一些实施方案中,预防性治疗功效通过检测rvwf预防性治疗前后从受试者获得的样品中的vwf:rco和/或fviii活性来测量。
38.在一些实施方案中,预防性治疗功效通过检测rvwf预防性治疗前后从受试者获得的样品中的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性来测量。
39.在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在rvwf预防性治疗后15分钟、30分钟、60分钟、3小时、6小时、12小时、24小
时、28小时、32小时、48小时、72小时或96小时获得。
40.在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在rvwf预防性治疗后25至31天获得。
41.在一些实施方案中,预防性治疗功效在出血发作后或期间测定,其中用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在出血发作后获得,并且进一步,其中样品在rvwf施用前、rvwf施用后2小时和接着每12
‑
24小时获得,直到出血发作消退。
42.在一些实施方案中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平的改善来指示。
43.在一些实施方案中,自发性出血或出血发作包括选自由关节积血、鼻衄、肌肉出血、口腔出血和消化道出血组成的组的任一种。
44.在所述任何方法的一些实施方案中,受试者未被诊断为患有2n型vwd或假vwd。
45.本发明的其他目的、优点和实施方案将从以下详细描述中显而易见。
附图说明
46.图1示出了本文所述的全球、多中心、开放标签、3期研究(nct02973087,eudract no.:2016
‑
001478
‑
14)的研究设计。
47.图2示出了关键研究纳入和排除标准的表。
48.图3示出了用于rvwf预防的示例性给药时间表的表。
49.图4示出了主要研究结果指标的表。
50.图5a
‑
图5c示出了人重组前原vwf的核酸序列。
51.图6a
‑
图6j示出了人重组前原vwf的氨基酸序列。
52.图7a
‑
图7g示出了人重组成熟vwf的氨基酸序列。
具体实施方式
53.引言
54.对于vwd患者,考虑到需要长期止血,特别是在大手术时,建议他们采用血管性血友病因子(vwf)替代治疗(mannucci pm和franchini m.,haemophilia,2017,23(2):182
‑
187;national institutes of health.national heart,lung,and blood institute.the diagnosis,evaluation,and management of von willebrand disease nih publication no.08
‑
5832;2007年12月)。血浆来源vwf疗法含有因子viii(fviii),并且在重复给药下具有fviii积聚的潜力。
55.美国批准的和其欧盟批准的等效物均包含在不添加外源人或动物来源的蛋白质的情况下通过重组dna技术在中国仓鼠卵巢细胞系中制造的重组血管性血友病因子(rvwf)浓缩物(turecek pl,等人2009;29(增刊1):s32
‑
38;mannucci pm,等人blood,2013;122(5):648
‑
657;gill jc,等人blood,2015;126(17):2038
‑
2046;european medicines agency.veyvondi summary of product characteristics)。rvwf包含全vwf多聚体概况,包括暴露于adamts13(vwf切割蛋白)的血
浆来源vwf(pdvwf)浓缩物中通常缺乏的超大多聚体。
56.大多数vwd患者出现轻度至中度粘膜出血和创伤或手术后出血,但也可能发生危及生命的出血,特别是在患有严重疾病的患者中(nichols等人,haemophilia,2008,14:171
‑
232;leebeek fw和eikenboom jc,n engl j med,2016,375:2067
‑
80)。预期降低出血发作的频率和持续时间将减少对红细胞输血的需要,并降低包括关节病的使人衰弱的合并症的风险。
57.患有严重vwd的患者可受益于预防性rvwf治疗以维持vwf和fviii水平,使得自发性出血发作(be)(包括关节积血、鼻衄和消化道出血)的风险降低(abshire tc,thromb res 2009,124(增刊1):s23
‑
6;berntorp e,haemophilia 2008,14(增刊5):47
‑
53;berntorp e和petrini p,blood coagul fibrinolysis,2005,16(增刊1):s23
‑
6;berntorp e,semin thromb hemost,2006,32:621
‑
5;abshire等人,haemophilia,2013,19:76
‑
81;abshire tc,j thromb haemost,2015,13:1585
‑
9)。
58.本发明提供了用于预防性治疗患有严重血管性血友病(vwd)的患者的自发性出血的方法。所述方法包括向受试者施用重组血管性血友病因子(rvwf)。在一些实施方案中,向受试者施用范围为约40
‑
80iu/kg的每周两次的剂量的rvwf。在一些实施方案中,向受试者施用范围为约40
‑
80iu/kg的周剂量的rvwf。在一些情况下,周剂量以每周一次单次施用提供。在某些情况下,周剂量以一周内不同日子的两次单独施用提供。在其他情况下,周剂量以一周内不同日子的三次单独施用提供。
59.pct申请公布号wo2012/171031的公开内容出于所有目的以引用的方式整体并入本文。
60.定义
61.在进一步描述本发明之前,应理解本发明不限于所述的具体实施方案,因此,当然也可有所变化。还应理解,本文所用的术语仅出于描述具体实施方案的目的,并且不意图具有限制性,因为本发明的范围将仅受限于所附权利要求书。
62.如本文所用,“rvwf”是指重组vwf。
63.如本文所用,“rfviii”是指重组fviii。
64.在参考例如细胞或核酸、蛋白质或载体一起使用时,术语“重组”表明细胞、核酸、蛋白质或载体已通过引入异源核酸或蛋白质或改变天然核酸或蛋白质来进行修饰,或者表明细胞源自如此修饰的细胞。因此,例如,重组细胞表达在细胞的天然(非重组)形式中未发现的基因或者表达原本被异常表达、表达不足或完全未表达的天然基因。
65.如本文所用,“重组vwf”包括通过重组dna技术获得的vwf。在某些实施方案中,本发明的vwf蛋白可包含构建体,例如,如1986年10月23日公布的wo 1986/06096和以ginsburg等人之名于1990年7月23日提交的美国专利申请序号07/559,509中制备的构建体,所述参考关于制备重组vwf的方法以引用的方式并入本文。本发明中的vwf可以包括所有潜在形式,包括单体和多聚体形式。还应当理解,本发明涵盖待组合使用的不同形式的vwf。例如,本发明的vwf可以包括不同的多聚体、不同的衍生物和生物活性衍生物与非生物活性衍生物两者。
66.在本发明的上下文中,重组vwf涵盖源自例如哺乳动物,诸如灵长类动物、人、猴子、兔、猪、啮齿动物、小鼠、大鼠、仓鼠、沙鼠、犬、猫的vwf家族的任何成员和其生物活性衍
生物。还涵盖具有活性的突变体和变体vwf蛋白以及vwf蛋白的功能片段和融合蛋白。此外,本发明的vwf还可包含促进纯化、检测或二者的标签。本文所述的vwf还可用治疗性部分或适合用于体外或体内成像的部分进行修饰。
67.如本文所用,“血浆来源vwf”或“pdvwf”包括在血液中发现的所有形式的蛋白质,其包括从哺乳动物获得的具有体内稳定(例如结合)至少一种fviii分子的特性的成熟vwf。
68.术语“高度多聚vwf”或“高分子量vwf”是指包含至少10个亚基,或12、14或16个亚基至约20、22、24或26个或更多亚基的vwf。术语“亚基”是指vwf的单体。如本领域已知的,它通常是聚合形成更大级别的多聚体的vwf的二聚体(参见turecek等人,semin.thromb.hemost.2010,36(5):510
‑
521,其出于所有目的且特别是针对关于vwf的多聚体分析的所有教义,特此以引用的方式整体并入)。
69.如本文所用,术语“因子viii”或“fviii”是指具有凝血因子viii的典型特征的任何形式的因子viii分子,无论是患者内源性的、血浆来源的或通过使用重组dna技术产生的,并且包括所有修饰形式的因子viii。因子viii(fviii)天然地并且作为由单基因产物产生的异质性分布的多肽存在于治疗性制剂中(参见,例如andersson等人,proc.natl.acad.sci.usa,83:2979
‑
2983(1986))。含有因子viii的治疗性制剂的可商购获得的实例包括以商品名hemofil m、advate和recombinate(可购自baxter healthcare corporation,deerfield,ill.,u.s.a.)销售的那些。
70.如本文所用,“血浆fviii活性”和“体内fviii活性”可互换使用。使用标准测定测量的体内fviii活性可以是内源性fviii活性、治疗学上施用的fviii(重组或血浆来源的)活性或内源性和施用的fviii两者的活性。相似地,“血浆fviii”是指内源性fviii或施用的重组或血浆来源fviii。
71.如本文所用,“血管性血友病”是指由血管性血友病因子缺陷引起的疾病群组。血管性血友病因子有助于血小板凝集在一起并粘着到血管壁上,这是正常血凝所必需的。如本文进一步详细描述,存在若干类型的血管性血友病,包括1、2a、2b、2m和3型。
72.术语“分离的”、“纯化的”或“生物学上纯的”是指基本上或实质上不含如在天然状态中发现的通常所伴随的组分的材料。纯度和均质性通常使用分析化学技术诸如聚丙烯酰胺凝胶电泳或高效液相色谱法测定。vwf是制剂中存在的主要物质,是基本上纯化的。在一些实施方案中,术语“纯化的”表示核酸或蛋白质在电泳凝胶中基本上产生一个条带。在其他实施方案中,意指核酸或蛋白质为至少50%纯的,更优选至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或以上纯的。在其他实施方案中,“纯化”(purify)或“纯化(purification)”意指从待纯化的组合物中去除至少一种污染物。在这个意义上,纯化不需要经纯化的化合物是均质的,例如100%纯的。
73.如本文所用,“施用”(和所有语法等同物)包括静脉内施用、肌内施用、皮下施用、口服施用、作为栓剂施用、局部接触、腹腔内、病灶内或鼻内施用或向受试者植入缓释装置例如微量渗透泵。通过任何途径进行施用,包括胃肠外和透粘膜(例如经口、经鼻、经阴道、经直肠或透皮)。胃肠外施用包括例如静脉内、肌内、小动脉内、真皮内、皮下、腹腔内、脑室内和颅内施用。其他递送模式包括但不限于脂质体制剂、静脉内输注、透皮贴剂等的使用。
74.术语“治疗有效量或剂量”或“治疗足够量或剂量”或“有效或足够的量或剂量”是指施用时产生治疗效果的剂量。例如,可用于治疗血友病的药物的治疗有效量可以是能够
预防或缓解一种或多种与血友病相关的症状的量。精确的剂量将取决于治疗的目的,并且可由本领域技术人员使用已知的技术确定(参见,例如,lieberman,pharmaceutical dosage forms(1
‑
3卷,1992);lloyd,the art,science and technology of pharmaceutical compounding(1999);pickar,dosage calculations(1999);和remington:the science and practice of pharmacy,第20版,2003,gennaro编,lippincott,williams和wilkins)。
75.如本文所用,术语“患者”和“受试者”可互换使用,并且是指患有疾病或有感染疾病的可能性的哺乳动物(优选地,人)。
76.如本文所用,术语“约”表示自指定值加上或减去10%的近似范围。例如,语言“约20%”涵盖18%
‑
22%的范围。
77.如本文所用,术语“半衰期”是指经历衰变(或从样品或患者中清除)的物质的量减少一半所需的时间段。
78.i.重组血管性血友病因子(rvwf)
79.本发明利用包含血管性血友病因子(rvwf)的组合物来预防性治疗患有严重vwd的受试者的自发性出血发作。在一些实施方案中,治疗降低了自发性出血发作的严重程度、发生率(频率)和/或持续时间。
80.在某些实施方案中,本发明的vwf蛋白可包含构建体,例如,如1986年10月23日公布的wo 1986/06096和以ginsburg等人之名于1990年7月23日提交的美国专利申请序号07/559,509中制备的构建体,所述参考关于制备重组vwf的方法以引用的方式并入本文。对本发明有用的vwf包括所有潜在形式,包括单体和多聚体形式。一种特别有用的形式的vwf为至少两个vwf的同源多聚体(homo
‑
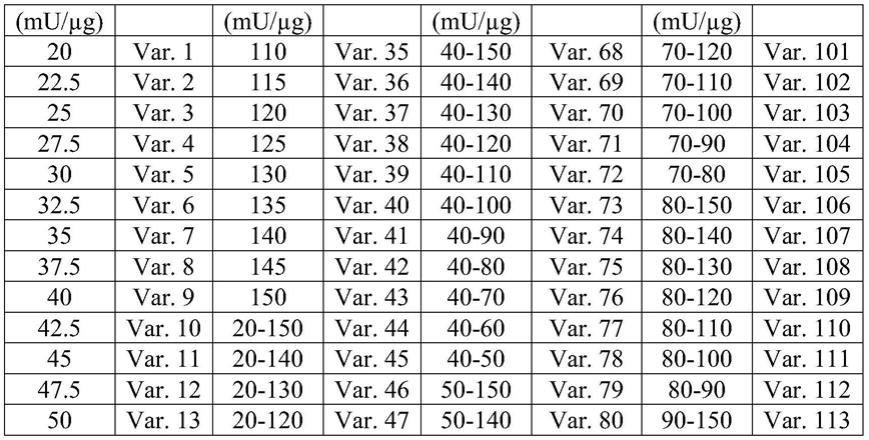
multimer)。vwf蛋白可以是生物活性衍生物,或当仅用作fviii的稳定剂时,vwf可以是非生物活性形式。还应当理解,本发明涵盖待组合使用的不同形式的vwf。例如,对本发明有用的组合物可以包含不同的多聚体、不同的衍生物和生物活性衍生物与非生物活性衍生物两者。
81.在初级止血中,vwf充当血小板和细胞外基质的特定组分(诸如胶原)之间的桥梁。vwf在此过程中的生物活性可以通过不同的体外测定测量(turecek等人,semin.thromb.hemost.28:149
‑
160,2002)。瑞斯托霉素辅因子测定是基于在vwf的存在下由抗生素瑞斯托霉素诱导的新鲜或福尔马林固定血小板的凝集。
82.血小板凝集的程度取决于vwf浓度并且可以通过比浊法(例如,通过使用凝集计)测量(weiss等人,j.clin.invest.52:2708
‑
2716,1973;macfarlane等人,thromb.diath.haemorrh.34:306
‑
308,1975)。第二种方法是胶原结合测定,其是基于elisa技术(brown和bosak,thromb.res.43:303
‑
311,1986;favaloro,thromb.haemost.83:127
‑
135,2000)。微孔板上涂覆i型或iii型胶原。接着,vwf结合至胶原表面并且随后用酶标多克隆抗体检测。最后一步是底物反应,其可使用elisa阅读器进行光度监测。如本文所提供,本发明的vwf的瑞斯托霉素辅因子的比活性(vwf:rco)通常以vwf的mu/μg来描述,如使用体外测定所测量。
83.本发明的rvwf组合物相对于pdvwf的优点是rvwf展现出比pdvwf更高的比活性。在一些实施方案中,本发明的rvwf具有至少约20、22.5、25、27.5、30、32.5、35、37.5、40、42.5、45、47.5、50、52.5、55、57.5、60、62.5、65、67.5、70、72.5、75、77.5、80、82.5、85、87.5、90、
92.5、95、97.5、100、105、110、115、120、125、130、135、140、145、150mu/μg或更高的比活性。
84.本发明的rvwf是包含约10至约40个亚基的高度多聚体。在另外的实施方案中,使用本发明的方法产生的多聚体rvwf包含约10
‑
30、12
‑
28、14
‑
26、16
‑
24、18
‑
22、20
‑
21个亚基。在另外的实施方案中,rvwf以大小从二聚体至超过40个亚基的多聚体(>1000万道尔顿)不等的多聚体存在。最大的多聚体提供可以与血小板受体和损伤的内皮下基质位点两者相互作用的多结合位点,并且是vwf最具止血活性的形式。adamts13的应用随时间推移将切割超大rvwf多聚体,但在制备期间(通常通过在细胞培养物中表达),本发明的rvwf组合物通常不会暴露于adamts13并保持其高度多聚结构。
85.在一个实施方案中,本文所述的方法中使用的rvwf组合物具有如下特征的rvwf寡聚体分布:95%的寡聚体具有6个亚基至20个亚基。在其他实施方案中,rvwf组合物具有如下特征的rvwf寡聚体分布:95%的寡聚体具有选自wo 2012/171031(其出于所有目的以引用的方式整体并入本文)的表2中发现的变动458至641的亚基范围。
86.在一个实施方案中,rvwf组合物可以根据以特定更高级别的rvwf多聚体或更大的多聚体存在的rvwf分子的百分比表征。例如,在一个实施方案中,本文所述的方法中使用的rvwf组合物的至少20%的rvwf分子以至少10个亚基的寡聚复合物存在。在另一个实施方案中,本文所述的方法中使用的rvwf组合物的至少20%的rvwf分子以至少12个亚基的寡聚复合物存在。而在其他实施方案中,本文提供的方法中使用的rvwf组合物具有最小百分比的(例如具有至少x%)以根据表3至表5中发现的变动134至457中任一者(其出于所有目的以引用的方式整体并入本文)的特定更高级别的rvwf多聚体或更大的多聚体(例如至少y个亚基的多聚体)存在的rvwf分子。
87.根据上文,施用于受试者(有或没有fviii)的rvwf组合物通常包含显著百分比的高分子量(hmw)rvwf多聚体。在另外的实施方案中,hmw rvwf多聚体组合物包含至少10%
‑
80%rvwf十聚体或更高级别的多聚体。在另外的实施方案中,组合物包含约10
‑
95%、20
‑
90%、30
‑
85%、40
‑
80%、50
‑
75%、60
‑
70%十聚体或更高级别的多聚体。在另外的实施方案中,hmw rvwf多聚体组合物包含至少约10%、20%、30%、40%、50%、60%、70%、80%、90%十聚体或更高级别的多聚体。
88.rvwf多聚体的数量和百分比的评估可以使用本领域已知的方法进行,包括但不限于使用电泳和尺寸排阻色谱法按大小分离vwf多聚体的方法,例如如cumming等人所讨论(j clin pathol.1993may;46(5):470
‑
473,其出于所有目的且特别是出于涉及vwf多聚体评估的所有教义,特此以引用的方式整体并入)。此类技术还可包括免疫印迹技术(诸如蛋白质印迹(western blot)),其中凝胶由放射性标记的抗vwf抗体进行免疫印迹,之后进行化学发光检测(参见,例如wen等人,(1993),j.clin.lab.anal.,7:317
‑
323,其出于所有目的且特别是出于涉及vwf多聚体评估的所有教义,特此以引用的方式整体并入)。另外的vwf测定包括vwf:抗原(vwf:ag)、vwf:瑞斯托霉素辅因子(vwf:rcof)和vwf:胶原结合活性测定(vwf:cba),这些经常用于血管性血友病的诊断和分类(参见,例如favaloro等人,pathology,1997,29(4):341
‑
456,其出于所有目的且特别是出于涉及vwf测定的所有教义,特此以引用的方式整体并入)。
89.在另外的实施方案中,本发明的更高级别的rvwf多聚体在施用后约1小时至约90小时是稳定的。而在另外的实施方案中,更高级别的rvwf多聚体在施用后约5
‑
80、10
‑
70、
15
‑
60、20
‑
50、25
‑
40、30
‑
35小时是稳定的。而在另外的实施方案中,更高级别的rvwf多聚体在施用后至少3、6、12、18、24、36、48、72小时是稳定的。在某些实施方案中,rvwf多聚体的稳定性在体外评估。
90.在一个实施方案中,本文提供的组合物和方法中使用的更高级别的rvwf多聚体在施用后具有至少12小时的半衰期。在另一个实施方案中,更高级别的rvwf多聚体在施用后具有至少24小时的半衰期。而在其他实施方案中,更高级别的rvwf多聚体具有选自wo2012/171031(其出于所有目的以引用的方式整体并入本文)的表6中发现的变动642至1045的半衰期。
91.在特定方面,根据本发明使用的rvwf(重组或血浆来源的)未经任何缀合、翻译后或共价修饰进行修饰。在特定的实施方案中,本发明的rvwf未经水溶性聚合物进行修饰,所述水溶性聚合物包括但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、聚唾液酸、羟乙基淀粉、多糖部分等。
92.在其他方面,根据本发明使用的rvwf(重组或血浆来源的)经由缀合、翻译后修饰或共价修饰进行修饰,所述修饰包括n
‑
或c
‑
末端残基的修饰以及所选侧链,例如在游离巯基、伯胺和羟基处的修饰。在一个实施方案中,水溶性聚合物通过赖氨酸基团或其他伯胺连接(直接或经接头)至蛋白质。在一个实施方案中,本发明的rvwf蛋白可以通过水溶性聚合物的缀合进行修饰,所述水溶性聚合物包括但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、聚唾液酸、羟乙基淀粉、多糖部分等。
93.可用来修饰rvwf和/或fviii的水溶性聚合物包括线性和支化结构。缀合的聚合物可以直接附接至本发明的凝血蛋白,或者另选地可以经由连接部分附接。蛋白质与水溶性聚合物缀合的非限制性实例可在美国专利号4,640,835、4,496,689、4,301,144、4,670,417、4,791,192和4,179,337以及abuchowski和davis“enzymes as drugs,”;holcenberg和roberts编,页数367 383;john wiley和sons,new york(1981);和hermanson g.,bioconjugate techniques第2版,academic press,inc.2008中发现。
94.蛋白质缀合可通过本领域中多种众所周知的技术来执行,例如,参见hermanson g.,bioconjugate techniques第2版,academic press,inc.2008。实例包括经由凝血蛋白或水溶性聚合物部分中的一个上的羧基和另一个的胺基团之间的肽键连接,或其中一个的羧基和另一个的羟基之间的酯键连接。可将本发明的凝血蛋白缀合至水溶性聚合物化合物的另一种连接是经由席夫碱(schiff base),在聚合物部分上的游离氨基通过过碘酸盐氧化与聚合物非还原端上所形成的醛基团反应之间(jennings和lugowski,j.immunol.1981;127:1011
‑
8;femandes和gregonradis,biochim biophys acta.1997;1341;26
‑
34)。所生成的席夫碱可通过用nacnbh3特异性还原以形成仲胺来稳定化。替代方法是通过在先前氧化后用nh4cl进行还原胺化而在聚合物上生成末端游离氨基。双官能试剂可以用于连接两个氨基或两个羟基。例如,含有氨基的聚合物可使用如bs3(双(磺基琥珀酰亚氨基)辛二酸酯/pierce,rockford,ill)的试剂来与凝血蛋白的氨基偶合。此外,例如可使用如sulfo
‑
emcs(n
‑
ε
‑
马来酰亚胺基己酰氧基)磺基琥珀酰亚胺酯/pierce)的异双官能交联剂来连接胺和硫醇基团。在其他实施方案中,醛反应性基团(诸如peg烷氧化物加溴乙醛的二乙缩醛、peg加dmso和乙酸酐以及peg氯化物加4
‑
羟基苯甲醛的苯氧化物)、琥珀酰亚胺基活性酯、活化的二硫代碳酸酯peg、2,4,5
‑
三氯苯基氯甲酸酯和对硝基苯基氯甲酸酯活化的peg可以用于
凝血蛋白的缀合。
95.在一些方面,本发明的方法中使用的rvwf已在体外用弗林蛋白酶熟化。在另外的实施方案中,弗林蛋白酶是重组弗林蛋白酶。
96.在另外的方面,本发明的方法中使用的rvwf通过使用本领域已知的方法在哺乳动物细胞培养物中表达产生。在特定的实施方案中,哺乳动物培养物包含cho细胞。在示例性实施方案中,本发明的rvwf包含从cho细胞表达系统分离的rvwf蛋白。在另外的实施方案中,原肽去除(propeptide)通过将原vwf暴露于弗林蛋白酶在体外介导——而在另外的实施方案中,用于原肽去除的弗林蛋白酶是重组弗林蛋白酶。而在另外的实施方案中,完全糖基化/abo血型聚糖不存在。
97.而在另外的实施方案中,本发明的方法和组合物中使用的rvwf在合适的真核宿主系统中表达。真核细胞的实例包括但不限于哺乳动物细胞,诸如cho、cos、hek 293、bhk、sk
‑
hep和hepg2;昆虫细胞,例如sf9细胞、sf21细胞、s2细胞和high five细胞;以及酵母细胞,例如酵母属(saccharomyces)细胞或裂殖酵母属(schizosaccharomyces)细胞。在一个实施方案中,vwf可以在酵母细胞、昆虫细胞、禽类细胞、哺乳动物细胞等中表达。例如,在人细胞系、仓鼠细胞系或鼠类细胞系中。在一个特定的实施方案中,细胞系为cho、bhk或hek细胞系。通常,哺乳动物细胞,例如来自连续细胞系的cho细胞可以用于表达本发明的vwf。
98.在某些实施方案中,包含编码vwf的序列的核酸序列可以是载体。载体可以由病毒递送或可以是质粒。编码所述蛋白质的核酸序列可以是特定基因或其生物学功能部分。在一个实施方案中,蛋白质至少是vwf的生物学活性部分。多种载体可以用于表达vwf并且可选自真核表达载体。真核表达载体的实例包括:(i)对于在酵母中表达,诸如pao、ppic、pyes、pmet的载体,使用诸如aox1、gap、gal1、aug1等的启动子;(ii)对于在昆虫细胞中表达,诸如pmt、pac5、pib、pmib、pbac等的载体,使用诸如ph、p10、mt、ac5、opie2、gp64、polh等的启动子,以及(iii)对于在哺乳动物细胞中表达,诸如psvl、pcmv、prc/rsv、pcdna3、pbpv等的载体,和源自病毒系统(诸如牛痘病毒、腺相关病毒、疱疹病毒、逆转录病毒等)的载体,使用诸如cmv、sv40、ef
‑
1、ubc、rsv、adv、bpv和β
‑
肌动蛋白的启动子。
99.在本发明的一些实施方案中,核酸序列还包含适用于蛋白质的控制表达的其他序列,诸如启动子序列、增强子、tata盒、转录起始位点、多接头、限制性位点、聚a序列、蛋白质加工序列、选择标记等,其通常为本领域的普通技术人员已知的。
100.在某些实施方案中,本发明的细胞培养方法可包括微载剂的使用。在一些实施方案中,实施方案的细胞培养可以在大型生物反应器中在适于提供高体积
‑
比培养表面积的条件下执行以实现高细胞密度和蛋白质表达。一种用于提供此类生长条件的方式为在搅拌槽生物反应器中使用微载剂进行细胞培养。在微载剂上进行细胞生长的概念首先由van wezel(van wezel,a.l.,nature 216:64
‑
5(1967))描述并且允许细胞附接于悬浮在生长培养基中的小固体颗粒的表面上。这些方法提供高表面体积比并且因此允许了有效的营养物利用。此外,对于真核细胞系中分泌蛋白的表达,增大的表面体积比允许更高水平的分泌并且因此获得在培养物上清液中更高的蛋白质产率。最后,这些方法允许容易地扩大真核表达培养物。
101.表达vwf的细胞可以在细胞培养物生长期间结合至球形或多孔微载剂。微载剂可为选自由基于葡聚糖、胶原、塑料、明胶和纤维素以及如butler(1988.in:spier和
griffiths,animal cell biotechnology3:283
‑
303)中所述的其他物质的微载剂组成的组的微载剂。还可以使细胞在球形微载剂上生长至生物质并当它们已达到最终发酵生物质时且在多孔微载剂上产生表达的蛋白质之前对细胞传代培养,或反之亦然。合适的球形微载剂可包括光滑表面微载剂,诸如cytodex
tm
1、cytodex
tm
2和cytode
tm
3(ge healthcare);以及大孔微载剂,诸如cytopore
tm
.1、cytopore
tm
2、cytoline
tm
1和cytoline
tm
2(ge healthcare)。
102.在某些实施方案中,rvwf在产生高分子量rvwf的细胞培养基中培养的细胞中表达。术语“细胞培养液”、“细胞培养基”和“细胞培养上清液”是指本领域通常众所周知的细胞培养过程的各个方面。在本发明的上下文中,细胞培养液可包含细胞培养基和细胞培养上清液。从外部向细胞培养液添加细胞培养基,任选地与补充剂一起,以提供用于培养表达vwf的细胞的营养物和其他组分。细胞培养上清液是指包含来自细胞培养基的营养物和其他组分以及在培养期间从细胞释放的、代谢的和/或分泌的产物的细胞培养液。在另外的实施方案中,培养基可以是不含动物蛋白的并化学限定的。制备不含动物蛋白并化学限定的培养基的方法是本领域中已知的,例如us2008/0009040和us 2007/0212770中的方法,所述两者出于所有目的且特别是出于涉及细胞培养基的所有教义并入本文。“不含蛋白质”和相关术语是指培养中的细胞外源性的或不同于培养中的细胞的蛋白质,所述细胞在生长期间天然产生蛋白质。在另一个实施方案中,培养基不含多肽。在另一个实施方案中,培养基不含血清。在另一个实施方案中,培养基不含动物蛋白。在另一个实施方案中,培养基不含动物组分。在另一个实施方案中,培养基含有蛋白质,例如来自血清(诸如胎牛血清)的动物蛋白。在另一个实施方案中,培养物具有外源添加的重组蛋白。在另一个实施方案中,所述蛋白来自经认证的不含病原体的动物。如本文所用,术语“化学限定的”应意指培养基不包含任何未限定的补充剂,诸如例如动物组分、器官、腺体、植物或酵母的提取物。因此,化学限定的培养基的每种组分都是准确限定的。在一个优选的实施方案中,培养基不含动物组分且不含蛋白质。
103.在另外的实施方案中,在自哺乳动物细胞培养物纯化之后,在施用之前复溶rfviii。而在另外的实施方案中,在复溶之前或之后用弗林蛋白酶处理rvwf。在另外的实施方案中,弗林蛋白酶是重组弗林蛋白酶。而在另外的实施方案中,本发明的rvwf不暴露于adamts13,因此本发明的rvwf组合物中存在超大多聚体(即,包含10个或更多个亚基)。
104.在特定方面,本发明的方法中使用的rvwf包含在含有缓冲液、糖和/或糖醇(包括但不限于海藻糖和甘露糖醇)、稳定剂(诸如甘氨酸)和表面活性剂(诸如聚山梨酸酯80)的制剂中。在另外的实施方案中,对于含有rfviii的制剂,所述制剂还可包含钠、组氨酸、钙和谷胱甘肽。
105.在一个方面,包含rvwf的制剂在施用之前冻干。冻干使用本领域中常见的技术进行,且应针对开发中的组合物进行优化[tang等人,pharm res.21:191
‑
200.(2004)和chang等人,pharm res.13:243
‑
9(1996)]。
[0106]
制备药物制剂的方法可以包括以下步骤中的一个或多个:在冻干之前将本文所述的稳定剂添加至所述混合物中;在冻干之前将选自增积剂(bulking agent)、渗透压(osmolarity)调节剂和表面活性剂的至少一种剂(每一者如本文所述)添加至所述混合物中。在一个方面,冻干制剂至少包含缓冲液、增积剂和稳定剂中的一种或多种。在此方面,在冻干步骤期间或在复溶期间聚集成为问题的情况下评估并选择表面活性剂的效用。包含适
当的缓冲剂以使制剂在冻干期间维持在稳定的ph区内。
[0107]
冻干材料的标准复溶规范是添加回一定体积的纯水或无菌注射用水(wfi)(通常等同于在冻干期间去除的体积),尽管抗细菌剂的稀溶液有时用于针对胃肠外施用的药物的产生[chen,drug development and industrial pharmacy,18:1311
‑
1354(1992)]。因此,提供了用于制备复溶的重组vwf组合物的方法,其包括将稀释剂添加至本发明的冻干重组vwf组合物中的步骤。
[0108]
冻干材料可以复溶为水溶液。多种水性载剂,例如无菌注射用水、供多剂量使用的含防腐剂的水、或含适量的表面活性剂的水(例如,含有与适于制造水性悬浮液的赋形剂混合的活性化合物的水性悬浮液)。在各个方面,此类赋形剂为悬浮剂,例如但不限于羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、褐藻酸钠、聚乙烯基吡咯烷酮、西黄蓍胶以及阿拉伯树胶;分散或湿润剂为天然存在的磷脂,例如但不限于卵磷脂;或环氧烷与脂肪酸的缩合产物,例如但不限于聚氧乙烯硬脂酸酯;或环氧乙烷与长链脂肪族醇的缩合产物,例如但不限于十七亚乙基氧十六醇(heptadecaethyleneoxycetanol);或环氧乙烷与从脂肪酸和己糖醇衍生的偏酯的缩合产物,诸如聚氧乙烯山梨糖醇单油酸酯;或环氧乙烷与从脂肪酸和己糖醇酐衍生的偏酯的缩合产物,例如但不限于聚乙烯脱水山梨糖醇单油酸酯。在各个方面,水性悬浮液还含有一种或多种防腐剂,例如但不限于对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯。
[0109]
在某些实施方案中,本发明的组合物是通过使用注射器或其他储存器皿施用的液体制剂。在另外的实施方案中,这些液体制剂由复溶为水溶液的本文所述的冻干材料制备。
[0110]
在另外的方面,本发明的组合物还包含一种或多种药学上可接受的载剂。短语“药学上”或“药理学上”可接受是指稳定的、抑制蛋白质降解诸如聚集和切割产物,并且此外如下所述在使用本领域中众所周知的途径施用时不产生过敏或其他不良反应的分子实体和组合物。“药学上可接受的载剂”包括任何和所有临床上有用的溶剂、分散介质、包衣、抗细菌及抗真菌剂、等渗和吸收延缓剂等,包括以上公开的那些剂。
[0111]
ii.重组vwf的产生
[0112]
本发明的游离成熟重组血管性血友病因子(rvwf)可以重组产生。本领域技术人员能认识到在宿主细胞中表达重组蛋白的有用的方法。在一些情况下,所述方法包括在宿主细胞诸如cho细胞中表达编码rvwf的核酸序列并在某些条件下培养所得宿主细胞以产生rvwf、前原vwf、原vwf等。
[0113]
在某些实施方案中,包含编码vwf的序列的核酸序列可以是表达载体。载体可以由病毒递送或可以是质粒。编码所述蛋白质的核酸序列可以是特定基因或其生物学功能部分。在一个实施方案中,蛋白质至少是vwf的生物学活性部分。核酸序列还可包含适用于蛋白质的控制表达的其他序列,诸如启动子序列、增强子、tata盒、转录起始位点、多接头、限制性位点、聚a序列、蛋白质加工序列、选择标记等,其通常为本领域的普通技术人员已知的。
[0114]
多种载体可以用于表达vwf并且可选自真核表达载体。真核表达载体的实例包括:(i)对于在酵母中表达,诸如pao、ppic、pyes、pmet的载体,使用诸如aox1、gap、gal1、aug1等的启动子;(ii)对于在昆虫细胞中表达,诸如pmt、pac5、pib、pmib、pbac等的载体,使用诸如ph、p10、mt、ac5、opie2、gp64、polh等的启动子,以及(iii)对于在哺乳动物细胞中表达,诸
如psvl、pcmv、prc/rsv、pcdna3、pbpv等的载体,和源自病毒系统(诸如牛痘病毒、腺相关病毒、疱疹病毒、逆转录病毒等)的载体,使用诸如cmv、sv40、ef
‑
1、ubc、rsv、adv、bpv和β
‑
肌动蛋白的启动子。
[0115]
在一些方面,本发明的方法中使用的rvwf通过使用本领域已知的方法在哺乳动物细胞培养物中表达产生。在特定的实施方案中,哺乳动物培养物包含cho细胞。在另外的实施方案中,rvwf与重组因子viii(rfviii)在同一培养物中共表达。在此类实施方案中,rvwf和rfviii使用本领域已知的方法一起纯化(共纯化)或单独纯化。在其他实施方案中,rvwf在不含rfviii的培养物中表达。
[0116]
在一些实施方案中,rvwf自合适的真核宿主系统中表达和分离。真核细胞的实例包括但不限于哺乳动物细胞,诸如cho、cos、hek293、bhk、sk
‑
hep和hepg2;昆虫细胞,例如sf9细胞、sf21细胞、s2细胞和high five细胞;以及酵母细胞,例如酵母属细胞或裂殖酵母属细胞。在一个实施方案中,vwf可以在酵母细胞、昆虫细胞、禽类细胞、哺乳动物细胞等中表达。例如,在人细胞系、仓鼠细胞系或鼠类细胞系中。在一个特定的实施方案中,细胞系为cho、bhk或hek细胞系。通常,哺乳动物细胞,例如来自连续细胞系的cho细胞可以用于表达本发明的vwf。在某些情况下,vwf蛋白自cho细胞表达系统中表达和分离。
[0117]
vwf可以在细胞培养系统中产生或根据本领域技术人员认识到的任何细胞培养方法产生。在一些实施方案中,细胞培养可以在大型生物反应器中在适于提供高体积
‑
比培养表面积的条件下执行以实现高细胞密度和蛋白质表达。一种用于提供此类生长条件的方式为在搅拌槽生物反应器中使用微载剂进行细胞培养。在微载剂上进行细胞生长的概念首先由van wezel(van wezel,a.l.,nature,1967,216:64
‑
5)描述并且允许细胞附接于悬浮在生长培养基中的小固体颗粒的表面上。这些方法提供高表面体积比并且因此允许了有效的营养物利用。此外,对于真核细胞系中分泌蛋白的表达,增大的表面体积比允许更高水平的分泌并且因此获得在培养物上清液中更高的蛋白质产率。最后,这些方法允许容易地扩大真核表达培养物。
[0118]
表达vwf的细胞可以在细胞培养物生长期间结合至球形或多孔微载剂。微载剂可为选自由基于葡聚糖、胶原、塑料、明胶和纤维素以及如butler(1988.in:spier和griffiths,animal cell biotechnology3:283
‑
303)中所述的其他物质的微载剂组成的组的微载剂。还可以使细胞在球形微载剂上生长至生物质并当它们已达到最终发酵生物质时且在多孔微载剂上产生表达的蛋白质之前对细胞传代培养,或反之亦然。合适的球形微载剂可包括光滑表面微载剂,诸如cytodex
tm
1、cytodex
tm
2和cytodex
tm
3(ge healthcare);和大孔微载剂,诸如cytopore
tm
1、cytopore
tm
2、cytoline
tm
1和cytoline
tm
2(ge healthcare)。
[0119]
在另外的实施方案中,通过将原vwf暴露于弗林蛋白酶,在体外自非成熟vwf切割vwf原肽。在一些实施方案中,用于原肽切割的弗林蛋白酶是重组弗林蛋白酶。
[0120]
在某些实施方案中,rvwf在产生高分子量rvwf的细胞培养基中培养的细胞中表达。术语“细胞培养液”、“细胞培养基”和“细胞培养上清液”是指本领域通常众所周知的细胞培养过程的各个方面。在本发明的上下文中,细胞培养液可包含细胞培养基和细胞培养上清液。从外部向细胞培养液添加细胞培养基,任选地与补充剂一起,以提供用于培养表达vwf的细胞的营养物和其他组分。细胞培养上清液是指包含来自细胞培养基的营养物和其他组分以及在培养期间从细胞释放的、代谢的和/或分泌的产物的细胞培养液。在另外的实
施方案中,培养基可以是不含动物蛋白的并化学限定的。制备不含动物蛋白并化学限定的培养基的方法是本领域中已知的,例如us2006/0094104、us 2007/0212770和us 2008/0009040中的方法,所述两者出于所有目的且特别是出于涉及细胞培养基的所有教义并入本文。“不含蛋白质”和相关术语是指培养中的细胞外源性的或不同于培养中的细胞的蛋白质,所述细胞在生长期间天然产生蛋白质。在另一个实施方案中,培养基不含多肽。在另一个实施方案中,培养基不含血清。在另一个实施方案中,培养基不含动物蛋白。在另一个实施方案中,培养基不含动物组分。在另一个实施方案中,培养基含有蛋白质,例如来自血清(诸如胎牛血清)的动物蛋白。在另一个实施方案中,培养物具有外源添加的重组蛋白。在另一个实施方案中,蛋白质来自经认证的不含病原体的动物。如本文所用,术语“化学限定的”应意指培养基不包含任何未限定的补充剂,诸如例如动物组分、器官、腺体、植物或酵母的提取物。因此,化学限定的培养基的每种组分都是准确限定的。在一个优选的实施方案中,培养基不含动物组分且不含蛋白质。
[0121]
在某些实施方案中,表达vwf的细胞的培养物可维持至少约7天,或至少约14天、21天、28天或至少约5周、6周、7周,或至少约2个月,或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18个月或更久。使细胞培养物针对重组vwf蛋白产生所维持的细胞密度将取决于用于蛋白表达的培养条件和培养基。本领域技术人员将能够容易地确定产生vwf的细胞培养物的最佳细胞密度。在一个实施方案中,将培养物长时间维持在约0.5x106和4x107细胞/ml之间的细胞密度下。在其他实施方案中,将细胞密度长时间维持在约1.0x106和约1.0x107细胞/ml之间的浓度下。在其他实施方案中,将细胞密度长时间维持在约1.0x106和约4.0x106细胞/ml之间的浓度下。在其他实施方案中,将细胞密度长时间维持在约1.0x106和约4.0x106细胞/ml之间的浓度下。而在其他实施方案中,可将细胞密度长时间维持在约2.0x106和约4.0x106之间、或约1.0x106和约2.5x106之间、或约1.5x106和约3.5x106或任何其他类似范围的浓度下。在细胞培养适当的时间后,可使用本领域已知的方法自表达系统分离rvwf。
[0122]
在特定的实施方案中,将用于产生rvwf的连续细胞培养物的细胞密度长时间维持在不大于2.5x106细胞/ml的浓度下。在其他特定的实施方案中,将细胞密度维持在不大于2.0x106细胞/ml、1.5x106细胞/ml、1.0x106细胞/ml、0.5x106细胞/ml或更小。在一个实施方案中,将细胞密度维持在1.5x106细胞/ml和2.5x106细胞/ml之间。
[0123]
在上述细胞培养物的一个实施方案中,细胞培养液包含含有铜的培养基补充剂。此类细胞培养液在例如美国专利号8,852,888和美国专利号9,409,971中描述,所述参考出于所有目的且特别是出于涉及用于制备重组vwf的细胞培养方法和组合物的所有教义,特此以引用的方式整体并入。
[0124]
前原vwf的多核苷酸和氨基酸序列分别在seq id no:1和seq id no:2中列出,并且可分别在genbank登录号nm_000552(智人血管性血友病因子(vwf)mrna)和np_000543处获得。对应于成熟vwf蛋白的氨基酸序列在seq id no:3中列出(对应于全长前原vwf氨基酸序列的氨基酸764
‑
2813)。在一些实施方案中,vwf展现出至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%的seq id no:3序列同一性。在一些实施方案中,本发明的rvwf展现出至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%的seq id no:3序列同一性。参见,例如美
国专利号8,597,910、美国专利公布号2016/0129090以及图5a
‑
5c、6a
‑
6j和7a
‑
7g。
[0125]
一种有用rvwf的形式至少具有体内稳定(例如结合)至少一种因子viii(fviii)分子的特性,并且任选地具有药理学上可接受的糖基化模式。其具体实例包括无a2结构域的vwf,因此抗蛋白水解(lankhof等人,thromb.haemost.77:1008
‑
1013,1997),以及从val 449至asn730的vwf片段(包括糖蛋白lb结合域和胶原与肝素的结合位点)(pietu等人,biochem.biophys.res.commun.164:1339
‑
1347,1989)。在一个方面,vwf稳定至少一种fviii分子的能力的测定根据本领域中现有状态下已知的方法在vwf缺陷哺乳动物中进行。
[0126]
本发明的rvwf可以通过本领域已知的任何方法产生。一个特定的实例于1986年10月23日公布的wo86/06096和1990年7月23日提交的美国专利申请号07/559,509中公开,所述参考关于制备重组vwf的方法以引用的方式并入本文。因此,本领域中已知以下方法:(i)通过遗传工程产生重组dna,例如经由逆转录rna和/或扩增dna;(ii)通过转染将重组dna引入原核细胞或真核细胞中,例如经由电穿孔或显微注射;(iii)培养转化的细胞,例如以连续或分批方式;(iv)表达vwf,例如组成型表达或在诱导后表达;以及(v)分离vwf,例如从培养基分离或通过收获转化的细胞;以便(vi)获得纯化的rvwf,例如经由阴离子交换色谱法或亲和色谱法。在一个方面,使用本领域众所周知的重组dna技术在转化的宿主细胞中制备重组vwf。例如,可以使用合适的限制性酶从dna中切除编码多肽的序列。另选地,在另一方面,所述dna分子可使用化学合成技术合成,诸如氨基磷酸酯方法。另外,在又一方面,使用这些技术的组合。
[0127]
本发明还提供了在适当的宿主中编码本发明多肽的载体。载体包含编码与适当的表达控制序列可操作地连接的多肽的多核苷酸。在将多核苷酸插入载体之前或之后实现这种可操作连接的方法是众所周知的。表达控制序列包括启动子、活化子、增强子、操纵子、核糖体结合位点、起始信号、终止信号、cap信号、多聚腺苷酸化信号和其他涉及转录或翻译控制的信号。其中具有多核苷酸的所得载体用来转化适当的宿主。此转化可使用本领域众所周知的方法执行。
[0128]
在本发明的实践中使用大量可用的和众所周知的宿主细胞中的任一种。特定宿主的选择取决于本领域认识到的多种因素,包括例如与所选表达载体的相容性、dna分子所编码的肽的毒性、转化率、肽的易回收性、表达特征、生物安全性和成本。这些因素的平衡必须认识到:并非所有宿主细胞对于特定dna序列的表达都同样有效。在这些一般准则内,有用的微生物宿主细胞包括但不限于细菌、酵母和其他真菌、昆虫、植物、培养中的哺乳动物(包括人)细胞或本领域已知的其他宿主。
[0129]
在常规发酵条件下培养转化的宿主细胞,以便表达所需化合物。此类发酵条件是本领域众所周知的。最后,通过本领域众所周知的方法从培养基或宿主细胞本身纯化多肽。
[0130]
根据用于表达本发明化合物的宿主细胞,将糖类(寡糖)基团任选地附接至已知为蛋白质中糖基化位点的位点。一般来讲,当作为序列asn
‑
x
‑
ser/thr的部分时(其中x可以是除脯氨酸以外的任何氨基酸),o
‑
连接寡糖附接至丝氨酸(ser)或苏氨酸(thr)残基,而n
‑
连接寡糖附接至天冬酰胺(asn)残基。x优选地为除脯氨酸以外的19个天然存在的氨基酸之一。n
‑
连接和o
‑
连接寡糖以及在每种类型中发现的糖残基的结构是不同的。一种常在n
‑
连接和o
‑
连接寡糖两者中发现的类型的糖为n
‑
乙酰神经氨酸(称为唾液酸)。唾液酸通常是n
‑
连接和o
‑
连接寡糖两者的末端残基,且在一个方面可凭借其负电荷对糖基化化合物赋予酸
性特性。可将此类位点掺入本发明化合物的接头中并且优选地在多肽化合物的重组产生期间通过细胞来使此类位点糖基化(例如,在诸如cho、bhk、cos的哺乳动物细胞中)。在其他方面,通过本领域已知的合成或半合成程序使此类位点糖基化。
[0131]
在一些实施方案中,可以作为本文所述的纯化程序(包括阴离子交换、阳离子交换、尺寸排阻和/或免疫亲和方法)的一部分在柱上执行唾液酸化(sialysation)(也称为唾液酸化(sialylation))。在一些实施方案中,相比于未经历唾液酸化的rvwf,唾液酸化使rvwf的稳定性增加。在一些实施方案中,相比于未经历唾液酸化的rvwf,唾液酸化使血液循环中rvwf的稳定性增加(例如,向受试者施用之后)。在一些实施方案中,相比于未经历唾液酸化的rvwf,唾液酸化的rvwf的稳定性增加10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,相比于未经历唾液酸化的rvwf,唾液酸化使rvwf的半衰期增加。在一些实施方案中,相对于未经历唾液酸化的rvwf,唾液酸化使血液循环中rvwf的半衰期增加(例如,向受试者施用之后)。在一些实施方案中,相对于未经历唾液酸化的rvwf,唾液酸化的rvwf的半衰期增加10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。在一些实施方案中,相比于未经历唾液酸化的rvwf,唾液酸化的rvwf的半衰期增加(例如,向受试者施用之后)使血液循环中rvwf稳定1小时、2小时、3小时、4小时、6小时、12小时、24小时或更久。在一些实施方案中,唾液酸化增加了2,3唾液酸化和/或2,6唾液酸化的数量。在一些实施方案中,作为另外的缓冲步骤,通过添加2,3唾液酸转移酶和/或2,6唾液酸转移酶和cmp
‑
nana(胞苷
‑
5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸钠盐)来增加唾液酸化。在一些实施方案中,作为另外的缓冲步骤,通过添加2,3唾液酸转移酶和cmp
‑
nana(胞苷
‑
5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸钠盐)来增加唾液酸化。在一些实施方案中,作为另外的缓冲步骤,通过添加2,3唾液酸转移酶和cmp
‑
nana(胞苷
‑
5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸钠盐)来增加2,3唾液酸化。
[0132]
在一些实施方案中,作为另外的缓冲步骤,通过添加2,6唾液酸转移酶和cmp
‑
nana(胞苷
‑
5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸钠盐)来增加2,6唾液酸化。在一些实施方案中,作为另外的缓冲步骤,通过添加2,3唾液酸转移酶和/或2,6唾液酸转移酶和cmp
‑
nana(胞苷
‑
5'
‑
单磷酸
‑
n
‑
乙酰神经氨酸钠盐)来增加2,3唾液酸化和/或2,6唾液酸化。在一些实施方案中,cmp
‑
nana被化学或酶修饰以将修饰的唾液酸转移至潜在的游离位置。在一些实施方案中,通过以下方式来执行唾液酸化:将rvwf加载到树脂上,用本文所述的一种或多种缓冲液洗涤以剔除不需要的杂质,在允许另外的唾液酸化的条件下施加一种或多种含有唾液酸转移酶和cmp
‑
nana的缓冲液,并用一种或多种缓冲液洗涤以剔除过量的唾液酸化试剂,以及用一种或多种缓冲液洗脱增强的rvwf(例如,具有增加的唾液酸化的rvwf)。在一些实施方案中,如本文所述,唾液酸化过程作为阳离子交换方法、阴离子交换方法、尺寸排阻方法或免疫亲和纯化方法的一部分执行。
[0133]
另选地,通过使用例如固相合成技术的合成方法制备化合物。合适的技术是本领域众所周知的,并且包括在merrifield(1973),chem.polypeptides,页数335
‑
61(katsoyannis and panayotis eds.);merrifield(1963),j.am.chem.soc.85:2149;davis等人(1985),biochem.intl.10:394
‑
414;stewart和young(1969),solid phase peptide synthesis;美国专利号3,941,763;finn等人(1976),the proteins(第3版)2:105
‑
253;和erickson等人(1976),the proteins(第3版)2:257
‑
527中描述的那些。固相合成是制备单个肽的优选技术,因为它是制备小肽的最具成本效益的方法。
[0134]
vwf的片段、变体和类似物可以根据本领域众所周知的方法产生。可以使用但不限于酶切(例如,胰蛋白酶、胰凝乳蛋白酶)以及使用重组方式以产生具有特定氨基酸序列的多肽片段来制备多肽片段。可以产生包含具有特定活性的蛋白质区域,诸如多聚化结构域或本领域已知的任何其他可识别的vwf结构域的多肽片段。
[0135]
制备多肽类似物的方法也是众所周知的。多肽的氨基酸序列类似物可以是取代、插入、添加或缺失类似物。缺失类似物(包括多肽的片段)缺乏天然蛋白的一个或多个残基,这些残基对功能或免疫原性活性不是必需的。插入类似物涉及在多肽的非末端点添加例如一个或多个氨基酸。此类似物可包括,例如但不限于,免疫反应性表位或仅单个残基的插入。添加类似物(包括多肽的片段)包括在蛋白质的一个或两个末端添加一个或多个氨基酸,并且包括例如融合蛋白。还设想了上述类似物的组合。
[0136]
取代类似物通常在蛋白质内的一个或多个位点将野生型的一个氨基酸与另一个氨基酸交换,并且可被设计来调节多肽的一种或多种特性而不完全丧失其他功能或特性。在一个方面,取代是保守取代。“保守氨基酸取代”是氨基酸被具有侧链或相似化学特性的氨基酸取代。用于进行保守取代的相似氨基酸包括具有酸性侧链(谷氨酸、天冬氨酸);碱性侧链(精氨酸、赖氨酸、组氨酸);极性酰胺侧链(谷氨酰胺、天冬酰胺);疏水性脂肪族侧链(亮氨酸、异亮氨酸、缬氨酸、丙氨酸、甘氨酸);芳香族侧链(苯丙氨酸、色氨酸、酪氨酸);小侧链(甘氨酸、丙氨酸、丝氨酸、苏氨酸、甲硫氨酸);或脂肪族羟基侧链(丝氨酸、苏氨酸)的那些。
[0137]
在一个方面,类似物与衍生它们的重组vwf基本上同源或基本上相同。类似物包括至少保留野生型多肽的一些生物活性,例如血凝活性的那些。
[0138]
所设想的多肽变体包括但不限于通过诸如泛素化、糖基化(包括聚唾液酸化(polysialation)(或聚唾液酸化(polysialylation)))、与治疗剂或诊断剂缀合、标记、共价聚合物附接诸如聚乙二醇化(用聚乙二醇衍生化)、引入不可水解键以及通过氨基酸(诸如鸟氨酸)的化学合成的插入或取代的技术进行化学修饰的多肽,所述多肽通常不会出现在人蛋白质中。变体保留了与本发明的未修饰分子相同或基本上相同的结合特性。此类化学修饰可包括剂与vwf多肽直接或间接(例如,经由接头)的附接。在间接附接的情况下,设想接头可以是可水解的或不可水解的。
[0139]
在一个方面,制备聚乙二醇化的多肽类似物包括以下步骤:(a)使多肽与聚乙二醇(诸如peg的反应性酯或醛衍生物)在使得结合构建体多肽附接至一个或多个peg基团的条件下反应;及(b)获得一种或多种反应产物。一般来讲,用于酰化反应的最佳反应条件基于已知参数和所需结果确定。例如,peg:蛋白质的比率越大,聚聚乙二醇化(poly
‑
pegylated)产物的百分比就越大。在一些实施方案中,结合构建体在n
‑
末端具有单个peg部分。聚乙二醇(peg)可以附接至血凝因子以例如提供更长的体内半衰期。peg基团可具有任何适当的分子量并且是直链或支链的。peg的平均分子量在约2千道尔顿(“kd”)至约100kda、约5kda至约50kda或约5kda至约10kda的范围内。在某些方面,peg基团经由通过peg部分上的天然或工程化反应性基团(例如醛、氨基、硫醇或酯基团)至血凝因子上的反应性基团(例如醛、氨基或酯基团)的酰化或还原烷基化或通过本领域已知的任何其他技术来附接至血凝因子。
[0140]
用于制备聚唾液酸化多肽的方法在美国专利公布20060160948,fernandes和gregoriadis;biochim.biophys.acta 1341:26
‑
34,1997和saenko等人,haemophilia 12:
hemost,2010,36:510
‑
521)。
[0147]
vwf:瑞斯托霉素辅因子(vwf:rco)测定是基于在vwf的存在下由抗生素瑞斯托霉素诱导的新鲜或福尔马林固定血小板的凝集。血小板凝集的程度取决于vwf浓度并且可以通过比浊法(例如,通过使用凝集计)测量(weiss等人,j.clin.invest.,1973,52:2708
‑
2716;macfarlane等人,thromb.diath.haemorrh.,1975,34:306
‑
308)。如本文所提供,本发明的vwf的瑞斯托霉素辅因子的比活性(vwf:rco)通常以vwf的mu/μg来描述,如使用体外测定所测量。
[0148]
在一些实施方案中,根据本发明的方法纯化的rvwf具有至少约20、22.5、25、27,5、30、32.5、35、37.5、40、42.5、45、47.5、50、52.5、55、57.5、60、62.5、65、67.5、70、72.5、75、77.5、80、82.5、85、87.5、90、92.5、95、97.5、100、105、110、115、120、125、130、135、140、145、150mu/μg或更高的比活性。在一些实施方案中,本文所述的方法中使用的rvwf具有20mu/μg至150mu/μg的比活性。在一些实施方案中,rvwf具有30mu/μg至120mu/μg的比活性。在一些实施方案中,rvwf具有40mu/μg至90mu/μg的比活性。在一些实施方案中,rvwf具有选自下表3中发现的变动1至133的比活性。
[0149]
表3.本文提供的组合物中发现的和在本文提供的方法中使用的rvwf比活性的示例性实施方案。
[0150]
[0151][0152]
var.=变动
[0153]
本发明的rvwf是包含约10至约40个亚基的高度多聚体。在另外的实施方案中,使用本发明的方法产生的多聚体rvwf包含约10
‑
30、12
‑
28、14
‑
26、16
‑
24、18
‑
22、20
‑
21个亚基。在一些实施方案中,rvwf以大小从二聚体至超过40个亚基的多聚体(>1000万道尔顿)不等的多聚体存在。最大的多聚体提供可以与血小板受体和损伤的内皮下基质位点两者相互作用的多结合位点,并且是vwf最具止血活性的形式。在一些实施方案中,本发明的rvwf包含超大多聚体(ulm)。一般来讲,高多聚体和超大多聚体被认为是止血最有效的(参见,例如turecek,p.,(37卷):增刊1,页数s15
‑
s25(2017))。在一些实施方案中,rvwf介于500kda和20,000kda之间。在一些实施方案中,可以使用所述方法获得任何所需多聚体模式。在一些实施方案中,当采用阴离子交换和/或阳离子交换剂方法时,可调控一个或多个洗涤步骤中的缓冲液或梯度缓冲液的ph、电导率和/或抗衡离子浓度以获得所需多聚体模式。在一些实施方案中,接着采用尺寸排阻色谱法,可采用收集标准来获得所需多聚体模式。在一些实施方案中,所述多聚体模式包括超大多聚体。在一些实施方案中,超大多聚体为至少10,000kda、至少11,000kda、至少12,000kda、至少13,000kda、至少14,000kda、至少15,000kda、至少16,000kda、至少17,000kda、至少18,000kda、至少19,000kda、至少20,000kda。在一些实施方案中,超大多聚体介于约10,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约11,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约12,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约13,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约14,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约15,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约16,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约17,000kda和
20,000kda之间。在一些实施方案中,超大多聚体介于约18,000kda和20,000kda之间。在一些实施方案中,超大多聚体介于约19,000kda和20,000kda之间。在一些实施方案中,使用本发明方法获得的rvwf包括存在于rvwf加载样品中的任何多聚体模式。在一些实施方案中,使用本发明方法获得的rvwf包括生理上存在的多聚体模式以及超大vwf多聚体模式。
[0154]
在一些实施方案中,通过本文所述的纯化方法制备的rvwf组合物具有如下特征的rvwf寡聚体分布:95%的寡聚体具有6个亚基至20个亚基。在一些实施方案中,rvwf组合物具有如下特征的rvwf寡聚体分布:95%的寡聚体具有选自4中发现的变动458至641的亚基范围。
[0155]
表4.本文提供的组合物中发现的和本文提供的方法中使用的rvwf寡聚体的分布的示例性实施方案。
[0156]
[0157][0158]
var.=变动
[0159]
在一些实施方案中,由本文提供的方法制备的rvwf组合物可以根据以特定更高级
别的rvwf多聚体或更大的多聚体存在的rvwf分子的百分比表征。例如,在一个实施方案中,本文所述的方法中使用的rvwf组合物的至少20%的rvwf分子以至少10个亚基的寡聚复合物存在。在另一个实施方案中,本文所述的方法中使用的rvwf组合物的至少20%的rvwf分子以至少12个亚基的寡聚复合物存在。而在其他实施方案中,本文提供的方法中使用的rvwf组合物具有最小百分比的(例如,具有至少x%)以根据表5至表7中发现的变动134至457中任一者的特定更高级别的rvwf多聚体或更大的多聚体(例如,至少y个亚基的多聚体)存在的rvwf分子。
[0160]
表5.存在于本文提供的组合物中发现的并在本文提供的方法中使用的特定更高级别的rvwf多聚体或更大的多聚体中的rvwf分子的百分比的示例性实施方案。
[0161][0162]
var.=变动
[0163]
表6.存在于本文提供的组合物中发现的并在本文提供的方法中使用的特定更高级别的rvwf多聚体或更大的多聚体中的rvwf分子的百分比的示例性实施方案。
[0164][0165]
var.=变动
[0166]
表7.存在于本文提供的组合物中发现的并在本文提供的方法中使用的特定更高级别的rvwf多聚体或更大的多聚体中的rvwf分子的百分比的示例性实施方案。
[0167][0168][0169]
var.=变动
[0170]
根据上文,rvwf包含显著百分比的高分子量(hmw)rvwf多聚体。在另外的实施方案中,hmw rvwf多聚体组合物包含至少10%
‑
80%rvwf十聚体或更高级别的多聚体。在另外的实施方案中,组合物包含约10
‑
95%、20
‑
90%、30
‑
85%、40
‑
80%、50
‑
75%、60
‑
70%十聚体或更高级别的多聚体。在另外的实施方案中,hmw rvwf多聚体组合物包含至少约10%、20%、30%、40%、50%、60%、70%、80%、90%十聚体或更高级别的多聚体。
[0171]
rvwf多聚体的数量和百分比的评估可以使用本领域已知的方法进行,包括但不限于使用电泳和尺寸排阻色谱法按大小分离rvwf多聚体的方法,例如如cumming等人所讨论(j clin pathol.1993may;46(5):470
‑
473,其出于所有目的且特别是出于涉及rvwf多聚体评估的所有教义,特此以引用的方式整体并入)。此类技术还可包括免疫印迹技术(诸如蛋白质印迹),其中凝胶由放射性标记的抗vwf抗体进行免疫印迹,之后进行化学发光检测(参见例如wen等人,(1993),j.clin.lab.anal.,7:470
‑
473,其出于所有目的且特别是出于涉及rvwf多聚体评估的所有教义,特此以引用的方式整体并入)。另外的vwf测定包括vwf:抗原(vwf:ag)、vwf:瑞斯托霉素辅因子(vwf:rcof)和vwf:胶原结合活性测定(vwf:cba),这些经常用于血管性血友病的诊断和分类。(参见例如favaloro等人,pathology,1997,29(4):341
‑
456,其出于所有目的且特别是出于涉及vwf测定的所有教义,特此以引用的方式整体并入)。
[0172]
在一些实施方案中,对于根据本发明的方法制备的rvwf,rfviii促凝活性(iu rfviii:c)与rvwf瑞斯托霉素辅因子活性(iu rvwf:rco)的比率介于3:1和1:5之间。在另外的实施方案中,比率介于2:1和1:4之间。而在另外的实施方案中,比率介于5:2和1:4之间。在另外的实施方案中,比率介于3:2和1:3之间。而在另外的实施方案中,比率为约1:1、1:2、1:3、1:4、1:5、2:1、2:3、2:4、2:5、3:1、3:2、3:4或3:5。在另外的实施方案中,比率介于1:1和1:2之间。而在另外的实施方案中,比率为1.1:1、1.2:1、1.3:1、1.4:1、1.5:1、1.6:1、1.7:1、1.8:1、1.9:1或2:1。在某些实施方案中,可用于本文所述的方法的组合物中的rfviii促凝活性(iu rfviii:c)与rvwf瑞斯托霉素辅因子活性(iu rvwf:rco)的比率选自表8中发现的变动1988至2140。
[0173]
表8.在本文提供的组合物中和本文提供的方法中使用的rfviii促凝活性(iu rfviii:c)与rvwf瑞斯托霉素辅因子活性(iu rvwf:rco)的比率的示例性实施方案。
[0174][0175][0176]
var.=变动
[0177]
在另外的实施方案中,本发明的更高级别的rvwf多聚体在施用后约1小时至约90小时是稳定的。而在另外的实施方案中,更高级别的rvwf多聚体在施用后约5
‑
80、10
‑
70、15
‑
60、20
‑
50、25
‑
40、30
‑
35小时是稳定的。而在另外的实施方案中,更高级别的rvwf多聚体在施用后至少3、6、12、18、24、36、48、72小时是稳定的。在某些实施方案中,rvwf多聚体的稳定性在体外评估。
[0178]
在一个实施方案中,本文提供的组合物和方法中使用的更高级别的rvwf多聚体在施用后具有至少12小时的半衰期。在另一个实施方案中,更高级别的rvwf多聚体在施用后具有至少24小时的半衰期。而在其他实施方案中,更高级别的rvwf多聚体具有选自表9中发现的变动642至1045的半衰期。
[0179]
表9.在通过本文提供的方法制备的组合物中发现的更高级别的rvwf多聚体的半衰期的示例性实施方案。
[0180]
[0181]
[0182]
[0183][0184]
var.=变动
[0185]
在一些实施方案中,根据本发明纯化的原vwf和/或纯化的rvwf未经任何缀合、翻译后或共价修饰进行修饰。在特定的实施方案中,本发明的原vwf和/或纯化的rvwf未经水溶性聚合物进行修饰,所述水溶性聚合物包括但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、聚唾液酸、羟乙基淀粉、多糖部分等。
[0186]
在一些实施方案中,根据本发明纯化的原vwf和/或纯化的rvwf经由缀合、翻译后修饰或共价修饰进行修饰,所述修饰包括n
‑
或c
‑
末端残基的修饰以及所选侧链,例如在游离巯基、伯胺和羟基处的修饰。在一个实施方案中,水溶性聚合物通过赖氨酸基团或其他伯胺连接(直接或经接头)至蛋白质。在一些实施方案中,本发明的原vwf和/或纯化的rvwf可以通过水溶性聚合物的缀合进行修饰,所述水溶性聚合物包括但不限于聚乙二醇(peg)、聚丙二醇、聚氧化烯、聚唾液酸、羟乙基淀粉、多糖部分等。
[0187]
可用来修饰原vwf和/或纯化的rvwf的水溶性聚合物包括线性和支化结构。缀合的聚合物可以直接附接至本发明的凝血蛋白,或者另选地可以经由连接部分附接。蛋白质与水溶性聚合物缀合的非限制性实例可在美国专利号4,640,835、4,496,689、4,301,144、4,670,417、4,791,192和4,179,337以及abuchowski和davis“enzymes as drugs,”;holcenberg和roberts编,页数367 383;john wiley和sons,new york(1981);和hermanson g.,bioconjugate techniques第2版,academic press,inc.2008中发现。
[0188]
蛋白质缀合可通过本领域中多种众所周知的技术来执行,例如,参见hermanson g.,bioconjugate techniques第2版,academic press,inc.2008。实例包括经由凝血蛋白或水溶性聚合物部分中的一个上的羧基和另一个的胺基团之间的肽键连接,或其中一个的羧基和另一个的羟基之间的酯键连接。可将本发明的凝血蛋白缀合至水溶性聚合物化合物的另一种连接是经由席夫碱(schiff base),在聚合物部分上的游离氨基通过过碘酸盐氧化与聚合物非还原端上所形成的醛基团反应之间(jennings和lugowski,j.immunol.1981;127:1011
‑
8;femandes和gregonradis,biochim biophys acta.1997;1341;26
‑
34)。所生成的席夫碱可通过用nacnbh3特异性还原以形成仲胺来稳定化。替代方法是通过在先前氧化后用nh4cl进行还原胺化而在聚合物上生成末端游离氨基。双官能试剂可以用于连接两个氨基或两个羟基。例如,含有氨基的聚合物可使用如bs3(双(磺基琥珀酰亚氨基)辛二酸酯/pierce,rockford,ill)的试剂来与凝血蛋白的氨基偶合。此外,例如可使用如sulfo
‑
emcs(n
‑
ε
‑
马来酰亚胺基己酰氧基)磺基琥珀酰亚胺酯/pierce)的异双官能交联剂来连接胺和硫醇基团。在其他实施方案中,醛反应性基团(诸如peg烷氧化物加溴乙醛的二乙缩醛、peg加dmso和乙酸酐以及peg氯化物加4
‑
羟基苯甲醛的苯氧化物)、琥珀酰亚胺基活性酯、活化
的二硫代碳酸酯peg、2,4,5
‑
三氯苯基氯甲酸酯和对硝基苯基氯甲酸酯活化的peg可以用于凝血蛋白的缀合。
[0189]
另一种用于测量vwf生物活性的方法是胶原结合测定,其是基于elisa技术(brown和bosak,thromb.res.,1986,43:303
‑
311;favaloro,thromb.haemost.,2000,83 127
‑
135)。微孔板上涂覆i型或iii型胶原。接着,vwf结合至胶原表面并且随后用酶标多克隆抗体检测。最后一步是底物反应,其可使用elisa阅读器进行光度监测。
[0190]
血管性血友病因子(vwf:ag)的免疫学测定是测量血浆中vwf蛋白浓度的免疫测定。它们没有指示vwf功能。存在多种用于测量vwf:ag的方法,并且这些方法包括酶联免疫吸附测定(elisa)或自动乳胶免疫测定(lia)。目前许多实验室使用全自动乳胶免疫测定。历史上,实验室使用了多种技术,包括laurell电免疫测定'laurell rockets',但现今这些技术在大多数实验室很少使用。
[0191]
iii.试剂盒
[0192]
作为另一方面,本发明包括试剂盒,所述试剂盒包含一种或多种冻干组合物,所述冻干组合物以有助于其用于向受试者施用的方式加以包装。在一个实施方案中,此类试剂盒包含本文所述的药物制剂(例如,包含治疗性蛋白或肽的组合物),所述药物制剂被包装在诸如密封瓶或器皿的容器中,其中描述化合物或组合物在实践所述方法中的用法的标签贴在容器上或包含在包装中。在一个实施方案中,药物制剂包装在容器中,以使得容器的顶部空间的量(例如,在液体制剂与容器顶部之间的空气的量)非常小。优选地,顶部空间的量是可忽略的(例如,几乎没有)。在一个实施方案中,试剂盒包含具有治疗性蛋白或肽组合物的第一容器和具有用于该组合物的生理学上可接受的复溶溶液的第二容器。在一个方面,药物制剂以单位剂量形式进行包装。试剂盒还可包含适用于根据特定施用途径来施用药物制剂的装置。优选地,试剂盒包含描述药物制剂的用法的标签。
[0193]
iv.用于患有严重vwd的患者的自发性出血的预防性治疗的方法的rvwf
[0194]
向患有严重vwd的受试者施用rvwf用于自发性出血发作的预防性治疗的优点之一是相比于pdvwf,rvwf的更高比活性使得所施用的rvwf的量和向受试者再次给药的次数具有灵活性。如将理解的和如本文中进一步详细讨论的,共施用的fviii可以是重组的或血浆来源的。
[0195]
使用由治疗医师选择的剂量水平和模式进行rvwf的单次施用或多次施用。对于预防或治疗疾病,适当的剂量取决于待治疗疾病的类型(例如,血管性血友病)、疾病的严重程度和病程、药物是出于预防还是治疗目的施用、先前疗法、患者的病史和对药物的反应,以及主治医师的判断。
[0196]
在一些方面,以范围为40
‑
80iu/kg的剂量向受试者预防性地施用rvwf,例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、40
‑
80、45
‑
80、50
‑
80、45
‑
70、45
‑
60、45
‑
55、45
‑
50、50
‑
60、55
‑
60、60
‑
65、55
‑
65、60
‑
70、65
‑
70、60
‑
75、70
‑
80或75
‑
80iu/kg。在一些实施方案中,剂量范围为40iu/kg至60iu/kg。在一些实施方案中,剂量范围为45iu/kg至55iu/kg。在一些实施方案中,剂量为约40iu/kg、约50iu/kg或约60iu/kg。在一些实施方案中,剂量为约50iu/kg。在一些实施方案中,剂量为约80iu/kg。在一些实施方案中,rvwf每周一次、每周两次、每周三次、每周四次、每周五次或更多次进行施用。在一些实施方案中,
rvwf每周施用两次。在一些实施方案中,rvwf每周施用两次。在一些实施方案中,rvwf以范围为40iu/kg至60iu/kg的剂量每周施用两次。在一些实施方案中,rvwf以范围为40iu/kg至60iu/kg的剂量通过iv输注每周施用两次。
[0197]
在一些实施方案中,用来测量vwf:ag、vwf:rco、vwf:cb和fviii活性水平的血液样品在给药前、在药物输注后15分钟、30分钟和60分钟,以及在3小时、6小时、12小时、24小时、28小时、32小时、48小时、72小时和96小时时采集。在一些实施方案中,可获得样品,包括例如血液样品,用于检测vwf:rco和fviii活性。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在rvwf预防性治疗前获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在rvwf预防性治疗后15分钟、30分钟、60分钟、3小时、6小时、12小时、24小时、28小时、32小时、48小时、72小时或96小时获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在rvwf预防性治疗后25至31天获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在出血发作后获得,并且在此类实施方案中,样品在rvwf施用前、施用后2小时和接着每12
‑
24小时获得,直到出血事件消退。在一些实施方案中,基于样品确定fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性与时间曲线。在一些实施方案中,还通过一阶段凝血测定与时间曲线测量fviii:c。
[0198]
在一些实施方案中,作为初始(第一次)施用,以40
‑
80iu/kg的范围向受试者施用rvwf,例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、40
‑
80、45
‑
80、50
‑
80、45
‑
70、45
‑
60、45
‑
55、45
‑
50、50
‑
60、55
‑
60、60
‑
65、55
‑
65、60
‑
70、65
‑
70、60
‑
75、70
‑
80或75
‑
80iu/kg。在一些实施方案中,作为第二次施用,以40
‑
80iu/kg的范围向受试者施用rvwf,例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、40
‑
80、45
‑
80、50
‑
80、45
‑
70、45
‑
60、45
‑
55、45
‑
50、50
‑
60、55
‑
60、60
‑
65、55
‑
65、60
‑
70、65
‑
70、60
‑
75、70
‑
80或75
‑
80iu/kg。在一些实施方案中,作为第三次施用,以40
‑
80iu/kg的范围向受试者施用rvwf,例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、40
‑
80、45
‑
80、50
‑
80、45
‑
70、45
‑
60、45
‑
55、45
‑
50、50
‑
60、55
‑
60、60
‑
65、55
‑
65、60
‑
70、65
‑
70、60
‑
75、70
‑
80或75
‑
80iu/kg。在一些实施方案中,作为后续施用,以40
‑
80iu/kg的范围向受试者施用rvwf,例如40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、40
‑
80、45
‑
80、50
‑
80、45
‑
70、45
‑
60、45
‑
55、45
‑
50、50
‑
60、55
‑
60、60
‑
65、55
‑
65、60
‑
70、65
‑
70、60
‑
75、70
‑
80或75
‑
80iu/kg。
[0199]
如本文所述,rvwf的组合物可包含在药物制剂中。此类制剂可口服、局部、透皮、胃肠外、通过吸入喷雾、经阴道、经直肠或通过颅内注射施用。如本文所用的术语胃肠外包括皮下注射、静脉内、肌内、脑池内注射或输注技术。也设想通过静脉内、真皮内、肌内、乳房内、腹腔内、鞘内、眼球后、肺内注射和/或在特定部位手术植入进行施用。一般来讲,组合物基本上不含热原质以及可能会对受体有害的其他杂质。
[0200]
在一个方面,本发明的制剂是通过初始推注,接着进行连续输注以便维持药物产品的治疗性循环水平来施用。作为另一个实例,本发明的化合物以一次剂量(one
‑
time dose)施用。本领域普通技术人员将容易地优化如根据良好的医学实践和个别患者的临床状况确定的有效剂量和施用方案。施用途径可以是但不限于通过静脉内、腹腔内、皮下或肌内施用。给药频率取决于剂的药代动力学参数和施用途径。最佳药物制剂由本领域技术人员根据施用途径和所需剂量来确定。参见例如,remington's pharmaceutical sciences,第18版,1990,mack publishing co.,easton,pa.18042页数1435
‑
1712,其公开内容出于所有目的且特别是出于涉及药物产品的制剂、施用途径和剂量的所有教义,特此以引用的方式整体并入。此类制剂影响所施用剂的物理状态、稳定性、体内释放速率和体内清除速率。取决于施用途径,合适的剂量根据体重、体表面积或器官大小计算。可通过使用用于测定血液水平剂量的已确立测定结合适当的剂量
‑
反应数据来确定适当的剂量。最终给药方案由主治医师考虑会改变药物作用的各种因素来确定,所述各种因素例如药物的比活性、患者的损伤严重程度和反应性、患者的年龄、状况、体重、性别和饮食、任何感染的严重程度、施用时间和其他临床因素。以举例的方式,本发明的重组vwf的典型剂量为大约50iu/kg,等于500μg/kg。在进行研究时,将出现关于针对各种疾病和病况的适当剂量水平和治疗持续时间的另外信息。
[0201]
在一个方面,为向人或测试动物施用组合物,所述组合物包含一种或多种药学上可接受的载剂。短语“药学上”或“药理学上”可接受是指稳定的、抑制蛋白质降解诸如聚集和切割产物,并且此外如下所述在使用本领域中众所周知的途径施用时不产生过敏或其他不良反应的分子实体和组合物。“药学上可接受的载剂”包括任何和所有临床上有用的溶剂、分散介质、包衣、抗细菌及抗真菌剂、等渗和吸收延缓剂等,包括以上公开的那些剂。
[0202]
药物制剂口服、局部、透皮、胃肠外、通过吸入喷雾、经阴道、经直肠或通过颅内注射施用。如本文所用的术语胃肠外包括皮下注射、静脉内、肌内、脑池内注射或输注技术。也设想通过静脉内、真皮内、肌内、乳房内、腹腔内、鞘内、眼球后和/或在特定部位肺内注射进行施用。一般来讲,组合物基本上不含热原质以及可能会对受体有害的其他杂质。
[0203]
使用由治疗医师选择的剂量水平和模式进行rvwf的单次施用或多次施用。对于预防或治疗疾病,适当的剂量取决于待治疗疾病的类型(例如,血管性血友病)、疾病的严重程度和病程、药物是出于预防还是治疗目的施用、先前疗法、患者的病史和对药物的反应,以及主治医师的判断。
[0204]
a.冻干vwf制剂
[0205]
本方法还提供了用于本文提供的治疗方法的rvwf的制剂。在一些实施方案中,rvwf组合物用于药物组合物的制备。在一些实施方案中,rvwf可配制为冻干制剂。
[0206]
在一些实施方案中,包含本发明的vwf多肽的制剂在纯化之后且在施用于受试者之前冻干。冻干使用本领域中常见的技术进行,且应当针对所开发的组合物进行优化(tang等人,pharm res.21:191
‑
200,(2004)和chang等人,pharm res.13:243
‑
9(1996))。
[0207]
在一个方面,冻干周期由三个步骤构成:冷冻、一次干燥和二次干燥(a.p.mackenzie,phil trans r soc london,ser b,biol 278:167(1977))。在冷冻步骤中,冷却溶液以开始结冰。此外,该步骤诱导增积剂的结晶。冰在一次干燥阶段升华,其通过将腔室压力降低至冰的蒸汽压以下进行,应用真空并引入热量以促进升华。最后,在二次干
燥阶段于降低的腔室压力和升高的搁板温度下去除吸附或结合水。所述过程产生一种称为冻干饼的材料。此后,可以用无菌水或合适的注射用稀释剂将饼复溶。
[0208]
冻干周期不仅决定赋形剂的最终物理状态,而且影响其他参数,诸如复溶时间、外观、稳定性和最终含水量。冻结状态下的组合物结构经历特定温度下发生的几次转变(例如,玻璃化转变、润湿和结晶),并且所述结构可以用于理解和优化冻干过程。玻璃化转变温度(tg和/或tg')可提供关于溶质物理状态的信息,并可通过差示扫描量热法(dsc)确定。tg和tg'是设计冻干周期时必须考虑的重要参数。例如,tg'对于一次干燥很重要。此外,在干燥状态下,玻璃化转变温度提供最终产品的储存温度的信息。
[0209]
b.药物制剂和赋形剂概述
[0210]
赋形剂是赋予或增强药物产品(例如,蛋白质)的稳定性和递送的添加剂。不论其纳入的原因,赋形剂是制剂的整体组成部分,因此需要是安全的和患者耐受良好的。对于蛋白质药物,赋形剂的选择特别重要,因为它们会影响药物的功效和免疫原性。因此,需要通过适当地选择提供合适的稳定性、安全性和适销性的赋形剂来开发蛋白质制剂。
[0211]
在一个方面,冻干制剂至少包含缓冲液、增积剂和稳定剂中的一种或多种。在此方面,在冻干步骤期间或在复溶期间聚集成为问题的情况下评估并选择表面活性剂的效用。包含适当的缓冲剂以使制剂在冻干期间维持在稳定的ph区内。表10提供了液体和冻干蛋白制剂所设想的赋形剂组分的比较。
[0212]
表10:冻干蛋白制剂的赋形剂组分
[0213][0214]
开发蛋白质制剂的主要挑战是稳定产品以对抗制造、运输和储存中的应力。制剂
pharmacol toxicol.,98(2):218
‑
21(2006))。经由皮下(sc)或肌内(im)途径施用的药物(在这种情况下药物溶液在部位保持相对较长的时间)与通过iv途径施用(在这种情况下制剂一经施用就快速稀释到血液中)时相比,刺痛和刺激的可能性更大。对于通过直接iv输注施用的制剂,需要监测缓冲液(和任何其他制剂组分)的总量。人们必须特别小心以磷酸钾缓冲液的形式施用的钾离子,这会诱导患者的心血管效应(hollander
‑
rodriguez jc等人,am.fam.physician.,73(2):283
‑
90(2006))。
[0223]
冻干制剂的缓冲液需要另外的考虑。一些缓冲液(如磷酸钠)会在冷冻期间从蛋白质无定形相中结晶出来,导致ph移动。其他常见的缓冲液,诸如醋酸盐和咪唑,可能会在冻干过程中升华或蒸发,从而在冻干期间或复溶后使制剂的ph移动。
[0224]
选择存在于组合物中的缓冲系统以在生理上相容并维持药物制剂的所需ph。在一个实施方案中,溶液的ph介于ph 2.0和ph 12.0之间。例如,溶液的ph可以为2.0、2.3、2.5、2.7、3.0、3.3、3.5、3.7、4.0、4.3、4.5、4.7、5.0、5.3、5.5、5.7、6.0、6.3、6.5、6.7、7.0、7.3、7.5、7.7、8.0、8.3、8.5、8.7、9.0、9.3、9.5、9.7、10.0、10.3、10.5、10.7、11.0、11.3、11.5、11.7或12.0。
[0225]
ph缓冲化合物可以适于将制剂的ph维持在预定水平的任何量存在。在一个实施方案中,ph缓冲浓度介于0.1mm和500mm(1m)之间。例如,设想ph缓冲剂为至少0.1、0.5、0.7、0.8、0.9、1.0、1.2、1.5、1.7、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50、60、70、80、90、100、200或500mm。
[0226]
用于缓冲如本文所陈述的制剂的示例性ph缓冲剂包括但不限于有机酸、甘氨酸、组氨酸、谷氨酸盐、琥珀酸盐、磷酸盐、醋酸盐、柠檬酸盐、tris、hepes和氨基酸或氨基酸混合物(包括但不限于天冬氨酸盐、组氨酸和甘氨酸)。在本发明的一个实施方案中,缓冲剂是柠檬酸盐。
[0227]
d.药用稳定剂和增积剂
[0228]
在本药物制剂的一个方面,添加稳定剂(或稳定剂的组合)以防止或减少储存诱导的聚集和化学降解。复溶时浑浊或混浊的溶液表明蛋白质已沉淀或至少已聚集。术语“稳定剂”意指在水性状态下能够防止聚集或物理降解,包括化学降解(例如,自溶、脱酰胺、氧化等)的赋形剂。设想的稳定剂包括但不限于蔗糖、海藻糖、甘露糖、麦芽糖、乳糖、葡萄糖、棉子糖、纤维二糖、龙胆二糖、异麦芽糖、阿拉伯糖、葡糖胺、果糖、甘露糖醇、山梨糖醇、甘氨酸、精氨酸盐酸盐、多羟基化合物(包括多糖诸如葡聚糖、淀粉、羟乙基淀粉、环糊精)、n
‑
甲基吡咯烷酮(n
‑
methyl pyrollidene)、纤维素和透明质酸、氯化钠(carpenter等人,develop.biol.standard 74:225,(1991))。在本制剂中,稳定剂以约0.1、0.5、0.7、0.8 0.9、1.0、1.2、1.5、1.7、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、500、700、900或1000mm的浓度掺入。在本发明的一个实施方案中,甘露糖醇和海藻糖用作稳定剂。
[0229]
如果需要,制剂还包含适当量的增积剂和渗透压调节剂。增积剂包括例如但不限于甘露糖醇、甘氨酸、蔗糖、聚合物诸如葡聚糖、聚乙烯吡咯烷酮、羧甲基纤维素、乳糖、山梨糖醇、海藻糖或木糖醇。在一个实施方案中,增积剂是甘露糖醇。增积剂以约0.1、0.5、0.7、0.8、0.9、1.0、1.2、1.5、1.7、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90、100、200、500、700、900或1000mm的浓度掺入。
[0230]
e.药物表面活性剂
[0231]
蛋白质具有与表面相互作用的高度倾向,使得它们易于在气
‑
液、小瓶
‑
液和液
‑
液(硅油)界面处吸附和变性。已观察到这种降解路径与蛋白质浓度成反向关系,并且导致可溶性和不溶性蛋白质聚集体的形成或经吸附至表面使蛋白质从溶液中流失。除了容器表面吸附之外,物理搅拌会加剧表面诱导的降解,正如产品运输和处理期间会经历的那样。
[0232]
表面活性剂通常用于蛋白质制剂中以防止表面诱导的降解。表面活性剂是两亲性分子,具有与蛋白质竞争界面位置的能力。表面活性剂分子的疏水部分占据界面位置(例如,气/液),而分子的亲水部分保持朝向本体溶剂。在足够的浓度下(通常大约为洗涤剂的临界胶束浓度),表面活性剂分子的表面层用于防止蛋白质分子吸附于界面处。因此,表面诱导的降解被最小化。本文设想的表面活性剂包括但不限于脱水山梨糖醇聚乙氧基化物的脂肪酸酯,例如聚山梨酸酯20和聚山梨酸酯80。两者的差别仅在于对分子赋予疏水特性的脂肪链(分别为c
‑
12和c
‑
18)的长度。因此,与聚山梨酸酯20相比,聚山梨酸酯80的表面活性更高并且具有更低的临界胶束浓度。
[0233]
洗涤剂也会影响蛋白质的热力学构象稳定性。这里同样,给定的洗涤剂赋形剂的作用将是蛋白质特异性的。例如,已显示出聚山梨酸酯会降低一些蛋白质的稳定性并增加其他蛋白质的稳定性。就可与部分或完全未折叠的蛋白质状态特异性结合的洗涤剂分子的疏水尾部而言,蛋白质的洗涤剂去稳定可以合理化。这些类型的相互作用能够使构象平衡向更加展开的蛋白质状态(例如增加蛋白质分子的疏水部分的暴露以作为结合聚山梨酸酯的补充)移动。另选地,如果蛋白质天然状态展现出一些疏水表面,洗涤剂与天然状态的结合可以稳定该构象。
[0234]
聚山梨酸酯的另一方面是它们固有地易氧化降解。作为原料,它们通常含有会导致蛋白质残基侧链(尤其是甲硫氨酸)氧化的足量过氧化物。由添加稳定剂产生的氧化损伤的可能性强调了应在制剂中使用最低有效浓度的赋形剂这一点。对于表面活性剂,给定蛋白质的有效浓度将取决于稳定作用的机制。
[0235]
还添加适当量的表面活性剂以防止在冷冻和干燥期间的表面相关的聚集现象(chang,b,j.pharm.sci.85:1325,(1996))。因此,示例性表面活性剂包括但不限于阴离子、阳离子、非离子、两性离子和两性表面活性剂(包括衍生自天然存在的氨基酸的表面活性剂)。阴离子表面活性剂包括但不限于月桂基硫酸钠、磺基琥珀酸二辛酯钠和磺酸二辛酯钠、鹅去氧胆酸、n
‑
月桂酰肌氨酸钠盐、十二烷基硫酸锂、1
‑
辛烷磺酸钠盐、胆酸钠水合物、脱氧胆酸钠和甘氨脱氧胆酸钠盐。阳离子表面活性剂包括但不限于苯扎氯铵或苄索氯铵、十六烷基氯化吡啶一水合物和十六烷基三甲基溴化铵。两性离子表面活性剂包括但不限于chaps、chapso、sb3
‑
10和sb3
‑
12。非离子表面活性剂包括但不限于毛地黄皂苷(digitonin)、triton x
‑
100、triton x
‑
114、tween
‑
20和tween
‑
80。表面活性剂还包括但不限于聚月桂乙二醇400(lauromacrogol 400)、聚乙二醇40硬脂酸酯(polyoxyl 40stearate)、聚氧乙烯氢化蓖麻油10、40、50和60、单硬脂酸甘油酯、聚山梨酸酯40、60、65和80、大豆卵磷脂和其他磷脂(诸如二油酰基磷脂酰胆碱(dopc)、二肉豆蔻酰基磷脂酰甘油(dmpg)、二肉豆蔻酰基磷脂酰胆碱(dmpc)和二油酰基磷脂酰甘油(dopg))、蔗糖脂肪酸酯、甲基纤维素和羧甲基纤维素。因此还提供了以不同比率包含这些表面活性剂(单独地或作为混合物)的组合物。在本发明的一个实施方案中,表面活性剂为tween
‑
80。在本制剂中,表
面活性剂以约0.01至约0.5g/l的浓度掺入。在提供的制剂中,表面活性剂的浓度为0.005、0.01、0.02、0.03、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9或1.0g/l。
[0236]
f.药用盐
[0237]
通常添加盐以增加制剂的离子强度,其对蛋白质溶解度、物理稳定性和等渗性很重要。盐可以通过多种方式影响蛋白质的物理稳定性。离子可以通过与蛋白质表面上的带电残基结合来稳定蛋白质的天然状态。另选地,盐可以通过与沿着蛋白质主链(
‑
conh
‑
)的肽基团结合来稳定变性状态。盐还可以通过屏蔽蛋白质分子内残基之间的排斥静电相互作用来稳定蛋白质的天然构象。蛋白质制剂中的盐还可以屏蔽蛋白质分子之间的可导致蛋白质聚集和不溶的吸引静电相互作用。在提供的制剂中,盐浓度介于0.1、1、10、20、30、40、50、80、100、120、150、200、300和500mm之间。
[0238]
g.其他常见赋形剂组分:药用氨基酸
[0239]
氨基酸被发现在蛋白质制剂中广泛用作缓冲液、增积剂、稳定剂和抗氧化剂。因此,在一个方面,组氨酸和谷氨酸分别用于在5.5
‑
6.5和4.0
‑
5.5的ph范围内缓冲蛋白质制剂。组氨酸的咪唑基团的pka=6.0且谷氨酸侧链的羧基具有4.3的pka,这使得这些氨基酸适于在其各自的ph范围内缓冲。谷氨酸在此类情况下特别有用。组氨酸常见于市售的蛋白质制剂中,并且此氨基酸提供了柠檬酸盐(一种已知在注射时会引起刺痛的缓冲液)的替代品。有趣的是,当在液体和冻干呈现形式两者中以高浓度使用时,组氨酸还被报告具有关于聚集的稳定作用(chen b,等人,pharm res.,20(12):1952
‑
60(2003))。其他人还观察到组氨酸降低了高蛋白质浓度制剂的粘度。然而,在同一项研究中,作者观察到在不锈钢容器中对抗体进行冻融研究期间,含有组氨酸的制剂的聚集和变色增加。组氨酸的另一个注意事项是它在金属离子存在下会经历光氧化(tomita m等人,biochemistry,8(12):5149
‑
60(1969))。在制剂中将甲硫氨酸作为抗氧化剂使用似乎很有前景;已观察到它对多种氧化应激有效(lam xm,等人,j pharm scl,86(11):1250
‑
5(1997))。
[0240]
在各个方面,提供了包含甘氨酸、脯氨酸、丝氨酸、精氨酸和丙氨酸中的一个或多个氨基酸的制剂,已显示出其通过优先排除的机制稳定蛋白质。甘氨酸也是冻干制剂中常用的增积剂。已显示出精氨酸是一种有效抑制聚集的剂,并已用于液体和冻干制剂两者。
[0241]
在提供的制剂中,氨基酸浓度介于0.1、1、10、20、30、40、50、80、100、120、150、200、300和500mm之间。在本发明的一个实施方案中,氨基酸是甘氨酸。
[0242]
h.其他常见赋形剂组分:药用抗氧化剂
[0243]
蛋白质残基的氧化由多种不同的来源产生。除了添加特定抗氧化剂之外,氧化蛋白质损伤的预防还涉及在产品的整个制造过程和储存中小心控制多种因素,诸如大气氧、温度、光照和化学污染。因此,本发明设想了使用药用抗氧化剂,包括但不限于还原剂、氧/自由基清除剂或螯合剂。在一个方面,治疗性蛋白质制剂中的抗氧化剂是水溶性的并且在整个产品保存期内保持活性。还原剂和氧/自由基清除剂通过消除溶液中的活性氧物质起作用。螯合剂诸如edta可有效结合促进自由基形成的痕量金属污染物。例如,在酸性成纤维细胞生长因子的液体制剂中利用edta来抑制金属离子催化的半胱氨酸残基的氧化。
[0244]
除了各种赋形剂防止蛋白质氧化的有效性之外,抗氧化剂本身诱导蛋白质发生其他共价或物理变化的可能性也值得关注。例如,还原剂会引起分子内二硫键的破坏,从而导
致二硫键改组。在过渡金属离子的存在下,已显示出抗坏血酸和edta可促进多种蛋白质和肽中的甲硫氨酸氧化(akers mj和defelippis mr.peptides and proteins as parenteral solutions.in:pharmaceutical formulation development of peptides and proteins.sven frokjaer,lars hovgaard编辑.pharmaceutical science.taylor和francis,uk(1999));fransson j.r.,/.pharm.sci.86(9):4046
‑
1050(1997);yin j,等人,pharm res.,21(12):2377
‑
83(2004))。硫代硫酸钠被报告降低了在rhumab her2中光和温度诱导的甲硫氨酸氧化的水平;然而,硫代硫酸
‑
蛋白质加合物的形成也在此研究中报告(lam xm,yang jy,等人,j pharm sci.86(11):1250
‑
5(1997))。根据蛋白质的特定应力和敏感性选择适当的抗氧化剂。在某些方面设想的抗氧化剂包括但不限于还原剂和氧/自由基清除剂、edta和硫代硫酸钠。
[0245]
i.其他常见赋形剂组分:药用金属离子
[0246]
一般来讲,蛋白质制剂中不需要过渡金属离子,因为它们会催化蛋白质中的物理和化学降解反应。然而,当特定金属离子是蛋白质的辅因子时,将其包含在制剂中;并且在特定金属离子形成配位复合物的情况下,将其包含在蛋白质的悬浮制剂中(例如,胰岛素的锌悬浮液)。最近,已提议使用镁离子(10
‑
120mm)来抑制天冬氨酸异构化为异天冬氨酸(wo 2004039337)。
[0247]
金属离子赋予蛋白质稳定性或增加的活性的两个实例是人脱氧核糖核酸酶(rhdnase,)和因子viii。就rhdnase而言,ca
2
离子(至多达100mm)通过特异性结合位点增加酶的稳定性(chen b等人,pharm sci.,88(4):477
‑
82(1999))。事实上,用egta从溶液中去除钙离子引起了脱酰胺和聚集的增加。然而,仅ca
2
离子被观察到此影响;其他二价阳离子mg
2
、mn
2
和zn
2
被观察到使rhdnase去稳定。在因子viii中观察到类似的影响。ca
2
和sr
2
离子稳定了蛋白质而其他离子如mg
2
、mn
2
和zn
2
、cu
2
和fe
2
使酶去稳定(fatouros,a.,等人,int.j.pharm.,155,121
‑
131(1997)。在使用因子viii的单独研究中,在al
3
离子的存在下观察到聚集速率显著增加(derrick ts,等人,/.pharm.sci.,93(10):2549
‑
57(2004))。作者指出其他赋形剂如缓冲盐经常被al
3
离子污染,并且说明了在配制的产物中需要使用适当质量的赋形剂。
[0248]
j.其他常见赋形剂组分:药用防腐剂
[0249]
当开发涉及自同一容器提取超过一次的多用胃肠外制剂时,防腐剂是必需的。它们的主要功能是在药物产品的整个保存期或使用期内抑制微生物生长,并确保产品无菌。常用的防腐剂包括但不限于苯甲醇、苯酚和间甲酚。尽管防腐剂具有悠久的使用历史,但开发包含防腐剂的蛋白质制剂可具有挑战性。防腐剂对蛋白质几乎始终具有去稳定作用(聚集),并且这已成为限制它们在多剂量蛋白质制剂中使用的主要因素(roy s,等人,j pharm scl,94(2):382
‑
96(2005))。
[0250]
迄今为止,大多数蛋白质药物已配制为仅供单次使用。然而,当多剂量制剂是可能的时,它们具有实现患者便利性和增加适销性的附加优势。一个良好实例是人生长激素(hgh),其中防腐制剂的开发已导致更方便的多用注射笔呈现形式的商业化。至少四种此类含有hgh防腐制剂的笔装置目前可在市场上获得。(液体,novo nordisk)、nutropin(液体,genentech)和genotropin(冻干
‑
双室药筒,pharmacia&upjohn)含有
苯酚,而(eli lilly)用间甲酚配制。
[0251]
在防腐剂型的制剂开发期间需要考虑几个方面。药物产品中的有效防腐剂浓度必须进行优化。这需要用赋予抗微生物有效性而不损害蛋白质稳定性的浓度范围在剂型中测试给定防腐剂。例如,在开发白细胞介素
‑
1受体(i型)液体制剂时,使用差示扫描量热法(dsc)成功筛选了三种防腐剂。防腐剂基于它们在市售产品中常用浓度下对稳定性的影响进行排序(remmele rl jr.,等人,pharm res.,15(2):200
‑
8(1998))。
[0252]
含有防腐剂的液体制剂的开发比冻干制剂更具挑战性。冷冻干燥产品可在无防腐剂的情况下冻干,并且在使用时用含有防腐剂的稀释剂复溶。这缩短防腐剂与蛋白质接触的时间,从而使相关稳定性风险显著最小化。就液体制剂而言,应在整个产品保存期(
‑
18
‑
24个月)维持防腐剂有效性和稳定性。一个需注意的要点是必须在含有活性药物和所有赋形剂组分的最终制剂中证明防腐剂有效性。
[0253]
一些防腐剂会引起注射部位反应,这是选择防腐剂时需要考虑的另一个因素。在专注于评估norditropin中的防腐剂和缓冲液的临床试验中,与含有间甲酚的制剂相比,在含有苯酚和苯甲醇的制剂中观察到的疼痛感更低(kappelgaard a.m.,horm res.62增刊3:98
‑
103(2004))。有趣的是,在常用的防腐剂当中,苯甲醇具有麻醉特性(minogue sc和sun da.,anesthanalg.,100(3):683
‑
6(2005))。在各个方面,防腐剂的使用提供了超过任何副作用的益处。
[0254]
k.药物制剂的制备方法
[0255]
本发明还设想了药物制剂的制备方法。
[0256]
本方法还包括以下步骤中的一个或多个:在冻干之前将本文所述的稳定剂添加至所述混合物中;在冻干之前将至少一种选自增积剂、渗透压调节剂和表面活性剂的剂(每一者如本文所述)添加至所述混合物中。
[0257]
冻干材料的标准复溶实践是添加回一定体积的纯水或无菌注射用水(wfi)(通常等同于在冻干期间去除的体积),只是在用于胃肠外施用的药物的制备中有时使用抗细菌剂的稀溶液(chen,drug development and industrial pharmacy,18:1311
‑
1354(1992))。因此,提供用于制备复溶的rvwf组合物的方法,其包括将稀释剂添加至本发明的冻干的rvwf组合物中的步骤。
[0258]
冻干材料可以复溶为水溶液。多种水性载剂,例如无菌注射用水、供多剂量使用的含防腐剂的水、或含适量的表面活性剂的水(例如,含有与适于制造水性悬浮液的赋形剂混合的活性化合物的水性悬浮液)。在各个方面,此类赋形剂为悬浮剂,例如但不限于羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、褐藻酸钠、聚乙烯基吡咯烷酮、西黄蓍胶以及阿拉伯树胶;分散或湿润剂为天然存在的磷脂,例如但不限于卵磷脂;或环氧烷与脂肪酸的缩合产物,例如但不限于聚氧乙烯硬脂酸酯;或环氧乙烷与长链脂肪族醇的缩合产物,例如但不限于十七亚乙基氧十六醇;或环氧乙烷与从脂肪酸和己糖醇衍生的偏酯的缩合产物,诸如聚氧乙烯山梨糖醇单油酸酯;或环氧乙烷与从脂肪酸和己糖醇酐衍生的偏酯的缩合产物,例如但不限于聚乙烯脱水山梨糖醇单油酸酯。在各个方面,水性悬浮液还含有一种或多种防腐剂,例如但不限于对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯。
[0259]
l.用于施用的示例性rvwf制剂
[0260]
在一些实施方案中,本方法提供了增强的制剂,其使得最终产品具有高效力(高
rvwf浓度和增强的长期稳定性)以减少用于治疗的体积(100iu/ml至10000iu/ml)。在一些实施方案中,用于施用的制剂中的rvwf浓度为约100iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约500iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约1000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约2000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约3000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约4000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约5000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约6000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约7000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约8000iu/ml至10000iu/ml。在一些实施方案中,用于施用的制剂中的rvwf浓度为约9000iu/ml至10000iu/ml。
[0261]
在一些实施方案中,用于施用的制剂包含一种或多种两性离子化合物,包括例如氨基酸(如组氨酸、甘氨酸、精氨酸)。在一些实施方案中,用于施用的制剂包含具有最少一个疏水基团和一个亲水基团的两亲特性的组分,包括例如聚山梨酸酯80、辛基吡喃糖苷(octylpyranosid)、二肽和/或两亲肽。在一些实施方案中,用于施用的制剂包含非还原糖或糖醇或二糖,包括例如山梨糖醇、甘露糖醇、蔗糖或海藻糖。在一些实施方案中,用于施用的制剂包含产生生理渗透压的无毒水溶性盐,包括例如氯化钠。在一些实施方案中,用于施用的制剂具有范围为6.0至8.0的ph。在一些实施方案中,用于施用的制剂具有约6.0、约6.5、约7、约7.5或约8.0的ph。在一些实施方案中,用于施用的制剂包含一种或多种稳定rvwf的二价阳离子,包括例如,ca2 、mg2 、zn2 、mn2和/或其组合。在一些实施方案中,用于施用的制剂包含约1mm至约50mm甘氨酸、约1mm至约50mm组氨酸、约0至约300mm氯化钠(例如,小于300mm钠)、约0.01%至约0.05%聚山梨酸酯20(或聚山梨酸酯80)和约0.5%至约20%(w/w)蔗糖,ph为约7.0并且在施用时间点具有生理渗透压。
[0262]
在一些实施方案中,用于施用的制剂可以经冷冻干燥。在一些实施方案中,用于施用的制剂是稳定的并且可以液态储存于约2℃至约8℃以及约18℃至约25℃下。在一些实施方案中,用于施用的制剂是稳定的并且可以液态储存于约2℃至约8℃下。在一些实施方案中,用于施用的制剂是稳定的并且可以液态储存于约18℃至约25℃下。
[0263]
v.用于预防性治疗患有严重vwd的患者的方法的rvwf的施用
[0264]
在一些实施方案中,本发明提供了预防性治疗患有严重血管性血友病(vwd)的受试者的自发性出血发作。在一些实施方案中,预防性治疗包括向受试者施用重组血管性血友病因子(rvwf)以降低自发性出血发作的频率和/或持续时间。
[0265]
在一些实施方案中,自发性出血发作包括与创伤无关的任何发作。在一些实施方案中,治疗的功效由自发性出血发作次数的减少来指示。在一些实施方案中,自发性出血发作次数的减少由年出血率(abr)的降低来指示。在一些实施方案中,治疗前abr基于以下公式确定:出血次数/不在治疗方案上的天数。在一些实施方案中,治疗前abr基于以下公式确定:出血次数/rvwf预防性治疗前的12个月。在一些实施方案中,预防性abr(预防性治疗后的abr)基于以下公式确定:出血次数/治疗方案的天数。
[0266]
在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防期间自发性出血发作的abr降低≥25%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),
rvwf预防性治疗期间自发性出血发作的abr降低≥30%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥35%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥40%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥45%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥50%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥55%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥60%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥65%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥70%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥75%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥80%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥85%指示预防性治疗功效。在一些实施方案中,相对于治疗前年出血率(abr),rvwf预防性治疗期间自发性出血发作的abr降低≥90%指示预防性治疗功效。
[0267]
在一些实施方案中,预防性治疗功效可通过在rvwf预防性治疗前后获得样品并检测vwf:rco和/或fviii活性来测量。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在rvwf预防性治疗前和在rvwf预防性治疗后获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在rvwf预防性治疗后15分钟、30分钟、60分钟、3小时、6小时、12小时、24小时、28小时、32小时、48小时、72小时或96小时获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在rvwf预防性治疗后25至31天获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性的样品在出血发作后或期间获得,并且在此类实施方案中,样品在rvwf施用前、施用后2小时和接着每12
‑
24小时获得,直到出血事件消退。在一些实施方案中,治疗功效可以在出血发作后或期间测定,并且在此类实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在出血发作后获得,并且进一步,其中样品在rvwf施用前、施用后2小时和接着每12
‑
24小时获得,直到出血事件消退。在一些实施方案中,基于样品确定fviii、fviii:c、vwf:rco、vwf:ag和vwf胶原结合能力活性与时间曲线,以监测rvwf预防性治疗的治疗功效。在一些实施方案中,还通过一阶段凝血测定与时间曲线测量fviii:c,以监测rvwf预防性治疗的治疗功效。在一些实施方案中,相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平有所改善。在一些实施方案中,相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平有所改善,并且此改善指示治疗功效。在一些实施方案中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平的改善来指示。
在一些实施方案中,fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平(例如未患有vwd的受试者中的水平)。
[0268]
在一些方面,rvwf施用的预防性治疗功效在出血发作之后或期间确定。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在出血发作之后获得。在一些实施方案中,用于检测fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性的样品在出血发作期间获得。在一些情况下,样品在出血发作期间从患者获得,使得可以使用样品来确定fviii、fviii:c、vwf:rco、vwf:ag和/或vwf胶原结合能力活性。在其他情况下,样品在出血发作之后从患者获得。在一些实施方案中,样品在rvwf施用前获得。在一些实施方案中,样品在rvwf施用后获得。在一些实施方案中,样品在rvwf施用后2小时获得。在一些实施方案中,样品是每12
‑
24小时获得,直到出血发作消退。在某些实施方案中,样品在rvwf施用前和rvwf施用后2小时获得。在一些实施方案中,样品在rvwf施用前和每12
‑
24小时获得,直到出血发作消退。在其他实施方案中,样品在rvwf施用前、rvwf施用后2小时和每12
‑
24小时获得,直到出血发作消退。因此,样品可以在rvwf施用前和出血发作前获得。在一些实施方案中,样品在rvwf施用后和出血发作前获得。在一些实施方案中,样品在rvwf施用后和出血发作期间获得。在某些实施方案中,样品在rvwf施用后和出血发作消退后获得。
[0269]
在一些方面,以40
‑
80iu/kg的范围向受试者施用rvwf,例如,40、45、50、55、60、65、70、75、80、90、100、40
‑
100、40
‑
80、50
‑
80、60
‑
80、70
‑
80、40
‑
50、40
‑
60、40
‑
70、40
‑
50、50
‑
60、60
‑
70或70
‑
80iu/kg。在一些实施方案中,rvwf每周施用至少一次以预防自发性出血发作。在一些情况下,给予受试者rvwf的单次施用。在一些情况下,向受试者施用rvwf的单次输注。
[0270]
在一些方面,以40
‑
80iu/kg的范围向受试者施用rvwf,例如,40、45、50、55、60、65、70、75、80、90、100、40
‑
100、40
‑
80、50
‑
80、60
‑
80、70
‑
80、40
‑
50、40
‑
60、40
‑
70、40
‑
50、50
‑
60、60
‑
70或70
‑
80iu/kg。在一些实施方案中,剂量范围为40iu/kg至60iu/kg。在一些实施方案中,剂量范围为45iu/kg至55iu/kg。在一些实施方案中,剂量为约40iu/kg、约50iu/kg或约60iu/kg。在一些实施方案中,rvwf每周施用至少两次以预防自发性出血发作。在其他实施方案中,rvwf每周施用两次或更多次,例如2、3、4、5或更多次,以防止自发性出血发作。在一些情况下,给予受试者rvwf的两次施用。在一些情况下,向受试者施用rvwf的两次输注。在一些实施方案中,rvwf每周施用两次。在一些实施方案中,rvwf以范围为40iu/kg至60iu/kg的输注剂量每周施用两次。在一些实施方案中,rvwf以范围为40iu/kg至60iu/kg的输注剂量通过iv输注每周施用两次。每次输注可包含范围为约40
‑
80iu/kg的rvwf,例如,40、45、50、55、60、65、70、75、80、40
‑
80、50
‑
80、60
‑
80、70
‑
80、40
‑
50、40
‑
60、40
‑
70、40
‑
50、50
‑
60、60
‑
70或70
‑
80iu/kg的rvwf。在一些实施方案中,每次输注范围为40iu/kg至60iu/kg。在一些实施方案中,每次输注范围为45iu/kg至55iu/kg。在一些实施方案中,每次输注为约40iu/kg、约50iu/kg或约60iu/kg。在一些实施方案中,所述输注的量可以基本上相等。例如,第一次输注和第二次输注的量可以基本上相等。在一些实施方案中,施用于受试者的rvwf的总剂量为约40
‑
160iu/kg,例如,40
‑
150、40
‑
125、40
‑
100、40
‑
90、40
‑
75、50
‑
150、50
‑
100、75
‑
150、100
‑
125或100
‑
160iu/kg。
[0271]
在一些方面,以40
‑
80iu/kg的范围向受试者施用rvwf,例如,40、45、50、55、60、65、70、75、80、90、100、40
‑
100、40
‑
80、50
‑
80、60
‑
80、70
‑
80、40
‑
50、40
‑
60、40
‑
70、40
‑
50、50
‑
60、60
‑
70或70
‑
80iu/kg。在一些实施方案中,rvwf每周施用至少两次以预防自发性出血发作。在一些实施方案中,rvwf每周施用至少三次以预防自发性出血发作。在其他实施方案中,rvwf每周施用三次或更多次,例如3、4、5或更多次,以预防自发性出血发作。在一些情况下,给予受试者rvwf的三次施用。在一些情况下,向受试者施用rvwf的三次输注。每次输注可包含范围为约40
‑
80iu/kg的rvwf,例如,40、45、50、55、60、65、70、75、80、40
‑
80、50
‑
80、60
‑
80、70
‑
80、40
‑
50、40
‑
60、40
‑
70、40
‑
50、50
‑
60、60
‑
70或70
‑
80iu/kg的rvwf。在一些实施方案中,所述输注的量可以基本上相等。例如,第一次输注、第二次输注和第三次输注的量可以基本上相等。在一些实施方案中,施用于受试者的rvwf的总剂量为约80
‑
240iu/kg,例如,120
‑
240、140
‑
240、140
‑
200、160
‑
240、180
‑
240、200
‑
240、80
‑
120、80
‑
160、80
‑
200、120
‑
220或220
‑
240iu/kg。在一些实施方案中,施用于受试者的rvwf的总剂量为小于约160iu/kg/周。在一些实施方案中,施用于受试者的rvwf的总剂量为小于约240iu/kg/周。
[0272]
在一些实施方案中,rvwf每周至少一次、每周至少两次(两次)、每周至少三次(三次)、每天、每隔一天、每2
‑
3天、每2
‑
4天、每2
‑
5天等进行施用。在一些情况下,rvwf在7天的疗程内总共施用1天、2天、3天、4天、5天、6天或7天。在一些实施方案中,rvwf在非连续日施用。在一些实施方案中,rvwf在连续日施用。
[0273]
在一些实施方案中,rvwf至少每12小时、24小时、36小时、48小时、60小时、72小时、84小时或96小时施用一次。在一些情况下,rvwf至少每60小时、72小时或84小时施用一次。在一些情况下,rvwf至少每72小时施用一次。
[0274]
在一些实施方案中,还向患有严重vwd的受试者施用重组因子viii(rfviii)以预防或降低自发性出血发作的频率和/或持续时间。在一些情况下,施用的治疗包含rvwf和rfviii。在其他情况下,施用的治疗不包含rfviii。在一些实施方案中,以约10
‑
70iu/kg的范围向受试者施用rfviii,例如,10
‑
70、10
‑
60、10
‑
50、10
‑
40、10
‑
30、10
‑
20、20
‑
30、30
‑
40、40
‑
50、50
‑
60或60
‑
70iu/kg。在一些情况下,rfviii在初始(第一)剂量或初始(第一次)输注中施用。在一些情况下,rfviii不在初始(第一)剂量中或初始(第一次)输注中施用。在一些情况下,rfviii作为第二剂量或第二次输注的一部分施用。在一些情况下,rfviii不作为第二剂量或第二次输注的一部分施用。在一些情况下,rfviii作为第三剂量或第三次输注的一部分施用。在一些情况下,rfviii不作为第三剂量或第三次输注的一部分施用。
[0275]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf和rfviii的单次输注。在一些实施方案中,rvwf的第二次施用不与fviii一起施用。在一些实施方案中,rvwf的第三次施用不与fviii一起施用。
[0276]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf和rfviii的单次输注。在一些实施方案中,rvwf的第二次施用与fviii一起施用。在一些实施方案中,rvwf的第三次施用不与fviii一起施用。
[0277]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf和rfviii的单次输注。在一些实施方案中,rvwf的第二次施用与fviii一起施用。在一些实施方案中,rvwf的第三次施用与fviii一起施用。
[0278]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf而无
rfviii的单次输注。在一些实施方案中,rvwf的第二次施用与fviii一起施用。在一些实施方案中,rvwf的第三次施用与fviii一起施用。
[0279]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf而无rfviii的单次输注。在一些实施方案中,rvwf的第二次施用不与fviii一起施用。在一些实施方案中,rvwf的第三次施用与fviii一起施用。
[0280]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf而无rfviii的单次输注。在一些实施方案中,rvwf的第二次施用与fviii一起施用。在一些实施方案中,rvwf的第三次施用不与fviii一起施用。
[0281]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf的第一次输注和第二次输注。在一些实施方案中,rvwf的第一次和/或第二次输注与fviii一起施用。
[0282]
在一些实施方案中,向有自发性出血发作风险的患有vwd的受试者施用rvwf的第一次输注、第二次输注和第三次输注。在一些实施方案中,rvwf的第一次、第二次和/或第三次输注与fviii一起施用。
[0283]
在所述方法的一些实施方案中,当rvwf和fviii一起施用时,rvwf与fviii的比率为约1.5:0.8。在所述方法的一些实施方案中,当rvwf和fviii一起施用时,rvwf与fviii的比率为约1.3:1。在所述方法的一些实施方案中,当rvwf和fviii一起施用时,rvwf与fviii的比率为约1.1:0.8。在所述方法的一些实施方案中,当rvwf和fviii一起施用时,rvwf与fviii的比率为约1.5:1。在所述方法的一些实施方案中,当rvwf和fviii一起施用时,rvwf与fviii的比率为约1.1:1.2。
[0284]
在一些实施方案中,施用约40iu/kg rvwf的rvwf用于自发性出血的预防。在一些实施方案中,施用约45iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约50iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约55iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约60iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约65iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约70iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约75iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约80iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约40iu/kg
‑
80iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约50iu/kg
‑
80iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约40iu/kg
‑
70iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约50iu/kg
‑
80iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约40iu/kg
‑
60iu/kg的rvwf用于自发性出血的预防。在一些实施方案中,施用约50iu/kg
‑
80iu/kg的rvwf用于自发性出血的预防。
[0285]
在一些实施方案中,40
‑
80iu/kg rvwf的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,50
‑
80iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,40iu/kg rvwf的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,45iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,55iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,
60iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,65iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,70iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,75iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。在一些实施方案中,80iu/kg的rvwf每周施用两次,用于自发性出血的预防性治疗。
[0286]
在一些实施方案中,40
‑
80iu/kg rvwf的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,50
‑
80iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,40iu/kg rvwf的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,45iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,55iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,60iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,65iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,70iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,75iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,80iu/kg的rvwf每周施用三次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf至少每72小时施用一次,用于自发性出血的预防性治疗。
[0287]
在一些实施方案中,40
‑
80iu/kg rvwf的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50
‑
80iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,40iu/kg rvwf的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,45iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,55iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,60iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,65iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,70iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,75iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,80iu/kg的rvwf每2或3天施用一次,用于自发性出血的预防性治疗。
[0288]
在一些实施方案中,40
‑
80iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50
‑
80iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,40iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,45iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,55iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,60iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,65iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,70iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,75iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,80iu/kg的rvwf每3或4天施用一次,用于自发性出血的预防性治疗。
[0289]
在一些实施方案中,40
‑
80iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50
‑
80iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,40iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,45iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,50iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,55iu/kg rvwf的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,60iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,65iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,70iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,75iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,80iu/kg的rvwf在7天(一周)周期的第1天和第5天、第2天和第6天或第3天和第7天施用一次,用于自发性出血的预防性治疗。
[0290]
在一些实施方案中,受试者接受自发性出血的预防性治疗至少一个月。在一些实施方案中,受试者接受自发性出血的预防性治疗至少6个月。在一些实施方案中,受试者接受自发性出血的预防性治疗至少1年。在一些实施方案中,受试者接受自发性出血的预防性治疗至少2年。在一些实施方案中,受试者接受自发性出血的预防性治疗至少5年。在一些实施方案中,受试者接受自发性出血的预防性治疗至少10年。
[0291]
在一些实施方案中,向患有严重vwd的受试者施用周剂量的rvwf,用于自发性出血发作的预防性治疗。在一些实施方案中,向受试者施用基本上等同于周剂量的血浆来源vwf(pdvwf)的周剂量的rvwf,用于自发性出血的预防。在一些实施方案中,向受试者施用功能上等同于周剂量的血浆来源vwf(pdvwf)的周剂量的rvwf,用于自发性出血的预防。在一些实施方案中,向受试者施用比血浆来源vwf(pdvwf)的周剂量少约10%的周剂量的rvwf,用于自发性出血的预防。在一些实施方案中,向受试者施用比血浆来源vwf(pdvwf)的周剂量多10%的周剂量的rvwf,用于自发性出血的预防。
[0292]
在一些实施方案中,周剂量的rvwf以至少两个单独剂量或至少2次输注施用。在一些实施方案中,每周向受试者提供至少两个剂量。在一些实施方案中,周剂量的rvwf以2次输注施用。在一些实施方案中,周剂量的rvwf以2次静脉内输注施用。在一些情况下,向受试者施用每周两次剂量的rvwf,或者换句话说,每周向受试者施用两次rvwf。在一些实施方案中,周剂量的rvwf以2次静脉内输注施用。在一些实施方案中,rvwf每周向受试者施用两次。在一些实施方案中,rvwf每3或4天向受试者施用一次。在一些实施方案中,在7天周期内,施用rvwf的第一次输注并且4天后施用rvwf的第二次输注。在一些实施方案中,rvwf在7天(一周)周期的第1天和第5天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,向受试者施用分为两次输注的周剂量,使得受试者在一周周期的第1天接受第一次输注并在
第5天接受第二次输注。在一些实施方案中,rvwf在一周周期的第2天和第6天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,向受试者施用分为两次输注的周剂量,使得受试者在一周周期的第2天接受第一次输注并在第6天接受第二次输注。在一些实施方案中,rvwf在一周周期的第3天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,向受试者施用分为两次输注的周剂量,使得受试者在一周周期的第3天接受第一次输注并在第7天接受第二次输注。在一些实施方案中,周剂量的rvwf对于每次输注至多达80iu/kg rvwf。在一些实施方案中,周剂量的rvwf被分为对于每次输注至多达80iu/kg rvwf的2次静脉内输注。
[0293]
在一些实施方案中,周剂量的rvwf以至少3个单独剂量或至少3次输注施用。在一些实施方案中,每周向受试者提供至少3个剂量。在一些实施方案中,周剂量的rvwf以3次静脉内输注施用。在一些情况下,向受试者施用每周三次剂量的rvwf,或者换句话说,每周向受试者施用三次rvwf。在一些实施方案中,rvwf每周向受试者施用三次。在一些实施方案中,周剂量的rvwf以3次静脉内输注施用,使得每次输注在不同日子施用。在一些实施方案中,rvwf每2或3天向受试者施用一次。在一些实施方案中,在7天周期内,施用rvwf的第一次输注,2天后施用rvwf的第二次输注并且3天后施用rvwf的第三次输注。在一些实施方案中,rvwf在7天周期的第1天、第3天和第6天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,向受试者施用分为3次输注的周剂量,使得受试者在一周周期的第1天接受第一次输注、在第3天接受第二次输注、在第6天接受第三次输注。在一些实施方案中,rvwf在一周周期的第1天、第3天和第6天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,向受试者施用分为3次输注的周剂量,使得受试者在一周周期的第2天接受第一次输注、在第4天接受第二次输注、在第7天接受第三次输注。在一些实施方案中,rvwf在一周周期的第2天、第4天和第7天施用一次,用于自发性出血的预防性治疗。在一些实施方案中,周剂量的rvwf对于每次输注至多达80iu/kg rvwf。在一些实施方案中,周剂量的rvwf被分为对于每次输注至多达80iu/kg rvwf的3次静脉内输注。
[0294]
在一些实施方案中,周剂量的rvwf以单个剂量或单次输注施用。在一些实施方案中,周剂量的rvwf以单次输注施用。在一些实施方案中,周剂量的rvwf以单次静脉内输注施用。在一些实施方案中,如果受试者先前已接受每周一次剂量的pdvwf,则向受试者施用每周一次剂量的rvwf。在一些实施方案中,此类输注的周剂量的rvwf为至多达80iu/kg rvwf。
[0295]
在一些实施方案中,在接受本文所述的预防性治疗后,受试者经历了自发性出血事件的年出血率(abr)的至少5%减少(例如5%、7%、10%、12%、14%、15%、17%、20%、22%、24%、25%、27%、30%、32%、34%、35%、37%、40%、42%、44%、45%、47%、50%或更多的减少)。在一些实施方案中,在接受预防性治疗后,受试者经历了自发性出血事件的abr的至少25%减少(例如25%、27%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或更多的减少)。在一些实施方案中,自发性出血发作次数的减少由年出血率(abr)的降低来指示。在一些实施方案中,治疗前abr基于以下公式确定:出血次数/不在治疗方案上的天数。在一些实施方案中,治疗前abr基于以下公式确定:出血次数/rvwf预防性治疗前的12个月。在一些实施方案中,预防性abr(预防性治疗后的abr)基于以下公式确定:出血次数/治疗方案的天数。
[0296]
在一些实施方案中,受试者在rvwf预防性治疗的疗程期间没有经历自发性出血事
件。在一些实施方案中,受试者在rvwf预防性治疗的疗程期间经历了1
‑
2次自发性出血事件。在一些实施方案中,受试者在rvwf预防性治疗的疗程期间经历了1
‑
3次自发性出血事件。在一些实施方案中,受试者在rvwf预防性治疗的疗程期间经历了3
‑
5次自发性出血事件。在一些实施方案中,受试者在rvwf预防性治疗的疗程期间经历了1
‑
5次自发性出血事件。在一些实施方案中,受试者在rvwf预防性治疗期间经历了超过5次自发性出血事件。
[0297]
在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年0次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年1次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年2次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年3次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年4次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年5次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年超过5次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年1
‑
5次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年3
‑
5次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年1
‑
3次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年少于5次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年少于4次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年少于3次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年少于2次。在一些实施方案中,rvwf的施用将自发性出血事件的次数减少至每年少于1次。
[0298]
在一些实施方案中,预防性治疗降低或减少自发性出血发作的严重程度(例如,轻度、中度和重度出血发作)、发生率、频率或持续时间。在一些实施方案中,与未接受预防性治疗的对照受试者相比,施用rvwf的受试者具有更少的自发性出血发作。在一些实施方案中,与开始治疗前相比,在治疗的疗程内施用rvwf的受试者具有更少的自发性出血发作。
[0299]
一般来讲,1型vwd由<30iu/dl vwf:rco、<30iu/dl vwf:ag、低或正常fviii以及>0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。在一些实施方案中,被诊断为1型vwd的受试者具有<20iu/dl vwf:rco。2a型vwd由<30iu/dl vwf:rco、<30
‑
200iu/dl vwf:ag、低或正常fviii以及<0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。2b型vwd由<30
‑
200iu/dl vwf:rco、<30iu/dl vwf:ag、低或正常fviii以及通常<0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。2m型vwd由<30iu/dl vwf:rco、<30
‑
200iu/dl vwf:ag、低或正常fviii以及<0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。2n型vwd由30
‑
2000iu/dl vwf:rco、30
‑
200iu/dl vwf:ag、极低fviii以及>0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。3型vwd由<3iu/dl vwf:rco、<3iu/dl vwf:ag、极低(<10iu/dl)fviii以及vwf:rco/vwf:ag比率不适用来指示。在一些实施方案中,被诊断为3型vwd的受试者具有<3iu/dl vwf:ag。正常由50
‑
200iu/dl vwf:rco、50
‑
200iu/dl vwf:ag、正常fviii以及>0.5
‑
0.7iu/dl vwf:rco/vwf:ag比率来指示。在一些实施方案中,受试者患有3型vwd。在一些实施方案中,受试者患有严重1型vwd。在一些实施方案中,受试者患有严重2型vwd。在一些实施方案中,受试者患有严重2a型vwd。在一些实施方案中,受试者患有严重2b型vwd。在一些实施方案中,受试者患有严重2m型vwd。在一些实施方案中,受试者患有严重3型vwd。
[0300]
在一些实施方案中,在患有1型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指
示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有1型vwd的受试者中的水平。在一些实施方案中,在患有严重1型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有严重1型vwd的受试者中的水平。在一些实施方案中,在患有2a型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有2a型vwd的受试者中的水平。在一些实施方案中,在患有严重2a型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有严重2a型vwd的受试者中的水平。在一些实施方案中,在患有2m型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有2m型vwd的受试者中的水平。在一些实施方案中,在患有严重2m型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有严重2m型vwd的受试者中的水平。在一些实施方案中,在患有2n型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有2n型vwd的受试者中的水平。在一些实施方案中,在患有严重2n型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有严重2n型vwd的受试者中的水平。在一些实施方案中,在患有3型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有3型vwd的受试者中的水平。在一些实施方案中,在患有严重3型vwd的患者中,预防性治疗功效由相比于rvwf预防性治疗前的水平,rvwf预防性治疗后的fviii、vwf:rco和/或vwf:ag活性水平的改善来指示。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有严重3型vwd的受试者中的水平。在一些实施方案中,fviii、vwf:rco和/或vwf:ag活性水平的改善包括活性水平的变化,由此使得活性水平更接近正常水平,例如未患有任何形式vwd的受试者中的水平。
[0301]
在一些实施方案中,受试者已接受vwd的诊断。在一些情况下,vwd诊断通过基因检
测、多聚体分析、患者病史或其组合来确认。
[0302]
在一些实施方案中,受试者在先前12个月内治疗了至少1次自发性出血事件。在一些实施方案中,受试者在先前12个月内治疗了超过1次自发性出血事件。在一些实施方案中,受试者在先前12个月内治疗了至少3次自发性出血事件。在一些实施方案中,受试者在先前12个月内治疗了3次或更多次自发性出血事件。
[0303]
在一些实施方案中,受试者目前正接受针对自发性出血事件(例如,发作)的按需治疗。在一些实施方案中,受试者目前正接受vwf疗法(例如,rvwf或pdvwf疗法)以治疗自发性出血事件。在一些实施方案中,受试者目前未接受针对自发性出血事件(例如,发作)的按需治疗。在一些实施方案中,受试者目前未接受vwf疗法(例如,rvwf或pdvwf疗法)以治疗自发性出血事件。
[0304]
在一些实施方案中,受试者在先前12个月内通过施用pdvwf预防性治疗了自发性出血。在一些实施方案中,受试者在先前12个月通过施用pdvwf预防性治疗了自发性出血。在一些实施方案中,受试者在至少先前12个月通过施用pdvwf预防性治疗了自发性出血。在一些实施方案中,受试者未在先前12个月内通过施用pdvwf预防性治疗自发性出血。在一些实施方案中,受试者未在先前12个月通过施用pdvwf预防性治疗自发性出血。在一些实施方案中,受试者未在至少先前12个月通过施用pdvwf预防性治疗自发性出血。
[0305]
一般来讲,小出血的特征在于急性或亚急性临床明显出血,其不满足大出血标准并导致因出血住院、由医师指导的因出血的药物或手术治疗或因出血的抗血栓疗法(包括研究药物)改变(aristotle临床定义);所有其他出血(大出血和ich除外)(re
‑
ly临床定义);不符合大出血标准但需要医疗干预、不定期与医师联系(拜访或电话)、暂时中断研究药物(即,延迟给药)、疼痛或日常活动障碍的明显出血(rocket
‑
af临床定义);临床相关出血,被定义为皮肤血肿>25cm2、自发性鼻出血>5分钟持续时间、肉眼血尿、自发性直肠出血、牙龈出血>5分钟、任何导致住院的出血、任何导致输血<2u的出血或研究者认为相关的任何其他出血(petro临床定义);和/或crnm(临床相关非大出血),被定义为急性或亚急性、临床明显、非大出血并导致因出血住院、由医师指导的因出血的药物或手术治疗或抗血栓疗法改变,以及小出血事件,被定义为不符合大出血或crnm出血标准的急性临床明显事件(aristotle
‑
j临床定义)。参见,例如,wells g,coyle d,cameron c,等人safety,effectiveness,and cost
‑
effectiveness of new oral anticoagulants compared with warfarin in preventing stroke and other cardiovascular events in patients with atrial fibrillation[internet].ottawa(on):canadian agency for drugs and technologies in health;2012apr 9.3,clinical review。可在万维网www.ncbi.nlm.nih.gov/books/nbk169813/上获得。小出血可包括被定义为不满足大出血或临床显著出血标准的事件;来自伤口的小出血(注射部位出血、鼻衄或不需要手术减压的伤口血肿);不符合大出血标准并与以下≥1项相关的明显出血:鼻衄持续超过5分钟或需要干预、瘀斑或血肿在其最大尺寸处>5厘米、与导尿管相关创伤无关的血尿、与ng管的插管或放置无关的gi出血、伤口血肿或并发症、需要停止用药的结膜下出血;gi或泌尿道小出血和注射部位血肿;和/或不符合大出血标准的明显出血。参见,例如,sobieraj dm,coleman ci,tongbram v,等人venous thromboembolism prophylaxis in orthopedic surgery[internet].rockville(md):agency for healthcare research and quality(us);
publishing co.,easton,pa.18042页数1435
‑
1712,其公开内容出于所有目的且特别是出于涉及药物产品的制剂、施用途径和剂量的所有教义,特此以引用的方式整体并入。此类制剂影响所施用剂的物理状态、稳定性、体内释放速率和体内清除速率。取决于施用途径,合适的剂量根据体重、体表面积或器官大小计算。可通过使用用于测定血液水平剂量的已确立测定结合适当的剂量
‑
反应数据来确定适当的剂量。最终给药方案由主治医师考虑会改变药物作用的各种因素来确定,所述各种因素例如药物的比活性、患者的损伤严重程度和反应性、患者的年龄、状况、体重、性别和饮食、任何感染的严重程度、施用时间和其他临床因素。以举例的方式,本发明的重组vwf的典型剂量为大约50iu/kg,等于500μg/kg。在进行研究时,将出现关于针对各种疾病和病况的适当剂量水平和治疗持续时间的另外信息。
[0309]
除非另外指明,否则本发明的实践可以采用本领域的技术范围内的有机化学、聚合物技术、分子生物学(包括重组技术)、细胞生物学、生物化学和免疫学的常规技术和描述。此类常规技术包括聚合物阵列合成、杂交、连接和使用标记的杂交检测。合适技术的具体说明可以参考本文以下实施例。不过,当然也可以使用其他等效常规工序。此类常规技术和描述可以在以下标准实验室手册中发现,诸如genome analysis:a laboratory manual series(vols.i
‑
iv);using antibodies:a laboratory manual;cells:a laboratory manual;pcr primer:a laboratory manual和molecular cloning:a laboratory manual(均来自cold spring harbor laboratory press);stryer,l.(1995)biochemistry(第4版)freeman,highly stabilized york,gait;“oligonucleotide synthesis:a practical approach”1984,irl press,london,nelson and cox(2000);lehninger,principles of biochemistry第3版w.h.freeman pub.,highly stabilized york,n.y.和berg等人(2002)biochemistry,第5版,w.h.freeman pub.,highly stabilized york,n.y.,其均出于所有目的以引用的方式整体并入本文。
[0310]
应注意,除非上下文另外明确指出,否则如本文和所附权利要求书中所用,单数形式“一个”、“一种”和“所述”包括多个指代物。因此,例如,提到“一个抗体”包括多个此类抗体并且提到“一种宿主细胞”包括提到一种或多种宿主细胞及其本领域技术人员已知的等同物等。还应注意,权利要求可拟订成排除任何任选的要素。因此,该陈述旨在充当结合权利要求要素的叙述来使用诸如“仅仅”、“只有”等排他性术语或使用“否定”限制的前置基础。
[0311]
除非另外定义,否则本文所用的所有技术和科学术语都具有与本发明所属领域中普通技术人员通常所理解的相同的含义。出于描述和公开描述于公布中并且可能与目前所描述的发明结合使用的装置、组合物、制剂以及方法学的目的,本文所提及的所有公布均以引用的方式并入本文。
[0312]
如果提供一个范围的值,那么应理解除非上下文另外清楚地规定,否则本发明内涵盖所述范围的上限与下限之间的每个居中值(至下限单位的十分之一)和在所陈述的范围中的任何其他陈述值或居中值。本发明内还涵盖这些更小范围的上限和下限可以独立地包括于更小范围内,受所陈述的范围中任何具体排除的限值所限。当所陈述的范围包括一个或两个限值时,排除那些所包括的限值之一或两者的范围也包括在本发明内。
[0313]
在以上描述中,阐述了大量具体细节以便提供对本发明的更详尽的理解。然而,本领域技术人员将清楚,可以在没有这些具体细节中的一个或多个具体细节的情况下实践本
发明。在其他情况下,为了避免混淆本发明,未对本领域技术人员所众所周知的众所周知的特征和程序进行描述。
[0314]
虽然主要参照具体实施方案描述本发明,但还预想在阅读本公开后其他实施方案对于本领域技术人员将是清楚的,并且意图这类实施方案包含于本发明的方法内。
[0315]
实施例
[0316]
实施例1:重组血管性血友病因子(vwf)预防在严重血管性血友病(vwd)中的功效和安全性:一项前瞻性、3期、开放标签、国际多中心研究的设计
[0317]
引言
[0318]
血管性血友病(vwd)患者由于血管性血友病因子(vwf)的数量或质量缺陷而止血功能受损,所述血管性血友病因子是一种大的多聚体血浆糖蛋白,其具有介导血小板聚集和稳定循环中的血凝因子viii(fviii)的关键止血功能(1
‑
3)。大多数vwd患者出现轻度至中度粘膜出血和创伤或手术后出血,但也可能发生危及生命的出血,特别是在患有严重疾病的患者中(1,2)。
[0319]
重组vwf(rvwf,vonicog alfa,veyvondi
tm
;baxalta innovations gmbh,a takeda company,vienna,austria)是在不添加外源人或动物来源的蛋白质的情况下通过重组dna技术在中国仓鼠卵巢细胞系中制造的(4)。vwf包含全vwf多聚体概况,包括暴露于adamts13(vwf切割蛋白)的血浆来源vwf(pdvwf)浓缩物中通常缺乏的超大多聚体(5
‑
7)。
[0320]
患有严重vwd的患者可受益于预防性rvwf治疗以维持vwf和fviii水平,使得自发性出血发作(be)(包括关节积血、鼻衄和消化道出血)的风险降低(8
‑
13)。
[0321]
降低be的频率和持续时间可能会减少对红细胞输血的需要,并降低包括关节病的使人衰弱的合并症的风险(8,9)。
[0322]
研究目标
[0323]
研究的目标是考察rvwf长期预防性治疗在患有严重vwd的患者中的功效和安全性。
[0324]
研究设计
[0325]
本文所述的是一项全球性、多中心、开放标签、3期研究(nct02973087,eudract no.:2016
‑
001478
‑
14),用以前瞻性地评估rvwf连续预防性治疗在患有严重vwd的成年患者(基线vwf瑞斯托霉素辅因子活性[vwf:rco]<20iu/dl)中的功效、安全性和药代动力学,所述患者需要pdvwf疗法来控制招募前一年的be(图1)。
[0326]
根据研究招募之前接受的vwf方案的类型,患者归属于第1个或第2个队列:按需治疗(按需队列)和使用pdvwf产品的预防性治疗(转换队列)。两个队列中的患者均接受1年的预防性rvwf治疗。
[0327]
患者
[0328]
被诊断为患有严重vwd的18岁的患者≥(基线vwf:rco<20iu/dl),需要vwf治疗以控制出血(关键研究资格标准在图2中详述)。该研究方案由相关地方伦理委员会批准并且所有患者都将在招募前提供书面知情同意书。
[0329]
研究治疗
[0330]
患者如下所述接受rvwf预防。
[0331]
对于按需队列,通过静脉输注施用50
±
10iu/kg rvwf:rco的标准预防剂量。剂量
可增至多达80iu/kg。
[0332]
所有患者均以每周两次的给药开始(图3,方案a)。
[0333]
对于转换队列,等同于
±
先前接受的每周pdvwf剂量的10%的每周rvwf剂量被分为每次输注最大剂量为80iu/kg的2次静脉输注(图3,方案a)。根据临床判断,周剂量以3次输注给予(图3,方案b);只有在患者之前接受过每周一次的pdvwf给药时,才允许每周一次的给药。
[0334]
rvwf剂量可以基于药代动力学数据、be病史以及临床和实验室评估结果在指定范围内进一步个体化。经历需要vwf治疗的be的患者将接受rvwf来治疗出血。按重量调整的给药应基于be的类型和严重程度以及适当的临床和实验室指标。如果临床上指示fviii水平立即升高,则应施用重组fviii(抗血友病因子[recombinant][advate;baxalta us inc.,a takeda company,lexington,ma])。
[0335]
在研究期间需要择期手术或牙科手术的患者用rvwf治疗以控制手术出血,并且然后恢复其预防性rvwf治疗方案。手术前,如果fviii活性(fviii:c)水平处于推荐的目标水平:≥小手术或口腔手术0.4iu/ml并且≥大手术0.8iu/ml,则施用rvwf而无重组fviii。
[0336]
研究结果指标和统计分析
[0337]
主要的研究结果指标列于图4(表3)。
[0338]
统计分析包括大约22名患者,包括至少5名患有3型vwd的患者以及每个研究队列中至少8名患者;没有进行正式的样本量计算。
[0339]
对所有已接受预防性rvwf治疗的患者进行主要功效分析。将对每个研究队列(按需队列或转换队列)使用负二项回归来估计自发性abr。预研究与在研究自发性abr的比较基于转换队列中的患者。评估将使用广义线性混合效应模型。每个研究队列的abr比率被报告为双侧95%置信区间。
[0340]
研究状态与结论
[0341]
研究招募现已完成。
[0342]
这项前瞻性的3期研究的结果提供了关于rvwf用于预防患有严重vwd的患者的自发性出血的功效和安全性的数据。
[0343]
预防性rvwf治疗的研究周期为1年,并且主要功效结果指标是自发性(非创伤性)出血的abr。
[0344]
主要结果指标
[0345]
前瞻性地记录(rvwf)预防性治疗期间自发性(与创伤无关)出血发作的年出血率(abr)和按需治疗期间参与者的自发性出血发作的历史abr(时间范围:大约1年)。
[0346]
修订的次要结果指标
[0347]
相对于按需治疗期间参与者自身历史abr,预防期间自发性(与创伤无关)出血发作的年出血率(abr)降低的参与者的数量(时间范围:大约1年)。
[0348]
重组血管性血友病因子(rvwf)预防性治疗期间出血零次的参与者的数量(时间范围:大约1年)。
[0349]
预防性治疗期间以及按需治疗期间每月重组血管性血友病因子(rvwf)和advate的输注次数(时间范围:大约1年)。
[0350]
预防性治疗期间以及按需治疗期间每年重组血管性血友病因子(rvwf)和advate
的输注次数(时间范围:大约1年)。
[0351]
预防性治疗期间以及按需治疗期间每月重组血管性血友病因子(rvwf)和advate的按重量调整的总消耗量(时间范围:大约1年)。
[0352]
预防性治疗期间以及按需治疗期间每年重组血管性血友病因子(rvwf)和advate的按重量调整的总消耗量(时间范围:大约1年)。
[0353]
血栓栓塞事件的发生率(时间范围:大约22个月的整个研究周期)。
[0354]
严重过敏反应的发生率(时间范围:大约22个月的整个研究周期)。
[0355]
发展出重组血管性血友病因子(rvwf)和因子viii(fviii)的中和抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0356]
发展出重组血管性血友病因子(rvwf)和因子viii(fviii)的总结合抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0357]
发展出中国仓鼠卵巢(cho)蛋白质、小鼠免疫球蛋白g(igg)和重组弗林蛋白酶(rfurin)的抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0358]
药代动力学
‑
增量恢复(ir)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0359]
药代动力学
‑
终末半衰期(t1/2)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0360]
药代动力学
‑
平均滞留时间(mrt)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0361]
药代动力学
‑
曲线下面积/剂量(auc/剂量)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0362]
药代动力学
‑
一阶矩曲线下面积/剂量(aumc/剂量)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0363]
药代动力学
‑
稳态分布容积(vss)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0364]
药代动力学
‑
清除率(cl)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0365]
每次自发性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的输注次数(时间范围:至多达大约22个月的整个研究周期)。
[0366]
每次创伤性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的输注次数(时间范围:至多达大约22个月的整个研究周期)。
[0367]
每次自发性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的按重量调整的消耗量(时间范围:至多达大约22个月的整个研究周期)。
[0368]
每次创伤性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的按重量调整的消耗量(时间范围:至多达大约22个月的整个研究周期)。
[0369]
出血消退时的总体止血功效评级(时间范围:至多达大约22个月的整个研究周期)。使用4级量表:优、良、中、无。
[0370]
术中实际失血量对预测失血量
‑
如果需要手术(时间范围:第0天(手术完成时))。由手术外科医生在手术完成时评估。
[0371]
术中止血功效
‑
如果需要手术(时间范围:第0天(手术完成时))。按优、良、中或无的量表评分
‑
由手术外科医生在手术完成时评估。
[0372]
对于择期手术:在最后一次围手术期输注rvwf后的24小时与第7天和第14天进行止血功效的总体评估(时间范围:最后一次围手术期输注rvwf后的24小时与第7天和第14天)。按优、良、中或无的量表评分。
[0373]
术中和术后每日按体重调整的剂量(时间范围:第0天(手术日)至术后第14天)。术中和术后每日按体重调整的有或无advate的rvwf的剂量。
[0374]
原始次要结果指标
[0375]
相对于按需治疗期间参与者自身历史abr,预防期间自发性(与创伤无关)出血发作的年出血率(abr)降低的参与者的数量(时间范围:大约1年)。
[0376]
重组血管性血友病因子(rvwf)预防性治疗期间出血零次的参与者的数量(时间范围:大约1年)。
[0377]
按需治疗期间每月重组血管性血友病因子(rvwf)和advate的输注次数(时间范围:大约1年)。
[0378]
按需治疗期间每年重组血管性血友病因子(rvwf)和advate的输注次数(时间范围:大约1年)。
[0379]
按需治疗期间每月重组血管性血友病因子(rvwf)和advate的按重量调整的总消耗量(时间范围:大约1年)。
[0380]
按需治疗期间每年重组血管性血友病因子(rvwf)和advate的按重量调整的总消耗量(时间范围:大约1年)。
[0381]
血栓栓塞事件的发生率(时间范围:大约22个月的整个研究周期)。
[0382]
严重过敏反应的发生率(时间范围:大约22个月的整个研究周期)。
[0383]
发展出重组血管性血友病因子(rvwf)和因子viii(fviii)的中和抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0384]
发展出重组血管性血友病因子(rvwf)和因子viii(fviii)的总结合抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0385]
发展出中国仓鼠卵巢(cho)蛋白质、小鼠免疫球蛋白g(igg)和重组弗林蛋白酶的抗体的参与者的数量(时间范围:大约22个月的整个研究周期)。
[0386]
药代动力学
‑
增量恢复(ir)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0387]
药代动力学
‑
终末半衰期(t1/2)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0388]
药代动力学
‑
平均滞留时间(mrt)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0389]
药代动力学
‑
曲线下面积/剂量(auc/剂量)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0390]
药代动力学
‑
一阶矩曲线下面积/剂量(aumc/剂量)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0391]
药代动力学
‑
稳态分布容积(vss)(时间范围:输注前30分钟;和输注后30分钟以及
1、6、12、24、48和72小时)。
[0392]
药代动力学
‑
清除率(cl)(时间范围:输注前30分钟;和输注后30分钟以及1、6、12、24、48和72小时)。
[0393]
每次自发性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的输注次数(时间范围:至多达大约22个月的整个研究周期)。
[0394]
每次创伤性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的输注次数(时间范围:至多达大约22个月的整个研究周期)。
[0395]
每次自发性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的按重量调整的消耗量(时间范围:至多达大约22个月的整个研究周期)。
[0396]
每次创伤性出血发作(be)重组血管性血友病因子(rvwf)和advate(rfviii)的按重量调整的消耗量(时间范围:至多达大约22个月的整个研究周期)。
[0397]
出血消退时的总体止血功效评级(时间范围:至多达大约22个月的整个研究周期)。使用4级量表:优、良、中、无。
[0398]
参考文献
[0399]
1.nichols wl,et al.,haemophilia 2008;14:171
‑
232.
[0400]
2.leebeek fw,eikenboom jc.n engl j med 2016;375:2067
‑
80.
[0401]
3.reininger aj.hamostaseologie 2015;35:225
‑
33.
[0402]
4.european medicines agency.veyvondi summary of product characteristics.https://www.ema,europa,ed/documents/product
‑
information/veyvondi
‑
ep ar
‑
product
‑
information_en.pdf.
[0403]
5.mannucci pm et al.,blood 1994;83:3018
‑
27.
[0404]
6.turecek pl et al.,hamostaseologie 2009;20(suppl 1):s32
‑
8.
[0405]
7.favaloro ej.,blood transfus.2016;14:262
‑
76.
[0406]
8.abshire t.,thromb res 2009;124(suppl 1):s15
‑
9.
[0407]
9.berntorp e.,haemophilia 2008;14(suppl 5):47
‑
53.
[0408]
10.berntorp e.,petrini p.,blood coagul fibrinolysis 2005;16(suppl 1):s23
‑
6.
[0409]
11.berntorp e.,semin thromb hemost 2006;32:621
‑
5.
[0410]
12.abshire tc,et al.,haemophilia 2013;19:76
‑
81.
[0411]
13.abshire t et al.,j thromb haemost 2015;13:1585
‑
9.
[0412]
尽管本文已示出和描述了本发明的示例性实施方案,但对于本领域技术人员来说将显而易见的是,此类实施方案仅作为实例提供。在不脱离本发明的情况下,本领域技术人员现将会想到众多的变动、改变和替代。应当理解的是,可以在实践本发明时采用在本文中描述的本发明的实施方案的各种替代方案。所意图的是,以下权利要求限定本发明的范围以及由此涵盖这些权利要求及其等同物范围内的方法和结构。
[0413]
提供上文列出的实施例来为本领域普通技术人员提供如何制造并使用本发明的组合物、系统和方法的实施方案,而不旨在限制发明人就其发明所认为的范围。对本领域技术人员而言明显的关于上述用于进行本发明的模式的修改处于以下权利要求的范围内。本说明书中提到的所有专利和公布都指示本发明所属领域技术人员的技术水平。本公开中引
用的所有参考文献都以引用的方式并入本文中,引用的程度如同将各参考文献独立地以引用的方式整体并入本文中。
[0414]
所有标题和章节名称仅出于清楚和参考目的而使用,并且不应被视为以任何方式进行限制。例如,本领域技术人员将理解根据本文所述的本发明的精神和范围适当地将来自不同标题和章节的各个方面进行组合的有用性。
[0415]
本文所引用的所有参考文献特此均以引用的方式整体并入本文,并且出于所有的目的,所述引用的程度就好像具体地和单独地出于所有的目的将各个公布或专利或专利申请以引用的方式整体并入。
[0416]
在不脱离本技术的精神和范围的情况下,可以对本技术进行许多修改和变动,这对于本领域技术人员来说是显而易见的。本文所述的特定实施方案和实施例仅以举例的方式提供,并且本技术仅受所附权利要求的条款以及权利要求所赋予的等同物的全部范围的限制。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。