用于治疗尿路上皮癌的fgfr酪氨酸激酶抑制剂
技术领域
1.本文披露了用含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品治疗尿路上皮癌的方法。本文还披露了销售或许诺销售含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品的方法。
背景技术:
2.遗传异常的鉴定对于为癌症患者选择一种或多种适当的疗法可能是有用的。这对于主要治疗选择(一线治疗)失败的癌症患者而言也是有用的,特别地是在没有针对二线或后续线治疗的可接受的标准护理的情况下。成纤维细胞生长因子受体(fgfr)属于受体酪氨酸激酶家族,参与调节细胞存活、增殖、迁移和分化。在一些癌症中已经观察到包括fgfr突变和fgfr融合或者易位在内的fgfr改变。迄今为止,尚无经批准的对具有fgfr改变的患者有效的用fgfr抑制剂的疗法。
技术实现要素:
3.本文描述了治疗尿路上皮癌的方法,这些方法包括以下、由以下组成或基本上由以下组成:向患有尿路上皮癌的患者以一定量施用含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,该量为所述药物产品的药物产品标签中描述的量。在某些实施例中,尿路上皮癌是局部晚期或转移性的。在另外的实施例中,如通过客观缓解率或缓解持续时间所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在一些实施例中,fgfr抑制剂的施用未导致超过3级的不良事件。
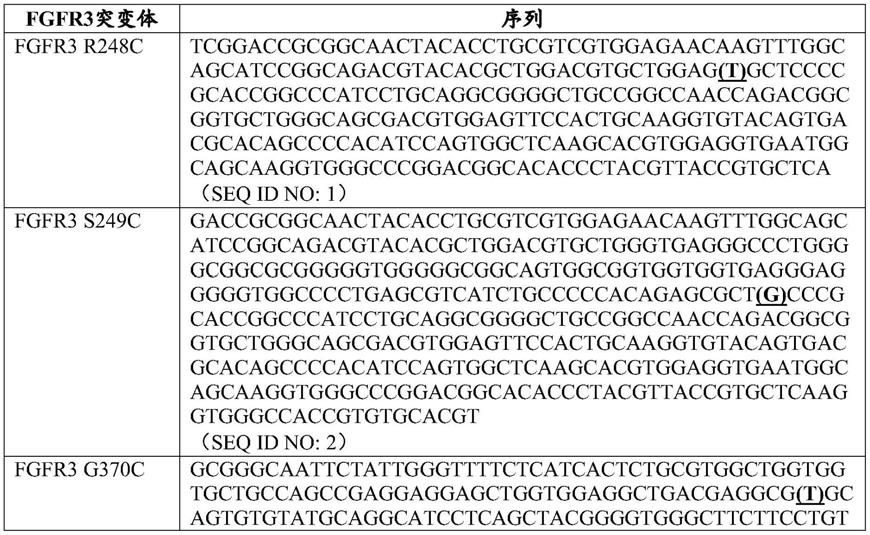
4.在另外的实施例中,尿路上皮癌对fgfr2遗传改变或fgfr3遗传改变易感。在某些实施例中,fgfr2或fgfr3遗传改变是fgfr3基因突变,或fgfr2或fgfr3基因融合。在一些实施例中,fgfr3基因突变是r248c、s249c、g370c、y373c、或其任何组合。在另外的实施例中,fgfr2或fgfr3基因融合是fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、或其任何组合。
5.本文还描述了治疗尿路上皮癌的方法,这些方法进一步包括以下、由以下组成或基本上由以下组成:在施用fgfr抑制剂前,评估来自患者的生物样品中是否存在一种或多种fgfr2或fgfr3遗传改变,特别是如本文所述的fgfr2或fgfr3遗传改变。在某些实施例中,生物样品是血液、淋巴液、骨髓、实体瘤样品或其任何组合。
6.在另外的实施例中,患者接受了用于治疗尿路上皮癌的至少一种先前疗法。在一些实施例中,用于治疗尿路上皮癌的至少一种先前疗法是含铂化学疗法。在某些实施例中,尿路上皮癌在含铂化学疗法的至少一线期间或之后有进展。在另外的实施例中,含铂化学疗法是新辅助的含铂化学疗法或辅助的含铂化学疗法。在仍另外的实施例中,尿路上皮癌在至少一线的该新辅助的含铂化学疗法或辅助的含铂化学疗法期间或之后的12个月内有进展。
7.在一些实施例中,fgfr抑制剂是厄达替尼。在另外的实施例中,每天、特别是每天一次施用厄达替尼。在仍另外的实施例中,将厄达替尼口服施用。在某些实施例中,将厄达替尼以连续每天给药方案口服施用。在一些实施例中,将厄达替尼以每天一次约8mg的剂量口服施用。在一些实施例中,将厄达替尼以连续每天给药方案以每天一次约8mg的剂量口服施用。在另外的实施例中,在开始治疗后的14至21天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg,前提是:(a)该患者在开始治疗后的14至21天展示出的血清磷酸盐(po4)水平小于约5.5mg/dl;和(b)以每天一次8mg施用厄达替尼未导致眼部障碍;或(c)以每天一次8mg施用厄达替尼未导致2级或更严重的不良反应。在某些实施例中,厄达替尼以固体剂型存在。在另外的实施例中,固体剂型是片剂。
8.在仍另外的实施例中,厄达替尼不与以下项共施用:(a)强cyp2c9抑制剂或cyp3a4抑制剂药物;(b)强cyp2c9诱导剂或cyp3a4诱导剂药物;(c)中度cyp2c9诱导剂或cyp3a4诱导剂药物;或(d)血清磷酸盐水平变更剂药物。在某些实施例中,厄达替尼不与以下项共施用:(a)cyp3a4底物药物;(b)oct2底物药物;或(c)p
‑
糖蛋白(p
‑
gp)底物药物。
9.本文还描述了治疗患者的尿路上皮癌的方法,这些方法包括以下、由以下组成或基本上由以下组成:(a)评估来自该患者的生物样品中是否存在一种或多种成纤维细胞生长因子受体(fgfr)基因改变;和(b)如果该样品中存在一种或多种fgfr基因改变,用一定量的含有fgfr抑制剂的批准的药物产品治疗该患者,该量为所述药物产品的药物产品标签中描述的量。
10.本文还提供了销售批准的药物产品的方法,该批准的药物产品包含厄达替尼、由厄达替尼组成、或基本上由厄达替尼组成,所述方法包括销售此类药物产品、由销售此类药物产品组成、或基本上由销售此类药物产品组成,其中此类药物产品的参比制剂(reference listed drug)的药物产品标签包括用于治疗尿路上皮癌的说明书。在某些实施例中,药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
11.本文进一步提供了许诺销售包含厄达替尼的批准的药物产品的方法,所述方法包括许诺销售此类药物产品、由许诺销售此类药物产品组成、或基本上由许诺销售此类药物产品组成,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。在某些实施例中,药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
12.本文还描述了包括销售包含厄达替尼的批准的药物产品、由其组成或基本上由其组成的方法,其中此类药物产品的参比制剂的药物产品标签包含客观缓解率或缓解持续时间数据。在某些实施例中,厄达替尼的客观缓解率数据为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。
13.本文仍进一步提供了在患有尿路上皮癌的患者中改善客观缓解率或缓解持续时间的方法,所述方法包括以下、由以下组成或基本上由以下组成:向所述患者施用包含厄达替尼的批准的药物产品。在某些实施例中,客观缓解率为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,缓解持续时间为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在仍另外的实施例中,批准的药物产品是anda药物产品或补充新药申请药物产品。
14.本文还提供了在患有尿路上皮癌的患者中改善客观缓解率或缓解持续时间的方法,所述方法包括以下、由以下组成或基本上由以下组成:向所述患者提供包含厄达替尼的批准的药物产品。在某些实施例中,客观缓解率为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,缓解持续时间为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,批准的药物产品是anda药物产品或补充新药申请药物产品。在另外的实施例中,此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。
15.本文进一步提供了批准的药物产品,其具有至少一种批准的适应症,其中所述批准的药物产品包含厄达替尼。在某些实施例中,批准的药物产品是nda药物产品、anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。在另外的实施例中,批准的药物产品的参比制剂产品包括药物产品标签。在仍另外的实施例中,药物产品标签包含客观缓解率数据。在一些实施例中,厄达替尼的客观缓解率数据为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,药物产品标签包含缓解持续时间数据。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。
16.本文进一步提供了用于治疗患有局部晚期或转移性尿路上皮癌的成年患者的包含厄达替尼的批准的药物产品,该局部晚期或转移性尿路上皮癌(a)对fgfr3或fgfr2遗传
改变易感,以及(b)在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展。
附图说明
17.当结合附图阅读时,将进一步理解本发明内容以及以下的具体实施方式。出于说明所披露的方法的目的,附图显示了方法的示例性实施例;然而,方法不限于所披露的具体实施例。在这些附图中:
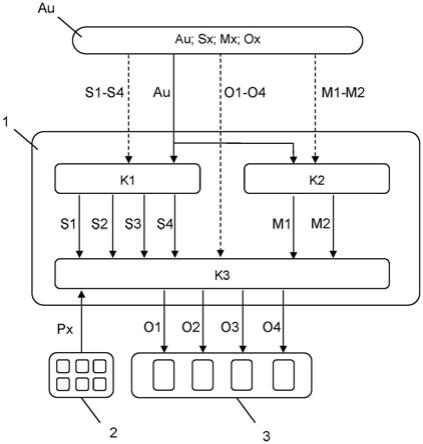
18.图1表示2期多中心开放标签研究来评估厄达替尼在患有携带选择的fgfr(成纤维细胞生长因子受体)遗传改变(fgfr易位或突变)的转移性或不可手术切除的尿路上皮癌的受试者中的功效和安全性的研究方案。
19.图2示出了患者对用8mg/天连续厄达替尼治疗(方案3)的响应:患者亚群中的客观缓解率(orr)。
20.图3(包含图3a至3c)示出了用厄达替尼治疗后靶病灶直径总和的减少的瀑布图。在所有患者中,用8mg/天连续厄达替尼治疗(方案3)的患者(图3a)、用10mg间歇厄达替尼治疗(方案1)的患者(图3b)、和用6mg/天连续厄达替尼治疗(方案2)的患者(图3c)的减少。
21.图4是用8mg/天连续厄达替尼治疗的所有患者对厄达替尼治疗的响应的泳道图。根据研究人员评估的响应
22.图5(包含图5a和5b)描绘了用8mg/天连续厄达替尼治疗(方案3)的患者的无进展生存期和总生存期。用8mg连续厄达替尼治疗后,无进展生存期(图5a)和总生存期(图5b)的卡普兰
‑
迈耶曲线(kaplan
‑
meier curve)。
23.图6(包含图6a和6b)描绘了用10mg/天间歇厄达替尼和用6mg/天连续厄达替尼治疗的患者的总生存期。用10mg/天间歇厄达替尼治疗(方案1)(图6a)和用6mg/天连续厄达替尼治疗(方案2)(图6b)后总生存期的卡普兰
‑
迈耶曲线。
具体实施方式
24.应认识到,为了清晰,在单独实施例的上下文中,本文描述的本发明的某些特征也可以被组合地提供在单一实施例中。即,除非明显不兼容或被明确排除,否则认为每个单独的实施例可与任何其他的一个或多个实施例组合,并且认为此种组合是另一个实施例。相反,为了简洁而在单独的实施例的上下文中描述的本发明的各种特征也可以分开或以任何亚组合形式提供。最后,尽管实施例可以被描述为一系列步骤的一部分或更普遍结构的一部分,但是可以认为每个所述步骤其本身,与其他组合的也是独立实施例。
25.特定术语
26.过渡术语“包含”、“基本上由
……
组成”和“由
……
组成”旨在暗示它们在专利白话中通常被接受的含义,即,(i)“包含(comprising)”同义于“包括(including)”、“含有(containing)”或“以
……
为特征的”是包括性的或是开放式的,并且不排除另外的未列举的要素或方法步骤;(ii)“由
……
组成”不包括未在权利要求中指定的任何要素、步骤或成分;和(iii)“基本上由
……
组成”将权利要求的范围限制为要求保护的发明的指定材料或步骤“以及不对一种或多种基本和新颖特征产生实质性影响的那些”。更特别地,基本和新颖特征涉及该方法提供本文所述的益处中至少一种的能力,包括但不限于,提高人群生存
能力(相对于在本文其他地方描述的可比较人群的生存能力)的能力。作为实施例,用短语“包含”(或其等效物)描述的实施例还提供了用“由
……
组成”和“基本上由
……
组成”独立描述的那些。
27.当通过使用描述符“约”将值表示为近似值时,应当理解,该具体值形成了另一实施例。通常,术语“约”的使用指示可根据试图通过所披露的主题获得的所希望特性而变化的近似值,并应基于其功能在使用术语的特定上下文中进行解释。本领域技术人员能够按常规对此进行解释。在一些情况下,用于具体值的有效数字的数量可以是确定词语“约”的程度的一种非限制性方法。在其他情况下,在一系列值中使用的等级可用于确定对针对每个值的术语“约”的有效的预期范围。在存在的情况下,所有范围均包括端值在内并且是可组合的。即,对范围中陈述的值的提及包括此范围内的每个值。
28.如果没有另外说明,那么术语“约”表示相关值
±
10%的变化,但是另外的实施例包括变化可以为
±
5%、
±
15%、
±
20%、
±
25%、或
±
50%的那些。
29.当呈现列表时,除非另有说明,否则应当理解,该列表的每个单独元素以及该列表的每个组合是单独的实施例。例如,呈现为“a、b、或c”的实施例的列表应解释为包括实施例“a”、“b”、“c”、“a或b”、“a或c”、“b或c”或“a、b、或c”。
30.如本文所用的,单数形式“一个/一种(a、an)”和“该/所述(the)”包括复数形式。
31.以下缩写用于整个披露中:fgfr(成纤维细胞生长因子受体);fgfr3
‑
tacc3 v1(编码fgfr3和转化酸性含卷曲螺旋蛋白质3变体1的基因之间的融合);fgfr3
‑
tacc3_v3(编码fgfr3和转化酸性含卷曲螺旋蛋白质3变体3的基因之间的融合);fgfr3
‑
baiap2l1(编码fgfr3和脑特异性血管生成抑制剂1相关蛋白质2样蛋白质1的基因之间的融合);fgfr2
‑
bicc1(编码fgfr2和双尾c同源物1的基因之间的融合);fgfr2
‑
casp7(编码fgfr2和半胱天冬酶7的基因之间的融合)。
32.如本文所用的,“患者”旨在意指任何动物,特别是哺乳动物。因此,这些方法适用于人和非人动物,尽管最优选人。术语“患者”和“受试者”和“人”可以互换使用。
33.术语“治疗(treat和treatment)”是指对患有病理病症的患者的治疗,并且是指通过杀死癌细胞来减轻该病症的作用,但也指导致抑制该病症进展(包括进展速率的降低、进展速率的中止、病症的改善和病症的治愈)的作用。还包括作为预防措施的治疗(即预防)。
34.如本文所用的,术语“癌症”是指细胞的异常生长,其倾向于以不受控制的方式增殖,并且在一些情况下转移(扩散)。
35.如本文所用的,术语“共施用”等旨在涵盖将所选择的治疗剂施用至单个患者,并且意欲包括其中药剂通过相同或不同的施用途径或在相同或不同时间的施用的治疗方案。
36.如本文所用的,术语“药物组合”意指由多于一种活性成分的混合或组合所产生的产品,并且包括活性成分的固定和非固定组合两者。术语“固定组合”意指将活性成分,例如厄达替尼和共药剂两者以单一单位或单一剂型的形式同时施用至患者。术语“非固定组合”意指活性成分(例如厄达替尼和共药剂)作为分开的单位或分开的剂型同时地、并行地或顺序地施用至患者(没有特定的间隔时间限制),其中这种施用在人体内提供安全且有效水平的两种活性成分。后者也适用于混合物疗法,例如三种或更多种活性成分的施用。
37.术语“连续每天给药方案”是指特定治疗剂的无任何药物假期的特定治疗剂的施用。在一些实施例中,特定治疗剂的连续每天给药方案包含每天在大约每天的相同时间施
用特定治疗剂。
38.术语“无进展生存期”被定义为从首次给药至疾病进展或死亡(以先到者为准)的书面证据日期的时间。
39.术语“缓解持续时间”被定义为从缓解的初始记录日期至疾病进展或死亡的书面证据日期的时间。
40.术语“总生存期”被定义为从首次给药至死亡日期的时间。将存活或具有未知状态的患者的数据在已知该患者存活的最后日期删失。
41.如本文所用的,术语“安慰剂”意指施用不包括fgfr抑制剂的药物组合物。
42.术语“随机化”当指的是临床试验时,是指当患者被确认符合临床试验资格并被分配到治疗组的时间。
43.术语“试剂盒”和“制品”用作同义词。
[0044]“生物样品”是指患者的任何样品,其中可获取癌细胞且能够检测fgfr遗传改变。合适的生物样品包括但不限于血液、淋巴液、骨髓、实体瘤样品或其任何组合。在一些实施例中,生物样品可以是福尔马林固定、石蜡包埋的组织(ffpet)。
[0045]
fgfr遗传改变
[0046]
本文披露了治疗尿路上皮癌的方法,该方法包括向患有尿路上皮癌的患者以一定量施用含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,该量为所述药物产品的药物产品标签中描述的量。
[0047]
蛋白酪氨酸激酶(ptk)受体的成纤维细胞生长因子(fgf)家族调节多种生理功能,包括有丝分裂发生、创伤愈合、细胞分化和血管生成,以及发育。正常细胞和恶性细胞的生长以及增殖都受到fgf(充当自分泌因子以及旁分泌因子的细胞外信号传导分子)的局部浓度的变化的影响。自分泌fgf信号传导在类固醇激素依赖性癌症进展为激素非依赖性状态的过程中可能特别重要。fgf及其受体在若干种组织和细胞系中以增加的水平表达,并且过表达被认为是造成恶性表型的原因。此外,许多癌基因是编码生长因子受体的基因的同源物,并且在人类胰腺癌中存在fgf依赖性信号传导的异常活化的可能(knights等人,pharmacology and therapeutics[药理学与治疗学]2010 125:1(105
‑
117);korc m.等人current cancer drug targets[目前癌症药物靶标]2009 9:5(639
‑
651))。
[0048]
两种原型成员是酸性成纤维细胞生长因子(afgf或fgf1)和碱性成纤维细胞生长因子(bfgf或fgf2),并且迄今为止,已鉴定了至少二十个不同的fgf家族成员。对fgf的细胞响应通过编号为1至4(fgfr1至fgfr4)的四种类型的高亲和力跨膜蛋白酪氨酸激酶成纤维细胞生长因子受体(fgfr)进行传递。
[0049]
在某些实施例中,尿路上皮癌对fgfr2遗传改变或fgfr3遗传改变易感。
[0050]
如本文所用的,“fgfr遗传改变”指野生型fgfr基因的改变,包括但不限于fgfr融合基因、fgfr突变、fgfr扩增或其任何组合。术语“变体”和“改变”在本文中可互换使用。
[0051]
在某些实施例中,fgfr2或fgfr3遗传改变是fgfr基因融合。“fgfr融合”或“fgfr基因融合”是指编码fgfr(例如,fgrf2或fgfr3)的一部分、和本文披露的融合配偶体中的一种或其一部分的基因,该基因通过两个基因之间的易位产生。术语“融合”和“易位”在本文中可互换使用。可以使用所披露的方法或用途确定来自患者的生物样品中是否存在以下fgfr融合基因中的一种或多种:fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、或
其任何组合。在某些实施例中,fgfr3
‑
tacc3是fgfr3
‑
tacc3变体1(fgfr3
‑
tacc3 v1)或fgfr3
‑
tacc3变体3(fgfr3
‑
tacc3 v3)。表1提供了fgfr融合基因以及融合的fgfr和融合配偶体外显子。表4中披露了单个fgfr融合基因的序列。
[0052]
表1
[0053]
融合基因fgfr外显子配偶体外显子fgfr2
ꢀꢀ
fgfr2
‑
bicc1193fgfr2
‑
casp7194fgfr3
ꢀꢀ
fgfr3
‑
baiap2l1182fgfr3
‑
tacc3 v11811fgfr3
‑
tacc3 v31810
[0054]
fgfr遗传改变包括fgfr单核苷酸多态性(snp)。“fgfr单核苷酸多态性”(snp)是指fgfr2或fgfr3基因,其中单个核苷酸在个体之间不同。在某些实施例中,fgfr2或fgfr3遗传改变是fgfr3基因突变。特别地,fgfr单核苷酸多态性”(snp)是指fgfr3基因,其中单个核苷酸在个体之间不同。来自患者的生物样品中一种或多种以下fgfr snp的存在可以通过本领域普通技术人员已知的方法或wo 2016/048833中披露的方法确定:fgfr3 r248c、fgfr3 s249c、fgfr3 g370c、fgfr3 y373c、或其任何组合。表2中提供了fgfr snp的序列。
[0055]
表2
[0056]
[0057][0058]
序列对应于fgfr3的核苷酸920
‑
1510(genebank id#nm_000142.4)。
[0059]
粗体下划线的核苷酸表示snp。
[0060]
*在文献中有时误称为y375c。
[0061]
如本文所用的,“fgfr遗传改变基因检测组套(gene panel)”包括一种或多种以上列出的fgfr遗传改变。在一些实施例中,fgfr遗传改变基因检测组套取决于患者的癌症类型。
[0062]
披露方法的评估步骤中使用的fgfr遗传改变基因检测组套部分基于患者的癌症类型。对于患有尿路上皮癌的患者,合适的fgfr遗传改变基因检测组套可以包含fgfr3
‑
tacc3 vl、fgfr3
‑
tacc3 v3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、fgfr3 r248c、fgfr3 s249c、fgfr3 g370c、或fgfr3 y373c、或其任何组合。
[0063]
用于在本披露的方法或用途中使用的fgfr抑制剂
[0064]
本文提供了用于在本披露的方法中使用的合适的fgfr抑制剂。
[0065]
在一些实施例中,如果样品中存在一个或多个fgfr遗传改变,可使用美国公开号2013/0072457a1(通过引用并入本文)中披露的fgfr抑制剂(包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐、或其溶剂化物(合适的r基团也在美国公开号2013/0072457a1中披露))来治疗尿路上皮癌患者。
[0066]
在一些方面,例如,该患者可用n
‑
(3,5
‑
二甲氧基苯基)
‑
n'
‑
(1
‑
甲基乙基)
‑
n
‑
[3
‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹喔啉
‑6‑
基]乙烷
‑
1,2
‑
二胺(本文称为“jnj
‑
42756493”或“jnj493”或厄达替尼)(包括其任何互变异构形式、其n
‑
氧化物、其药学上可接受的盐或其溶剂化物)治疗。在一些实施例中,fgfr抑制剂可以是具有式(i)的化合物:
[0067][0068]
或其药学上可接受的盐。在一些方面,药学上可接受的盐是hcl盐。在优选的方面,使用厄达替尼碱。
[0069]
在一些实施例中,尿路上皮癌患者可以用fgfr抑制剂治疗,其中该fgfr抑制剂是如gavine,p.r.等人,azd4547:an orally bioavailable,potent,and selective inhibitor of the fibroblast growth factor receptor tyrosine kinase family[azd4547:成纤维细胞生长因子受体酪氨酸激酶家族的口服生物可利用的、强效和选择性抑制剂],cancer res.[癌症研究]2012年4月15日72;2045中所述的n
‑
[5
‑
[2
‑
(3,5
‑
二甲氧基苯基)乙基]
‑
2h
‑
吡唑
‑3‑
基]
‑4‑
(3,5
‑
二甲基哌嗪
‑1‑
基)苯甲酰胺(azd4547):
[0070][0071]
当化学上可能时,包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐或其溶剂化物。
[0072]
在一些实施例中,尿路上皮癌患者可以用fgfr抑制剂治疗,其中该fgfr抑制剂是如国际公开号wo 2006/000420中所述的3
‑
(2,6
‑
二氯
‑
3,5
‑
二甲氧基
‑
苯基)
‑
l
‑
{6
‑
[4
‑
(4乙基
‑
哌嗪
‑
l
‑
基)
‑
苯基氨基]
‑
嘧啶
‑4‑
基}
‑
甲基
‑
尿素(nvp
‑
bgj398):
[0073][0074]
当化学上可能时,包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐或其溶剂化物。
[0075]
在一些实施例中,尿路上皮癌患者可以用fgfr抑制剂治疗,其中该fgfr抑制剂是如国际公开号wo 2006/127926中所述的4
‑
氨基
‑5‑
氟
‑3‑
[6
‑
(4
‑
甲基哌嗪
‑
l
‑
基)
‑
lh
‑
苯并咪唑
‑2‑
基]
‑
lh
‑
喹啉
‑2‑
酮(多韦替尼(dovitinib)):
[0076][0077]
当化学上可能时,包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐或其溶剂化物。
[0078]
在一些实施例中,尿路上皮癌患者可以用fgfr抑制剂治疗,其中该fgfr抑制剂是如bello,e.等人,e
‑
3810is a potent dual inhibitor of vegfr and fgfr that exerts antitumor activity in multiple preclinical models[e
‑
3810是vegfr和fgfr的强效双重抑制剂,可在多种临床前模型中发挥抗肿瘤活性],cancer res[癌症研究]2011年2月15日71(a)1396
‑
1405和国际公开号wo 2008/112408中所述的6
‑
(7
‑
((l
‑
氨基环丙基)
‑
甲氧基)
‑6‑
甲氧基喹啉
‑4‑
基氧基)
‑
n
‑
甲基
‑1‑
萘甲酰胺(al3810)(德立替尼(lucitanib);e
‑
3810):
[0079][0080]
当化学上可能时,包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐或其溶剂化物。
[0081]
另外合适的fgfr抑制剂包括bay1163877(拜耳公司(bayer))、bay1179470(拜耳公司)、tas
‑
120(大宝公司(taiho))、arq087(阿库利(arqule))、asp5878(安斯泰来公司(astellas))、ff284(中外制药株式会社(chugai))、fp
‑
1039(gsk/fiveprime)、blueprint、ly
‑
2874455(美国礼来公司(lilly))、rg
‑
7444(罗氏公司(roche))、或其任何组合(当化学上可能时,包括其任何互变异构或立体化学异构形式、以及其n
‑
氧化物、其药学上可接受的盐或其溶剂化物)。
[0082]
在实施例中,将通常地fgfr抑制剂,以及特别地厄达替尼作为药学上可接受的盐施用。在优选的实施例中,将通常地fgfr抑制剂,以及更特别地厄达替尼以碱形式施用。在实施例中,将通常地fgfr抑制剂,以及特别地厄达替尼以相当于8mg碱当量或相当于9mg碱当量的量作为药学上可接受的盐施用。在实施例中,将通常地fgfr抑制剂,以及更特别地厄达替尼以8mg或9mg的量以碱形式施用。
[0083]
这些盐可通过例如使通常地fgfr抑制剂,以及更特别地厄达替尼与适当的酸在适当的溶剂中反应来制备。
[0084]
酸加成盐可以与酸(无机酸和有机酸两者)形成。酸加成盐的实例包括与选自下组的酸形成的盐,该组由以下组成:乙酸、盐酸、氢碘酸、磷酸、硝酸、硫酸、柠檬酸、乳酸、琥珀酸、马来酸、苹果酸、羟乙磺酸、富马酸、苯磺酸、甲苯磺酸、甲磺酸(methanesulphonic acid,mesylate)、乙磺酸、萘磺酸、戊酸、乙酸、丙酸、丁酸、丙二酸、葡糖醛酸和乳糖酸。酸加成盐的另一个组包括从以下酸形成的盐:乙酸、己二酸、抗坏血酸、天冬氨酸、柠檬酸、dl
‑
乳酸、富马酸、葡糖酸、葡糖醛酸、马尿酸、盐酸、谷氨酸、dl
‑
苹果酸、甲磺酸、癸二酸、硬脂酸、琥珀酸和酒石酸。
[0085]
在实施例中,将通常地fgfr抑制剂,以及更特别地厄达替尼以溶剂化物的形式施
用。如本文所用的,术语“溶剂化物”是指厄达替尼与一种或多种溶剂分子的物理缔合。这种物理缔合涉及不同程度的离子和共价键合,包括氢键键合。在某些情况下,溶剂化物能够分离(例如当一种或多种溶剂分子掺入结晶固体的晶格中时)。术语“溶剂化物”旨在涵盖溶液相和可分离的溶剂化物这两者。可以形成溶剂化物的溶剂的非限制性实例包括水、异丙醇、乙醇、甲醇、dmso、乙酸乙酯、乙酸或乙醇胺等。
[0086]
溶剂化物在药物化学中是熟知的。它们对于制备物质的过程(例如关于它们的纯化)、物质的储存(例如其稳定性)和物质处理的容易性是重要的,并且通常作为化学合成的分离或纯化阶段的一部分形成。本领域技术人员可以借助于标准的和长期使用的技术确定水合物或其他溶剂化物是否已经通过用于制备给定化合物的分离条件或纯化条件而形成。此类技术的实例包括热重量分析(tga)、差示扫描量热法(dsc)、x射线结晶学(例如单晶x射线结晶学或x射线粉末衍射)和固态nmr(ss
‑
nmr,也称为魔角旋转nmr或mas
‑
nmr)。此类技术与nmr、ir、hplc和ms一样,是熟练的化学家的标准分析工具包的一部分。可替代地,技术人员可以使用结晶条件有意地形成溶剂化物,这些结晶条件包括特定溶剂化物所需的一定量的溶剂。此后,上述标准方法可以用于确定溶剂化物是否已形成。还涵盖任何复合物(例如与如环糊精的化合物的包合复合物或笼形包合物、或与金属的复合物)。
[0087]
此外,化合物可具有一种或多种多晶型(结晶)或无定形形式。
[0088]
这些化合物包括具有一个或多个同位素取代的化合物,并且对具体元素的提及包括在其范围内所述元素的所有同位素。例如,对氢的提及包括在其范围内的1h、2h(d)、和3h(t)。类似地,对碳和氧的提及分别包括在其范围内的
12
c、
13
c和
14
c以及
16
o和
18
o。这些同位素可以是放射性的或非放射性的。在一个实施例中,化合物不含放射性同位素。此类化合物对于治疗用途是优选的。然而,在另一个实施例中,化合物可以含有一种或多种放射性同位素。含有此类放射性同位素的化合物在诊断的上下文中可以是有用的。
[0089]
治疗方法/化合物使用方法
[0090]
本文描述了治疗尿路上皮癌的方法,该方法包括向患有尿路上皮癌的患者以一定量施用含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,该量为所述药物产品的药物产品标签中描述的量。
[0091]
本文还描述了含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,其用于在治疗患者的尿路上皮癌中使用,其中将该批准药物产品以所述药物产品的药物产品标签中描述的量施用。
[0092]
本文还描述了含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品在制造用于治疗患者的尿路上皮癌的药物中的用途,其中将该药物以所述药物产品的药物产品标签中描述的量施用。
[0093]
在某些实施例中,尿路上皮癌是局部晚期或转移性的。在某些实施例中,患者是高风险患者,特别是患有转移性或不可手术切除的尿路上皮癌的高风险患者,特别是携带选择的fgfr遗传改变(fgfr易位或突变)的转移性或不可手术切除的尿路上皮癌,特别是如本文所定义的fgfr遗传改变。高风险患者是满足以下一个或多个标准的患者:年龄≥75岁;ecog ps 2;血红蛋白<10g/dl;内脏转移,特别是肝、肺和/或骨的转移;以及2个或3个贝尔蒙特风险因素。在一个实施例中,所述血红蛋白水平是在全血中测量的。
[0094]
在某些实施例中,如通过客观缓解率、无进展生存期、缓解持续时间、或总生存期
所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过客观缓解率或缓解持续时间所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过客观缓解率所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过完全客观缓解率所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过部分客观缓解率所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过部分客观缓解率和完全客观缓解率所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过无进展生存期所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过缓解持续时间所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。在某些实施例中,如通过总生存期所测量的,fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。
[0095]
在某些实施例中,抗肿瘤活性的改善是相对于安慰剂治疗。在某些实施例中,抗肿瘤活性的改善是相对于无治疗。在某些实施例中,抗肿瘤活性的改善是相对于标准护理。
[0096]
为评估客观缓解率或未来进展,有必要估计基线处的总肿瘤负荷并且将其用作随后测量的比较物。可测量的疾病定义为存在至少一个可测量病灶。
[0097]
在一些实施例中,以安全且有效量施用fgfr抑制剂未导致超过2级的不良事件。在其他实施例中,以安全且有效量施用fgfr抑制剂未导致超过3级的不良事件。在一些实施例中,以安全且有效量施用fgfr抑制剂未导致超过4级的不良事件。
[0098]
本文还描述了方法、批准的药物产品、和用途,进一步包括在施用fgfr抑制剂前,评估来自患者的生物样品中是否存在一种或多种fgfr2或fgfr3遗传改变。在某些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3基因突变,或fgfr2或fgfr3基因融合。在某些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3基因突变。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3 r248c、fgfr3 s249c、fgfr3 g370c、fgfr3 y373c、或其任何组合。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3 r248c。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3s249c。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3 g370c。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3 y373c。
[0099]
在某些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr2基因融合或fgfr3基因融合。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、或其任何组合。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3
‑
tacc3。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr3
‑
baiap2l1。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr2
‑
bicc1。在一些实施例中,本文披露的方法、批准的药物产品、和用途进一步包括评估来自患者的生物样品中是否存在fgfr2
‑
casp7。
[0100]
本文进一步提供了用于治疗患有局部晚期或转移性尿路上皮癌的成年患者的包含厄达替尼的批准的药物产品,该局部晚期或转移性尿路上皮癌(a)对fgfr3或fgfr2遗传改变易感,以及(b)在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展。
[0101]
评估样品中是否存在一种或多种fgfr遗传改变
[0102]
本文还提供了治疗患者的尿路上皮癌的方法,这些方法包括:(a)评估来自该患者的生物样品中是否存在一种或多种成纤维细胞生长因子受体(fgfr)基因改变;和(b)如果该样品中存在一种或多种fgfr基因改变,用一定量的含有fgfr抑制剂的批准的药物产品治疗该患者,该量为所述药物产品的药物产品标签中描述的量。
[0103]
本文还描述了含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,其用于在治疗患者的尿路上皮癌中使用,其中将该批准药物产品以所述药物产品的药物产品标签中描述的量施用,并且其中评估来自该患者的生物样品中是否存在一种或多种fgfr基因改变。
[0104]
本文还描述了含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品在制造用于治疗患者的尿路上皮癌的药物中的用途,其中将该药物以所述药物产品的药物产品标签中描述的量施用,并且其中评估来自该患者的生物样品中是否存在一种或多种fgfr基因改变。
[0105]
用于评估生物样品中是否存在一种或多种fgfr遗传改变的以下方法同样适用于任何以上披露的治疗方法和用途。
[0106]
如果来自患者的生物样品中存在一种或多种fgfr遗传改变,则披露的方法适用于治疗患者的癌症。在一些实施例中,fgfr遗传改变可以是一种或多种fgfr融合基因。在一些实施例中,fgfr遗传改变可以是一种或多种fgfr突变。在一些实施例中,fgfr遗传改变可以是一种或多种fgfr扩增。在一些实施例中,一种或多种fgfr遗传改变的组合可以存在于来自患者的生物样品中。例如,在一些实施例中,这些fgfr遗传改变可以是一种或多种fgfr融合基因和一种或多种fgfr突变。在一些实施例中,这些fgfr遗传改变可以是一种或多种fgfr融合基因和一种或多种fgfr扩增。在一些实施例中,这些fgfr遗传改变可以是一种或多种fgfr突变和一种或多种fgfr扩增。在又其他的实施例中,这些fgfr遗传改变可以是一种或多种fgfr融合基因、突变、和扩增。表1中提供了示例性fgfr融合基因,并且其包括但不限于:fgfr2
‑
bicc1;fgfr2
‑
casp7;fgfr3
‑
baiap2l1;fgfr3
‑
tacc3 v1;fgfr3
‑
tacc3 v3;或其组合。
[0107]
本文的方法部分和wo 2016/048833(以其全文并入本文)中描述了用于评估生物样品中是否存在一种或多种fgfr遗传改变的合适方法。例如并且不旨在进行限制,评估生
物样品中是否存在一种或多种fgfr遗传改变可以包括以下步骤的任何组合:从生物样品中分离rna;从rna合成cdna;并且扩增cdna(预扩增的或未预扩增的)。在一些实施例中,评估生物样品中是否存在一种或多种fgfr遗传改变可以包括:用一对结合并扩增一种或多种fgfr遗传改变的引物来扩增患者的cdna;并且确定样品中是否存在一种或多种fgfr遗传改变。在一些方面,cdna可以是预扩增的。在一些方面,评估步骤可以包括从样品中分离rna、从分离的rna合成cdna、以及预扩增cdna。
[0108]
用于进行扩增步骤的合适引物对包括但不限于wo 2016/048833中披露的那些,示例如下:
[0109]
表3
[0110][0111][0112]
可以在任何合适的时间点(包括在诊断时、肿瘤切除后、一线治疗后、临床治疗期间或其任何组合)评估一种或多种fgfr遗传改变的存在。
[0113]
例如,可以分析取自患者的生物样品,以确定患者患有或可能患有的病症或疾病(诸如癌症)是否是以遗传异常或异常蛋白质表达为特征的病症或疾病,该遗传异常或异常蛋白质表达导致fgfr的水平或活性的上调,或导致对正常fgfr活性的途径的敏化,或导致这些生长因子信号传导途径(诸如生长因子配体水平或生长因子配体活性)的上调,或导致fgfr活化的下游的生物化学途径的上调。
[0114]
导致fgfr信号的活化或敏化的这类异常的实例包括凋亡途径的丧失或抑制、受体或配体的上调,或者受体或配体的遗传改变(例如ptk变体)的存在。具有fgfr1、fgfr2或fgfr3或fgfr4遗传改变或fgfr1的上调(特别是过表达)、或fgfr2或fgfr3的功能获得性遗传改变的肿瘤对fgfr抑制剂可以是特别敏感的。
[0115]
这些方法、批准的药物产品和用途可进一步包括在施用步骤之前评估生物样品中一种或多种fgfr遗传改变的存在。
[0116]
诊断测试和筛选通常对选自肿瘤活检样品、血样(脱落肿瘤细胞的分离与富集)、粪便活检、痰、染色体分析、胸膜液、腹膜液、口腔粘膜涂片、活检、循环dna或尿的生物样品进行。在某些实施例中,生物样品是血液、淋巴液、骨髓、实体瘤样品或其任何组合。在某些实施例中,生物样品是实体瘤样品。
[0117]
鉴定和分析蛋白质的遗传改变和上调的方法是本领域技术人员已知的。筛选方法可以包括但不限于:标准方法诸如逆转录酶聚合酶链反应(rt pcr),或原位杂交诸如荧光原位杂交(fish)。
[0118]
携带fgfr中的遗传改变,特别是如本文所述的fgfr遗传改变的个体的鉴定可能意味着该患者将特别适合用厄达替尼治疗。在治疗前可以优先筛选肿瘤中是否存在fgfr变体。筛选过程将典型地涉及直接测序、寡核苷酸微阵列分析或突变特异性抗体。此外,对具有此类遗传改变的肿瘤的诊断可以使用本领域技术人员已知的技术和如本文所述的技术(诸如rt
‑
pcr和fish)来进行。
[0119]
此外,例如fgfr的遗传改变可以通过使用pcr对例如肿瘤活检直接测序和如上文所述对pcr产物直接测序的方法来鉴定。本领域技术人员将认识到,用于检测上述蛋白质的过表达、活化或突变的所有此类熟知的技术都可以适用于本案例。
[0120]
在通过rt
‑
pcr的筛选中,在由pcr进行cdna扩增后,通过创建mrna的cdna拷贝来评定肿瘤中mrna的水平。pcr扩增方法、引物的选择和扩增条件是本领域技术人员已知的。核酸操作和pcr通过标准方法进行,如例如ausubel,f.m.等人编辑(2004)current protocols in molecular biology[分子生物学实验室指南],john wiley&sons inc.[约翰威利父子出版公司],或innis,m.a.等人编辑(1990)pcr protocols:a guide to methods and applications[pcr方案:方法和应用指南],academic press,san diego[圣地亚哥学术出版社]中所述。涉及核酸技术的反应和操作还描述于sambrook等人,(2001),第3版,molecular cloning:a laboratory manual[分子克隆:实验室手册],cold spring harbor laboratory press[冷泉港实验室出版社]中。替代性地,可以使用可商购获得的rt
‑
pcr试剂盒(例如罗氏分子生物化学公司(roche molecular biochemicals)),或如在美国专利4,666,828;4,683,202;4,801,531;5,192,659、5,272,057、5,882,864和6,218,529中列出并且通过引用并入本文的方法。用于评定mrna表达的原位杂交技术的一个实例是荧光原位杂交(fish)(参见angerer(1987)meth.enzymol.[酶学方法],152:649)。
[0121]
通常,原位杂交包括以下主要步骤:(1)固定待分析的组织;(2)对样品进行预杂交处理,以增加靶核酸的可接近性,并减少非特异性结合;(3)使核酸混合物与生物结构或组织中的核酸杂交;(4)杂交后洗涤,以除去未在杂交中结合的核酸片段,以及(5)检测杂交的核酸片段。在此类应用中使用的探针一般例如用放射性同位素或荧光报道分子进行标记。优选的探针是足够长的,例如,约50、100或200个核苷酸至约1000个或更多个核苷酸,以能够在严格条件下与一种或多种靶核酸特异性杂交。用于进行fish的标准方法描述于:ausubel,f.m.等人编辑(2004)current protocols in molecular biology[现行分子生物学方案],john wiley&sons inc[约翰
·
威利父子公司];和由john m.s.bartlett编辑的fluorescence in situ hybridization:technical overview[荧光原位杂交技术概述],在molecular diagnosis of cancer,methods and protocols[癌症的分子诊断、方法和方案],第2版中;isbn:1
‑
59259
‑
760
‑
2,2004年3月,第077
‑
088页,丛书:methods in molecular medicine[分子医学方法]中。
[0122]
(deprimo等人,(2003),bmc cancer[bmc癌症],3:3)描述了用于基因表达谱分析的方法。简言之,该方案如下:使用(dt)24寡聚物(seq id no:38:tttttttttt tttttttttt tttt)由总rna合成双链cdna,首先启动第一链cdna合成,接着用随机六聚物引物进行第二链cdna合成。将双链cdna用作模板,用于使用生物素酰化的核糖核苷酸进行crna的体外转录。根据昂飞公司(affymetrix)(美国加利福尼亚州圣克拉拉(santa clara,ca,usa))描述的方案将crna进行化学片段化,然后在人类基因组阵列上杂交过夜。
[0123]
替代性地,从mrna表达的蛋白产物可以通过肿瘤样品的免疫组织化学、用微量滴定板的固相免疫测定、蛋白质印迹、2维sds
‑
聚丙烯酰胺凝胶电泳、elisa、流式细胞术和本领域已知的用于检测具体蛋白质的其他方法进行测定。检测方法将包括使用位点特异性抗体。技术人员将认识到,用于检测fgfr和/或vegfr的上调,或检测fgfr和/或vegfr变体或突变体的所有此类众所周知的技术可适用于本案例。
[0124]
蛋白质(诸如fgfr)的异常水平可以使用标准酶测定(例如本文所述的那些测定)来测量。还可以在组织样品(例如肿瘤组织)中检测到活化或过表达。通过用一种测定诸如来自佳美工国际公司(chemicon international)的测定来测量酪氨酸激酶活性。将从样品裂解物中免疫沉淀出感兴趣的酪氨酸激酶,并测量其活性。
[0125]
用于测量fgfr(包括其同种型)的过表达或活化的替代性方法包括测量微血管密度。这可以例如使用由orre和rogers描述的方法(int j cancer[国际癌症杂志](1999),84(2)101
‑
8)来测量。测定方法还包括标志物的使用。
[0126]
因此,所有这些技术也可以用于鉴定特别适合用本发明的化合物治疗的肿瘤。
[0127]
厄达替尼特别可用于治疗具有遗传改变的fgfr,特别是突变的fgfr的患者。在某些实施例中,尿路上皮癌对fgfr2遗传改变或fgfr3遗传改变易感。在某些实施例中,fgfr2或fgfr3遗传改变是fgfr3基因突变,或fgfr2或fgfr3基因融合。在一些实施例中,fgfr3基因突变是r248c、s249c、g370c、y373c、或其任何组合。在另外的实施例中,fgfr2或fgfr3基因融合是fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、或其任何组合。
[0128]
药物组合物和施用途径
[0129]
鉴于其有用的药理学特性,通常地fgfr抑制剂,以及更特别地厄达替尼可以配制成各种药物形式用于施用目的。
[0130]
在一个实施例中,药物组合物(例如配制品)包含至少一种本发明的活性化合物以及一种或多种药学上可接受的载体、佐剂、赋形剂、稀释剂、填充剂、缓冲剂、稳定剂、防腐剂、润滑剂或本领域技术人员熟知的其他物质以及任选地其他治疗剂或预防剂。
[0131]
为制备药物组合物,将有效量的通常地fgfr抑制剂,以及更特别地厄达替尼作为活性成分与药学上可接受的载体组合成紧密混合物,该载体可采用众多种形式,这取决于施用所希望的制剂形式。这些药物组合物可以为适用于口服施用、肠胃外施用、局部施用、鼻内施用、眼内施用、耳内施用、直肠施用、阴道内施用或经皮施用的任何形式。这些药物组合物有利地为适用于、优选地适用于口服施用、直肠施用、经皮施用或通过肠胃外注射施用的单位剂型。例如,在制备为口服剂型的组合物时,可以采用任何常见的药物介质,在口服液体制备物(诸如混悬剂、糖浆剂、酏剂和溶液剂)的情况下,诸如水、二醇类、油类、醇类等;或在散剂、丸剂、胶囊剂和片剂的情况下,固体载体诸如淀粉、糖、髙岭土、润滑剂、粘合剂、崩解剂等。
[0132]
本发明的药物组合物(特别是胶囊和/或片剂)可以包括一种或多种药学上可接受的赋形剂(药学上可接受的载体),如崩解剂、稀释剂、填充剂、粘合剂、缓冲剂、润滑剂、助流剂、增稠剂、甜味剂、调味剂、着色剂、防腐剂等。一些赋形剂可用于多种目的。
[0133]
适合的崩解剂是具有大的膨胀系数的那些。其实例为亲水性、不溶性或水难溶性的交联聚合物例如交联聚维酮(交联聚乙烯吡咯烷酮)和交联羧甲基纤维素钠(croscarmellose sodium,crosslinked sodiumcarboxymethylcellulose)。根据本发明的片剂中的崩解剂的量可方便地在从约2.5%至约15%(w/w)的范围内,并且优选地在从约2.5%至7%w/w的范围内,特别为约2.5%至5%w/w的范围内。因为崩解剂当大量使用时借由其性质产生缓释配方,用被称为稀释剂或填充剂的惰性物质将其稀释是有利的。
[0134]
可使用多种材料作为稀释剂或填充剂。实例是乳糖一水合物、无水乳糖、蔗糖、右旋糖、甘露醇、山梨醇、淀粉、纤维素(例如微晶纤维素(avicel
tm
)、硅化微晶纤维素)、二水合或无水的磷酸氢钙、以及其他在本领域中已知的,及其混合物(例如乳糖一水合物(75%)与微晶纤维素(25%)的喷雾干燥混合物,其作为microcelac
tm
是可商购的)。优选的是微晶纤维素和甘露醇。本发明的药物组合物中稀释剂或填充剂的总量可以方便地在从约20%至约95%w/w的范围内,并且优选地在从约55%至约95%w/w、或从约70%至约95%w/w、或从约80%至约95%w/w、或从约85%至约95%的范围内。
[0135]
润滑剂和助流剂可用于某些剂型的制造中,并且当产生片剂将通常被利用。润滑剂和助动剂的实例为氢化植物油例如氢化棉籽油、硬脂酸镁、硬脂酸、月桂基硫酸钠、月桂基硫酸镁、胶态二氧化硅、胶态无水二氧化硅、滑石、其混合物,以及其他在本领域中已知的。感兴趣的润滑剂是硬脂酸镁和硬脂酸镁与胶态二氧化硅的混合物,硬脂酸镁是优选的。优选的助流剂是胶态无水二氧化硅。
[0136]
如果存在,则助流剂通常占总组合物重量的0.2%至7.0%w/w,特别是0.5%至1.5%w/w,更特别地是1%至1.5%w/w。
[0137]
如果存在,则润滑剂通常占总组合物重量的0.2%至7.0%w/w,特别是0.2%至2%w/w、或0.5%至2%w/w、或0.5%至1.75%w/w、或0.5%至1.5%w/w。
[0138]
粘合剂可任选地用于本发明的药物组合物中。合适的粘合剂是水溶性聚合物,如烷基纤维素(如甲基纤维素);羟烷基纤维素(如羟甲基纤维素、羟乙基纤维素、羟丙基纤维
素和羟丁基纤维素);羟烷基烷基纤维素(如羟乙基甲基纤维素和羟丙基甲基纤维素);羧烷基纤维素(如羧甲基纤维素);羧烷基纤维素的碱金属盐(如羧甲基纤维素钠);羧烷基烷基纤维素(如羧甲基乙基纤维素);羧烷基纤维素酯;淀粉;果胶(如羧甲基支链淀粉钠);几丁质衍生物(如脱乙酰几丁质);二糖、寡糖、多糖(如海藻糖、环糊精、和其衍生物,藻酸、其碱金属和铵盐,角叉菜聚糖,半乳甘露聚糖,黄芪胶,琼脂,阿拉伯胶,瓜尔胶和黄原胶);聚丙烯酸及其盐;聚甲基丙烯酸,其盐和酯,甲基丙烯酸酯共聚物;聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)和其共聚物,例如pvp
‑
va。优选地,水溶性聚合物是羟烷基烷基纤维素,如羟丙基甲基纤维素,例如羟丙基甲基纤维素15cps。
[0139]
其他赋形剂(如着色剂和色素)也可以添加至本发明的组合物中。着色剂和色素包括适用于食品的二氧化钛和染料。着色剂或色素是本发明的配制品中的任选成分,但是当使用时,着色剂可以按总组合物重量为基准高至3.5%w/w的量存在。
[0140]
调味剂在组合物中是任选的并且可选自合成调味油和调味芳族化合物或天然油类,来自植物叶、花、果实等的萃取物及其组合。这些可以包括肉桂油、冬青油、薄荷油、月桂油、茴香油、桉油、百里香油。作为调味剂也有用的是香草、柑桔油(包括柠檬、柑桔、葡萄、青柠和葡萄柚)以及水果香精(包括苹果、香蕉、梨、桃、草莓、覆盆子、樱桃、李、凤梨、杏等),调味剂的量可视许多因素包括所需的器官感觉的效果而定。通常调味剂将以从约0%至约3%(w/w)的量存在。
[0141]
甲醛清除剂是能吸收甲醛的化合物。它们包括包含与甲醛反应的氮中心的化合物,如以在甲醛清除剂和甲醛之间形成一个或多个可逆或不可逆键。例如,甲醛清除剂包含一个或多个与甲醛反应的氮原子/中心,以形成席夫碱亚胺,该席夫碱随后能与甲醛结合。例如,甲醛清除剂包含一个或多个与甲醛反应的氮中心,以形成一个或多个5
‑
8元环。甲醛清除剂优选地包含一个或多个胺或酰胺基。例如,甲醛清除剂可以是氨基酸、氨基糖、α胺化合物、或其缀合物或衍生物、或其的混合物。甲醛清除剂可以包含两种或更多种胺和/或酰胺。
[0142]
甲醛清除剂包括,例如,甘氨酸、丙氨酸、丝氨酸、苏氨酸、半胱氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、酪氨酸、天冬氨酸、谷氨酸、精氨酸、赖氨酸、鸟氨酸、瓜氨酸、牛磺酸、吡咯赖氨酸、葡甲胺、组氨酸、阿斯巴甜、脯氨酸、色氨酸、瓜氨酸、吡咯赖氨酸、天冬酰胺、谷氨酰胺或其缀合物或混合物;或,只要可能,其药学上可接受的盐。
[0143]
在本发明的一个方面,甲醛清除剂是葡甲胺或其药学上可接受的盐,特别是葡甲胺碱。
[0144]
本发明的另一目的是提供制备如本文所述的,特别是片剂或胶囊剂形式的药物组合物的方法,该方法的特征在于将甲醛清除剂(特别是葡甲胺)、和厄达替尼(其药学上可接受的盐或其溶剂化物,特别是厄达替尼碱)、以及药学上可接受的载体共混,并且涵盖将所述共混物压制成片剂或将所述共混物填充到胶囊中。
[0145]
片剂和胶囊剂由于其施用简易性而代表了最有利的口服剂量单位形式,在该情况下显然采用固体药物载体。对于肠胃外组合物来说,载体通常将至少大部分包含无菌水,但也可以包含例如有助于溶解性的其他成分。例如可制备可注射溶液,其中载体包含盐溶液、葡萄糖溶液或盐水和葡萄糖溶液的混合物。也可以制备可注射悬浮液,在这种情况下可以采用适当的液体载体、助悬剂等。在适合用于经皮施用的组合物中,载体任选地包括渗透增
强剂和/或合适的润湿剂、任选地与小比例的具有任何性质的合适添加剂组合,这些添加剂不会对皮肤造成明显的有害作用。所述添加剂可以促进向皮肤施用并且/或者可以有助于制备所希望的组合物。可以按各种方式施用这些组合物,例如作为透皮贴剂、作为点涂剂(spot
‑
on)、作为软膏剂。特别有利的是,将上述药物组合物以剂量单位形式配制,以实现施用的简易性和剂量的均匀性。如本说明书和权利要求书中所用的剂量单位形式在本文中是指适合作为单位剂量的物理离散单位,每一单位含有经计算以与所希望的药物载体结合而产生所希望的治疗效果的预定量的活性成分。此类剂量单位形式的实例是片剂(包括刻痕或包衣片剂)、胶囊剂、丸剂、散剂包、糯米纸囊剂、可注射溶液剂或混悬剂、一茶匙的量、一汤匙的量等,以及分离的多个这些剂量单位形式。
[0146]
特别有利的是,将上述药物组合物以剂量单位形式配制,以实现施用的简易性和剂量的均匀性。如本文所用的剂量单位形式是指适合作为单位剂量的物理上离散的单位;每个单位含有经计算与所要求的药物载体联合产生所希望的治疗效果的预定量的活性成分。此类剂量单位形式的实例是片剂(包括刻痕或包衣片剂)、胶囊剂、丸剂、散剂包、糯米纸囊剂、可注射溶液剂或混悬剂、一茶匙的量、一汤匙的量等,以及分离的多个这些剂量单位形式。优选的形式是片剂和胶囊。
[0147]
在某些实施例中,fgfr抑制剂以固体单位剂型和适合于口服施用的固体单位剂型存在。单位剂型可以含有约1、2、3、4、5、6、7、8、9、或10mg fgfr抑制剂/单位剂型,或由这些值中的两个限定的范围内的量,特别是3、4或5mg/单位剂量。
[0148]
取决于施用的模式,药物组合物将优选地包含0.05重量%至99重量%、更优选地0.1重量%至70重量%、甚至更优选地0.1重量%至50重量%的本发明的化合物,以及1重量%至99.95重量%、更优选地30重量%至99.9重量%、甚至更优选地50重量%至99.9重量%的药学上可接受的载体,所有的百分数都基于该组合物的总重量。
[0149]
本发明的片剂或胶囊可进一步具有薄膜包衣例如以改良味道,提供吞咽的容易性和、极好的外观。聚合薄膜包衣材料在本领域中是已知的。优选的薄膜包衣是与基于溶剂的薄膜包衣相反的基于水的薄膜包衣,因为基于溶剂的薄膜包衣可能含有更多痕量的醛。优选的薄膜包衣材料是ii水性薄膜包衣系统,例如ii 85f,如ii 85f92209。进一步优选的薄膜包衣是保护免受环境水分影响的基于水的薄膜包衣,如(例如d)、ms、amb、amb ii,其是水性防潮薄膜包衣系统。优选的薄膜包衣是amb ii(高性能的防潮薄膜包衣),其是基于pva的即释系统(无聚乙二醇)。
[0150]
在根据本发明的片剂中,以重量为单位,薄膜包衣优选地占总片剂重量的约4%(w/w)或更少。
[0151]
对于根据本发明的胶囊,羟丙甲纤维素(hpmc)胶囊优于明胶胶囊。
[0152]
在本发明的一方面,如本文所述的药物组合物(特别是胶囊或片剂形式的)包含0.5mg至20mg碱当量、或从2mg至20mg碱当量、或从0.5mg至12mg碱当量、或从2mg至12mg碱当量、或从2mg至10mg碱当量、或从2mg至6mg碱当量、或2mg碱当量、3mg碱当量、4mg碱当量、5mg碱当量、6mg碱当量、7mg碱当量、8mg碱当量、9mg碱当量、10mg碱当量、11mg碱当量或12mg碱当量的厄达替尼,其药学上可接受的盐或其溶剂化物。特别地,如本文所述的药物组合物包
含3mg碱当量、4mg碱当量或5mg碱当量的厄达替尼、其药学上可接受的盐或其溶剂化物。
[0153]
在本发明的一方面,如本文所述的药物组合物,特别是胶囊或片剂形式的,包含从0.5mg至20mg、或从2mg至20mg、或从0.5mg至12mg、或从2mg至12mg、或从2mg至10mg、或从2mg至6mg、或2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg或12mg的厄达替尼碱。特别地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱。特别地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱和从约0.5%至约5%w/w、从约0.5%至约3%w/w、从约0.5%至约2%w/w、从约0.5%至约1.5%w/w、或从约0.5%至约1%w/w的甲醛清除剂(特别是葡甲胺)。特别地,如本文所述的药物组合物包含3mg、4mg或5mg的厄达替尼碱和从约0.5%至约1.5%w/w、或从约0.5%至约1%w/w的甲醛清除剂(特别是葡甲胺)。
[0154]
在本发明的一个方面,为了获得所希望的剂量(例如每日剂量),可以施用超过一个(例如两个)如本文所述的药物组合物。
[0155]
根据本发明的药物组合物中,甲醛清除剂(特别是葡甲胺)的量可以在从约0.1%至约10%w/w、约0.1%至约5%w/w、从约0.1%至约3%w/w、从约0.1%至约2%w/w、从约0.1%至约1.5%w/w、从约0.1%至约1%w/w、从约0.5%至约5%w/w、从约0.5%至约3%w/w、从约0.5%至约2%w/w、从约0.5%至约1.5%w/w、从约0.5%至约1%w/w的范围内。
[0156]
术语“安全且有效量”是指活性成分的量,该量在受试者的生物系统中引发所希望的生物或药物响应并且不具有超过此类响应的益处的风险(根据联邦食品、药品和化妆品法案,经修订(secs.201
‑
902,52stat.1040et seq.,经修订;21u.s.c.
§§
321
‑
392))。通常通过毒性测试来测量安全性以确定实现所希望的益处所需的活性药物成分的最高耐受剂量或最佳剂量。
[0157]
着眼于安全性的研究还设法鉴定可能导致暴露于药物的任何潜在不良影响。通常通过在适当情况下(如严格控制的临床试验)测试时,确定活性药物成分是否展示超过安慰剂或其他干预措施的健康益处,来测量功效。
[0158]
如本文所用的,对于配制品、组合物或成分,术语“可接受的”意指该配制品、组合物或成分对被治疗人的一般健康状况的有益作用在任何程度上均远远超过其有害作用。
[0159]
用于口服施用的所有配制品均为适合于此类施用的剂型。
[0160]
给药方法和治疗方案
[0161]
通常地fgfr抑制剂以及特别地厄达替尼是以足以发挥其抗肿瘤活性的量施用的。本领域技术人员可容易地从下文呈现的测试结果确定该有效量。通常,预期治疗有效量将为0.005mg/kg至100mg/kg体重,特别地为0.005mg/kg至10mg/kg体重。在全天以适宜间隔以单个、两个、三个、四个或更多个子剂量施用所需剂量可能是适当的。所述子剂量可以配制成单位剂型,例如每单位剂型含有0.5至500mg、特别地1mg至500mg、更特别地10mg至500mg活性成分。
[0162]
在一方面,本文描述了治疗尿路上皮癌的方法,这些方法包括以下、由以下组成或基本上由以下组成:向患有尿路上皮癌的患者施用安全且有效量的fgfr抑制剂,其中将该fgfr抑制剂口服施用。在一些实施例中,每天,特别是每天一次施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每天两次施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每天三次施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每天四次施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每隔一天
施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每周施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每周两次施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,每隔一周施用通常地fgfr抑制剂,以及特别地厄达替尼。在一些实施例中,以连续每天剂量方案口服施用通常地fgfr抑制剂,以及特别地厄达替尼。
[0163]
通常,用于在人中治疗本文所述的疾病或病症的fgfr抑制剂,以及特别地厄达替尼的剂量典型地在约1至20mg/天的范围内。在一些实施例中,将fgfr抑制剂,以及特别地厄达替尼以约1mg/天、约2mg/天、约3mg/天、约4mg/天、约5mg/天、约6mg/天、约7mg/天、约8mg/天、约9mg/天、约10mg/天、约11mg/天、约12mg/天、约13mg/天、约14mg/天、约15mg/天、约16mg/天、约17mg/天、约18mg/天、约19mg/天或约20mg/天的剂量向人口服施用。
[0164]
在某些实施例中,将厄达替尼以每天一次约8mg的剂量口服施用。在另外的实施例中,在开始治疗后的14至21天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg,前提是:(a)该患者在开始治疗后的14至21天展示出的血清磷酸盐(po4)水平小于约5.5mg/dl;和(b)以每天一次8mg施用厄达替尼未导致眼部障碍;或(c)以每天一次8mg施用厄达替尼未导致2级或更严重的不良反应。
[0165]
在某些实施例中,在开始治疗后的第14天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第15天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第16天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第17天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第18天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第19天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。在某些实施例中,在开始治疗后的第20天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg。
[0166]
在实施例中,以10mg的剂量施用厄达替尼。在实施例中,以10mg的剂量间歇施用厄达替尼。在实施例中,以10mg的剂量、以7天施用/7天不施用来间歇施用厄达替尼。
[0167]
在实施例中,以8mg的剂量、特别地每天一次8mg的剂量施用厄达替尼。在实施例中,以8mg的剂量施用、特别地每天一次8mg的剂量施用厄达替尼,根据血清磷酸盐水平(例如,血清磷酸盐水平<5.5mg/dl或<7mg/dl,或在从7mg/dl(并包括7mg/dl)至≤9mg/dl的范围,或≤9mg/dl)以及根据观察到的与治疗相关的不良事件,可选择上调滴定至9mg。在一个实施例中,在厄达替尼治疗的第一周期期间的治疗日(特别是施用厄达替尼的第14天
±
2天,更具体是第14天),测量用于确定是否上调滴定的血清磷酸盐的水平。
[0168]
在实施例中,如本文所用的治疗周期是28天的周期。
[0169]
在一个实施例中,将所希望的剂量方便地以单一剂量或者以同时(或经一短时段)或以适当的间隔施用的分开剂量呈现,例如以每天两个、三个、四个或更多个子剂量施用。在一些实施例中,fgfr抑制剂方便地以分开的剂量存在,这些分开的剂量每天一次同时(或经短的时间段)施用。在一些实施例中,fgfr抑制剂方便地以分开的剂量存在,这些分开的剂量每天两次(等份)施用。在一些实施例中,fgfr抑制剂方便地以分开的剂量存在,这些分开的剂量每天三次(等份)施用。在一些实施例中,fgfr抑制剂方便地以分开的剂量存在,这些分开的剂量每天四次(等份)施用。
[0170]
在某些实施例中,所希望的剂量可以在整天过程中以1、2、3、4、5、6、7、8、9或10个
分单位剂量递送,使得在一天的过程中通过分单位剂量递送的fgfr抑制剂的总量提供每日总剂量。
[0171]
在一些实施例中,向人给予的fgfr抑制剂的量根据因素(例如但不限于疾病或病症的状况和严重程度、和人的特性(例如体重)以及施用的特定的另外的治疗剂(如果适用))而不同。
[0172]
在另外的实施例中,患者接受了用于治疗尿路上皮癌的至少一种先前疗法。在一些实施例中,用于治疗尿路上皮癌的至少一种先前疗法是含铂化学疗法。在某些实施例中,尿路上皮癌在含铂化学疗法的至少一线期间或之后有进展。在另外的实施例中,含铂化学疗法是新辅助的含铂化学疗法或辅助的含铂化学疗法。在仍另外的实施例中,尿路上皮癌在至少一线的该新辅助的含铂化学疗法或辅助的含铂化学疗法期间或之后的12个月内有进展。
[0173]
在仍另外的实施例中,厄达替尼不与以下项共施用:(a)强cyp2c9抑制剂或cyp3a4抑制剂药物;(b)强cyp2c9诱导剂或cyp3a4诱导剂药物;(c)中度cyp2c9诱导剂或cyp3a4诱导剂药物;或(d)血清磷酸盐水平变更剂药物。在某些实施例中,厄达替尼不与强cyp2c9抑制剂或cyp3a4抑制剂药物共施用。在某些实施例中,厄达替尼不与强cyp2c9抑制剂药物共施用。在某些实施例中,厄达替尼不与强cyp3a4抑制剂药物共施用。在某些实施例中,厄达替尼不与强cyp2c9诱导剂或cyp3a4诱导剂药物共施用。在某些实施例中,厄达替尼不与强cyp2c9诱导剂药物共施用。在某些实施例中,厄达替尼不与强cyp3a4诱导剂药物共施用。在某些实施例中,厄达替尼不与中度cyp2c9诱导剂或cyp3a4诱导剂药物共施用。在某些实施例中,厄达替尼不与中度cyp2c9诱导剂药物共施用。在某些实施例中,厄达替尼不与中度cyp3a4诱导剂药物共施用。在某些实施例中,厄达替尼不与血清磷酸盐水平变更剂药物共施用。
[0174]
在某些实施例中,厄达替尼不与以下项共施用:(a)cyp3a4底物药物;(b)oct2底物药物;或(c)p
‑
糖蛋白(p
‑
gp)底物药物。在某些实施例中,厄达替尼不与cyp3a4底物药物共施用。在某些实施例中,厄达替尼不与oct2底物药物共施用。在某些实施例中,厄达替尼不与p
‑
糖蛋白(p
‑
gp)底物药物共施用。
[0175]
强cyp3a4抑制剂的非限制性实例包括柏塞瑞韦、阿瑞吡坦、克拉霉素、考尼伐坦、葡萄柚汁、茚地那韦、洛匹那韦、伊曲康唑、米贝拉地尔、酮康唑、奈法唑酮、利托那韦、泊沙康唑、奈非那韦、沙奎那韦、考尼伐坦、特拉匹韦、柏塞瑞韦、特利霉素、克拉霉素、伏立康唑、克霉唑、地尔硫卓、红霉素、氟康唑、戊脉安和三乙酰夹竹桃霉素。
[0176]
中度至强cyp3a4诱导剂的非限制性实例包括阿伐麦布、圣约翰草(st.john’s wort)、卡马西平、依法韦仑、苯妥英、依曲韦林、波生坦、奈夫西林、利福平、莫达非尼、利福布汀和巴比妥类药物。
[0177]
强cyp2c9抑制剂的非限制性实例是氟康唑。
[0178]
cyp2c9诱导剂的非限制性实例包括卡马西平(carbamiazepine)、利福平、恩杂鲁胺、司可巴比妥、奈韦拉平、圣约翰草(st.john’s wort)、和苯巴比妥。
[0179]
试剂盒/制品的制造
[0180]
为了在本文所述的使用方法中使用,也对试剂盒和制品进行了描述。此类试剂盒包括包装或容器,该包装或容器被分隔以接收一种或多种剂量的本文披露的药物组合物。
合适的容器包括,例如,瓶子。在一个实施例中,这些容器是由各种各样的材料(如玻璃或塑料)制成的。
[0181]
本文提供的制品包含包装材料。用于包装药物产品的包装材料包括,例如,美国专利号5,323,907、5,052,558和5,033,252。药物包装材料的实例包括,但不限于,泡罩包装、瓶子、管、袋子、容器、瓶子,以及适合于所选择的配制品和预期的施用和治疗模式的任何包装材料。
[0182]
试剂盒通常包括列出内容和/或使用说明书的标签,以及具有使用说明书的包装插页。通常还包括一系列的说明书。
[0183]
在一个实施例中,标签在容器上或与容器相关联。在一个实施例中,当形成标签的字母、数字或其他字符被附接、模制或蚀刻到容器本身上时,标签在容器上;当标签存在于也固持容器的贮器或载体内时,标签例如以包装插页形式与容器相关联。
[0184]
在一个实施例中,使用标签来指示这些内容物将用于具体的治疗应用。标签还指示使用内容物的指导,例如在本文所述的方法中。
[0185]
在某些实施例中,在包装或分配器装置中呈现的药物组合物包含含本文提供的化合物的一个或多个单位剂型。包装,例如包括金属或塑料箔(例如,泡罩包装)。在一个实施例中,包装或分配器装置附有施用说明书。在一个实施例中,包装或分配器还附有与管制药品的制造、使用或销售的政府机构规定的形式的容器相关联的公告,该通知反映了该机构批准用于人或兽医施用的药物的形式。这样的公告,例如是由美国食品和药物管理局批准的用于处方药物的标签,或批准的产品插页。在一个实施例中,还制备包含本文所提供的一种化合物、被配制于相容性药物载体中的组合物,将组合物放入合适的容器中,并对适用病症的治疗进行标注。
[0186]
销售方法
[0187]
本文还提供了销售包含厄达替尼的批准的药物产品的方法,所述方法包括销售此类药物产品,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。在某些实施例中,药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
[0188]
术语“药物产品”或“批准的药物产品”是含有活性药物成分的产品,该活性药物成分已经被政府当局(例如,美国食品与药品管理局或其他国家的相似当局)批准上市用于至少一种适应症。
[0189]
术语“参比制剂(rld)”是与新型仿制版本相比显示出生物等效性的药物产品。21cfr 314.3(b))它也是已获得欧盟成员国或委员会基于完整档案(即具有根据2001/83/ec指令中第8(3)、10a、10b或10c条的提交质量、临床前和临床数据,并且仿制/混合医药产品的上市许可申请所参考(通过展示其生物等效性,一般是通过提交适当的生物利用度研究))的上市许可的医药产品。
[0190]
在美国,寻求批准上市等效仿制药的公司必须在其简化新药申请(anda)中提及rld。例如,anda申请人依赖于fda发现先前批准的药物产品,即rld,是安全且有效的,并且(除其他事项外)必须证明所提议的仿制药物产品在某些方面与rld相同。特别地,除了有限的例外情形,提交anda的药物产品(除其他事项外)必须具有与rld相同的一种或多种活性成分、使用条件、施用途径、剂型、规格、和(具有某些允许的差异)标签。rld是上市药品,
anda申请人必须显示出其提议的anda药物产品与该上市药品在一种或多种活性成分、剂型、施用途径、规格、标签、和使用条件等特征方面是相同的。在电子版橙皮书中,其中一栏是针对rld,另一栏是针对参比标准。在印刷版橙皮书中,rld和参比标准由特定的符号标识。对于基于批准的适用性请愿的anda(请愿性anda),参比制剂通常是批准的适用性请愿中所引用的上市药品。
[0191]
参比标准是fda所选择的、寻求批准anda的申请人在进行批准所需的体内生物等效性研究中必须使用的药物产品。fda通常选择单一参比标准,并且anda申请人必须在体内生物等效性测试中使用该单一参比标准。通常,fda将选择参比制剂作为参比标准。然而,在一些情况下(例如,当参比制剂已撤市,并且fda裁定其并非因为安全性或有效性而撤市,fda会选择anda作为参比标准),参比制剂和参比标准可以不同。
[0192]
fda在处方药物产品、otc药物产品、和撤市药物产品列表中指定参比制剂。指定为参比制剂的上市药品代表了申请人在寻求批准anda时可以依赖的药物产品。fda旨在周期性地更新在处方药物产品、otc药物产品、和撤市药物产品列表中指定的参比制剂(视情况而定)。
[0193]
fda还在处方药物产品和otc药物产品列表中指定了参比标准。指定为参比标准的上市药品代表了fda目前出于进行任何批准所需的体内生物等效性研究的目的而对于适当比较物的最佳判断。
[0194]
在一些情况下,当fda未指定上市药品为参比制剂时,此类上市药品可以免于仿制药竞争。如果fda没有为申请人旨在复制的药物产品指定参比制剂,潜在的申请人可以要求fda为该药物产品指定参比制剂。
[0195]
在有助于确保仿制药的申请可以被提交和评估的情况下,例如在目前被选择作为参比标准的上市药品出于安全性或功效之外的原因已撤市的情况下,fda可能会主动选择新的参比标准。
[0196]
基于fd&c法案下的药物产品的不同简化批准路径包括fd&c法案的505(j)和505(b)(2)节(分别为21u.s.c.355(j)和21u.s.c.23355(b)(2))中描述的简化批准路径。
[0197]
根据fda(https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm579751.pdf,其内容通过引用并入本文),nda和anda可被分为以下四类:
[0198]
(1)“独立nda”是基于fd&c法案的505(b)(1)节提交和505(c)节批准的、含有完整的安全性和有效性调查报告的申请,这些报告是由申请人或为申请人进行、或申请人有权引用或使用。
[0199]
(2)505(b)(2)申请是基于fd&c法案的505(b)(1)节提交和505(c)节批准的、含有完整的安全性和有效性调查报告的nda,其中批准所需的至少部分信息并非由申请人或为申请人进行研究而获得的,并且申请人无权引用或使用。
[0200]
(3)anda是用于复制先前批准的药物产品的申请,该申请是基于fd&c法案的505(j)节提交和批准的。anda依赖于fda发现先前批准的药物产品(即,参比制剂(rld))是安全且有效的。anda通常必须含有以下信息,即显示所提议的仿制产品(a)与rld在一种或多种活性成分、使用条件、施用途径、剂型、规格和标签(具有某些允许的差异)方面相同,以及(b)与rld具有生物等效性。如果必须进行研究以证明所提议的产品具有安全性和有效性,
则可以不提交anda。
[0201]
(4)请愿性anda是一种用于以下药物产品的anda,该药物产品在剂型、施用途径、规格、或活性成分(在具有超过一种活性成分的产品中)方面与rld不同,并且对此fda已经确定(作为对基于fd&c法案的505(j)(2)(c)节提交的请愿(适用性请愿)的回应)证明所提议的产品具有安全性和有效性的研究不是必要的。
[0202]
哈奇
‑
维克斯曼修正案(hatch
‑
waxman amendments)的科学前提是将anda中基于fd&c法案的505(j)节批准的药物产品假定为与其rld具有治疗等效性。归类为具有治疗等效性的产品是完全有希望被取代的,用于取代的产品当在标签所规定的条件下向患者施用时将产生与规定产品相同的临床作用和安全性曲线。与anda相反,505(b)(2)申请对于所提议的产品的特征具有更大的灵活性。505(b)(2)申请在批准时不一定被评为与其引用的上市药品具有治疗等效性。
[0203]
在欧洲,申请人在仿制/混合医药产品(其与anda或snda药物产品相同)的申请表中确定与rld同义的参比医药产品(产品名称、规格、药物形式、mah、首次许可、成员国/群体),如下所示:
[0204]
1.在eea中获得或已获得授权,用作证明欧洲药品法中所限定的数据保护期已过的基础的医药产品。出于计算数据保护期期满的目的而确定的这种参比医药产品可以与仿制/混合医药产品在规格、药物形式、施用途径或表现方面不用。
[0205]
2.档案在仿制/混合药申请(产品名称、规格、药物形式、mah、上市许可数量)中交叉引用的医药产品。这种参比医药产品可能已经通过独立程序获得了授权,并且名称与出于计算数据保护期期满的目的而指定的参比医药产品不同。这种参比医药产品的产品信息在原则上将用作仿制/混合医药产品所声称的产品信息的基础。
[0206]
3.用于一种或多种生物等效性研究(在适用情况下)的医药产品(产品名称、规格、药物形式、mah、来源成员国)。
[0207]
术语“参比制剂的治疗等效物”意指该药物产品是参比制剂产品的仿制等效物(即药物等效物),并且因此被fda评为参比制剂产品的ab治疗等效物,由此通过支持生物等效性的充分的体内和/或体外证据,解决了实际或潜在的生物等效性问题。
[0208]“药物等效物”意指与参比制剂在相同剂型和(一种或多种)施用途径下含有相同量的相同活性药物成分的药物产品。
[0209]
fda将符合以下通用标准的产品归类为治疗等效物:(1)被批准为安全且有效的;(2)是药物等效物,因其(a)在相同剂型和施用途径下含有相同量的相同活性药物成分,以及(b)符合规格、质量、纯度、和特性的药典或其他适用标准;(3)是生物等效物,因其(a)不存在已知或潜在的生物等效性问题,并且符合可接受的体外标准,或(b)如果确实存在此类已知或潜在的问题,其已经证明符合适当的生物等效性标准;(4)被充分地标示;和(5)是按照现行良好制造规范法规生产的
[0210]
术语“生物等效”或“生物等效性”是当在适当设计的研究中、在相似条件下以相同摩尔剂量施用时,药物等效物或药物替代品中的活性成分或活性部分在药物作用位点的可用率和可用程度没有显著差异。fd&c法案的505(j)(8)(b)节描述了一组条件,在这些条件下测试和参比制剂应当被认为是生物等效的:
[0211]
在相似实验条件下以单一剂量或多剂量施用相同摩尔剂量的治疗成分时,[测试]
药物的吸收率和吸收程度与[参比]药物的吸收率和吸收程度没有显著差异;或
[0212]
在相似实验条件下以单一剂量或多剂量施用相同摩尔剂量的治疗成分时,[测试]药物的吸收程度与[参比]药物的吸收程度没有显著差异,并且[测试]药物与[参比]药物的吸收程度的差异是有意的、反映在其所提议的标签中、对于在长期使用中实现有效体内药物浓度不是必须的、并且被认为对药物是医学上无关紧要的。
[0213]
如果以上这些方法不适用(例如,对于不旨在被血流吸收的药物产品),证明生物等效性的其他科学有效的体内或体外测试方法可能是适当的。
[0214]
例如,有时可以使用体外生物等效性标准来证明生物等效性,特别是当此类体外测试与人体内生物利用度数据相关时。在其他情况中,有时可以通过对比性临床试验或药效动力学研究来证明生物等效性。
[0215]
术语“销售(sale/selling)”意指将药物产品(例如药物组合物或口服剂型)从卖方转移到买方。
[0216]
术语“许诺销售”意指卖方向买方提出销售药物产品(例如药物组合物和口服剂型)的建议。
[0217]
本文进一步提供了一种许诺销售包含厄达替尼的批准的药物产品的方法,所述方法包括许诺销售此类药物产品,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。在某些实施例中,药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
[0218]
本文还描述了一种包括销售包含厄达替尼的批准的药物产品的方法,其中此类药物产品的参比制剂的药物产品标签包含客观缓解率或缓解持续时间数据。在另外的实施例中,此类药物产品的参比制剂的药物产品标签包括客观缓解率数据。在某些实施例中,客观缓解率数据是完全缓解率数据。在某些实施例中,客观缓解率数据是部分缓解率数据。在某些实施例中,客观缓解率数据是完全缓解率数据和部分缓解率数据。在某些实施例中,厄达替尼的客观缓解率数据为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据为约2.3%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的部分客观缓解率数据为约29.9%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据和部分客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学
疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。
[0219]
本文仍进一步提供了在患有尿路上皮癌的患者中改善客观缓解率或缓解持续时间的方法,所述方法包括向所述患者施用包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善客观缓解率的方法,所述方法包括向所述患者施用包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善完全客观缓解率的方法,所述方法包括向所述患者施用包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善部分客观缓解率的方法,所述方法包括向所述患者施用包含厄达替尼的批准的药物产品。在某些实施例中,厄达替尼的客观缓解率为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据为约2.3%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的部分客观缓解率数据为约29.9%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据和部分客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,厄达替尼的缓解持续时间为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在仍另外的实施例中,批准的药物产品是anda药物产品或补充新药申请药物产品。
[0220]
本文还提供了在患有尿路上皮癌的患者中改善客观缓解率或缓解持续时间的方法,所述方法包括向所述患者提供包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善客观缓解率的方法,所述方法包括向所述患者提供包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善完全客观缓解率的方法,所述方法包括向所述患者提供包含厄达替尼的批准的药物产品。本文还提供了在患有尿路上皮癌的患者中改善部分客观缓解率的方法,所述方法包括向所述患者提供包含厄达替尼的批准的药物产品。在某些实施例中,厄达替尼的客观缓解率为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据为约2.3%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗
法复发性/难治性疾病)。在某些实施例中,厄达替尼的部分客观缓解率数据为约29.9%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据和部分客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在另外的实施例中,厄达替尼的缓解持续时间为约5.6个月,特别地其中患者患有局部晚期或转移性尿路上皮癌。在另外的实施例中,厄达替尼的缓解持续时间为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,批准的药物产品是anda药物产品或补充新药申请药物产品。在另外的实施例中,此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。
[0221]
本文进一步提供了批准的药物产品,其具有至少一种批准的适应症,其中所述批准的药物产品包含厄达替尼。在某些实施例中,批准的药物产品是nda药物产品、anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。在另外的实施例中,批准的药物产品的参比制剂产品包括药物产品标签。在仍另外的实施例中,药物产品标签包含客观缓解率数据。在仍另外的实施例中,药物产品标签包含部分客观缓解率数据。在仍另外的实施例中,药物产品标签包含完全客观缓解率数据。在仍另外的实施例中,药物产品标签包含部分和完全客观缓解率数据。在一些实施例中,厄达替尼的客观缓解率数据为约40.2%,特别地其中患者患有局部晚期或转移性尿路上皮癌。在某些实施例中,厄达替尼的客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据为约2.3%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的部分客观缓解率数据为约29.9%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,厄达替尼的完全客观缓解率数据和部分客观缓解率数据为约32.2%,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。在某些实施例中,药物产品标签包含缓解持续时间数据。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.6个月。在另外的实施例中,厄达替尼的缓解持续时间数据为约5.4个月,特别地其中患者患有已经在至少一线的先前含铂化学疗法期间或之后(包括在新辅助的或辅助的含铂化学疗法的12个月内)有进展的局部晚期或转移性尿路上皮癌(化学疗法复发性/难治性疾病)。
[0222]
fgfr融合基因的核苷酸序列
[0223]
表4中提供了fgfr融合cdna的核苷酸序列。具有下划线的序列对应于fgfr3或
fgfr2,黑色的序列代表融合配偶体,而斜体的序列代表fgfr3基因的内含子序列。
[0224]
表4
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231][0232]
实例
[0233]
提供这些实例用于说明目的,并不限制本文提供的权利要求的范围。
[0234]
实例1:2期、多中心、开放标签研究(nct 02365597)
[0235]
进行了2期、多中心、开放标签研究,以评估厄达替尼在患有携带选择性fgfr遗传改变(fgfr易位或突变)的转移性或不可手术切除的尿路上皮癌受试者中的功效和安全性。
[0236]
该研究包括筛选阶段(在首次剂量前的任何时间的分子筛选和首次剂量的30天内的研究筛选)、治疗阶段和治疗后随访阶段。治疗阶段包括从首次剂量到治疗结束随访的期间。随访阶段延长至受试者死亡、撤回同意、失去随访、或研究结束,以先到者为准。
[0237]
研究治疗是在28天的周期内施用的。在中期分析1之前,有2个治疗方案。将患者按1:1至28天的周期随机分配至以下2种方案,直至选择用于进一步研究的方案:方案1(10mg,每日一次,间歇(7天进行/7天);方案2(6mg,每日一次,连续)。根据体能状态(0至1对比2)、血红蛋白值(<10对比≥10g/dl)、fgfr改变类型(突变对比融合)、治疗前状态(化学疗法抗性对比化学疗法初治)、和疾病分布(存在或不存在内脏[肝、肺、骨]转移)对随机进行分层。起始剂量选择是基于1期功效和耐受性。
[0238]
基于中期分析和血清磷酸盐水平的药代动力学
‑
药效动力学模型,将起始剂量增加至8mg/天连续(方案3)。因此,中期分析之后,此研究成为单组研究。在第14天仍未达到目标血清磷酸盐水平(≥5.5mg/dl,与1期中提高的缓解率相关)的患者和未观察到与治疗相关的不良事件的患者中,通过药效动力学指导的上调滴定至9mg/天而将给药进一步个体化。治疗持续直到研究人员评估有疾病进展或出现一种或多种不可接受的不良事件。将由研究人员和主办方来判断具有研究人员评估的疾病进展的患者是否可以继续厄达替尼。2期研究方案见图1。
[0239]
目的
[0240]
主要目的
[0241]
·
评估所选择的给药方案在患有携带特异性fgfr基因组改变的转移性或不可手术切除的尿路上皮癌的受试者中的客观缓解率(完全缓解[cr] 部分缓解[pr])。
[0242]
次要目的
[0243]
·
评估所选择的给药方案在化疗难治性受试者中的客观缓解率
[0244]
·
评估所选择的给药方案在所有以及化疗难治性受试者中的无进展生存期(pfs)、缓解持续时间、和总生存期
[0245]
·
评估所选择的给药方案的生物标志物特异性亚群中(易位对比突变)的缓解率
[0246]
·
评估其他测试的给药方案的客观缓解率、pfs、缓解持续时间、和总生存期
[0247]
·
评估所有给药方案中厄达替尼的安全性和药代动力学
[0248]
患者
[0249]
纳入的患者是患有根据实体瘤缓解评估标准1.1版可测量的尿路上皮癌的成人。
[0250]
使用定制的逆转录酶聚合酶链反应测定法,患者需要具有根据中心实验室对来自福尔马林固定的石蜡包埋肿瘤样品的rna测试的至少1个fgfr2/fgfr3突变或融合。
[0251]
患者在至少1线的先前全身化学疗法期间或之后、或接受新辅助的或辅助的化学疗法的12个月内有进展。
[0252]
根据方案标准所允许的不适用顺铂的化学疗法初治患者。顺铂的不适用是基于肾功能受损,定义为:1)通过24小时尿测量,肾小球滤过率<60ml/min/1.73m2;2)通过科克罗夫特
‑
高尔特(cockcroft
‑
gault)方程计算;或3)2级或更高级周围神经病变(不良事件的常见术语标准[ctcae]4.0版(美国国家癌症研究所(national cancer institute)ctcae v4.0.nci,nih,dhhs.2009年5月29日.nih出版#09
‑
7473:2009))。
[0253]
要求东部肿瘤协作组(ecog)体能状态(五分制,数字越大说明身体失能越大)为0
‑
2。
[0254]
对先前治疗线的数量没有限制。
[0255]
允许先前免疫疗法(例如,用免疫检查点抑制剂进行治疗)。
[0256]
患者需要有足够的骨髓、肝脏和肾脏(肌酐清除率≥40ml/min)功能。
[0257]
尽管有医疗管理,但仍排除磷酸盐水平持续高于正常上限、未控制的心血管疾病、脑转移、已知的乙型肝炎或丙型肝炎、或已知的hiv感染的患者。
[0258]
评估
[0259]
使用在筛选期间的胸腔、腹部、和骨盆的计算机断层扫描或磁共振成象扫描(前3个月每6周进行一次,接下来的9个月每12周进行一次,然后每4至6个月进行一次直到出现进展),根据recist v.1.1评估对患者的功效。首次评估的4至6周内,所有客观缓解需要通过进行另外的研究人员评估来确认。还通过独立放射照相审查委员会对方案3进行疾病评估。每12周联系患者以进行生存评估。
[0260]
基于临床实验室测试、体格检查、心电图、以及眼科检查对安全性进行评估。由研究人员评估不良事件和异常,并且根据nci ctcae v.4.0对其进行分级
[0261]
终点
[0262]
此研究的主要终点是所选择的方案的客观缓解率(方案3)。
[0263]
次要终点包括无进展生存期(pfs)、缓解持续时间、总生存期、安全性、生物标志物
特异性亚群中的缓解率、以及药代动力学。
[0264]
统计学分析
[0265]
该研究计划招募180名具有指定fgfr改变的患者。其中,所选择的方案中需要≥88名患者。初步假设方案3的客观缓解率(orr)>25%。该研究有85%功效以拒绝零假设,即orr≤25%,单边
ɑ
为0.025,给定的真实缓解率为42%。由评估研究人员和独立放射学审查委员会对缓解进行评估。使用卡普兰
‑
迈耶(kaplan
‑
meier)乘积极限法对无进展生存期和总生存期进行估算。在最后一次肿瘤评估时删失来自无进展和存活或具有未知状态的患者的数据。在初步分析截至时分析功效终点。
[0266]
结果
[0267]
患者
[0268]
评估了2214名患者的合格性。210名合格/经治疗的患者中,方案1中招募了33名患者,方案2中招募了78名患者,并且所选择的2期给药方案(方案3)中招募了99名患者。
[0269]
在用方案3治疗的患者中,在初步分析的截止日期和40例死亡后,中位生存随访时间为11.0个月(四分位距范围,0.7 至17.4[95%置信区间(ci),9.1至12.2])。每月接受的周期的中位数为5.0(范围,1至18);中位治疗持续时间为5.3个月。方案3中,99名患者中有41名被上调滴定至9mg/天厄达替尼;如方案允许的,13名患者在出现进展后继续治疗,持续至少4周。
[0270]
在用方案1或2治疗的患者中,在初步分析的截止日期,接受方案1的组的中位生存随访时间为22.9个月(四分位范围,1.7 至25.3 [95%ci,20.5至24.5]),接受方案2的组为18.5个月(四分位距,0.4 至21.6[95%ci,15.0至19.4)。方案1和方案2中周期的中位数分别为5.0(范围,1至25)和4.5(范围,1至22)。方案1和方案2中的中位治疗持续时间分别为4.4个月和3.9个月。
[0271]
表5中呈现了方案1至3中患者的人口统计学和基线疾病特征。
[0272]
表5:人口统计学和基线疾病特征
[0273]
[0274]
[0275][0276]
在所有方案中,在研究招募前,有184名患者已经接受了一线基于铂的化学疗法,83名已经接受了二线化学疗法,并且24名已经接受了三线化学疗法。在所有方案中,根据研究人员评估的最佳orr中,一线吉西他滨加顺铂为35%(33/94);一线吉西他滨加卡铂为25%(15/59);一线甲氨蝶呤、长春花碱、阿霉素、和顺铂(mvac)为23%(5/22);二线多西他赛、长春氟宁、或紫杉醇为17%(8/46);以及三线多西他赛、长春氟宁、或紫杉醇为15%(3/20)。
[0277]
主要终点
[0278]
表6中呈现了用方案3治疗的患者中根据研究人员评估的确认的orr(40.4%,双边95%ci为30.7%至50.1%)和缓解时间。因为置信区间的下边界>25%,所以实现了主要终点。另外39名(39%)患者在≥1个疾病评价评估(>36天)中疾病稳定。两名患者没有基线后疾病评估。无论先前化学疗法、先前治疗线的数量、内脏转移的存在、或基线特征(如年龄、性别、血红蛋白水平、或肾功能)如何,orr均相似(表6,图2)。具有≥1个基线后疾病评估的97名患者中有75名(77%)的靶病灶直径总和减少,并且48名(49%)的最大肿瘤减少在30%与100%之间(图3a)。根据独立放射照相审查,方案3中的orr为34.3%(95%ci,25%至43.7%)。
[0279]
表6:厄达替尼的3种给药方案的抗肿瘤活性
[0280]
[0281][0282]
用方案3治疗并且具有fgfr突变的患者(n=74)的orr为48.6%(表6)。另外26名患者的疾病稳定,中位数为3.7个月(范围,0 至13.6个月)。缓解不受特定突变影响。方案3中具有fgfr融合的25名患者中,orr为16.0%(表6)。fgfr3
‑
tacc3 v1是最常见的融合(n=11;表5);并且这些患者中有四名(36.4%)得到缓解。
[0283]
方案3中,22名患者在研究招募前接受了免疫疗法(表5);这些患者中厄达替尼的确认的orr为59%。探索性分析确定了这些22名患者中仅有一名(5%)根据研究人员评估对先前免疫疗法产生响应。
[0284]
表6还呈现了方案1和2的orr。
[0285]
用方案3治疗的99名患者中,87名患者在至少一种先前化学疗法期间或之后有进展(化学疗法复发性或难治性疾病)并且具有以下基因改变中至少1种:fgfr3基因突变(r248c、s249c、g370c、y373c)或fgfr基因融合(fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7),如通过在中心试验室进行的临床试验测定所确定的(表5)。此群体中,中位年龄为67岁(范围:36至87岁),79%是男性,并且74%是高加索人。大多数患者(92%)的基线东部肿瘤协作组(ecog)体能状态为0或1。三名(3%)患者在仅进行先前含铂的新辅助或辅助疗法后出现疾病进展。八十七名(97%)患者先前接受了至少一次顺铂或卡铂。56%的患者仅接受了先前基于顺铂的方案,29%仅接受了先前基于卡铂的方案,和10%接受了基于顺铂和基于卡铂的方案。24%的患者已经用先前抗pd
‑
l1/pd
‑
1疗法治疗过。79%的患者具有内脏转移(骨、肝或肺)。
[0286]
在方案3中的87名化学疗法难治性患者中,如研究人员所评估的总缓解率为40.2%;表7a呈现了此患者群体的结果。响应者包括之前未对抗pd
‑
l1/pd
‑
1疗法产生响应的患者。表8a呈现了通过fgfr改变的orr。
[0287]
表7a:方案3中化学疗法难治性患者(n=87)的功效结果
[0288][0289]
orr=cr pr
[0290]
ci=置信区间
[0291]
表8a:方案3中化学疗法难治性患者通过fgfr遗传改变的功效结果
[0292] 研究人员评估fgfr3点突变n=64orr(%)95%ci(%)48.4(36.2,60.7)fgfr融合n=23orr(%)95%ci(%)17.4(1.9,32.9)
[0293]
orr=cr pr
[0294]
ci=置信区间
[0295]
在方案3中的87名化学疗法复发性/难治性患者中,如盲法独立审查委员会所评估的总缓解率为32.2%;表7b呈现了此患者群体的结果。响应者包括之前未对抗pd
‑
l1/pd
‑
1疗法产生响应的患者。表8b呈现了通过fgfr改变的orr。
[0296]
表7b:方案3中化学疗法难治性患者的功效结果
[0297][0298]
a
birc:盲法独立审查委员会
[0299]
orr=cr pr
[0300]
ci=置信区间
[0301]
表8b:方案3中化学疗法难治性患者通过fgfr遗传改变的功效结果
[0302] birc
a
评估fgfr3点突变n=64orr(%)95%ci(%)40.6(28.6,52.7)fgfr3融合
b,c
n=18orr(%)95%ci(%)11.1(0,25.6)fgfr2融合
c
n=6orr(%)0
[0303]
a
birc:盲法独立审查委员会
[0304]
b
响应者均具有fgfr3
‑
tacc3_v1融合
[0305]
c
在以上fgfr2融合和fgfr3融合中均报告了一名具有fgfr2
‑
casp7/fgfr3
‑
tacc3_v3融合的患者
[0306]
orr=cr pr
[0307]
ci=置信区间
[0308]
次要终点
[0309]
表6呈现了接受方案3的患者中的缓解持续时间;大约30%的缓解维持了>12个月。在疾病稳定的39名患者中,有13名(33%)持续了>6个月保持疾病稳定(图4)。21%的患者在数据截至时仍在接受治疗。
[0310]
图5a呈现了根据研究人员评估的接受方案3的患者在中位随访(11.2个月)时的中位无进展生存。12个月时的无进展生存率(95%ci)为19%(11%至29%)。图5b呈现了中位11.0个月的生存随访时的中位总生存。12个月的生存率为55%(43%至66%)。
[0311]
在接受方案3的99名患者中,有34名(34%)继续接受后续疗法,其中25名(25%)接受了一个后续疗法,并且九名(9%)接受了两个后续线疗法。十九名(19%)接受了化学疗法并且15名(15%)接受了免疫疗法作为第一后续疗法。患者均未对第一后续化学疗法产生客观缓解;一名患者对第一后续免疫疗法产生部分缓解。
[0312]
表6还呈现了用方案1和2治疗的患者的缓解持续时间。图6a和6b呈现了接受方案1和2治疗的患者的无进展生存和总生存。
[0313]
根据研究人员评估,接受方案1和2的患者的中位(95%ci)无进展生存期分别为4.8(2.7至5.5)个月和5.3(4.1至5.5)个月。方案1和2在12个月时的无进展生存率(95%ci)分别为18%(7%至33%)和11%(5%至19%)。接受方案1和2治疗的患者在分别为22.9个月(方案1)和18.5个月(方案2)中位生存随访时的中位总生存期(95%ci)分别为7.5(6.0至10.7)个月和8.6(6.5至9.7)个月(图6a
‑
6b)。接受方案1和2治疗的患者在12个月时的总生存率(95%ci)分别为31%(16%至48%)和33%(22%至44%)。
[0314]
预防措施
[0315]
采取预防措施以使与fgfr抑制相关的常见不良事件的风险降至最低。为了降低高磷酸盐血症的风险,所有患者均建议使用低磷酸盐饮食(每天饮食磷酸盐的摄入量为600mg至800mg)。为了减少皮肤影响的风险,建议使用不含酒精的润肤保湿霜并且避免不必要的阳光照射、肥皂、芳香产品和热水浴。为了减少指甲影响的风险,要求患者保持手指和脚趾清洁并修剪指甲。
[0316]
由于已经报告了激酶抑制剂和fgfr抑制剂的中心性严重视网膜病变(一种在暂时药物中断后可逆转的视网膜障碍),在基线对患者进行测试并且通过内部(in
‑
office)阿姆斯勒方格表(amsler grid)测试和眼科检查(包括眼底镜检查和(如果有)视相干断层扫描)对这种眼部不良事件进行常规监测。如有临床指示,则进行额外的眼科检查。
[0317]
安全性
[0318]
方案3中的所有患者报告了伴随治疗的不良事件(表14);67%为3级或4级。39名患者(39%)报告了严重的伴随治疗的不良事件(表10)。在62名患者(63%)中治疗中止的最常见原因为疾病进展。十三名患者(13%)由于伴随治疗的不良事件(包括视网膜色素上皮脱离、手足综合征、和口干以及皮肤/指甲事件,各自n=2)而中止治疗。五十五名患者(56%)
需要减少剂量;导致剂量减少的最常见伴随治疗的不良事件在16名患者(16%)中为口腔炎,在九名患者(9%)中为高磷酸盐血症。安全性曲线允许将8mg方案中在第14天未达到5.5mg/dl目标血清磷酸盐水平的41名患者的剂量上调滴定至9mg/天连续厄达替尼。在这41名患者中,24名(59%)需要≥1次剂量减少。8mg/天连续组中上调滴定至9mg/天的患者报告了与总试验群体相比,≥3级伴随治疗的不良事件的百分比相似(分别为68%和66%)。所有方案中,常见的伴随治疗的不良事件和治疗相关的不良事件均相似(表11和表12)。一名患者由于不良事件(认为与治疗无关的心肌梗塞)而死亡。表13呈现了特别感兴趣的或临床上重要的治疗相关的不良事件及其管理。解决了76%的中心性严重视网膜病变事件;所有未解决的事件均为1级或2级。
[0319]
[0320][0321]
表10:≥2%的患者报告的严重的伴随治疗的不良事件
[0322][0323]
表11:≥10%的用8mg/天连续厄达替尼治疗的患者报告的治疗相关的不良事件
[0324]
[0325][0326]
表12:≥10%的用10mg/天间歇厄达替尼和6mg/天连续厄达替尼治疗的患者报告的治疗相关的不良事件
[0327]
[0328][0329]
表13:用8mg/天连续厄达替尼(方案3)治疗的患者中特别感兴趣的或临床上重要的治疗相关的不良事件。
[0330][0331]
*中心性浆液性视网膜病变是特别感兴趣的不良事件的分组术语,包括以下各自优选的术语:视网膜脱离、玻璃体脱离、视网膜水肿、视网膜病变、脉络膜视网膜病变、视网膜色素上皮脱离、和黄斑视网膜色素上皮脱离。
[0332]
除中心性浆液性视网膜病变外的最常见眼部事件包括干眼症(19%)、视力模糊(16%)、流泪增加(11%)、以及结膜炎(9%)。
[0333]
表14:用8mg连续厄达替尼(方案3)治疗中>15%的患者报告的伴随治疗的全因性不良事件或多于1名患者≥3级。
[0334][0335]
被认为是特别感兴趣的/临床上重要的治疗相关的不良事件是高磷酸盐血症、皮肤影响、指甲影响、以及眼障碍,包括中心性浆液性视网膜病变(csr)和其他非csr的眼部事件(表13)。用8mg/天连续厄达替尼治疗的患者中,73%、49%、和52%的患者分别报告了治疗相关的高磷酸盐血症、对皮肤有影响和对指甲有影响。多数事件为轻度至中度。在此组患者中,最常见的治疗相关的对皮肤的影响是皮肤干燥(32%)和手足综合征(22%),并且最常见的治疗相关的对指甲的影响是甲营养不良和甲脱离(各16%)。总体上,63%用8mg/天连续厄达替尼治疗的患者和54%总体上经历了一些眼障碍类型(无论是否被认为与治疗相关)的患者。患有眼障碍的患者(n=62)中,大多数(n=52,84%)经历了1级或2级事件。二十一名接受了8mg/天连续厄达替尼的患者(21%)患有治疗相关的csr(一种优选的术语,包括脉络膜视网膜病变、视网膜脱离、和视网膜色素上皮脱离);这些患者中仅有三名(3%)出现
≥3级事件。大多数患有csr事件的患者能够在剂量中断或减少的管理后继续治疗。csr导致三名患者中止治疗;没有患者出现视网膜静脉或动脉闭塞。
[0336]
不良事件的管理
[0337]
通过剂量中断(23%)、剂量减少(9%)、以及在医疗保证时用磷酸盐粘合剂治疗来管理高磷酸盐血症,这是最常见的治疗相关的不良事件(表11、12和14)。磷酸盐上升通常在开始施用厄达替尼后6周达到峰值,并在第5周期归一化。一名患者由于1级高磷酸盐血症中止治疗。用另外的局部软膏(如乳酸铵、水杨酸或氧化锌霜剂)管理皮肤干燥。用局部指甲增强剂管理指甲影响,并且将抗生素或硝酸银用于严重病例。
[0338]
讨论
[0339]
此研究达成了其主要目的,用8mg/天连续厄达替尼治疗后具有40%确认的orr,这证明了在患有局部晚期以及不可切除的/转移性尿路上皮癌的、具有某些fgfr遗传改变的患者中与目前可用的治疗选项相比的抗肿瘤活性。对厄达替尼的响应是快速的,并且不依赖于先前疗法线数量和类型、内脏转移的存在、或肿瘤位置。
[0340]
重要地,中位无进展生存期和完全生存期分别为5.5个月(图5a)和13.8个月(图5b),包括具有内脏转移和不良肾功能、在多线疗法期间或之后有进展的患者。如方案所允许的,13名患者在出现进展后继续治疗,该进展是在靶病灶处的有限进展或小的新病灶出现,同时患者被评估为具有持续的临床益处。安全性曲线允许8mg连续每天给药,通过血清磷酸盐水平的指导上调滴定至9mg每天给药。上调滴定并未增加不良事件的严重程度,因为两个组中≥3级事件的百分比是相似的。77%的患者(方案3)报告了高磷酸盐血症(一种已知的fgfr抑制剂类作用),并且其通常是可管理并且可逆的。眼部事件(如中心性浆液性视网膜病变)是已知的丝裂原活化蛋白激酶途径抑制剂类作用。虽然眼部不良事件常见于厄达替尼治疗,但是这些事件多数为轻度至中度,并且用剂量中断或减少解决。
[0341]
具有fgfr突变或融合的患者很少会对免疫疗法产生响应。在我们的研究中,仅有1/22(5%)的患者对先前免疫疗法产生了响应,并且那些患者中59%在免疫疗法失败后对厄达替尼产生了响应。在罗加替尼的研究中也注意到了此观察结果,其中9/10(90%)的患者在先前免疫疗法后出现疾病进展,并且30%对罗加替尼产生了响应
[0342]
这些结果指示全fgfr抑制剂厄达替尼在患有具有fgfr改变的晚期尿路上皮癌的患者中具有可测量的益处。
[0343]
实例2:药效动力学和药代动力学
[0344]
药效动力学
[0345]
心脏电生理学
[0346]
基于187名患有癌症的患者中的开放标签、剂量递增和剂量扩增的研究中对qtc间隔的评估,厄达替尼对qtc间隔没有大影响(即,>20ms)。
[0347]
血清磷酸盐
[0348]
由于fgfr抑制,厄达替尼增加了血清磷酸盐水平。在周期早期中应该将厄达替尼增加至最大建议剂量并且连续每天给药以实现5.5
‑
7.0mg/dl的目标血清磷酸盐水平
[0349]
在厄达替尼临床试验中,禁止使用可以增加血清磷酸盐水平的药物(如磷酸钾补充剂、维他命d补充剂、抗酸药、含磷酸盐的灌肠剂或泻药、以及已知含有磷酸盐作为赋形剂的药物),除非没有替代品。为管理磷酸盐升高,允许使用磷酸盐粘合剂。在基于血清磷酸盐
水平的初始剂量增加期之前,避免与能改变血清磷酸盐水平的药剂同时使用。
[0350]
药代动力学
[0351]
8mg每天一次施用后,平均(变异系数[cv%])厄达替尼稳态最大观察到的血浆浓度(cmax)、曲线下面积(auctau)、和最小观察到的血浆浓度(cmin)分别为1399ng/ml(51%)、29268ng
·
h/ml(60%)、和936ng/ml(65%)。
[0352]
单一和重复每天一次给药后,厄达替尼暴露(观察到的最大血浆浓度[cmax]和血浆浓度时间曲线下面积[auc])在0.5至12mg的剂量范围内成比例增加(最大批准建议剂量的0.06至1.3倍)。每天一次给药持续2周后实现稳态,并且平均累积率是4倍。
[0353]
吸收
[0354]
实现峰血浆浓度的中位时间(tmax)为2.5小时(范围:2至6小时)。
[0355]
食物的效果
[0356]
施用高脂肪和高卡路里食物(800卡路里至1,000卡路里,其中食物的总卡路里含量中有大约50%来自脂肪)后,未在健康受试者中观察到厄达替尼药代动力学的临床上有意义的差异。
[0357]
分布
[0358]
厄达替尼在患者中的平均表观分布容积为29l。
[0359]
厄达替尼在患者中的蛋白质(主要是与α
‑1‑
酸性糖蛋白)结合率为99.8%。
[0360]
消除
[0361]
厄达替尼在患者中的平均总表观清除率(cl/f)为0.362l/h。
[0362]
厄达替尼在患者中的平均有效半衰期为59小时。
[0363]
代谢
[0364]
厄达替尼主要通过cyp2c9和cyp3a4代谢。cyp2c9和cyp3a4对于厄达替尼的总清除率的贡献分别估计为39%和20%。未改变的厄达替尼是血浆中的主要药物相关部分,不存在循环代谢产物。
[0365]
排泄
[0366]
放射性标记的厄达替尼的单一口服剂量后,大约69%的剂量在粪便中恢复(19%未改变)而19%的剂量在尿液中恢复(13%未改变)。
[0367]
特定群体
[0368]
基于年龄(21
‑
88岁)、性别、种族、体重(36
‑
132kg)、轻度(egfr[估计的肾小球滤过率,使用肾脏疾病饮食修正方程]60至89ml/min/1.73m2)或中度(egfr 30
‑
59ml/min/1.73m2)肾损害或轻度肝损害(总胆红素≤uln和ast>uln,或总胆红素>1.0
‑
1.5xuln和任何ast),未观察到厄达替尼的药代动力学的临床上有意义的趋势。
[0369]
厄达替尼在患有重度肾损害、需要透析的肾损害、中度或重度肝损害的患者中的药代动力学是未知的。
[0370]
实例3:药物相互作用
[0371]
其他药物对厄达替尼的作用
[0372]
1.强cyp2c9或cyp3a4抑制剂
[0373]
临床影响
[0374]
·
厄达替尼与强cyp2c9或cyp3a4抑制剂的共施用增加了厄达替尼血浆浓度;
[0375]
·
增加的厄达替尼血浆浓度可能导致增加的药物相关毒性。
[0376]
临床管理
[0377]
·
在厄达替尼治疗期间考虑了强cyp2c9或cyp3a4抑制剂之外的可替代疗法。
[0378]
·
如果与强cyp2c9或cyp3a4抑制剂的共施用是不可避免的,则密切监测不良反应并且相应地考虑进行剂量修正。如果中止使用强抑制剂,不存在药物相关毒性时可以增加厄达替尼的剂量。
[0379]
2.强cyp2c9或cyp3a4诱导剂
[0380]
临床影响
[0381]
·
厄达替尼与强cyp2c9或cyp3a4诱导剂的共施用可以显著降低厄达替尼血浆浓度。
[0382]
·
降低的厄达替尼血浆浓度可能导致活性降低。
[0383]
临床管理
[0384]
·
避免强cyp2c9或cyp3a4诱导剂与厄达替尼的共施用。
[0385]
3.中度cyp2c9或cyp3a4诱导剂
[0386]
临床影响
[0387]
·
厄达替尼与中度cyp2c9或cyp3a4诱导剂的共施用可以降低厄达替尼血浆浓度。
[0388]
·
降低的厄达替尼血浆浓度可能导致活性降低。
[0389]
临床管理
[0390]
·
如果中度cyp2c9或cyp3a4诱导剂必须在厄达替尼治疗开始时共施用,则如建议的施用厄达替尼(8mg每天一次,并且基于第14至21天的血清磷酸盐水平以及耐受性可能增加至9mg每天一次)。
[0391]
·
如果中度cyp2c9或cyp3a4诱导剂必须在基于血清磷酸盐水平和耐受性的初始剂量增加期之后共施用,则将厄达替尼的剂量增加至9mg。
[0392]
·
当中止使用中度cyp2c9或cyp3a4诱导剂时,不存在药物相关毒性时以相同剂量继续施用厄达替尼。
[0393]
4.血清磷酸盐水平变更剂
[0394]
临床影响
[0395]
·
厄达替尼与其他血清磷酸盐水平变更剂的共施用可能增加或降低血清磷酸盐水平。
[0396]
·
由于血清磷酸盐水平变更剂(除厄达替尼之外)导致的血清磷酸盐水平改变可能对基于血清磷酸盐水平确定增加的初始剂量所需的血清磷酸盐水平造成干扰。
[0397]
临床管理
[0398]
·
避免在基于血清磷酸盐水平的初始剂量增加期(第14至21天)之前将血清磷酸盐水平变更剂与厄达替尼共施用。
[0399]
厄达替尼对其他药物的作用
[0400]
1.cyp3a4底物
[0401]
临床影响
[0402]
·
厄达替尼与cyp3a4底物的共施用可能改变cyp3a4底物的血浆浓度
[0403]
·
改变的cyp3a4底物的血浆浓度可能导致cyp3a4底物丧失活性或毒性增加。
[0404]
临床管理
[0405]
·
避免将厄达替尼与具有窄治疗指数的敏感性cyp3a4底物共施用。
[0406]
2.oct2底物
[0407]
临床影响
[0408]
·
厄达替尼与oct2底物的共施用可能增加oct2底物的血浆浓度;
[0409]
·
增加的oct2底物的血浆浓度可能导致oct2底物的毒性增加。
[0410]
临床管理
[0411]
·
考虑除oct2底物之外的可替代疗法,或基于耐受性考虑减少oct2底物(例如,二甲双胍)的剂量。
[0412]
3.p
‑
糖蛋白(p
‑
gp)底物
[0413]
临床影响
[0414]
·
厄达替尼与p
‑
gp底物的共施用可能增加p
‑
gp底物的血浆浓度;
[0415]
·
增加的p
‑
gp底物的血浆浓度可能导致p
‑
gp底物的毒性增加。
[0416]
临床管理
[0417]
·
如果厄达替尼与p
‑
gp底物的共施用是不可避免的,则在施用具有窄治疗指数的p
‑
gp底物之前或之后间隔至少6小时施用厄达替尼。
[0418]
实例4:最终fda批准的药物产品标签
[0419]
包含厄达替尼的药物产品用于治疗成人患者,该成人患者患有局部晚期或转移性尿路上皮癌,其具有
[0420]
·
易感的fgfr3或fgfr2遗传改变,并且
[0421]
·
在至少一线的先前含铂化学疗法期间或之后,包括在新辅助的或辅助的含铂化学疗法的12个月内有进展
[0422]
根据以下标签:
[0423]
[0424][0425]
完整处方信息
[0426]
1适应症和剂量
[0427]
balversa
tm
适用于治疗如下成人患者,该成人患者患有局部晚期或转移性尿路上皮癌(muc),其具有
[0428]
·
易感的fgfr3或fgfr2遗传改变,并且
[0429]
·
在至少一线的先前含铂化学疗法期间或之后,包括在新辅助的或辅助的含铂化学疗法的12个月内有进展。
[0430]
基于fda
‑
批准的用于balversa的搭配诊断,选择患者进行治疗[参见剂量和施用(2.1)和临床研究(14)]。
[0431]
此适应症是在基于肿瘤缓解率的加速批准下获准的。此适应症的继续批准可能取决于验证性试验中对临床益处的验证和描述[参见临床研究(14)]。
[0432]
2剂量和施用
[0433]
2.1患者选择
[0434]
基于如fda批准的搭配诊断所检测的肿瘤样品中易感的fgfr遗传改变的存在,针对用balversa治疗局部晚期或转移性尿路上皮癌选择患者[参见临床研究(14.1)]。
[0435]
关于检测尿路上皮癌中fgfr遗传改变的fda批准的测试的信息可获得自:http://www.fda.gov/companiondiagnostics。
[0436]
2.2建议的剂量和方案
[0437]
建议的balversa起始剂量为8mg(两片4mg片剂)口服每天一次,基于14至21天的血清磷酸盐(po4)水平和耐受性可将剂量增加至9mg(三片3mg片剂)每天一次[参见剂量和施用(2.3)]。
[0438]
随食物或不随食物整片吞下片剂。如果服用balversa后在任何时间出现呕吐,下一剂量应在第二天服用。治疗应当继续,直到疾病进展或出现不可接受的毒性。
[0439]
如果漏服了一剂balversa,可以在同一天尽快服用。第二天恢复balversa的正常每日剂量方案。不应服用额外的片剂来弥补漏服的剂量。
[0440]
基于血清磷酸盐水平增加剂量
[0441]
在治疗开始后的14至21天评估血清磷酸盐水平。如果血清磷酸盐水平<5.5mg/dl并且未出现眼部障碍或2级或更严重的不良反应,则将balversa的剂量增加至9mg每天一次。每月针对高磷酸盐血症监测磷酸盐水平[参见药效动力学(12.2)]。
[0442]
2.3针对不良反应的剂量修正
[0443]
针对不良反应的建议的剂量修正列于表1中。
[0444]
表1:balversa剂量减少方案
[0445][0446]
表2汇总了在管理特定不良反应中针对剂量中断、剂量减少、或中止balversa的建议。
[0447]
表2:针对不良反应的剂量修正
[0448][0449][0450]
a
使用根据美国国家癌症研究所不良事件通用术语标准(nci ctcaev4.03)对剂量调整进行分级。
[0451]
3剂型和规格
[0452]
片剂:
[0453]
·
3mg:黄色,圆形双凸面,薄膜包衣,一面有“3”样凹陷;并且另一面有“ef”样凹陷。
[0454]
·
4mg:橙色,圆形双凸面,薄膜包衣,一面有“4”样凹陷;并且另一面有“ef”样凹陷。
[0455]
·
5mg:棕色,圆形双凸面,薄膜包衣,一面有“5”样凹陷;并且另一面有“ef”样凹陷。
[0456]
4禁忌
[0457]
无
[0458]
5警告和注意事项
[0459]
5.1眼部障碍
[0460]
balversa可导致眼部障碍,包括造成视野缺损的中心性浆液性视网膜病变/视网膜色素上皮脱离(csr/rped)。
[0461]
用balversa治疗的患者中有25%报告了csr/rped,其初次发作的中位时间为50天。患者中有3%报告了累及中央视野的3级csr/rped。研究截至时,13%的患者解决了csr/rped,13%的患者仍经历csr/rped。csr/rped在9%和14%的患者中分别导致了剂量中断和剂量减少,并且3%的患者中止了balversa。
[0462]
用balversa治疗期间,28%的患者出现了干眼症状,并且6%的患者出现了3级干眼症状。所有患者应根据需要接受干眼症的预防(使用眼部缓和剂)。
[0463]
治疗的前4个月期间每月进行眼科检查,随后每3个月检查一次,并且在出现视觉症状的任何时候紧急进行检查。眼科检查应该包括视敏度评估、裂隙灯检查、眼底镜检查、和光学相干断层成像术。
[0464]
当发生csr时暂停balversa,并且如果在4周内csr未解决或严重程度为4级则永久中止balversa。对于眼部不良反应,遵循剂量修正指南[参见剂量和施用(2.3)]。
[0465]
5.2高磷酸盐血症
[0466]
磷酸盐水平增加是balversa的药效动力学作用[参见药效动力学(12.2)]。用balversa治疗的患者中有76%报告高磷酸盐血症为不良反应。任何等级的高磷酸盐血症事件的中位发作时间为开始balversa后的20天(范围:8
‑
116)。32%的患者在用balversa治疗期间接受了磷酸盐粘合剂。
[0467]
监测高磷酸盐血症并且在需要时遵循剂量修正指南[参见剂量和施用(2.2,2.3)]。
[0468]
5.3胚胎
‑
胎儿毒性
[0469]
基于作用机制和动物繁殖研究中的发现。当向孕妇施用时,balversa可能对胎儿造成伤害。在胚胎
‑
胎儿毒性研究中,在器官发生期间向妊娠大鼠口服施用厄达替尼,在母体暴露量小于基于曲线下面积(auc)的最大人类建议剂量下的人类暴露量时,可导致畸形和胚胎
‑
胎儿死亡。告知孕妇对胎儿的潜在风险。建议具有生殖潜能的女性患者在用balversa治疗期间和最后一剂后一个月使用有效避孕措施。建议拥有具有生殖潜能的女性伴侣的男性患者在用balversa治疗期间和最后一剂后的一个月使用有效避孕措施[参见在
特定群体中的使用(8.1,83)和临床药理学(12.1)]。
[0470]
6不良反应
[0471]
以下严重不良反应在标签的其他部分也有描述:
[0472]
·
眼部障碍[参见警告和注意事项(5.1)]。
[0473]
·
高磷酸盐血症[参见警告和注意事项(5.2)]。
[0474]
6.1临床试验经验
[0475]
因为临床试验是在差异巨大的条件下进行的,在药物临床试验中观察到的不良反应率不能与另一药物的临床试验中的不良反应率直接比较,并且可能无法反映在实践中观察到的不良反应率。
[0476]
在包括患有局部晚期或转移性尿路上皮癌的87名患者的blc2001研究中,对balversa的安全性进行评估,该局部晚期或转移性尿路上皮癌具有易感的fgfr3或fgfr2遗传改变并且在至少一线的先前含铂化学疗法期间或之后(包括在新辅助或辅助的含铂化学疗法的12个月内)有进展[参见临床研究(14.1)]。用balversa(8mg口服每天一次)治疗患者;将在第1周期的第14天磷酸盐水平<5.5mg/dl的患者的剂量增加至9mg。中位治疗持续时间为5.3个月(范围:0至17个月)。
[0477]
最常见的不良反应(ar)、包括实验室异常(≥20%)是磷酸盐增加、口腔炎、疲劳、肌酐增加、腹泻、口干、甲脱离、丙氨酸转氨酶增加、碱性磷酸酶增加、钠减少、食欲下降、白蛋白减少、味觉障碍、血红蛋白减少、皮肤干燥、天冬氨酸转氨酶增加、镁减少、干眼症、脱发、掌跖红斑感觉丧失性综合征、便秘、磷酸盐减少、腹部疼痛、钙增加、恶心、和肌骨骼疼痛。最常见的3级或更严重ar(>1%)是口腔炎、甲营养不良、掌跖红斑感觉丧失性综合征、甲沟炎、指甲病、角膜炎、甲脱离、和高磷酸盐血症。
[0478]
在1%的患者中造成致死结果的不良反应是急性心肌梗塞。
[0479]
41%的患者中发生严重不良反应,包括眼障碍(10%)。
[0480]
13%的患者由于不良反应而永久中止。导致永久中止的最常见原因包括眼障碍(6%)。
[0481]
68%的患者发生剂量中断。最常见的需要剂量中断的不良反应包括高磷酸盐血症(24%)、口腔炎(17%)、眼障碍(17%)、和掌跖红斑感觉丧失性综合征(8%)。
[0482]
53%的患者发生剂量减少。最常见的导致剂量减少的不良反应包括眼障碍(23%)、口腔炎(15%)、高磷酸盐血症(7%)、掌跖红斑感觉丧失性综合征(7%)、甲沟炎(7%)、和甲营养不良(6%)。
[0483]
表3呈现了≥10%的用8mg balversa(每天一次)治疗的患者报告的ar。
[0484]
表3:≥10%(任何等级)或≥5%(3
‑
4级)的患者报告的不良反应
[0485]
[0486][0487]
a
包括腹部疼痛、腹部不适、上腹部疼痛、和下腹部疼痛
[0488]
b
包括虚弱、疲劳、嗜睡、和不适
[0489]
c
包括甲脱离、甲折断、指甲病、甲营养不良、和甲脊
[0490]
d
包括皮肤干燥和口干燥
[0491]
e
包括干眼症、眼干燥症、角膜炎、异物感、和角膜糜烂
[0492]
r
包括呼吸困难和劳力性呼吸困难
[0493]
g
包括背痛、肌骨骼不适、肌骨骼疼痛、肌骨骼胸痛、颈痛、肢体疼痛
[0494]
h
包括体重减轻和恶病质
[0495]
表4:≥10%(任何等级)或≥5%(3
‑
4级)的患者报告的实验室异常
[0496][0497]
a
1/87的患者未进行实验室测试。
[0498]
7药物相互作用
[0499]
7.1其他药物对balversa的作用
[0500]
表5汇总了影响balversa暴露或血清磷酸盐水平及其临床管理的药物相互作用。
[0501]
表5:影响balversa的药物相互作用
[0502]
[0503][0504]
7.2balversa对其他药物的作用
[0505]
表6汇总了balversa对其他药物的作用及其临床管理。
[0506]
表6:影响其他药物的balversa药物相互作用
[0507]
[0508][0509]
8在特定群体中的使用
[0510]
8.1妊娠
[0511]
风险汇总
[0512]
基于作用机制和动物繁殖研究中的发现。当向孕妇施用时,balversa可能对胎儿造成伤害[参见临床药理学(12.1)]。没有关于孕妇使用balversa的可用数据来告知与药物相关的风险。在器官发生期间向妊娠大鼠口服施用厄达替尼,在母体暴露量小于基于auc(参见数据)的最大建议的人类剂量下的人类暴露量时,可导致畸形和胚胎
‑
胎儿死亡。告知孕妇和具有生殖潜能的女性对胎儿的潜在风险。
[0513]
对于适用群体的重大先天缺陷和流产的估算背景风险是未知的。所有妊娠均有先天缺陷、损失或其他不良后果的背景风险。在美国一般人群中,在临床上认可的妊娠中重大先天缺陷和流产的估算背景风险分别为2%
‑
4%和15%
‑
20%。
[0514]
数据
[0515]
动物数据
[0516]
在胚胎
‑
胎儿毒性研究中,在器官发生期间向妊娠大鼠口服施用厄达替尼。剂量≥4mg/kg/天(在总母体暴露量<0.1%的总人类暴露量下,基于auc的最大建议的人类剂量)产生胚胎
‑
胎儿死亡、重大血管畸形和其他血管异常、四肢畸形(缺趾、缺失或畸形长骨)、多处骨(椎骨、胸骨、肋骨)的骨骼异常发生率增加、以及胎儿体重减轻。
[0517]
8.2哺乳
[0518]
风险汇总
[0519]
没有数据证明母乳中存在厄达替尼、或厄达替尼对母乳喂养的儿童或对泌乳有作用。由于母乳喂养的儿童有可能对厄达替尼产生严重的不良反应,建议哺乳期妇女在balversa治疗期间和最后一剂后的一个月不要进行母乳喂养。
[0520]
8.3女性和男性的生殖潜能
[0521]
妊娠测试
[0522]
建议具有生殖潜能的女性在开始balversa治疗前进行妊娠测试。
[0523]
避孕
[0524]
女性
[0525]
当向孕妇施用时,balversa可能对胎儿造成伤害。建议具有生殖潜能的女性在用balversa治疗期间和最后一剂后的一个月使用有效避孕措施[参见在特定群体中的使用
(8.1)]。
[0526]
男性
[0527]
建议拥有具有生殖潜能的女性伴侣的男性患者在用balversa治疗期间和最后一剂后的一个月使用有效避孕措施[参见在特定群体中的使用(8.1)]。
[0528]
不孕症
[0529]
女性
[0530]
基于来自动物研究的发现。balversa可能对具有生殖潜能的女性的生育能力造成损害[参见非临床毒理学(13.1)]。
[0531]
8.4儿童患者用药
[0532]
balversa在儿童患者中的安全性和有效性尚未确定。
[0533]
在大鼠和狗中进行4周和13周的重复剂量毒理学研究,在暴露量小于最大建议的人类剂量下的人类暴露量(auc)时在骨骼和牙齿中观察到了毒性。在两个物种的多处骨骼中均报告了软骨样发育异常/组织变形,并且牙齿异常包括异常的不规则凹痕(大鼠和狗中),以及成牙本质细胞变色和退化(大鼠中)。
[0534]
8.5老年患者用药
[0535]
在临床研究中的416名用balversa治疗的患者中,45%是65岁或以上,并且12%是75岁或以上。在这些患者和更年轻患者之间未观察到安全性或有效性的总体差异[参见临床研究(14)]。
[0536]
8.6cyp2c9弱代谢者
[0537]
cyp2c9*3/*3基因型:具有cyp2c9*3/*3基因型的患者中厄达替尼血浆浓度预计会更高。监测已知具有或疑似具有cyp2c9*3/*3基因型的患者中不良反应的增加[参见药物基因组学(12.5)]。
[0538]
11描述
[0539]
厄达替尼(balversa中的活性成分)是激酶抑制剂。化学名称为n
‑
(3,5
‑
二甲氧基苯基)
‑
n
’‑
(1
‑
甲基乙基)
‑
n
‑
[3
‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)喹喔啉
‑6‑
基]乙烷
‑
1,2
‑
二胺。厄达替尼是黄色粉末。它在有机溶剂中是几乎不溶的、或不可溶至易溶的,并且在ph值范围很广的水介质中是微溶至几乎不溶的、或不溶的。分子式为c
25
h
30
n6o2,并且分子量为446.56。
[0540]
厄达替尼的化学结构如下:
[0541][0542]
balversa(厄达替尼)以3mg、4mg或5mg薄膜包衣片剂的形式提供以用于口服施用,并且含有以下非活性成分:
[0543]
片剂核心:交联羧甲基纤维素钠、硬脂酸镁(来自植物来源)、甘露醇、葡甲胺、和微晶纤维素。
[0544]
薄膜包衣:(欧巴代amb ii):i型甘油单癸酰基癸酸酯、部分水解的聚乙烯醇、月桂基硫酸钠、滑石、二氧化钛、氧化铁黄、氧化铁红(仅限橙色和棕色片剂)、四氧化三铁/氧化
铁黑(仅限棕色片剂)。
[0545]
12临床药理学
[0546]
12.1作用机制
[0547]
厄达替尼是激酶抑制剂,并且基于体外数据厄达替尼结合至fgfr1、fgfr2、fgfr3和fgfr4并且抑制其酶活性。厄达替尼还结合至ret、csf1r、pdgfra、pdgfrb、flt4、kit、和vegfr2。厄达替尼抑制了fgfr的磷酸化和信号传导,并且降低了表达fgfr遗传改变的细胞系的细胞活力(包括点突变、扩增、和融合)。厄达替尼在表达fgfr的细胞系和衍生自肿瘤类型(包括膀胱癌)的异种移植物模型中展示出了抗肿瘤活性。
[0548]
12.2药效动力学
[0549]
心脏电生理学
[0550]
基于187名患有癌症的患者中的开放标签、剂量递增和剂量扩增的研究中对qtc间隔的评估,厄达替尼对qtc间隔没有大影响(即,>20ms)。
[0551]
血清磷酸盐
[0552]
由于fgfr抑制,厄达替尼增加了血清磷酸盐水平。在周期早期中应该将balversa增加至最大建议剂量并且连续每天给药以实现5.5
‑
7.0mg/dl的目标血清磷酸盐水平[参见剂量和施用(2.3)]。
[0553]
在厄达替尼临床试验中,禁止使用可以增加血清磷酸盐水平的药物(如磷酸钾补充剂、维他命d补充剂、抗酸药、含磷酸盐的灌肠剂或泻药、以及已知含有磷酸盐作为赋形剂的药物),除非没有替代品。为管理磷酸盐升高,允许使用磷酸盐粘合剂。在基于血清磷酸盐水平的初始剂量增加期之前,避免与能改变血清磷酸盐水平的药剂同时使用[参见药物相互作用(7.1)]。
[0554]
12.3药代动力学
[0555]
8mg每天一次施用后,平均(变异系数[cv%])厄达替尼稳态最大观察到的血浆浓度(c
max
)、曲线下面积(auc
tau
)、和最小观察到的血浆浓度(c
min
)分别为1,399ng/ml(51%)、29,268ng
·
h/ml(60%)、和936ng/ml(65%)。
[0556]
单一和重复每天一次给药后,厄达替尼暴露(观察到的最大血浆浓度[cmax]和血浆浓度时间曲线下面积[auc])在0.5至12mg的剂量范围内成比例增加(最大批准建议剂量的0.06至1.3倍)。每天一次给药持续2周后实现稳态,并且平均累积率是4倍。
[0557]
吸收
[0558]
实现峰血浆浓度的中位时间(t
max
)为2.5小时(范围:2至6小时)。
[0559]
食物的效果
[0560]
施用高脂肪和高卡路里食物(800卡路里至1,000卡路里,其中食物的总卡路里含量中有大约50%来自脂肪)后,未在健康受试者中观察到厄达替尼药代动力学的临床上有意义的差异。
[0561]
分布
[0562]
厄达替尼在患者中的平均表观分布容积为29l。
[0563]
厄达替尼在患者中的蛋白质(主要是与α
‑1‑
酸性糖蛋白)结合率为99.8%。
[0564]
消除
[0565]
厄达替尼在患者中的平均总表观清除率(cl/f)为0.362l/h。
[0566]
厄达替尼在患者中的平均有效半衰期为59小时。
[0567]
代谢
[0568]
厄达替尼主要通过cyp2c9和cyp3a4代谢。cyp2c9和cyp3a4对于厄达替尼的总清除率的贡献分别估计为39%和20%。未改变的厄达替尼是血浆中的主要药物相关部分,不存在循环代谢产物。
[0569]
排泄
[0570]
放射性标记的厄达替尼的单一口服剂量后,大约69%的剂量在粪便中恢复(19%未改变)而19%的剂量在尿液中恢复(13%未改变)。
[0571]
特定群体
[0572]
基于年龄(21
‑
88岁)、性别、种族、体重(36
‑
132kg)、轻度(egfr[估计的肾小球滤过率,使用肾脏疾病饮食修正方程]60至89ml/min/1.73m2)或中度(egfr 30
‑
59ml/min/1.73m2)肾损害或轻度肝损害(总胆红素≤uln和ast>uln,或总胆红素>1.0
‑
1.5x uln和任何ast),未观察到厄达替尼的药代动力学的临床上有意义的趋势。
[0573]
厄达替尼在患有重度肾损害、需要透析的肾损害、中度或重度肝损害的患者中的药代动力学是未知的。
[0574]
药物相互作用研究
[0575]
临床研究和基于模型的方法
[0576]
强cyp2c9抑制剂:
[0577]
相对于仅施用厄达替尼,当与氟康唑(一种强cyp2c9抑制剂和中度cyp3a4抑制剂)共施用时,厄达替尼平均比率(90%ci)对c
max
和auc
inf
分别为121%(99.9,147)和148%(120,182)。
[0578]
强cyp3a4抑制剂:
[0579]
相对于仅施用厄达替尼,当与伊曲康唑(一种强cyp3a4抑制剂和p
‑
gp抑制剂)共施用时,厄达替尼平均比率(90%ci)对c
max
和auc
inf
分别为105%(86.7,127)和134%(109,164)。
[0580]
强cyp3a4/2c9诱导剂:
[0581]
模拟显示利福平(一种强cyp3a4/2c9诱导剂)可以显著降低厄达替尼的c
max
和auc。
[0582]
体外研究
[0583]
cyp底物:
[0584]
厄达替尼是cyp3a4的时间依赖性抑制剂和诱导剂。厄达替尼对敏感性cyp3a4底物的作用是未知的。在临床相关浓度下,厄达替尼不是其他主要cyp同工酶的抑制剂。
[0585]
转运体:
[0586]
厄达替尼是p
‑
gp的底物和抑制剂。p
‑
gp抑制剂预计不会以临床相关的程度影响厄达替尼暴露。厄达替尼是oct2的抑制剂。
[0587]
在临床相关浓度下,厄达替尼不抑制bcrp、oatp1b、oatp1b3、oat1、oat3、oct1、mate
‑
1、或mate
‑
2k。
[0588]
降酸剂:
[0589]
厄达替尼在ph为1至7.4的范围内具有足够的溶解性。降酸剂(例如,抗酸药、h2拮抗剂、质子泵抑制剂)预计不会影响厄达替尼的生物利用度。
[0590]
12.5药物基因组学
[0591]
cyp2c9活性在具有基因变体(如cyp2c9*2和cyp2c9*3多态性)的个体中减弱。厄达替尼暴露在具有cyp2c9*1/*2和*1/*3基因型的受试者中与在具有cyp2c9*1/*1基因型(野生型)的受试者中相似。未获得通过其他基因型(例如,*2/*2、*2/*3、*3/*3)表征的受试者的数据。模拟显示具有cyp2c9*2/*2和*2/*3基因型的受试者中的厄达替尼暴露没有临床上有意义的差异。具有cyp2c9*3/*3基因型的受试者中,厄达替尼的暴露预计会高出50%,据估计在不同种族群体中占到0.4%至3%。
[0592]
13非临床毒理学
[0593]
13.1致癌作用、诱发突变、和生育能力损害
[0594]
未对厄达替尼进行致癌作用研究。
[0595]
厄达替尼在细菌的回复突变(ames)测定中不诱发突变,并且在体外微核或体内大鼠骨髓微核测定中不致使染色体断裂。
[0596]
未在动物中对厄达替尼进行生育研究。在3个月的重复剂量毒性研究中,在暴露量小于最大建议的人类剂量下的人类暴露量(auc)时,厄达替尼在大鼠中显示出了对雌性生殖器的作用(卵黄体坏死)。
[0597]
14临床研究
[0598]
14.1具有易感的fgfr遗传改变的尿路上皮癌
[0599]
blc2001研究(nct 02365597)是多中心、开放标签的单组研究,以评估balversa在患有局部晚期或转移性尿路上皮癌(muc)的患者中的功效和安全性。通过临床试验测定(cta)确定了用于筛选和患者招募的成纤维细胞生长因子受体(fgfr)突变状态。功效群体由一组八十七名被纳入本研究的患有如下疾病的患者组成,该疾病在至少一次先前化学疗法期间或之后有进展,并且具有至少1种以下遗传改变:fgfr3基因突变(r248c、s249c、g370c、y373c)或fgfr基因融合(fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7),如通过在中心实验室进行的cta所确定的。通过qiagenfgfr rgq rt
‑
pcr试剂盒(fda批准的用于为balversa选择muc患者的测试)对来自69名患者的肿瘤样品进行了回顾性测试。
[0600]
患者接受的balversa的起始剂量为8mg每天一次,将在第14天和第17天之间将血清磷酸盐水平低于5.5mg/dl的目标的患者的剂量增加至9mg每天一次;41%的患者发生剂量增加。施用balversa,直到疾病进展或出现不可接受的毒性。主要功效结果测量指标是如盲法独立审查委员会(birc)根据recist v1.1所确定的客观缓解率(orr)和缓解持续时间(dor)。
[0601]
中位年龄为67岁(范围:36至87岁),79%是男性,并且74%是高加索人。大多数患者(92%)的基线东部肿瘤协作组(ecog)体能状态为0或1。66%的患者具有内脏转移。八十七名(97%)患者先前接受了至少一次顺铂或卡铂。56%的患者仅接受了先前基于顺铂的方案,29%仅接受了先前基于卡铂的方案,和10%接受了基于顺铂和基于卡铂的方案。三名(3%)患者在仅进行先前含铂的新辅助或辅助疗法后出现疾病进展。24%的患者已经用先前抗pd
‑
l1/pd
‑
1疗法治疗过。
[0602]
功效结果汇总于表7和表8中。总缓解率为32.2%。响应者包括之前未对抗pd
‑
l1/pd
‑
1疗法产生响应的患者。
[0603]
表7:功效结果
[0604][0605]
a birc:盲法独立审查委员会
[0606]
orr=cr pr
[0607]
ci=置信区间
[0608]
表8:fgfr遗传改变的功效结果
[0609] birc
a
评估fgfr3点突变n=64orr(95%ci)40.6%(28.6,52.7)fgfr3融合
b,c
n=18orr(95%ci)11.1%(0,25.6)fgfr2融合
c
n=6orr0
[0610]
a birc:盲法独立审查委员会
[0611]
b
响应者均具有fgfr3
‑
tacc3_v1融合
[0612]
c
在以上fgfr2融合和fgfr3融合中均报告了一名具有fgfr2
‑
casp7/fgfr3
‑
tacc3_v3融合的患者
[0613]
orr=cr pr
[0614]
ci=置信区间
[0615]
16如何供应/储存和处理
[0616]
balversa
tm
(厄达替尼)片剂的可用规格和包装如下所列:
[0617]
·
3mg片剂:黄色,圆形双凸面,薄膜包衣,一面有“3”样凹陷,并且另一面有“ef”样凹陷。
[0618]
‑
56片瓶装,带有防儿童闭合件(ndc 59676
‑
030
‑
56)。
[0619]
‑
84片瓶装,带有防儿童闭合件(ndc 59676
‑
030
‑
84)。
[0620]
‑
56片盒装(ndc 59676
‑
030
‑
55),包含两个剂量的皮夹式包装(各28片)(ndc 59676
‑
030
‑
22)。
[0621]
‑
84片盒装(ndc 59676
‑
030
‑
88),包含两个剂量的皮夹式包装(各42片)(ndc 59676
‑
030
‑
44)。
[0622]
·
4mg片剂:橙色,圆形双凸面,薄膜包衣,一面有“4”样凹陷,并且另一面有“ef”样凹陷。
[0623]
‑
28片瓶装,带有防儿童闭合件(ndc 59676
‑
040
‑
28)。
[0624]
‑
56片瓶装,带有防儿童闭合件(ndc 59676
‑
040
‑
56)。
[0625]
‑
14片盒装,包含一个基本皮夹式包装(ndc 59676
‑
040
‑
14)。
[0626]
‑
28片盒装,包含一个剂量皮夹式包装(ndc 59676
‑
040
‑
22)。
[0627]
‑
56片盒装(ndc 59676
‑
040
‑
55),包含两个剂量的皮夹式包装(各28片)(ndc 59676
‑
040
‑
22)。
[0628]
·
5mg片剂:棕色,圆形双凸面,薄膜包衣,一面有“5”样凹陷,并且另一面有“ef”样凹陷。
[0629]
‑
28片瓶装,带有防儿童闭合件(ndc 59676
‑
050
‑
28)。
[0630]
‑
28片盒装,包含一个剂量皮夹式包装(ndc 59676
‑
050
‑
22)。
[0631]
在20℃
‑
25℃(68
°
f
‑
77
°
f)储存:允许偏差在15℃和30℃(59
°
f和86
°
f)之间[参见usp受控室温(controlled room temperature)]。
[0632]
17患者咨询信息
[0633]
建议患者阅读fda批准的患者标签(患者信息)。
[0634]
fgfr遗传改变:告知患者肿瘤样本中易感的fgfr3或fgfr2突变或基因融合的证据对于鉴定出治疗适用的患者是关键的[参见剂量和施用(2.1)]。
[0635]
眼部障碍:建议患者在经历任何视力变化时联系其健康护理提供者[参见警告和注意事项(5.1)]。为预防或和治疗干眼症,建议患者频繁(醒时至少每2小时一次)使用人工泪液替代品、保湿或润滑眼用凝胶或软膏[参见剂量和施用(2.3)]。
[0636]
皮肤、黏膜或指甲障碍:建议患者在经历进行性或不能忍受的皮肤、黏膜或指甲障碍时联系其健康护理提供者[参见不良反应(6.1)]。
[0637]
高磷酸盐血症:告知患者其健康护理提供者将评估其在治疗开始14天和第21天之间的血清磷酸盐水平,并且如果需要将调整剂量[参见警告和注意事项(5.2)]。在这项首次磷酸盐评估期期间,建议患者避免同时使用可以改变血清磷酸盐水平的药剂。告知患者在首次磷酸盐评估期之后,应在balversa治疗期间每月针对高磷酸盐血症进行磷酸盐水平监测[参见药物相互作用(7.1)]。
[0638]
药物相互作用:建议患者告知其健康护理提供者所有同时使用的药物,包括处方药、非处方药、和草药[参见药物相互作用(7.1,7.2)]。
[0639]
给药说明:指导患者每日一次随食物或不随食物整片吞下片剂。如果服用balversa后在任何时间出现呕吐,建议患者在第二天服用下一剂量。[参见剂量和施用(2.1)]。
[0640]
漏服剂量:如果漏服了剂量,建议患者尽快服用所漏服的剂量。第二天恢复balversa的正常每日剂量方案。不应服用额外的片剂来弥补漏服的剂量[参见剂量和施用(2.3)]。
[0641]
胚胎
‑
胎儿毒性:告知孕妇和具有生殖潜能的女性对胎儿的潜在风险。建议女性告知其健康护理提供者已知的或疑似的妊娠[参见警告和注意事项(5.3)和在特定群体中的使用(8.1)]。
[0642]
建议具有生殖潜能的女性患者在治疗期间和最后一剂balversa后一个月使用有效避孕措施。建议拥有具有生殖潜能的女性伴侣的男性患者在治疗期间和最后一剂balversa后的一个月使用有效避孕措施[参见在特定群体中的使用(8.3)]。
[0643]
哺乳:不建议女性在用balversa治疗期间和最后一剂后的一个月进行母乳喂养
[参见在特定群体中的使用(8.2)]。
[0644]
瑞士产品
[0645]
[0646]
[0647]
[0648][0649]
本文所述的实例和实施例仅用作举例说明目的,并且各种修改或改变对本领域技术人员而言已有提示,这些修改或改变包括在本技术的精神和主旨以及所附权利要求书的范围内。
[0650]
应当理解,本文所述的治疗方法实施例也可以用厄达替尼用于制造药物的用途的形式或厄达替尼用于在治疗中使用的形式来表达。
[0651]
以下条款描述了本发明的主题。
[0652]
1.一种治疗尿路上皮癌的方法,该方法包括向患有尿路上皮癌的患者以一定量施用含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,该量为所述药物产品的药物产品标签中描述的量。
[0653]
2.如权利要求1所述的方法,其中该尿路上皮癌是局部晚期或转移性的。
[0654]
3.如权利要求1或2所述的方法,其中如通过客观缓解率或缓解持续时间所测量的,该fgfr抑制剂的施用提供了相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者而言改善的抗肿瘤活性。
[0655]
4.如前述权利要求中任一项所述的方法,其中该fgfr抑制剂的施用未导致超过3级的不良事件。
[0656]
5.如前述权利要求中任一项所述的方法,其中该尿路上皮癌对fgfr2遗传改变或fgfr3遗传改变易感。
[0657]
6.如权利要求5所述的方法,其中该fgfr2或fgfr3遗传改变是fgfr3基因突变,或fgfr2或fgfr3基因融合。
[0658]
7.如权利要求6所述的方法,其中该fgfr3基因突变是r248c、s249c、g370c、y373c、或其任何组合。
[0659]
8.如权利要求6所述的方法,其中该fgfr2或fgfr3基因融合是fgfr3
‑
tacc3、fgfr3
‑
baiap2l1、fgfr2
‑
bicc1、fgfr2
‑
casp7、或其任何组合。
[0660]
9.如前述权利要求中任一项所述的方法,该方法进一步包括在施用该fgfr抑制剂前,评估来自该患者的生物样品中是否存在一种或多种fgfr2或fgfr3遗传改变。
[0661]
10.如权利要求9所述的方法,其中该生物样品是血液、淋巴液、骨髓、实体瘤样品或其任何组合。
[0662]
11.如前述权利要求中任一项所述的方法,其中该患者接受了用于治疗尿路上皮癌的至少一种先前疗法。
[0663]
12.如权利要求11所述的方法,其中该用于治疗尿路上皮癌的至少一种先前疗法是含铂化学疗法。
[0664]
13.如权利要求12所述的方法,其中该尿路上皮癌在至少一线的含铂化学疗法期间或之后有进展。
[0665]
14.如权利要求13所述的方法,其中该含铂化学疗法是新辅助的含铂化学疗法或辅助的含铂化学疗法。
[0666]
15.如权利要求14所述的方法,其中该尿路上皮癌在至少一线的该新辅助的含铂化学疗法或辅助的含铂化学疗法期间或之后的12个月内有进展。
[0667]
16.如前述权利要求中任一项所述的方法,其中该fgfr抑制剂是厄达替尼。
[0668]
17.如权利要求16所述的方法,其中每天施用厄达替尼。
[0669]
18.如权利要求16或17所述的方法,其中将厄达替尼口服施用。
[0670]
19.如权利要求16至18中任一项所述的方法,其中将厄达替尼以连续每天给药方案口服施用。
[0671]
20.如权利要求16至19中任一项所述的方法,其中将厄达替尼以每天一次约8mg的剂量口服施用。
[0672]
21.如权利要求20所述的方法,其中在开始治疗后的14至21天,将厄达替尼的剂量从每天一次8mg增加至每天一次9mg,前提是:
[0673]
(a)该患者在开始治疗后的14至21天展示出的血清磷酸盐(po4)水平小于约5.5mg/dl;和
[0674]
(b)以每天一次8mg施用厄达替尼未导致眼部障碍;或
[0675]
(c)以每天一次8mg施用厄达替尼未导致2级或更严重的不良反应。
[0676]
22.如权利要求16至21中任一项所述的方法,其中厄达替尼以固体剂型存在。
[0677]
23.如权利要求22所述的方法,其中该固体剂型是片剂。
[0678]
24.如权利要求16至23中任一项所述的方法,其中厄达替尼不与以下项共施用:
[0679]
(a)强cyp2c9抑制剂或cyp3a4抑制剂药物;
[0680]
(b)强cyp2c9诱导剂或cyp3a4诱导剂药物;
[0681]
(c)中度cyp2c9诱导剂或cyp3a4诱导剂药物;或
[0682]
(d)血清磷酸盐水平变更剂药物。
[0683]
25.如权利要求16至24中任一项所述的方法,其中厄达替尼不与以下项共施用:
[0684]
(a)cyp3a4底物药物;
[0685]
(b)oct2底物药物;或
[0686]
(c)p
‑
糖蛋白(p
‑
gp)底物药物。
[0687]
26.一种治疗患者的尿路上皮癌的方法,该方法包括:
[0688]
(a)评估来自该患者的生物样品中是否存在一种或多种成纤维细胞生长因子受体(fgfr)基因改变;和
[0689]
(b)如果该样品中存在一种或多种fgfr基因改变,用一定量的含有fgfr抑制剂的批准的药物产品治疗该患者,该量为所述药物产品的药物产品标签中描述的量。
[0690]
27.一种销售包含厄达替尼的批准的药物产品的方法,所述方法包括销售此类药物产品,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。
[0691]
28.如权利要求27所述的方法,其中该药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
[0692]
29.一种许诺销售包含厄达替尼的批准的药物产品的方法,所述方法包括许诺销售此类药物产品,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。
[0693]
30.如权利要求29所述的方法,其中该药物产品是anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
[0694]
31.一种包括销售包含厄达替尼的批准的药物产品的方法,其中此类药物产品的参比制剂的药物产品标签包含客观缓解率或缓解持续时间数据。
[0695]
32.如权利要求31所述的方法,其中厄达替尼的该客观缓解率数据为约32.2%。
[0696]
33.如权利要求31所述的方法,其中厄达替尼的该缓解持续时间数据为约5.4个月。
[0697]
34.一种相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者改善患有尿路上皮癌的患者的客观缓解率或缓解持续时间的方法,所述方法包括向所述患者施用包含厄达替尼的批准的药物产品。
[0698]
35.如权利要求34所述的方法,其中该客观缓解率为约32.2%。
[0699]
36.如权利要求34所述的方法,其中该缓解持续时间为约5.4个月。
[0700]
37.如权利要求34至36中任一项所述的方法,其中该批准的药物产品是anda药物产品或补充新药申请药物产品。
[0701]
38.一种相对于未接受fgfr抑制剂治疗的患有尿路上皮癌的患者改善患有尿路上皮癌的患者的客观缓解率或缓解持续时间的方法,所述方法包括向所述患者提供包含厄达替尼的批准的药物产品。
[0702]
39.如权利要求38所述的方法,其中该客观缓解率为约32.2%。
[0703]
如权利要求38所述的方法,其中该缓解持续时间为约5.4个月。
[0704]
40.如权利要求38至40中任一项所述的方法,其中该批准的药物产品是anda药物产品或补充新药申请药物产品。
[0705]
41.如权利要求38至41中任一项所述的方法,其中此类药物产品的参比制剂的药物产品标签包括用于治疗尿路上皮癌的说明书。
[0706]
42.一种批准的药物产品,其具有至少一种批准的适应症,其中所述批准的药物产品包含厄达替尼。
[0707]
43.如权利要求43所述的批准的药物产品,其中该批准的药物产品是nda药物产品、anda药物产品、补充新药申请药物产品或505(b)(2)药物产品。
[0708]
44.如权利要求43所述的批准的药物产品,其中该批准的药物产品的参比制剂产品包括药物产品标签。
[0709]
45.如权利要求45所述的批准的药物产品,其中该药物产品标签包含客观缓解率数据。
[0710]
46.如权利要求46所述的批准的药物产品,其中厄达替尼的该客观缓解率数据为约32.2%。
[0711]
47.如权利要求45所述的批准的药物产品,其中该药物产品标签包含缓解持续时间数据。
[0712]
48.如权利要求48所述的批准的药物产品,其中厄达替尼的该缓解持续时间数据为约5.4个月。
[0713]
49.一种含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品,其用于在治疗患者的尿路上皮癌中使用,其中将该批准药物产品以所述药物产品的药物产品标签中描述的量施用。
[0714]
50.含有成纤维细胞生长因子受体(fgfr)抑制剂的批准的药物产品在制造用于治疗患者的尿路上皮癌的药物中的用途,其中将该药物以所述药物产品的药物产品标签中描述的量施用。
[0715]
51.一种包含厄达替尼的批准的药物产品,其用于治疗患有局部晚期或转移性尿路上皮癌的成人患者,该局部晚期或转移性尿路上皮癌是:
[0716]
(a)易感的fgfr3或fgfr2遗传改变,以及
[0717]
(b)在至少一线的先前含铂化学疗法期间或之后,包括在新辅助的或辅助的含铂化学疗法的12个月内有进展。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。