1.本公开涉及一种含有苯并氮杂卓化合物的冻干组合物。本文中公开的所有文件,包括以下现有技术文件(专利文献(ptl)和非专利文献(npl)),通过引用整体并入本文。
背景技术:
2.托伐普坦(tolvaptan)是一种苯并氮杂卓化合物,具有血管升压素v2受体拮抗活性,并用作利尿剂等。下式(2)显示了托伐普坦的结构式。
[0003][0004]
然而,托伐普坦水溶性差,在剂型、施用途径等方面有许多限制。托伐普坦可以施用于口服施用有困难的患者(吞咽困难的患者,或意识不清的患者),且预期药物的效果比片剂更快表现;因此,需要用于经静脉施用的托伐普坦注射制剂。然而,对水溶性差的托伐普坦的开发有难度。因此,已对溶于水的托伐普坦前药进行了研究和开发。例如,ptl1提出了一种具有优异水溶性的托伐普坦前药。
[0005]
引文列表
[0006]
专利文献
[0007]
ptl1:wo2007/074915
技术实现要素:
[0008]
技术问题
[0009]
然而,托伐普坦的前药稳定性差,并容易转变回托伐普坦。因此,本发明人试图开发稳定包含托伐普坦前药的制剂。
[0010]
解决问题的技术方案
[0011]
本发明人分析了托伐普坦前药的稳定性。他们注意到,在制备水溶液制剂如注射剂的过程中,所述前药当溶解在水中并用高压蒸汽灭菌时,降解形成水溶性差的托伐普坦,导致混浊或形成不溶性颗粒物。此外,该水溶液制剂的长期储存引起所述前药降解形成托伐普坦,导致不溶性异物沉淀或形成不溶性颗粒物。
[0012]
鉴于上述,本发明人对托伐普坦前药的稳定性进行了进一步研究,发现包含特定托伐普坦前药和二糖的组合物也许可以稳定包含该前药。发明人随后进行了进一步的改进。
[0013]
例如,本公开涵盖以下项中呈现的主题。
[0014]
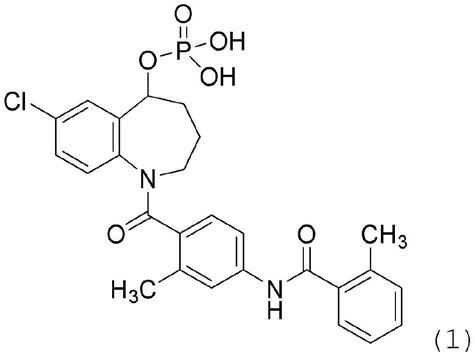
项1.一种冻干组合物,所述冻干组合物包含由式(1)表示的化合物:
[0015][0016]
或其金属盐和二糖。
[0017]
项2.根据项1所述的冻干组合物,其中所述金属盐是二钠盐。
[0018]
项3.根据项1或2所述的冻干组合物,其中所述二糖是选自蔗糖、麦芽糖、乳糖和海藻糖中的至少一种。
[0019]
项4.根据项1至3中的任一项所述的冻干组合物,其中相对于每质量份的由式(1)表示的化合物或其金属盐,所述二糖以0.5至70质量份的量存在。
[0020]
项5.根据项1至4中的任一项所述的冻干组合物,其中所述由式(1)表示的化合物或其金属盐和所述二糖的总量为全部组合物的65质量%或更多。
[0021]
项6.根据项1至5中的任一项所述的冻干组合物,所述冻干组合物还包含缓冲剂。
[0022]
项7.根据项6所述的冻干组合物,其中所述缓冲剂是磷酸盐缓冲剂。
[0023]
项8.根据项1至7中的任一项所述的冻干组合物,所述冻干组合物用于在溶解于水(优选生理盐水或葡萄糖注射液)从而构成ph为7至9的水溶液组合物后经血管施用。
[0024]
项9.一种水溶液组合物,所述水溶液组合物包含由式(1)表示的化合物:
[0025][0026]
或其金属盐和二糖,并且所述水溶液组合物具有7至9的ph。
[0027]
项10.根据项9所述的水溶液组合物,其中所述金属盐是二钠盐。
[0028]
项11.根据项9或10所述的水溶液组合物,其中所述二糖是选自蔗糖、麦芽糖、乳糖和海藻糖中的至少一种。
[0029]
项12.根据项9至11中的任一项所述的水溶液组合物,其中相对于每质量份的由式(1)表示的化合物或其金属盐,所述二糖以0.5至70质量份的量存在。
[0030]
项13.根据项9至12中的任一项所述的水溶液组合物,其中所述二糖以1w/v%至8w/v%的浓度存在。
[0031]
项14.根据项9至13中的任一项所述的水溶液组合物,所述水溶液组合物还包含缓冲剂。
[0032]
项15.根据项14所述的水溶液组合物,其中所述缓冲剂是磷酸盐缓冲剂。
[0033]
项16.根据项9至15中的任一项所述的水溶液组合物,所述水溶液组合物用于经血管施用。
[0034]
项17.根据项9至16中的任一项所述的水溶液组合物,所述水溶液组合物用于制备根据项1至8中的任一项所述的冻干组合物。
[0035]
项18.根据项1至8中的任一项所述的冻干组合物,所述冻干组合物用于制备根据项9至16中的任一项所述的水溶液组合物。
[0036]
项19.根据项1至18中的任一项所述的组合物,所述组合物是无菌的。
[0037]
项20.根据项1至19中的任一项所述的组合物,所述组合物是药物组合物。
[0038]
有利效果
[0039]
本发明提供了稳定包含特定托伐普坦前药的制剂(优选水性注射剂)。由于水性注射剂用于经血管施用,因此不允许溶液中形成的不溶性异物或不溶性颗粒物超过各国药典规定的数量。所述稳定包含托伐普坦前药的制剂特别适合作为水性注射剂,因为所述制剂即使在长期储存后也不易形成等于或大于药典中规定数量的不溶性异物或不溶性颗粒物。
附图说明
[0040]
[图1]图1是显示被制备成含有浓度为0.1w/v%的化合物(1)并经高压蒸汽灭菌(121℃,20分钟)的水溶液的稳定性评价结果的图。
[0041]
[图2]图2是显示使用不同ph的水溶液制备的化合物(1)冻干组合物的稳定性评价结果的图。
[0042]
发明详述
[0043]
本公开优选包涵,例如,包含特定托伐普坦前药的冻干组合物或水溶液组合物;然而,本公开不限于这些,并且包括本文中公开的和本领域技术人员认识的所有题材。
[0044]
本发明所包涵的冻干组合物和水溶液组合物各自包含由下式(1)表示的化合物:
[0045][0046]
或其金属盐和二糖,优选包含由式(1)表示化合物的金属盐和二糖。所述由式(1)表示的化合物有时被称为“化合物(1)”。此外,各自包含化合物(1)或其盐和二糖的所述冻干组合物和所述水溶液组合物有时被分别称为“本公开的冻干组合物”和“本公开的水溶液组合物”。它们有时被统称为“本公开的组合物”。优选本公开的冻干组合物通过冻干本公开的水溶液组合物来制备。进一步优选本公开的水溶液组合物通过用水重构本公开的冻干组合物来制备。本公开的冻干组合物优选是饼状组合物。
[0047]
化合物(1)或其金属盐充当特定的托伐普坦前药,包含在本公开的冻干组合物或水溶液组合物中。特别地,所述特定的托伐普坦前药优选是化合物(1)的金属盐。
[0048]
所述化合物(1)的金属盐优选是碱金属盐、碱土金属盐或锌盐。更具体地,例如,优选钠盐(单钠盐或二钠盐)、钾盐(单钾盐或二钾盐)、钙盐、镁盐、锌盐等。其中,特别优选二钠盐。下面是化合物(1)的二钠盐的结构式。
[0049][0050]
化合物(1)或其金属盐可以通过已知方法或从已知方法容易想到的方法制备。例如,它们可以通过ptl 1(wo2007/074915)中公开的方法(特别是实施例中公开的方法)产生。
[0051]
所述二糖优选是其中构成二糖的两个糖中的至少一个是葡萄糖的二糖。具体的实例包括蔗糖、麦芽糖、海藻糖、乳糖、纤维二糖等,其中优选蔗糖、麦芽糖、海藻糖和乳糖,更优选蔗糖和海藻糖,特别优选蔗糖。这些二糖可以单独使用,或以两种或更多种的组合使用。
[0052]
所述二糖优选以每质量份化合物(1)或其金属盐的量约0.5至70质量份的量存在。该范围的上限或下限可以是,例如,0.6、0.7、0.8、0.9、1、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.5、4、4.5、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、或69质量份。例如,每质量份的化合物(1)或其金属盐的量,所述二糖的量可以为约0.8至60质量份。考虑到在用水重构本公开的冻干组合物中的起泡,所述量优选为约1至15质量份,因为不太可能发生起泡。
[0053]
特别地,当所述组合物是冻干组合物时,化合物(1)或其金属盐和二糖的总量优选为全部组合物的65质量%或更多,更优选为66、67、68、69、或70质量%或更多。
[0054]
特别地,当所述组合物是水溶液组合物时,所述二糖优选以1至8w/v%的浓度存在。该范围的上限或下限可以是,例如,1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7或7.5w/v%。例如,考虑到在用水重构本公开的冻干组合物中的起泡,所述浓度优选为约1至3w/v%,因为不太可能发生起泡。
[0055]
本公开的组合物优选还包含缓冲剂。缓冲剂优选是磷酸盐缓冲剂或碳酸盐缓冲剂,特别优选磷酸盐缓冲剂。更具体地,例如,优选磷酸氢二钠(磷酸氢钠)和/或磷酸二氢钠。所述水溶液组合物中磷酸盐缓冲剂的浓度没有特别限制,只要表现出缓冲能力即可。所述浓度优选为例如约5至100mm。该范围的上限或下限可以是,例如,10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90或95mm。例如,所述浓度更优选约10至80mm,进一步优选约15至50mm,更加优选约20至40mm。
[0056]
此外,本公开的组合物可任选包含ph调节剂。就ph调节剂而言,酸性ph调节剂的具体实例包括盐酸、乙酸、磷酸等;碱性ph调节剂的具体实例包括氢氧化钠、氢氧化钾、碳酸钙、氧化镁、氢氧化镁等。由于本发明的水溶液组合物的ph值为6.5至9,因此特别优选使用碱性ph调节剂。其中,特别优选氢氧化钠。本公开的水溶液组合物的ph范围的上限或下限可以是,例如,6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8或8.9。例如,本公开的水溶液组合物优选ph为约8至9,最优选约8.5。
[0057]
除上述之外,本发明的组合物还可任选包含药学上可接受的载体,特别是冻干药物制剂领域中已知的组分。
[0058]
本公开的组合物可以优选用作例如药物组合物。特别地,所述组合物可以优选用作血管升压素受体(特别是v2受体)拮抗剂。更具体地,例如,所述药物组合物可以优选用于治疗因抗利尿激素分泌不当综合征(siadh)引起的充血性心力衰竭、肝硬化或低钠血症;或在常染色体显性多囊肾病中抑制肾体积增大或肾功能下降。
[0059]
本发明组合物的施用途径优选但不特别限于经血管施用,更优选静脉内施用。所述水溶液组合物可以直接用于经血管施用。所述冻干组合物可以在溶于水(即重构)后用于经血管施用。用于溶解所述冻干组合物的水可含有本技术领域中已知的其它组分。例如,所述水更优选为生理盐水,或葡萄糖注射液。
[0060]
本公开的组合物的剂型的实例包括但不特别限于注射剂、滴注剂等。
[0061]
如上所述,本公开的水溶液组合物可以就此用于经血管施用。另外,通过将本公开
的水溶液组合物冻干,可以优选地制备本公开的冻干组合物。也就是说,本公开的水溶液组合物也可用于制备本公开的冻干组合物。
[0062]
本公开的水溶液组合物可以优选通过将本公开的冻干组合物溶解在水中(即重构)来制备。更具体地,本公开的冻干组合物可以由根据本公开的水溶液组合物制备,并且也可用于(再)制备本公开的水溶液组合物。
[0063]
为了用作注射剂,本公开的组合物优选是灭菌的或无菌的。灭菌方法没有特别限制。优选的实例包括在制备所述水溶液之后进行无菌过滤的方法。
[0064]
本公开的组合物可以基于已知的方法、例如制备冻干药物制剂的方法来制备。更具体地,例如,可以通过将化合物(1)或其金属盐和二糖;以及任选的缓冲剂、ph调节剂等与水一起混合进行溶解,来制备水溶液组合物。进一步地,如上所述,冻干组合物可以通过冻干所述水溶液组合物来制备。
[0065]
术语“包含”和“含有”包括“基本上由
……
组成”和“由
……
组成”。
[0066]
在每个上述实施方式中描述的各种特征(例如,性质、结构和功能)可以用任何方式组合,来指定本公开所包涵的主题。
具体实施方式
[0067]
下面更详细地描述本公开所包涵的主题。然而,所述主题不限于以下实施例。
[0068]
化合物(1)的金属盐的产生
[0069]
化合物(1)及其二钠盐根据ptl 1(wo2007/074915)的实施例(特别是实施例1、3和9)中公开的方法制备。所述二钠盐在以下分析中用作化合物a。所述制备具体如下进行。在下面具体制备方法的描述中,化合物(1b)对应化合物(1),化合物(1b)的二钠盐对应化合物a。
[0070][0071]
将1.0g量的托伐普坦和460mg的1h
‑
四唑溶解于30ml二氯甲烷中;并在室温下伴随
搅拌向该溶液滴加1.2g的二苄基二异丙基亚磷酰胺,随后在相同的温度下搅拌2小时。
[0072]
将所得的反应混合物冷却至
‑
40℃,向其滴加920mg间氯过苯甲酸在二氯甲烷(6ml)中的溶液。将所述混合物在相同的温度下搅拌30分钟,在0℃下再搅拌30分钟。将所述反应混合物用硫代硫酸钠水溶液和饱和碳酸氢钠水溶液洗涤,然后经无水硫酸钠干燥。将所得的反应混合物过滤并浓缩,残余物通过硅胶柱色谱法纯化(洗脱液:正己烷:乙酸乙酯=1:1),得到1.5g的无定形形式的化合物(1a
‑
1)(产率:97.2%)。
[0073][0074]
将5.3g量的化合物(1a
‑
1)溶解在100ml乙醇中。使用2g的5%钯炭作为催化剂,将所述溶液在常温常压下催化还原10分钟。通过过滤除去溶液中的催化剂,并将所得的滤液浓缩(4.2g)。所得的残余物从甲醇
‑
水中结晶。通过过滤收集晶体,并减压干燥(五氧化二磷),得到3.5g的化合物(1b),为白色粉末(产率:88.5%)。
[0075]
此外,将1.0ml的1n氢氧化钠水溶液在冰冷却下添加到276mg(0.52mmol)化合物(1b)在甲醇(2ml)的溶液中,并将所生成的混合物搅拌5分钟。将所述反应混合物减压浓缩,残余物从丙酮
‑
水中重结晶,得到221mg的化合物(1b)二钠盐,为白色粉末。
[0076]
另外,根据ptl 1的实施例中公开的方法,产生化合物(1)的钙盐、镁盐和锌盐。分析了这些金属盐在固态下的稳定性。与化合物(1)相比,所述二钠盐(即化合物a)、钙盐、镁盐和锌盐的稳定性明显改善。另外,分析了在水中的溶解度。与化合物(1)、钙盐、镁盐和锌盐相比,所述二钠盐(即化合物a)具有明显优异的水溶性,如下表所示;所述二钠盐适合作为水性注射剂的药物物质。
[0077]
[表1]
[0078]
化合物(1)和化合物(1)的金属盐在水中的溶解度(w/v%)
[0079] 化合物(1)二钠盐钙盐镁盐锌盐溶解度0.14w/v%4w/v%或更高0.12w/v%0.14w/v%0.003w/v%
[0080]
在高压蒸汽灭菌处理中化合物(1)中的磷酸酯键的稳定性
[0081]
制备含有浓度为0.1w/v%的化合物(1)的水溶液,并分析所述水溶液在受到高压蒸汽灭菌(121℃,20分钟)时的稳定性。所述水溶液使用100mm磷酸钠缓冲液或100mm tris缓冲液制备。使用每种缓冲液制备的水溶液的ph用氢氧化钠调节,以制备具有不同ph的溶液。处理后,化合物(1)的纯度和托伐普坦的产生量通过hplc面积归一化法确定。
[0082]
图1显示了具体结果。结果揭示,通过高压蒸汽灭菌,化合物(1)中的磷酸酯键水解,形成作为沉淀物的托伐普坦。结果还揭示,使用ph为7.5或更高的磷酸钠缓冲液有效地抑制水解,且化合物(1)中的磷酸酯键高度稳定。
[0083]
分析1:化合物(1)的冻干制剂的稳定性
[0084]
使用20mm磷酸氢二钠缓冲液制备含有化合物(1)(0.1w/v%)、甘露醇(4w/v%)和氢氧化钠(适量)的水溶液(ph 7、7.5、8、8.5或9)磷酸氢缓冲液。
[0085]
将所述水溶液各自放入2ml玻璃小瓶中,冷冻至
‑
40℃或更低的温度。之后,将小瓶减压至真空,并在冻干期间除去水,由此获得冻干组合物。所生成的产物在40℃下储存3个月,或在60℃下储存1个月;然后用与冻干除去的同样量的水重构,使所述产物恢复回水溶液。通过hplc面积归一化方法确定每种获得的水溶液中产生的总降解产物或托伐普坦的量(%)。
[0086]
图2显示了结果。在使用ph超过8的溶液制备的冻干组合物中,化合物(1)相对稳定,即使在60℃下储存期间也是如此。然而,在含有甘露醇的冻干组合物中,在60℃下储存1个月后形成托伐普坦,即使这些组合物是使用高ph的溶液制备的;即,当使用ph为8.5的溶液时,形成了1.45%的托伐普坦,当使用ph为9的溶液时,形成了0.9%的托伐普坦,因而表明稳定化效果不足。
[0087]
分析2:化合物(1)的冻干制剂的稳定性
[0088]
使用甘露醇以外的添加剂,即nacl、山梨糖醇、蔗糖、麦芽糖、海藻糖或乳糖,以与上述“分析1:化合物(1)的冻干制剂的稳定性”部分相同的方式制备冻干组合物。在此,在制备冻干组合物之前将水溶液的ph值调节至8.5。然而,对于乳糖,在制备冻干组合物之前用24mm碳酸氢钠缓冲液将水溶液的ph调节至9.0。
[0089]
所得的冻干组合物在60℃下储存1个月后,通过hplc面积归一法确定托伐普坦的产生量,并分析各组合物中化合物(1)的稳定性。表2显示了结果。结果证实,与添加氯化钠或甘露醇时相比,添加二糖(蔗糖、麦芽糖、海藻糖或乳糖)明显降低了托伐普坦的产生量。用蔗糖、麦芽糖和乳糖时的降低特别明显。另外,制备冻干组合物前将所述水溶液在60℃下储存1周后,分析在各组合物中化合物(1)的稳定性。表3显示了结果。结果证实,使用麦芽糖或乳糖增加了托伐普坦的产生量(%)。
[0090]
上述结果揭示,使用二糖制备冻干组合物(即制备用于制备冻干组合物的水溶液组合物)明显改善了托伐普坦前药(化合物(1))在所述冻干组合物中的稳定性,此外,使用蔗糖明显改善了托伐普坦前药(化合物(1))的稳定性,即使在尚未冻干的水溶液组合物的状态下也是如此。因此,结果揭示,在冻干产物中和在水溶液状态下添加蔗糖均取得了极其明显的稳定化效果。
[0091]
[表2]
[0092]
冻干组合物在60℃下储存1个月后的托伐普坦产生量(%)
[0093] 托伐普坦的产生量(%)0.9%氯化钠5.914%甘露醇1.454%蔗糖0.134%麦芽糖0.134%海藻糖0.197.5%乳糖(ph 9.0)低于检测限
[0094]
[表3]
[0095]
制备冻干组合物前将水溶液在60℃下储存1周后的托伐普坦产生量(%)
[0096] 托伐普坦的产生量(%)4%蔗糖0.244%麦芽糖2.034%海藻糖0.337.5%乳糖(ph 9.0)1.12
[0097]
分析1:化合物a的冻干制剂的稳定性
[0098]
除了使用浓度为0.541w/v%的化合物a和浓度为7.5w/v%的蔗糖之外,以与上述“分析2:化合物(1)的冻干制剂的稳定性”部分相同的方式制备ph为7.5、8、8.5或9的水溶液。将所生成的水溶液冻干以获得冻干组合物。将所述冻干组合物在60℃下储存1个月。之后,通过hplc面积归一化法确定托伐普坦的产生量(%)。ph为7.5时托伐普坦的产生量为0.22%,ph为8时为0.10%,ph为8.5时为0.07%,ph为9时低于检测限;这些全部显示出优异的稳定性。
[0099]
分析2:化合物a的冻干制剂的稳定性
[0100]
使用磷酸钾代替磷酸钠作为缓冲剂,以与上述“分析1:化合物a的冻干制剂的稳定性”部分相同的方式制备ph为8.5的水溶液。进一步制备冻干组合物,分析冻干组合物中化合物a的稳定性(在60℃储存1个月后)。托伐普坦的产生量(%)为0.07%,与使用磷酸钠时相同。
[0101]
以与上述“分析1:化合物a的冻干制剂的稳定性”部分相同的方法制备ph为8.0的水溶液,使蔗糖浓度为1%、2%、4%或7.5%。进一步制备冻干组合物,分析冻干组合物中化合物a的稳定性(在60℃储存1个月后)。托伐普坦的产生量(%)在蔗糖浓度为1%时为0.25%,蔗糖浓度为2%时为0.12%,蔗糖浓度为4%时为0.08%,蔗糖浓度为7.5%时为0.10%。因此,在此分析的化合物a的稳定性在所有情况下都优异;并且这些结果揭示,含有一定浓度、特别是超过1%的蔗糖的水溶液表现出更优异的稳定性。然而,当蔗糖浓度为4%或7.5%的冻干组合物用水重构并恢复成水溶液时,观察到起泡和轻微混浊;需要让所述溶液静置直至完全脱气,颜色恢复透明。虽然这在施用中不引起问题,但从不会因起泡引起混浊的观点来看,认为优选在水溶液中的蔗糖浓度低于4%。
[0102]
除了含有浓度为20mm的磷酸钠且ph为8.5的水溶液之外,还以与上述“分析1:化合物a的冻干制剂的稳定性”部分相同的方式制备含有浓度为10mm或50mm的磷酸钠的水溶液。进一步制备冻干组合物,分析冻干组合物中化合物a的稳定性(在60℃储存1个月、或在40℃储存3个月后)。之后,分析用水重构时的ph。下表显示了结果。
[0103]
[表4]
[0104][0105]
结果揭示,与储存前相比,没有观察到ph的显著变化。
[0106]
此外,分析了冻干组合物中化合物a的稳定性(在60℃下储存1个月后)。托伐普坦的产生量(%)在浓度为10mm时为0.07%,在浓度为20mm时为0.07%,并在浓度为50mm时低于检测限。在所有情况下稳定性均为优异。
[0107]
组成例1
[0108]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表5所示组成的水溶液。将表5所示的组成的水溶液进行无菌过滤,分别将5.21ml的制剂溶液例1和20.66ml的制剂溶液例2装入无菌小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
10℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表6所示组成的无菌冻干组合物。在40℃/75%rh(相对湿度)下储存6个月、或在25℃/60%rh下储存36个月后,分析制剂例1的冻干组合物中化合物a的稳定性。根据hplc面积归一化方法的结果,托伐普坦的产生量低于检测限;化合物a即使在长期储存后也极为稳定。向制剂例1添加注射用水(5ml)、向制剂例2添加注射用水20ml以实现重构。由此得到表5所示的制剂溶液例1和制剂溶液例2,其中不溶性异物和不溶性颗粒物即使在长期储存后仍均在日本药典(japanese pharmacopoeia)规定的范围内。
[0109]
[表5]
[0110]
化合物a的水溶液组合物的制剂例(mg/ml)
[0111][0112]
[表6]
[0113]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0114][0115]
组成例2
[0116]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表7所示组成的水溶液。无菌过滤后,将2.63ml至2.64ml表7所示组成的水溶液装入无菌小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
20℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表8所示组成的无菌冻干组合物。在
40℃/75%rh下储存6个月、或在25℃/60%rh下储存18个月后,分析制剂例3、4、5和6的冻干组合物中化合物a的稳定性。托伐普坦的产生量均低于检测限;化合物a即使在长期储存后也非常稳定。将注射用水(2.5ml)添加到表7中所示的冻干组合物中。于是得到表7所示的制剂溶液例3、4、5和6,其中不溶性异物和不溶性颗粒物即使在长期储存后仍均在日本药典规定的范围内。
[0117]
[表7]
[0118]
化合物a的水溶液组合物的制剂例(mg/ml)
[0119][0120]
[表8]
[0121]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0122][0123]
组成例3
[0124]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表9所示组成的水溶液。进一步,无菌过滤后,将2ml表9所示组成的水溶液装入小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
20℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表10所示组成的冻干组合物。在50℃下储存4周后,分析表10所示的制剂例7、8和9的冻干组合物中化合物a的稳定性。制剂例7(比较例)中托伐普坦的产生量为1.2%,并且制剂例8和9中低于检测限。在50℃下储存4周后,向表10中所示的冻干组合物添加50ml盐水以实现重构。虽然制剂例7(比较例)中的不溶性颗粒物超过了日本药典中规定的量,但制剂例8和9中的量均在日本药典规定的范围内。因此,在此也证实了添加蔗糖对托伐普坦和不溶性颗粒物形成的效应。
[0125]
[表9]
[0126]
化合物a的水溶液组合物的制剂例(mg/ml)
[0127][0128]
[表10]
[0129]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0130][0131]
组成例4
[0132]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表11所示组成的水溶液。无菌过滤后,将2ml表11所示组成的水溶液装入小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
20℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表12所示组成的冻干组合物。在50℃下储存4周后,分析表12所示的制剂例10、11、12和13的冻干组合物中化合物a的稳定性。在所有制剂例中,托伐普坦的产生量均低于检测限。在50℃下储存4周后,向表12中所示的冻干组合物添加50ml盐水以实现重构,从而获得其中不溶性异物和不溶性颗粒物均在日本药典规定的范围内的制剂溶液。
[0133]
[表11]
[0134]
化合物a的水溶液组合物的制剂例(mg/ml)
[0135][0136]
[表12]
[0137]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0138][0139]
组成例5
[0140]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表13所示组成的水溶液。无菌过滤后,将2ml表13所示组成的水溶液装入小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
20℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表14所示组成的冻干组合物。在50℃下储存4周后,分析表14所示的制剂例14、15、16和17的冻干组合物中化合物a的稳定性。在所有制剂例中,托伐普坦的产生量均低于检测限。在50℃下储存4周后,向表14中所示的冻干组合物添加50ml盐水以实现重构,从而获得其中不溶性异物和不溶性颗粒物在日本药典中规定的范围内的制剂溶液。
[0141]
[表13]
[0142]
化合物a的水溶液组合物的制剂例(mg/ml)
[0143][0144]
[表14]
[0145]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0146][0147]
组成例6
[0148]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠调节ph至8.5;并制备表15所示组成的水溶液。无菌过滤后,将2.04ml表15所示组成的水溶液装入小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
20℃来去除水。之后,通过将搁架温度设置为30℃来去除残余水,从而获得具有表16所示组成的冻干组合物。将表16的冻干组合物溶解于50ml生理盐水或葡萄糖注射液中,由此制备用于输注的化合物a注射液。
[0149]
[表15]
[0150]
化合物a的水溶液组合物的制剂例(mg/ml)
[0151][0152]
[表16]
[0153]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0154][0155]
组成例7
[0156]
下表显示了包含化合物a的制剂的组成例。将化合物a、纯化的白糖(蔗糖)、水合磷酸氢钠和磷酸二氢钠溶解于注射用水中;用氢氧化钠或磷酸调节ph至8.5;并制备表17所示组成的水溶液。无菌过滤后,将2.14ml表17所示组成的水溶液装入小瓶中。冷冻至
‑
40℃或更低的温度后,将小瓶减压至真空,并通过将搁架温度设置为
‑
10℃来去除水。之后,通过将搁架温度设置为40℃来去除残余水,从而获得具有表18所示组成的冻干组合物。将表18的冻干组合物溶解于50ml生理盐水或葡萄糖注射液中,由此制备用于输注的化合物a注射液。
[0157]
[表17]
[0158]
化合物a的水溶液组合物的制剂例(mg/ml)
[0159][0160]
[表18]
[0161]
化合物a的冻干组合物的制剂例(mg/小瓶)
[0162]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。