bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用。
背景技术:
2.胃癌是一种高发病率高致死率的癌症。即使是进行了系统的外科手术,辅助化疗等规范化治疗,5年生存率也只有30%左右。将近15%的患者,在诊断时就已经扩散到腹膜了,这些有腹膜扩散的患者,预后更差,在不治疗的情况下,中位生存期只有3到4个月。腹水细胞学阳性的患者,在没有明显腹膜肿瘤扩散的情况下,中位生存期是15个月,5年生存率则接近0% 。腹腔热灌注化疗(hipec)在结直肠癌,阑尾癌,腹膜假粘液腺瘤中都取得了良好的疗效。
3.furthermore,kuramotoet等发现,在手术中对腹腔进行广泛彻底的清洗后,再进行腹腔内化疗,可显著改善胃癌患者的预后,与单纯的腹腔内化疗,手术组比较,5年生存率分别是43.8%,4.6% 和0%。对于hipec在胃癌中治疗中的作用,有几个随机临床试验证实了其潜在的价值。yanget对比了一个3期随机临床试验发现,细胞减瘤术(crs) hipec,患者中位生存期可以达到11个月,而单纯的crs组只有6.5个月。
4.crs hipec 的治疗模式无疑是可以显著提高胃癌患者的生存期的,但是从这些临床试验中我们也发现,尽管初期患者反应十分良好,但是后期,仍然不可避免的出现复发和耐药。对于这一类难治性患者,目前的治疗模式,几乎是没有任何效果的。
技术实现要素:
5.本发明以bex2作为胃癌的耐药基因,通过rna干扰,在hipec治疗的43度高温下,协同性杀死耐药耐热恶性胃癌细胞,减少复发。
6.本发明是通过以下的技术方案来实现的。
7.bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用;在本发明中,所述的热化疗耐药胃癌指的是对热化疗药物耐药的胃癌组织或胃癌细胞。bex2在本发明中表示bex2基因,及其由该基因为模板合成的rna或者蛋白质等产物。
8.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述bex2作为靶点;所述的bex2为bex2基因。
9.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述bex2基因的核苷酸序列如seq id no.1所示。
10.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述bex2作为靶点;所述的bex2为以bex2基因为模板翻译而成的蛋白质。
11.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述的蛋白质的序列如seq id no.2所示。
12.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述的耐药胃癌细胞的耐受药物为铂类热化疗药物。
13.优选地,所述的bex2在制备热化疗耐药胃癌增敏药物或制备预测疗效产品的应用,所述的铂类热化疗药物为奥沙利铂、顺铂、卡铂、奈达铂中的至少一种。在本发明中,通过对顺铂和奥沙利铂等常用药物的测定,发现,在抑制bex2表达的情况下,能够有效的提高耐药胃癌细胞对顺铂和奥沙利铂的敏感性,可以以更低浓度的药物抑制其活性,结合实施例中,在抑制了bex2的表达后,胃癌细胞对于高温更加敏感,在高温时期细胞活性更差;由此推断其他作用机制相同或相似的铂类热化疗药物也有相同的作用。
14.本发明还提供一种用于治疗热化疗药物耐药胃癌的组合物,所述的组合物包含有bex2抑制剂。本发明所述的抑制剂可以为下文所述的bex2的sirna;也可以为bex2的其他抑制剂,结合本领域常识,如一种与bex2基因或者蛋白质结合的竞争性抑制剂、与mrna结合的抑制剂,或者能将bex2基因进行敲除的制剂,均能够实现bex2的沉默,从而实现对耐药为癌细胞的增敏作用。
15.优选地,本发明还提供了具体的bex2抑制剂,即所述的bex2抑制剂包含有bex2基因的sirna或者包含有能够指导合成bex2基因的sirna的载体。所述的载体可以为含有目标序列的质粒载体或者其他病毒载体等。
16.优选地,所述的sirna为以序列为:cgccaacactgagtcttacctcgtt或ccaacactgagtcttacctcgttgt作为模板合成的sirna。
17.优选地,所述组合物还包含有热化疗药物,所述热化疗药物为铂类热化疗药物;更具体的,所述热化疗药物为奥沙利铂、顺铂、卡铂、奈达铂中的至少一种。在本发明中,干扰或沉默bex2基因后,ags oxa
‑
r细胞对于奥沙利铂的增敏效果最佳。
18.本发明提供了一种筛选用于治疗热化疗药物耐药胃癌的药物的方法:步骤1:用待选药物处理热化疗药物耐药胃癌细胞;步骤2:检测处理后细胞的bex2基因的表达情况;其中可以采用免疫组化、western blot、带检测基团的bex2产物抗体等技术手段对bex2的表达情况进行定性或者定量的检测。
19.步骤3:根据所获取bex2基因表达情况进行药物筛选。
20.本发明提供的药物筛选方法能够用于筛选出用于与热化疗药物配合治疗耐药胃癌的药物。即,如果某种物质或者方法能够有效的降低bex2基因的表达,甚至沉默该基因,则该物质能够增强胃癌细胞的药物敏感性,进而实现将其与热化疗药物联合用药,增强化疗的效果。同时,通过对患者胃癌组织中bex2表达量的量化,能够预后其热化疗效果,指导医生的用药。
21.本发明的有益技术效果在于:本发明发现了bex2基因的表达量与胃癌细胞耐药程度成正相关;并且,通过抑制bex2基因的表达能够提高胃癌细胞对于热化疗药物的敏感性,尤其是增强了耐药胃癌细胞对于奥沙利铂的敏感性。
22.本发明海通过sirna抑制了bex2的表达,从而实现了对耐药胃癌细胞的增敏作用,由此,将sirna制备成一种抑制剂,联合热化疗药物一起使用,将有效的提高药物的化疗效果。
23.本发明还提供了一种开发筛选新药的方法;该方法只需要将药物对耐药胃癌细胞进行处理,再进一步的对处理后的胃癌细胞进行检测bex2的表达量,从而确定该新药是否对热化疗药物耐药的胃癌细胞有效,具有简单快捷的优点,为药物的前期开发筛选提供了一种新的思路。
附图说明
24.图1为不同细胞株对奥沙利铂热化疗的敏感性图2为敏感株癌细胞中靶基因对预后的影响图3为热化疗药物耐药株中靶基因对预后的影响图4为奥沙利铂 温度 靶基因sirna对ags细胞活性的影响图5为温度 靶基因sirna对mkn
‑
28细胞活性的影响图6为奥沙利铂 温度 靶基因sirna对mkn
‑
28细胞活性的影响图7为mkn
‑
28细胞在bex2基因sirna干扰下对不同浓度奥沙利铂的反应图8为ags oxa
‑
r细胞在bex2基因sirna干扰下对不同浓度奥沙利铂的反应图9为mkn
‑
28细胞在bex2基因sirna干扰下对不同浓度顺铂的反应图10为bex2基因在干扰后的wb鉴定图11为耐药患者胃癌组织的bex2免疫组化效果图图12为敏感患者胃癌组织的bex2免疫组化效果图图13 为bex2表达对淋巴未转移的胃癌患者的预后影响图14 为bex2表达对淋巴已转移的胃癌患者的预后影响。
具体实施方式
25.下面,结合附图以及具体实施方式,对本发明做进一步描述:实验材料:细胞株:胃癌细胞株ags, mkn28, mkn7, ags oxa
‑
r, 细胞株购自procell公司,均有str证书。
26.试剂:cck
‑
8, 购自上海碧云天生物技术有限公司。
27.胎牛血清,由上海素尔生物科技有限公司提供。
28.奥沙利铂,由mce公司提供。
29.sirna, 由上海捷瑞生物工程有限公司提供。
30.实施例1细胞增殖
‑
毒性检测方法标准曲线制作1. 先用细胞计数板计数所制备的细胞悬液中的细胞数量,然后接种细胞。
31.2. 按比例 (例如:1/2比例) 依次用培养基等比稀释成一个细胞浓度梯度,一般要做3
‑
5个细胞浓度梯度,每组3
‑
6个复孔。
32.3. 接种后培养2
‑
4小时使细胞贴壁,然后加cck
‑
8(cell counting kit 8)试剂培养一定时间后测定od值,制作出一条以细胞数量为横坐标 (x轴),od值为纵坐标 (y轴) 的标准曲线。根据此标准曲线可以测定出未知样品的细胞数量 (使用此标准曲线的前提条件是实验的条件要一致,便于确定细胞的接种数量以及加入cck
‑
8后的培养时间)。
33.细胞活性检测1.在96孔板中接种细胞悬液 (100μl/孔 )。将培养板放在培养箱预培养 (在37℃,5% co2的条件下)。
34.2. 向每孔加入10 μl的cck
‑ꢀ
8溶液 (注意不要在孔中生成气泡,它们会影响od值的读数)。
35.3. 将培养板在培养箱内孵育1
‑
4小时。
36.4. 用酶标仪测定在450 nm处的吸光度。
37.细胞增殖
‑
毒性检测1. 在96孔板中配制100μl的细胞悬液。将培养板在培养箱预培养24小时 (在37℃,5% co2的条件下)。
38.2. 向培养板加入10 μl不同浓度的待测物质。
39.3. 将培养板在培养箱孵育一段适当的时间 (例如: 6,12, 24或48小时)。
40.4. 向每孔加入10 μl cck
‑
8溶液 (注意不要在孔中生成气泡,它们会影响od值的读数)。
41.5. 将培养板在培养箱内孵育1
‑
4小时。
42.6. 用酶标仪测定在450 nm处的吸光度。
43.计算公式:细胞存活率 = [(as
‑
ab) / (ac
‑
ab)]
×
100%抑制率 = [(ac
‑
as) / (ac
‑
ab)]
×
100%as:实验孔(含有细胞的培养基、cck
‑
8、待测物质)ac:对照孔(含有细胞的培养基、cck
‑
8、没有待测物质)ab:空白孔(不含细胞和待测物质的培养基、cck
‑
8)本实施例所述的cck
‑
8试剂盒由东仁化学科技(上海)有限公司提供实施例2sirna转染细胞1.提前1天细胞种植贴壁细胞:提前一天将细胞种植在96孔板中,以转染时细胞汇合度(confluence)在30%左右为宜,转染前全培养基总量为0.1ml。
[0044]
2.转染过程
⑴
取80um的sirna,加入一定量无血清稀释液,充分混匀,制成rna稀释液,终体积为12μl。
[0045]
注意:无血清稀释液建议采用opti
‑
mem、无血清dmem或1640。
[0046]
⑵
取1ul的lipo2000,然后加入24ul无血清稀释液体,充分混匀,制成lipo2000稀
释液,终体积为12μl。室温静置5分钟。
[0047]
⑶
将lipo2000稀释液和rna稀释液充分混合(可用振荡器振荡或用加样器吹吸10次以上)混合,室温静置15分钟。转染复合物制备完成。
[0048]
⑷
将24μl转染复合物滴加到有0.1ml全培养基(可含10%血清和抗生素)的细胞上,前后移动培养皿,混合均匀。
[0049]
⑸
转染后6小时观察细胞状态,如状态良好可不必更换培养基,继续培养24
‑
96小时得到结果。
[0050]
实施例3免疫组化鉴定1,将载玻片放入烤箱中,60℃,2小时,室温冷却载玻片30分钟2,脱蜡,二甲苯浸洗3次,每次10分钟,每次更换新的二甲苯3,梯度乙醇水化,100%乙醇,95%乙醇,85%乙醇,75%乙醇,每次5分钟,最后过蒸馏水 2次,每次5分钟,放置于摇床,缓慢摇。
[0051]
4,内源性过氧化物酶封闭, 3%双氧水,室温10分钟,避光。
[0052]
5,蒸馏水洗,5分钟一次,2次(置于摇床)。
[0053]
6,抗原修复,不同的抗原需要不同的修复方法,常规推荐用10mm ph 6.0枸橼酸钠缓冲液进行微波修复,缓冲液倒满整个盒子,微波炉高火3分钟,中火8分钟,取出染色盒,补充枸橼酸钠缓冲液,再次中火8分钟,玻片不可取出,室温下冷却30分钟,不可在冷却过程中拿出玻片,不可强行冷却,必须自然冷却,抗原修复液要足够,避免蒸干。
[0054]
7,tbst洗2次,5分钟一次,置于摇床。
[0055]
8,正常血清封闭,一般用山羊血清封闭,37℃,15分钟;封闭血清用tbst配制,1μl 血清加入19μl tbst中(1:20),每张玻片大约50微升。
[0056]
9,用滤纸吸去血清,不洗,滴加一抗,每张玻片大致50微升,放于湿盒,37℃,1到2小时,也可以4℃过夜,不要让冷库风扇对着吹,会直接吹干玻片,可以放于4度冰箱。
[0057]
10,tbst洗3次,2分钟一次,置于摇床。
[0058]
11,按试剂盒要求配制二抗,滴加二抗,室温孵育20到30分钟,不要孵育过久。
[0059]
12,tbst洗3次,1分钟一次,置于摇床。
[0060]
13,准备发色底物,滴加发色底物,根据显色情况,孵育5分钟左右,一般进口的试剂,2到5分钟就能看到明显的显色反应,国产的试剂通常要慢一些,可以孵育到30分钟左右。
[0061]
14,tbst洗3次,,1分钟一次,置于摇床(不可省略,否则玻片会出现非特异染色)。
[0062]
15,如果是双染,此时加入第二种发色底物,根据显色情况,孵育15分钟左右。
[0063]
16,tbst洗3次,,1分钟一次,置于摇床(不可省略,否则玻片会出现非特异染色)。
[0064]
17,复染,一般用苏木素复染细胞核,呈蓝色,复染前,用白片做个预实验,以确认复染的大致时间,一般1到2分钟足够,自来水冲洗,不可直接对着组织标本冲。
[0065]
18,0.5%盐酸酒精分化,一般2到8秒,原则是变红为止,迅速放入水中,流水冲至变蓝(即蓝化,60度温自来水效果就很好),蒸馏水洗3次,1分钟一次,tbst洗一分钟,蒸馏水再洗一分钟,如果分化过度,可再次复染。
[0066]
19,梯度酒精脱水,80%,2分钟
ꢀ→
95%,2分钟
ꢀ→
100%,3次,每次2分钟。
[0067]
20,透明,二甲苯3次,每次一分钟。
[0068]
21,风干玻片,滴加2到3滴中性树脂,盖玻片一端与树脂充分接触后,慢慢放平,注意避免气泡;中性树脂气味较大,可以用水性封片剂代替,但需要在盖玻片两端重新用树脂胶连,因为水性封片剂遇水还会重新溶解。
[0069]
22,可以放在通风柜一晚,风干树脂,第二天再拍片。
[0070]
实施例4western blot 鉴定一、提取抗原蛋白将提取rna途中留存的样品,加入150μl 100%酒精充分混匀,静置5 min(rt), 2000
×
g,4℃离心5 min,吸取上清至新管中,加入750 μl异丙醇,混匀,静置10min (rt), 12000
×
g,4℃离心10min,弃上清,加入1 ml 0.3mol/l盐酸胍/95%酒精重悬沉淀,用加样器打散沉淀,混旋20~30秒,静置20 min(rt),7500
×
g, 4℃离心5 min,弃上清,重新加入1 ml 0.3mol/l盐酸胍/95%酒精两次,重悬沉淀,离心后弃上清,加入100%无水乙醇1 ml,混旋1 min,静置20 min(rt),7500
×
g,4℃离心5 min,弃上清,真空干燥5 min,50 μl 1%sds溶解沉淀,用50℃热水助溶,直至全部溶解。10000
×
g,离心10 min,去除沉渣。
[0071]
二、蛋白定量1.取pbs、各样品10ul,加dw990 ul2.取dw匀浆缓冲液、样品稀释液、系列牛血清白蛋白标准浓度0.5ml。
[0072]
3.向各管加入2.5ml d 试剂(a50ml+b0.5ml+c0.5mla-2%na2 co3 、0.1 n naoh,b
‑
0.5% cuso 4 ,c
‑
1%酒石酸钠)混匀,静置10分钟。
[0073]
4.迅速加入酚试剂 0.25ml,混匀37℃水浴30分钟。
[0074]
5.721分光光度计650 nm,比色,s 0 标准管调零。
[0075]
6.最后稀释为4 ug/ul,加载样缓冲液后,终浓度为2 ug/ul,上样量为30~80 ug/泳道。
[0076]
三、电泳1.制备凝胶,配方如下:制备2块11%分离胶h2o 4.36 ml3m tris 3.0 ml30%arc 4.4 ml10%sds 0.24 ml10%aps 0.12 mltemed 10ul制备两块4%积层胶h2o 3.66ml0.5m tris 1.5 ml30%arc 0.5 ml 0.78 ml10%sds 60 ul10%aps 20ul 30 ul
temed 5ul 6ul2.上样品前的样品处理:样品100℃、3分钟、冷却,900
×
g、离心30s。
[0077]
3.通电电:积层胶电泳电压50v左右,分离胶电泳电压90~110v。
[0078]
4.考马斯亮蓝染色:1小时,1号脱色1小时,2号脱色2小时。
[0079]
四、电转印1.将滤纸ncm切成与凝胶尺寸大小,置于dm中浸透5分钟,电转液平衡15分钟。
[0080]
2.转移:用二张大滤纸贴于两张多孔垫料,将ncm、胶夹于中间,在ncm与大滤纸之间垫小滤纸。ncm朝正极,20v恒压转移12小时。取下ncm杂交,凝胶染色看效果。
[0081]
五、杂交1.取下ncm,做好标记,dh2o冲洗,室温滤纸干或放入膜固定液15分钟。
[0082]
2.ncm用pbs冲洗二遍,呈5~6%non-fatmilk的ph7.2的pbs中封闭,室温6-8小时或室温1-2小时,4℃,过夜。
[0083]
3.将封闭的膜用pbs冲洗一遍,洗15分钟
×
1,5分钟
×
2。
[0084]
4.加入一抗1:1000-1200,室温,反应1小时5.pbs洗15分钟
×
1,15分钟
×
4。
[0085]
6.加入二抗1:5000,室温,反应1小时。
[0086]
7.pbs洗15分钟
×
1,5分钟
×
4。
[0087]
六、化学发光试剂检测1.混合等体积bottle1&2与ncm共孵育1分钟。
[0088]
2.放射自显影:曝光3分钟至10分钟。
[0089]
3.显影后清水漂洗,再定影。
[0090]
七、所用试剂1、匀浆缓冲液4
×
1l:nah2po 4
(
·
h2o)12.48g;na2po
4 ·
12h2o114.6g;nacl3.6g;h2o800ml;最后,调节ph 至7.0,调节体积至1 l(1)用时稀释4倍。
[0091]
(2)40ml pbs+pmsf 40 ul+1.10 phenautehroline 80 ul+iodo 80ul+pepstalma 80ul2. 系列牛血清蛋白浓度稀释法:取500ug / ml bsa按下法配制:500ug/ml bsa ns
ꢀꢀꢀ
蛋白浓度ug/mls1
ꢀꢀꢀ
50 ul
ꢀꢀꢀꢀ
1.95 ml
ꢀꢀꢀ
12.5s2
ꢀꢀꢀ
100 ul
ꢀꢀꢀꢀꢀ
1.90 ml
ꢀꢀꢀ
25s3
ꢀꢀꢀ
200 ul
ꢀꢀꢀꢀꢀ
1.80 ml
ꢀꢀꢀ
50s4
ꢀꢀꢀ
400 ul
ꢀꢀꢀꢀꢀ
1.60 ml
ꢀꢀꢀ
100s5
ꢀꢀꢀ
800 ul
ꢀꢀꢀꢀꢀ
1.20 ml
ꢀꢀꢀ
200实施例5bex2基因在sirna干扰后的western blot鉴定
结合实施例2的转染方法,对成功转染bex2基因sirna的mkn
‑
28细胞进行western blot 鉴定,如图10所示,分别转染了两种sirna,均成功的感染了bex2的表达;同时在本实施例中还采用了qpcr的方法对干扰后的bex2基因表达情况进行鉴定,结果也表明了干扰成功,实施例中qpcr方法中采用的引物为:ggccaacactgagtcttacctcgtt; ccaacactgagtcttacctcgttgt。
[0092]
由此表明,可以通过wb或qpcr的方法鉴定出bex2是否表达。
[0093]
在本发明中所述的bex2基因的序列(seq id no.1)为:1 gagtcttacctcgttgtggcgtcagaaccgccgtcgctcgctcccttctcggcagtggta61 cctgttcccggtgtccctgaggacgtgcgggccaggtacggccccgaaagtaggaagcgg121 agggggagcaggtaagggacccggagggggtccctggggttggtgtgggggagcagcccc181 ggcctgcggatgccccatccccgggcagcagcgcggagacgcagccggtccacgatgcag241 ccccggggccccgccgcgggaccgcgagccttgtgtgagcggaggggtgcccggccccgc301 gggagccggcgatcctgaggctacgacctttcggaagcacctgcctccgtcaccagcgca361 agcttttccaacacccctgctccgcccttcttgatgcagaaaatggtggtttgcggggcc421 aagtgttgcggcgacgcacctcacgtcgagaatcgggaggaggagactgcaaggataggc481 ccaggagtaatggagtccaaagaggaacgagcgttaaacaatctcatcgtggaaaatgtc541 aaccaggaaaatgatgaaaaagatgaaaaggagcaagttgctaataaaggggagcccttg601 gccctacctttgaatgttagtgaatactgtgtgcctagaggaaaccgtaggcggttccgc661 gttaggcagcccatcctgcagtatagatgggacataatgcataggcttggagagccacag721 gcaaggatgagagaggagaatatggaaaggattggggaggaggtgagacagctgatggaa781 aagctgagggaaaagcagttgagtcatagtttgcgggcagtcagcactgatccccctcac841 catgaccatcacgatgagttttgccttatgccctgaatcctgatggtttccctgaagtta901 atagggagacccctgcttcctaaacttacacatttgtggtgtacctttgtcgtaaacgtt961 ttgatgttacctatttcttgtgggtctcctattaccagcttctaaatgaatgttgttttt1021 gacccagtttgtaagtttctgtcagcaggagagttttacctattgcatggaaagatgctc1081 attatatattgtgaagttaataaaacagttttaaaaagca所述bex2基因表达的蛋白质序列(seq id no.2)为:mqkmvvcgakccgdaphvenreeetarigpgvmeskeeralnnlivenvnqendekdekeqvankgeplalplnvseycvprgnrrrfrvrqpilqyrwdimhrlgepqarmreenmerigeevrqlmeklrekqlshslravstdpphhdhhdefclmp实施例6不同细胞株对奥沙利铂热化疗的敏感性96孔板种不同的胃癌细胞株,加入奥沙利铂后,43度加热60分钟,放回37度二氧化碳细胞培养箱,继续培养48小时,加入cck8, 在450nm波长检测细胞活性。
[0094]
实验结果表明,如图1所示,以最右端为参考,自上而下的细胞株分别为ags oxa
‑
r、mkn28 oxa、hgc27 oxa、ags oxa; 其中ags oxa对奥沙利铂热化疗非常敏感,mkn28 oxa细胞相对耐药,药物诱导的耐药细胞株ags
‑
oxa
‑
r对热化疗极度耐药。
[0095]
实施例7胃癌患者中,对生产预后影响明显的靶基因鉴定
对奥沙利铂耐药和敏感的胃癌患者标本,分别测序,进行差异基因分析,再对差异基因进行生存分析,结果如图2
‑
3所示,纵坐标为基因种类,横坐标为风险比;由图2可知bex2属于高风险基因,与不良预后有明显关联关系,且p<0.05,关联性显著。
[0096]
实施例8不同靶基因sirna筛选如图4
‑
6所示,采用实施例2的方法通过对不同的癌细胞转染靶基因的sirna对靶基因进行沉默或干扰;再采用实施例1的方法进行细胞活性的检测,最终确定哪个靶基因被干扰后,药物具有良好的抑制癌细胞的作用,从而确定靶基因的耐药作用。如图4所示的为,通过在ags细胞(敏感株)中进行sirna的干扰和加入奥沙利铂进行处理,其中处理温度分别为37摄氏度和43摄氏度。结果如图4所示,在同一靶基因的处理中,左边的为37度加奥沙利铂的处理,右边的为43度加奥沙利铂的处理。同理,图5为在sirna干扰不同靶基因的条件下,癌细胞mkn
‑
28对温度37度和43度的反应;图6为在图5的基础上增加奥沙利铂的处理。结果表明,bex2, chst3,k6c等基因明显影响胃癌患者耐药,需要对这些靶基因进一步做sirna筛选。
[0097]
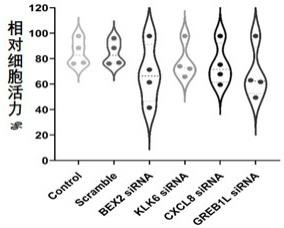
实施例9在不同的热化疗药物浓度下,检测靶基因对胃癌细胞株的增敏作用对已经转染了bex2基因sirna的mkn
‑
28和ags oxa
‑
r细胞分别使用浓度为0、10、50、100μm的奥沙利铂进行处理,在采用实施例1的方法测试处理后的细胞活性。如图7
‑
8所示的小提琴图,自上而下采用的浓度为0、10、50、100μm的奥沙利铂处理;在mkn
‑
28和ags oxa
‑
r(奥沙利铂耐药胃癌细胞)细胞中,bex2基因受到干扰后,耐药程度快速下降,增敏效果最明显,及可以显著看到癌细胞的活性别抑制;尤其是在ags oxa
‑
r细胞中更为明显。
[0098]
其次是对转染了bex2基因sirna的mkn
‑
28细胞分别使用浓度为0、1、10、50、100μm的顺铂进行处理,在采用实施例1的方法测试处理后的细胞活性。结果如图9所示在干扰了bex基因后,随着顺铂的浓度提高,能够发现胃癌细胞mkn
‑
28的细胞活性在迅速下降。
[0099]
由此表明在不同的奥沙利铂或顺铂浓度下,对于原发性耐药细胞株mkn
‑
28, 获得性耐药细胞株ags oxa
‑
r,bex2的增敏作用最显著。对此,也表明其他的热化疗药物,如卡铂,奈达铂等铂类的热化疗药物也有相应的效果。
[0100]
实施例10耐药胃癌组织与敏感型胃癌组织的免疫组化对比为了进一步的研究在实际的患者中bex2的表达是否与胃癌耐药有直接关系,采用了在腹腔热灌注化疗(hipec)的耐药患者的胃癌组织和非耐药(敏感)的患者的胃癌组织进行如实施例3所述方法的免疫组化鉴定;本实施例中所述的耐药中的药物为奥沙利铂。结果如图11和图12所示在耐药患者中,bex2表达明显更强,而敏感患者中,bex2表达是弱阳性。结果也表明,bex2的表达与耐药程度成正相关性。
[0101]
实施例11bex2表达对胃癌患者的预后影响为了更进一步的研究bex2基因对于胃癌患者的影响,发明人特别的对bex2基因高表达和低表达的患者的预后情况进行了统计;如图13所示,在胃癌未发生淋巴结转移的患者中,采用spss的生存分析,样本数631,低表达组278,高表达组353;如图14所述,对在已经
发生淋巴结转移的患者的spss的生存分析,样本数422,低表达组205,高表达组217;其中图中的low表示为低表达(上方曲线),high为高表达(下方曲线);其中图中纵坐标为生存几率,横坐标为生存的月数。结果表示,在胃癌患者中,高表达bex2的患者中,预后更差。在伴随淋巴结转移的胃癌患者中,高表达bex2同样提示了预后不良。
[0102]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。