1.本发明涉及河豚毒素的检测技术领域,尤其涉及贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用、河豚毒素的检测方法。
背景技术:
2.河豚毒素(ttx)是一种典型低分子量(319da)的高毒性神经毒素,其广泛存在于河豚鱼和某些海洋动物中。ttx可高选择性和高亲和性地结合神经细胞膜上电压门控钠离子通道的受体,阻碍钠离子透过细胞膜传导神经的冲动,从而引起神经麻痹、呼吸衰竭,甚至死亡。ttx的化学性质和热性质均很稳定,一般烹调手段不能将其破坏,只有在高温加热30min以上或在碱性条件下才能被分解。如果含有ttx的食物处理不当,而摄入ttx污染的食物,ttx在0.5~3mg的低剂量下即可导致成年人中毒死亡,其毒性比氰化物高近1200倍,严重危害生命安全。因此,有必要开发一种高灵敏、准确的食品中ttx检测方法。
3.目前,食品安全国家标准水产品中河豚毒素的测定方法有小鼠生物法、液相色谱
‑
串联质谱法、液相色谱
‑
荧光检测法和酶联免疫吸附法。其中,小鼠生物法利用ttx毒性特点实现检测,方法设计简单,结果直观,但检测效率低、实验耗时长且劳动强度大;仪器分析法(液相色谱
‑
串联质谱法、液相色谱
‑
荧光检测法)具有较高的灵敏度和准确性,但是需要专业的技术人员和昂贵的仪器设备;免疫分析法(酶联免疫吸附法)具有较好的特异性,但抗体成本高且操作步骤繁琐。
4.针对上述问题,近年来多种检测ttx的新方法也不断涌现,如表面等离子体共振法、荧光传感器检测方法和电化学传感器检测方法等。这些检测方法虽然满足灵敏检测的需求,但大多数是以抗体或适配体为特异性识别分子,它们都需要复杂而繁琐的生物分子固定化或修饰过程才能获得特异性的结合响应信号,其低固定化效率会降低方法的检测性能。更重要的是,绝大多数已报道的检测技术主要是基于单一方法的检测模式,检测手段较为单一,广泛应用性较差。
技术实现要素:
5.本发明的目的在于提供贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用、河豚毒素的检测方法。所述贵金属掺杂的金属有机框架复合材料可以提高对河豚毒素的检测灵敏性和准确性,同是还可以实现检测手段的多样性,应用性较好。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用,所述贵金属掺杂的金属有机框架复合材料包括金属有机框架和掺杂在所述金属有机框架多孔结构中的贵金属纳米颗粒;
8.所述金属有机框架包括mil
‑
101、mil
‑
88b、zif
‑
8或uio
‑
66;
9.所述贵金属纳米颗粒包括金纳米颗粒、银纳米颗粒、铜纳米颗粒或金银合金纳米
颗粒;
10.所述检测河豚毒素的方法为荧光检测或表面增强拉曼检测;
11.所述检测河豚毒素的过程中,以cy3荧光染料标记的河豚毒素适配体为识别元件。
12.优选的,所述贵金属纳米颗粒与金属有机框架复合材料的质量比为(1.4~4.2):1。
13.本发明还提供了一种河豚毒素的检测方法,包括以下步骤:
14.将cy3荧光染料标记的河豚毒素适配体和tris
‑
hcl缓冲液混合,得到cy3
‑
适配体溶液;
15.将贵金属掺杂的金属有机框架复合材料和tris
‑
hcl缓冲液混合,得到贵金属掺杂的金属有机框架复合材料溶液;所述贵金属掺杂的金属有机框架复合材料为上述技术方案中所述的贵金属掺杂的金属有机框架复合材料;
16.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,分别加入一系列不同浓度的第一河豚毒素标准液作为实验组,进行荧光恢复和加入tris
‑
hcl缓冲液作为对照组,采用荧光分光光度计进行荧光检测,分别记录发射波长为570nm处的荧光强度;
17.以所述第一河豚毒素标准液的浓度的对数为横坐标,以相对于对照组荧光强度的改变量为纵坐标,建立标准曲线;
18.将所述待测样品进行提取和河豚毒素加标处理,得到含河豚毒素的浸提液;
19.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,加入所述含河豚毒素的浸提液进行荧光恢复,采用荧光分光光度计进行荧光检测,记录发射波长为570nm处的荧光强度;将所述荧光强度相对对照组荧光强度的改变量带入所述标准曲线中,得到所述含河豚毒素的浸提液中河豚毒素的浓度,计算加标回收率和相对标准偏差。
20.优选的,所述荧光检测的条件为:激发波长为525nm,带宽为10nm,增益为1000v,扫描速度为1000nm/min。
21.优选的,所述第一河豚毒素标准液的浓度分别为0.01ng/ml、0.03ng/ml、0.1ng/ml、0.3ng/ml、1ng/ml、3ng/ml、10ng/ml、30ng/ml、100ng/ml和300ng/ml。
22.优选的,所述cy3
‑
适配体溶液的浓度为1μm;所述贵金属掺杂的金属有机框架复合材料溶液的浓度为0.05~0.6mg/ml;
23.所述cy3
‑
适配体溶液、所述贵金属掺杂的金属有机框架复合材料溶液和所述河豚毒素标准液的体积比为1:1:1。
24.优选的,所述荧光淬灭的时间为0.5~3.5min;
25.所述荧光恢复的时间为10~70min。
26.优选的,所述浸提采用的浸提液为体积比为1:99的乙酸和甲醇的混合液。
27.本发明还提供了一种河豚毒素的检测方法,包括以下步骤:
28.将cy3荧光染料标记的河豚毒素适配体和tris
‑
hcl缓冲液混合,得到cy3
‑
适配体溶液;
29.将贵金属掺杂的金属有机框架复合材料和tris
‑
hcl缓冲液混合,得到贵金属掺杂的金属有机框架复合材料溶液;所述贵金属掺杂的金属有机框架复合材料为上述技术方案
中所述的贵金属掺杂的金属有机框架复合材料;
30.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行拉曼增强后,分别加入一系列不同浓度的第一河豚毒素标准液作为实验组,进行拉曼恢复和加入tris
‑
hcl缓冲液作为对照组,进行表面增强拉曼检测,分别记录波数为1587cm
‑1处的拉曼强度;
31.以所述第一河豚毒素标准液的浓度的对数为横坐标,以相对于对照组拉曼强度的改变量为纵坐标,建立标准曲线;
32.将所述待测样品进行提取和河豚毒素加标处理,得到含河豚毒素的浸提液;
33.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行拉曼增强后,加入所述含河豚毒素的浸提液进行拉曼恢复,进行表面增强拉曼检测,分别记录波数为1587cm
‑1处的拉曼强度;将所述拉曼强度相对对照组拉曼强度的改变量带入所述标准曲线中,得到所述含河豚毒素的浸提液中河豚毒素的浓度,计算加标回收率和相对标准偏差。
34.优选的,所述拉曼增强的时间为0.5~3.5min;所述拉曼恢复的时间为10~70min。
35.优选的,所述表面增强拉曼检测的条件为:积分时间为5s,激光功率为5mw。
36.本发明提供了一种贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用,所述贵金属掺杂的金属有机框架复合材料包括金属有机框架和掺杂在所述金属有机框架多孔结构中的贵金属纳米颗粒;所述金属有机框架包括mil
‑
101、mil
‑
88b、zif
‑
8或uio
‑
66;所述贵金属纳米颗粒包括金纳米颗粒、银纳米颗粒、铜纳米颗粒或金银合金纳米颗粒;所述检测河豚毒素的方法为荧光检测或表面增强拉曼检测;所述检测河豚毒素的过程中,以cy3荧光染料标记的河豚毒素适配体为识别元件。本发明中,所述贵金属掺杂的金属有机框架复合材料可以作为荧光淬灭剂或拉曼增强基底,由于金属有机框架材料具有较好的比表面积和较高的吸附能力,可以使在后续的检测中荧cy3荧光染料标记的河豚毒素适配体与金属有机框架材料之间形成π
‑
π堆积和静电作用,从而使cy3荧光染料标记的河豚毒素适配体被有效的吸附在所述贵金属掺杂的金属有机框架复合材料的表面,进而所述贵金属掺杂的金属有机框架复合材料与cy3荧光染料之间发生光诱导电子转移和荧光共振能量转移过程,降低荧光染料的荧光信号,产生荧光淬灭限定;或者,利用所述贵金属纳米颗粒的等离激元特性,所述贵金属掺杂的金属有机框架复合材料可以增强cy3荧光染料的拉曼信号,产生拉曼增强效应。但是ttx存在时,由于cy3荧光染料标记的河豚毒素适配体能与ttx发生特异性结合,形成具有刚性结构的cy3荧光染料标记的河豚毒素适配体和ttx的复合物,使贵金属掺杂的金属有机框架复合材料与荧光染料标记的ttx适配体之间的结合力降低,从而导致荧光染料标记的ttx适配体从所述贵金属掺杂的金属有机框架复合材料的表面释放出来,进而产生荧光信号和拉曼信号的恢复。并最终根据上述荧光强度和拉曼强度的变化实现ttx的定量分析。根据实施例的记载,本发明的荧光和表面增强拉曼双模式检测方法,具有宽检测范围(0.01~300ng/ml)和高灵敏度,荧光和和表面增强拉曼法的检出限分别为0.006ng/ml和0.008ng/ml。相较于现有的亲水相互作用色谱
‑
串联质谱法(hilic
‑
ms/ms)(检测ttx的检测范围为2.2~400ng/ml,获得的最低的检出限为0.65ng/ml;电化学免疫分析法
2.的检测范围为1.2~52.7ng/ml,检出限为1.2ng/ml)的检测范围和检测灵敏度都有较大的提高。同时还克服了仪器分析方法需要昂贵的精密仪器和需要专业人员操作的缺
陷。也同时避免了电化学免疫分析法需要在电极表面固定修饰特异性抗原的问题,过程简单,避免了使用昂贵的抗体,降低了检测成本。
附图说明
37.图1为实施例1制备得到的aunps@mil
‑
101的tem图;
38.图2为基于实施例1所述aunps@mil
‑
101的荧光法检测河豚毒素的特异性检测结果图;
39.图3为基于实施例1所述aunps@mil
‑
101的表面增强拉曼广谱法检测河豚毒素的特异性检测结果图;
40.图4为实施例2以所述河豚毒素标准液的浓度的对数为横坐标,以相对于对照组荧光强度的改变量为纵坐标的标准曲线图;
41.图5为实施例4以所述河豚毒素标准液的浓度的对数为横坐标,以相对于对照组拉曼强度的改变量为纵坐标的标准曲线图。
具体实施方式
42.本发明提供了一种贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用,所述贵金属掺杂的金属有机框架复合材料包括金属有机框架和掺杂在所述金属有机框架多孔结构中的贵金属纳米颗粒;
43.所述金属有机框架包括mil
‑
101、mil
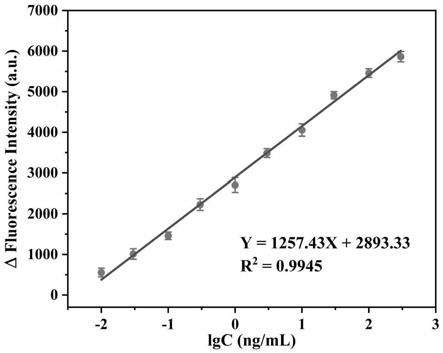
‑
88b、zif
‑
8或uio
‑
66;
44.所述贵金属纳米颗粒包括金纳米颗粒、银纳米颗粒、铜纳米颗粒或金银合金纳米颗粒;
45.所述检测河豚毒素的方法为荧光检测或表面增强拉曼检测;
46.所述检测河豚毒素的过程中,以cy3荧光染料标记的河豚毒素适配体为识别元件。
47.在本发明中,所述金属有机框架包括mil
‑
101、mil
‑
88b、zif
‑
8或uio
‑
66,优选包括mil
‑
101。
48.在本发明中,所述贵金属纳米颗粒包括金纳米颗粒、银纳米颗粒、铜纳米颗粒或金银合金纳米颗粒,优选包括金纳米颗粒。本发明对所述贵金属纳米颗粒的粒径没有任何特殊的限定,采用本领域技术人员熟知的纳米级别的贵金属即可。
49.在本发明中,所述贵金属纳米颗粒与金属有机框架复合材料的质量比优选为(1.4~4.2):1,更优选为(2.0~4.0):1,最优选为(2.5~3.5):1。
50.本发明对所述贵金属纳米颗粒掺杂的金属有机框架复合材料的来源没有任何特殊的限定,采用本领域技术人员熟知的市售产品或采用本领域技术人员熟知的制备方法制备得到均可。
51.在本发明的具体实施例中,具体采用金纳米颗粒掺杂的mil
‑
101(记为aunps@mil
‑
101)进行验证所述贵金属纳米颗粒掺杂的金属有机框架复合材料对检测河豚毒素的可行性。
52.在本发明的具体实施例中,所述aunps@mil
‑
101优选通过制备得到,所述aunps@mil
‑
101的制备方法具体为:
53.将九水合硝酸铬(cr(no3)3·
9h2o)、氢氟酸(1ml,5mmol)和苯二甲酸(820mg,
5mmol)超声溶解在24ml水中,将得到的混合液置于50ml聚四氟乙烯内衬高压反应釜中,在220℃的烘箱中加热8h。冷却至室温后,获得绿色产物和重结晶的苯二甲酸。经过滤除去重结晶的苯二甲酸,再通过离心(10000rpm,10min)收集含有mil
‑
101的绿色溶液,并分别用n,n
‑
二甲基甲酰胺和甲醇洗涤两次。最后,将纯化的浅绿色产物在80℃真空下干燥,得到mil
‑
101固体粉末;
54.将50mg所述mil
‑
101粉末悬浮在30ml浓度为0.1%(w/v)氯金酸水溶液中,并在45℃下连续搅拌2.5h。然后加热至剧烈沸腾,然后快速注入220μl浓度为10%(w/v)柠檬酸钠溶液,并在沸腾下持续搅拌40min。冷却后,通过以10000rpm离心10min收集合成后的aunps@mil
‑
101湿品,并在80℃真空下干燥,得到aunps@mil
‑
101固体粉末。
55.在本发明中,所述检测河豚毒素的过程中,优选以cy3荧光染料标记的河豚毒素适配体为识别元件。在本发明中,所述cy3荧光染料标记的河豚毒素适配体优选为上海生工生物(北京合成部)合成的5
′‑
cy3
‑
tca aat ttt cgt cta ctc aat ctt tct gtc tta tc
‑3′
。
56.本发明还提供了一种河豚毒素的检测方法,包括以下步骤:
57.将cy3荧光染料标记的河豚毒素适配体和tris
‑
hcl缓冲液混合,得到cy3
‑
适配体溶液;
58.将贵金属掺杂的金属有机框架复合材料和tris
‑
hcl缓冲液混合,得到贵金属掺杂的金属有机框架复合材料溶液;所述贵金属掺杂的金属有机框架复合材料为上述技术方案所述的贵金属掺杂的金属有机框架复合材料;
59.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,分别加入一系列不同浓度的第一河豚毒素标准液作为实验组,进行荧光恢复和加入tris
‑
hcl缓冲液作为对照组,采用荧光分光光度计进行荧光检测,分别记录发射波长为570nm处的荧光强度;
60.以所述第一河豚毒素标准液的浓度的对数为横坐标,以相对于对照组荧光强度的改变量为纵坐标,建立标准曲线;
61.将所述待测样品进行提取和河豚毒素加标处理,得到含河豚毒素的浸提液;
62.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,加入所述含河豚毒素的浸提液进行荧光恢复,采用荧光分光光度计进行荧光检测,记录发射波长为570nm处的荧光强度;将所述荧光强度相对对照组荧光强度的改变量带入所述标准曲线中,得到所述含河豚毒素的浸提液中河豚毒素的浓度,计算加标回收率和相对标准偏差。
63.本发明将cy3荧光染料标记的河豚毒素适配体和tris
‑
hcl缓冲液混合,得到cy3
‑
适配体溶液。
64.在本发明中,所述tris
‑
hcl缓冲液的ph值优选为7.4,优选包括150mm的nacl和2mm的mgcl2。
65.在本发明中,所述cy3
‑
适配体溶液中cy3荧光染料标记的河豚毒素适配体的浓度优选为1μm。
66.本发明将贵金属掺杂的金属有机框架复合材料和tris
‑
hcl缓冲液混合,得到贵金属掺杂的金属有机框架复合材料溶液;所述贵金属掺杂的金属有机框架复合材料为上述技术方案所述的贵金属掺杂的金属有机框架复合材料。
67.在本发明中,所述tris
‑
hcl缓冲液为上述技术方案所述的tris
‑
hcl缓冲液,在此不再进行赘述。
68.在本发明中,所述贵金属掺杂的金属有机框架复合材料溶液中金属掺杂的金属有机框架复合材料的浓度优选为0.05~0.6mg/ml,进一步优选为0.3~0.6mg/ml,更优选为0.3~0.5mg/ml,最优选为0.3~0.4mg/ml。
69.得到cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液后,本发明将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,分别加入一系列不同浓度的第一河豚毒素标准液作为实验组,进行荧光恢复和加入tris
‑
hcl缓冲液作为对照组,采用荧光分光光度计进行荧光检测,分别记录发射波长为570nm处的荧光强度。
70.在本发明中,所述cy3
‑
适配体溶液、所述贵金属掺杂的金属有机框架复合材料溶液和所述河豚毒素标准液的体积比优选为1:1:1。
71.在本发明中,所述荧光淬灭的温度优选为室温,所述荧光淬灭优选在涡旋震荡的条件下进行,本发明对所述涡旋震荡的条件参数没有任何特殊的限定,采用本领域技术人员熟知的条件参数进行即可。在本发明中,所述荧光淬灭的时间优选为0.5~3.5min,进一步优选为2~3.5min,更优选为2~3min,最优选为2min。
72.在本发明中,所述第一河豚毒素标准液的浓度分别优选为0.01ng/ml、0.03ng/ml、0.1ng/ml、0.3ng/ml、1ng/ml、3ng/ml、10ng/ml、30ng/ml、100ng/ml和300ng/ml。
73.在本发明中,作为所述对照组的tris
‑
hcl缓冲液优选参考上述技术方案所述的tris
‑
hcl缓冲液,在此不再进行赘述。
74.在本发明中,所述荧光恢复的温度优选为室温,所述荧光淬灭优选在涡旋震荡的条件下进行,本发明对所述涡旋震荡的条件参数没有任何特殊的限定,采用本领域技术人员熟知的条件参数进行即可。在本发明中,所述荧光淬灭的时间优选为10~70min,进一步优选为40~70min,更优选为50~60min,最优选为60min。
75.在本发明中,所述荧光检测的条件优选为:激发波长为525nm,带宽为10nm,增益为1000v,扫描速度为1000nm/min。
76.在本发明中,进行所述荧光检测时,优选采用f97pro荧光分光光度计(上海棱光技术有限公司)平行测定3次并取平均值。
77.分别记录发射波长为570nm处的荧光强度后,本发明以所述第一河豚毒素标准液的浓度的对数为横坐标,以相对于对照组荧光强度的改变量为纵坐标,建立标准曲线。
78.本发明对建立所述标准曲线的过程没有任何特殊的限定,采用本领域技术人员熟知的过程进行即可。
79.得到标准曲线后,本发明将所述待测样品进行提取和河豚毒素加标处理,得到含河豚毒素的浸提液;
80.在本发明中,制备所述含河豚毒素的浸提液的过程优选参考gb 5009.206
‑
2016《食品安全国家标准水产品中河豚毒素的测定》中的第三法(液相色谱
‑
荧光检测法)进行样品提取和ttx加标处理。
81.在本发明的实施例中,所述待测样品具体为购于超市的无毒的冷冻河豚鱼肉;对所述无毒的冷冻河豚鱼肉进行提取和河豚毒素加标处理的具体过程为:将所述无毒的冷冻
河豚鱼肉置于室温解冻后,用蒸馏水清洗后,用滤纸吸干,取河豚鱼的肌肉部分,将样品剪碎,充分均质,得到均质河豚鱼肌肉;将2g所述均质河豚鱼肌肉加入2ml不同浓度的ttx标准品溶液(0、0.02、0.2、2、20、200ng/ml)后,在50ml聚苯乙烯离心管中充分振荡混合5min。加入10ml的乙酸和甲醇的混合液(乙酸和甲醇的体积比为1:99),充分振荡混合5min后,60℃水浴超声提取30min,4500rpm离心5min。上清液于60℃的氮气气氛中浓缩至近干,加入2ml的乙酸溶液(0.1vol%)充分溶解残渣,经0.22μm的水相微孔滤膜过滤,滤液进行检测荧光分析。
82.得到所述含河豚毒素的浸提液后,本发明将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行荧光淬灭后,加入所述含河豚毒素的浸提液进行荧光恢复,采用荧光分光光度计进行荧光检测,记录发射波长为570nm处的荧光强度;将所述荧光强度相对对照组荧光强度的改变量带入所述标准曲线中,得到所述含河豚毒素的浸提液中河豚毒素的浓度,计算加标回收率和相对标准偏差。
83.在本发明中,上述荧光淬灭、荧光恢复和荧光检测的过程优选参考上述制备标准曲线时的荧光淬灭、荧光恢复和荧光检测的过程,在此不再进行赘述。
84.本发明对所述加标回收率和相对标准偏差的计算没有任何特殊的限定,采用本领域技术人员熟知的过程进行即可。
85.本发明还提供了一种河豚毒素的检测方法,包括以下步骤:
86.将cy3荧光染料标记的河豚毒素适配体和tris
‑
hcl缓冲液混合,得到cy3
‑
适配体溶液;
87.将贵金属掺杂的金属有机框架复合材料和tris
‑
hcl缓冲液混合,得到贵金属掺杂的金属有机框架复合材料溶液;所述贵金属掺杂的金属有机框架复合材料为上述技术方案的贵金属掺杂的金属有机框架复合材料;
88.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行拉曼增强后,分别加入一系列不同浓度的第一河豚毒素标准液作为实验组,进行拉曼恢复和加入tris
‑
hcl缓冲液作为对照组,进行表面增强拉曼检测,分别记录波数为1587cm
‑1处的拉曼强度;
89.以所述第一河豚毒素标准液的浓度的对数为横坐标,以相对于对照组拉曼强度的改变量为纵坐标,建立标准曲线;
90.将所述待测样品进行提取和河豚毒素加标处理,得到含河豚毒素的浸提液;
91.将所述cy3
‑
适配体溶液和贵金属掺杂的金属有机框架复合材料溶液混合进行拉曼增强后,加入所述含河豚毒素的浸提液进行拉曼恢复,进行表面增强拉曼检测,分别记录波数为1587cm
‑1处的拉曼强度;将所述拉曼强度相对对照组拉曼强度的改变量带入所述标准曲线中,得到所述含河豚毒素的浸提液中河豚毒素的浓度,计算加标回收率和相对标准偏差。
92.在本发明中,所述拉曼增强的时间优选为0.5~3.5min,更优选为2min;所述拉曼恢复的时间优选为10~70min,更优选为40min。
93.在本发明中,所述表面增强拉曼检测的过程优选为:将20μl待测检测样品滴加在干净的硅片上,室温晾干后,在室温条件下,在配备有638nm的激光光源和ccd探测器的激光微共焦表面增强拉曼光谱仪(xplora plus,horiba scientific公司)中测量表面增强拉曼
光谱,并记录波数为1587cm
‑1处的拉曼强度,每个浓度平行测定3次。
94.在本发明中,进行所述表面增强拉曼检测前,优选以单晶硅的一阶峰(520.7cm
‑1)作为参考峰位对峰位进行校准。
95.在本发明中,对于每次的样本扫描,激光束优选以50倍物镜聚焦。
96.在本发明中,所述表面增强拉曼检测的条件优选为:积分时间优选为5s,激光功率优选为5mw。
97.在本发明中,在所述表面增强拉曼光谱为800~1800cm
‑1的范围内优选采集3次,并利用拉曼光谱仪中配备的abspec 6分析软件对去除背景信号。
98.在本发明中,上述检测过程的其他技术特征优选参考上述技术方案所述的利用荧光检测法检测河豚毒素的过程,在此不再进行赘述。
99.下面结合实施例对本发明提供的贵金属掺杂的金属有机框架复合材料在检测河豚毒素中的应用、河豚毒素的检测方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
100.实施例1
101.aunps@mil
‑
101)的制备:
102.将九水合硝酸铬(cr(no3)3·
9h2o)、氢氟酸(1ml,5mmol)和苯二甲酸(820mg,5mmol)超声溶解在24ml水中,将得到的混合液置于50ml聚四氟乙烯内衬高压反应釜中,在220℃的烘箱中加热8h。冷却至室温后,获得绿色产物和重结晶的苯二甲酸。经过滤除去重结晶的苯二甲酸,再通过离心(10000rpm,10min)收集含有mil
‑
101的绿色溶液,并分别用n,n
‑
二甲基甲酰胺和甲醇洗涤两次。最后,将纯化的浅绿色产物在80℃真空下干燥,得到mil
‑
101固体粉末;
103.将50mg所述mil
‑
101粉末悬浮在30ml浓度为0.1%(w/v)氯金酸水溶液中,并在45℃下连续搅拌2.5h。然后加热至剧烈沸腾,然后快速注入220μl浓度为10%(w/v)柠檬酸钠溶液,并在沸腾下持续搅拌40min。冷却后,通过以10000rpm离心10min收集合成后的aunps@mil
‑
101湿品,并在80℃真空下干燥,得到aunps@mil
‑
101;
104.将所述aunps@mil
‑
101进行tem测试,测试结果如图1所示,由图1可知,所述aunps@mil
‑
101复合材料的粒径约为300纳米,其显示出mil
‑
101所具有的八面体晶体结构,并且材料内部负载了大量aunps,结果表明aunps@mil
‑
101复合材料的合成成功。
105.测试例1
106.基于所述aunps@mil
‑
101的荧光法检测河豚毒素的特异性测试:
107.特异性检测体系(12个组):河豚毒素(ttx)溶液、扇贝毒素(ptx
‑
2)溶液、石房蛤毒素(stx)溶液、微囊藻毒素(mc)溶液、冈田酸(oa)溶液、软骨藻酸(da)溶液、ttx与ptx
‑
2、stx、mc、oa、da(ttx mix)混合溶液、ttx与ptx
‑
2(ttx ptx)混合溶液、ttx与stx(ttx stx)混合溶液、ttx与mc(ttx mc)混合溶液、ttx与oa(ttx oa)混合溶液、ttx与da(ttx da)混合溶液,其中,在上述任意混合液中,ttx与其他任何一种毒素的浓度相同,且每组溶液中ttx的浓度都有5个浓度,分别为0.02ng/ml、0.2ng/ml、2ng/ml、20ng/ml和200ng/ml;
108.将100μl的aunps@mil
‑
101(0.3mg/ml)溶液与100μl的ttx cy3
‑
适配体(1μm)溶液混合,室温涡旋振荡2min;然后分别加入100μl的上述12组特异性检测体系,室温涡旋振荡40min后,采用f97pro荧光分光光度计(上海棱光技术有限公司)进行荧光测量,每个浓度平
行测定3次,记录发射波长为570nm处的荧光强度,每个样品平行测定3次。同时,以ph为7.4,浓度为50mm的tris
‑
hcl缓冲液(含150mm的nacl和2mm的mgcl2)作为对照组,获得反应前后荧光强度的改变量。荧光测量参数:激发波长,525nm;带宽,10nm;增益(pmt),1000v;扫描速度,1000nm/min;
109.所述特异性检测的结果如图2所示,由图2可知,随着ttx浓度的增加,荧光强度响应逐渐增强,表明与ttx特异性结合后,aunps@mil
‑
101表面释放出更多cy3
‑
适配体,并且在与干扰的生物毒素共存时,cy3
‑
适配体的荧光强度也没有恢复,结果表明,该荧光传感方法具有高特异性和低交叉反应。
110.测试例2
111.基于所述aunps@mil
‑
101的表面增强拉曼广谱法检测河豚毒素的特异性测试:
112.特异性检测体系(12个组):河豚毒素(ttx)溶液、扇贝毒素(ptx
‑
2)溶液、石房蛤毒素(stx)溶液、微囊藻毒素(mc)溶液、冈田酸(oa)溶液、软骨藻酸(da)溶液、ttx与ptx
‑
2、stx、mc、oa、da(ttx mix)混合溶液、ttx与ptx
‑
2(ttx ptx)混合溶液、ttx与stx(ttx stx)混合溶液、ttx与mc(ttx mc)混合溶液、ttx与oa(ttx oa)混合溶液、ttx与da(ttx da)混合溶液,其中,在上述任意混合液中,ttx与其他任何一种毒素的浓度相同,且每组溶液中ttx的浓度都有5个浓度,分别为0.02ng/ml、0.2ng/ml、2ng/ml、20ng/ml和200ng/ml;
113.将100μl的aunps@mil
‑
101(0.3mg/ml)溶液与100μl的ttx cy3
‑
适配体(1μm)溶液混合,室温涡旋振荡2min;然后分别加入100μl的上述12组特异性检测体系,室温涡旋振荡40min后,取20μl样品滴加在干净的硅片上,室温晾干后,在室温下在配备有638nm激光光源和ccd探测器的激光微共焦拉曼光谱仪(xplora plus,horiba scientific公司)中测量sers光谱,每个浓度平行测定3次,记录波数为1587cm
‑
1处的拉曼强度。同时,以ph为7.4,浓度为50mm的tris
‑
hcl缓冲液(含150mm的nacl和2mm的mgcl2)作为对照组,获得反应前后拉曼强度的改变量,每个样品平行测定3次。sers测量条件:测量前,以单晶硅的一阶峰(520.7cm
‑
1)作为参考峰位对峰位进行校准。对于每一次的样本扫描,激光束以50倍物镜聚焦。采用5s的积分时间和5mw的激光功率进行sers测量。sers光谱在800~1800cm
‑
1范围内采集3次,并利用拉曼光谱仪中配备的labspec 6分析软件对去除背景信号。
114.测试结果如图3所示,由图3可知,只有在ttx存在时,才会出现明显的拉曼响应,干扰的其它生物毒素并不能引起拉曼信号响应,说明只有ttx才能与cy3
‑
适配体发生特异性结合反应,因此说明了该sers传感方法同样具有高特异性和低交叉反应。
115.实施例2
116.将cy3荧光染料标记的河豚毒素适配体和ph为7.4的tris
‑
hcl缓冲液(50mm,包括150mm的nacl和2mm的mgcl2)混合,得到cy3
‑
适配体溶液(浓度为1μm);
117.将实施例1制备得到的aunps@mil
‑
101和ph为7.4,浓度为50mm的tris
‑
hcl缓冲液(包括150mm的nacl和2mm的mgcl2)混合,得到aunps@mil
‑
101溶液(浓度为0.3mg/ml);
118.将100μl所述cy3
‑
适配体溶液和100μl所述aunps@mil
‑
101溶液混合,在室温条件下涡旋震荡2min进行荧光淬灭后,分别加入100μl河豚毒素标准液(0.01ng/ml、0.03ng/ml、0.1ng/ml、0.3ng/ml、1ng/ml、3ng/ml、10ng/ml、30ng/ml、100ng/ml和300ng/ml)作为实验组在室温条件下涡旋震荡40min,进行荧光恢复和加入100μl的浓度为50mm的tris
‑
hcl缓冲液(包括150mm的nacl和2mm的mgcl2)作为对照组在室温条件下涡旋震荡40min,采用f97pro荧
光分光光度计(上海棱光技术有限公司)进行荧光检测(荧光测量参数:激发波长,525nm;带宽,10nm;增益(pmt),1000v;扫描速度,1000nm/min),分别记录发射波长为570nm处的荧光强度;
119.以所述河豚毒素标准液的浓度的对数为横坐标,以相对于对照组荧光强度的改变量为纵坐标,建立标准曲线;标准曲线如图4所示,由图4可知,ttx浓度的对数与荧光强度的该变量在0.01~300ng/ml的浓度范围内呈现良好的线性关系,线性方程为y=1257.43x 2893.33,r2=0.9945。
120.根据20个空白样品(即浓度为50mm的tris
‑
hcl缓冲液)的三倍标准差,计算得到所述方案的检出限为0.006ng/ml。结果表明,所述方法具有较宽的检测范围和较高的检测灵敏度。
121.将所述无毒的冷冻河豚鱼肉置于室温解冻后,用蒸馏水清洗后,用滤纸吸干,取河豚鱼的肌肉部分,将样品剪碎,充分均质,得到均质河豚鱼肌肉;将2g所述均质河豚鱼肌肉加入2ml不同浓度的ttx标准品溶液(0、0.02、0.2、2、20、200ng/ml)后,在50ml聚苯乙烯离心管中充分振荡混合5min。加入10ml的乙酸和甲醇的混合液(乙酸和甲醇的体积比为1:99),充分振荡混合5min后,60℃水浴超声提取30min,4500rpm离心5min。上清液于60℃的氮气气氛中浓缩至近干,加入2ml的乙酸溶液(0.1vol%)充分溶解残渣,经0.22μm的水相微孔滤膜过滤,滤液(即河豚毒素的浸提液)进行检测荧光分析;
122.将100μl的aunps@mil
‑
101(0.3mg/ml)溶液与100μl的ttx cy3
‑
适配体(1μm)溶液混合,室温涡旋振荡2min;然后加入100μl的上述已处理样品溶液,室温涡旋振荡40min后,采用f97pro荧光分光光度计(上海棱光技术有限公司)进行荧光测量,每个浓度平行测定6次,记录发射波长为570nm处的荧光强度。同时,以ph为7.4的tris
‑
hcl缓冲液(50mm,含150mm的nacl和2mm的mgcl2)作为对照组,获得反应前后荧光强度的改变量。根据反应前后荧光强度的改变量与ttx浓度的对数的标准曲线,获得加标河豚鱼肉样品中ttx含量,通过与实际加标浓度比较,荧光模式测得的加标回收率为97.65%~107.43%,相对标准偏差为2.85%~4.59%,果表明荧光法在检测河豚鱼肉样品具有较高的准确性和和精密度,且检测过程简单、快速,实际应用价值高。
123.实施例3
124.将cy3荧光染料标记的河豚毒素适配体和ph为7.4浓度为50mm的tris
‑
hcl缓冲液(包括150mm的nacl和2mm的mgcl2)混合,得到cy3
‑
适配体溶液(浓度为1μm);
125.将实施例1制备得到的aunps@mil
‑
101和ph为7.4浓度为50mm的tris
‑
hcl缓冲液(包括150mm的nacl和2mm的mgcl2)混合,得到aunps@mil
‑
101溶液(浓度为0.3mg/ml);
126.将100μl所述cy3
‑
适配体溶液和100μl所述aunps@mil
‑
101溶液混合,在室温条件下涡旋震荡2min进行拉曼增强后,分别加入100μl河豚毒素标准液(0.01ng/ml、0.03ng/ml、0.1ng/ml、0.3ng/ml、1ng/ml、3ng/ml、10ng/ml、30ng/ml、100ng/ml和300ng/ml)作为实验组在室温条件下涡旋震荡40min,进行荧光恢复和加入100μl的tris
‑
hcl缓冲液(50mm,包括150mm的nacl和2mm的mgcl2)作为对照组在室温条件下涡旋震荡40min,将20μl所述实验组和对照组分别滴加在干净的硅片上,室温晾干后,在室温条件下,在配备有638nm的激光光源和ccd探测器的激光微共焦表面增强拉曼光谱仪(xplora plus,horiba scientific公司)中测量表面增强拉曼光谱,并记录波数为1587cm
‑1处的拉曼强度,每个浓度平行测定3
次。进行所述表面增强拉曼检测前,以单晶硅的一阶峰(520.7cm
‑1)作为参考峰位对峰位进行校准。对于每次的样本扫描,激光束优选以50倍物镜聚焦,采用5s的积分时间和5mw的激光功率进行测量,在所述表面增强拉曼光谱为800~1800cm
‑1的范围内优选采集3次,并利用拉曼光谱仪中配备的abspec6分析软件对去除背景信号。
127.以所述河豚毒素标准液的浓度的对数为横坐标,以相对于对照组拉曼强度的改变量为纵坐标,建立标准曲线;标准曲线如图5所示,由图5可知,ttx的浓度的对数与拉曼强度的改变量在0.01~300ng/ml的范围内呈现良好的线性关系,线性方程为y=1470.04x 3386.77,r2=0.9958。根据20个空白样品的三倍标准差,计算得sers方法的ttx检出限为0.008ng/ml,结果表明表面增强拉曼光谱法具有较宽的检测范围和较高的检测灵敏度。
128.将所述无毒的冷冻河豚鱼肉置于室温解冻后,用蒸馏水清洗后,用滤纸吸干,取河豚鱼的肌肉部分,将样品剪碎,充分均质,得到均质河豚鱼肌肉;将2g所述均质河豚鱼肌肉加入2ml不同浓度的ttx标准品溶液(0、0.02、0.2、2、20、200ng/ml)后,在50ml聚苯乙烯离心管中充分振荡混合5min。加入10ml的乙酸和甲醇的混合液(乙酸和甲醇的体积比为1:99),充分振荡混合5min后,60℃水浴超声提取30min,4500rpm离心5min。上清液于60℃的氮气气氛中浓缩至近干,加入2ml的乙酸溶液(0.1vol%)充分溶解残渣,经0.22μm的水相微孔滤膜过滤,滤液(即河豚毒素的浸提液)进行检测荧光分析;
129.将100μl的aunps@mil
‑
101(0.3mg/ml)溶液与100μl的ttx cy3
‑
适配体(1μm)溶液混合,室温涡旋振荡2min;然后加入100μl的上述已处理样品溶液,室温涡旋振荡40min后,取20μl样品滴加在干净的硅片上,室温晾干后,在室温下在配备有638nm激光光源和ccd探测器的激光微共焦拉曼光谱仪(xplora plus,horiba scientific公司)中测量sers光谱,每个浓度平行测定6次,记录波数为1587cm
‑1处的拉曼强度。同时,以ph为7.4的tris
‑
hcl缓冲液(50mm,含150mm的nacl和2mm的mgcl2)作为对照组,获得反应前后拉曼强度的改变量。根据反应前后拉曼强度的改变量与ttx浓度的对数的标准曲线,获得加标河豚鱼肉样品中ttx含量,通过与实际加标浓度比较,sers模式测得的加标回收率为95.85%~106.56%,相对标准偏差为3.84%~7.25%,结果表明sers法在检测河豚鱼肉样品具有较高的准确性和和精密度,且检测过程简单、快速,实际应用价值高。
130.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。