tert过表达星形胶质细胞培养液及在促进髓鞘形成中的应用
技术领域
1.本发明涉及细胞培养液及其应用,特别涉及一种tert过表达星形胶质细胞培养液及其在促进髓鞘形成中的应用。
背景技术:
2.少突胶质细胞(oligodendrocytes,ol),起源于神经外胚层的少突胶质前体细胞(oligodendrocyte progenitor cells,opc),约占胶质细胞总数的5%
‑
10%。成熟的ol经历4个发育阶段,神经祖细胞、opc、未髓鞘化的ol以及成髓鞘化的ol。ol谱系在不同的发育阶段,表达不同的分子标记物,可依据不同的抗原进行标记,如a2b5标记opc、ng2/o4标记未髓鞘化的ol、髓磷脂碱性蛋白(myelin basic protein,mbp)标记成熟阶段的ol。成熟的ol是中枢神经系统的形成髓鞘结构的主要细胞,在维持神经冲动的跳跃式传导和轴突的绝缘性及完整性中至关重要。髓鞘形成是一个高度动态的过程,由ol产生髓鞘,包裹在神经元轴突周围,参与神经冲动的快速跳跃传导和保护轴突的完整性。
3.发生于中枢神经系统的髓鞘相关性病变,可分为成髓鞘障碍和脱髓鞘病变。髓鞘形成过程涉及高能量消耗和高代谢转换,极易受细胞毒性和兴奋性毒性的影响,致使髓鞘化障碍。ol在妊娠晚期经历了发育成熟的关键阶段,是早产儿发生脑白质损伤(white matter injury,wmi)主要累及的细胞群体。据统计,在全世界范围内,每年约有1500万例早产儿,约占出生新生儿总数的10%。早产儿由于中枢神经系统尚未发育成熟,更容易遗留永久性的神经损害,如脑瘫、癫痫、精神行为异常、认知及学习障碍等,早产及其并发症是新生儿和5岁以下儿童死亡的主要原因。wmi是早产儿缺氧缺血损伤后幸存患儿最常见的中枢神经系统损伤形式,在超过50%的极低出生体重儿中可能存在一定程度的脑白质损伤。因此,wmi是一个全球化的早产儿健康问题,具有较大的社会和经济负担,如何有效治疗及减轻患儿远期神经系统后遗症,改善患儿生活质量是一个亟待解决的问题。在wmi的急性期主要以未髓鞘化的ol为靶向,发生明显的氧化损伤,导致髓鞘形成障碍。wmi的慢性期,在神经胶质炎性反应、氧化应激、胶质瘢痕增生等作用下,致使髓鞘再生和修复功能异常,破坏了未髓鞘化的ol的成熟和正常的髓鞘形成过程。因此,如何使缺氧缺血下少突胶质细胞进行正常分化,促进髓鞘形成,对改善wmi患儿近期、远期的预后,具有重要意义。
4.脱髓鞘病变主要包含多发性硬化等免疫介导的髓鞘破坏性特异性疾病,多青壮年起病,以中枢神经系统多发髓鞘脱失以及少突胶质细胞的大量丢失为主要病理特点。目前这类疾病尚无特异性的治疗方法,与成髓鞘障碍疾病的治疗方法类似,脱髓鞘病变也需要通过促进髓鞘形成、调节少突胶质细胞的功能改善其病理损伤。
5.星形胶质细胞(astrocyte,as),作为中枢神经系统数量最多,体积最多的一类胶质细胞,发挥强大的营养支持和免疫调节功能。研究表明,星形胶质细胞参与调节髓鞘形成的每一步过程,包括opc增殖、分化、ol
‑
轴突初始接触和髓鞘形成(domingues h s,portugal c c,socodato r,et al.oligodendrocyte,astrocyte,and microglia crosstalk in myelin development,damage,and repair[j].front cell dev biol,
2016,4:71.)。但基于星形胶质细胞的微环境对少突胶质细胞有双重作用,一方面,来源于as分泌的可溶性因子,如趋化因子家族系列(1、8、10、12)、白血病抑制因子等,能够促进ol的髓鞘化过程;另一方面,as分泌的另一类因子,如血小板衍生生长因子、碱性成纤维生长因子、tenascin c,骨形态发生蛋白、透明质酸和内皮素
‑
1,能够抑制ol的分化,对髓鞘的形成产生负面作用。因此如何增强星形胶质细胞对少突胶质细胞的保护作用,促进髓鞘形成,是亟待解决的问题。
技术实现要素:
[0006]
本发明的目的在于克服现有技术的不足,提供一种端粒酶逆转录酶过表达星形胶质细胞培养液及其在促进髓鞘形成中的应用。
[0007]
所述端粒酶逆转录酶,是端粒酶的催化亚基,其英文为telomerase reverse transcriptase,在说明书继后的描述中端粒酶逆转录酶简称为tert。
[0008]
本发明所述tert过表达星形胶质细胞培养液,用含tert的慢病毒转染第三代、第四代或第五代星形胶质细胞,构建tert过表达的星形胶质细胞;再向稳定转染tert过表达的星形胶质细胞加入无血清高糖dmem培养基培养,即获得tert过表达星形胶质细胞培养液。无血清高糖dmem培养基的加入量取决于培养皿的大小。
[0009]
上述tert过表达星形胶质细胞培养液,所述tert过表达的星形胶质细胞加入无血清高糖dmem培养基的培养是在37℃恒温细胞培养箱内持续培养18h至72h。培养箱为5v.%co2、95v.%空气的co2培养箱。
[0010]
本发明通过实验证明:tert过表达星形胶质细胞培养液对缺氧缺血少突胶质前体细胞具有保护作用,减少了少突胶质前体细胞凋亡并促进少突胶质前体细胞分化。因此,可将tert过表达星形胶质细胞培养液在促进髓鞘形成中应用。
[0011]
本发明具有以下有益结果:
[0012]
1、本发明成功获得了tert过表达星形胶质细胞培养液。
[0013]
2、本发明所述tert过表达星形胶质细胞培养液为少突胶质前体细胞的保护及促进髓鞘形成提供了一种新的技术方案。
附图说明
[0014]
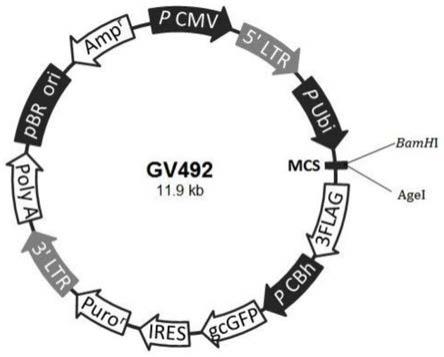
图1为慢病毒载体图谱;载体名称:gv492;原件顺序:ubi
‑
mcs
‑
3flag
‑
cbh
‑
gcgfp
‑
ires
‑
puromycin;荧光标签:绿色荧光蛋白(gcgfp);克隆位点:bamhi/agei。
[0015]
图2为体外培养的大鼠星形胶质细胞照片;其中,a
‑
c分别为原代大鼠星形胶质细胞培养1天、3天、7天的生长状态照片;d
‑
f分别为第二代纯化的大鼠星形胶质细胞接种后24h、72h及95%融合的照片。
[0016]
图3为使用免疫荧光染色鉴定大鼠星形胶质细胞的照片;其中,a为细胞核图片,b为星形胶质细胞,c为ab合并,d为c图中方框放大。
[0017]
图4为体外培养大鼠少突胶质前体细胞的照片;其中,a为原代大鼠少突胶质前体细胞增殖阶段培养1天的生长状态照片,箭头示:细胞呈双极突起形态;b、c分别为原代大鼠少突胶质前体细胞增殖阶段培养3天、7天的生长状态照片;d
‑
f分别为原代大鼠少突胶质前体细胞分化阶段培养至9天、12天、14天的生长状态。
[0018]
图5为使用免疫荧光染色鉴定少突胶质前体细胞的照片;其中,a
‑
d分别为原代大鼠少突胶质前体细胞增殖阶段o4特异性表达的照片,其中,a为细胞核图片,b为增殖阶段少突胶质前体细胞,c为ab合并,d为c图中方框放大;e
‑
h分别为原代大鼠少突胶质前体细胞分化阶段髓磷脂碱性蛋白(myelin basic protein,mbp)特异性表达的照片,其中,e为细胞核图片,f为分化阶段少突胶质前体细胞,g为ef合并,h为g图中方框放大。
[0019]
图6为慢病毒转染星形胶质细胞tert mrna表达图;其中,r
‑
nc为慢病毒载体大鼠星形胶质细胞阴性对照组;r
‑
tert为tert过表达慢病毒大鼠星形胶质细胞组。
[0020]
图7为使用免疫荧光染色检测星形胶质细胞tert表达照片;其中。r
‑
nc(rat
‑
negative control)为慢病毒载体大鼠星形胶质细胞阴性对照组;r
‑
tert(rat
‑
tert)为tert过表达慢病毒大鼠星形胶质细胞组。
[0021]
图8为体外氧
‑
糖剥夺不同时间点大鼠少突胶质前体细胞的存活率随时间的变化图。
[0022]
图9为细胞培养液干预氧糖剥夺模型(oxygen
‑
glucose deprivation,ogd)少突胶质前体细胞的存活率图;其中,acm为星形胶质细胞培养液组;nc为阴性对照细胞培养液组;tert为tert过表达星形胶质细胞培养液组。
[0023]
图10为使用免疫荧光染色检测三组细胞培养液干预7天少突胶质前体细胞后细胞mbp表达情况照片。其中,a为常氧对照组照片:常氧对照组少突胶质前体细胞分化;b为氧糖剥夺组照片:氧
‑
糖剥夺组少突胶质前体细胞分化。acm为星形胶质细胞培养液组;nc为阴性对照细胞培养液组;tert为tert过表达星形胶质细胞培养液组。
[0024]
图11为细胞培养液中差异表达蛋白筛选图,nc为阴性对照细胞培养液组;tert为tert过表达星形胶质细胞培养液组;其中,a为差异表达蛋白整体分布情况图;b为差异表达蛋白火山图。
[0025]
图12为tert组细胞培养液中top30差异蛋白go生物学过程富集分析图。
[0026]
图13为慢病毒转染星形胶质细胞差异表达蛋白验证图;其中,a为ptn的mrna表达水平图;b为mdk的mrna表达水平图;c为rheb的mrna表达水平图;其中。r
‑
nc(rat
‑
negative control)为慢病毒载体大鼠星形胶质细胞阴性对照组;r
‑
tert(rat
‑
tert)为tert过表达慢病毒大鼠星形胶质细胞组。
[0027]
图14为重组多效生长因子(pleiotrophin,ptn)蛋白干预ogd少突胶质前体细胞分化情况照片;其中,a为常氧对照组照片:常氧对照组少突胶质前体细胞分化;b为氧
‑
糖剥夺组照片:氧
‑
糖剥夺组少突胶质前体细胞分化。
具体实施方式
[0028]
1、实验材料与试剂
[0029]
1.1实验动物
[0030]
spf级别sd1日龄大鼠乳鼠,雌雄不限,提取大鼠星形胶质细胞及少突胶质细胞前体细胞。所有实验动物购自达硕实验动物有限公司(成都),均具备动物合格证。
[0031]
1.2主要试剂
[0032]
[0033]
[0034][0035]
2、实验方法
[0036]
2.1原代大鼠星形胶质细胞培养
[0037]
1)准备工作:提前一天将器械盒、枪头、烧杯于高压蒸汽灭菌锅灭菌并烘干;
[0038]
2)麻醉、消毒:取8只1日龄的sd大鼠乳鼠分批于冰上麻醉2
‑
3min,于预冷的75%乙醇(体积分数)的烧杯内浸泡1
‑
2min;
[0039]
3)取脑:取出已麻醉和消毒的乳鼠,断头,取出完整的脑组织,放入盛有预冷的pbs缓冲液6cm皿内;
[0040]
4)分离脑组织:分离嗅球、小脑、丘脑。沿大脑中线将脑组织分为左右两侧,将丘脑分离后,放入盛有预冷的pbs缓冲液6cm皿内;
[0041]
5)剔除血管膜:于解剖显微镜下剔除血管膜,放至于冰上且预冷的4ml高糖dmem内;
[0042]
6)消化:使用眼科镊将脑组织剪成约为1mm3的组织块,加入1ml 10mg/ml的木瓜蛋白酶。加入50μl 1ku dna酶ⅰ。消化30min,每间隔10min,晃动培养皿;
[0043]
7)终止消化:消化结束后,弃去含消化酶的培养基后,加入10%fbs(体积分数)的高糖dmem中,并再次加入50
‑
100μl1ku dna酶ⅰ,吹打为单细胞悬液后,再次加入4
‑
5ml10%fbs(体积分数)的高糖dmem,吹打混匀后,静置2
‑
3min。
[0044]
8)过滤:将70μm滤网放置于50ml离心管上,使用10%fbs(体积分数)的高糖dmem预润,吸取含星形胶质细胞的单细胞悬液至滤网上,下层即为含星形胶质细胞的单细胞悬液母液;
[0045]
9)计数:取无菌ep管,吸取5μl细胞悬液母液,加入至含45μl培养基的ep管内,混匀后,吸取10μl于镜下计数;
[0046]
10)接种:计数结束后,按照8
×
10^6个细胞接种,培养体积为8
‑
10ml 10%fbs(体积分数)的高糖dmem,接种到预包被且已清洗的t75培养瓶内,于恒温培养箱内培养(5v.%co2,95v.%空气的co2培养箱);
[0047]
11)换液:隔天于光学显微镜下观察所提取的细胞生长及贴壁情况,并给予更换新鲜的培养基。后每3天换液,待生长至85%
‑
90%融合后,进行纯化及传代。
[0048]
2.2原代大鼠少突胶质前体细胞培养
[0049]
1)
‑
9):操作方法同原代大鼠星形胶质细胞培养;
[0050]
10)磁珠孵育:吸取细胞总数为4
×
10^7个含少突胶质前体细胞的混合细胞悬液于15ml离心管内,封口胶封住瓶口。10min,0.3rcf,离心,移去上清,加入0.36ml分选柱缓冲液和0.04mla2b5免疫磁珠,混匀,4℃冰箱内孵育半小时。每间隔10min,轻轻摇晃离心管。
[0051]
11)离心:孵育后,加入2ml分选柱缓冲液,0.3rcf,离心10min。
[0052]
12)磁场分选a2b5阳性细胞:加入0.5ml的免疫磁珠分选柱缓冲液,混匀后,将macs分选器放入生物安全柜内,于相应的卡槽放置ls分选柱。吸取细胞悬液0.5ml,轻轻滴入ls分选柱内,待其完全通过分选柱后,加入2ml分选柱缓冲液洗脱a2b5阴性的细胞,共计4次,分选柱下方用离心管收集洗脱液。洗脱结束后,将ls分选柱从macs分选器上取下,置于15ml离心管内,加入5ml分选柱缓冲液洗脱a2b5阳性细胞;
[0053]
13)计数:0.3rcf,离心10min。弃上清,加入少突胶质细胞前体细胞增殖培养基2ml,重悬,吸取10μl单细胞悬液母液,镜下计数。根据细胞总数,,按照2
×
10^5个细胞,500μl培养体系接种于预多聚鸟氨酸包被内含细胞爬片的24孔板内,于37℃恒温培养箱内培养(5v.%co2,95v.%空气的co2培养箱)。
[0054]
2.3免疫荧光染色鉴定星形胶质细胞及少突胶质前体细胞
[0055]
1)取出内置星形胶质细胞及少突胶质前体细胞的细胞爬片的24孔板,弃上清,pbs漂洗三次,1次/5min;
[0056]
2)固定:向每孔加入500μl 4%多聚甲醛(质量体积分数),于室温下固定30min;
[0057]
3)弃去多聚甲醛,pbs漂洗三次,1次/5min;
[0058]
4)穿孔:加入500μl 0.3%tritonx
‑
100(体积分数),室温放置15
‑
30min;
[0059]
5)荧光封闭液封闭:弃去0.3%triton(体积分数),加入0.5ml荧光封闭液,孵育60min;
[0060]
6)一抗孵育:弃去封闭液;每孔分别加入180
‑
200μl封闭液配制的一抗(gfap,1:500,o4,1:50;mbp,1:250),于4℃冰箱内孵育12h
‑
18h;
[0061]
7)弃去一抗,pbs漂洗3次,每次5min(可于摇床上低速清洗);
[0062]
8)二抗孵育:滴加封闭液配制的二抗和dapi(1:500),避光静置1小时;
[0063]
9)避光,pbs漂洗三次,1次/5min;
[0064]
10)封片:载玻片上滴加适量抗淬灭剂,取出爬片,用纸吸干pbs后,将细胞爬片面倒置在已滴加荧光淬灭剂的玻片上,采集图片。
[0065]
2.4慢病毒转染第三代成熟星形胶质细胞
[0066]
1)细胞纯化:于光学显微镜下观察步骤2.1所培养的原代大鼠星形胶质细胞(一代星形胶质细胞)细胞生长情况,待原代星形胶质细胞生长至90%融合程度左右,约7
‑
9天,进行恒温摇床振荡提纯。使用封口胶封住t75培养瓶瓶口,设置恒温摇床温度37℃,转速180r/min,振荡30min用以去除贴壁能力较差的小胶质细胞。移除上清,pbs缓冲液清洗1
‑
2次后,加入新鲜培养基8ml,再次用封口胶封住t75培养瓶瓶口,设置温度37℃,转速为240r/min,持续振荡18
‑
24h用以除去少突胶质细胞。取出培养瓶,并用酒精棉球消毒瓶身及瓶口周围,剧烈摇晃培养瓶约1min后,弃去上清,pbs缓冲液清洗2
‑
3次后,再次加入新鲜培养基8
‑
10ml,于37℃恒温培养箱内培养至100%融合(5v.%co2,95v.%空气的co2培养箱)。
[0067]
2)一次传代:待纯化后的第一代星形胶质细胞生长融合至100%后,弃去培养基,pbs缓冲液清洗1
‑
2次后,加入1.5
‑
2ml胰酶,晃动培养瓶,使胰酶铺满瓶底细胞,镜下观察,
待细胞突起回缩、变圆、细胞间连接消失,弃去胰酶,加入5
‑
8ml星形胶质细胞培养基吹打为单细胞悬液后,按照1:3进行传代,即为第二代星形胶质细胞,于37℃恒温培养箱内培养至细胞生长融合至100%(5v.%co2,95v.%空气的co2培养箱);
[0068]
3)二次传代:将第二代成熟的星形胶质细胞消化接种,24孔板接种密度根据病毒感染预实验调整至5
×
10^4个细胞,6孔板接种密度根据病毒感染预实验调整至1.25
×
10^5个细胞,10cm皿接种密度为1.4
×
10^6个细胞,于37℃恒温培养箱内培养(5v.%co2,95v.%空气的co2培养箱),即为第三代星形胶质细胞;
[0069]
4)阴性对照空载体及tert过表达慢病毒载体制备:阴性对照空载体及tert过表达慢病毒载体由吉凯基因承担慢病毒包装(病毒滴度,阴性对照空载体组简称阴性对照:3.0
×
10^8tu/ml;tert过表达慢病毒载体组简称tert:5
×
10^8tu/ml)。目的基因名称:tert(nm_053423);物种:rat;基因大小:3378bp。慢病毒载体图谱如图1所示,载体名称:gv492;原件顺序:ubi
‑
mcs
‑
3flag
‑
cbh
‑
gcgfp
‑
ires
‑
puromycin;荧光标签:绿色荧光蛋白(gcgfp);克隆位点:bamhi/agei;
[0070]
5)病毒感染:待第三代星形胶质细胞生长至35%
‑
45%,根据慢病毒的滴度,按照moi=5加入相应的病毒体积(阴性对照:3.0
×
10^8tu/ml;tert:5
×
10^8tu/ml)后,置于37℃恒温培养箱内培养(5v.%co2,95v.%空气的co2培养箱),隔天荧光显微镜观察绿色荧光蛋白表达程度。
[0071]
6)筛选:慢病毒感染3天后,观察gcgfp表达量,待gcgfp达到80%程度,根据慢病毒载体所携带的抗性基因—嘌呤霉素,加入1μg/ml工作浓度的嘌呤霉素进行稳定转染阴性对照及tert过表达组的细胞筛选(嘌呤霉素筛选维持浓度0.5μg/ml);筛选至gcgfp达到90%以上,即可进行tert转染效率的检测。筛选期间,根据细胞生长状态及绿色荧光蛋白表达量,调整筛选浓度及筛选时间。
[0072]
2.5 qpcr检测转染效率
[0073]
1)trizol法提取rna
[0074]
将培养在6孔板内稳定转染tert的三代成熟星形胶质细胞,弃去上清,pbs清洗后,每孔加入0.5mltrizol,于冰上裂解5
‑
8min后,使用1ml枪尖倒置或细胞刮,刮取细胞后,再次裂解5min后,将含rna的裂解液转移至ep管内,放置于冰上;配制75%乙醇(体积分数,使用无酶水配制),
‑
20℃预冷备用;每孔加入100μl氯仿,混匀,静置10
‑
15min,待分层后,12000rcf,4℃离心15min;小心吸取上层上清,约200
‑
300μl后,加入与所吸取的上清体积相等的异丙醇后,混匀后放置10min,12000rcf,4℃离心10min;直接弃去上清后,加入预冷的75%乙醇(体积分数),悬浮rna沉淀后,转速设置为7000rcf,4℃离心5min后;弃上清,重复操作。将ep管管口朝下,吸干多余的乙醇,待乙醇挥发后,加入20μl无酶水溶解rna沉淀,于冰上,测定浓度用以逆转录操作。
[0075]
2)逆转录
[0076]
去基因组dna
[0077][0078]
反应条件:42℃,2min。
[0079]
逆转录
[0080][0081]
反应条件:
①
50℃,15min;
②
85℃,5sec。
[0082]
反应结束后,将cdna稀释至100μl,可立即进行qpcr或保存于
‑
20℃备用。
[0083]
3)荧光定量pcr
[0084]
引物序列:
[0085][0086]
反应体系:
[0087][0088]
反应程序:
[0089][0090]
2.6免疫荧光
[0091]
1)取出稳定转染阴性对照的第三代星形胶质细胞及稳定转染tert过表达慢病毒的第三代星形胶质细胞的细胞爬片的24孔板,弃上清,pbs漂洗三次,1次/5min;
[0092]
2)固定:向每孔加入500μl 4%多聚甲醛(质量体积分数),于室温下固定30min;
[0093]
3)弃去多聚甲醛,pbs漂洗三次,1次/5min;
[0094]
4)穿孔:加入500μl 0.3%tritonx
‑
100(体积分数),室温放置15
‑
30min;
[0095]
5)荧光封闭液封闭:弃去0.3%triton(体积分数),加入0.5ml荧光封闭液,孵育60min;
[0096]
6)一抗孵育:弃去封闭液;每孔分别加入180
‑
200μl封闭液配制的一抗(rabbit
‑
anti tert1:250),于4℃冰箱内孵育12h
‑
18h;
[0097]
7)弃去一抗,pbs漂洗3次,每次5min(可于摇床上低速清洗);
[0098]
8)二抗孵育:滴加封闭液配制的二抗和dapi(1:500),避光静置1小时;
[0099]
9)避光,pbs漂洗三次,1次/5min;
[0100]
10)封片:载玻片上滴加适量抗淬灭剂,取出爬片,用纸吸干pbs后,将细胞爬片面倒置在已滴加荧光淬灭剂的玻片上,采集图片。
[0101]
2.7构建tert过表达星形胶质细胞培养液
[0102]
1)将三组细胞:第三代星形胶质细胞、稳定转染阴性对照的第三代星形胶质细胞及稳定转染tert过表达慢病毒的第三代星形胶质细胞分为3组,于37℃恒温培养箱内进行培养(5v.%co2,95v.%空气的co2培养箱);
[0103]
2)待三组细胞生长至90%融合以上,分别对三组细胞使用pbs清洗两次,再分别加入等量无血清高糖dmem培养基(所添加培养基的量取决于培养皿的大小),于37℃恒温细胞培养箱内持续培养18h(5v.%co2,95v.%空气的co2培养箱);将第三代星形胶质细胞加入无血清高糖dmem培养基培养18h的细胞培养液命名为星形胶质细胞培养液组(astrocyte conditioned medium,acm组),将稳定转染阴性对照的第三代星形胶质细胞加入无血清高糖dmem培养基培养18h的细胞培养液命名为阴性对照细胞培养液组(negative control,nc组),将稳定转染tert过表达慢病毒的第三代星形胶质细胞加入无血清高糖dmem培养基培养18h的细胞培养液命名为tert过表达细胞培养液组(tert组),tert组即为tert过表达星形胶质细胞培养液。
[0104]
2.8 tert过表达星形胶质细胞培养液对少突胶质前体细胞功能的调控
[0105]
2.8.1构建少突胶质前体细胞体外缺氧缺血模型
[0106]
1)将无糖无血清dmem放置于含94v.%高纯n2、5v.%高纯co2、1v.%氧气o2的三气培养箱,预缺氧8
‑
10h;
[0107]
2)光学显微镜下观察,待少突胶质前体细胞生长至85%
‑
90%,pbs漂洗2次;
[0108]
3)加入预缺氧的无糖无血清dmem,设置缺氧时间梯度2h、4h、6h,放置于三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内模拟体外缺氧缺血,即氧糖剥夺模型(oxygen
‑
glucose deprivation,ogd);同时设置常氧对照组。
[0109]
2.8.2 cck8检测在氧
‑
糖剥夺不同时间点少突胶质前体细胞存活率
[0110]
1)设置对照组与不含细胞的空白对照。将培养在96孔板内不同缺氧时间梯度的少突胶质前体细胞(2h、4h、6h),从三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内取出,移去培养基后,pbs缓冲液轻柔漂洗1次后,每孔加入预先配制的含cck8的培养基100μl(培养基:cck8=10:1);
[0111]
2)在37℃恒温培养箱内孵育1
‑
4h(5v.%co2,95v.%空气的co2培养箱),测定各组在450nm波长的吸光度
[0112]
3)计算:细胞存活率=(氧糖剥夺组
‑
空白)/(对照组
‑
空白)
×
100%。
[0113]
2.8.3 tert过表达星形胶质细胞培养液干预少突胶质前体细胞
[0114]
1)将上述2.7中所收集的acm组、nc组和tert组无血清高糖dmem培养基培养18h的细胞培养液上清,0.5rcf,离心15min,去除细胞成分后,过滤备用;
[0115]
2)将常氧对照组和氧糖剥夺组2h的少突胶质前体细胞,分别从37℃恒温培养箱(5v.%co2,95v.%空气的co2培养箱)和三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内取出,移去培养基,pbs缓冲液轻轻漂洗细胞1次后,添加各组细胞培养液;
[0116]
3)分别按照比例添加各组培养液后,于37℃恒温培养基内进行培养(5v.%co2,95v.%空气的co2培养箱);
[0117]
[0118]
备注:分化期opc细胞培养液干预,隔天换液。acm组:星形胶质细胞培养液组;nc组:阴性对照细胞培养液组;tert组:tert过表达细胞培养液组(tert组)
[0119]
2.8.4 cck8检测各组少突胶质前体细胞存活率
[0120]
1)常氧对照组:将培养在24孔板内的少突胶质前体细胞,从常氧恒温培养箱内取出,移去培养基后,pbs缓冲液轻柔漂洗1次后,按上述2.8.3细胞存活阶段表格所示培养基添加比例,添加细胞培养液,每组4个复孔,于37℃恒温细胞培养箱培养24h(5v.%co2,95v.%空气的co2培养箱);
[0121]
2)氧糖剥夺组:将培养在24孔板内缺氧2h的少突胶质前体细胞,从三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内取出,移去培养基后,pbs缓冲液轻柔漂洗1次后,按上述2.8.3细胞存活阶段表格所示培养液添加比例,添加细胞培养液,恒温细胞培养箱培养24h,每组4个复孔,于37℃恒温培养基内进行培养(5v.%co2,95v.%空气的co2培养箱)
[0122]
3)两组每孔均加入预先配制的含cck8的培养基500μl;同时设置无细胞的空白对照组;
[0123]
4)检测及计算同上述2.8.2。
[0124]
2.9免疫荧光染色检测细胞分化
[0125]
1)常氧对照组:将培养在24孔板内的少突胶质前体细胞,从常氧恒温培养箱内取出,移去培养基后,pbs缓冲液轻柔漂洗1次后,按上述2.8.3分化阶段表格所示培养液添加比例添加,于37℃恒温细胞培养箱培养7天(5v.%co2,95v.%空气的co2培养箱),隔天换液,每组4个复孔;
[0126]
2)氧糖剥夺组:将培养在24孔板内缺氧2h的少突胶质前体细胞,从三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内取出,移去培养基后,pbs缓冲液轻柔漂洗1次后,按上述2.8.3分化阶段表格所示培养液添加比例添加,于37℃恒温细胞培养箱培养7天(5v.%co2,95v.%空气的co2培养箱),隔天换液,每组4个复孔;
[0127]
3)收集各组细胞培养液干预7天的常氧对照组和氧糖剥夺的少突胶质前体细胞的细胞爬片,弃上清,pbs漂洗三次,1次/5min;
[0128]
4)固定:向每孔加入500μl 4%多聚甲醛(质量体积分数),于室温下固定30min;
[0129]
5)弃去多聚甲醛,pbs漂洗三次,1次/5min;
[0130]
6)穿孔:加入500μl 0.3%tritonx
‑
100(体积分数),室温放置15
‑
30min;
[0131]
7)荧光封闭液封闭:弃去0.3%triton(体积分数),加入0.5ml荧光封闭液,孵育60min;
[0132]
8)一抗孵育:弃去封闭液;每孔分别加入180
‑
200μl封闭液配制的一抗(mouseanti
‑
mbp:1:250),于4℃冰箱内孵育12h
‑
18h;
[0133]
9)弃去一抗,pbs漂洗3次,每次5min(可于摇床上低速清洗);
[0134]
10)二抗孵育:滴加封闭液配制的二抗和dapi(1:500),避光静置1小时;
[0135]
11)避光,pbs漂洗三次,1次/5min;
[0136]
12)封片:载玻片上滴加适量抗淬灭剂,取出爬片,用纸吸干pbs后,将细胞爬片面倒置在已滴加荧光淬灭剂的玻片上,采集图片。
[0137]
2.10细胞培养液蛋白组学检测
[0138]
采用串联质谱标签(tandem mass tags,tmt)技术,进行细胞培养液中蛋白质的定性和定量分析。基本步骤如下:
[0139]
2.10.1细胞培养液蛋白提取
[0140]
1)水浴溶解将阴性对照细胞培养液组(negative control,nc组)以及tert过表达细胞培养液组(tert组)(每组四个生物学重复,两组共计8个样品),每次转移10ml上清至3kd超滤离心管中;
[0141]
2)4℃,6400rcf离心40min,弃上清,并重复上一步至样品用完;
[0142]
3)转移出截留液用200μl色谱水冲洗超滤管3次,与截留液混合后,于4℃,12000rcf离心15min后,取上清,过夜冻干;
[0143]
4)加入sd裂解液于冻干液中,室温溶解3h;
[0144]
5)12000rcf离心10min后,转移上清并离心以去除不溶杂质;
[0145]
6)上清即分别为阴性对照细胞培养液组(negative control,nc组)以及tert过表达细胞培养液组(tert组)的总蛋白溶液,蛋白浓度测定后,分装储存于
‑
80℃;
[0146]
7)样品浓度采用thermo(america)bca试剂盒进行蛋白浓度测定;
[0147]
8)工作液配制(现配现用):a液和b液按50:1(体积比)比例配置混匀,根据样本数量配制;
[0148]
9)取20μl蛋白标准品(2mg/mlbsa),加入60μl ddh2o稀释为0.5mg/ml;
[0149]
10)按(0,1,2,4,8,12,16,20)μl将稀释后标准蛋白分别加到96孔板,根据20μl终体积使用ddh2o补齐;
[0150]
11)样品各取2μl加到96孔板的样品孔中,根据20μl终体积每孔加入18μl使用ddh2o补齐;
[0151]
12)每孔加入0.2ml工作液,避免气泡产生,酶标仪测定562nm波长下溶液的吸光度;
[0152]
13)根据标准曲线,计算待测样品浓度(μg/μl)。
[0153]
2.10.2 sds—聚丙烯酰胺凝胶电泳
[0154]
根据蛋白浓度,每个样品分别取10μg总蛋白,采用12%浓度(体积分数)的胶进行分离;考马斯亮蓝染液染色后成像。
[0155]
2.10.3胰蛋白酶酶解
[0156]
1)根据所测的蛋白浓度,对每个样品取50μg的总蛋白(使用裂解液将不同浓度的样品稀释至相同的浓度和体积);
[0157]
2)加入25nm的二硫苏糖醇(dithiothreitol,dtt),终浓度为5mm,混匀,55℃孵育30min后,冰上冷却至室温;
[0158]
3)加入100nm的碘乙酰胺(iodacetamide,iam),终浓度为10mm,混匀后,避光放置15min;
[0159]
4)加入6倍体积的丙酮以沉淀蛋白,
‑
20℃放置4h以上;
[0160]
5)4℃,8000rcf离心10min收集沉淀,挥发丙酮2
‑
3min;
[0161]
6)加入100μl 200mm的teab再次溶解沉淀后,加入样品质量的1/50的1mg/ml胰酶trypsin
‑
tpck,于37℃消化12h
‑
18h;
[0162]
7)将酶解后的各组样品冻干,
‑
80℃保存。
[0163]
2.10.4肽段标记
[0164]
1)每管加入50μl teab(100mm)缓冲液,涡旋混匀,行肽段标记反应;
[0165]
2)加入20μl无水乙腈至平衡至室温的tmtpro试剂,涡旋5min,离心;
[0166]
3)每管样品中加入10μl tmtpro,涡旋混匀,室温放置1h。
[0167]
4)每管加入5μl羟胺(hydroxylamine)(羟胺浓度为5%),以终止肽段标记反应。15min后,冻干各组样品,
‑
80℃冰箱保存备用。
[0168]
2.10.5质谱分离
[0169]
采用agilent 1100hplc液相系统,反相色谱分离两组样品。流动相a相为含2%(体积分数)的乙腈(acetonitrile,acn)水溶液,b相含90%(体积分数)的acn水溶液,a相和b相均使用氨水调节ph=10。上样后,设置色谱柱流速为300nl/min,梯度洗脱耗时75min。a相:98%持续8min
→
98%~95%持续0.6s
→
95%~75%持续39.99min
→
75~60%持续12min
→
60~10%持续0.6s
→
10%持续0.010.6s
→
10~98%持续0.6s
→
98%持续4.99min。收集8
‑
60min之间流出的样品,采用真空干燥后冷冻保存待检。
[0170]
色谱柱流速设置为350nl/min,将样品上样至预柱后,采用75μm
×
15cm的rp
‑
c18分析柱分离样品。0.1%(体积分数)的甲酸水溶液为流动相a相,80(体积分数)%的甲酸acn水溶液(甲酸为0.1%(体积分数))为流动相b相。梯度洗脱耗时60min,流动相b相:2
‑
6%持续1min
→6‑
35%持续51min
→
35
‑
90%持续2min
→
90%持续6min。使用q exactive hf质谱仪,以数据依赖型的正离子检测方式分析数据,m/z扫描范围在350
‑
1650之间,并对15个最高峰进行全扫描。ms1自动增益为3e 6,ms2自动增益为1e 5。ms1设为120000,ms1/ms2设为60000,最大注射时间和动态排除的时间分别设置为30ms、40ms。使用proteome discover(2.4版本)对原始下机数据进行分析,蛋白database采用uniprot
‑
proteome_up000002494
‑
20200817.fasta。trypsin为消化酶,漏切数设置为2;动态修饰为氧化(m),乙酰基(n
‑
末端),固定修饰为tmt(n末端,k);氨基甲酰甲基(c);ms1和ms2的公差分别设置为10ppm、0.02da。
[0171]
2.11差异表达蛋白筛选及验证
[0172]
对阴性对照细胞培养液组(negative control,nc组)以及tert过表达细胞培养液组(tert组)中差异表达蛋白进行表达水平及蛋白功能分析及筛选进行转录水平的验证。
[0173]
引物序列:
[0174][0175]
2.12重组ptn对缺氧缺血少突胶质前体细胞分化的影响
[0176]
1)将原代培养至7天的opc,分为常氧对照组和氧糖剥夺组;
[0177]
2)将无糖无血清dmem放置于含94v.%高纯n2、5v.%高纯co2、1v.%氧气o2的三气培养箱,预缺氧8
‑
10h;
[0178]
3)常氧对照组:将培养在24孔板内(内含细胞爬片)的少突胶质细胞取出,pbs缓冲液清洗两次后,加入opc基础培养基配制100ng/ml浓度的ptn,于37℃恒温细胞培养箱培养7天(5v.%co2,95v.%空气的co2培养箱),隔天换液,每组三个复孔;同时设置不含ptn蛋白的阴性对照组;
[0179]
4)氧糖剥夺组:将培养在24孔板内(内含细胞爬片)的少突胶质细胞取出,pbs缓冲液清洗两次后,加入预缺氧的无糖无血清dmem,于三气培养箱(94v.%高纯n2、5v.%高纯co2、1v.%氧气o2)内培养2h。弃去培养基,加入opc基础培养基配制100ng/ml浓度的ptn,于37℃恒温细胞培养箱培养7天(5v.%co2,95v.%空气的co2培养箱),隔天换液,每组三个复孔;同时设置不含ptn蛋白的阴性对照组;
[0180]
5)分别收集不含ptn蛋白的阴性对照组和含100ng/ml浓度的ptn干预7天的常氧对照组和氧糖剥夺的少突胶质前体细胞的细胞爬片,弃上清,pbs漂洗三次,1次/5min;
[0181]
6)固定:向每孔加入500μl 4%多聚甲醛(质量体积分数),于室温下固定30min;
[0182]
7)弃去多聚甲醛,pbs漂洗三次,1次/5min;
[0183]
8)穿孔:加入500μl 0.3%tritonx
‑
100(体积分数),室温放置15
‑
30min;
[0184]
9)荧光封闭液封闭:弃去0.3%triton(体积分数),加入0.5ml荧光封闭液,孵育60min;
[0185]
10)一抗孵育:弃去封闭液;每孔分别加入180
‑
200μl封闭液配制的一抗(mouseanti
‑
mbp:1:250),于4℃冰箱内孵育12h
‑
18h;
[0186]
11)弃去一抗,pbs漂洗3次,每次5min(可于摇床上低速清洗);
[0187]
12)二抗孵育:滴加封闭液配制的二抗和dapi(1:500),避光静置1小时;
[0188]
13)避光,pbs漂洗三次,1次/5min;
[0189]
14)封片:载玻片上滴加适量抗淬灭剂,取出爬片,用纸吸干pbs后,将细胞爬片面倒置在已滴加荧光淬灭剂的玻片上,采集图片。
[0190]
3、实验结果
[0191]
3.1星形胶质细胞及少突胶质前体细胞形态及鉴定
[0192]
光学显微镜观察上述2.1原代培养的大鼠星形胶质细胞及上述2.4恒温摇床振摇提纯的成熟星形胶质细胞的细胞形态。如图2所示,原代培养1天后,细胞贴壁,呈长梭形,折光性良好,更换培养基后,死细胞及碎片等减少。第3天,死细胞及残渣减少,大多数细胞已生长出不规则细胞突起,生长状况良好。培养至第7天,细胞已增殖至75
‑
85%融合,绝大多数细胞折光性一致,但存在部分杂细胞(图2.a
‑
c)。待细胞生长至90%融合,纯化后的星形胶质细胞一次传代后24h、72h及细胞生长至95%的二代星形胶质细胞形态如图2.d
‑
f所示。
[0193]
采用3dhistech切片扫描仪观察上述2.3,星形胶质细胞特异性表达的分子标志物gfap免疫荧光染色显示:如图3所示,gfap染色阳性与dapi共染的细胞占比达到97%,提示所培养及纯化后的第三代成熟的大鼠星形胶质细胞,纯度较高。
[0194]
采用光学显微镜观察上述2.2,使用a2b5免疫磁珠提取的少突胶质前体细胞各阶段的生长状况。如图4所示,培养1天后,可见多数细胞贴壁,折光性强,且有部分细胞已成双
极突起形态(图4.a黑色箭头所示)。培养3天后,可见多数细胞成椭圆形或长梭形,折光性强,呈现出双极或三极细胞突起。培养7天后,可见椭圆形细胞胞体及双极或三极细胞突起,为典型的少突胶质前体细胞形态。更换分化培养基后,即培养至第9天(d图),可见部分细胞已长出多个突起,呈丝状放射状分布于胞体周围。培养至12天(e图),细胞突起增多,彼此相互连结。培养至14天(f图),可见放射状分布的丝状突起增多,细胞之间相互连通,呈网状分布。表明所提取的少突胶质前体细胞具备分化成熟的能力。
[0195]
采用3dhistech切片扫描仪和激光共聚焦显微镜观察上述2.3,使用免疫荧光技术检测ol谱系不同阶段的特异性分子标记物,结果如图5所示:a
‑
d图所示为o4染色阳性与dapi共染的细胞,其占比达到92%,表明采用免疫磁珠所提取的a2b5阳性细胞,能够正常增殖且表达未髓鞘化的少突胶质细胞的特异性分子标记物。e
‑
h图所示为:将培养基更换为少突胶质细胞分化期培养基后,细胞能够正常表达mbp,围绕在胞体周围,呈现为放射状分布的丝状突起,这表明培养的a2b5阳性细胞可分化为成熟的少突胶质细胞。
[0196]
3.2 tert在稳定转染星形胶质细胞中的表达
[0197]
3.2.1 qpcr检测tert表达量
[0198]
慢病毒载体阴性对照和tert过表达慢病毒分别转染星形胶质细胞,使用嘌呤霉素筛选稳定转染细胞(筛选浓度1μg/ml,维持浓度0.5μg/ml),利用qpcr检测上述2.5,tertmrna的表达情况,结果显示,与r
‑
nc组相比,r
‑
tert组星形胶质细胞中tert mrna的表达上调42.355倍(p<0.01),见图6。
[0199]
3.2.2免疫荧光染色检测tert表达
[0200]
利用免疫荧光染色检测上述2.6,星形胶质细胞tert表达,结果如图7所示,在tert过表达慢病毒稳定转染的星形胶质细胞组中检测到tert蛋白,其表达量高于稳定转染慢病毒载体阴性对照。结果表明,在正常的大鼠星形胶质细胞中tert表达水平较低,通过tert过表达慢病毒转染星形胶质细胞后,tert能够在星形胶质细胞中稳定表达。
[0201]
3.3 cck8检测氧
‑
糖剥夺不同时间点少突胶质前体细胞的存活率
[0202]
cck8检测上述2.8.2,大鼠少突胶质前体细胞在氧
‑
糖剥夺不同时间点的细胞存活率,如图8所示,随着ogd时间逐渐延长,细胞存活率也随之降低。氧
‑
糖剥夺2h,细胞存活率为48.3%,细胞活性显著降低,可用于模拟体外缺氧缺血损伤。
[0203]
3.4 cck8检测细胞培养液干预ogd少突胶质前体细胞的存活率
[0204]
将第三代星形胶质细胞、稳定转染阴性对照的第三代星形胶质细胞及稳定转染tert过表达慢病毒的第三代星形胶质细胞,加入无血清高糖dmem培养基培养18h的细胞培养液,分别命名为星形胶质细胞培养液组(astrocyteconditionedmedium,acm组)、阴性对照细胞培养液组(negativecontrol,nc组)、tert过表达细胞培养液组(tert组)。cck8检测上述2.8.4,三组细胞培养液分别干预氧
‑
糖剥夺少突胶质前体细胞24h后的细胞存活率,如图9所示,与acm、nc组相比,tert组细胞培养液能够促进缺氧缺血后少突胶质前体细胞的存活,p<0.05。这表明,tert过表达的星形胶质细胞细胞培养液中存在某些促进细胞存活的因子,参与缺氧缺血后少突胶质前体细胞的保护。
[0205]
3.5 mbp染色检测细胞分化
[0206]
第三代星形胶质细胞、稳定转染阴性对照的第三代星形胶质细胞及稳定转染tert过表达慢病毒的第三代星形胶质细胞,加入无血清高糖dmem培养基培养18h的细胞培养液,
分别命名为星形胶质细胞培养液组(astrocyteconditionedmedium,acm组)、阴性对照细胞培养液组(negativecontrol,nc组)、tert过表达细胞培养液组(tert组)。使用免疫荧光染色检测上述2.9,三组干预7天后少突胶质前体细胞后细胞mbp表达情况,结果如图10所示:
①
在常氧对照组中,与acm、nc组对比,tert组mbp的表达量高于其余两组,p<0.05,差异具有统计学意义。
②
在氧糖剥夺组中,与nc组对比,tert组mbp的表达量也高于nc组,p<0.05,差异具有统计学意义。
[0207]
结果表明,体外氧
‑
糖剥夺模拟少突胶质前体细胞缺氧缺血损伤后,给予tert过表达星形胶质细胞细胞培养液,能够在促进少突胶质前体细胞分化。
[0208]
3.6差异蛋白筛选
[0209]
上述2.10,在可信蛋白的基础上,根据差异筛选细胞:差异倍数fc=1.5倍且p<0.05,结果如下图11a所示:阴性对照细胞培养液组(negative control,nc组)以及tert过表达细胞培养液组(tert组)共计统计到有236个差异蛋白,其中131个蛋白下调,105个蛋白的表达量上调。图11b为阴性对照细胞培养液组(negative control,nc组)以及tert过表达细胞培养液组(tert组)中差异表达蛋白的火山图,图中箭头向下表示下调,箭头向上表示上调。结果表明,tert过表达,对星形胶质细胞的分泌功能产生较大影响。
[0210]
3.7差异蛋白go富集分析
[0211]
上述2.10,对差异蛋白进行go富集分析,主要包括细胞成分、分子功能和生物学过程三个方面,其中生物学过程go分析更有助于筛选感兴趣基因。因此,我们对nc组和tert组间的差异蛋白的生物学过程go分析,结果如下:共富集到1431条go条目,其中包括细胞对缺氧的反应、炎症反应、脑发育、细胞分化、凋亡过程、老化和氧化应激等生物过程有关,提示tert过表达的星形胶质细胞细胞培养液可能在这些生物学过程中发挥作用(见表1)。
[0212]
其中,我们发现与阴性对照细胞培养液组(negative control,nc组)对比,tert过表达细胞培养液组(tert组)上调的差异蛋白go富集分析显示:top30的生物学过程,涉及到少突胶质细胞分化的正向调控,如图12,进一步提示tert过表达星形胶质细胞细胞培养液中存在参与opc分化的相关调节因子。因此,我们着重分析与此生物学过程相关的差异表达蛋白。
[0213]
表1 nc组和tert组差异蛋白go富集分析(top20生物学过程)
[0214][0215]
3.8差异表达蛋白筛选及验证
[0216]
根据蛋白表达差异倍数、差异蛋白功能富集分析和文献查阅,我们对稳定转染阴性对照的第三代星形胶质细胞及稳定转染tert过表达慢病毒的第三代星形胶质细胞的细胞培养液,进行差异表达蛋白分析,筛选与opc分化和神经保护相关的差异表达蛋白,并使用qpcr对细胞进行转录水平的验证。筛选的目标蛋白如表2所示。其中ptn、mdk、rheb共同富集在少突胶质细胞分化的正向调控生物学过程中。上述2.11,其中以ptn的mrna水平上调倍数最为显著,如图13所示:与r
‑
nc组相比,r
‑
tert组星形胶质细胞中ptn mrna的表达上调86.3451倍(p<0.01)蛋白组学分析两组细胞培养液中ptn蛋白的差异倍数为:fc=2.725016,p<0.05。且在差异表达蛋白go富集分析中,ptn参与树突再生、脑发育、细胞增殖、少突胶质细胞分化、神经营养因子、细胞对缺氧的反应、神经元投射发育的正调控等多个生物学过程。因此推测,ptn可能是tert过表达的星形胶质细胞细胞培养液中参与调控少突胶
质前体细胞分化的调节因子。
[0217]
表2筛选的差异表达蛋白
[0218][0219]
3.9重组ptn蛋白干预少突胶质前体细胞分化
[0220]
使用免疫荧光检测上述2.12,100ng/ml的重组ptn蛋白,干预氧糖剥夺少突胶质前体细胞后mbp的表达情况,结果如图14所示:
①
在常氧对照组中,与阴性对照组相比,ptn组的mbp表达量增多,p<0.05,差异有统计学意义;
②
在氧糖剥夺组中,与阴性对照组相比,ptn组的mbp表达量增高,p<0.05,差异有统计学意义。这表明,体外氧
‑
糖剥夺干预opc,外源性给予ptn干预后,能够在一定程度上恢复mbp的表达,促进髓鞘形成。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。