大豆胞囊线虫新小种x12的提纯方法及应用
技术领域
1.本发明涉及一种大豆胞囊线虫新小种x12的提纯方法及应用,属于生物技术领域。
背景技术:
2.大豆是人们摄取植物蛋白和植物油的重要来源,因此大豆在农业生产中具有举足轻重的地位。然而,大豆胞囊线虫(soybean cyst nematode,scn)在世界大豆主产区分布广泛,给大豆生产带来严重经济损失。黄淮地区是我国两大大豆主产区之一,前期研究结果表明,该地区大豆胞囊线虫发生普遍,2号为优势生理小种,其次是5号生理小种。调查研究中,还检测到了具有超强致病力的大豆胞囊线虫新小种x12,该小种能够在我国的优异抗源兴县灰皮支(zdd2315)及其它目前已公布的所有抗源上成功寄生,属于具有超强致病力的大豆胞囊线虫新小种,该生理小种的发现表明大豆胞囊线虫正进一步威胁大豆生产。
3.由于大豆胞囊线虫繁殖属于种内杂交,从感染大豆胞囊线虫田块采取的病土中繁殖的胞囊是多个群体混杂的,未经纯化的大豆胞囊线虫混合群体严重阻碍了大豆胞囊线虫在基因组测序研究、大豆胞囊线虫致病基因研究、大豆抗性资源筛选、抗大豆胞囊线虫基因定位及大豆抗病品种培育进程。结合我国“注重资源节约和注重环境友好”的农业绿色发展指导方针,急需培育抗病品种用于防御大豆胞囊线虫给大豆生产带来的经济损失,这是防御大豆胞囊线虫最经济、最有效、最绿色环保措施,而开展大豆胞囊线虫新小种x12的提纯用于筛选抗病资源,是培育抗病新品种的前提。
技术实现要素:
4.针对现有技术的不足,本发明的目的是提供一种大豆胞囊线虫新小种x12的提纯方法及应用,该方法能够从自然界混杂的大豆胞囊线虫群体中将具有超强致病力的x12小种分离并纯化。
5.为了实现上述目的,本发明所采用的技术方案是:
6.一种大豆胞囊线虫新小种x12的提纯方法,包括以下步骤:
7.(1)采集受大豆胞囊线虫x12感染的病土,将病土和无菌细沙以3:0.5~1.0的体积比均匀混合,制备成试验病土,分装在大豆胞囊线虫抗性鉴定用的实验杯中;
8.(2)将萌发3~5d,子叶出土期的大豆优异抗源兴县灰皮支移栽至装有试验病土的实验杯中,每个实验杯移栽1株,置于温室培养;
9.(3)培养20~25d后,从根系上用镊子取单胞囊接种至在无菌土中生长了3~5d的兴县灰皮支根系附近,每杯接种单个胞囊,温室培养20~25d;
10.(4)重复步骤(3),单胞囊繁殖4次后,将从单个实验杯中搜集的第4代胞囊全部接种至另一杯在无菌土中生长3~5d的兴县灰皮支根系附近,温室培养20~25d后,得到纯化后的第5代胞囊;
11.(5)将从单个实验杯中搜集的第5代胞囊全部接种到在无菌土中生长3~5d的兴县灰皮支根系附近,温室培养20~25d后,得到纯化后第6代胞囊;
12.(6)重复步骤(5),至得到纯化后的第8代或更高代胞囊,将从单个实验杯中得到的第8代或更高代胞囊全部接种至在无菌土中生长3~5d的感病品种lee根系附近,实现胞囊的群体纯化及加代保存。
13.所述病土的采集方法为:从受大豆胞囊线虫x12感染的大豆田块采集土壤表层以下2cm
‑
6cm间的土壤,备用。
14.所述温室培养条件为:白天16h与黑夜8h轮替;温度:白天27℃
±
1℃,黑夜24℃
±
1℃;湿度为70%
±
5%。
15.所述的提纯方法在大豆胞囊线虫基因组测序中的应用。
16.所述的提纯方法在大豆胞囊线虫致病基因研究及抗大豆胞囊线虫基因定位中的应用。
17.所述的提纯方法在大豆抗性资源筛选及大豆抗病品种培育中表型鉴定筛选中的应用。
18.本发明有益效果:
19.本发明提供一种大豆胞囊线虫新小种x12的提纯方法,将鉴定为大豆胞囊线虫x12生理小种的大豆胞囊线虫群体,采用单胞囊繁殖法在国内优异抗源兴县灰皮支(编号:zdd2315)上连续单胞囊繁殖4代后,继续在兴县灰皮支上纯化、扩繁3
‑
4代,再利用感病品种lee恢复1代,实现胞囊的群体纯化及扩繁。相比于现有采用单胞囊繁殖1代后即开展扩繁获得的纯化群体而言,本方法采用单胞囊繁殖4代后继续用兴县灰皮支连续筛选4代再开展扩繁获得的纯化群体,群体纯合度高,后代稳定,在第32代仍然相对纯合。
20.采用本发明提供的方法对大豆胞囊线虫新小种x12提纯,能够从自然界混杂的大豆胞囊线虫群体中将具有超强致病力的x12小种分离并纯化,经提纯的x12小种可多代连续用于基因组测序研究、大豆胞囊线虫致病基因研究、大豆抗性资源筛选、抗大豆胞囊线虫基因定位及大豆抗病品种培育过程中表型鉴定筛选研究,在大豆胞囊线虫相关研究方面具有重要应用价值。
附图说明
21.图1为大豆胞囊线虫新小种x12的纯化流程示意图;
22.图2为大豆胞囊线虫新小种x12纯化前后的平均胞囊数目。
具体实施方式
23.以下结合实施例对本发明的具体实施方式作进一步详细说明。
24.实施例1
25.一种大豆胞囊线虫新小种x12的提纯方法,包括以下步骤:
26.(1)采集受大豆胞囊线虫x12感染的病土,将病土和无菌细沙以3∶0.5~1.0的体积比均匀混合,制备成试验病土,分装在大豆胞囊线虫抗性鉴定用的一次性塑料实验杯中;
27.病土的采集方法为:依据报道的调查研究结果,从受大豆胞囊线虫x12感染的大豆田块采集土壤表层以下2cm
‑
6cm间的土壤,备用;所述大豆胞囊线虫具有9对染色体;
28.(2)将萌发3~5d,子叶出土期的大豆优异抗源兴县灰皮支(编号:zdd2315)移栽至装有试验病土的实验杯中,每个实验杯移栽1株,置于温室培养;
29.温室培养条件为:白天16h与黑夜8h轮替;温度:白天27℃
±
1℃,黑夜24℃
±
1℃;湿度为70%
±
5%;
30.(3)培养20~25d后,从根系上利用镊子取单胞囊接种至在无菌土中生长了3~5d的兴县灰皮支根系附近,接种单个胞囊/杯,温室培养20~25d;
31.(4)重复步骤(3),单胞囊繁殖4次后,将从单个实验杯中搜集的第4代胞囊全部接种(约10
‑
30个胞囊)至另一杯在无菌土中生长了3~5d的兴县灰皮支根系附近,温室培养20~25d后,得到纯化后的第5代胞囊;
32.(5)将从单个实验杯中搜集的第5代胞囊全部接种(约20
‑
60个胞囊)在无菌土中生长了3~5d的兴县灰皮支根系附近,温室培养20~25d后,得到纯化后第6代胞囊;
33.(6)重复步骤(5),至得到纯化后的第8代或更高代胞囊,将从单个实验杯中得到的第8代或更高代胞囊全部接种(约150
‑
300个胞囊)至在无菌土中生长了3~5d的感病品种lee根系附近(大于60杯),实现胞囊的群体纯化及加代保存(该纯化流程如图1所示)。
34.应用例1
35.将利用本发明实施例1纯化方法纯化的大豆胞囊线虫新小种x12,及未经纯化的大豆胞囊线虫新小种x12分别接种于兴县灰皮支根系,2000个虫卵/株,纯化前的接种方法重复3次,纯化后的接种方法重复4次,接种20d
‑
30d后分别统计每颗植株根系上的胞囊数目,结果如图2所示。
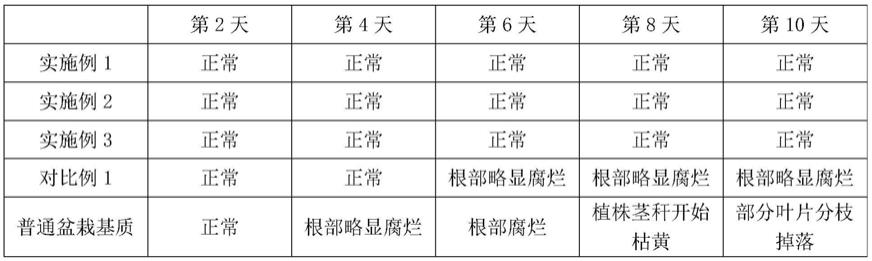
36.结果显示,未经纯化的x12小种接种的植株,待接种植株根系上的平均胞囊数目是110.2个,利用纯化后的x12小种接种的植株,待接种植株根系上的平均胞囊数目是250.2个。在一定程度上表明在接种的2000个虫卵中,经纯化x12生理小种的虫卵纯度较未纯化后x12生理小种纯度高,由于本技术纯化方法经多代单胞囊纯化x12后,淘汰掉了群体中混杂的其它生理小种和非纯合的x12小种,使得纯合的x12虫卵占得比例大,所以能有效侵染到兴县灰皮支上,导致单株胞囊数目较多,不仅有效侵染到兴县灰皮支根系上的胞囊数多,而且重复性高。
37.应用例2
38.利用本发明实施例1纯化方法纯化的x12生理小种在野生大豆抗性资源筛选中筛选到了抗源。
39.利用本发明实施例1纯化方法纯化的x12生理小种,对420份野生大豆资源进行温室接种及表型鉴定。对表现为抗病的野生豆材料单株扩繁,于2019.10单株收获后进行重复抗性鉴定(采用hg type鉴别模式 riggs鉴别模式 我国优异抗源),抗性鉴定结果表明,其中一份表现高抗(fi=2.2,材料名称ysd56),ysd56野生豆资源在多个大豆胞囊线虫生理小种中的抗性鉴定结果见表1。选择ysd56与感病亲本构建群体,可用于后续抗性基因定位及大豆胞囊线虫抗病品种的培育研究。
40.表1 ysd56及其它主要抗源在不同大豆胞囊线虫生理小种中的抗性鉴定
[0041][0042]
a
胞囊指数,fi=female index;
[0043]
b
对大豆胞囊线虫的抗性水平:fi≤10(resistant=r,抗);10<fi≤30(moderately resistant=mr,中抗);30<fi≤60(moderately susceptible=ms,中感),and fi>60(susceptible=s,感);抗性水平依据fi值划分,fi等于待鉴定材料根系上平均胞囊数目/lee根系上平均胞囊数目*100;
[0044]
c
在lee上着生的平均胞囊数目(个);
[0045]
d
代表riggs模式中的鉴别寄主;
[0046]
e
代表hg type模式中的鉴别寄主;
[0047]
f
代表我国优异抗源。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。