1.本发明属于体外诊断试剂技术领域,具体一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸及其制备方法。
背景技术:
2.阴道毛滴虫(trichomonas vaginalis)是寄生在人体阴道和泌尿道的鞭毛虫,主要引起滴虫性阴道炎和尿道炎,是以性传播为主的一种传染病。
3.加德纳菌(gardnerella vaginalis)是一类革兰染色阴性或阳性的短杆菌,厌氧,嗜血,培养困难。是女性细菌性阴道病的主要病原菌之一,可经性接触传播,可引起输卵管妊娠、胎膜早破和新生儿早产等不良妊娠结局。
4.白色念珠菌(candida albicans)呈卵圆形,由芽生孢子及细胞发芽伸长形成假菌丝,假菌丝与孢子相连成分枝或链状。霉菌阴道感染 80%~90%系白色念珠菌引起。
5.现有的滴虫、加德纳菌、白色念珠菌检测技术主流技术为显微镜观察法,检测结果的准确性主要为靠检验医师的主观判定,个体差异明显,客观性差。目前也已有的胶体金免疫层析技术开发的检测产品,虽然解决便捷性问题,但胶体金本身灵敏度差,与临床上诊断结果的符合率较低。另外涉及到样本量问题,目前基本采用阴道式子采样,样本量小,在保障检测浓度的前提下,不足以支撑多个项目的检测。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸及其制备方法,所述试纸对检测样品的需求量小,同时具有较高的灵敏度和检测结果准确性。
7.本发明提供了一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸,包括底板和从下到上依次粘附在底板上的样品垫、过滤垫、结合垫、硝酸纤维素膜和吸水垫,所述硝酸纤维素膜上设置1条质控线c和3条检测线t,所述3条检测线t分别包被羊抗滴虫抗体、羊抗加德纳菌抗体和羊抗白色念珠菌抗体;所述质控线c 包被有抗羊igg;所述结合垫上喷涂有羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球和羊抗白色抗体标记量子点微球。
8.优选的,羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球或羊抗白色念珠菌抗体标记量子点微球的制备方法,包括以下步骤:
9.1)向洗涤的量子点微球溶液依次添加n
‑
羟基琥珀酰亚胺、1
‑
(3
‑ꢀ
二甲氨基丙基)
‑3‑
乙基碳二亚胺进行活化反应,分离沉淀经洗涤后分散,得到活化量子点微球溶液;
10.2)将活化量子点微球溶液稀释,滴加羊抗滴虫抗体溶液、羊抗加德纳菌抗体溶液或羊抗白色念珠菌抗体溶液进行偶联反应,经封闭,分离沉淀,复溶,得到羊抗滴虫抗体标记的量子点微球溶液、羊抗加德纳菌抗体标记的量子点微球溶液和羊抗白色念珠菌抗体标
记的量子点微球溶液。
11.优选的,所述量子点微球溶液的质量浓度为0.8%~1.2%;
12.所述n
‑
羟基琥珀酰亚胺或1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺的添加终浓度独立为1~5mg/ml;
13.所述活化反应的时间包括25~35min。
14.优选的,步骤2)中所述活化量子点微球溶液的稀释倍数为 10~100倍。
15.优选的,所述活化量子点微球溶液的体积和羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体的质量比为1ml:2~5μg;
16.所述羊抗滴虫抗体溶液、羊抗加德纳菌抗体溶液或羊抗白色念珠菌抗体溶液的浓度独立为0.01~0.1mg/ml;
17.所述滴加的速度为1~5s/滴;每滴液的体积为30~50μl。
18.优选的,所述羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球和羊抗白色抗体标记量子点微球按照1:1:1的体积比混合,得到的混合液喷涂在结合垫上,喷涂量为0.1~3μl/cm;
19.优选的,所述抗羊igg的包被浓度为1~2mg/ml;
20.羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体的包被浓度独立为0.1~3mg/ml。
21.优选的,所述羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体由滴虫抗原、加德纳菌抗原或白色念珠菌抗原免疫小鼠制备得到。
22.优选的,所述样品垫经过处理液浸泡处理后干燥得到;
23.所述处理液为含有质量百分含量0.09%~0.11%bsa、质量百分含量9%~11%蔗糖、体积百分含量0.09%~0.11%吐温
‑
20的9~11mm ph 7.3~7.5的pbs缓冲液。
24.本发明提供了所述同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸的制备方法,包括以下步骤;
25.将硝酸纤维素膜、过滤垫、结合垫、样品垫、吸水纸粘贴于底板上,裁切条状。
26.本发明提供了一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸,硝酸纤维素膜上设置1条质控线c和3条检测线 t,所述3条检测线t分别包被羊抗滴虫抗体、羊抗加德纳菌抗体和羊抗白色念珠菌抗体;所述质控线c包被有抗羊igg;所述结合垫上喷涂有羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球和羊抗白色抗体标记量子点微球。所述试纸采用夹心法原理进行检测,实现对三种病原微生物滴虫、加德纳菌和白色念珠菌的同时检测,操作简单,并且一次加样即可完成三项检测,对样品的需求量少, 50~80μl液体样本即可完成三项检测,检测效率高。并且所述试纸相对于常规产品,检测快速,5~10min获得检测结果;此外,所述试纸在灵敏度上相较于胶体金方法学灵敏度获得极大提升。
附图说明
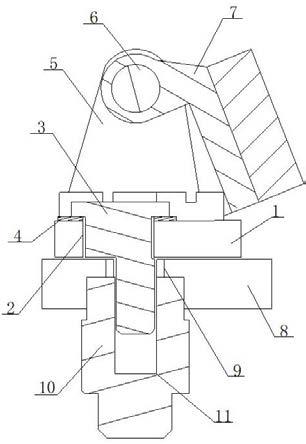
27.图1为本发明提供的试纸的结构示意图,其中1、检测线t1,2、检测线t2,3、检测线t3,4、质控线c,5、加样孔。
具体实施方式
28.本发明提供了一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸,包括底板和从下到上依次粘附在底板上的样品垫、过滤垫、结合垫、硝酸纤维素膜和吸水垫,所述硝酸纤维素膜上设置1条质控线c和3条检测线t,所述3条检测线t分别包被羊抗滴虫抗体、羊抗加德纳菌抗体和羊抗白色念珠菌抗体;所述质控线c 包被有抗羊igg;所述结合垫上喷涂有羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球和羊抗白色抗体标记量子点微球。
29.在本发明中,所述试纸中包含结合垫。所述结合垫上喷涂有羊抗滴虫抗体标记量子点微球、羊抗加德纳菌抗体标记量子点微球和羊抗白色抗体标记量子点微球溶液。羊抗滴虫抗体标记量子点微球溶液、羊抗加德纳菌抗体标记量子点微球溶液和羊抗白色抗体标记量子点微球溶液按照1:1:1的体积比混合,得到的混合液喷涂在结合垫上。所述混合液的喷涂量优选为0.1~3μl/cm,更优选为0.5~2.5μl/cm,最优选为2μl/cm。羊抗滴虫抗体标记量子点微球溶液、羊抗加德纳菌抗体标记量子点微球溶液和羊抗白色抗体标记量子点微球溶液的浓度独立优选为0.01~0.1μm,更优选为0.02~0.08μm,进一步优选为 0.04~0.07μm,最优选为0.05μm。
30.在本发明中,羊抗滴虫抗体标记量子点微球溶液、羊抗加德纳菌抗体标记量子点微球溶液或羊抗白色念珠菌抗体标记量子点微球溶液的制备方法,包括以下步骤:
31.1)向洗涤的量子点微球溶液依次添加n
‑
羟基琥珀酰亚胺、1
‑
(3
‑ꢀ
二甲氨基丙基)
‑3‑
乙基碳二亚胺进行活化反应,分离沉淀经洗涤后分散,得到活化量子点微球溶液;
32.2)将活化量子点微球溶液稀释,滴加羊抗滴虫抗体溶液、羊抗加德纳菌抗体溶液或羊抗白色念珠菌抗体溶液进行偶联反应,经封闭,分离沉淀,复溶,得到羊抗滴虫抗体标记的量子点微球溶液、羊抗加德纳菌抗体标记的量子点微球溶液和羊抗白色念珠菌抗体标记的量子点微球溶液。
33.本发明向洗涤的量子点微球溶液依次添加n
‑
羟基琥珀酰亚胺、 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺进行活化反应,分离沉淀经洗涤后分散,得到活化量子点微球溶液。
34.在本发明中,所述量子点微球溶液的质量浓度优选为 0.8%~1.2%,更优选为1%。所述量子点微球的粒径优选为100~500nm,更优选为150~450nm,进一步优选为200~400nm,再进一步优选为 300nm。本发明对所述量子点微球的来源没有特殊限制,采用本领域所熟知的量子点微球即可。在本发明实施例中,所述量子点微球购自赛默飞世尔科技(中国)有限公司。所述洗涤的方法优选为将量子点微球溶液进行离心,弃去上清,采用吗啉乙磺酸(mes)缓冲液重悬至原体积,超声后得到洗涤的量子点微球溶液。所述离心的离心力优选为7500~8500g,更优选为8000g。所述离心的时间优选为8~12min,最优选为10min。所述吗啉乙磺酸缓冲液的浓度优选为10mm。所述超声的功率优选为150~200w,更优选为180w。所述超声的时间优选为0.1~1min,更优选为0.5min。
35.在本发明中,所述n
‑
羟基琥珀酰亚胺或1
‑
(3
‑
二甲氨基丙基)
‑3‑ꢀ
乙基碳二亚胺的添加终浓度独立优选为1~5mg/ml,更优选为 1.5~4.5mg/ml,进一步优选为2~4mg/ml,最优选为3mg/ml。所述n
‑ꢀ
羟基琥珀酰亚胺或1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺优选采用 10mm ph 6 mes缓冲液配制,初始浓度大于20mg/ml。所述活化反应的时间优选包括25~35min,更优选为30min。所述活化反应的温度优选在室温条件下进行。所述分离沉淀的方法
优选采用离心进行。所述离心的离心力优选为7500~8500g,更优选为8000g。所述离心的时间优选为8~12min,最优选为10min。所述洗涤后分散优选采用离心所得沉淀用10mm ph 6 mes缓冲液重悬复溶至原体积,超声均匀后,形成活化量子点微球溶液。
36.得到活化量子点微球溶液后,本发明将活化量子点微球溶液稀释,滴加羊抗滴虫抗体溶液、羊抗加德纳菌抗体溶液或羊抗白色念珠菌抗体溶液进行偶联反应,经封闭,分离沉淀,复溶,得到羊抗滴虫抗体标记的量子点微球溶液、羊抗加德纳菌抗体标记的量子点微球溶液和羊抗白色念珠菌抗体标记的量子点微球溶液。
37.在本发明中,所述活化量子点微球溶液的稀释倍数优选为 10~100倍,更优选为20~80倍,进一步优选为40~70倍,最优选为 50倍。所述活化量子点微球溶液的体积和羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体的质量比优选为1ml:2~5μg,更优选为1ml:3~4μg,最优选为1ml:3.5μg。所述羊抗滴虫抗体溶液、羊抗加德纳菌抗体溶液或羊抗白色念珠菌抗体溶液的浓度独立为 0.01~0.1mg/ml,更优选为0.02~0.08mg/ml,最优选为0.04~0.6mg/ml,最优选为0.05mg/ml。在本发明实施例中,羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体均委托北京大文生物科技有限公司开发得到,均属于多克隆抗体。所述滴加的速度优选为1~5s/滴,更优选为2~4s/滴,最优选为3s/滴。每滴液的体积优选为30~50μl,更优选为40μl。所述偶联反应优选持续1~4h,更优选为2~3h,最优选为2.5h。本发明对所述封闭的方法没有特殊限制,采用本领域所熟知的封闭方法即可。在本发明实施例中,所述封闭优选使用20%的bsa 溶液添加到偶联反应液中至终浓度0.1%~0.2%。所述封闭的时间优选 0.5~1h,更优选为0.7~0.9h。所述分离沉淀优选采用离心方法进行。所述复溶优选采用含0.1~1%bsa,5~10%蔗糖,0.1~1%吐温
‑
20的 10mm ph 7.4 pbs缓冲液复溶。所述复溶的体积优选至反应前量子点微球溶液的体积。所述结合垫的材料优选包括玻璃纤维膜或聚酯纤维膜。
38.在本发明中,所述试纸中包含硝酸纤维素膜。所述硝酸纤维素膜上设置1条质控线c和3条检测线t,所述质控线c在3条检测线t 上方。所述3条检测线t分别包被羊抗滴虫抗体、羊抗加德纳菌抗体和羊抗白色念珠菌抗体。所述质控线c包被抗羊igg。所述抗羊igg 的包被浓度优选为1~2mg/ml,更优选为1.5mg/ml。羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体的包被浓度独立优选为 0.1~3mg/ml,更优选为0.5~2.5mg/ml,进一步优选为0.6~2mg/ml,最优选为0.8mg/ml。所述羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体委托北京大文生物科技有限公司开发得到,均属于多克隆抗体。
39.在本发明中,所述试纸中包含样品垫。所述样品垫经过处理液优选浸泡处理后干燥得到。所述处理液为含有质量百分含量 0.09%~0.11%bsa、质量百分含量9%~11%蔗糖、体积百分含量 0.09%~0.11%吐温
‑
20的9~11mm ph 7.3~7.5的pbs缓冲液,更优选为含有质量百分含量0.1%bsa、质量百分含量10%蔗糖、体积百分含量0.1%吐温
‑
20的10mm ph 7.4的pbs缓冲液。
40.在本发明中,所述试纸中包含过滤垫。所述过滤垫优选为亲水材质,例如玻璃纤维滤血垫或聚醚砜滤血垫。所述过滤垫可实现对大于 0.5μm的颗粒实现有效拦截。
41.在本发明中,所述试纸优选还包括卡壳。试纸至于卡壳中,密封保存。
42.本发明提供了所述同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸的制备方法,包括以下步骤;
43.将样品垫、过滤垫、结合垫、硝酸纤维素膜、吸水纸按从下至上的顺序依次粘贴于底板上,裁切条状。
44.在本发明中,所述试纸的裁切宽度优选为3~5mm,更优选为 3.5mm。当包括卡壳时,将裁剪的试纸装入卡壳中,形成试纸卡。
45.在本发明中,所述量子点免疫层析试纸的检测方法,是基于夹心法完成,当样品中存在滴虫、加德纳菌、白色念珠菌中的一种或几种抗原时,滴虫、加德纳菌或白色念珠菌在层析作用力下随着水流向上移动到达结合垫,与相应抗体标记的量子点微球结合形成二元复合物,二元复合物随着层析作用力向上移动到达硝酸纤维素膜时,二元复合物中抗原与对应的抗体结合形成三元复合物,由于抗体被固定包被在硝酸纤维素膜上,三元复合物被固定在检测线t上,同时结合垫上多余的抗体标记的量子点微球随着层析作用力达到硝酸纤维素膜质控线c,与抗羊igg发生特异性亲和反应,形成二元复合物,在检测仪检测下产生荧光信号,具体操作方法如下:
46.1)将待检测样品滴加到试纸的样品垫,静置5~10min,用紫外灯读取质控线c和检测线t的荧光信号,当质控线c和检测线t同时显示荧光信号,判断待测样品为阳性,含有对应检测线t包被抗体的抗原;当只有质控线c显示荧光信号,而检测线t不显示荧光信号,判断待测样品为阴性样品,为不含有相应检测对象或样品中所含检测对象的浓量低于所述试纸的检测限;当仅有检测线t显示荧光信号,质控线c不显示荧光信号时,说明检测有误,需重新检测样品。实验结果表明,本发明制备的检测试纸的检测结果与胶体金法的检测结果一致,本发明实现10~15分钟内获得检测结果,且检测灵敏度有显著提高,操作十分简单。
47.下面结合实施例对本发明提供的一种同时检测滴虫、加德纳菌、白色念珠菌的量子点荧光免疫层析试纸及其制备方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
48.实施例1
49.一种同时检测滴虫、加德纳菌、白色念珠菌的高灵敏量子点荧光免疫层析试纸及其制备方法,具体制备方法入下:
50.取粒径为200nm、浓度为1μm量子点微球90μl,8000g离心10 分钟,小心吸弃上清,沉淀用10mm ph 6 mes缓冲液重悬复溶至 90μl,超声均匀后,待用;
51.使用10mm ph 6 mes缓冲液分别配制浓度为50mg/mlnhs溶液和edc溶液,向上述微球中加入nhs 5μl,混合均匀后,再加入edc 溶液5μl,混匀后反应30分钟,8000g离心10分钟,小心吸弃上清,沉淀用10mm ph 6 mes缓冲液重悬复溶至90μl,超声均匀后,形成活化量子点微球。将活化后的量子点微球分为3支,每支30μl,待用;
52.使用10mm ph 7.4 pbs缓冲液将0.1mg的羊抗滴虫抗体、羊抗加德纳菌抗体、羊抗白色念珠菌抗体分别稀释至0.01mg/ml,取一支 30μl的活化量子点微球,使用10mm ph 7.4 pbs缓冲液稀释至2ml,转移至洁净烧杯中,放入洁净转子,搅拌中逐滴加入全部0.01mg/ml 羊抗滴虫抗体、羊抗加德纳菌抗体或羊抗白色念珠菌抗体,滴加结束后反应2小时,之后加入20%的bsa0.1ml进行封闭,反应1小时,将溶液转移至30ml离心管中,8000g离心45分钟,弃上清;沉淀使用含0.1%bsa,10%蔗糖,0.1%吐温
‑
20的10mm ph7.4 pbs缓冲液复溶至300μl,形成羊抗滴虫抗体标记的量子点微球、羊抗加德纳菌抗体标记的量子点微球、羊抗白色念珠菌抗体标记的量子点微球;
53.分别将羊抗滴虫抗体标记的量子点微球、羊抗加德纳抗体标记的量子点微球和羊抗白色念珠菌抗体标记的量子点微球按体积比1:1: 1混合,混合后的量子点微球用喷膜仪按2μl/cm喷膜量喷至聚酯纤维膜上,干燥后形成量子点结合物垫。
54.使用10mm ph 7.4 pbs缓冲液将羊抗滴虫抗体、羊抗加德纳抗体和羊抗白色念珠菌抗体和抗羊igg分别稀释至1mg/ml,分别制备 t1、t2、t3以及质控线c包被液,使用喷划膜仪按着1μl/cm的划膜量包被于爬速为135sec/4cm的硝酸纤维素膜上,干燥4小时后备用;
55.将空白玻璃纤维膜浸入含有0.1%bsa、10%蔗糖、0.1%吐温
‑
20 的10mm ph 7.4 pbs缓冲液中,待玻璃纤维膜完全浸润后,捞出并晾干,制备样品垫;
56.将硝酸纤维素膜、量子点结合物垫、过滤垫、样品垫、吸水纸依次粘贴于底板上,裁切为3.8mm规格,装入卡壳中,完成试纸条的制备。
57.实施例2
58.检测方法
59.分别将滴虫阳性样本、加德纳阳性样本、白色念株菌阳性样本使用生理盐水进行10倍比稀释,每一梯度样本取70μl滴加到检测卡的加样孔中,反应10分钟后,在紫光灯照射下判读结果,对应的检测线发出荧光条带即判定阳性。同时进行乳胶层析检测卡(购自北京泰格科信生物科技有限公司,产品名称为白色念珠菌/阴道毛滴虫/阴道加德纳菌抗原联合检测试剂盒(乳胶层析法))的检测
60.检测结果见表1表3。
61.表1 两种检测方法对滴虫阳性样本的检测结果统计表
62.滴虫阳性样本稀释倍数1:11:101:1001:10001:10000本发明试剂检测结果阳性阳性阴性阴性阴性胶体金检测结果弱阳性阴性阴性阴性阴性
63.表2 两种检测方法对加德纳菌阳性样本的检测结果统计表
64.加德纳菌阳性样本稀释倍数1:11:101:1001:10001:10000本发明试剂检测结果阳性阳性阳性阳性阴性胶体金检测结果阳性弱阳性阴性阴性阴性
65.表3 两种检测方法对加德纳菌阳性样本的检测结果统计表
[0066][0067]
实验结果表明本发明的试纸条在灵敏度上相较于胶体金方法学灵敏度获得极大提升,可有效避免因采样因素、样本本身浓度因素等造成漏检现象,且检测过程中未发现非特异性假阳性结果。
[0068]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。