1.本发明属于生物技术领域,具体涉及一种基于木寡糖氧化酶的木寡糖含量测定方法。
背景技术:
2.木寡糖(xos)是由木聚糖经酶解产生的聚合度为2
‑
10的木糖低聚物,商业上主要是以富含木聚糖的木质纤维素为原料,经过木聚糖酶水解后分离精制而得。
3.xos在酸性条件下相对稳定,是一种新型的不易消化的低聚糖(ndo)。在胃肠道中的不可消化性使其对胃酸、哺乳动物水解酶和胃肠道吸收具有天然的抵抗力。口服后会完整地到达结肠,在经过肠道微生物群发酵后,可选择性地刺激肠道微生物群的生长活性,改善肠道微生态,对宿主产生直接的生理作用,包括抗炎、抗氧化、矿物质代谢、脂质代谢和免疫调节等。
4.而目前常用的木寡糖含量测定方法主要是基于高效阴离子交换色谱或者高效液相色谱,测定步骤较为繁琐,且需要较为昂贵的色谱仪器。
5.本发明通过筛选和研究木寡糖氧化酶的氧化活性从而建立了一种操作简单且方便快捷以及结果准确等优点的木寡糖含量测定方法。
技术实现要素:
6.本发明通过在里氏木霉中表达纯化了尚未明确功能的aa7家族基因(ncbi gene symbol thite_2106069),首次鉴定其具有独特的木寡糖氧化活性。
7.在此基础上,本发明的目的是提供一种基于专一木寡糖氧化活性的木寡糖氧化酶耦联辣根过氧化物酶检测木寡糖含量的方法。具体地,所述方法基于专一木寡糖氧化活性的木寡糖氧化酶耦联辣根过氧化物酶以trinder试剂作为色源物质产生在515nm波长下具有特征吸收峰的显色产物,仅通过分光光度法测定即可以高效便捷的检测样品中木寡糖含量。
8.本发明的技术方案为:
9.一种测定木寡糖含量的方法,所述方法包括以下步骤:
10.(1)取木寡糖标准品,制定木寡糖浓度的标准曲线;
11.(2)取待测样品加入检测体系中反应;
12.(3)于分光光度计中测定515nm吸光值;
13.(4)将检测结果与标准曲线进行线性拟合,获得木寡糖含量;
14.其中,所述检测体系包括4
‑
氨基安替比林,3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐,辣根过氧化物酶,磷酸盐缓冲液和木寡糖氧化酶。
15.具体地,本发明所述检测体系包括10
‑
30微升1mm
‑
3mm 4
‑
氨基安替比林,10
‑
30微升10mm
‑
40mm 3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐(dhbs),5u
‑
10u辣根过氧化物酶,10
‑
30微升1μm
‑
20μm木寡糖氧化酶,用50
‑
100mm磷酸盐缓冲液补到150
‑
250微升。
16.优选地,本发明所述检测体系包括20微升1mm 4
‑
氨基安替比林,20微升10mm 3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐(dhbs),10u辣根过氧化物酶,20微升10μm木寡糖氧化酶,以及110微升100mm磷酸盐缓冲液。
17.其中,本发明所述木寡糖氧化酶源自太瑞斯梭孢壳霉,具有如seq id no.11所示的氨基酸序列。
18.本发明的另一个目的是提供本发明所述木寡糖氧化酶在测定木寡糖含量中的用途。
19.本发明所述测定方法的具体原理是:木寡糖氧化酶氧化木寡糖后产生过氧化氢,在辣根过氧化物酶(hrp)的作用下氧化4
‑
氨基安替比林(4
‑
aap,氧化后的4
‑
aap和3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐(dhbs)反应产生红色醌亚胺化合物,该化合物在515nm波长下具有特征吸收峰,仅通过分光光度法测定即可以高效便捷的检测样品中木寡糖含量。
附图说明
20.图1是表达载体的构建示意图。
21.图2是重组蛋白xoox的变性聚丙烯酰胺凝胶电泳和蛋白免疫印迹。
22.其中,a:为经考马斯亮蓝染色的变性聚丙烯酰胺凝胶电泳;b:为重组蛋白表达的蛋白免疫印迹验证。泳道m为蛋白分子量标准;s1和w1为亲本菌株qm9414液体发酵样品;s2和w2为重组菌株液体发酵样品;s3和w3为纯化后的重组蛋白。
23.图3是xoox的底物特异性检测结果图。
24.本实施例选择23种不同的底物测定了xoox的底物选择性。
25.图4是xoox酶的最适反应条件。
26.其中,a:最适反应ph值。b:最适反应温度。
27.图5是xoox对不同聚合度底物的酶促反应动力学参数。使用经典的米氏方程拟合数据。
28.图6是不同浓度木二糖和木三糖标准品检测结果。
29.其中,a:不同浓度木二糖标准品检测结果。b:不同浓度木三糖标准品检测结果。不同浓度标准品20微升加入到180微升检测体系中,室温反应30分钟后进行检测,每组数值重复3次,计算平均值和标准差并进行线性回归。
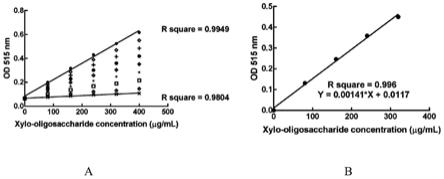
30.图7是不同浓度木寡糖检测结果图。
31.其中,a:不同浓度木寡糖混合物每分钟检测一次持续检测30分钟,选择每隔3分钟组数据绘制,并对第一次检测和最后一次检测结果进行线性回归。b:寡糖标准曲线。不同浓度木寡糖室温反应30分钟后进行检测,每组数值重复3次,计算平均值和标准差并进行线性回归。
具体实施方式
32.以下通过具体的实施例进一步对本发明进行说明,不能理解为是对本发明的限制,实施例中使用的全部材料、试剂,质粒等,如无特殊说明,均可从商业途径得到。其中所有引物均由广东艾基生物科技有限公司合成。
33.【实施例1】从太瑞斯梭孢壳霉(thilavia terrestris)中克隆寡糖氧化酶基因的
核苷酸序列。
34.材料:真菌基因组提取试剂盒(上海生工生物)、太瑞斯梭孢壳霉(thilavia terrestris,购自于美国模式菌种收藏中心,atcc)、puc19质粒、clonexpress ultra one step cloning kit(南京诺唯赞生物科技股份有限公司),大肠杆菌感受态细胞dh5α,胶回收试剂盒(南京诺唯赞),质粒小提试剂盒(南京诺唯赞)。
35.具体操作过程如下:
36.1、在cazy酶学数据库中检索太瑞斯梭孢壳霉aa7家族序列信息;在ncbi中查找已经公布的里氏木霉gpd启动子和终止子以及xyn2信号肽序列信息。根据序列信息thite_2106069基因属于氧依赖的fad
‑
linked氧化还原酶家族,具有独特的fad
‑
binding pcmh
‑
type结构域,去除信号肽后编码477个氨基酸,理论分子大小和等电点分别为52.8kda和5.69。设计扩增片段引物并添加同源臂具体引物序列如下表1所示。
37.表1实施案例中所用到的引物
[0038][0039]
2、在固体pda平板上接种里氏木霉qm9414菌种(购自美国模式菌种收藏中心,atcc),28℃条件下培养一周,用无菌水将平板上的孢子洗下并接种到50ml液体基本培养基中,在28℃震荡培养48小时后,减压抽滤获得里氏木霉qm9414菌丝。按照真菌基因组提取试剂盒操作说明进行里氏木霉基因组提取。按照相似的方法在45℃条件下分别以pda和液体基本培养基培养获得嗜热真菌太瑞斯梭孢壳霉的菌丝并提取基因组。以里氏木霉qm9414基因组为模板扩增组成型基因gpd的启动子区段、终止子区段以及xyn2的信号肽片段;以太瑞斯梭孢壳霉的基因组扩增去除信号肽的寡糖氧化酶(xoox)基因片段(thite_2106069),并在c末端添加6
×
his标签序列,如seq id no.11所示。
[0040]
3、以puc19为质粒为模板分别在ecorⅰ和hindⅲ酶切位点进行反向pcr扩增获得线性化的puc19载体片段,将线性化的puc19片段和gpd的启动子片段、xyn2的信号肽片段、xoox基因片段、gpd的终止子片段进行1%琼脂糖凝胶电泳,并进行切胶回收,按照切胶回收
试剂盒(南京诺唯赞生物科技股份有限公司)进行操作,使用nanodrop 2000进行核酸浓度定量。
[0041]
【实施例2】重组表达载体的构建
[0042]
由于引物设计过程中扩增各基因片段引物分别添加了特定的同源臂。因此按照clonexpress ultra one step cloning kit(南京诺唯赞生物科技股份有限公司)使用说明,取等摩尔量的各基因片段进行重组构建质粒,并按照使用说明中提供的转化步骤用热激的方式将重组产物转化到大肠杆菌dh5α(takara)。将转化重组质粒的大肠杆菌菌株在含有amp抗性以及iptg和x
‑
gal的lb固体平板上进行涂布,37℃培养12
‑
14小时,挑取大小适中的白色单菌落转接到含有amp抗性的液体lb培养基中进行培养。
[0043]
分别取上述液体培养的大肠杆菌菌液1μl作为pcr反应模板,用验证引物进行菌液pcr验证所选择大肠杆菌转化菌株是否为重组菌株。将验证后的重组菌株在lb液体培养基中进行培养,取200微升菌液送往广州艾基生物技术有限公司进行测序验证重组质粒有无突变。选择目的基因无突变重组质粒菌株在lb液体培养基中进行扩大培养,准备质粒提取。使用ez
‑
500柱式质粒大量抽提试剂盒(生工生物工程(上海)股份有限公司)按照使用说明进行质粒提取。保存在大肠杆菌dh5菌株中的pan7
‑
1质粒也按照相同的方式进行质粒提取。
[0044]
【实施例3】重组载体转化至里氏木霉
[0045]
材料:pda固体培养基:称取200g去皮马铃薯,切碎后于1000ml去离子水中煮沸30分钟,所得溶液用三层纱布过滤后,加入葡萄糖20g,琼脂15g,加去离子水定容至1000ml。若用作筛选转化子筛选培养基,则加入终浓度为160μg/ml的潮霉素b。
[0046]
液体基本培养基:mandels营养盐浓缩液100ml/l,mandels微量元素浓缩液1.0ml/l,葡萄糖20g/l,蛋白胨1.0g/l,1m ph 4.5的柠檬酸缓冲液50ml/l,吐温80 2.0g/l。
[0047]
mandels营养盐浓缩液:(nh4)2so4 14g,尿素3g,kh2po4 20g,cacl2.2h2o 4g,mgso4.7h2o 3g,加水至1000ml。
[0048]
mandels微量元素浓缩液:feso4.7h2o 5g,znso4.7h2o 1.7g,cocl2.6h2o 3.7g,mnso4.h2o 1.6g,加水至1000ml。
[0049]
stc溶液:山梨醇109.3g,1m tris
·
hcl溶液5ml,1m cacl2溶液25ml,去离子水定容至500ml,121℃高压灭菌25min。
[0050]
1m mgso4溶液:硫酸镁60g,用去离子水定容至500ml,121℃高压灭菌25min。
[0051]
60%peg4000溶液:预先配置含有50mm cacl2和10mm tris
·
hcl的缓冲溶液,取60g peg4000于烧杯中,加缓冲液定容至100ml,加热溶解后再次定容至100ml。
[0052]
具体过程如下:
[0053]
1、取约108个里氏木霉qm9414孢子接种于50ml液体基本培养基中,于250ml锥形瓶中28℃,250r/min,培养12小时。
[0054]
2、将培养液于50ml离心管中5000rpm离心10min,去上清液。
[0055]
3、加入20ml的1m mgso4溶液,并吹打均匀,5000rpm离心10min,取上清液。
[0056]
4、重复步骤3一次。
[0057]
5、加入10ml溶壁酶(100mg溶壁酶溶解于10ml 1m mgso4溶液中过滤除菌),并吹打均匀,于250ml的锥形瓶中28℃,70r/min培养2h。
[0058]
6、取培养液于50ml离心管中,加入20ml的stc,轻柔吹打均匀,于4℃,5000rpm离心
15min,去上清。
[0059]
7、加入10ml的stc,轻柔吹打均匀,5000rpm再次离心5min。
[0060]
8、弃上清液,加入1ml的stc,轻柔吹打均匀,取200μl加入已灭菌的1.5ml的离心管中。
[0061]
9、加入重组质粒和pan7
‑
1各10μg后,于冰上静置30min。
[0062]
10、48℃热激2min后,加入50μl 60%的peg4000,混匀后静置20min。
[0063]
11、将溶液转移至50ml离心管中,加入2ml 60%的peg4000,混匀后静置5min。
[0064]
12、加入20ml的stc,4℃,5000rpm离心15min,去上清液。
[0065]
13、吹打均匀后加入10ml原生质体再生培养基(5ml的2倍浓度stc,1ml的10倍浓度葡萄糖,4ml的2.5倍浓度基本培养基)。于250ml的锥形瓶中,28℃,70r/min培养24小时。
[0066]
14、培养液加入20ml的stc溶液于50ml的离心管中,5000rpm离心10min。
[0067]
15、加入1ml的stc溶液,吹打均匀,取200μl涂布于pda潮霉素b抗性平板上,37℃培养2~3d后挑取单菌落,于pda潮霉素b抗性平板再次筛选。
[0068]
16、培养2~3d后挑取单菌落于pda平板28℃培养7天后,获得里氏木霉重组菌株用于进一步验证。用无菌水洗脱孢子和60%甘油按照等体积比例混匀
‑
80℃保存。
[0069]
【实施例4】重组蛋白表达验证及纯化
[0070]
材料:
[0071]
里氏木霉重组菌株。
[0072]
土豆培养基(pda)培养基:用于里氏木霉的固体培养,含20%土豆浸出液,1%葡萄糖,2%agar。20%土豆浸出液作法如下:将土豆去皮切碎,每20g土豆加水100ml,煮沸30min,用三层纱布过滤,加入葡萄糖后定容,121℃灭菌30min。
[0073]
含有潮霉素土豆培养基(pda)培养基:土豆培养基(pda)培养基121℃灭菌30min后,待温度降到45℃,加入终浓度为100μg/ml的潮霉素b。
[0074]
里氏木霉液体基本培养基:含100ml/l mandels营养液浓缩液,1.0ml/l mandels微量元素浓缩液,10g/l无水葡萄糖,1.0g/l蛋白胨,50ml/l ph 4.5的1mol/l的柠檬酸缓冲液,1.0
‑
2.0g/l吐温80。
[0075]
含有潮霉素里氏木霉液体基本培养基:在里氏木霉液体基本培养基中加入终浓度为100μg/ml的潮霉素b。
[0076]
液体产酶发酵培养基:70g葡萄糖,20g蛋白胨,100ml mandels营养盐浓缩液,1ml mandels微量元素浓缩液,50ml ph 4.5的1mol/l的柠檬酸缓冲液,0.5g吐温80,加水至1000ml。
[0077]
mandels营养盐浓缩液:(nh4)2so4 14g,尿素3g,kh2po4 20g,cacl2.2h2o 4g,mgso4.7h2o 3g,加水至1000ml。
[0078]
mandels微量元素浓缩液:feso4.7h2o 5g,znso4.7h2o 1.7g,cocl2.6h2o 3.7g,mnso4.h2o 1.6g,加水至1000ml。
[0079]
具体步骤:将在潮霉素抗性pda平板上生长的转化子菌丝转接到新的潮霉素抗性平板上,生长一周后收集孢子进行液体培养2天,取2ml菌液接种到40ml发酵培养基中继续培养一周。取发酵培养后的菌液上清进行聚丙烯酰胺凝胶电泳和蛋白免疫印迹,确定目的蛋白正确表达。电泳显示出条带大小在60kda左右(图3),略高于通过氨基酸序列计算得到
的52.8kda,我们认为可能是由于糖基化导致。因在重组表达过程中在xoox蛋白氨基酸序列c末端添加了6个组氨酸构成的标签序列,用histrap hp预装柱进行亲和层析。将发酵后的样品抽滤去除菌丝,然后经过0.22微米滤膜过滤去除不溶性颗粒,将过滤后的发酵液装入透析袋中,在透析袋外部覆盖一层peg 20000干粉,置于4℃低温浓缩样品6
‑
8小时,然后将透析带转入亲和层析上样缓冲液中透析12小时,期间更换两次缓冲液。处理后的样品按照预装柱使用说明书进行亲和层析,获得均质蛋白。收集到的纯蛋白洗脱液含有高浓度的咪唑,而高浓度的咪唑能抑制蛋白活性。所以,要用脱盐柱进行脱盐。此时用的洗脱缓冲液为tbs缓冲液,并添加5%的甘油。
[0080]
将脱盐后的纯蛋白样品用10000mw超滤管(millipore)进行离心浓缩。然后以50μl的体积分装,
‑
80℃保存备用。取适量的样品进行sds
‑
page。结果如图2所示。图2结果中,a:为经考马斯亮蓝染色的变性聚丙烯酰胺凝胶电泳;b:为重组蛋白表达的蛋白免疫印迹验证。泳道m为蛋白分子量标准;s1和w1为亲本菌株qm9414液体发酵样品;s2和w2为重组菌株液体发酵样品;s3和w3为纯化后的重组蛋白。从图中可以看到重组蛋白大小在60kda左右。纯化后的蛋白质送至深圳大学生科院仪器共享平台进行质谱检测其序列,详细序列如seq id no.11所示。
[0081]
【实施例5】xoox酶学性质研究
[0082]
使用纯化至均质的xoox,在先前报道的96孔显色分析方法基础上适当调整后用于本实验中所纯化的酶活力。取纯化至均质的酶液20微升,加入到180微升检测体系中,检测体系包含0.1mm 4
‑
氨基安替比林(4
‑
aap),1mm 3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐(dhbs),10u辣根过氧化物酶,100mm磷酸盐缓冲液(ph7.0),以及不同种类底物,在515nm吸光值下进行检测,确定所纯化酶的底物选择性。结果可以看出xoox仅对木寡糖混合物和木寡糖表现出明显活性,其中木寡糖混合物活性最强,而对桦木木寡糖活性不强。值得注意的是,xoox对于木糖在检测期间(最高持续60分钟)也未表现出活性,具体如图3所示。
[0083]
选择该酶表现最强活性的木寡糖混合物(10mg/ml)作为底物,使用纯化至均质的xoox在上述体系中测定不同温度条件下的反应曲线。为了避免该酶耦联hrp反应过程中hrp酶学参数对测定的干扰,因此选择先加入待测酶液和木寡糖混合物及缓冲液成分,在水浴锅中反应5分钟后立即置于冰上并加入hrp等其余成分,然后室温反应5分钟后置于酶标仪中进行检测。如图5所示,该酶最适温度在60℃和70℃之间,表现为较高的耐热活性。按照相似的方式,在50℃条件下用br缓冲液(britton
‑
robinson buffer)在ph 2至9的范围内改变反应ph,反应五分钟后将20微升反应后体系加入到180微升检测体系中室温检测,检测体系包括100mm的磷酸盐缓冲液ph为7.2,以及其余固定浓度的成分,以使不同浓度的br缓冲液造成的酸碱度得以平衡。xoox在ph为6的条件下发挥最大催化活性,呈现典型的倒v型曲线(参见图4)
[0084]
动力学参数的确定是根据反应速度对底物浓度的依赖性,通过使用50nm的酶和一定浓度的木二糖、木三糖、木四糖、木五糖混合反应进行测定。初始反应速率是通过在ph 6.0的br缓冲溶液中在25℃条件下每30s测量反应产物吸光值,持续测定5min来获得的,所有测定均一式三份进行,然后对所测定的吸光值进行仪器校准,将其转变为每厘米光径数值,通过使用朗伯比尔定律按照4
‑
aap和dhbs的粉色产物消光系数为26000m
‑
1计算产生的过氧化氢浓度,从而得到反应速度,然后使用graphpad prism中的曲线拟合工具进行选择
经典米氏方程,确定动力学参数(参见图5)。详细参数如表2所示,xoox对于木二糖、木三糖、木四糖、木五糖的km值依次为:3.604mm、1.078mm、1.046mm、1.036mm。
[0085]
表2木寡糖氧化酶xoox对于不同聚合度底物的米氏方程拟合参数
[0086][0087][0088]
【实施例6】木寡糖含量的测定
[0089]
取不同浓度的木二糖标准品、木三糖标准品20微升,加入到180微升检测体系中,检测体系包含20微升1mm 4
‑
氨基安替比林(4
‑
aap),20微升10mm3,5
‑
二氯
‑2‑
羟基苯磺酸钠盐(dhbs),10u辣根过氧化物酶,110微升100mm磷酸盐缓冲液(ph7.0),以及20微升10um纯化后xoox,室温反应30分钟后测定515nm吸光值,并对检测结果进行线性拟合。
[0090]
同时以木寡糖水解酶处理木寡糖后的得到的木寡糖混合物作为底物,在515nm吸光值持续检测30分钟,选择每隔3分钟组数据绘制,并对第一次检测和最后一次检测结果进行线性拟合,发现无论第一次测定还是最后一次测定均能表现出较好的拟合效果(r2>0.98),但随着反应时间延长拟合度逐渐提高到0.9949(参见图7a。因此,我们认为前期检测主要依靠于随着木寡糖浓度增加xoox的反应速率也增加,即测定反应初速度也可作为定量木寡糖浓度的标准;但存在对于木寡糖浓度增加时拟合度不高的情况,我们认为可能是因为反应体系中底物饱和,因此若选择基于初始反应速率衡量木寡糖浓度则需要考虑反应体系中xoox与木寡糖浓度相适应。随着反应时间的延长,反应体系中原本存在的超过xoox饱和限度的木寡糖逐渐被完全氧化直接反应出体系中木寡糖所具有的还原力,可以直接表征体系中所含有的木寡糖浓度。因此单独测定了一组新的木二糖木三糖标准品反应完成后的吸光值并绘制标准曲线,证明该方法可以准确测定溶液中木寡糖含量,具体结果如图6
‑
7所示。其中,图6是不同浓度木二糖和木三糖标准品检测结果。图7是不同浓度木寡糖检测结果图。
[0091]
由此可见基因thite_2106069表达的重组木寡糖氧化酶具有专一的木寡糖氧化活性且具有较好的温度稳定性。在检测样品中木寡糖含量的过程中,可实现极高的灵敏性和准确性,同时检测速度快有实现高通量的潜力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。