1.本发明涉及生物分析中免疫原性技术领域,特别涉及一种提高抗药抗体分析中药物耐受的操作方法。
背景技术:
2.近年来随着人口老龄化以及癌症发病率的持续增加,健康问题受到广泛关注,因此生物医药行业得以快速发展,越来越多的生物药物进入临床试验研究阶段,药物从立项到上市中间经历了漫长且复杂的成长过程,中间每一个环节的失败都可能导致项目终止,距离药物申报上市仅差一步之遥而宣布项目失败的案例比比皆是,其中由免疫原性引起的药物安全性是导致失败的主要原因之一;
3.免疫原性定义为治疗性蛋白产品产生对自身及相关蛋白免疫反应或诱导免疫相关临床不良反应的现象,由于治疗性蛋白产品对于人体自身属于“外来物”,作为免疫原会使机体产生很强的免疫反应从而引起的一系列安全隐患,机体对于治疗性蛋白产品的免疫应答可能会影响该产品的药代动力学,药效学,安全性及有效性,受试者免疫应答在临床上可能对受试者健康完全没有影响也可能带来极其严重的结果,因此,在临床试验中,免疫原性的检测尤为重要,是药物申请上市必须提供的核查数据材料,是评估药物安全性的重要指标;
4.针对于免疫原性的检测方法目前主要应用的平台有酶标仪、msd等手段,主要针对的是免疫原性的抗药抗体(anti
‑
drug antibody,ada)检测,但问题在于很多ada的检测方法的存在药物耐受性差的问题,即存在于血清中的治疗性蛋白质产品(药物本身)或其内源靶点可能干扰方法的灵敏度,这对于半衰期长的药物(例如抗体药)尤其明显,在ada检测方法中,评估其对治疗性蛋白质产品的抗干扰能力,称药物耐受,我们知道,抗药抗体检测主要是评估治疗性蛋白质产品在进入人体后,人体针对于该免疫原所产生的ada,针对的是ada的检测,而非药物本身,因此难点在于受试者样本大多都是接受了治疗性蛋白质产品治疗的样本,其样本中的ada是与治疗性蛋白质产品结合的复合体,而非单一形式的ada,因此在检测前必须对样本进行前处理,将原本结合的复合体酸解分离,然后通过竞争法得到所要检测的ada,最后进行分离后的ada的检测;
5.针对于研究ada的检测方法主要难点在于解决药物耐受,目前开发的检测方法主要是通过酸解将原本结合的复合体解离,加入碱性环境下的竞争试剂(通常为研究的治疗性蛋白产品)孵育后进行ada检测,达到竞争ada的目的,但由于竞争试剂为固相且浓度不高,竞争能力远远低于游离药物与ada的结合效率;酸解后的样品中仍然存在大量酸解前的治疗性蛋白产品,对后续试验造成干扰,因此该方法提升药物耐受的效果并不显著且有一定的局限性。
技术实现要素:
6.本发明的主要目的在于提供一种提高抗药抗体分析中药物耐受的操作方法,可以
有效解决背景技术中的问题。
7.为实现上述目的,本发明采取的技术方案为:
8.一种提高抗药抗体分析中药物耐受的操作方法,具体步骤如下:
9.(s1)、样品酸化:对药物样品进行稀释,再将稀释的样品加入稀释板中,并在稀释板中加入甘氨酸,然后放入恒温震荡仪上进行孵育;
10.(s2)、sa磁珠清洗:取sa磁珠置于磁力架上,再移去上清液体,加入2%bsa涡旋,重复两次;
11.(s3)、磁珠封闭:将sa磁珠置于磁力架上,移去上清液体,加入2%bsa,再放置于垂直混匀仪中进行室温孵育;
12.(s4)、生物素化的药物孵育:在步骤(s1)的稀释板中加入生物素标记的药物(biotin
‑
drug),继续在恒温震荡仪上进行孵育;
13.(s5)、磁珠富集:将经过封闭的sa磁珠加入稀释板中,继续在恒温震荡仪上进行孵育以结合样本中的抗药抗体;
14.(s6)、磁珠清洗:将稀释板置于磁板上,待磁珠富集抗药抗体后移去上清液体,通过pbst吹洗磁珠,重复四次;
15.(s7)、磁珠酸化:将稀释板置于磁板上,去除上清液体,再加入甘氨酸后放入恒温震荡仪上进行抗药抗体的洗脱;
16.(s8)、中和孵育:将稀释板上酸化后的样品加入tris
‑
hcl,再放入恒温震荡仪上进行孵育。
17.优选的,所述步骤(s1)中的恒温震荡仪的孵育时间为30min
±
5min,温度为室温,转速为800rpm。
18.优选的,所述步骤(s1)和所述步骤(s7)中的甘氨酸浓度均为0.3m,所述甘氨酸的ph值均为2.0
‑
3.0。
19.优选的,所述步骤(s2)中的sa磁珠的浓度为10mg/ml。
20.优选的,所述步骤(s2)和所述步骤(s3)中的bsa是以pbst作为溶液,所述步骤(s2)中单次涡旋的时间为1min,所述步骤(s3)中垂直混匀仪的孵育时间大于60min。
21.优选的,所述步骤(s4)中的恒温震荡仪的孵育时间为60min
±
10min,温度为室温,转速为800rpm。
22.优选的,所述步骤(s5)中的恒温震荡仪的孵育时间为60min
±
10min,温度为室温,转速为800
‑
1200rpm。
23.优选的,所述步骤(s6)中吹洗磁珠的pbst的量为稀释板每孔200μl。
24.优选的,所述步骤(s7)中恒温震荡仪上洗脱时间为10min,温度为室温,转速为800
‑
1200rpm。
25.优选的,所述步骤(s8)中的恒温震荡仪的孵育时间为60min
±
5min,温度为室温,转速为600rpm。
26.与现有技术相比,本发明具有如下有益效果:
27.本发明中,采用磁珠富集的方式,在检测平台不变的前提下大大提高了检测的药物耐受浓度,达到监管局可以接受的范围,增加了方法的适用范围;
28.本发明中,通过磁珠富集处理样本,检测灵敏度同样很高,远远高于法规要求的最
低灵敏度要求;
29.本发明中,采用磁珠富集方式有效的去除了干扰物,为接下来的检测提供了稳定性保障;
30.本发明中,采用磁珠富集方法,使后期操作实现自动化成为可能。
31.本发明方法运用了亲和磁珠的理化特性,通过将ada酸解富集出来进行检测,不仅排除了研究药物的干扰,且使ada处于相对单一的样本环境,我们在实施例中展示本发明的统计数据与传统方法的对比,性能分别提升2000倍和30000倍,充分展示了sa磁珠分离富集的有效性;
32.综上所述,本发明方法大大提高了ada的抓取富集效率,且有效去除了样本中的治疗性蛋白产品,避免其与ada的再次结合,降低了后期检测的复杂性,磁珠富集后的ada通过酸解解离下来后即可进行后期检测,本发明相较于传统方法药物耐受浓度提高超过上千倍。
附图说明
33.图1为本发明一种提高抗药抗体分析中药物耐受的操作方法中的磁珠富集原理图。
具体实施方式
34.为使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。
35.如图1所示,一种提高抗药抗体分析中药物耐受的操作方法,具体步骤如下:
36.(s1)、样品酸化:对药物样品进行稀释,再将稀释的样品加入稀释板中,并在稀释板中加入甘氨酸,然后放入恒温震荡仪上进行孵育;
37.(s2)、sa磁珠清洗:取sa磁珠置于磁力架上,再移去上清液体,加入2%bsa涡旋,重复两次;
38.(s3)、磁珠封闭:将sa磁珠置于磁力架上,移去上清液体,加入2%bsa,再放置于垂直混匀仪中进行室温孵育;
39.(s4)、生物素化的药物孵育:在步骤(s1)的稀释板中加入生物素标记的药物(biotin
‑
drug),继续在恒温震荡仪上进行孵育;
40.(s5)、磁珠富集:将经过封闭的sa磁珠加入稀释板中,继续在恒温震荡仪上进行孵育以结合样本中的抗药抗体;
41.(s6)、磁珠清洗:将稀释板置于磁板上,待磁珠富集抗药抗体后移去上清液体,通过pbst吹洗磁珠,重复四次;
42.(s7)、磁珠酸化:将稀释板置于磁板上,去除上清液体,再加入甘氨酸后放入恒温震荡仪上进行抗药抗体的洗脱;
43.(s8)、中和孵育:将稀释板上酸化后的样品加入tris
‑
hcl,再放入恒温震荡仪上进行孵育。
44.以下实施例一和实施例二中:ada筛选的临界值(screening cut
‑
point,scp)通过正常个体/临床试验未给药的受试者样本检测和计算获得,高于scp值表示该样本ada呈阳
性,低于scp值表示样本的ada检测呈阴性。药物耐受所研究试验为通过配制一定浓度ada阳性样本所能耐受的药物干扰浓度,即信噪比(s/n)值大于scp所对应的最高药物浓度点,即为药物耐受。
45.实施例一为单克隆抗体药物,实施例二为双特异性抗体药物。
46.实施例一
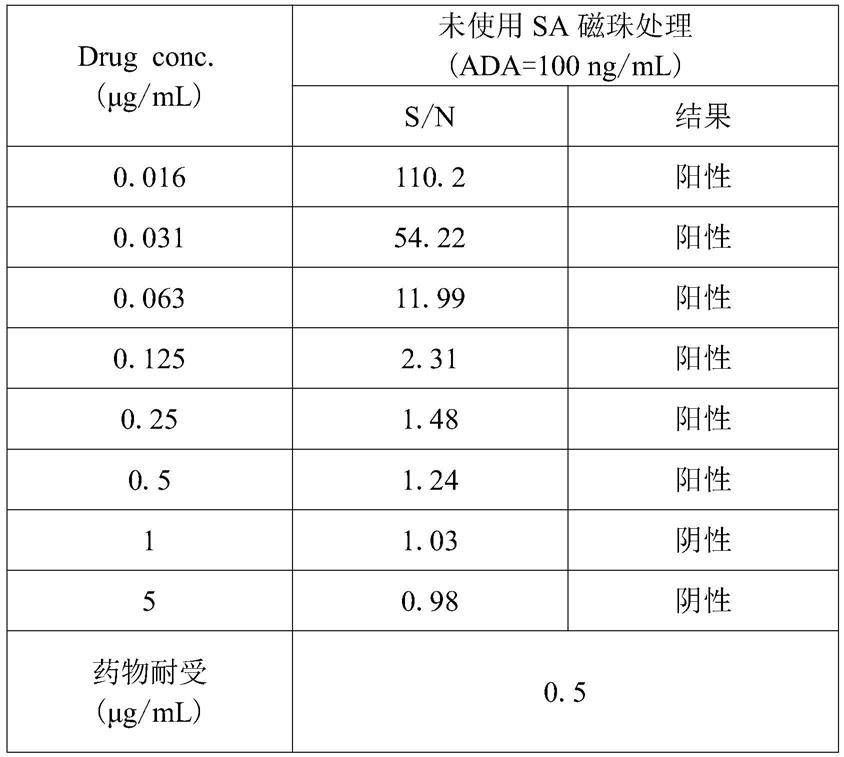
47.scp为1.04,最小稀释倍数(mrd)为20,ada浓度为100ng/ml,表示ada浓度在100ng/ml,未使用sa磁珠方法富集处理时所对应的最大药物耐受为0.5μg/ml,即药物浓度最大为0.5μg/ml时,ada浓度为100ng/ml或以上表现为阳性。
48.表一:未使用sa磁珠处理的药物耐受
[0049][0050]
在上述相同条件下,增加sa磁珠富集处理步骤,所对应的最大药物耐受为1000μg/ml,且所对应的s/n值仍然远高于scp值(1.04),即药物浓度最大为1000μg/ml时,ada浓度为100ng/ml表现为阳性。
[0051]
表二:使用sa磁珠处理后的药物耐受
[0052][0053]
通过表一和表二数据对比得出,在使用sa磁珠富集处理步骤后,药物耐受由原本的0.5μg/ml提高至1000μg/ml以上,性能提升超过2000倍。
[0054]
实施例二
[0055]
scp为1.30,最小稀释倍数(mrd)为5,ada浓度为100ng/ml,表示ada浓度在100ng/ml,未使用磁珠方法富集做前期处理时所对应的最大药物耐受为0.031μg/ml,即药物浓度最大为0.031μg/ml时,ada浓度为100ng/ml表现为阳性。
[0056]
表三:未使用sa磁珠处理的药物耐受
[0057][0058]
在上述相同项目条件下,增加磁珠富集前期处理步骤,所对应的最大药物耐受为1000μg/ml,且所对应的s/n值仍然远高于scp值(1.30),即药物浓度最大为1000μg/ml时,ada浓度为100ng/ml表现为阳性。
[0059]
表四:使用sa磁珠处理的药物耐受
[0060][0061]
通过表三和表四数据对比得出,在使用sa磁珠富集处理步骤后,药物耐受由原本的0.031μg/ml提高至1000μg/ml以上,性能提升超过30000倍。
[0062]
结合实施例一和实施例二可以得知:本方法利用磁珠和链霉亲和素(streptavidin,sa)的基本物理化学性质,将streptavidin通过化学偶联反应连接在磁珠表面,形成具有一定特异性的磁珠试剂,利用streptavidin可以特异性结合生物素(biotin)的化学性质,以及磁珠可被磁铁快速吸附的物理性质;通过sa磁珠酸解富集ada的方法,即使用游离状态下标记生物素的竞争试剂(通常为治疗性蛋白产品,biotin
‑
drug),与酸解离后的样本混合、进行孵育反应,通过较高浓度的游离竞争试剂达到高效竞争结合的目的,形成biotin
‑
drug
‑
ada复合物,然后通过sa磁珠与biotin结合的性质将该复合物抓取后通过磁性环境富集出来,大大提高了ada的抓取效率,且有效去除了样本中的治疗性蛋白产品,避免其与ada的再次结合,对ada起到纯化的作用,降低了后期检测的复杂性。
[0063]
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。