1.本发明涉及蛋白检测领域。具体而言,本发明涉及提高间接标记灵敏度的方法和试剂盒。
背景技术:
2.在申请号为200810216400.0的中国专利文献中曾提出一种“间接标记纳米颗粒的抗体检测双抗原夹心法及其试剂盒”,该专利研究了间接标记在纳米颗粒类标记物如胶体金方面的应用。纳米颗粒因为粒径较大的原因,标记物最终的形态是以纳米颗粒标记物为核心的——一个纳米颗粒标记物表面偶联多个抗原,于是间接标记带来许多优势:首先间接标记因其相当于在纳米颗粒和标记抗原之间加了一个“手臂”,所以更有利于暴露抗原表位;其次可以降低标记抗原的用量,抗原和纳米颗粒类标记物的比例理想状态是1:1。
3.而实际实验中,纳米颗粒类标记物经标记配体、标记抗原的振荡过程,一部分标记抗原从配体脱落游离在标记体系中导致灵敏度下降;基于此,本发明在间接标记的标记方法上做出进一步的改进,以提高灵敏度。
技术实现要素:
4.在一些实施方案中,本发明可以包括下述一项或多项:
5.1.一种抗原标记方法,其中,所述方法包括步骤(
ⅰ
)配体标记纳米颗粒类标记物,(
ⅱ
)标记抗原标记步骤(
ⅰ
)所得的配体
‑
纳米颗粒类标记物,(
ⅲ
)向标记体系中补充加入标记了配体的纳米颗粒类标记物,得到抗原标记复合物;其中,纳米颗粒类标记物与标记抗原之间的标记是通过抗原上的标签和标记在纳米颗粒类标记物上的可特异性识别该标签的所述配体相结合来完成的间接标记。
6.2.项目1所述的方法,其中,所述标记抗原包括但不限于艾滋病毒抗原、甲型肝炎病毒抗原、乙型肝炎病毒抗原、丙型肝炎病毒抗原、丁型肝炎病毒抗原、戊型肝炎病毒抗原、庚型肝炎病毒抗原、风疹病毒抗原、人巨细胞病毒抗原、单纯疱疹病毒1型抗原、单纯疱疹病毒2型抗原、狂犬病毒抗原、人类t淋巴细胞白血病病毒抗原、登革热病毒抗原、人乳头瘤病毒抗原、西尼罗河病毒抗原、森林脑炎病毒抗原、麻疹病毒抗原、流感病毒抗原、副流感病毒抗原、水痘病毒抗原、艾柯病毒抗原、柯萨奇病毒抗原、乙型脑炎病毒抗原、eb病毒抗原、腮腺炎病毒抗原、梅毒螺旋体抗原、包柔氏螺旋体抗原、沙眼衣原体抗原、肺炎衣原体抗原、鹦鹉热衣原体抗原、解脲脲原体抗原、肺炎支原体抗原、结核分枝杆菌抗原、幽门螺旋杆菌抗原、淋球菌抗原、疟原虫抗原、枯氏锥虫抗原、弓形虫抗原。
7.3.项目1所述的方法,其中,所述纳米颗粒类标记物包括纳米颗粒、胶体、有机纳米颗粒、磁性纳米颗粒、量子点纳米颗粒、稀土络合物纳米颗粒,以及它们各自的衍生物,或者两者以上的组合物;其中所述胶体包括胶体金属、分散型染料和染料标记的微球、乳胶;其中所述胶体金属包括胶体金、胶体银、胶体硒。
8.4.项目1所述的方法,其中,所述标签为选择以下的多肽或蛋白:his tag、t7 tag、
s tag、flag tag、ha tag、gst融合蛋白、trx融合蛋白、sod融合蛋白、cks融合蛋白、dsba融合蛋白、mbp融合蛋白、cbd融合蛋白,或者为生物素。
9.5.项目1所述的方法,其中,所述配体包括但不限于针对标签的特异性抗体、与标签有亲和力的物质如链霉亲和素或其类似物。
10.6.项目1所述的方法,其中,所述补充加入标记了配体的纳米颗粒类标记物的添加量可以是标记体系定容体积的5%
‑
30%;例如可以是标记体系定容体积的7.5%
‑
17.5%;优选为10%。
11.7.项目7所述的方法,其中,所述标记体系使用的标记物稀释液的组成包括20mm pb,150mm nacl,1%bsa,0.1%triton x
‑
100,2%蔗糖,0.01%proclin300。
12.8.项目1
‑
7任一项所述的抗原标记复合物。
13.9.一种检测试剂盒,其包括项目8所述的抗原标记复合物。
14.10.项目1
‑
7任一项所述的方法和/或项目8所述的抗原标记复合物在制备抗体检测试剂盒中的应用。
附图说明
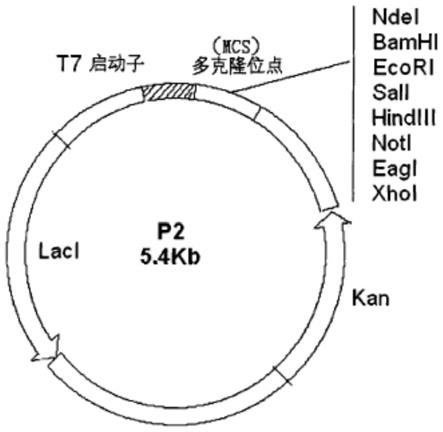
15.图1为载体p2的图谱;
16.图2为带有x融合蛋白的载体p2
‑
x的构建过程。
具体实施方式
17.在一些实施方案中,本发明提供了一种抗原标记方法,其中,所述方法包括步骤(
ⅰ
)配体标记纳米颗粒类标记物,(
ⅱ
)标记抗原标记步骤(
ⅰ
)所得的配体
‑
纳米颗粒类标记物,(
ⅲ
)向标记体系中补充加入标记了配体的纳米颗粒类标记物,得到抗原标记复合物;其中,纳米颗粒类标记物与标记抗原之间的标记是通过抗原上的标签和标记在纳米颗粒类标记物上的可特异性识别该标签的所述配体相结合来完成的间接标记。
18.在一些实施方案中,本发明的抗原标记方法,所述标记抗原包括但不限于艾滋病毒抗原、甲型肝炎病毒抗原、乙型肝炎病毒抗原、丙型肝炎病毒抗原、丁型肝炎病毒抗原、戊型肝炎病毒抗原、庚型肝炎病毒抗原、风疹病毒抗原、人巨细胞病毒抗原、单纯疱疹病毒1型抗原、单纯疱疹病毒2型抗原、狂犬病毒抗原、人类t淋巴细胞白血病病毒抗原、登革热病毒抗原、人乳头瘤病毒抗原、西尼罗河病毒抗原、森林脑炎病毒抗原、麻疹病毒抗原、流感病毒抗原、副流感病毒抗原、水痘病毒抗原、艾柯病毒抗原、柯萨奇病毒抗原、乙型脑炎病毒抗原、eb病毒抗原、腮腺炎病毒抗原、梅毒螺旋体抗原、包柔氏螺旋体抗原、沙眼衣原体抗原、肺炎衣原体抗原、鹦鹉热衣原体抗原、解脲脲原体抗原、肺炎支原体抗原、结核分枝杆菌抗原、幽门螺旋杆菌抗原、淋球菌抗原、疟原虫抗原、枯氏锥虫抗原、弓形虫抗原。
19.在一些实施方案中,本发明的间接标记纳米颗粒的抗体检测方法可以应用于以纳米颗粒作为标记物和/或信号物的免疫检测中;在一些实施方案中,所述免疫检测为免疫层析检测。
20.在一些实施方案中,本发明所述纳米颗粒类标记物包括纳米颗粒、胶体、有机纳米颗粒、磁性纳米颗粒、量子点纳米颗粒、稀土络合物纳米颗粒,以及它们各自的衍生物,或者两者以上的组合物;在一些实施方案中,所述胶体包括胶体金属、分散型染料和染料标记的
微球、乳胶;在一些实施方案中,所述胶体金属包括胶体金、胶体银、胶体硒。
21.在一些实施方案中,本发明所述标签为选择以下的多肽或蛋白:his tag、t7 tag、s tag、flag tag、ha tag、gst融合蛋白、trx融合蛋白、sod融合蛋白、cks融合蛋白、dsba融合蛋白、mbp融合蛋白、cbd融合蛋白,或者为生物素。在一些实施方案中,标签可以结合在标记抗原的n端、c端、两端或内部。
22.在一些实施方案中,本发明所述配体包括但不限于针对标签的特异性抗体、与标签有亲和力的物质如链霉亲和素或其类似物。
23.在一些实施方案中,本发明所述补充加入标记了配体的纳米颗粒类标记物的添加量可以是标记体系定容体积的5%
‑
30%;在一些实施方案中,添加量可以是标记体系定容体积的7.5%
‑
17.5%;在一些实施方案中,添加量可以是例如5%、例如7.5%、例如10%、例如12.5%、例如15%、例如17.5%、例如20%、例如22.5%、例如25%、例如27.5%、例如30%,但不限于此。
24.在一些实施方案中,本发明所述标记体系使用的标记物稀释液的组成包括20mm pb,150mm nacl,1%bsa,0.1%triton x
‑
100,2%蔗糖,0.01%proclin300。
25.在一些实施方案中,本发明提供了任一实施方案的抗原标记复合物。在一些实施方案中,所述抗原标记复合物可以是液体试剂;在一些实施方案中,所述抗原标记复合物可以被制成标记物结合垫;在一些实施方案中,制备方式包括但不限于冻干、烘干、风干。
26.在一些实施方案中,本发明提供了包括任一实施方案的抗原标记复合物的试剂盒(试纸条)。
27.在一些实施方案中,本发明还提供了包括任一实施方案的方法和/或抗原标记复合物在制备抗体检测试剂盒中的应用。
28.在一些实施方案中,采用本发明的方法和/或试剂盒,可以在间接标记原本模式的基础上进一步提高灵敏度。
29.下面主要结合具体实施例对本发明作进一步详细的说明。提供以下实施例以说明本发明的实施方案,并非意在限制本发明。本发明可以任选包括未通过实施例示出的实施方案。本发明所使用的克隆载体p2图谱见附图1,在实施本发明的过程中p2并不是必须的表达载体,其上游的增强子在本发明中也不起实质作用,其它许多表达载体如pet
‑
24a( )(美国novagen公司,货号69749
‑
3)均可用于实施本发明。
30.实施例一、丙型肝炎病毒(hcv)的间接标记纳米颗粒的抗体检测
31.1.1丙肝重组抗原的制备
32.1.1.1丙肝包被抗原的制备
33.pcr扩增丙型肝炎病毒基因组orf全长1201
‑
1465aa所对应的dna区段,其上游引物带有bamhi位点,下游引物带有ecori位点且ecori位点之前带有6个his氨基酸的编码序列以及终止密码taa。pcr的片段经回收之后,用bamhi和ecori酶切,连接到用bamhi和ecori酶切之后的表达载体p2中,得到重组质粒p2
‑
ns3,即本发明的包被抗原的重组质粒。
34.质粒p2
‑
ns3转化er2566菌,用含100μg/ml硫酸卡那霉素的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,部分目的蛋白分布在裂解液沉淀。每升菌液的菌体用10ml裂解缓冲
液(50mm tris
‑
hcl,ph8.0,1mm edta,100mm nacl)重悬,超声破碎,4℃12000rpm离心20分钟收集包涵体,用含2%triton x
‑
100的溶液1(20mm tris
‑
hcl,ph8.5,5mm edta,100mm nacl)重悬,4℃12000rpm离心20分钟收集包涵体,用溶液1配制的4m尿素溶解后对100体积的pb缓冲液(ph7.0,20mm)透析,换液3次,4℃12000rpm离心20分钟去除沉淀后制成粗抗原,用同一pb缓冲液平衡sephacryl s
‑
200凝胶柱(美国amersham biosciences公司)后将上述粗抗原过柱,收集并合并含目的蛋白的溶液,用5ml平衡缓冲液(10mm na2hpo4,1.8mm kh2po4,140mm nacl,2.7mm kcl,25mm咪唑,ph8.0)溶解。用10倍柱床体积的平衡缓冲液平衡ni
‑
nta亲和柱(qiagen公司,货号30210)之后,加入蛋白样,用10倍介质体积的平衡缓冲液洗去未结合的蛋白,再用5倍体积洗脱缓冲液(20mm na2hpo4,300mm nacl,250mm咪唑,ph8.0),洗脱目的蛋白,测定蛋白浓度,4℃或
‑
20℃保存备用,蛋白命名为p2
‑
ns3。
35.1.1.2丙肝标记抗原的制备
36.用1.1.1中的ns3片段,连接到用bamhi和ecori双酶切处理之后的载体p2
‑
x中得到重组质粒p2
‑
x
‑
ns3,即本发明的标记抗原的重组质粒。p2
‑
x
‑
ns3质粒转化er2566,挑单克隆菌落,接种于含100μg/ml硫酸卡那霉素的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,部分目的蛋白分布在裂解液沉淀。每升菌液的菌体用10ml裂解缓冲液(50mm tris
‑
hcl,ph8.0,1mm edta,100mm nacl)重悬,超声破碎,4℃12000rpm离心20分钟收集包涵体,用含2%triton x
‑
100的溶液1(20mm tris
‑
hcl,ph8.5,5mm edta,100mm nacl)重悬,4℃12000rpm离心20分钟收集包涵体,用溶液1配制的6m尿素溶解后对100体积的pb缓冲液(ph7.0,20mm)透析,换液3次,4℃12000rpm离心20分钟去除沉淀后制成粗抗原,用同一pb缓冲液平衡sephacryl s
‑
200凝胶柱(美国amersham biosciences公司)后将上述粗抗原过柱,收集并合并含目的蛋白的溶液,用5ml平衡缓冲液(10mm na2hpo4,1.8mm kh2po4,140mm nacl,2.7mm kcl,25mm咪唑,ph8.0)溶解。用10倍柱床体积的平衡缓冲液平衡ni
‑
nta亲和柱(qiagen公司,货号30210)之后,加入蛋白样,用10倍介质体积的平衡缓冲液洗去未结合的蛋白,再用5倍体积洗脱缓冲液(20mm na2hpo4,300mm nacl,250mm咪唑,ph8.0),洗脱目的蛋白,测定蛋白浓度,4℃或
‑
20℃保存备用,蛋白命名为x
‑
ns3。
37.1.1.3免疫原和杂交瘤细胞筛选抗原(x蛋白)的制备
38.以p2
‑
x、pinpoint
tm xa
‑
1(美国promega公司,货号v2031)质粒转化大肠杆菌er2566,根据质粒所带的抗生素基因,分布选择涂布于含100μg/ml硫酸卡那霉素或100μg/ml氨苄西林钠的lb平板上,37℃过夜培养,挑取单克隆,用含同一浓度的硫酸卡那霉素或者氨苄西林钠的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,部分目的蛋白分布在裂解液沉淀。每升菌液的菌体用10ml裂解缓冲液(50mm tris
‑
hcl,ph8.0,1mm edta,100mm nacl)重悬,超声破碎,4℃12000rpm离心20分钟收集包涵体,用含2%triton x
‑
100的溶液1(20mm tris
‑
hcl,ph8.5,5mm edta,100mm nacl)重悬,4℃12000rpm离心20分钟收集包涵体,用溶液1配制的8m尿素溶解后对100体积的pb缓冲液(ph7.0,20mm)透析,换液3次,4℃12000rpm离心20分钟去除沉淀后制成粗抗原,用同一pb缓冲液平衡sephacryl s
‑
200凝胶柱(美国
amersham biosciences公司)后将上述粗抗原过柱,收集并合并含目的蛋白的溶液,再过deae琼脂糖离子交换柱(美国amersham biosciences公司),用pbs缓冲液(ph7.0,20mm pb,50mm nacl)洗涤以去除未被吸附的杂蛋白,再以pbs缓冲液(ph7.0,20mm pb,500mm nacl)洗脱目的蛋白,测定蛋白浓度,4℃或
‑
20℃保存备用。
39.1.2抗x杂交瘤细胞株的建立及其单克隆抗体的制备
40.1.2.1重组x蛋白免疫小鼠
41.将p2
‑
x表达的x蛋白溶液用pbs透析之后,用pbs稀释到1.0mg/ml,与福氏完全佐剂等体积混合,并充分乳化,背皮下注射免疫6周龄的纯系balb/c小鼠,剂量50μg/只。2周后,将x蛋白与福氏不完全佐剂等体积混合,并充分乳化,腹腔注射,剂量50μg/只。2周后,将x蛋白不加佐剂,腹腔注射,剂量50μg/只。第三次免疫后7天,取小鼠尾血,分离血清,用间接elisa法测定效价,效价高于1:10000即可用于融合。融合前4天,第四次免疫,将x蛋白不加佐剂,尾静脉注射,剂量50μg/只。
42.1.2.2杂交瘤细胞株制备
43.准备融合前12天提前复苏骨髓瘤细胞sp2/0(atcc,货号crl
‑
1581),用含10%胎牛血清的1640培养基培养。融合前24h把细胞浓度调至3
×
105/ml。次日收集骨髓瘤细胞,1200g离心5分钟,用无血清培养基洗涤3次,细胞计数。处死免疫小鼠,取出脾脏,制备成细胞悬液,细胞计数,取108脾细胞,和2
×
107骨髓瘤细胞混合,用50%peg1500融合,在hat培养基上选择培养杂交瘤。
44.1.2.3杂交瘤细胞株的筛选与克隆
45.融合后培养第10天,用elisa法检测各孔融合细胞上清中的抗体活性。各取200μl的融合细胞培养上清液,加入到96孔elisa板孔中,其中每孔包被有10μg/ml的不同x蛋白。反应在37℃进行1小时,然后用含有0.05
‰
的tween20的pbs洗涤5次,在各孔中加入1:5000稀释的hrp标记的抗小鼠igg。反应在37℃进行1小时,用上述洗涤液洗板5次,然后每孔加入含0.05
‰
过氧化氢尿素、4.76
‰
三水合乙酸钠、0.9
‰
冰醋酸的显色剂a及含0.32
‰
tmb、5mm柠檬酸、0.5mm edta
‑
2na、5%甲醇、2
‰
二甲基甲酰胺的显色剂b各50μl,37℃避光显色30分钟。每孔加50μl,用含2m硫酸的终止液终止反应,酶标仪检测每孔450nm波长。经过三次有限稀释克隆,最后获得12株稳定分泌抗x蛋白的细胞株,其中抗体活性最高的一株细胞,其分泌的抗体命名为3d4。
46.1.2.4x蛋白单抗腹水的制备与纯化
47.取8周龄balb/c小鼠,腹腔注射液体石蜡,0.5ml/只。1周后腹腔注射1
×
107个3d4杂交瘤细胞。接种细胞7天后采集腹水,3000g离心10分钟,取上清用0.01m ph7.4的pbs稀释3倍。样品经fplc系统上protein a免疫亲和层析柱,ph2.8甘氨酸洗脱。收集特异性蛋白峰流出液,立即用ph9.0的tris溶液矫正至ph7.0,过滤除菌后分装,与
‑
80℃保存。
48.1.3丙肝间接标记的胶体金试剂盒的制备
49.1.3.1胶体金制备
50.在三角烧瓶中加入100ml超纯水,磁力加热器上加热至沸腾,加入1ml1%氯金酸溶液,沸腾后立刻加入1ml1%柠檬酸三钠水溶液,继续沸腾10分钟,然后自然冷却即可。
51.1.3.2胶体金标记
52.a.取10ml上述胶体金放入烧杯中,搅拌中加入150μl的0.2m k2co3调节ph至7.0,继
续搅拌20秒;
53.b.加入一定量的3d4单抗,继续搅拌10分钟;
54.c.加入0.1ml10%bsa,继续搅拌5分钟;
55.d.5000g离心10分钟,吸出上清,收集沉淀至离心管,用胶体金稀释液(20mm pb,150mm nacl,1%bsa,0.1%triton x
‑
100,2%蔗糖,0.01%proclin300)定容至1ml;
56.e.最后在该1ml胶体金标记3d4单抗复合物中加入一定量的标记抗原x
‑
ns3,间接标记金标复合物命名为x
‑
ns3
‑
3d4
‑
au。
57.1.3.3金标垫制备
58.将上述金标复合物用胶体金稀释液10倍稀释后浸泡玻璃纤维膜,冻干,即制成金标垫。
59.1.3.4硝酸纤维素膜(nc膜)包被
60.用检测线稀释液(10mm pbs,2%蔗糖)稀释包被抗原p2
‑
ns3至0.8mg/ml制成检测线工作液,用同一稀释液稀释羊抗鼠单抗至0.5mg/ml制成对照线工作液,用点膜仪将这两种工作液划到硝酸纤维素膜的相应位置上,37℃干燥1小时。
61.1.3.5组装
62.将上述金标垫、包被好的硝酸纤维素膜以及吸水纸、pvc底板、样品垫等辅料组装成hcv金标检测试剂盒。
63.1.3.6检测方法
64.加100μl待测样品(例如血清)到样品垫处,检测hcv抗体。
65.1.4丙肝间接标记的梯度添加“纳米颗粒
‑
配体”胶体金试剂盒的制备
66.1.4.1丙肝标记复合物的制备
67.a.取10ml实施例1.3.1中的胶体金放入烧杯中,搅拌中加入150μl的0.2m k2co3调节ph至7.0,继续搅拌20秒;
68.b.加入一定量的3d4单抗,继续搅拌10分钟;
69.c.加入0.1ml10%bsa,继续搅拌5分钟;
70.d.5000g离心10分钟,吸出上清,收集沉淀至离心管,用胶体金稀释液定容至1ml;
71.e.在该1ml胶体金标记3d4单抗复合物中加入一定量的标记抗原x
‑
ns3;
72.f.继续向复合物中添加标记了3d4单抗的胶体金,添加量按照定容体积(1ml)的5%、10%、15%、20%、25%、30%梯度进行,3d4单抗的标记浓度保持同步骤b一致,添加了“纳米颗粒
‑
配体”的金标复合物命名为 au
‑
3d4(5%)
…
以此类推。
73.1.4.2组装
74.参见实施例1.3.5。
75.1.5丙肝两种检测试剂盒检测效果的比较
76.以美国chiron公司的riba试剂作为确认对照,分别比较了间接标记添加“纳米颗粒
‑
配体”与否对hcv阳性血清和阴性血清的检测结果。
77.1.5.1灵敏度
78.用间接标记添加“纳米颗粒
‑
配体”与否的胶体金试剂盒,在同样的条件下对100份系列稀释比例的血清进行检测,得到了表1的结果:对于稀释倍数从低到高的可检出血清,添加au
‑
3d4后的灵敏度要明显高于原间接标记金标复合物。
79.表1、丙肝两种检测试剂盒的灵敏度比较
[0080][0081]
根据表1的结果,继续细化梯度,对同样的100份系列稀释比例的血清进行检测,得到表2的结果。
[0082]
表2、梯度细化
[0083][0084][0085]
根据表1、表2,选取最优梯度的组进行特异性放大实验。
[0086]
1.5.2特异性
[0087]
用间接标记添加“纳米颗粒
‑
配体”与否的胶体金试剂盒,在同样的条件下对3000份临床阴性血清进行检测:普通的间接标记试剂盒的特异性为99.7%,7.5%、10%、12.5%、15%梯度添加“纳米颗粒
‑
配体”的间接标记试剂盒的特异性分别为99.7%、99.7%、99.7%、99.6%,两种标记方式的特异性相当。
[0088]
1.5.3稳定性
[0089]
将本发明的成品试剂盒于37℃考核7天,取出后与同时4℃存放的试剂盒,以及不添加“纳米颗粒
‑
配体”的x
‑
ns3
‑
3d4
‑
au标记物于4℃存放的标记物制备成的试剂盒,在同一条件下检测相同的阴、阳性血清,以考察试剂盒的稳定性,结果如表3所示。
[0090]
表3、标记物和试剂盒的稳定性考核
[0091][0092]
注: 为弱阳, 为中阳, 为强阳,
‑
为阴性。
[0093]
此实验表明,本发明的标记物和试剂盒的稳定性较好。
[0094]
1.5.4精密性
[0095]
以添加10%梯度“纳米颗粒
‑
配体”的试剂盒检测同一份已知hcv阳性标本,做10次重复实验,得到的各试纸条的结果均为阳性,且显色程度也无显著差异,说明本试剂盒的精密性较好。
[0096]
实施例二、梅毒螺旋体(tp)的间接标记纳米颗粒的抗体检测
[0097]
2.1梅毒重组抗原的制备
[0098]
2.1.1梅毒包被抗原的制备
[0099]
pcr扩增梅毒螺旋体17kda(tp17)基因22
‑
156aa所对应的dna片段,其上游引物带有bamhi位点,下游引物带有ecori位点且ecori位点之前带有6个his氨基酸的编码序列以及终止密码taa。pcr的片段经回收之后,用bamhi和ecori酶切,连接到用bamhi和ecori酶切之后的表达载体p2中,得到重组质粒p2
‑
tp17,即本发明的包被抗原的重组质粒。质粒p2
‑
tp17转化er2566菌,用含100μg/ml硫酸卡那霉素的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液(50mm tris
‑
hcl,ph8.0,1mm edta,100mm nacl)重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,大部分目的蛋白分布在裂解液上清中。收集上清,逐滴缓慢加入饱和硫酸铵溶液至硫酸铵终浓度为30%,4℃静置30分钟,4℃12000g离心20分钟,收集上清,继续逐滴缓慢加入饱和硫酸铵至硫酸铵终浓度为60%,4℃静置30分钟,4℃12000g离心20分钟,收集沉淀,用5ml平衡缓冲液(10mm na2hpo4,1.8mm kh2po4,140mm nacl,2.7mm kcl,25mm咪唑,ph8.0)溶解。用10倍柱床体积的平衡缓冲液平衡ni
‑
nta亲和柱(qiagen公司,货号30210)之后,加入蛋白样,用10倍介质体积的平衡缓冲液洗去未结合的蛋白,再用5倍体积洗脱缓冲液(20mm na2hpo4,300mm nacl,250mm咪唑,ph8.0),洗脱目的蛋白,测定蛋白浓度,
‑
20℃保存备用,蛋白命名为p2
‑
tp17。
[0100]
2.1.2梅毒标记抗原的制备
[0101]
用2.1.1中的tp17片段,连接到用bamhi和ecori双酶切处理之后的载体pgex
‑
6p
‑
1(phamacia公司,货号27
‑
4597
‑
01)中得到重组质粒pgex
‑
6p
‑1‑
tp17,即本发明的标记抗原的重组质粒。上述阳性克隆,接种于含100μg/ml氨苄西林钠的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液(50mm tris
‑
hcl,ph8.0,1mm edta,100mm nacl)重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,大部分目的蛋白分布在裂解液上清中。收集上清,逐滴缓慢加入饱和硫酸铵溶液至硫酸铵终浓度为25%,4℃静置30
分钟,4℃12000g离心20分钟,收集上清,继续逐滴缓慢加入饱和硫酸铵至硫酸铵终浓度为45%,4℃静置30分钟,4℃12000g离心20分钟,收集沉淀,用10ml平衡缓冲液溶解。用10倍柱床体积的平衡缓冲液平衡gstrap亲和柱(amersham公司,货号17
‑
5130
‑
02)之后,加入蛋白样,用10倍介质体积的平衡缓冲液洗去未结合的蛋白,再用5倍体积洗脱缓冲液(50mm tris
‑
hcl,10mm还原型谷胱甘肽,ph8.0),洗脱目的蛋白,测定蛋白浓度,
‑
20℃保存备用,蛋白命名为gst
‑
tp17。
[0102]
2.1.3免疫原和杂交瘤细胞筛选抗原(gst蛋白)的制备
[0103]
以pgex
‑
2t(phamacia公司,货号27
‑
4801
‑
01)、pgex
‑
6p
‑
1、pgex
‑
5x
‑
1(phamacia公司,货号27
‑
4584
‑
01)、pet
‑
41a(novagen公司,货号70556
‑
3)质粒转化大肠杆菌er2566,根据质粒所带的抗生素基因,分布选择涂布于含100μg/ml硫酸卡那霉素或100μg/ml氨苄西林钠的lb平板上,37℃过夜培养,挑取单克隆,用含同一浓度的硫酸卡那霉素或者氨苄西林钠的500ml lb培养基37℃振荡培养至od
600
=1.0左右,用终浓度为0.5mm的iptg,37℃诱导4小时。4℃5000g离心20分钟收集菌体,每升菌液的菌体用20ml裂解缓冲液重悬,超声破碎,4℃12000g离心20分钟,经sds
‑
page电泳鉴定后,大部分目的蛋白分布在裂解液上清。缓慢加入饱和硫酸铵同时快速搅拌均匀,使硫酸铵终浓度为30%,4℃静置30分钟,4℃12000g离心20分钟,收集上清,缓慢加入饱和硫酸铵同时快速搅拌均匀,使硫酸铵累计浓度为60%,4℃静置30分钟,4℃12000g离心20分钟,收集沉淀,用10ml平衡缓冲液溶解。用10倍柱床体积的平衡缓冲液平衡gstrap亲和柱之后,加入蛋白样,用10倍介质体积的平衡缓冲液洗去未结合的蛋白,再用5倍体积洗脱缓冲液洗脱目的蛋白,测定蛋白浓度,
‑
20℃保存备用。
[0104]
2.2抗gst杂交瘤细胞株的建立及其单克隆抗体的制备
[0105]
2.2.1重组gst蛋白免疫小鼠
[0106]
参见实施例1.2.1,用重组gst蛋白免疫小鼠。
[0107]
2.2.2杂交瘤细胞株制备
[0108]
参见实施例1.2.2,进行细胞融合。
[0109]
2.2.3杂交瘤细胞株的筛选与克隆
[0110]
融合后培养第10天,用elisa法检测各孔融合细胞上清中的抗体活性。各取200μl的融合细胞培养上清液,加入到96孔elisa板孔中,其中每孔包被有10μg/ml的不同gst蛋白。后续步骤参见1.2.3,其中抗体活性最高的一株细胞,其分泌的抗体命名为6f8。
[0111]
2.2.4gst蛋白单抗的制备与纯化
[0112]
参见实施例1.2.4,得到纯化之后的6f8单抗。
[0113]
2.3梅毒间接标记的胶体金试剂盒的制备
[0114]
2.3.1胶体金制备
[0115]
参见实施例1.3.1制备胶体金。
[0116]
2.3.2胶体金标记
[0117]
a.取10ml上述胶体金放入烧杯中,搅拌中加入150μl的0.2m k2co3调节ph至7.0,继续搅拌20秒;
[0118]
b.加入一定量的6f8单抗,继续搅拌10分钟;
[0119]
c.加入0.1ml10%bsa,继续搅拌5分钟;
[0120]
d.5000g离心10分钟,吸出上清,收集沉淀至离心管,用胶体金稀释液定容至1ml;
[0121]
e.最后在该1ml胶体金标记6f8单抗复合物中加入一定量的标记抗原gst
‑
tp17,间接标记金标复合物命名为gst
‑
tp17
‑
6f8
‑
au。
[0122]
2.3.3金标垫制备
[0123]
参见实施例1.3.3制备金标垫。
[0124]
2.3.4硝酸纤维素膜(nc膜)包被
[0125]
用检测线稀释液稀释包被抗原p2
‑
tp17至0.8mg/ml制成检测线工作液,用同一稀释液稀释羊抗鼠单抗至0.5mg/ml制成对照线工作液,用点膜仪将这两种工作液划到硝酸纤维素膜的相应位置上,37℃干燥1小时。
[0126]
2.3.5组装
[0127]
参见1.3.5组装成tp金标检测试剂盒。
[0128]
2.3.6检测方法
[0129]
参见实施例1.3.6检测tp抗体。
[0130]
2.4梅毒间接标记的梯度添加“纳米颗粒
‑
配体”胶体金试剂盒的制备
[0131]
2.4.1梅毒标记复合物的制备
[0132]
a.取10ml实施例1.3.1中的胶体金放入烧杯中,搅拌中加入150μl的0.2m k2co3调节ph至7.0,继续搅拌20秒;
[0133]
b.加入一定量的6f8单抗,继续搅拌10分钟;
[0134]
c.加入0.1ml10%bsa,继续搅拌5分钟;
[0135]
d.5000g离心10分钟,吸出上清,收集沉淀至离心管,用胶体金稀释液定容至1ml;
[0136]
e.在该1ml胶体金标记6f8单抗复合物中加入一定量的标记抗原gst
‑
tp17;
[0137]
f.继续向复合物中添加标记了6f8单抗的胶体金,添加量按照定容体积(1ml)的5%、10%、15%、20%、25%、30%梯度进行,6f8单抗的标记浓度保持同步骤b一致,添加了“纳米颗粒
‑
配体”的金标复合物命名为 au
‑
6f8(5%)
…
以此类推。
[0138]
2.5梅毒两种检测试剂盒检测效果的比较
[0139]
以日本富士公司的tppa试剂盒作为确认对照,分别比较了间接标记添加“纳米颗粒
‑
配体”与否对tp阳性血清和阴性血清的检测结果。
[0140]
2.5.1灵敏度
[0141]
用间接标记添加“纳米颗粒
‑
配体”与否的胶体金试剂盒,在同样的条件下对100份系列稀释比例的血清进行检测,得到了表4的结果:对于稀释倍数从低到高的可检出血清,添加au
‑
6f8后的灵敏度要明显高于原间接标记金标复合物。
[0142]
表4、梅毒两种检测试剂盒的灵敏度比较
[0143][0144][0145]
选取最优梯度(10%)的组进行特异性放大实验。
[0146]
2.5.2特异性
[0147]
用间接标记添加“纳米颗粒
‑
配体”与否的胶体金试剂盒,在同样的条件下对3000份临床阴性血清进行检测:普通的间接标记试剂盒的特异性为99.8%,10%梯度添加“纳米颗粒
‑
配体”的间接标记试剂盒的特异性为99.8%,两种标记方式的特异性相当。
[0148]
2.5.3稳定性
[0149]
将本发明的成品试剂盒【标记物: au
‑
6f8(10%)】于37℃考核7天,取出后与同时4℃存放的试剂盒,以及不添加“纳米颗粒
‑
配体”的gst
‑
tp17
‑
6f8
‑
au标记物于4℃存放的标记物制备成的试剂盒,在同一条件下检测相同的阴、阳性血清,以考察试剂盒的稳定性,实验结果表明,本发明的标记物和试剂盒的稳定性较好。
[0150]
2.5.4精密性
[0151]
以添加10%梯度“纳米颗粒
‑
配体”的试剂盒检测同一份已知tp阳性标本,做10次重复实验,得到的各试纸条的结果均为阳性,且显色程度也无显著差异,说明本试剂盒的精密性较好。
[0152]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。