一种双靶向、ph刺激响应的纳米粒子的制备及其在肿瘤诊疗中的应用
技术领域
1.本发明涉及生物医药技术领域,尤其涉及一种双靶向纳米粒子及其制备方法和应用、含有该纳米粒子的纳米复合材料。
背景技术:
2.胰腺癌的发病率和恶性程度极高,已成为世界第七大癌症致死原因(腹部外科,2020,第33卷第6期)。目前手术切除是胰腺癌病人获得治愈机会最有效方法,然而大多数胰腺癌病人因确诊不及时而失去手术治疗的机会。随着肿瘤学研究进行,人们对胰腺癌的诊断和治疗的研究进展迅速,开发具有肿瘤靶向性、降低对正常组织的毒性,克服肿瘤细胞多耐药性的新型高效的癌症诊疗手段得到了广泛的开发和深入的研究。
3.瘤微环境(tme)由于具有血管形态异常、生物代谢中间产物失调、缺氧、微酸性和h2o2含量高等特点(chemical society reviews 2017,46,3830),为癌细胞的生长和驻留提供了内部环境,对肿瘤的恶性生长、侵袭性转移和高耐药性起重要作用,所以,探索新的针对tme的抗癌策略应引起高度重视 (theranostics 2018,8,1059)。tme的独特特性也为肿瘤治疗提供新的治疗靶点。为了实现精准的肿瘤治疗,使用具有tme刺激响应治疗能力的智能纳米材料被认为是最理想的方法之一。近年来,对tme触发的微创诊疗平台的设计受到广泛关注,并得以快速发展。其中,光热疗法(ptt)、光动力疗法 (pdt)等作为新兴的治疗手段,因其具有可忽略的侵袭性、低毒性和高选择性等优点而成为潜在的抗癌策略(acs nano 2017,11,579)。ptt可以利用近红外光诱导光热转换剂将光能转化为热能被直接用于肿瘤消融,而pdt通常需要在o2存在条件下,用特定波长的光照射来激活光敏剂,产生具有细胞毒性的活性氧(ros),以诱导细胞凋亡和坏死。pdt作为一种新型的肿瘤治疗方式,因其侵袭性低、治愈率高、对机体损伤小而受到广泛关注。然而,由于tme的复杂性以及每种治疗方法的固有缺陷,单一疗法很难完全抑制肿瘤生长(nanoscale 2018,10,4452)。因此,联合几种治疗方法的协同疗法常被用来克服单一疗法抑瘤效果的不足。然而,开发将两种或两种以上不同的抗癌方法集成到一个治疗纳米平台的治疗策略具有一定的挑战性。
4.一般而言,pdt包括三个基本条件:光源、光敏剂(ps)和组织中的高氧环境。然而,ps通常需要紫外光或可见光激活,但这两种波长光源的穿透能力有限,紫外光对生物体的潜在光损伤,这些问题极大地限制了ps在肿瘤治疗中的实际应用。其次,由于多种实体瘤的缺氧微环境,在pdt期间,ps 介导的o2消耗进一步恶化了这种缺氧情况,进而削弱了依赖o2的pdt效果 (nature 2012,491,364
‑
373)。此外,pdt产生的ros的寿命短,并且只能迁移很短的距离(<20nm),因此,pdt的作用范围仅在ps附近。基于传统pdt的缺点,许多新的策略被开发出来。首先,为解决激光穿透能力的问题,近红外(nir)光(780
‑
1400nm)比可见光和紫外光具有更深的组织穿透能力和更低的组织吸收,如果能将近红外光在体内转换成紫外可见光则可解决光的穿透弱和光损伤的问题。巧合的是,基于稀土离子的上转换纳米粒子(ucnps)可以很好的将近红外光转化为紫外或可见光,ucnps激发波长具有较高的组织穿透
深度、较低的自发荧光和良好的光稳定性,同时也能避免紫外线对皮肤的直接损害(nature communications 2018,9,2415)。负载光敏剂后,即可实现近红外光刺激的深部组织pdt治疗。
5.2016年,he等设计了yb
3
增强合成了核心的ucnps(naybf4:2%er
3
),并包覆了介孔二氧化硅的上转换/介孔二氧化硅纳米复合材料(ucnp@sio2),用于连续的细胞成像、光热药物传递和癌症治疗,验证了其高效光热性能及其在同步生物医学成像和光热触发的癌症化疗药物传递方面的巨大潜力 (opticalmaterials express,2016,6,1161)。此外,2020年you等通过原位生长策略成功开发了一种基于bi2se3共轭上转换纳米粒子(ucnps)的新型杂化纳米材料,在808nm近红外激光照射下,ucnps
‑
bi2se3能发出明亮的可见光,展示了其在高效的细胞上转换发光(ucl)、ct成像和癌细胞消融等方面的能力,实现了在双模态成像指导下设计的治疗策略,具有实时动态监测、远程可控性和无创性等特点(chemistry
‑
aeuropean journal 2020,26,1127)。
6.2017年,yan等利用超分子配位组装,合成了装载脂溶性光敏剂ce6的纳米复合材料。由于单宁酸(ta)和fe
3
的配位聚合,疏水ce6纳米粒子在界面组装的络合物中具有良好的稳定性。与自由的ce6分子相比,ce6@ta
‑
fe(iii)nps血液循环时间更长,肿瘤选择性积累更多,抗肿瘤效果更好(scientific reports 2017,7,42978)。同年,wu以超快、绿色、简单、通用的方法包裹并合成了含有银纳米粒子(agnps)的ta/fe
3
银纳米膜。通过体外和体内实验,考察了ta/fe
3
/agnps的物理抗菌活性和光动力抗菌治疗 (pat)的效果,证明了其具有较强的抗菌活性和良好的生物相容性(acsappliedmaterials&interfaces,2017,9,39657)。以上研究仅利用了ucnp的生物医学成像功能,ta/fe
3
的载药以及延长血液循环的能力,促进pss的肿瘤选择性积累等,并没有将成像及光热治疗/光动力治疗结合在一起,尤其材料并没有肿瘤特异的靶向作用,并且在光动力治疗中没有考虑到解决肿瘤缺氧的问题等等。
7.值得注意的是,作为缓解tme中缺氧的主要策略之一,过氧化氢酶可以通过催化tme中高浓度的h2o2(100μm
‑
1mm)原位生成o2(acs nano 2017, 11,7006)。然而,由于天然酶对复杂生物环境的敏感性,它们很容易失去活性并降解。而且,它们的制备成本相当高。因此,设计和开发一种功能类似于天然酶的高稳定性催化剂
‑
纳米酶,作为产氧剂来提高实体瘤中的氧浓度是非常重要的。
8.此外,目前纳米材料制备方法还存在以下问题:制备过程复杂,耗时较长,并且大多数材料纳米尺寸较大或者毒性原因,不能用于生物体内治疗,尤其单独的上转换纳米粒子没有光动力及光热治疗能力;有的材料只具备单一的治疗功能,治疗效果差;一些材料没有主动靶向效果,或者仅仅具有一种靶向能力,不能特异识别癌细胞和细胞器;有些材料仅仅有治疗效果,没有成像诊断能力,很难将诊断与治疗结合,用于精准的成像指导的治疗;多数材料不具备刺激响应的能力,不能做到可操控的治疗和降低对正常组织的毒性和损伤。
技术实现要素:
9.有鉴于此,本发明目的在于提供一种双靶向、ph刺激响应的纳米粒子的制备及其在肿瘤诊疗中的应用。该光热纳米复合材料不仅具有良好的光热稳定性,而且具有较高的
光热性能,光热转换效率高达77.86%。在ucttd上负载光敏剂pc4后,获得的纳米复合材料具有αvβ3整合素受体和线粒体双靶向能力,通过808nm的激光照射即可实现ptt与pdt协同治疗乏氧胰腺癌。
10.为了实现上述发明目的,本发明提供以下技术方案:
11.一种双靶向纳米粒子,其特征在于,包括:
12.上转换粒子内核;和
13.由内到外依次包覆在所述内核表面的单宁酸/fe
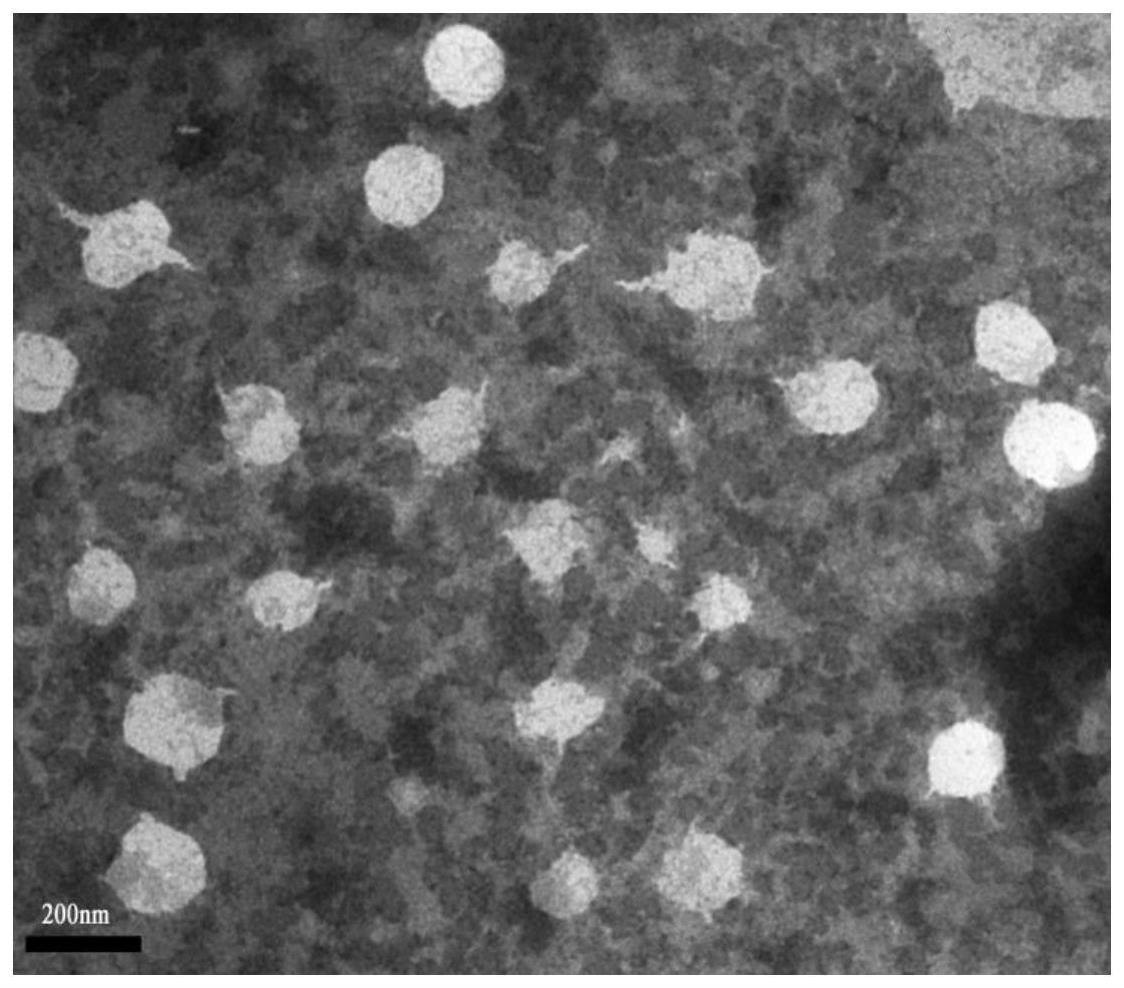
3
络合物、tpp和crgd。
14.本发明双靶向纳米粒子以上转换纳米材料为内核,在室温下超快速的包覆单宁酸和铁离子的络合物。由于铁离子的加入,使其具有过氧化氢酶的活性,消耗肿瘤组织中的过氧化氢,产生氧气,改善肿瘤缺氧的环境,提升需氧的pdt的效率,兼具光热治疗能力和改善肿瘤乏氧环境的能力。
15.包覆单宁酸和铁离子的络合物之后,修饰tpp及crgd,获得后纳米粒子ucttd。修饰tpp及crgd的纳米粒子可以特异性识别表面高表达αvβ3整合素受体的癌细胞,并在线粒体内集中分布。本发明中,crgd肽的序列为 cyclo(arg
‑
gly
‑
asp
‑
d
‑
phe
‑
cys)。crgd肽的连接使纳米材料高度亲和表达αvβ3整合素受体的癌细胞,也由于线粒体靶向分子tpp的连接,使其更易进入到 ros敏感的细胞器—线粒体,从而提高线粒体内活性氧(ros)的浓度,加速线粒体功能障碍,诱导癌细胞凋亡。双靶向具有更强的靶向选择性,提升材料进入肿瘤组织的效率同时,由于双靶向纳米粒子中含有fe
3
,可以催化 h2o2反应,产生氧气,为pdt提供充足的o2,提升pdt的效率,可以获得更有效的癌细胞杀伤效果。
16.其中,所述双靶向纳米粒子的水合动力学直径为150
‑
200nm,具体可为 150nm、174nm或200nm。
17.本发明还提供了所述双靶向纳米粒子的制备方法,包括如下步骤:
18.步骤1:将ucnp纳米粒子与单宁酸溶液混合、超声后,加入fecl3溶液反应,离心、清洗,获得包覆有单宁酸/fe
3
络合物的纳米粒子ucnp@ta/fe;
19.步骤2:向ucnp@ta/fe溶液中加入peg溶液,旋转震荡6
‑
24h,用水洗涤,得peg化的ucnp@ta/fe;
20.步骤3:将tpp和peg化的ucnp@ta/fe混合,反应,获得纳米粒子 ucnp@ta/fe
‑
tpp;
21.步骤4:将所述ucnp@ta/fe
‑
tpp与crgd溶液混合,反应,获得光热纳米材料ucnp@ta/fe
‑
tpp
‑
crgd(ucttd)。
22.一些实施方案中,步骤1中,所述单宁酸溶液的浓度为1.6
‑
6.4mg/ml,具体可为1.6mg/ml、3.2mg/ml或6.4mg/ml;所述ucnp纳米粒子和单宁酸溶液的质量体积比以mg/ml计为(2.5
‑
10):(0.5
‑
2),具体可为5:1。
23.一些实施方案中,步骤2中,所述peg溶液的浓度为0.5
‑
2mg/ml,具体可为1mg/ml,其中,所述peg由dspe
‑
peg
2000
、nh2‑
peg
2000
‑
nh2和 dspe
‑
peg
2000
‑
maleimide组成;所述dspe
‑
peg
2000
、nh2‑
peg
2000
‑
nh2和 dspe
‑
peg
2000
‑
maleimide的质量比为90:5:5。
24.一些实施方案中,步骤3中,所述反应在旋转震荡条件下进行;所述tpp 为经活化剂活化的tpp,所述活化剂为edc和/或nhs。
25.一些实施方案中,步骤4中,所述反应的条件为2
‑
10℃下旋转震荡6
‑
24 h。一些具体实施例中,所述反应条件为4℃下旋转震荡12h。
26.一些具体实施例中,所述双靶向纳米粒子的制备方法,包括如下步骤:
27.(1)制备单宁酸(ta)和fe
3
的络合物包覆的上转换纳米粒子 (ucnp@ta/fe)
28.将2.5
‑
10mg ucnp纳米粒子加入到0.5
‑
2ml的ta溶液(1.6
‑
6.4mg/ml) 中,超声10min后,加入0.25
‑
1ml的fecl3溶液(0.8
‑
3.2mg/ml),大力震荡或者快速搅拌20
‑
120s,离心后,50
‑
75%乙醇清洗两次,去离子水洗一次即得ucnp@ta/fe。
29.(2)ucnp@ta/fe
‑
tpp的制备
30.首先将ucnp@ta/fe加入0.5
‑
2mg/ml的dspe
‑
peg
2000
溶液中(其中 nh2‑
peg
2000
‑
nh2及dspe
‑
peg
2000
‑
maleimide占总dspe
‑
peg
2000
量的5
‑
20%),旋转震荡6
‑
24h,去离子水洗2次后备用。期间,活化4
‑
羧丁基三苯基溴化膦(tpp)。称取tpp(0.2
‑
0.5mmol)、edc(0.5
‑
1mmol)和nhs(1
‑
2mmol) 加到50
‑
200μl无水dmso中活化0.5
‑
6h,将其加到1ml peg化的 ucnp@ta/fe中,旋转震荡6
‑
24h。去离子水洗三次后得到ucnp@ta/fe
‑
tpp, 4℃保存备用。
31.(3)ucnp@ta/fe
‑
tpp
‑
crgd的制备
32.将ucnp@ta/fe
‑
tpp加入到与dspe
‑
peg
2000
‑
maleimide相同摩尔数量的 crgd溶液中,2
‑
10℃下旋转震荡6
‑
24h,去离子水洗3次,得到 ucnp@ta/fe
‑
tpp
‑
crgd(ucttd),4℃保存备用。
33.本发明还提供一种纳米复合材料,包括本发明所述的双靶向纳米粒子或本发明所述制备方法制得的双靶向纳米粒子,以及负载在所述双靶向纳米粒子上的光敏剂。
34.一些实施方案中,本发明纳米复合材料的制备方法,包括:
35.在避光条件下,将本发明双靶向纳米粒子(ucttd)加入到25~200 μg/ml的光敏剂溶液中,避光旋转震荡反应6~36h,获得负载有光敏剂的纳米复合材料。
36.一些实施方案中,所述光敏剂为pc4。
37.一些具体实施例中,所述光敏剂为pc4,负载有pc4的纳米复合材料的制备方法为:在避光条件下,将本发明双靶向纳米粒子(ucttd)加入到 25~200μg/ml的pc4溶液中,避光旋转震荡反应6~36h,获得负载有光敏剂的纳米复合材料。
38.在一个具体实施例中,本发明考察了ucttd光热纳米粒子在不同浓度 pc4溶液中的负载效率,发现ucttd对pc4负载量为80μg/mg。
39.本发明还提供了所述双靶向纳米粒子或所述的纳米复合材料在制备抗肿瘤药物中的应用。
40.一些实施方案中,所述肿瘤包括胰腺癌、肝癌、肺癌、胃癌、肠癌、乳腺癌和宫颈癌。
41.一些具体实施例中,具体为胰腺癌,更具体可为乏氧胰腺癌。
42.本发明提供的双靶向纳米粒子,包括:上转换粒子内核;和由内到外依次包覆在所述内核表面的单宁酸/fe
3
络合物、tpp和rgd。本发明将单宁酸/fe
3
的络合物包覆在ucnp上,并修饰tpp及crgd,构建的光热纳米粒子ucttd 具有癌细胞和细胞器双靶向能力,同时具有良好的光热稳定性和光热性能,光热转换效率高达77.86%。
43.在材料上负载光敏剂pc4后,仅通过808nm一种波长的激光即可实现 ptt与pdt的协同治疗。并且由于铁的掺杂使材料具有类过氧化氢酶的性质,对癌细胞中的h2o2表现出优异的催化性能,从而克服肿瘤缺氧,提高pdt 的疗效。同时,单宁酸/fe
3
的络合物对ph变化敏感,具有ph刺激响应的能力,可以通过ph刺激响应性能,在微酸的肿瘤微环境中释放更多的光敏剂 (pc4),实现可操控的pdt治疗。ucttd
‑
pc4纳米复合物具有纳米材料的稳定性,有
利于克服天然酶的不稳定性和易失活性。此外,由于rgd肽的连接,使纳米材料高度亲和表达αvβ3整合素受体的癌细胞,也由于线粒体靶向的连接,使其更易进入到ros敏感的细胞器线粒体中,提高线粒体内ros 的浓度,从而加速线粒体功能障碍和细胞凋亡。本发明提供的双靶向纳米粒子ucttd具有更高的靶向选择性,可以获得更好的治疗效果。此外,ucttd 可以作为多模态成像诊断试剂,可进行光声(pa)、核磁共振(mr)、光热 (pt)和上转换荧光(ucl)成像。总之,该材料具有制作简单、成本低、生物相容性好、稳定性好、功能多样等特点。
附图说明
44.图1为ucnp@ta/fe纳米材料反应前后的照片,(a)ta溶液中的ucnp, (b)ucnp@ta/fe溶液的照片;
45.图2纳米材料的表征;(a)ucttd的透射电镜图像。(b)ucnp@ta/fe 及ucttd的傅里叶变换红外光谱;(c)ucnp,ucnp@ta/fe,ucttd及 ucttd
‑
pc4的荧光发射光谱。ucnp,ucnp@ta/fe,ucnp@ta/fe
‑
tpp,ucttd及ucttd
‑
pc4的水合粒径分布(d)及zeta电势(e);(f)ucnp, pc4,ucnp@ta/fe,ucttd及ucttd
‑
pc4的紫外吸收光谱图;
46.图3ucttd的光热性能和光热稳定性的测定;(a)808nm激光器以0.5 w/cm2的激光功率照射ucttd,经过6次升温降温的光热稳定性测定,每个周期激光辐照10min降温20min;(b)光热转换效率的测定,0.5w/cm2的激光功率分别辐照水和ucttd溶液10min后,自然冷却至室温下的温度变化曲线,及其在降温过程时间与
‑
ln(θ)的线性曲线;
47.图4ucttd对光敏剂pc4负载与ph响应释放研究;(a)ucttd在不同时间点对pc4(25,50,100,150,200μg/ml)的负载比率;(b)ucttd
‑
pc4 在不同ph下pc4的释放效率;
48.图5细胞靶向递送研究;(a)流式细胞分析仪定量分析ucttd
‑
pc4和 ucnp@ta/fe
‑
tpp
‑
pc4递送效率的流式图像;(b)有无crgd靶向分子连接材料的递送效率统计图;
49.图6体外产生氧气研究;ucttd在h2o2溶液(1mm)中o2的生成情况,同浓度的h2o2溶液为对照;
50.图7体外产生ros研究;(a)ucttd
‑
pc4 h2o2 dpbf溶液和(b) dpbf溶液在808nm激光(0.3w/cm2)照射不同时间下的紫外吸收光谱;
51.图8.细胞活性及毒性;(a)capan
‑
1细胞与0,150,300,600,900, 1200,1500和2000μg/ml的ucttd共孵育24h和48h后的细胞活性。(b) 经过pbs,pbs l,pc4,pc4 l
470
,ucttd,ucttd l,ucttd
‑
pc4, ucttd
‑
pc4 l不同组别处理capan
‑
1细胞24h和48h后,细胞的相对存活率。数据平均值
±
sd;
52.图9体外不同浓度ucttd的光声成像强度值及光声成像图片;
53.图10.体外不同浓度ucttd的t1(a)和t2(b)加权核磁共振成像强度值及核磁共振成像图片;
54.图11示活体的治疗效果研究(n=5);(a)荷载capan
‑
1肿瘤的雌性 balb/c裸鼠在治疗第14天的代表性照片及不同组别肿瘤的照片(空的蓝色虚线圈表示肿瘤被完全消融);(b)各个组别在治疗期间肿瘤体积的变化情况;l
470
表示470nm激光器(激光密度:0.1w/cm2),l代表808nm激光器(激光密度:1.2w/cm2),辐照时间10min。
具体实施方式
55.本发明提供了一种双靶向、ph刺激响应的纳米粒子的制备及其在肿瘤诊疗中的应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
56.光热治疗(photothermal therapy,ptt):光热治疗法是利用具有较高光热转换效率的材料,将其注射入人体内部,利用靶向性识别技术聚集在肿瘤组织附近,并在外部光源(一般是近红外光)的照射下将光能转化为热能来杀死癌细胞的一种治疗方法。
57.光动力治疗(photodynamic therapy,pdt):是用光敏药物和激光活化治疗肿瘤疾病的一种新方法。用特定波长照射肿瘤部位,能使选择性聚集在肿瘤组织的光敏药物活化,光敏药物会将能量传递给周围的氧,引发光化学反应,生成活性很强的单态氧,单态氧能与附近的生物大分子发生氧化反应,产生细胞毒性进而杀伤肿瘤细胞。
58.ph响应纳米材料:是指随着ph的变化,能够在分子内或分子间产生化学或物理变化的一类功能纳米材料。
59.过氧化氢酶(catalase,cat):是催化过氧化氢分解成氧和水的酶。
60.纳米酶:是一类既有纳米材料的独特性能,又有催化功能的模拟酶。纳米酶具有催化效率高、稳定、经济和规模化制备的特点,它在医学、化工、食品、农业和环境等领域得到广泛应用。
61.本发明采用的试剂和材料皆为普通市售品,皆可于市场购得。
62.下面结合实施例,进一步阐述本发明:
63.实施例1复合材料的制备
64.(1)制备单宁酸(ta)和fe
3
的络合物包覆的上转换纳米粒子 (ucnp@ta/fe)
65.将5mg ucnp纳米粒子加入到1ml的ta溶液(3.2mg/ml)中,超声10min后,加入0.5ml的fecl3溶液(1.6mg/ml),大力震荡或者快速搅拌 20
‑
120s,离心后,50
‑
75%乙醇清洗两次,去离子水洗一次即得ucnp@ta/fe。
66.(2)ucnp@ta/fe
‑
tpp的制备
67.首先将ucnp@ta/fe加入1mg/ml的dspe
‑
peg
2000
溶液中(其中 nh2‑
peg
2000
‑
nh2及dspe
‑
peg
2000
‑
maleimid占总dspe
‑
peg
2000
量的5%),旋转震荡12h,去离子水洗2次后备用。期间,活化4
‑
羧丁基三苯基溴化膦 (tpp)。称取tpp(0.2mmol)、edc(0.5mmol)和nhs(1mmol)加到100μl无水dmso中活化1h,将其加到1mlpeg化的ucnp@ta/fe中,旋转震荡12h。去离子水洗三次后得到ucnp@ta/fe
‑
tpp,4℃保存备用。
68.(3)ucnp@ta/fe
‑
tpp
‑
crgd的制备
69.将ucnp@ta/fe
‑
tpp加入到与dspe
‑
peg
2000
‑
maleimid相同摩尔数量的 crgd溶液中,4℃下旋转震荡12h,去离子水洗3次,得到ucnp@ta/fe
‑
tpp
‑
crgd(ucttd),4℃保存备用。
70.图1为单宁酸(ta)与fe
3
络合物包覆上转换材料前后溶液的颜色变化,图1a为ucnp分散在ta溶液中,此时为ta的淡黄色,当fe
3
加入时,ta 与fe
3
络合物瞬间形成,包覆在ucnp表面,溶液颜色瞬时变为黑色(图1b),此时ucnp@ta/fe材料具有良好的光热性能。
71.图2a为ucnp@ta/fe
‑
tpp
‑
rgd(ucttd)的透射电镜图片(tem),从图2可以看到,ucnp外表面成功包上了ta与fe
3
的络合物。图2b为 ucnp@ta/fe与ucnp@ta/fe
‑
tpp
‑
rgd(ucttd)的傅里叶变换红外光谱,与ucnp@ta/fe相比,ucttd含有苯环的特征吸收峰:苯环c
‑
h伸缩振动为3068cm
‑1;1479cm
‑1及1569cm
‑1为苯环的骨架振动。692cm
‑1和750cm
‑1同时出现说明苯环为单取代峰。这些官能团与tpp分子结构一致,此外,在 1678cm
‑1处出现酰胺键(
–
nh
–
c=o)的特征吸收峰,推测为马来酰亚胺基团与crgdfc[cyclo(arg
‑
gly
‑
asp
‑
d
‑
phe
‑
cys)]中的巯基通过迈克尔加成缩合反应后,开环水解生成稳定的酰胺键,说明crgd连接成功。如图2d所示,ucnp, ucttd及ucttd
‑
pc4的水合动力学直径分别为80nm、174nm和262nm。图2e为各种粒子的zeta电势变化情况。可以看到ucnp的电势为 36.7mv,在ta与fe
3
的络合物包覆后ucnp@ta/fe的电势变为
‑
13.4mv。在连接靶向分子后,电势变化不大,ucnp@ta/fe
‑
tpp(uctt)和ucttd电位分别为
‑
6.4mv和
‑
7.0mv,但是负载上带正电荷的pc4后,ucttd
‑
pc4的电位变为 2.7mv,此电位说明pc4被成功的负载到材料上。另一方面,少量的正电荷使ucttd
‑
pc4更容易进入细胞而且几乎没有电荷毒性。总之,以上表征结果证明带有双靶向的ucttd被成功合成。图2f为ucnp,pc4, ucnp@ta/fe,ucttd及ucttd
‑
pc4的紫外吸收光谱图,从图中可以看出 ucnp在近红外处与基线几乎重合,而ucnp@ta/fe在近红外处有明显吸收,尤其在连接靶向分子后,ucttd的近红外吸收得到进一步提高,这也意味着 ucttd有更好的光热性能。ucttd负载上pc4后,ucttd
‑
pc4在450
‑
500 nm处出现pc4的紫外吸收峰,也证明pc4的成功负载。此外,pc4的紫外最大吸收峰为470nm左右,图2c为ucnp,ucnp@ta/fe,ucttd和 ucttd
‑
pc4的荧光发射光谱,虽然在包裹后荧光强度有所下降,但仍然有较强的470nm处的发射光,刚好为光敏剂pc4提供光源。
[0072]
为了测量ucttd的光热能力与光稳定性,将1ml ucttd置于无色透明比色皿中,用近红外激光器(los2
‑
bld
‑
0808
‑
005w
‑
c/p,高科技光电有限公司,中国)照射600s(0.5w/cm2),然后降至室温,重复上述循环6个周期,检测材料的光热稳定性。用热电偶(tes k型温度计1319a,中国台湾)每 30s记录一次溶液的实时温度。此外,以水为阴性对照,近红外激光器照射期间,用flir c2热像相机(美国)每10s读取一次溶液温度,最后计算材料的光热转换效率(η)。
[0073]
如图3a,ucttd溶液经过808nm激光器(0.5w/cm2)照射10min,间歇20min,6次升温降温周期循环后,溶液仍能达到46.8℃,说明ucttd纳米材料不仅具有较高的光热性能,而且具有较好的光热稳定能力。如图3b, ucttd的光热转换效率高达77.86%
[0074]
综上结果可知,本发明提供的光热纳米材料ucttd不仅光热稳定性好,而且光热转换效率较高,是一种极具潜力的光热治疗试剂。
[0075]
实施例2纳米复合材料负载光敏剂pc4
[0076]
取1mg实施例1制备的光热纳米材料ucttd加入到1ml不同浓度(25、50、100、150、200μg/ml)的pc4溶液中,避光旋转震荡反应36h,获得载有光敏剂pc4的纳米复合材料ucttd
‑
pc4。
[0077]
实施例3光敏剂(pc4)的负载和释放
[0078]
按照实施例2的方法制备纳米复合材料,反应期间,分别于在6、12、24 和36h时,测量上清液中pc4的浓度(c
x
),计算pc4的装载率:
[0079]
装载率=(c0‑
c
x
)/c0×
100%
[0080]
其中,c0为初始pc4的浓度。对于pc4的释放,将ucttd
‑
pc4分别置于ph为5.0、6.5、7.4的pbs溶液中,旋转震荡48h,期间在1、3、6、12、 24、48h,测上清液中释放的pc4的浓度c
x
,释放率=c
x
/c0×
100%,其中 c0为材料负载的量。结果见图4。
[0081]
如图4a为1mg ucttd纳米材料在不同浓度pc4溶液中的负载效率,可以看到在装载36h后,通过计算,ucttd对pc4负载量为80μg/mg左右。由于单宁酸及铁的络合物对ph较为敏感,我们考察了不同ph(7.4、6.5、5.0) 的pbs中ucttd
‑
pc4的释放行为,可以看到,ucttd
‑
pc4在ph为7.4时,释放率仅为2.6%,在ph为5.0时,释放效率是中性条件下的1.8倍(图4b)。以上结果证明ucttd
‑
pc纳米颗粒具有良好的稳定性,可有效减少光敏剂到达病灶区域前的过早释放。而在进入到肿瘤病灶内时,肿瘤组织较低的ph可以刺激pc4的释放。
[0082]
大量研究发现,整合素αvβ3在血管生成中发挥着重要的作用,而且在肿瘤的血管和多种侵袭性肿瘤细胞中都有较高表达,而在正常的内皮细胞和组织中表达量很低甚至不表达。crgd肽与αvβ3受体具有高度的亲和能力,已经被许多研究作为靶向分子特异的识别癌细胞。将crgd肽通过迈克尔加成反应连接到纳米材料上,不仅能提高材料进入肿瘤细胞的量来提高抗肿瘤效果,而且能降低对正常细胞的副作用。在体外治疗前,我们首先对材料的实施例4复合材料靶向能力测定
[0083]
将capan
‑
1细胞以10000个/孔的密度接种于96孔板中,37℃孵育12h 后,分别用ucnp@ta/fe
‑
tpp
‑
pc4(
‑
crgd)和ucttd
‑
pc4( crgd)培养6h后,消化下来用流式细胞仪进行递送定量分析。
[0084]
如图5a和5b,利用流式细胞仪单独分析有无rgd靶向的ucttd
‑
pc4 和ucnp@ta/fe
‑
tpp
‑
pc4(uctt
‑
pc4)的递送情况。ucttd
‑
pc4和 uctt
‑
pc4的递送效率分别为73.8%和49.8%。这充分说明了rgd靶向分子对capan
‑
1细胞的亲和力,也证明ucttd纳米粒子靶向癌细胞的可靠性。
[0085]
使用ysi5000溶氧
‑
bod测定仪(美国)检测ucttd产生o2的能力。通常,将ucttd纳米粒子分散体(30ml)置于50ml的离心管中,加入 h2o2,使材料置于1mm h2o2浓度下。不断搅拌下,采用溶解氧计探头检测氧浓度的变化,不加ucttd纳米粒子的h2o2(1mm)溶液为阴性对照。
[0086]
如图6,h2o2溶液本身氧含量没有明显变化,但加入纳米材料的溶液中,随着时间变化含氧浓度增加,说明ucttd纳米粒子具有较好的类过氧化氢酶活性,即能够催化h2o2产生o2。我们推测其产生o2原因是由于材料中含有 fe
3
,在h2o2的存在下产生芬顿反应,反应机制如下:
[0087]
fe
3
h2o2→
fe
2
o2 2h
[0088]
对于体外产ros的检测,使用化学探针dpbf的化学氧化法,dpbf与1o2发生不可逆反应,使dpbf的吸光度降低。通过紫外可见光谱检测探针 dpbf在410nm处的吸收强度变化来确认1o2的产生。通常,在含有20μg/ml dpbf的ucttd
‑
pc4溶液中,加入适量h2o2使其终浓度为1mm,在避光情况下,用808nm激光器(0.3w/cm2)照射5min,期间每分钟测量一次紫外。不加ucttd
‑
pc4的dpbf(20μg/ml)用相同功率密度的激光照射作为对照组。
[0089]
根据产生氧气的结果,推测ucttd中的fe
3
催化中心与pc4的协同作用或许可以提高ros的生成量。为了验证ucttd
‑
pc4生成ros的能力,首先在体外通过dpbf对ucttd
‑
pc4生成1o2的能力进行了研究。如图7a所示,ucttd
‑
pc4在808nm(0.3w/cm2)激光照射5min期间,
dpbf在420 nm处的吸收峰不断下降。对照组在相同条件下,不加入ucttd
‑
pc4的dpbf 吸收强度几乎没有变化(图7b)。以上结果表明ucttd
‑
pc4在体外具有良好的ros生成能力。
[0090]
实施例5复合材料的体外治疗效果评价
[0091]
由于纳米材料应用在生物上的光热治疗(ptt)和光动力治疗(pdt), ucttd
‑
pc4在激光照射和黑暗条件下细胞的活性毒性是一个重要参数。
[0092]
细胞活性及毒性实验根据cck
‑
8试剂盒标准步骤检测。
[0093]
首先,将capan
‑
1细胞以10000个/孔的密度接种于96孔板中,37℃培养12h后,加入含有不同浓度ucttd的新鲜培养基(0、150、300、600、 900、1200、1500、2000μg/ml)。继续培养24h和48h后,进行细胞活性检测。将铺板12h后的细胞分为8组:pbs,pbs l,ucttd,ucttd l, pc4,pc4 l
470
,ucttd
‑
pc4和ucttd
‑
pc4 l。激光照射组在孵育6h后分别用470nm或者808nm激光照射。24h和48h后,用pbs清洗细胞,加入 100μl新鲜培养液(含10μl cck
‑
8试剂)继续培养30min左右。利用酶标仪(spark controltm tecan,usa)记录450nm处的吸光度。每组实验重复三次。
[0094]
如图8a,细胞与浓度低于1200μg/ml的ucttd纳米材料共孵育24h或者48h后,仍有较高的存活率,表明ucttd生物相容性及生物安全性良好。然而,在用光动力试剂,光热试剂或者光动力光热协同治疗试剂处理后,细胞显示出明显不同的存活率(图8b),相对于空白对照组,激光(pbs l),材料(ucttd,ucttd
‑
pc4),光敏剂(pc4)对细胞的存活率几乎没有影响,而用pc4 l
470
处理48h后,细胞活性仅降低至68.6%,ucttd l
808
处理后,细胞活性降低至26.8%,尤其在光热和光动力协同治疗48h后,细胞存活率显著降低至8.1%。这说明在含有fe
3
的催化下,并且加上tpp和rgd 靶向的作用后,大大增强细胞对光动力治疗的敏感性,最终使ptt协同pdt 治疗的效果显著。这些结果表明,ucttd
‑
pc4在黑暗条件下具有很高的生物相容性,安全无毒,但在特定的激光照射下是一种有效的低氧癌细胞ptt/pdt 光动力协同治疗剂,具有优异的治疗效果。
[0095]
实施例6复合材料用于肿瘤成像可行性评价
[0096]
为了更明确的指导材料诊断及治疗,本实施例研究了本发明纳米复合材料的成像及造影效果以及其在肿瘤中的富集情况。
[0097]
首先,进行了体外的光声成像以确认材料本身的光声成像能力,根据操作规程制作小鼠假体,将不同浓度的ucttd(0.125、0.25、0.5、1、2、4mg/ml) 注入到假体中,在多光谱光声层析成像系统(msot invision 128,ithermedical,德国)中进行光声成像。利用制造商提供的软件处理光声成像图片及光声信号强度。
[0098]
通过体外用假体模拟体内光声成像情况的实验结果可以看到(图9),随着假体中ucttd浓度加大,光声强度也随之增强,其线性(r2=0.9939)呈现浓度依赖性,插图为体外光声成像图片,说明可以产生光声信号并且信号强度与浓度呈良好的线性关系。
[0099]
核磁共振成像(magnetic resonance imaging,mri)是临床诊断中不可或缺的、也是最常用的诊断工具之一。该成像技术安全系数高、具有较高的软组织分辨率、可在无创伤情况下进行多方位、多参数成像,且其效果不受组织深度的影响。因此,在临床诊断中,mri能够安全、快速、准确地为患者提供高分辨率的三维结构图像,常用于各种疾病的检测。为了研究ucttd作为mri造影剂的潜力,首先通过3.0t临床mri扫描仪测量不同浓度ucttd (0、0.5、1、2、4mg/ml)的t1和t2加权的mri以及纵向和横向mr弛豫率。
[0100]
ucttd水溶液的mr图像显示出体外浓度依赖的成像效果(图10),且具有相对较高的纵向(r1)弛豫和横向(r2)弛豫,表明ucttd是一种有效的mri造影剂。
[0101]
实施例7复合材料体内抗肿瘤的评价
[0102]
本实施例对荷载capan
‑
1肿瘤的雌性裸鼠进行治疗,评价其体内抗肿瘤能力。
[0103]
如图为pbs组和ucttd
‑
pc4 l组小鼠治疗14天后小鼠及肿瘤(图11a) 的照片以及8个组别在治疗期间肿瘤体积的变化情况(图11b)。相比pbs 组,pc4 l
470
组肿瘤略有减小,ucttd l组有效抑制肿瘤生长,在 ucttd
‑
pc4 l组中,有的肿瘤几乎被完全杀灭而无任何再生,而pbs l, pc4,ucttd和ucttd
‑
pc4组小鼠的肿瘤仍然保持较高的生长速度,说明 pdt本身因为激光(470nm)穿透性差且没有靶向,体内循环时间短,治疗效果不理想,但是在光热协同治疗下,由于纳米材料既有靶向作用,而且fe
3
能够催化h2o2产生氧气,进一步提高光动力敏感性,所以在光热协同光动力治疗组中展现出优异的治疗效果。
[0104]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
技术领域
1.本发明涉及生物医药技术领域,尤其涉及一种双靶向纳米粒子及其制备方法和应用、含有该纳米粒子的纳米复合材料。
背景技术:
2.胰腺癌的发病率和恶性程度极高,已成为世界第七大癌症致死原因(腹部外科,2020,第33卷第6期)。目前手术切除是胰腺癌病人获得治愈机会最有效方法,然而大多数胰腺癌病人因确诊不及时而失去手术治疗的机会。随着肿瘤学研究进行,人们对胰腺癌的诊断和治疗的研究进展迅速,开发具有肿瘤靶向性、降低对正常组织的毒性,克服肿瘤细胞多耐药性的新型高效的癌症诊疗手段得到了广泛的开发和深入的研究。
3.瘤微环境(tme)由于具有血管形态异常、生物代谢中间产物失调、缺氧、微酸性和h2o2含量高等特点(chemical society reviews 2017,46,3830),为癌细胞的生长和驻留提供了内部环境,对肿瘤的恶性生长、侵袭性转移和高耐药性起重要作用,所以,探索新的针对tme的抗癌策略应引起高度重视 (theranostics 2018,8,1059)。tme的独特特性也为肿瘤治疗提供新的治疗靶点。为了实现精准的肿瘤治疗,使用具有tme刺激响应治疗能力的智能纳米材料被认为是最理想的方法之一。近年来,对tme触发的微创诊疗平台的设计受到广泛关注,并得以快速发展。其中,光热疗法(ptt)、光动力疗法 (pdt)等作为新兴的治疗手段,因其具有可忽略的侵袭性、低毒性和高选择性等优点而成为潜在的抗癌策略(acs nano 2017,11,579)。ptt可以利用近红外光诱导光热转换剂将光能转化为热能被直接用于肿瘤消融,而pdt通常需要在o2存在条件下,用特定波长的光照射来激活光敏剂,产生具有细胞毒性的活性氧(ros),以诱导细胞凋亡和坏死。pdt作为一种新型的肿瘤治疗方式,因其侵袭性低、治愈率高、对机体损伤小而受到广泛关注。然而,由于tme的复杂性以及每种治疗方法的固有缺陷,单一疗法很难完全抑制肿瘤生长(nanoscale 2018,10,4452)。因此,联合几种治疗方法的协同疗法常被用来克服单一疗法抑瘤效果的不足。然而,开发将两种或两种以上不同的抗癌方法集成到一个治疗纳米平台的治疗策略具有一定的挑战性。
4.一般而言,pdt包括三个基本条件:光源、光敏剂(ps)和组织中的高氧环境。然而,ps通常需要紫外光或可见光激活,但这两种波长光源的穿透能力有限,紫外光对生物体的潜在光损伤,这些问题极大地限制了ps在肿瘤治疗中的实际应用。其次,由于多种实体瘤的缺氧微环境,在pdt期间,ps 介导的o2消耗进一步恶化了这种缺氧情况,进而削弱了依赖o2的pdt效果 (nature 2012,491,364
‑
373)。此外,pdt产生的ros的寿命短,并且只能迁移很短的距离(<20nm),因此,pdt的作用范围仅在ps附近。基于传统pdt的缺点,许多新的策略被开发出来。首先,为解决激光穿透能力的问题,近红外(nir)光(780
‑
1400nm)比可见光和紫外光具有更深的组织穿透能力和更低的组织吸收,如果能将近红外光在体内转换成紫外可见光则可解决光的穿透弱和光损伤的问题。巧合的是,基于稀土离子的上转换纳米粒子(ucnps)可以很好的将近红外光转化为紫外或可见光,ucnps激发波长具有较高的组织穿透
深度、较低的自发荧光和良好的光稳定性,同时也能避免紫外线对皮肤的直接损害(nature communications 2018,9,2415)。负载光敏剂后,即可实现近红外光刺激的深部组织pdt治疗。
5.2016年,he等设计了yb
3
增强合成了核心的ucnps(naybf4:2%er
3
),并包覆了介孔二氧化硅的上转换/介孔二氧化硅纳米复合材料(ucnp@sio2),用于连续的细胞成像、光热药物传递和癌症治疗,验证了其高效光热性能及其在同步生物医学成像和光热触发的癌症化疗药物传递方面的巨大潜力 (opticalmaterials express,2016,6,1161)。此外,2020年you等通过原位生长策略成功开发了一种基于bi2se3共轭上转换纳米粒子(ucnps)的新型杂化纳米材料,在808nm近红外激光照射下,ucnps
‑
bi2se3能发出明亮的可见光,展示了其在高效的细胞上转换发光(ucl)、ct成像和癌细胞消融等方面的能力,实现了在双模态成像指导下设计的治疗策略,具有实时动态监测、远程可控性和无创性等特点(chemistry
‑
aeuropean journal 2020,26,1127)。
6.2017年,yan等利用超分子配位组装,合成了装载脂溶性光敏剂ce6的纳米复合材料。由于单宁酸(ta)和fe
3
的配位聚合,疏水ce6纳米粒子在界面组装的络合物中具有良好的稳定性。与自由的ce6分子相比,ce6@ta
‑
fe(iii)nps血液循环时间更长,肿瘤选择性积累更多,抗肿瘤效果更好(scientific reports 2017,7,42978)。同年,wu以超快、绿色、简单、通用的方法包裹并合成了含有银纳米粒子(agnps)的ta/fe
3
银纳米膜。通过体外和体内实验,考察了ta/fe
3
/agnps的物理抗菌活性和光动力抗菌治疗 (pat)的效果,证明了其具有较强的抗菌活性和良好的生物相容性(acsappliedmaterials&interfaces,2017,9,39657)。以上研究仅利用了ucnp的生物医学成像功能,ta/fe
3
的载药以及延长血液循环的能力,促进pss的肿瘤选择性积累等,并没有将成像及光热治疗/光动力治疗结合在一起,尤其材料并没有肿瘤特异的靶向作用,并且在光动力治疗中没有考虑到解决肿瘤缺氧的问题等等。
7.值得注意的是,作为缓解tme中缺氧的主要策略之一,过氧化氢酶可以通过催化tme中高浓度的h2o2(100μm
‑
1mm)原位生成o2(acs nano 2017, 11,7006)。然而,由于天然酶对复杂生物环境的敏感性,它们很容易失去活性并降解。而且,它们的制备成本相当高。因此,设计和开发一种功能类似于天然酶的高稳定性催化剂
‑
纳米酶,作为产氧剂来提高实体瘤中的氧浓度是非常重要的。
8.此外,目前纳米材料制备方法还存在以下问题:制备过程复杂,耗时较长,并且大多数材料纳米尺寸较大或者毒性原因,不能用于生物体内治疗,尤其单独的上转换纳米粒子没有光动力及光热治疗能力;有的材料只具备单一的治疗功能,治疗效果差;一些材料没有主动靶向效果,或者仅仅具有一种靶向能力,不能特异识别癌细胞和细胞器;有些材料仅仅有治疗效果,没有成像诊断能力,很难将诊断与治疗结合,用于精准的成像指导的治疗;多数材料不具备刺激响应的能力,不能做到可操控的治疗和降低对正常组织的毒性和损伤。
技术实现要素:
9.有鉴于此,本发明目的在于提供一种双靶向、ph刺激响应的纳米粒子的制备及其在肿瘤诊疗中的应用。该光热纳米复合材料不仅具有良好的光热稳定性,而且具有较高的
光热性能,光热转换效率高达77.86%。在ucttd上负载光敏剂pc4后,获得的纳米复合材料具有αvβ3整合素受体和线粒体双靶向能力,通过808nm的激光照射即可实现ptt与pdt协同治疗乏氧胰腺癌。
10.为了实现上述发明目的,本发明提供以下技术方案:
11.一种双靶向纳米粒子,其特征在于,包括:
12.上转换粒子内核;和
13.由内到外依次包覆在所述内核表面的单宁酸/fe
3
络合物、tpp和crgd。
14.本发明双靶向纳米粒子以上转换纳米材料为内核,在室温下超快速的包覆单宁酸和铁离子的络合物。由于铁离子的加入,使其具有过氧化氢酶的活性,消耗肿瘤组织中的过氧化氢,产生氧气,改善肿瘤缺氧的环境,提升需氧的pdt的效率,兼具光热治疗能力和改善肿瘤乏氧环境的能力。
15.包覆单宁酸和铁离子的络合物之后,修饰tpp及crgd,获得后纳米粒子ucttd。修饰tpp及crgd的纳米粒子可以特异性识别表面高表达αvβ3整合素受体的癌细胞,并在线粒体内集中分布。本发明中,crgd肽的序列为 cyclo(arg
‑
gly
‑
asp
‑
d
‑
phe
‑
cys)。crgd肽的连接使纳米材料高度亲和表达αvβ3整合素受体的癌细胞,也由于线粒体靶向分子tpp的连接,使其更易进入到 ros敏感的细胞器—线粒体,从而提高线粒体内活性氧(ros)的浓度,加速线粒体功能障碍,诱导癌细胞凋亡。双靶向具有更强的靶向选择性,提升材料进入肿瘤组织的效率同时,由于双靶向纳米粒子中含有fe
3
,可以催化 h2o2反应,产生氧气,为pdt提供充足的o2,提升pdt的效率,可以获得更有效的癌细胞杀伤效果。
16.其中,所述双靶向纳米粒子的水合动力学直径为150
‑
200nm,具体可为 150nm、174nm或200nm。
17.本发明还提供了所述双靶向纳米粒子的制备方法,包括如下步骤:
18.步骤1:将ucnp纳米粒子与单宁酸溶液混合、超声后,加入fecl3溶液反应,离心、清洗,获得包覆有单宁酸/fe
3
络合物的纳米粒子ucnp@ta/fe;
19.步骤2:向ucnp@ta/fe溶液中加入peg溶液,旋转震荡6
‑
24h,用水洗涤,得peg化的ucnp@ta/fe;
20.步骤3:将tpp和peg化的ucnp@ta/fe混合,反应,获得纳米粒子 ucnp@ta/fe
‑
tpp;
21.步骤4:将所述ucnp@ta/fe
‑
tpp与crgd溶液混合,反应,获得光热纳米材料ucnp@ta/fe
‑
tpp
‑
crgd(ucttd)。
22.一些实施方案中,步骤1中,所述单宁酸溶液的浓度为1.6
‑
6.4mg/ml,具体可为1.6mg/ml、3.2mg/ml或6.4mg/ml;所述ucnp纳米粒子和单宁酸溶液的质量体积比以mg/ml计为(2.5
‑
10):(0.5
‑
2),具体可为5:1。
23.一些实施方案中,步骤2中,所述peg溶液的浓度为0.5
‑
2mg/ml,具体可为1mg/ml,其中,所述peg由dspe
‑
peg
2000
、nh2‑
peg
2000
‑
nh2和 dspe
‑
peg
2000
‑
maleimide组成;所述dspe
‑
peg
2000
、nh2‑
peg
2000
‑
nh2和 dspe
‑
peg
2000
‑
maleimide的质量比为90:5:5。
24.一些实施方案中,步骤3中,所述反应在旋转震荡条件下进行;所述tpp 为经活化剂活化的tpp,所述活化剂为edc和/或nhs。
25.一些实施方案中,步骤4中,所述反应的条件为2
‑
10℃下旋转震荡6
‑
24 h。一些具体实施例中,所述反应条件为4℃下旋转震荡12h。
26.一些具体实施例中,所述双靶向纳米粒子的制备方法,包括如下步骤:
27.(1)制备单宁酸(ta)和fe
3
的络合物包覆的上转换纳米粒子 (ucnp@ta/fe)
28.将2.5
‑
10mg ucnp纳米粒子加入到0.5
‑
2ml的ta溶液(1.6
‑
6.4mg/ml) 中,超声10min后,加入0.25
‑
1ml的fecl3溶液(0.8
‑
3.2mg/ml),大力震荡或者快速搅拌20
‑
120s,离心后,50
‑
75%乙醇清洗两次,去离子水洗一次即得ucnp@ta/fe。
29.(2)ucnp@ta/fe
‑
tpp的制备
30.首先将ucnp@ta/fe加入0.5
‑
2mg/ml的dspe
‑
peg
2000
溶液中(其中 nh2‑
peg
2000
‑
nh2及dspe
‑
peg
2000
‑
maleimide占总dspe
‑
peg
2000
量的5
‑
20%),旋转震荡6
‑
24h,去离子水洗2次后备用。期间,活化4
‑
羧丁基三苯基溴化膦(tpp)。称取tpp(0.2
‑
0.5mmol)、edc(0.5
‑
1mmol)和nhs(1
‑
2mmol) 加到50
‑
200μl无水dmso中活化0.5
‑
6h,将其加到1ml peg化的 ucnp@ta/fe中,旋转震荡6
‑
24h。去离子水洗三次后得到ucnp@ta/fe
‑
tpp, 4℃保存备用。
31.(3)ucnp@ta/fe
‑
tpp
‑
crgd的制备
32.将ucnp@ta/fe
‑
tpp加入到与dspe
‑
peg
2000
‑
maleimide相同摩尔数量的 crgd溶液中,2
‑
10℃下旋转震荡6
‑
24h,去离子水洗3次,得到 ucnp@ta/fe
‑
tpp
‑
crgd(ucttd),4℃保存备用。
33.本发明还提供一种纳米复合材料,包括本发明所述的双靶向纳米粒子或本发明所述制备方法制得的双靶向纳米粒子,以及负载在所述双靶向纳米粒子上的光敏剂。
34.一些实施方案中,本发明纳米复合材料的制备方法,包括:
35.在避光条件下,将本发明双靶向纳米粒子(ucttd)加入到25~200 μg/ml的光敏剂溶液中,避光旋转震荡反应6~36h,获得负载有光敏剂的纳米复合材料。
36.一些实施方案中,所述光敏剂为pc4。
37.一些具体实施例中,所述光敏剂为pc4,负载有pc4的纳米复合材料的制备方法为:在避光条件下,将本发明双靶向纳米粒子(ucttd)加入到 25~200μg/ml的pc4溶液中,避光旋转震荡反应6~36h,获得负载有光敏剂的纳米复合材料。
38.在一个具体实施例中,本发明考察了ucttd光热纳米粒子在不同浓度 pc4溶液中的负载效率,发现ucttd对pc4负载量为80μg/mg。
39.本发明还提供了所述双靶向纳米粒子或所述的纳米复合材料在制备抗肿瘤药物中的应用。
40.一些实施方案中,所述肿瘤包括胰腺癌、肝癌、肺癌、胃癌、肠癌、乳腺癌和宫颈癌。
41.一些具体实施例中,具体为胰腺癌,更具体可为乏氧胰腺癌。
42.本发明提供的双靶向纳米粒子,包括:上转换粒子内核;和由内到外依次包覆在所述内核表面的单宁酸/fe
3
络合物、tpp和rgd。本发明将单宁酸/fe
3
的络合物包覆在ucnp上,并修饰tpp及crgd,构建的光热纳米粒子ucttd 具有癌细胞和细胞器双靶向能力,同时具有良好的光热稳定性和光热性能,光热转换效率高达77.86%。
43.在材料上负载光敏剂pc4后,仅通过808nm一种波长的激光即可实现 ptt与pdt的协同治疗。并且由于铁的掺杂使材料具有类过氧化氢酶的性质,对癌细胞中的h2o2表现出优异的催化性能,从而克服肿瘤缺氧,提高pdt 的疗效。同时,单宁酸/fe
3
的络合物对ph变化敏感,具有ph刺激响应的能力,可以通过ph刺激响应性能,在微酸的肿瘤微环境中释放更多的光敏剂 (pc4),实现可操控的pdt治疗。ucttd
‑
pc4纳米复合物具有纳米材料的稳定性,有
利于克服天然酶的不稳定性和易失活性。此外,由于rgd肽的连接,使纳米材料高度亲和表达αvβ3整合素受体的癌细胞,也由于线粒体靶向的连接,使其更易进入到ros敏感的细胞器线粒体中,提高线粒体内ros 的浓度,从而加速线粒体功能障碍和细胞凋亡。本发明提供的双靶向纳米粒子ucttd具有更高的靶向选择性,可以获得更好的治疗效果。此外,ucttd 可以作为多模态成像诊断试剂,可进行光声(pa)、核磁共振(mr)、光热 (pt)和上转换荧光(ucl)成像。总之,该材料具有制作简单、成本低、生物相容性好、稳定性好、功能多样等特点。
附图说明
44.图1为ucnp@ta/fe纳米材料反应前后的照片,(a)ta溶液中的ucnp, (b)ucnp@ta/fe溶液的照片;
45.图2纳米材料的表征;(a)ucttd的透射电镜图像。(b)ucnp@ta/fe 及ucttd的傅里叶变换红外光谱;(c)ucnp,ucnp@ta/fe,ucttd及 ucttd
‑
pc4的荧光发射光谱。ucnp,ucnp@ta/fe,ucnp@ta/fe
‑
tpp,ucttd及ucttd
‑
pc4的水合粒径分布(d)及zeta电势(e);(f)ucnp, pc4,ucnp@ta/fe,ucttd及ucttd
‑
pc4的紫外吸收光谱图;
46.图3ucttd的光热性能和光热稳定性的测定;(a)808nm激光器以0.5 w/cm2的激光功率照射ucttd,经过6次升温降温的光热稳定性测定,每个周期激光辐照10min降温20min;(b)光热转换效率的测定,0.5w/cm2的激光功率分别辐照水和ucttd溶液10min后,自然冷却至室温下的温度变化曲线,及其在降温过程时间与
‑
ln(θ)的线性曲线;
47.图4ucttd对光敏剂pc4负载与ph响应释放研究;(a)ucttd在不同时间点对pc4(25,50,100,150,200μg/ml)的负载比率;(b)ucttd
‑
pc4 在不同ph下pc4的释放效率;
48.图5细胞靶向递送研究;(a)流式细胞分析仪定量分析ucttd
‑
pc4和 ucnp@ta/fe
‑
tpp
‑
pc4递送效率的流式图像;(b)有无crgd靶向分子连接材料的递送效率统计图;
49.图6体外产生氧气研究;ucttd在h2o2溶液(1mm)中o2的生成情况,同浓度的h2o2溶液为对照;
50.图7体外产生ros研究;(a)ucttd
‑
pc4 h2o2 dpbf溶液和(b) dpbf溶液在808nm激光(0.3w/cm2)照射不同时间下的紫外吸收光谱;
51.图8.细胞活性及毒性;(a)capan
‑
1细胞与0,150,300,600,900, 1200,1500和2000μg/ml的ucttd共孵育24h和48h后的细胞活性。(b) 经过pbs,pbs l,pc4,pc4 l
470
,ucttd,ucttd l,ucttd
‑
pc4, ucttd
‑
pc4 l不同组别处理capan
‑
1细胞24h和48h后,细胞的相对存活率。数据平均值
±
sd;
52.图9体外不同浓度ucttd的光声成像强度值及光声成像图片;
53.图10.体外不同浓度ucttd的t1(a)和t2(b)加权核磁共振成像强度值及核磁共振成像图片;
54.图11示活体的治疗效果研究(n=5);(a)荷载capan
‑
1肿瘤的雌性 balb/c裸鼠在治疗第14天的代表性照片及不同组别肿瘤的照片(空的蓝色虚线圈表示肿瘤被完全消融);(b)各个组别在治疗期间肿瘤体积的变化情况;l
470
表示470nm激光器(激光密度:0.1w/cm2),l代表808nm激光器(激光密度:1.2w/cm2),辐照时间10min。
具体实施方式
55.本发明提供了一种双靶向、ph刺激响应的纳米粒子的制备及其在肿瘤诊疗中的应用。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
56.光热治疗(photothermal therapy,ptt):光热治疗法是利用具有较高光热转换效率的材料,将其注射入人体内部,利用靶向性识别技术聚集在肿瘤组织附近,并在外部光源(一般是近红外光)的照射下将光能转化为热能来杀死癌细胞的一种治疗方法。
57.光动力治疗(photodynamic therapy,pdt):是用光敏药物和激光活化治疗肿瘤疾病的一种新方法。用特定波长照射肿瘤部位,能使选择性聚集在肿瘤组织的光敏药物活化,光敏药物会将能量传递给周围的氧,引发光化学反应,生成活性很强的单态氧,单态氧能与附近的生物大分子发生氧化反应,产生细胞毒性进而杀伤肿瘤细胞。
58.ph响应纳米材料:是指随着ph的变化,能够在分子内或分子间产生化学或物理变化的一类功能纳米材料。
59.过氧化氢酶(catalase,cat):是催化过氧化氢分解成氧和水的酶。
60.纳米酶:是一类既有纳米材料的独特性能,又有催化功能的模拟酶。纳米酶具有催化效率高、稳定、经济和规模化制备的特点,它在医学、化工、食品、农业和环境等领域得到广泛应用。
61.本发明采用的试剂和材料皆为普通市售品,皆可于市场购得。
62.下面结合实施例,进一步阐述本发明:
63.实施例1复合材料的制备
64.(1)制备单宁酸(ta)和fe
3
的络合物包覆的上转换纳米粒子 (ucnp@ta/fe)
65.将5mg ucnp纳米粒子加入到1ml的ta溶液(3.2mg/ml)中,超声10min后,加入0.5ml的fecl3溶液(1.6mg/ml),大力震荡或者快速搅拌 20
‑
120s,离心后,50
‑
75%乙醇清洗两次,去离子水洗一次即得ucnp@ta/fe。
66.(2)ucnp@ta/fe
‑
tpp的制备
67.首先将ucnp@ta/fe加入1mg/ml的dspe
‑
peg
2000
溶液中(其中 nh2‑
peg
2000
‑
nh2及dspe
‑
peg
2000
‑
maleimid占总dspe
‑
peg
2000
量的5%),旋转震荡12h,去离子水洗2次后备用。期间,活化4
‑
羧丁基三苯基溴化膦 (tpp)。称取tpp(0.2mmol)、edc(0.5mmol)和nhs(1mmol)加到100μl无水dmso中活化1h,将其加到1mlpeg化的ucnp@ta/fe中,旋转震荡12h。去离子水洗三次后得到ucnp@ta/fe
‑
tpp,4℃保存备用。
68.(3)ucnp@ta/fe
‑
tpp
‑
crgd的制备
69.将ucnp@ta/fe
‑
tpp加入到与dspe
‑
peg
2000
‑
maleimid相同摩尔数量的 crgd溶液中,4℃下旋转震荡12h,去离子水洗3次,得到ucnp@ta/fe
‑
tpp
‑
crgd(ucttd),4℃保存备用。
70.图1为单宁酸(ta)与fe
3
络合物包覆上转换材料前后溶液的颜色变化,图1a为ucnp分散在ta溶液中,此时为ta的淡黄色,当fe
3
加入时,ta 与fe
3
络合物瞬间形成,包覆在ucnp表面,溶液颜色瞬时变为黑色(图1b),此时ucnp@ta/fe材料具有良好的光热性能。
71.图2a为ucnp@ta/fe
‑
tpp
‑
rgd(ucttd)的透射电镜图片(tem),从图2可以看到,ucnp外表面成功包上了ta与fe
3
的络合物。图2b为 ucnp@ta/fe与ucnp@ta/fe
‑
tpp
‑
rgd(ucttd)的傅里叶变换红外光谱,与ucnp@ta/fe相比,ucttd含有苯环的特征吸收峰:苯环c
‑
h伸缩振动为3068cm
‑1;1479cm
‑1及1569cm
‑1为苯环的骨架振动。692cm
‑1和750cm
‑1同时出现说明苯环为单取代峰。这些官能团与tpp分子结构一致,此外,在 1678cm
‑1处出现酰胺键(
–
nh
–
c=o)的特征吸收峰,推测为马来酰亚胺基团与crgdfc[cyclo(arg
‑
gly
‑
asp
‑
d
‑
phe
‑
cys)]中的巯基通过迈克尔加成缩合反应后,开环水解生成稳定的酰胺键,说明crgd连接成功。如图2d所示,ucnp, ucttd及ucttd
‑
pc4的水合动力学直径分别为80nm、174nm和262nm。图2e为各种粒子的zeta电势变化情况。可以看到ucnp的电势为 36.7mv,在ta与fe
3
的络合物包覆后ucnp@ta/fe的电势变为
‑
13.4mv。在连接靶向分子后,电势变化不大,ucnp@ta/fe
‑
tpp(uctt)和ucttd电位分别为
‑
6.4mv和
‑
7.0mv,但是负载上带正电荷的pc4后,ucttd
‑
pc4的电位变为 2.7mv,此电位说明pc4被成功的负载到材料上。另一方面,少量的正电荷使ucttd
‑
pc4更容易进入细胞而且几乎没有电荷毒性。总之,以上表征结果证明带有双靶向的ucttd被成功合成。图2f为ucnp,pc4, ucnp@ta/fe,ucttd及ucttd
‑
pc4的紫外吸收光谱图,从图中可以看出 ucnp在近红外处与基线几乎重合,而ucnp@ta/fe在近红外处有明显吸收,尤其在连接靶向分子后,ucttd的近红外吸收得到进一步提高,这也意味着 ucttd有更好的光热性能。ucttd负载上pc4后,ucttd
‑
pc4在450
‑
500 nm处出现pc4的紫外吸收峰,也证明pc4的成功负载。此外,pc4的紫外最大吸收峰为470nm左右,图2c为ucnp,ucnp@ta/fe,ucttd和 ucttd
‑
pc4的荧光发射光谱,虽然在包裹后荧光强度有所下降,但仍然有较强的470nm处的发射光,刚好为光敏剂pc4提供光源。
[0072]
为了测量ucttd的光热能力与光稳定性,将1ml ucttd置于无色透明比色皿中,用近红外激光器(los2
‑
bld
‑
0808
‑
005w
‑
c/p,高科技光电有限公司,中国)照射600s(0.5w/cm2),然后降至室温,重复上述循环6个周期,检测材料的光热稳定性。用热电偶(tes k型温度计1319a,中国台湾)每 30s记录一次溶液的实时温度。此外,以水为阴性对照,近红外激光器照射期间,用flir c2热像相机(美国)每10s读取一次溶液温度,最后计算材料的光热转换效率(η)。
[0073]
如图3a,ucttd溶液经过808nm激光器(0.5w/cm2)照射10min,间歇20min,6次升温降温周期循环后,溶液仍能达到46.8℃,说明ucttd纳米材料不仅具有较高的光热性能,而且具有较好的光热稳定能力。如图3b, ucttd的光热转换效率高达77.86%
[0074]
综上结果可知,本发明提供的光热纳米材料ucttd不仅光热稳定性好,而且光热转换效率较高,是一种极具潜力的光热治疗试剂。
[0075]
实施例2纳米复合材料负载光敏剂pc4
[0076]
取1mg实施例1制备的光热纳米材料ucttd加入到1ml不同浓度(25、50、100、150、200μg/ml)的pc4溶液中,避光旋转震荡反应36h,获得载有光敏剂pc4的纳米复合材料ucttd
‑
pc4。
[0077]
实施例3光敏剂(pc4)的负载和释放
[0078]
按照实施例2的方法制备纳米复合材料,反应期间,分别于在6、12、24 和36h时,测量上清液中pc4的浓度(c
x
),计算pc4的装载率:
[0079]
装载率=(c0‑
c
x
)/c0×
100%
[0080]
其中,c0为初始pc4的浓度。对于pc4的释放,将ucttd
‑
pc4分别置于ph为5.0、6.5、7.4的pbs溶液中,旋转震荡48h,期间在1、3、6、12、 24、48h,测上清液中释放的pc4的浓度c
x
,释放率=c
x
/c0×
100%,其中 c0为材料负载的量。结果见图4。
[0081]
如图4a为1mg ucttd纳米材料在不同浓度pc4溶液中的负载效率,可以看到在装载36h后,通过计算,ucttd对pc4负载量为80μg/mg左右。由于单宁酸及铁的络合物对ph较为敏感,我们考察了不同ph(7.4、6.5、5.0) 的pbs中ucttd
‑
pc4的释放行为,可以看到,ucttd
‑
pc4在ph为7.4时,释放率仅为2.6%,在ph为5.0时,释放效率是中性条件下的1.8倍(图4b)。以上结果证明ucttd
‑
pc纳米颗粒具有良好的稳定性,可有效减少光敏剂到达病灶区域前的过早释放。而在进入到肿瘤病灶内时,肿瘤组织较低的ph可以刺激pc4的释放。
[0082]
大量研究发现,整合素αvβ3在血管生成中发挥着重要的作用,而且在肿瘤的血管和多种侵袭性肿瘤细胞中都有较高表达,而在正常的内皮细胞和组织中表达量很低甚至不表达。crgd肽与αvβ3受体具有高度的亲和能力,已经被许多研究作为靶向分子特异的识别癌细胞。将crgd肽通过迈克尔加成反应连接到纳米材料上,不仅能提高材料进入肿瘤细胞的量来提高抗肿瘤效果,而且能降低对正常细胞的副作用。在体外治疗前,我们首先对材料的实施例4复合材料靶向能力测定
[0083]
将capan
‑
1细胞以10000个/孔的密度接种于96孔板中,37℃孵育12h 后,分别用ucnp@ta/fe
‑
tpp
‑
pc4(
‑
crgd)和ucttd
‑
pc4( crgd)培养6h后,消化下来用流式细胞仪进行递送定量分析。
[0084]
如图5a和5b,利用流式细胞仪单独分析有无rgd靶向的ucttd
‑
pc4 和ucnp@ta/fe
‑
tpp
‑
pc4(uctt
‑
pc4)的递送情况。ucttd
‑
pc4和 uctt
‑
pc4的递送效率分别为73.8%和49.8%。这充分说明了rgd靶向分子对capan
‑
1细胞的亲和力,也证明ucttd纳米粒子靶向癌细胞的可靠性。
[0085]
使用ysi5000溶氧
‑
bod测定仪(美国)检测ucttd产生o2的能力。通常,将ucttd纳米粒子分散体(30ml)置于50ml的离心管中,加入 h2o2,使材料置于1mm h2o2浓度下。不断搅拌下,采用溶解氧计探头检测氧浓度的变化,不加ucttd纳米粒子的h2o2(1mm)溶液为阴性对照。
[0086]
如图6,h2o2溶液本身氧含量没有明显变化,但加入纳米材料的溶液中,随着时间变化含氧浓度增加,说明ucttd纳米粒子具有较好的类过氧化氢酶活性,即能够催化h2o2产生o2。我们推测其产生o2原因是由于材料中含有 fe
3
,在h2o2的存在下产生芬顿反应,反应机制如下:
[0087]
fe
3
h2o2→
fe
2
o2 2h
[0088]
对于体外产ros的检测,使用化学探针dpbf的化学氧化法,dpbf与1o2发生不可逆反应,使dpbf的吸光度降低。通过紫外可见光谱检测探针 dpbf在410nm处的吸收强度变化来确认1o2的产生。通常,在含有20μg/ml dpbf的ucttd
‑
pc4溶液中,加入适量h2o2使其终浓度为1mm,在避光情况下,用808nm激光器(0.3w/cm2)照射5min,期间每分钟测量一次紫外。不加ucttd
‑
pc4的dpbf(20μg/ml)用相同功率密度的激光照射作为对照组。
[0089]
根据产生氧气的结果,推测ucttd中的fe
3
催化中心与pc4的协同作用或许可以提高ros的生成量。为了验证ucttd
‑
pc4生成ros的能力,首先在体外通过dpbf对ucttd
‑
pc4生成1o2的能力进行了研究。如图7a所示,ucttd
‑
pc4在808nm(0.3w/cm2)激光照射5min期间,
dpbf在420 nm处的吸收峰不断下降。对照组在相同条件下,不加入ucttd
‑
pc4的dpbf 吸收强度几乎没有变化(图7b)。以上结果表明ucttd
‑
pc4在体外具有良好的ros生成能力。
[0090]
实施例5复合材料的体外治疗效果评价
[0091]
由于纳米材料应用在生物上的光热治疗(ptt)和光动力治疗(pdt), ucttd
‑
pc4在激光照射和黑暗条件下细胞的活性毒性是一个重要参数。
[0092]
细胞活性及毒性实验根据cck
‑
8试剂盒标准步骤检测。
[0093]
首先,将capan
‑
1细胞以10000个/孔的密度接种于96孔板中,37℃培养12h后,加入含有不同浓度ucttd的新鲜培养基(0、150、300、600、 900、1200、1500、2000μg/ml)。继续培养24h和48h后,进行细胞活性检测。将铺板12h后的细胞分为8组:pbs,pbs l,ucttd,ucttd l, pc4,pc4 l
470
,ucttd
‑
pc4和ucttd
‑
pc4 l。激光照射组在孵育6h后分别用470nm或者808nm激光照射。24h和48h后,用pbs清洗细胞,加入 100μl新鲜培养液(含10μl cck
‑
8试剂)继续培养30min左右。利用酶标仪(spark controltm tecan,usa)记录450nm处的吸光度。每组实验重复三次。
[0094]
如图8a,细胞与浓度低于1200μg/ml的ucttd纳米材料共孵育24h或者48h后,仍有较高的存活率,表明ucttd生物相容性及生物安全性良好。然而,在用光动力试剂,光热试剂或者光动力光热协同治疗试剂处理后,细胞显示出明显不同的存活率(图8b),相对于空白对照组,激光(pbs l),材料(ucttd,ucttd
‑
pc4),光敏剂(pc4)对细胞的存活率几乎没有影响,而用pc4 l
470
处理48h后,细胞活性仅降低至68.6%,ucttd l
808
处理后,细胞活性降低至26.8%,尤其在光热和光动力协同治疗48h后,细胞存活率显著降低至8.1%。这说明在含有fe
3
的催化下,并且加上tpp和rgd 靶向的作用后,大大增强细胞对光动力治疗的敏感性,最终使ptt协同pdt 治疗的效果显著。这些结果表明,ucttd
‑
pc4在黑暗条件下具有很高的生物相容性,安全无毒,但在特定的激光照射下是一种有效的低氧癌细胞ptt/pdt 光动力协同治疗剂,具有优异的治疗效果。
[0095]
实施例6复合材料用于肿瘤成像可行性评价
[0096]
为了更明确的指导材料诊断及治疗,本实施例研究了本发明纳米复合材料的成像及造影效果以及其在肿瘤中的富集情况。
[0097]
首先,进行了体外的光声成像以确认材料本身的光声成像能力,根据操作规程制作小鼠假体,将不同浓度的ucttd(0.125、0.25、0.5、1、2、4mg/ml) 注入到假体中,在多光谱光声层析成像系统(msot invision 128,ithermedical,德国)中进行光声成像。利用制造商提供的软件处理光声成像图片及光声信号强度。
[0098]
通过体外用假体模拟体内光声成像情况的实验结果可以看到(图9),随着假体中ucttd浓度加大,光声强度也随之增强,其线性(r2=0.9939)呈现浓度依赖性,插图为体外光声成像图片,说明可以产生光声信号并且信号强度与浓度呈良好的线性关系。
[0099]
核磁共振成像(magnetic resonance imaging,mri)是临床诊断中不可或缺的、也是最常用的诊断工具之一。该成像技术安全系数高、具有较高的软组织分辨率、可在无创伤情况下进行多方位、多参数成像,且其效果不受组织深度的影响。因此,在临床诊断中,mri能够安全、快速、准确地为患者提供高分辨率的三维结构图像,常用于各种疾病的检测。为了研究ucttd作为mri造影剂的潜力,首先通过3.0t临床mri扫描仪测量不同浓度ucttd (0、0.5、1、2、4mg/ml)的t1和t2加权的mri以及纵向和横向mr弛豫率。
[0100]
ucttd水溶液的mr图像显示出体外浓度依赖的成像效果(图10),且具有相对较高的纵向(r1)弛豫和横向(r2)弛豫,表明ucttd是一种有效的mri造影剂。
[0101]
实施例7复合材料体内抗肿瘤的评价
[0102]
本实施例对荷载capan
‑
1肿瘤的雌性裸鼠进行治疗,评价其体内抗肿瘤能力。
[0103]
如图为pbs组和ucttd
‑
pc4 l组小鼠治疗14天后小鼠及肿瘤(图11a) 的照片以及8个组别在治疗期间肿瘤体积的变化情况(图11b)。相比pbs 组,pc4 l
470
组肿瘤略有减小,ucttd l组有效抑制肿瘤生长,在 ucttd
‑
pc4 l组中,有的肿瘤几乎被完全杀灭而无任何再生,而pbs l, pc4,ucttd和ucttd
‑
pc4组小鼠的肿瘤仍然保持较高的生长速度,说明 pdt本身因为激光(470nm)穿透性差且没有靶向,体内循环时间短,治疗效果不理想,但是在光热协同治疗下,由于纳米材料既有靶向作用,而且fe
3
能够催化h2o2产生氧气,进一步提高光动力敏感性,所以在光热协同光动力治疗组中展现出优异的治疗效果。
[0104]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。