1.本发明公开一种用于胰腺癌免疫治疗的工程化外泌体,同时还提供了其制备工艺,属于生物医药生产技术领域。
背景技术:
2.胰腺癌发病隐匿、进展迅速、死亡率高,预后极差,是目前已知恶性程度最高的肿瘤之一。由于缺乏有效地筛选及诊断方法,绝大多数患者在确诊时处于晚期,只能以接受化疗为主。而且,胰腺癌肿瘤组织血管稀少,血供仅为正常胰腺组织的1/3,导致化疗药物及其他活性成分无法有效递送至肿瘤部位,因此,胰腺癌病人中位生存期只有5-8个月,5年生存率小于10%。
3.巨噬细胞来源于骨髓单核细胞,几乎存在于机体的所有组织中。作为先天免疫的重要组成部分,巨噬细胞能够对侵入机体血液和组织中的病原体与异物迅速做出应答,激发炎症反应,清除病原体以维护机体内环境的稳态,参与机体的非特异性免疫应答;同时,巨噬细胞也能够在特异性免疫应答中发挥抗原递呈和免疫调节的作用。由于巨噬细胞具有良好的多能性和可塑性,所以在体内不同时期和不同环境下能够分化出不同的表型并表现出不同的功能。巨噬细胞在不同微环境信号的刺激下,主要分化为m1型和m2型。m1型主要在肿瘤的起始阶段发挥作用,通过分泌细胞因子杀伤肿瘤细胞;随着肿瘤的进展,m1型巨噬细胞逐渐被肿瘤细胞分泌的因子驯化为m2型,发挥免疫抑制功能,促进肿瘤恶性进展。肿瘤微环境中的肿瘤相关巨噬细胞主要表现为m2型。
4.胞质dna感受器环鸟苷酸腺苷酸合成酶-干扰素基因刺激因子信号通路(cgas-sting)是内源性i型干扰素(ifns)产生的主要来源,sting信号通路可激活巨噬细胞产生ifns,具有引发或增强先天性和获得性免疫应答的潜力,对胰腺癌免疫治疗至关重要。位于细胞质内游离的双链dna可以激活cgas,cgas在结合双链dna后会发生构象改变,从而催化atp和gtp形成2’, 3
’‑
环状gmp-amp(cgamp)。第二信使cgamp可以激活位于内质网上的sting,然后,sting通过高阶低聚反应形成四聚体,并从内质网被转运到内质网-高尔基体中间隔室。在高尔基体,sting的四聚体可以作为信号平台招募并激活tank结合激酶1(tbk1)二聚体,反过来tbk1可以磷酸化sting的c末端结构域以招募ifn反应因子3(irf3)进行激活,磷酸化的irf3移位至细胞核作为转录因子促进ifns的转录表达,因而,激活效应t细胞。然而,sting是一种胞质蛋白,其天然激动剂如cgamp的胞质递送效率较差,且血清稳定性低,组织清除率快,从而阻碍其治疗效果。
5.外泌体是由活细胞分泌的40-160 nm的细胞外囊泡,具有体积小、生物相容性好、低毒、免疫原性低等优点;与脂质体、纳米粒等其他载体相比,外泌体可以保护核苷酸药物以及mrna的稳定性,免于体内降解,提高其血清稳定性,增加其循环时间。而且外泌体能够遗传母细胞的特性,获得母细胞的一些成分,如蛋白质、脂质和核酸,赋予其归巢效应和激活免疫反应的能力。此外,外泌体含有跨膜和膜锚定蛋白,增加其工程化能力,从而增强靶细胞的内吞作用,促进其内内容物的传递。
技术实现要素:
6.本发明构建了一种用于胰腺癌免疫治疗的工程化外泌体,利用m1巨噬细胞来源的外泌体进行工程化改造,实现药物靶向递送至巨噬细胞。
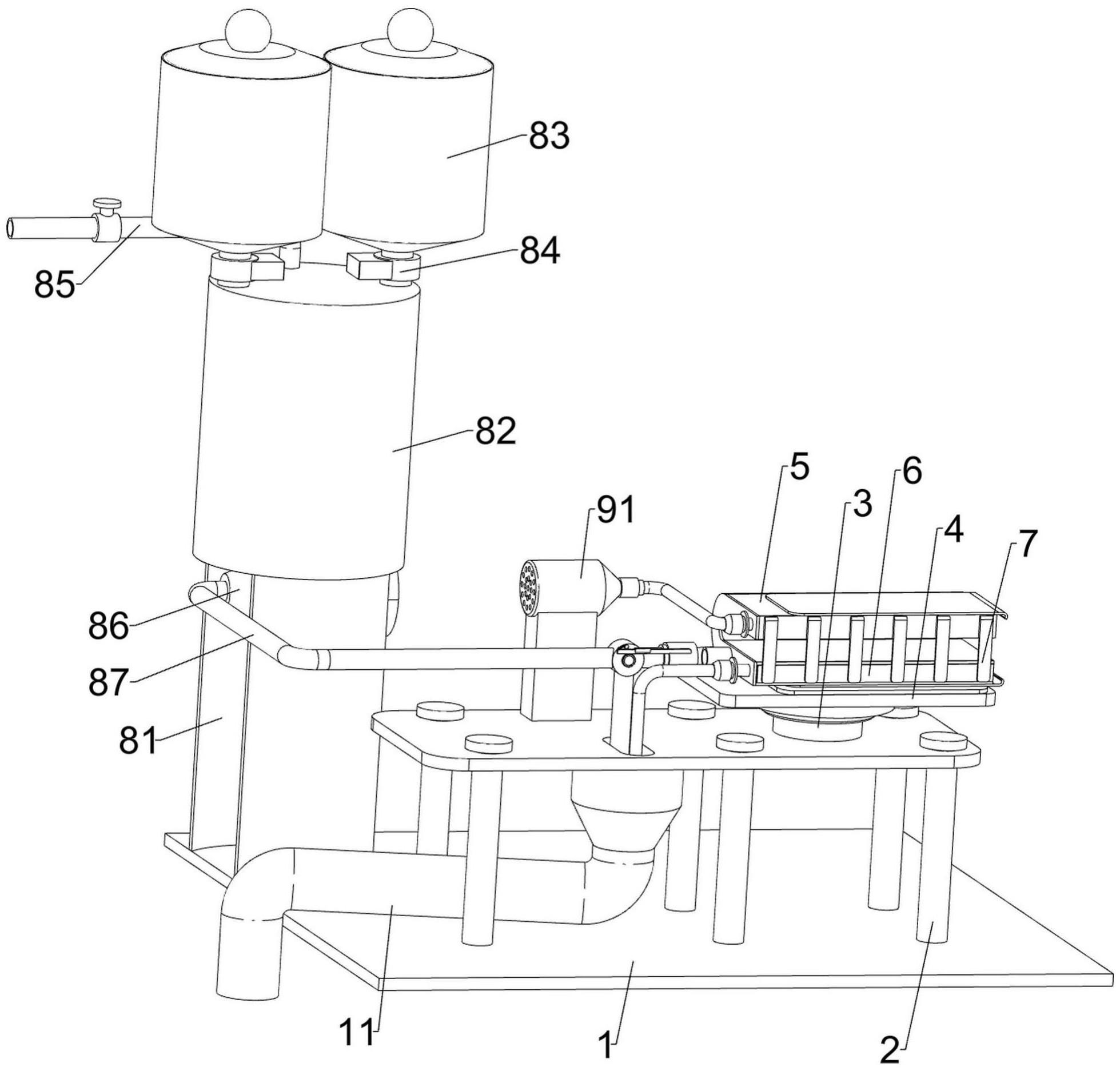
7.为到达目的本发明,采用技术方案如下:大批量培养m1巨噬细胞后,使用细胞纳米穿孔技术电转m1巨噬细胞,培养24小时后,取培养基上清液离心,上清液超滤浓缩,获取粗提外泌体,再用超速离心机进一步纯化,得纯化外泌体;通过细胞纳米穿孔技术将cgamp与il-12 mrna负载到纯化的外泌体中,再将cd11b抗体与外泌体孵育,用pbs洗去未负载的治疗性药物和未修饰的cd11b抗体,获得工程化外泌体,即负载有治疗性药物且修饰cd11b抗体的外泌体。
8.本发明所述的一种用于胰腺癌免疫治疗的工程化外泌体的制备方法,包括如下步骤:1)将巨噬细胞thp-1传到细胞培养瓶中,用含有0.1 mg/ml pma的rmpi1640与细胞孵育过夜,细胞由悬浮状态转化成贴壁状态;再用含有0.4 mg/ml lps的opti mem培养基与细胞孵育,细胞转化成m1巨噬细胞;2)取步骤1)中的上清液依次进行电转、离心、过滤,超速离心,获得纯化外泌体;其中上清液采用细胞纳米穿孔技术提取外泌体,过滤采用0.22 μm的滤膜过滤,滤过液用100000 g的超速离心机离心;3)负载治疗性药物和表面修饰:将cgamp与il-12 mrna负载至步骤2)的纯化外泌体内,再加入cd11b抗体孵育,孵育之后的混合液用超滤管4℃离心,再加入pbs离心洗涤未负载的治疗性药物及未修饰的cd11b抗体,获得工程化外泌体(exo-acd11b-cgamp-il-12 mrna)。
9.本发明还限定了靶向治疗性药负载采用细胞纳米穿孔技术,其中:细胞纳米穿孔技术装载药物的过程为:将取收集好的纯化外泌体以蛋白浓度2 mg/ml 500 μl附着于纳米通道阵列的芯片表面上,将cgamp以浓度100 ng/ml、il-12mrna 50 ng/ml各500 μl,加入缓冲液通道,在220 v的瞬间脉冲下,将cgamp与il-12mrna负载于纯化外泌体中,得到载药的工程化外泌体(exo-cgamp-il-12 mrna)。
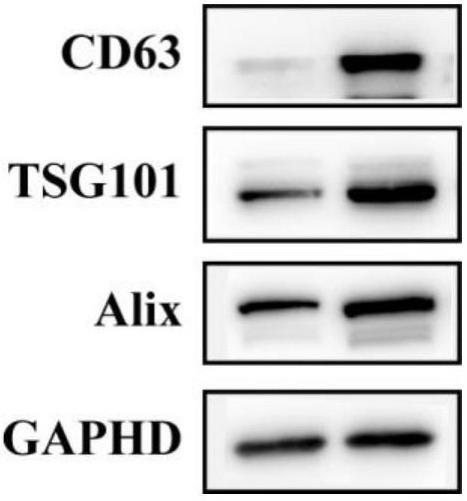
10.更进一步地,本发明还限定了通过限定方法得到的工程化外泌体,外泌体形貌为碟状,含有cd63外泌体特征蛋白质,平均直径为100 nm。本发明制得的工程化外泌体可以激活cgas-sting通路,激活效应t细胞;逆转肿瘤微环境,将m2型巨噬细胞极化为m1型,抑制胰腺癌的增长。
11.本发明所述的工程化外泌体(exo-acd11b-cgamp-il-12 mrna)可以用于制备治疗胰腺癌疾病的药物。
12.本发明的积极效果在于:提供了一种可以免疫治疗胰腺癌的工程化外泌体;利用m1巨噬细胞来源的外泌体进行工程化改造,巨噬细胞表面过表达cd11b分子,实现药物靶向递送至巨噬细胞,在其表面连接cd11b抗体,并在其中负载cgamp分子以及il-12 mrna,激活cgas-sting通路,刺激巨噬细胞产生ifns,激活效应t细胞,同时,实现肿瘤微环境中m2巨噬细胞极化为m1巨噬细胞,实现胰腺癌的高效治疗。本发明通过对外泌体进行一系列工程化改造,提高外泌体对胰腺癌的治疗效果。
acd11b呈现了较高的摄取量;参见图3巨噬细胞摄取exo-acd11b的流式分析图。
18.胰腺癌肿瘤模型构建:balb/c裸鼠(雄性,18-20 g,4周)购自辽宁长生股份有限公司。将panc-02细胞于dmem培养液中稳定传代5~6代,观察细胞增殖旺盛时终止培养,用无血清dmem培养液制备细胞悬液,调整细胞密度至1
×
109个/l,以60 mg/kg腹腔注射戊巴比妥钠,取腹部正中切口,牵出胰腺,于脾门较宽大处胰腺背膜下注射1
×
106个/l地鼠胰腺癌细胞悬液后常规关腹。
19.活体治疗:所有荷瘤小鼠分成7组,每组5只荷瘤小鼠,将100 μl exo-acd11b-cgamp-il12 mrna(cgamp 100 μg/只,mrna 0.086 nmol/只),100 μl exo-acd11b-cgamp(cgamp 100 μg/只),exo-acd11b-il12 mrna(mrna 0.086 nmol/只),100 μl exo-acd11b,100 μl sirna (sirna 0.086 nmol/只),100 μl cgamp和100 μl pbs在balb/c裸鼠注射肿瘤后的第10天,14天,17天和21天经尾静脉注射到荷瘤小鼠体内,观察每组荷瘤小鼠的生存期、体重以及瘤体积大小。其结果如图4、图5和图6所示,从图中的结果可以证明:exo-acd11b-cgamp-il12 mrna可以显著延长荷瘤小鼠的生存期且该组荷瘤小鼠体重变化不大;而且exo-acd11b-cgamp-il12 mrna较其他单一负载药物呈现了更好地效果。
20.以上仅为本发明的一般说明和实施方法,并非因此限制本发明的专利保护范围,但凡根据本发明说明书及附图所做的等效改变,或者直接或者间接利用本发明专利到其他相关技术领域,均视作在本发明专利的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。