1.本发明涉及高效生产白蛋白的植物细胞株及生产其的方法,更具体地,涉及高效生产源自狗或猫的重组白蛋白的水稻悬浮细胞、生产其的方法以及包含上述水稻悬浮细胞或源自其的重组白蛋白蛋白质的用于预防、改善或治疗低白蛋白血症的兽用药物组合物。
背景技术:
2.人血清白蛋白(human serum albumin,hsa)为主要在肝脏中合成的在血液中存在最多的蛋白质,在人体内起到重要的生理学作用。已知人血清白蛋白不仅在运输血液内的脂肪酸等低分子及包括胆红素在内的低分子蛋白质的同时担当通过胶体渗透压保持血管内外水分平衡的功能,还担当生物体内的大部分抗氧化功能。在医疗领域中,因这样的多种功能性而在血液量减少、低蛋白血症、休克、烫伤、重症出血、肝脏/肾脏疾病等的治疗中广泛用作药物制剂。
3.另一方面,医疗现场中使用的大部分人血清白蛋白主要从人类的采集血液中分离来制备,尽管已在临床中长期使用,但在未发生过传播病毒等感染性物质的事例的血液制剂中也被认为是安全性高的制剂。但在人血清白蛋白制剂中也有过检测出作为脱氧核糖核酸(dna)病毒的细小病毒(parvovirus)b19的脱氧核糖核酸的事例,即使是经过纯化工序的白蛋白制剂,由于原料只能依赖人类的血浆,因此新的观点认为无法完全排除未知的危险性(非专利文献001)。
4.在这样的背景下,包括本技术人在内的诸多团队致力于直接从血液中制备的方式脱离出来,开发利用酵母、植物细胞等多种生产系统生产重组人血清白蛋白的研究,现在已实现商用化(非专利文献002)。
5.另一方面,随着近来宠物市场的急速成长,在动物医疗现场中,也在因肝功能障碍、肾功能衰竭、烫伤、慢性炎症性肠疾病、肿瘤、淋巴管扩张症等多种疾病引起的低白蛋白血症的治疗中使用人血清白蛋白。通常在血中白蛋白的浓度降到2.0g/dl以下时处方人血清白蛋白。
6.但是,最近发现狗或猫的血清白蛋白(csa/fsa;canine/feline serum albumin)的氨基酸结构与人血清白蛋白比较有80%的同源性,从无副作用的安全的处方考虑,克服20%的差异成为日益抬头的重要问题。
7.通常,哺乳动物中的非保守的(non-conserved)氨基酸序列被鉴定为过敏反应中的活性抗原表位(epitope)(非专利文献003及非专利文献004),已知显出狗或猫的血清白蛋白与人血清白蛋白的氨基酸结构的决定性差异的部分为作为非保守序列的ib结构域(氨基酸残基110-133),起到对过敏抗原性的活性表位的作用(非专利文献005)。仔细仅比较这些ib结构域的序列,因与狗血清白蛋白(csa)具有54%的同源性,与猫血清白蛋白(fsa)具有58%的同源性,成为生成抗体的主要原因,因此在安全处方中可能成为决定性副作用的原因(参照图1及图2)。
8.作为实际临床例,有报告显示,在宠物中,向患有作为低白蛋白血症的主要病因之
一的炎症性肠疾病(ibd;inflammatory bowel disease)或蛋白质丢失性肠疾病(ple;protein-losing enteropathy)的猫或狗,以通常的处方给药25%的人血清白蛋白时,出现过因发生严重的急性副作用而死亡或执行安乐死的事例,并且,在向未患疾病的健康的狗或猫给药人血清白蛋白的实验中,也出现过严重的浮肿、皮疹、皮肤病变等副作用(非专利文献006)。这样的副作用认为是由前述的人血清白蛋白与狗或猫的血清白蛋白的氨基酸结构的差异引起的免疫反应的结果。
9.综合至今报告的与人血清白蛋白处方相关的内容,得出在给药人血清白蛋白的狗或猫中有30%左右的概率引起严重的浮肿、炎症、凝血障碍、因血管炎引起的皮肤病变、呕吐、食欲不振、无力、血压升高、死亡等多种严重的副作用的结论(非专利文献006及非专利文献007)。并且,由给药异种蛋白质引起的抗体生成起到在二次处方后使已给药的白蛋白的功效失效的作用(非专利文献008)。
10.即,只要处方过一次人血清白蛋白的动物,因生成对人血清白蛋白的抗体,在二次处方及反复给药时,不仅无法看到人血清白蛋白的疗效,而且出现严重的过敏性休克(anaphylactic shock)的风险非常大。并且,在动物医疗现场中的人血清白蛋白处方方面,与美国、欧洲等不同的是,韩国缺乏有关在动物疾病治疗中使用人体药品的制度及法律依据,近来也频繁出现与之相关的社会争论。
11.然而,现在的情况是,由于没有能够替代人血清白蛋白的动物专用白蛋白制剂,在动物医疗现场只能冒着副作用的风险使用人血清白蛋白处方。虽然一部分动物医院中购买由狗或猫的血液制备的血液制剂来使用,但在大量饲育用于采血的供血犬(提供血液的狗)的问题、污染的血液问题等社会争论和安全性方面仍存有多种问题。与之相反,只有在美国、欧洲等等动物福利现今的国家和地区中,在动物医疗现场中使用由通过宠物献血收集的血液制备的得到官方许可的血浆之际。
12.但随着近来宠物医疗市场的急速成长带来的血液制剂需求的增加,无法只依赖通过献血的血液制剂,而且,由血浆制备的狗血清白蛋白因纯化工序而提高成本,因此增加宠物的医疗费用负担。
13.现有技术文献
14.非专利文献
15.非专利文献001:marano g,vaglio s,pupella s,et al.(2015)human parvovirus b19 and blood product safety:a tale of twenty years of improvements.blood transfus.13:184-196。
16.非专利文献002:he y,ning t,xie t,et al.(2011)large-scale production of functional human serum albumin from transgenic rice seeds.proc natl acad sci u s a 108(47):19078-19083。
17.非专利文献003:majorek ka,porebski pj,dayal a,et al.(2012)structural and immunologic characterization of bovine,horse,and rabbit serum albumins.molecular immunology 52(3-4):174-182。
18.非专利文献004:tanabe s,kobayashi y,takahata y,morimatsu f,shibata r,nishimura t(2002)some human b and t cell epitopes of bovine serum albumin,the major beef allergen.biochem biophys res commun.293(5):1348-1353。
19.非专利文献005:pongprayoon p,japrung d(2021)revealing the structural dynamics of feline serum albumin.structural chemistry 32(1):69-77。
20.非专利文献006:cohn la,kerl me,lenox ce,livingston rs,dodam jr.(2007)response of healthy dogs to infusions of human serum albumin.am j vet res.68(6):657-663。
21.非专利文献007:loyd ka,cocayne cg,cridland jm,hause wr.(2016)retrospective evaluation of the administration of 25%human albumin to dogs with protein-losing enteropathy:21cases(2003-2013).j vet emerg crit care(san antonio).26(4):587-592。
22.非专利文献008:martin lg,luther ty,alperin dc,gay jm,hines sa.(2008)serum antibodies against human albumin in critically ill and healthy dogs.j am vet med assoc.232(7):1004-1009。
技术实现要素:
23.要解决的技术问题
24.为了解决上述需求并克服现有技术的问题,本发明的目的在于,提供用于高效生产白蛋白的重组核酸。
25.并且,本发明的再一目的在于,提供包含上述重组核酸的水稻悬浮细胞及利用其的高效生产白蛋白的方法。
26.并且,本发明的还有一目的在于,提供包含上述重组核酸、水稻悬浮细胞或源自其的重组白蛋白蛋白质作为有效成分的用于治疗低白蛋白血症的兽用药物组合物。
27.本技术的其他目的及本发明所要实现的技术问题不限定于上述提及的目的,将通过下述说明和本说明书中记载的发明要求保护范围以及附图得到进一步明确。并且,本发明所属技术领域的普通技术人员(以下称“普通技术人员”)可以明确理解并类推本说明书中未记载的本发明所要实现的技术问题。
28.技术方案
29.为了实现上述目的,提供如下发明。
30.本发明提供一种用于高效生产白蛋白的重组核酸,编码信号肽(signal peptide,sp)的核酸序列结合在白蛋白基因的5'-末端。
31.作为一实例,在上述重组核酸中,白蛋白基因可以为源自狗或猫的基因。更具体地,上述白蛋白基因可以包含序列1或序列2的碱基序列。
32.并且,作为一实例,在上述重组核酸中,信号肽可以源自水稻淀粉酶3a(ramy3a)或大豆贮存蛋白a(vspa)。更具体地,上述信号肽可以由序列11或序列12的氨基酸序列形成。
33.并且,本发明提供与编码信号肽的核酸序列结合在白蛋白基因的5'-末端的用于高效生产白蛋白的重组核酸可操作地连接的表达载体。
34.作为一实例,上述表达载体可以包含5'-utr、编码信号肽的碱基序列及编码狗或猫白蛋白的成熟肽(mature peptide)的碱基序列。更优选地,表达载体可以包含选自序列7至序列10中的一种碱基序列。上述序列7至序列10的碱基序列相当于5'-utr、编码信号肽的碱基序列及编码狗或猫白蛋白的成熟肽的碱基序列的序列,序列7的碱基序列为依次连接
5'-utr、编码水稻淀粉酶3a(ramy3a)信号肽的碱基序列及编码狗白蛋白的成熟肽的碱基序列的序列,序列8的碱基序列为依次连接5'-utr、编码大豆贮存蛋白a(vspa)信号肽的碱基序列及编码狗白蛋白的成熟肽的碱基序列的序列,序列9的碱基序列为依次连接5'-utr、编码水稻淀粉酶3a(ramy3a)信号肽的碱基序列及编码猫白蛋白的成熟肽的碱基序列的序列,序列10的碱基序列为依次连接5'-utr、编码大豆贮存蛋白a(vspa)信号肽的碱基序列及编码猫白蛋白的成熟肽的碱基序列的序列。
35.并且,本发明提供包含上述表达载体的宿主细胞。
36.在本发明所属技术领域中公知的宿主细胞中,只要是能够连续表达本发明的表达载体的宿主细胞就可以使用,例如,可以使用植物细胞、大肠杆菌、酵母或芽孢杆菌属菌株等,但不限定于此。
37.作为本发明的一实例,上述宿主细胞可以具体为高效生产重组狗白蛋白或重组猫白蛋白的植物细胞,更具体地,上述植物细胞可以为水稻悬浮细胞,但不限定于此。
38.本发明提供高效生产白蛋白的方法,包括培养包含上述表达载体的宿主细胞的步骤。其中,上述宿主细胞可以为植物细胞,更具体地,可以为水稻悬浮细胞,但不限定于此。
39.并且,本发明提供用于预防或治疗低白蛋白血症的兽用药物组合物,包含编码信号肽的核酸序列结合在白蛋白基因的5'-末端的用于高效生产白蛋白的重组核酸、与上述重组核酸可操作地连接的表达载体、由上述表达载体转化来高效生产重组狗白蛋白或重组猫白蛋白的宿主细胞或源自其的重组狗白蛋白或重组猫白蛋白蛋白质作为有效成分。
40.作为一实例,上述组合物用于向狗或猫给药,可以减少给药人白蛋白时发生的副作用。更具体地,上述副作用可以为浮肿、皮疹或皮肤病变。
41.并且,本发明提供用于预防或改善低白蛋白血症的饲料添加剂组合物,包含编码信号肽的核酸序列结合在白蛋白基因的5'-末端的用于高效生产白蛋白的重组核酸、与上述重组核酸可操作地连接的表达载体、由上述表达载体转化来高效生产重组狗白蛋白或重组猫白蛋白的宿主细胞或源自其的重组狗白蛋白或重组猫白蛋白蛋白质作为有效成分。
42.有益效果
43.本发明的用于高效生产白蛋白的重组核酸、包含其的载体及包含上述载体的水稻悬浮细胞可以用作用于安全有效地大量生产狗专用重组狗血清白蛋白(rcsa;recombinant canine serum albumin)及猫专用重组猫血清白蛋白(rfsa;recombinant feline serum albumin)的最佳手段。
44.并且,本发明的通过上述水稻悬浮细胞来高效生产源自狗或猫的重组白蛋白的方法在蛋白质纯化的便利性、安全性、生产成本等方面提供独创的技术。
45.并且,在解决该技术领域中所要解决的在动物医疗现场中处方人血清白蛋白(hsa)时发生的安全性问题、社会争论等各种问题方面,本发明的包含水稻悬浮细胞或源自其的重组白蛋白蛋白质的用于预防、改善或治疗低白蛋白血症的兽用药物组合物将作出很大的贡献。
附图说明
46.图1示出比较人、牛、狗及猫的血清白蛋白的蛋白质结构及氨基酸序列的结果。
47.图2为在图1的比较结果中比较作为在氨基酸序列中显出决定性差异的非保守序
列的ib结构域的氨基酸结构的结果。
48.图3为本发明中使用的狗白蛋白来源基因的碱基序列。
49.图4为本发明中使用的猫白蛋白来源基因的碱基序列。
50.图5示出在单子叶植物中用于表达狗或猫白蛋白基因的植物表达载体基因图谱。
51.图6示出在双子叶植物中用于表达狗或猫白蛋白基因的植物表达载体基因图谱。
52.图7为示出导入狗白蛋白基因的水稻愈伤组织的狗白蛋白生产程度的免疫印迹分析(western blot analysis)结果。
53.图8为示出导入猫白蛋白基因的水稻愈伤组织的猫白蛋白生产程度的免疫印迹分析结果。
54.图9为示出导入狗白蛋白基因的烟草植物体的狗白蛋白生产程度的免疫印迹分析结果。
55.图10为示出导入猫白蛋白基因的烟草植物体的猫白蛋白生产程度的免疫印迹分析结果。
56.图11为示出导入狗白蛋白基因的马铃薯植物体的狗白蛋白生产程度的免疫印迹分析结果。
57.图12为示出导入猫白蛋白基因的马铃薯植物体的猫白蛋白生产程度的免疫印迹分析结果。
58.图13示出通过酶联免疫吸附测定(elisa)分析确认本发明的狗白蛋白生产收率的结果。
59.图14示出通过酶联免疫吸附测定分析确认本发明的猫白蛋白生产收率的结果。
60.图15示出狗白蛋白及猫白蛋白蛋白质的结构域结构。
61.图16示出结合5'-utr、编码水稻淀粉酶3a(ramy3a)信号肽的基因以及编码狗白蛋白的成熟肽的基因的基因(kc11)的碱基序列。
62.图17示出结合5'-utr、编码大豆贮存蛋白a(vspa)的基因以及编码狗白蛋白的成熟肽的基因的基因(kc12)的碱基序列。
63.图18示出结合5'-utr、编码水稻淀粉酶3a(ramy3a)信号肽的基因以及编码猫白蛋白的成熟肽的基因的基因(kf11)的碱基序列。
64.图19示出结合5'-utr、编码大豆贮存蛋白a(vspa)的基因以及编码猫白蛋白的成熟肽的基因的基因(kf12)的碱基序列。
65.图20示出分别用于表达融合基因kc11、kc12、kf11及kf12的植物表达载体pkc11、pkc12、pkf11及pkf12的基因图谱。
66.图21为确认由pkc11转化的水稻悬浮细胞的重组狗白蛋白表达程度的免疫印迹分析结果。
67.图22为确认由pkc12转化的水稻悬浮细胞的重组狗白蛋白表达程度的免疫印迹分析结果。
68.图23为确认由pkf11转化的水稻悬浮细胞的猫白蛋白表达程度的免疫印迹分析结果。
69.图24为确认由pkf12转化的水稻悬浮细胞的猫白蛋白表达程度的免疫印迹分析结果。
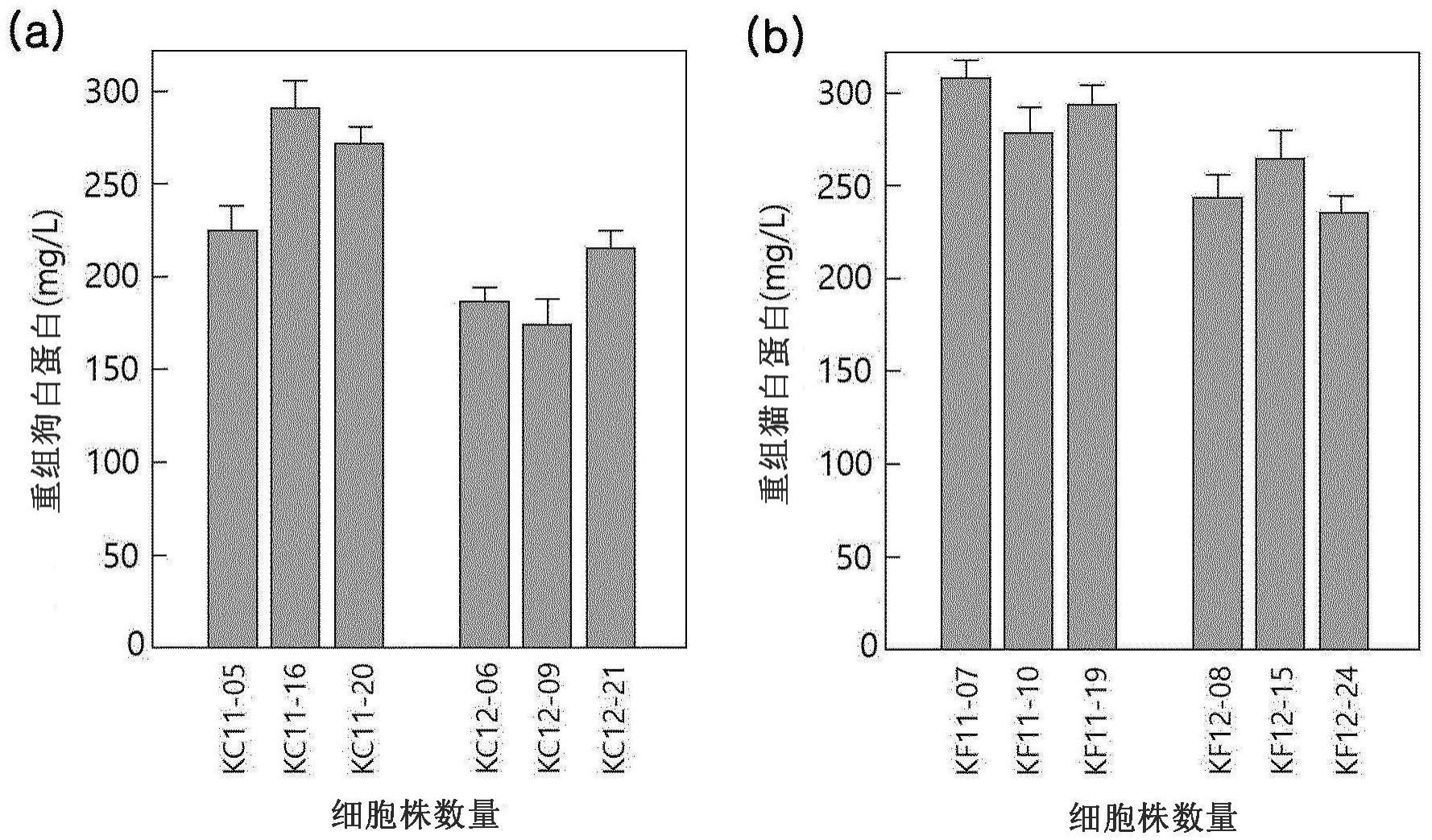
70.图25的(a)部分为示出在本发明的水稻悬浮细胞kc11-5、kc11-16、kc11-20及kc12-6、kc12-9、kc12-21中通过酶联免疫吸附测定分析确认狗白蛋白生产收率的结果,(b)部分为示出在水稻悬浮细胞kf11-7、kf11-10、kf11-19及kf12-8、kf12-15、kf12-24中通过酶联免疫吸附测定分析确认猫白蛋白生产收率的结果。
具体实施方式
71.本发明为了实现解决在动物医疗现场中处方人血清白蛋白时发生的安全性问题、社会争论等各种问题的目的,基于用于高效生产白蛋白的重组核酸、包含其的载体、包含上述载体的水稻悬浮细胞及包含上述细胞的用于预防、改善或治疗低白蛋白血症的兽用药物组合物来完成。
72.并且,本发明的通过上述水稻悬浮细胞来高效生产源自狗或猫的重组白蛋白的方法提供安全有效地大量生产狗专用重组狗血清白蛋白或猫专用重组猫血清白蛋白的独创的技术。
73.以下,通过实施例更为详细地说明本发明。应该注意的是,下述实施例仅包括发明的一部分实例,而非包括所有实例。通过本说明书公开的发明的内容不限定于在此说明的特定实施例,应该明白的是,本发明所属技术领域的普通技术人员可以多种多样地实施本发明。因此,应该理解的是,本说明书中公开的发明内容不限定于在此记载的特定实施例,有关于此的变形及其他实例都应包括在发明要求保护范围内。
74.实施例1.开发高效生产狗或猫白蛋白的细胞株
75.1.基因克隆及表达载体的制备
76.(1)狗或猫白蛋白基因和包含其的质粒载体
77.白蛋白基因为了基于狗白蛋白(uniprot p49822)和猫白蛋白(uniprot p49064)的基因信息来向植物载体导入,在狗白蛋白基因和猫白蛋白基因的5'-末端包含xbai位点,在3'-末端包含kpni位点,委托赛默飞世尔科技公司(thermo fisher scientific)进行基因的合成。
78.这样合成的狗白蛋白基因碱基序列(序列1)如图3所示,将包含上述狗白蛋白基因的质粒命名为pkct-1。并且,本发明中合成的猫白蛋白基因碱基序列(序列2)如图4所示,将包含上述猫白蛋白基因的质粒命名为pkft-1。
79.(2)制备用于向单子叶植物导入狗或猫白蛋白基因的植物表达载体
80.为了在单子叶植物水稻中诱导上述合成的狗白蛋白或猫白蛋白基因的高表达,向(株)nbm公司开发的单子叶植物高表达载体pmyn75中导入。pmyn75植物表达载体在缺失糖的培养基条件下在水稻的悬浮细胞中特异性表达。
81.使用kpni和xbai切割包含合成的狗白蛋白基因的质粒pkct-1及包含合成的猫白蛋白基因的质粒pkft-1后,分别导入pmy75载体的kpni和xbai位点来制备狗白蛋白基因表达载体pkcn11及猫白蛋白基因表达载体pkfn11。表达载体pkcn11及pkfn11的详细基因图谱如图5所示。
82.(3)用于向双子叶植物导入狗或猫白蛋白基因植物表达载体
83.为了在双子叶植物烟草和马铃薯中诱导上述合成的狗白蛋白或猫白蛋白基因的高表达,向(株)nbm公司开发并使用的双子叶植物高表达载体pmy27中导入。
84.使用kpni和xbai切割包含合成的狗白蛋白基因的质粒pkct-1及包含合成的猫白蛋白基因的质粒pkft-1后,分别导入pmy27载体的kpni和xbai位点来制备狗白蛋白基因表达载体pkcn12及猫白蛋白基因表达载体pkfn12。表达载体pkcn12及pkfn12的详细基因图谱如图6所示。
85.2.转化及高产植物细胞株的筛选
86.为了筛选高效生产源自狗或猫的白蛋白的最佳植物和表达系统,进行如下实验来在马铃薯、烟草、水稻中确立狗或猫的白蛋白生产技术。
87.(1)转化植物表达载体的农杆菌(agrobacterium)
88.在进行农杆菌介导的植物转化之前,通过三秦交配法(tri-parental mating)分别将上述构建的pkcn11和pkcn12以及pkfn11和pkfn12转化到根癌农杆菌(agrobacterium tumefaciens)lba4404中。
89.将分别包含在28℃的温度下暗培养2天的lba4404、pkcn11、pkcn12、pkfn11及pkfn12质粒的大肠杆菌、包含作为辅助质粒(helper plasmid)的prk2013的大肠杆菌在37℃的温度下培养16小时后,各取1ml来离心分离,使用lb培养基洗涤三次来去除各自包含的抗生素。
90.各取100μl的去除抗生素的分别包含pkcn11、pkcn12、pkfn11及pkfn12质粒的大肠杆菌和包含lba4404以及包含prk2013的大肠杆菌装入新的试管中,充分混合来均匀吸收于lb培养基中后,在28℃的温度下暗培养2天。
91.2天后,收集lb培养基中的细胞稀释后均匀吸收于包含利福平和卡那霉素的固体培养基中后,在28℃的温度下培养3天。3天后取生长的各个菌落来确认基因的插入。具体地,利用对狗白蛋白具有特异性的正向引物(序列3,f1:5'-gca agt acc tct acg aga tc-3')及反向引物(序列4,r1:5'-tgc gct cgg tct cag gct tc-3')对猫白蛋白具有特异性的正向引物(序列5,f2:5'-cag agc gca acg agt gct tc-3')及反向引物(序列6,r2:5'-tct gta cag cac ttc gtc ac-3')进行聚合酶链式反应(pcr)来使用确认基因插入的lba4404菌转化水稻、烟草及马铃薯。以下说明具体的实验方法。
92.(2)水稻转化
93.为了分别将狗白蛋白基因表达载体pkcn11和猫白蛋白基因表达载体pkfn11转化到水稻,使用70%的乙醇对去除种皮的水稻种子(品种名:东珍)进行表面消毒后,使用2%的漂白水消毒20分钟来在作为愈伤组织诱导培养基的n6ci固体培养基(每升含30g的蔗糖(sucrose),4.4g的n6盐(salt),1g的酪蛋白氨基酸(casamino acid)及2ppm的2,4-d,0.8%的琼脂)中各放置约16个,3周后,只分离出直径为3mm-4mm左右大小的乳白色愈伤组织并移到新的n6ci培养基后,3天后用在转化中。
94.在水稻愈伤组织中感染分别包含pkcn11和pkfn11的lba4404菌后,将其在包含100μm的乙酰丁香酮(acetosyringone)的n6co培养基(每升含30g的蔗糖,4.4g的n6盐,1g的酪蛋白氨基酸,10g的葡萄糖(glucose)及2ppm的2,4-d)以25℃的温度暗培养3天。
95.然后,取水稻愈伤组织先用水洗涤,再用包含500μg/ml的头孢噻肟(cefotaxime)的水洗涤后,将愈伤组织放到过滤纸上来去除多余的lba4404。放在n6s培养基(在n6ci培养基中追加50μg/ml的潮霉素b(hygromycin b)和500μg/ml的头孢噻肟)培养3周-4周左右。若出现潮霉素抗生素抗性,则只分离除新出现的愈伤组织移到新的培养基来增殖愈伤组织。
96.(3)烟草转化
97.烟草的转化使用已经通过horsch等报告的叶圆片(leaf-disc)方法进行。首先使用70%的乙醇消毒烟草(品种名:by-2)的叶1分钟,再用次氯酸钠消毒5分钟后,使用灭菌水洗涤后裁剪为1cm的大小后,接种分别包含pkcn12和pkfn12的lba4404菌后,放在ms-nb培养基(murashige-skoog,1mg/l的6-bap,0.1mg/l的naa)中进行共培养。
98.3天后,移植到包含抗生物质羧苄青霉素的ms-nb培养基中在去除多余的农杆菌的同时诱导愈伤组织。10天后放在包含卡那霉素(100mg/l)和羧苄青霉素(500mg/l)的ms-nb培养基中进行转化体的筛选。将从愈伤组织中形成的不定芽(adventitious bud)移到包含上述抗生物质的ms培养基后,通过再分化来筛选生出根部的植物体,将其在25℃、12小时光照条件的生长腔室中育成后,经过驯化过程移到花盆中进行栽培。
99.(4)马铃薯转化
100.马铃薯的转化使用已经通过stiekema等报告的块茎圆片(tuber-disc)法进行。首先,剥掉马铃薯(品种名:秀美)的块茎外皮并使用次氯酸钠(1%的氯浓度)进行表面杀菌后,使用灭菌水洗涤4次。使用灭菌的直径为1cm的软木转孔器采集上述块茎后切为3mm的厚度来制备块茎圆片。将马铃薯块茎切片各浸渍在悬浮有分别包含pkcn12和pkfn12的lba4404菌的ms液体培养基中15分钟来接种后,放在ms固体培养基中以21℃、16小时光照的条件共培养3天。
101.然后,使用包含卡那霉素(50mg/l)和羧苄青霉素(500mg/l)的ms液体培养基中洗涤块茎圆片后,在包含上述抗生物质和植物生长调节物质(0.1mg/l的iaa,0.1mg/l的ga3,0.1mg/l的aba,2mg/l的玉米素核苷(zeatin riboside))的ms固体培养基中以21℃、16小时光照的条件培养来进行多余农杆菌的去除和转化体的筛选。以2周的间隔将块茎圆片移到新的培养基,长出新枝(shoot)的个体为了促进根部的形成切去新枝,移植到未加入植物生长调节物质的ms固体培养基(加入50mg/l的卡那霉素)中育成转化体后,经过驯化过程移到花盆中进行栽培。
102.3.筛选白蛋白高产植物细胞株
103.(1)筛选白蛋白高产水稻细胞株
104.通过利用对狗或猫的白蛋白具有特异性的抗体的免疫印迹分析确认导入包含狗白蛋白基因的表达载体pkcn11的转化水稻愈伤组织或导入包含猫白蛋白基因的表达载体pkfn11的转化水稻愈伤组织是否生产白蛋白。
105.将10g的导入狗或猫白蛋白基因的转化水稻愈伤组织与10ml的提取缓冲液(50mm的tris-cl,ph8.2,0.5%的triton x-100,30mm的nacl,1mm的苯甲基磺酰氟(pmsf))混合后,利用研钵研磨来提取蛋白质。利用赛默飞世尔科技公司的iblot
tm
2gel transfer device按照提供的实验方法实施免疫印迹分析。对狗白蛋白的一次抗体使用bethyl laboratories公司的狗特异性抗体(bethyl a40-113a),对猫白蛋白的一次抗体使用毛特异性抗体(bethyl a20-109a)。
106.免疫印迹分析结果,在由狗白蛋白基因转化的水稻愈伤组织试样中,kcn11-r5及kcn11-r22试样中确认到推断为狗白蛋白的强的条带,因此将kcn11-r5及kcn11-r22愈伤组织筛选为狗白蛋白高产水稻的骨干品系(elite line)(图7),在由猫白蛋白基因转化的水稻愈伤组织试样中,在kfn11-r5、kfn11-r11及kfn11-r23试样中确认到推断为猫白蛋白的
强的条带,因此将kfn11-r5、kfn11-r11及kfn11-r23愈伤组织筛选为猫白蛋白高产水稻的骨干品系(图8)。
107.(2)筛选白蛋白高产烟草细胞株
108.通过利用对狗白蛋白具有特异性的抗体(bethyl a40-113a)或对猫白蛋白具有特异性的抗体(bethyl a20-109a)的免疫印迹分析确认导入包含狗白蛋白基因的表达载体pkcn12的转化烟草植物体或导入包含猫白蛋白基因的表达载体pkfn12的转化烟草植物体是否生产白蛋白,以10g的各转化植物体的叶为试样,以与上述“筛选白蛋白高产植物细胞株”相同的方法进行。
109.进行免疫印迹分析的结果,在由狗白蛋白基因转化的烟草植物体试样中,在kcn12-t3及kcn12-t4的试样中确认到推断为狗白蛋白的条带,因此将kcn12-t3及kcn12-t4植物体筛选为狗白蛋白高产烟草的骨干品系(图9),在由猫白蛋白基转化的烟草植物体试样中,在kfn12-t8及kfn12-t11中确认到推断为猫白蛋白的强的条带,因此将kfn12-t8及kfn12-t11植物体筛选为猫白蛋白高产烟草的骨干品系(图10)。
110.(3)筛选白蛋白高产马铃薯细胞株
111.通过利用对狗白蛋白具有特异性的抗体(bethyl a40-113a)或对猫白蛋白具有特异性的抗体(bethyl a20-109a)的免疫印迹分析确认导入包含狗白蛋白基因的表达载体pkcn12的转化马铃薯植物体或导入包含猫白蛋白基因的表达载体pkfn12的转化马铃薯植物体是否生产白蛋白,以10g的各转化植物体的叶为试样,以与上述“筛选白蛋白高产植物细胞株”相同的方法进行。
112.进行免疫印迹分析的结果,在由狗白蛋白基因转化的马铃薯植物体试样中,在kcn12-p1及kcn12-p9中确认到推断为狗白蛋白的条带,因此将kcn12-p1及kcn12-p9植物体筛选为狗白蛋白高产马铃薯的骨干品系(图11),在由猫白蛋白基因转化的马铃薯植物体试样中,在kfn12-p6及kfn12-p14中确认到推断为猫白蛋白的条带,因此将kfn12-p6及kfn12-p14植物体筛选为猫白蛋白高产马铃薯的骨干品系(图12)。
113.实施例2.确认高效生产狗或猫白蛋白的细胞株的生产收率
114.利用酶联免疫吸附测定方法确认通过实施例1筛选的高效生产狗或猫白蛋白的植物细胞株的白蛋白生产收率,以下,进行具体说明。
115.1.从狗和猫白蛋白高产植物愈伤组织及植物体中诱导悬浮细胞
116.(1)从狗和猫白蛋白高产转化水稻愈伤组织中诱导悬浮细胞
117.将在实施例1中筛选为高效生产狗白蛋白的水稻愈伤组织的kcn11-r5及kcn11-r22细胞株(图7)和筛选为高效生产猫白蛋白的水稻愈伤组织的kfn11-r5kfn11-r11及kfn11-r23细胞株(图8)接种于n6ci液体培养基(每升含30g的蔗糖,4.4g的n6盐,1g的酪蛋白氨基酸及2ppm的2,4-d)后,在25℃、暗培养条件下以间隔3周的方式进行传代培养来诱导悬浮细胞,每7天将1/5的培养基移到新鲜的培养基来传代培养。
118.(2)从狗和猫白蛋白高产转化烟草植物体中诱导悬浮细胞
119.使用70%的乙醇消毒实施例1中筛选为高效生产狗白蛋白的烟草转化植物体的kcn12-t3及kcn12-t4(图9)和筛选为高效生产猫白蛋白的烟草转化植物体的kfn12-t8及kfn12-t11(图10)的叶1分钟,再用次氯酸钠消毒5分钟后,使用灭菌水洗涤后切割为1cm的大小放在ms固体培养基(2mg/l的2,4-二氯苯氧乙酸2,0.02mg/l的激动素(kinetin),3%的
蔗糖及0.8%的琼脂)中在25℃、3000lux的条件下以间隔3周的方式传代培养来诱导愈伤组织。6周-8周后将诱导的愈伤组织接种到去除琼脂的50ml的ms液体培养基中后,在25℃、110rpm的旋转培养机中培养。每7天将培养物的1/5移到新鲜的培养基中来传代培养悬浮细胞。
120.(3)从狗和猫白蛋白高产转化马铃薯植物体中诱导悬浮细胞
121.使用70%的乙醇消毒实施例1中筛选为高效生产狗白蛋白的马铃薯转化植物体的kcn12-p1及kcn12-p9(图11)和筛选为高效生产猫白蛋白的马铃薯转化植物体的kfn12-p6及kfn12-p14(图12)的叶1分钟,再用次氯酸钠消毒5分钟后,使用灭菌水洗涤后切割为1cm的大小放在ms固体培养基(3mg/l的naa,2mg/l的iba,3%的蔗糖,0.8%的琼脂)中在25℃、暗培养条件下以间隔3周的方式传代培养来诱导愈伤组织。6周-8周后将诱导的愈伤组织接种到去除琼脂的50ml的ms液体培养基中后,在25℃、110rpm的旋转培养机中培养。每7天将培养物的1/5移到新鲜的培养基中来传代培养悬浮细胞。
122.2.利用酶联免疫吸附测定确认白蛋白生产收率
123.(1)制备用于进行酶联免疫吸附测定的试样
124.分别将适量的将通过液体培养保持的狗白蛋白高产水稻悬浮细胞kcn11-r5及kcn11-r22、烟草悬浮细胞kcn12-t3及kcn12-t4、马铃薯悬浮细胞kcn12-p1及kcn12-p9、猫白蛋白高产水稻悬浮细胞kfn11-r5、kfn11-r11及kfn11-r23、烟草悬浮细胞kfn12-t8及kfn12-t11、马铃薯悬浮细胞kfn12-p6及kfn12-p14放在灭菌的真空过滤漏斗的过滤纸上,启动真空去除液体培养基后,各取10g的去除液体培养基的悬浮细胞,将烟草和马铃薯悬浮细胞放在50ml的与培养悬浮细胞时相同的液体培养基中进行培养。水稻悬浮细胞则放在50ml的与培养悬浮细胞时使用的液体培养基成分相同但去除蔗糖的液体培养基来实施培养,重复培养各悬浮细胞三次后,取第五天的液体培养基来定量白蛋白的量。
125.为了酶联免疫吸附测定分析,将1ml的各悬浮细胞培养液以4℃、200xg的条件离心分离10分钟来分离为上清液和细胞颗粒后,在4℃的温度下在磷酸盐缓冲溶液上透析一夜,将透析的培养上清液用作试样。狗白蛋白生产量的确认使用狗白蛋白酶联免疫吸附测定试剂盒(elisa kit)(ab277078,abcam公司,英国(uk)),猫白蛋白生产量的确认使用猫白蛋白酶联免疫吸附测定试剂盒(deiabl383,creative diagnostics公司,美国(usa))进行定量分析,分析方法根据各试剂盒随附的说明书重复进行3次。
126.有关狗白蛋白高产水稻悬浮细胞(kcn11-r5、kcn11-r22)、烟草悬浮细胞(kcn12-t3、kcn12-t4)、马铃薯悬浮细胞(kcn12-p1、kcn12-p9)的酶联免疫吸附测定结果如图13所示。狗白蛋白高产烟草悬浮细胞的白蛋白生产收率最大约为3mg/l,马铃薯悬浮细胞的白蛋白生产收率最大约为5mg/l,而水稻悬浮细胞的狗白蛋白生产收率最大约为34mg/l,确认到烟草悬浮细胞的约10倍,马铃薯悬浮细胞的约7倍以上的高生产收率。
127.有关猫白蛋白高产水稻悬浮细胞(kfn11-r5、kfn11-r11、kfn11-r23)、烟草悬浮细胞(kfn12-t8、kfn12-t11)、马铃薯悬浮细胞(kfn12-p6、kfn12-p14)的酶联免疫吸附测定结果如图14所示。猫白蛋白高产烟草悬浮细胞的猫白蛋白生产收率最大约为9mg/l,马铃薯悬浮细胞的猫白蛋白生产收率最大约为9mg/l,而水稻悬浮细胞的猫白蛋白生产收率最大约为58mg/l,确认到与烟草和马铃薯悬浮细胞相比高6.5倍以上的生产收率。
128.确认到为了通过上述实施例2.2在植物中生产狗或猫的重组白蛋白,将包含狗或
猫白蛋白基因的植物表达载体导入水稻愈伤组织中来生产的组合最为优选。
129.3.确认源自水稻的狗和猫白蛋白的n-末端氨基酸序列
130.确认了在上述水稻的悬浮细胞中生产的狗白蛋白或猫白蛋白的n-末端氨基酸序列。
131.取100ml的生产狗白蛋白水稻悬浮细胞kcn11-r5培养液和100ml的生产猫白蛋白的水稻悬浮细胞kfn11-r11培养液,利用0.45μm孔隙(pore)大小的过滤器过滤后,利用30kda的中空纤维(hollow fiber)过滤器截止(cut-off)后,使用hiscreen blue sepharose ff(cytiva公司,28978243)色谱柱根据生产公司提供的说明书从浓缩液中分离纯化白蛋白。委托(株)lifesciencelaboratory公司利用埃德曼降解法(edman degradation)分析纯化的狗及猫白蛋白的氨基酸序列。
132.通过本发明的实施例1中使用的狗白蛋白(uniprot p49822)和猫白蛋白(uniprot p49064)的信息可知狗和猫的白蛋白都由信号肽(signal peptide,1~18)、前肽(propeptide,19~24)、成熟肽(mature peptide,25~608)构成。
133.氨基酸序列分析结果,从水稻悬浮细胞中生产的狗白蛋白的n-末端氨基酸序列确认到r-g-l-v-r和l-v-r-r-e两种,r-g-l-v-r包含图15的示意图所示的其廍前肽,l-v-r-r-e在前肽的第21个中包含第24个氨基酸(图15)并且,确认从水稻悬浮细胞中生产的猫白蛋白的n-末端氨基酸序列的结果,确认到r-g-v-t-r和v-t-r-r-e两种,r-g-v-t-r包含图15所示的所有前肽,v-t-r-r-e在前肽的第21个中包含第24位氨基酸。
134.上述结果表明,在本发明的从水稻悬浮细胞中生产的狗白蛋白或猫白蛋白蛋白质的情况下,表达为前肽序列未完全被去除的未成熟白蛋白。于是在本发明中进行了表达与存在于狗或猫血液中的自然形态的成熟蛋白质相同的蛋白质的追加实验。
135.实施例3.从水稻悬浮细胞中生产与自然状态的成熟蛋白质相同的重组狗或猫白蛋白的方法
136.通过实施例2确认的结果,从水稻悬浮细胞中生产的狗白蛋白和猫白蛋白的蛋白质的n-末端与源自狗和猫的自然型成熟蛋白质不同,因此应确认大量生产n-末端序列与自然型相同的重组白蛋白的技术。
137.信号肽为存在于蛋白质分子中的由3个-60个氨基酸构成的肽序列,指示在细胞质中生物合成的蛋白质的输送(transport)和定位(localization)。已知指示向细胞核、高尔基体、线粒体、叶绿体等细胞器输送及定位的特定序列。其中,向细胞外分泌(通过内质网的输送)的内质网信号肽为存在于蛋白质分子的n-末端的包含5个-10个疏水性(hydrophobic)氨基酸的序列。这些内质网信号肽(sp)被利用在有效生产多种外来蛋白质的生产(分泌)系统中,在提高目标蛋白质的生产效率方面,最佳信号肽的选择及其正确度(正确的切割)起到非常重要的作用。
138.导入表达载体中的信号肽根据其种类在目标蛋白质的生产效率上显出很大差异,由于不存在生物种之间保存的序列,因此需要通过多种信号肽的组合来探索显出最高生产效率的最佳的信号肽序列。
139.1.筛选最佳的信号肽
140.(1)筛选狗和猫重组白蛋白生产中的最佳信号肽
141.已知哺乳动物的白蛋白在形成三维结构的过程中通过作为内肽酶的furine切割
前肽来形成成熟的白蛋白蛋白质。如在本发明的实施例2中确认的,在从水稻悬浮细胞中生产狗或猫的重组白蛋白的情况下,由于水稻中不存在存在于哺乳动物中的作为内肽酶的furine,因此无法实现前肽的切割,结果为生产的白蛋白的n-末端序列与狗或猫的自然型成熟蛋白质不同。
142.于是,探索在本发明的水稻悬浮细胞中表达狗或猫的自然型成熟蛋白质的最佳的信号肽序列。调查在植物中生产重组蛋白质方面使用的技术,利用蛋白质信号肽序列相关数据库(http://proline.bic.nus.edu.sg/spdb)最终导出13个信号肽序列。将导出的13种信号肽序列与狗或猫白蛋白的成熟肽结合后,利用signalp-5.0服务器(http://www.cbs.dtu.dk/services/signalp/)确认它们正确切割信号肽序列的能力。
143.利用signalp-5.0程序确认信号肽序列的切割可能性的结果如表1和表2所示。将13种信号肽氨基酸序列与狗和猫的成熟肽序列连接后,确认信号肽切割可能性的结果,确认到尤其在与水稻淀粉酶3a信号肽序列(mgkqmaalcgfllvallwltpdvaha,序列11)或大豆贮存蛋白a信号肽序列(mkmvvlvffvatilvawqcha,序列12)结合的情况下,在狗和猫白蛋白中都显出最高的从信号肽中七个的可能性。
144.表1
145.确认根据信号肽序列的狗白蛋白的切割部位
146.[0147][0148]
表2
[0149]
确认根据信号肽序列的猫白蛋白的切割部位
[0150]
[0151][0152]
2.基因合成及表达载体的制备
[0153]
(1)基因合成及表达载体的制备
[0154]
如在本发明的上述实施例2中确认的,在从水稻悬浮细胞中生产白蛋白的情况下,确认到未以与狗或猫血液中存在的白蛋白相同的方式在n-末端切割,狗或猫白蛋白的前肽的一部分(4个~6个氨基酸)仍存在于狗或猫白蛋白的成熟肽n-末端。
[0155]
基于该结果,在狗或猫白蛋白的成熟肽n-末端直接连接本实施例3中筛选的水稻淀粉酶3a信号肽或大豆贮存蛋白a信号肽来表达蛋白质后,在与狗和猫血液中存在的蛋白质相同的n-末端进行切割。
[0156]
利用赛默飞世尔科技公司的主页中提供的的geneart
tm
geneoptimizer
tm
程序使用水稻的密码子最佳化后,委托赛默飞世尔科技公司合成狗白蛋白基因和猫白蛋白基因。融合有5'-utr、编码水稻淀粉酶3a信号肽以及狗白蛋白的成熟肽的基因的基因(kc11)碱基序列(序列7)如图16所示,将这样包含合成的重组狗白蛋白基因的质粒命名为pkct-3。融合5'-utr、编码大豆贮存蛋白a信号肽和狗白蛋白的成熟肽的基因(序列8)的基因(kc12)的碱基序列如图17所示,将这样合成的包含上述合成的重组狗白蛋白基因的质粒命名为pkct-4。
[0157]
同样,融合5'-utr、编码ramy3a信号肽和猫白蛋白的成熟肽的基因的基因(kf11)的碱基序列(序列9)如图18所示,将包含这样合成的重组猫白蛋白基因的质粒命名为pkft-3,融合5'-utr、编码vspa信号肽和猫白蛋白的成熟肽的基因的基因(kf12)碱基序列(序列10)如图19所示,将包含这样合成的猫白蛋白基因的质粒命名为pkft-4。
[0158]
为了在单子叶植物水稻中高诱导上述合成的重组狗白蛋白和重组猫白蛋白基因的高表达,导入本发明的实施例1中使用的单子叶植物高表达载体pmyn75。分别使用kpni和xbai切割包含使用植物密码子最佳化的重组狗白蛋白基因的pkct-3及pkct-4后,导入pmyn75载体的kpni和xbai位点来分别制备重组狗白蛋白基因表达载体pkc11及pkc12。其详细基因图谱如图20所示。
[0159]
并且,分别使用kpni和xbai切割包含使用植物密码子最佳化的重组猫白蛋白基因的pkft-3及pkft-4后,导入pmyn75载体的kpni和xbai位点来分别制备重组猫白蛋白基因表达载体pkf11及pkf12。其详细基因图谱如图20所示。
[0160]
3.水稻转化及高产细胞株的筛选
[0161]
(1)水稻转化及高产细胞株的筛选
[0162]
根据实施例1所述的方法分别将上述pkc11、pkc12、pkf11及pkf12载体导入农杆菌和水稻中,通过进行实施例1所述的免疫印迹分析法在转化的水稻愈伤组织中确认白蛋白的生产性。
[0163]
分析通过转化包含融合有ramy3a信号肽和狗白蛋白的成熟肽的基因的pkc11来筛选的23个系统的愈伤组织的结果,在kc11-5、kc11-16及kc11-20细胞株中确认到强的条带,从而筛选为重组狗白蛋白高产细胞株(图21)。并且,分析通过转化包含融合有vspa信号肽与狗白蛋白的成熟肽的基因pkc12来筛选的23个系统的愈伤组织的结果,在kc12-6、kc12-9及kc12-21细胞株中确认到强的条带,从而筛选为重组狗白蛋白高产细胞株(图22)。
[0164]
并且,分析通过转化包含融合有ramy3a信号肽和猫白蛋白的成熟肽的基因的pkf11来筛选的25个系统的愈伤组织的结果,在kf11-7、kf11-10及kf11-19细胞株中确认到强的条带,从而筛选为重组猫白蛋白高产细胞株(图23)。分析通过转化包含融合有vspa信号肽与狗白蛋白的成熟肽的基因pkf12来筛选的24个系统的愈伤组织的结果,在kf12-8、kf12-15及kf12-24细胞株中确认到强的条带,从而筛选为重组猫白蛋白高产细胞株(图24)。
[0165]
4.确认白蛋白生产收率
[0166]
(1)确认利用酶联免疫吸附测定的重组狗白蛋白生产收率
[0167]
以与本发明的上述实施例2所述相同的酶联免疫吸附测定方法确认上述筛选的重组狗白蛋白高产水稻悬浮细胞kc11-5、kc11-16、kc11-20、kc12-6、kc12-9及kc12-21的重组狗白蛋白生产收率,结果如图25的(a)部分所示。
[0168]
确认导入pkc11的转化悬浮细胞株的重组狗白蛋白的生产收率的结果,kc11-5悬浮细胞株示出约250mg/l的生产收率,kc11-16悬浮细胞株示出约290mg/l的生产收率,kc11-20悬浮细胞株示出约270mg/l的生产收率。并且,确认导入pkc12的转化愈伤组织的重组狗白蛋白的生产收率的结果,kc12-6悬浮细胞株示出约180mg/l的生产收率,kc12-9悬浮细胞株示出约170mg/l的生产收率,kc12-21悬浮细胞株示出约220mg/l的生产收率。在使用水稻淀粉酶3a信号肽的情况下,根据信号肽的重组狗白蛋白的生产收率示出约50mg/l的更
高的生产收率。
[0169]
该结果与使用在本发明的实施例2中确认的狗白蛋白的信号肽序列时在重组狗白蛋白高产kcn11-r5悬浮细胞株中确认的约34mg/l的生产收率相比,在使用ramy3a信号肽时提高约8倍~10倍的生产性,使用vspa信号肽时提高约5倍~6.5倍的生产性。
[0170]
本发明人将实施例3中完成的重组狗白蛋白高产kc11-16水稻细胞株特许保藏在韩国生命工学研究院生物资源中心(kctc)(保藏编号:kctc 14618bp)。并且,通过本实施例3确认到为了在植物中大量生产重组狗白蛋白,与使用狗的信号肽相比,使用水稻淀粉酶3a信号肽或大豆贮存蛋白a信号肽更为有效,优选地,使用ramy3a信号肽更为有效。
[0171]
(2)确认利用酶联免疫吸附测定的重组猫白蛋白生产收率
[0172]
以与本发明的上述实施例2所述相同的酶联免疫吸附测定方法确认上述筛选的重组狗白蛋白高产水稻悬浮细胞kf11-7、kf11-10、kf11-19、kf12-8、kf12-15及kf12-24的重组猫白蛋白生产收率,结果如图25的(b)部分所示。
[0173]
确认导入pkf11的转化悬浮细胞株的重组猫白蛋白的生产收率的结果,kf11-7悬浮细胞株示出约310mg/l的生产收率,kf11-10悬浮细胞株示出约280mg/l的生产收率,kf11-19悬浮细胞株示出约290mg/l的生产收率,平均示出约290mg/l的生产收率。确认导入pkf12的转化愈伤组织的重组猫白蛋白的生产收率的结果,kf12-8悬浮细胞株示出约240mg/l的生产收率,kf12-15悬浮细胞株示出约260mg/l的生产收率,kf12-24悬浮细胞株示出约230mg/l的生产收率,平均示出约243mg/l的生产收率。根据信号肽的重组猫白蛋白生产收率在使用水稻淀粉酶3a信号肽时示出平均高出约47mg/l的生产收率。
[0174]
该结果与使用在本发明的实施例2中确认的猫白蛋白的信号肽序列时在重组猫白蛋白高产kfn11-r11悬浮细胞株中确认的约58mg/l的生产收率相比,在使用ramy3a信号肽时提高约5倍的生产性,使用vspa信号肽时提高约4倍的生产性。
[0175]
本发明人将实施例3中完成的重组猫白蛋白高产kf11-7水稻细胞株特许保藏在韩国生命工学研究院生物资源中心(kctc)(保藏编号:kctc 14617bp)。并且,确认到为了通过本实施例3在植物中大量生产重组猫白蛋白,与使用猫的信号肽相比,使用ramy3a信号肽或vspa信号肽更为有效,优选地,使用ramy3a信号肽更为有效。
[0176]
5.确认重组白蛋白的n-末端氨基酸序列
[0177]
以与实施例2所述相同的方法确认在导入pkc11的重组狗白蛋白的高产kc11-16和导入pkc12的重组狗白蛋白的高产kc12-21细胞株中生产的重组狗白蛋白的n-末端氨基酸序列。结果,在kc11-16和kc12-21细胞株中生产的重组狗白蛋白都确认到e-a-y-k-s,确认到这与狗血液中存在的自然状态的狗白蛋白蛋白质和n-末端序列相同。
[0178]
并且,以与实施例2所述相同的方法确认导入pkf11的重组狗白蛋白的高产kf11-07和导入pkf12的重组狗白蛋白的kf12-15。结果,在kf11-07和kf12-15细胞株中生产的重组猫白蛋白都确认到e-a-h-q-s。由此确认与猫血液中存在的自然状态的成熟的猫白蛋白和n-末端序列相同。
[0179]
实施例4.评估重组狗或猫白蛋白的功效
[0180]
通过动物实验评估通过上述实施例3生产的重组狗或猫白蛋白的功效。委托(株)huvetbio公司实施动物实验。
[0181]
现在,在动物医院中,对于患有低白蛋白血症的动物的治疗使用以人为对象制备
的白蛋白剂,据报告,有颜面部浮肿等副作用。本发明中使用的重组狗白蛋白为源自植物的白蛋白,为实际在动物医院中应用于患病动物而制备,在本试验中,使用了实际动物医院中的患病的狗及猫。
[0182]
(1)重组狗白蛋白在低白蛋白血症模型中的功效
[0183]
从orientbio公司购入体重为10kg~10.6kg的10月龄的雄性比格犬(beagle dog),实施所有关于动物的一般健康状态的兽医学检疫后,进行7天的驯化、饲育。饲育室的温度保持在24
±
2℃,湿度保持40%~60%,明暗周期保持12小时,提供市面上出售的狗专用饲料和纯水供其自由摄取。在得到(株)huvetbio公司企业附属研究所的动物研究伦理委员会(iacuc)的认可后实施实验(许可号:hv 2022-002),试验组由放血全血的8%后给药生理盐水(0.9%的普通生理盐水(0.9%normal saline))的对照组(n=3)和放血全血的8%后给药重组狗白蛋白的白蛋白给药组(n=3)组成。
[0184]
向经过驯化的实验动物分别以0.1ml/kg、0.1ml/kg的量混合注射氯胺酮(ketamine hydrochloride,50mg/ml,柳韩洋行公司)与甲苯噻嗪盐酸盐注射液(xylazine hydrochloride,23.32mg/ml,bayerkorea公司)来麻醉后,在头静脉(cephalic vein)中确保导管后使用10cc的注射器缓缓诱导放血。放血作为全血8%的70ml。以放血后确认白蛋白含量减少的个体为对象,将50ml的生理盐水与重组狗白蛋白(2g/10ml/vial)以与实验动物的体重相对应的2g/5kg的剂量利用输液泵(infusion pump)以70ml/h的速度向静脉(intravenous)注入。分别在放血前、放血后、重组给药狗白蛋白一天后、三天后、七天后采血来分析血球检查(bc-2800vet,mindray公司)及血清生化检查(pt10v,samsung公司)数值变化。
[0185]
表3
[0186]
主要血液数值变化
[0187]
[0188][0189]
上述表3为实验动物的放血前(起点)、放血后、注入白蛋白1天后、3天后以及7天后的血液数值变化的分析结果,下述表4及表5以放血前数值为基准换算为百分比(%)。
[0190]
表4
[0191]
对照组(生理盐水(saline))的血液数值变化(以放血前数值为基准,%)
[0192]
[0193][0194]
表5
[0195]
白蛋白给药组的血液数值变化(以放血前数值为基准,%)
[0196][0197]
确认到在对照组与重组狗白蛋白给药组之间观察到大差异的时间点为注入试验物质1天后的时间点,这时,相对于对照组,观察到白蛋白给药组中的白蛋白增加比例高出约9.2%,可以确认至少在血液中保持到第七天。并且,除上述数值以外,在血细胞检查中没有观察到注入试验材料后炎症数值增加等异常数值变化,在血清生化检查中确认到肝和肾脏的数值正常。并且,通过腹部穿刺采取尿后检查尿时未观察到异常数值,也未观察到颜面部浮肿等因注入白蛋白引起的副作用。通过上述结果认为给药重组狗白蛋白有助于无副作用地提高白蛋白数值。
[0198]
(2)重组猫白蛋白在低白蛋白血症模型中的功效
[0199]
从orientbio公司购入体重为4.5kg~5kg的10月龄的雄性猫,实施所有关于动物
的一般健康状态的兽医学检疫后,进行7天的驯化、饲育。饲育室的温度保持在24
±
2℃,湿度保持40%~60%,明暗周期保持12小时,提供市面上出售的猫专用饲料和纯水供其自由摄取。在得到(株)huvetbio公司企业附属研究所的动物研究伦理委员会的认可后实施实验(许可号:hv 2022-002),试验组由放血全血的8%后给药生理盐水(0.9%的普通生理盐水)的对照组(n=3)和放血全血的8%后给药重组狗白蛋白的白蛋白给药组(n=3)组成。
[0200]
向经过驯化的实验动物分别以0.1ml/kg、0.1ml/kg的量混合注射氯胺酮(50mg/ml)与甲苯噻嗪盐酸盐注射液(23.32mg/ml)来麻醉后,在头静脉(cephalic vein)中确保导管后使用10cc的注射器缓缓诱导放血。放血作为全血8%的35ml。以放血后确认白蛋白含量减少的个体为对象,将25ml的生理盐水与重组猫白蛋白(2g/10ml/vial)以与实验动物的体重相对应的2g/5kg的剂量利用输液泵(infusion pump)以35ml/h的速度向静脉注入。分别在放血前、放血后、重组给药狗白蛋白一天后、三天后、七天后采血来分析血细胞检查及血清生化检查数值变化。
[0201]
表6
[0202]
主要血液数值变化
[0203][0204][0205]
上述表6为实验动物的放血前(起点)、放血后、注入白蛋白1天后、3天后以及7天后的血液数值变化的分析结果,下述表7及表8以放血前数值为基准换算为百分比(%)。
[0206]
表7
[0207]
对照组(生理盐水(saline))的血液数值变化(以放血前数值为基准,%)
[0208][0209]
表8
[0210]
白蛋白给药组的血液数值变化(以放血前数值为基准,%)
[0211][0212][0213]
确认到在对照组与重组猫白蛋白给药组之间观察到大差异的时间点为注入试验
物质1天后的时间点,这时,相对于对照组,观察到白蛋白给药组中的白蛋白增加比例高出约10.1%,可以确认至少在血液中保持到第七天。并且,与利用狗的实验相同,未观察到任何副作用。通过上述结果认为给药重组猫白蛋白有助于无副作用地提高白蛋白数值。
[0214]
[0215]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。