1.本发明属于纳米工程和动物病毒学技术领域,具体涉及一种苦参碱碳量子点及其制备方法和应用。
背景技术:
2.碳量子点(carbondots,cds),又称碳点或碳纳米点,是一类尺寸在10nm以下的零维碳质纳米材料,碳量子点具有良好的光致发光性、良好的生物相容性、低生物毒性和抗光漂白性,以及合成成本低等特点,目前被广泛应用于生物成像、生物传感、生物标记、光动力治疗和药物输送等领域。
3.苦参碱(matrine)是从豆科的槐属、野决明属及山豆根属等植物提取的生物碱,具有多种生物活性,包括抗寄生虫、抗细菌、抗真菌及抗病毒等作用。猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,prrsv)属于动脉炎病毒科动脉炎病毒属,主要引起妊娠母猪流产、死胎、木乃伊胎、弱仔等繁殖障碍以及仔猪的呼吸系统疾病和死亡。由于缺乏安全有效的疫苗和特效治疗药物,prrsv自发现以来一直严重危害着世界养猪业的健康发展,给世界养猪业造成了巨大的经济损失。有文献报道苦参碱对prrsv在marc-145细胞上的增殖有一定的抑制作用,但其效果不理想。
技术实现要素:
4.本发明的目的在于提供一种苦参碱碳量子点,与苦参碱相比,所述苦参碱碳量子点对动脉炎病毒科病毒具有更强的抑制作用。
5.本发明提供了一种苦参碱碳量子点,所述苦参碱碳量子点的直径为1.3~3.7nm,晶格间距为0.24nm,最佳激发波长优选为380~390nm,最佳发射波长优选为460~465nm。
6.本发明还提供了上述技术方案所述的苦参碱碳量子点的制备方法,包括如下步骤:将苦参碱粉末在加压的条件下进行加热,对加热得到的产物溶解后进行纯化,得到含有所述苦参碱碳量子点的溶液。
7.优选的,所述加热的温度为140~220℃,时间为1~6h。
8.优选的,所述加热于反应釜中进行。
9.优选的,所述纯化包括:将所述产物冷却后溶解,对溶解后的溶液离心去沉淀,得到产物溶液;
10.将所述产物溶液用滤膜过滤并透析,得到含有所述苦参碱碳量子点的溶液。
11.优选的,所述过滤用滤膜的孔径为0.22μm。
12.优选的,所述透析使用截留分子量为500da的透析袋。
13.本发明还提供了上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点在抑制动脉炎病毒科病毒增殖中的应用。
14.本发明还提供了上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点在制备防治猪繁殖与呼吸综合征的药物中的应用。
15.本发明还提供了一种防治猪繁殖与呼吸综合征的药物,所述药物的有效成分包括上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点。
16.有益效果:
17.本发明提供了一种苦参碱碳量子点,所述苦参碱碳量子点的直径为1.3~3.7nm,晶格间距为0.24nm,最佳激发波长优选为380~390nm,最佳发射波长优选为460~465nm。所述苦参碱碳量子点具有粒径小,水溶性高、生物相容性好,且保留了苦参碱主要官能团,对包括猪繁殖与呼吸综合征病毒在内的动脉炎病毒科病毒的增殖具备更好的抑制作用,可用于猪繁殖与呼吸综合征的防治,促进养猪业的健康发展。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单的介绍。
19.图1为本发明实施例1中合成苦参碱碳量子点(matrine-cds)的流程示意图;
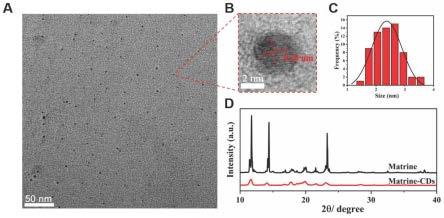
20.图2为本发明测试例1中对matrine-cds的表征结果,其中a和b为matrine-cds在透射电子显微镜下的图像,c为matrine-cds的粒径分布图,d为matrine-cds的x射线衍射光谱图;
21.图3为本发明测试例1中对实施例1~5中matrine-cds的荧光激发和发射光谱;
22.图4为本发明测试例1中对实施例1中matrine-cds的表征结果,其中a为紫外吸收光谱、荧光激发和发射光谱,b为傅里叶转换红外光谱(ft-ir),c为xps全扫描光谱,d-f分别为matrine-cds的c1s谱、n 1s谱、o 1s谱;
23.图5为本发明测试例2中对实施例1~5中matrine-cds(b-f)及matrine(a)的细胞毒性检测结果,横坐标为matrine或matrine-cds的浓度,纵坐标为细胞的相对活力;
24.图6为本发明测试例3中实施例1~5中matrine-cds及matrine抑制prrsv增殖的tcid
50
检测结果。
25.图7为本发明测试例3中实施例1中matrine-cds及matrine抑制prrsv增殖的tcid
50
检测结果;
26.图8为本发明测试例3中prrsv wuh3株接种12h时,实施例1中matrine-cds对prrsv增殖影响的间接免疫荧光法(ifa)检测结果,标尺为50μm;
27.图9为本发明测试例3中prrsv wuh3株接种24h时,实施例1中matrine-cds对prrsv增殖影响的间接免疫荧光法(ifa)检测结果,标尺为50μm;
28.图10为本发明测试例3中prrsv wuh3株接种36h时,实施例1中matrine-cds对prrsv增殖影响的间接免疫荧光法(ifa)检测结果,标尺为50μm;
29.图11为本发明测试例3中浓度为125μg/ml的实施例1中matrine-cds抑制prrsv增殖的westernblot检测结果;
30.图12为本发明测试例3中浓度为250μg/ml的实施例1中matrine-cds抑制prrsv增殖的westernblot检测结果;
31.图13为本发明测试例3中浓度为500μg/ml的实施例1中matrine-cds抑制prrsv增殖的westernblot检测结果。
具体实施方式
32.本发明提供了一种苦参碱碳量子点,所述苦参碱碳量子点的直径为1.3~3.7nm,晶格间距为0.24nm,最佳激发波长为380~390nm,最佳发射波长为460~465nm。
33.本发明所述苦参碱碳量子点(matrine-cds)的平均直径优选为2.4nm。本发明所述苦参碱量子点的最佳激发波长优选为390nm。本发明所述苦参碱量子点的最佳发射波长优选为465nm。本发明所述苦参碱碳量子点表面包括羟基和羰基,且羟基为苦参碱当中所不具备的官能团,可以增强苦参碱碳量子点的溶解性。本发明所述苦参碱碳量子点优选包括c、n和o三种元素;以百分比计,所述三种元素的含量依次优选为78.11%、10.67%和11.22%。本发明所述苦参碱碳量子点优选包括官能团c-h、o=c-nh、c-n和-oh,所述-oh为苦参碱中所没有的官能团。
34.本发明还提供了上述技术方案所述的苦参碱碳量子点的制备方法,包括如下步骤:将苦参碱粉末在加压的条件下进行加热,对加热得到的产物进行纯化,得到含有所述苦参碱碳量子点的溶液。
35.本发明优选对苦参碱进行研磨,得到苦参碱粉末。本发明对所述研磨的方式没有特殊限定,采用本领域中常规研磨方式即可。本发明对所述苦参碱粉末的粒径没有特殊限定,采用本领域中常规认定的粉末状态即可。本发明所述苦参碱的纯度优选为98%。本发明对所述苦参碱的来源没有特殊限定,采用本领域中常规市售产品即可。
36.得到所述苦参碱粉末后,本发明将所述苦参碱粉末在加压条件下进行加热。本发明所述加热的温度优选为140~220℃,进一步优选为180~210℃,更优选为200℃;所述加热的时间优选为1~6h,进一步优选为1.5~4.5h,更优选为2h。本发明所述加热优选于反应釜中进行;在本发明的实施例中,所述加热是在内衬为聚四氟乙烯的反应釜中进行。本发明所述苦参碱在加热条件下部分碳化。
37.所述加热后,本发明对加热得到的产物进行纯化,得到含有所述苦参碱碳量子点的溶液。
38.本发明所述纯化优选包括:将所述产物冷却后用水溶解,对溶解后的溶液离心去沉淀,得到产物溶液;将所述产物溶液用滤膜过滤并透析,得到含有所述苦参碱碳量子点的溶液。
39.本发明优选对加热得到的产物冷却后溶解。本发明所述冷却后的温度优选为室温,更优选为25℃。本发明所述溶解的溶剂优选为水,更优选为去离子水。本发明所述产物与水的质量体积比优选为0.1~1g:10ml,更优选为0.2g:10ml。本发明优选以超声辅助所述溶解,所述超声的频率优选为40khz;所述超声的功率优选为100w;所述超声的时间优选为0.5~2h,更优选为1h。
40.所述溶解后,本发明优选对溶解后的溶液离心去沉淀,得到产物溶液。本发明所述离心的转速优选为4000~13000rpm,更优选为12000rpm;所述离心的时间优选为0.5~1.5h,更优选为1h。
41.得到所述产物溶液后,本发明优选采用微孔滤膜对所述产物溶液进行过滤,所述滤膜的孔径优选为0.22μm。本发明所述滤膜优选为水相滤膜。
42.所述过滤后,本发明优选对所述微孔滤膜过滤得到的溶液进行透析,得到含有所述苦参碱碳量子点的溶液。本发明所述透析优选包括采用截留分子量为100~1000da的透
析袋对所述过滤得到的溶液透析2~10h,每2h换一次水。本发明所述透析袋的截留分子量优选为500da;所述透析的时间优选为8h。
43.得到所述含有所述苦参碱碳量子点的溶液后,本发明优选对所述溶液进行真空冷冻干燥,得到苦参碱碳量子点。
44.本发明还提供了上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点在抑制动脉炎病毒科病毒增殖中的应用。本发明所述动脉炎病毒科病毒优选为猪繁殖与呼吸综合征病毒。
45.基于所述苦参碱碳量子点在抑制动脉炎病毒科病毒增殖中的用途,本发明还提供了上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点在制备防治猪繁殖与呼吸综合征的药物中的应用。本发明所述苦参碱碳量子点以苦参碱为原料进行制备,较常规苦参碱具备更高的生物相容性和更低的生物毒性,粒径更小,对包括猪繁殖与呼吸综合征病毒在内的动脉炎病毒科病毒的增殖具备更好的抑制作用,可用于防治猪繁殖与呼吸综合征的药物的制备,具有更好的应用前景。
46.本发明还提供了一种防治猪繁殖与呼吸综合征的药物,所述药物的有效成分包括上述技术方案所述的苦参碱碳量子点或所述制备方法制备得到的苦参碱碳量子点。
47.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细的描述,但不能将它们理解为对本发明保护范围的限定。
48.下述实施例中所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
49.在本发明的实施例中,用到的部分试剂如下:
50.细胞培养液为dulbecco's modified eagle medium(dmem)细胞生长液,细胞维持液为dmem细胞维持液;
51.具体配制方法及成分如下:
52.dmem细胞基础培养液:将dmem粉剂13.3g溶于950ml超纯水中,搅拌至完全溶解后,加入3.7g nahco3和5.9g hepes,用1mol/l hcl调ph值至6.8,定容至1l,微孔滤膜(0.22μm)过滤除菌,置4℃保存备用;
53.dmem细胞生长液:在dmem细胞基础培养液中按10%的体积比加入新生牛血清、终浓度为100u/ml的青霉素和100μg/ml和链霉素,4℃保存备用;
54.dmem细胞维持液:在dmem细胞基础培养液中按2%的比例加入新生牛血清、终浓度为100u/ml的青霉素和100μg/ml的链霉素,4℃保存备用。
55.实施例1
56.苦参碱碳量子点的合成流程示意图如图1所示。
57.苦参碱碳量子点(matrine-cds)的制备方法,步骤如下:
58.1)将matrine(购自上海阿拉丁生化科技股份有限公司,纯度98%,m109803)在玛瑙研钵中研磨混匀;
59.2)将研磨好的0.2g matrine转移至体积为25ml的反应釜(其内衬为聚四氟乙烯)中,在烘箱中200℃反应2h;
60.3)待产物冷却至室温(25℃),打开反应釜,加入10ml的去离子水,40khz100w超声条件下助溶1h;
61.4)以12000rpm离心1h,收集上清液;
62.5)将步骤4)中收集的上清液,用0.22μm的水相滤膜过滤,进一步去除沉淀;
63.6)将步骤5)得到的溶液装入截留分子量为500da的透析袋中,用超纯水进行透析,每2h更换一次超纯水,透析8h;
64.7)收集透析袋内的溶液,真空冷冻干燥,即得到纯化的matrine-cds。
65.实施例2
66.采用实施例1中的方法制备苦参碱碳量子点,区别在于步骤2)中的温度为140℃。
67.实施例3
68.采用实施例1中的方法制备苦参碱碳量子点,区别在于步骤2)中的温度为160℃。
69.实施例4
70.采用实施例1中的方法制备苦参碱碳量子点,区别在于步骤2)中的温度为180℃。
71.实施例5
72.采用实施例1中的方法制备苦参碱碳量子点,区别在于步骤2)中的温度为220℃。
73.测试例1
74.matrine-cds的表征,步骤如下:
75.利用高分辨透射电镜对实施例1中合成的matrine-cds的大小和形貌进行观察,发现所合成的matrine-cds为球形,分散良好,粒径分布均匀,平均直径为2.4nm,晶格间距为0.24nm。xrd衍射显示matrine结晶度良好,而matrine-cds结晶度下降,如图2所示。
76.利用荧光分光光度计检测实施例1~5合成的matrine-cds的荧光光谱,结果如图3所示,发现不同温度合成的matrine-cds的最佳激发波长基本一致,都在380~390nm、且最佳发射波长也基本一致,在460~465nm。
77.利用紫外-可见分光光度计和荧光分光光度计对实施例1中制备得到的matrine-cds的紫外吸收光谱和荧光光谱进行进一步检测,发现在297nm处出现一个小峰,在465nm处表现为明显的蓝色荧光,最佳激发波长为390nm,如图4中a所示。
78.对实施例1合成的matrine-cds的傅里叶转换红外光谱(ft-ir)进行检测,并与matrine进行比较,如图4中b所示:结果发现matrine-cds在3425cm-1
处出现了一个matrine没有的宽峰(-oh),其它主要的峰,如c-h(2935cm-1
)、o=c-nh(1631cm-1
)和c-n(1417cm-1
),matrine与matrine-cds两者一致,说明在制备matrine-cds的过程中,matrine的主要官能团得到了保留。
79.为了进一步解析matrine-cds的元素组成和表面官能团,利用x射线光电子能谱(xps)对实施例1合成的matrine-cds进行了相应的表征,结果如图4中c~f所示:
80.xps全扫描光谱显示matrine-cds主要含有c、n、o三种元素,对应的峰分别为284ev、399ev和531ev,且元素组成分别为78.11%、10.67%和11.22%(图4中c);高分辨率的c1s能被解卷积成3个峰c=o(286.8ev),c-o(285.2ev),c-c/c-n(284.2ev)(图4中d);而高分辨率的n1s能被分解成2个峰,可被指认为pyrrolic-n(398.8ev)、amino-n(400.6ev)(图4中e);高分辨的o1s能被分解成3个拟合峰,分别指派给c=o(530.3ev)、c-o(531.3ev)、o=c-o(532.1ev)(图4中f)。
81.xps与ft-ir的表征结果相匹配,证实本发明所合成的matrine-cds表面存在羟基和羰基,且出现了新的亲水基团-羟基(-oh)。
82.测试例2
83.matrine-cds的细胞毒性检测,步骤如下:
84.采用cck-8(购自上海碧云天生物技术有限公司,c0042)法检测matrine、实施例1~5制备得到的matrine-cds对marc-145细胞(购自中国.武汉.武汉大学中国典型培养物保藏中心(cctcc))活性的影响。将生长状态良好的marc-145细胞接种于96孔板中,每孔100μl,细胞量为0.5~2
×
105个/ml,待细胞长成单层后吸弃培养液;
85.设置试验分组:药物处理孔、细胞对照孔和空白对照孔。
86.药物处理孔:包括matrine组和matrine-cds组(包括实施例1~5制备得到的matrine-cds);
87.matrine组为:在吸弃培养液的96孔板中,分别加入含不同浓度(2000μg/ml、1750μg/ml、1500μg/ml、1250μg/ml、1000μg/ml、500μg/ml、250μg/ml和125μg/ml)的matrine,每孔100μl,每个药物浓度做6个复孔;
88.matrine-cds组:在吸弃培养液的96孔板中,分别加入含不同浓度(2000μg/ml、1750μg/ml、1500μg/ml、1250μg/ml、1000μg/ml、500μg/ml、250μg/ml和125μg/ml)的matrine-cds,每孔100μl,每个药物浓度做6个复孔;
89.细胞对照孔:不加药物处理,设置6个复孔;
90.空白对照孔:不加细胞,不加药物处理,设置6个复孔;
91.将包含有药物处理孔、细胞对照孔和空白对照孔的96孔板于37℃5%co2细胞培养箱中继续培养48h。每孔加入10μl cck-8试剂,将96孔板置于37℃温箱孵育1h,用多功能酶标仪测定各孔在450nm波长处的吸光值od
450nm
。计算各组的平均od
450nm
值,将未经处理的对照组细胞的存活率设定为100%,根据各组细胞的平均od
450nm
值计算细胞存活率。
92.细胞存活率=((as-ab)/(ac-ab))*100%;
93.as:药物处理孔od
450nm
值;ac:细胞对照孔od
450nm
值;ab:空白对照孔od
450nm
值;
94.matrine和matrine-cds的细胞毒性结果如图5所示,其中的横坐标为matrine或matrine-cds的浓度,纵坐标为细胞的相对活力。
95.由图5结合graphpad prism 7进行拟合计算可以得出:matrine的cc
50
(半数细胞毒性浓度)为1437μg/ml,实施例1~5中matrine-cds的cc
50
依次为1575μg/ml、1503μg/ml、1513μg/ml、1496μg/ml和1478μg/ml,说明matrine-cds和matrine对marc-145细胞的毒性均很小,且matrine-cds具有更小的细胞毒性。
96.测试例3
97.matrine-cds对prrsv增殖的影响,步骤如下:
98.通过tcid
50
、间接免疫荧光(ifa)和western blot实验检测matrine-cds对prrsv增殖的影响,并与matrine的作用进行比较
99.1)tcid
50
检测实施例1~5中matrine-cds对prrsv增殖的影响
100.①
将marc-145细胞接种于24孔细胞培养板中,每孔1ml,细胞量为0.5~2
×
105个/ml;
101.②
待细胞长至80%~90%融合时,吸弃细胞培养液,加入含500μg/ml的matrine或不同温度制备的matrine-cds的细胞维持液,每孔1ml,每个浓度设置3个复孔,于37℃5%co2培养箱中孵育2h;
102.③
于prrsvwuh3株(genbank登录号:hm853673;为华中农业大学农业微生物学国家重点实验室病毒分室分离保存)病毒液中加入与步骤
②
相应的matrine或matrine-cds至终浓度分别为500μg/ml,混匀后于4℃作用1h;
103.④
将作用完成的prrsv以0.5moi的量接种处理好的细胞,于37℃孵育1h,吸弃接种物,用1
×
pbs漂洗细胞3次;
104.⑤
加入含与步骤
②
相应matrine或matrine-cds的细胞维持液,每孔1ml,于37℃5%co2培养箱中继续培养;
105.⑥
于培养36h后分别收样,反复冻融三次后进行tcid
50
检测。同时设置不加药物处理的对照组(control)。
106.⑦
tcid
50
检测的具体操作是:将marc-145细胞接种96孔细胞培养板,置于37℃5%co2培养箱中培养。待细胞生长至90%融合时,用dmem细胞维持液将待测样品在1.5mlep管中作连续10倍稀释,从10-1
至10-8
,将不同稀释度的病毒液分别接种到96孔细胞微量培养板的第1-8列中,每个稀释度接种8孔,每孔接种100μl,第9-10列加等量的dmem细胞维持液作为对照。将96孔细胞培养板置于37℃5%co2培养箱中继续培养,逐日观察,记录细胞产生cpe的孔数,直到细胞病变稳定为止。按reed-muench法计算病毒的tcid
50
,结果如图6所示。
107.由图6可以看出:当matrine和matrine-cds的浓度为500μg/ml时,实施例1~5中制备得到的matrine-cds对prrsv的增殖抑制作用均强于matrine,尤其实施例1中采用200℃加热温度制备得到的matrine-cds对prrsv增殖的抑制作用最强。
108.2)采用步骤1)中的步骤通过tcid
50
进一步检测实施例1中合成的matrine-cds其不同浓度在不同的感染时间下对prrsv增殖的影响
109.区别在于:
110.步骤
②
中加入的细胞维持液分别含有500μg/ml、250μg/ml和125μg/ml的matrine或matrine-cds;
111.步骤
⑥
中于培养12h、24h、36h后分别收样后,反复冻融三次后进行tcid
50
检测。
112.结果如图7所示。
113.由图7可以得出,matrine和matrine-cds均能有效抑制prrsv在marc-145细胞中的增殖,且这种抑制作用具有时间和剂量依赖性,并以12h的抑制效果最明显,matrine-cds的抑制作用显著强于matrine,而且高浓度的matrine-cds(500μg/ml)在检测的3个时间点(感染后12h、24h、36h)均可完全抑制prrsv的增殖。
114.3)ifa检测实施例1中合成的matrine-cds对prrsv增殖的影响
115.①
将marc-145细胞接种于预先放置有细胞爬片的24孔细胞培养板中,每孔1ml,细胞量为0.5~2
×
105个/ml;
116.②
待细胞长至80%~90%融合时,吸弃细胞培养液,加入含不同浓度(500μg/ml、250μg/ml、125μg/ml)matrine或matrine-cds的细胞维持液,每孔1ml,于37℃5%co2培养箱中孵育2h;
117.③
于prrsv wuh3株病毒液中加入matrine或matrine-cds至终浓度分别为500μg/ml、250μg/ml、125μg/ml,混匀后于4℃作用1h;
118.④
将步骤
③
作用完成的prrsv以0.5moi的量接种处理好的细胞,于37℃孵育1h,吸弃接种物,用1
×
pbs漂洗细胞3次;
119.⑤
加入含与步骤
②
相应浓度matrine或matrine-cds的细胞维持液,每孔1ml,于37℃5%co2培养箱中继续培养;
120.⑥
于培养12h、24h、36h后分别收样进行ifa检测。同时设置不加药物处理的对照孔(control)和既不加药物处理也不接毒的细胞对照孔(mock)。
121.⑦
ifa检测的具体操作是:吸弃细胞培养液,用pbs漂洗细胞3次,5min/次,用4%多聚甲醛固定细胞15min,再用-20℃预冷的甲醇透化10min,透化后用预冷的pbs漂洗细胞3次,5min/次;用含5%bsa的pbs室温封闭60min,再加入抗prrsvn蛋白的鼠源单克隆抗体(抗prrsvn蛋白的鼠源单克隆抗体为华中农业大学农业微生物学国家重点实验室病毒分室制备并保存,参见jiang y,fang l,luo r,xiao s,chen h.2010.n-acetylpenicillamine inhibits the replication of porcine reproductive and respiratory syndrome virus in vitro.veterinary research communications 34:607
–
617.)于室温孵育1h,pbs漂洗细胞3次;加入异硫氰酸荧光素(fitc)(alexafluor488)标记的兔抗鼠igg(购自jackson immunoresearch,inc,货号:200-002-037),于37℃避光孵育1h,pbs漂洗细胞3次;加入dapi(4',6-二脒基-2-苯基吲哚),于室温避光作用10min,pbs漂洗细胞3次;取出爬片,用封片液固定于载玻片上,于olympus fluoview ver.3.1激光共聚焦显微镜下进行观察,并拍照,结果如图8~10所示。
122.由图8~10发现,在prrsvwuh3株接种后3个不同的时间点(12h、24h、36h),matrine与matrine-cds均能有效抑制prrsv的增殖,并以matrine-cds的作用显著强于matrine。matrine-cds处理组只有低剂量组(125μg/ml)在病毒接种后36h可以观察到少量细胞发荧光,其余孔细胞均无荧光反应;而matrine对prrsv的抑制作用呈现明显的时间与剂量依赖性,对病毒复制早期的抑制作用最明显,并只有高剂量(500μg/ml)的matrine在病毒感染后12h可完全抑制病毒的增殖。
123.4)western blot检测实施例1中合成的matrine-cds对prrsv增殖的影响
124.①
将marc-145细胞接种于6孔细胞培养板中,每孔3ml,细胞量为0.5~2
×
105个/ml;
125.②
待细胞长至80%~90%融合时,吸弃细胞培养液,加入含不同浓度(500μg/ml、250μg/ml、125μg/ml)matrine或matrine-cds的细胞维持液,每孔3ml,于37℃5%co2培养箱中孵育2h;
126.步骤
③
~
⑥
同步骤3);
127.⑦
western blot检测的具体操作是:吸弃细胞培养液,用pbs漂洗细胞3次,每孔加入300μl细胞裂解液,并用细胞刮刮取细胞。用一次性1ml注射器吸取裂解的细胞悬液,加到1.5ml ep管中,用注射器充分吸打约20次。加入相应体积的5
×
sds-page上样缓冲液,沸水煮10min,12000rpm离心10min,取上清进行sds-page电泳,电泳完成后转印pvdf膜(聚偏二氟乙烯膜),用含有10%脱脂牛奶的tbst封闭,以抗prrsvn/nsp2蛋白的鼠源单克隆抗体(抗prrsv n/nsp2蛋白的鼠源单克隆抗体为华中农业大学农业微生物学国家重点实验室病毒分室保存制备并保存)为一抗,hrp标记兔抗鼠igg为二抗进行western blot检测,并用化学发光成像系统进行图像采集,结果如图11~13所示。
128.由图11~13发现,3种浓度(500μg/ml、250μg/ml、125μg/ml)的matrine-cds在不同时间点(感染后12h、24h和36h)均完全抑制了prrsv的n和nsp2蛋白的表达,而matrine虽然
在不同时间点均能有效抑制prrsv的n和nsp2蛋白的表达,但只有高浓度(500μg/ml)的matrine在感染后12h能完全抑制prrsv的n和nsp2蛋白的表达,结果与ifa检测结果一致,说明matrine-cds对prrsv增殖的抑制作用显著强于matrine。
129.由以上结果可以得出,matrine和matrine-cds均能抑制prrsv在marc-145细胞中的增殖,但matrine-cds的抑制作用明显强于matrine。
130.尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。