一种表达pah的基因修饰细胞药物及其制备方法与应用
技术领域
1.本发明属于生物医药技术领域,涉及一种表达苯丙氨酸羟化酶(pah)的基因修饰细胞药物及其制备方法与应用。
背景技术:
2.苯丙酮尿症(pku)是一种主要由苯丙氨酸羟化酶(pah)基因突变引起的常染色体隐性遗传性疾病,其特征是患者血液和大脑等器官中积累高浓度的苯丙氨酸(phe),导致不可逆转且严重的智力发育障碍。
3.pku的治疗策略是恢复和提高pah的活性以及降低血液中苯丙氨酸浓度。目前,pku治疗方法主要包括限制饮食疗法、沙丙蝶呤和酶替代疗法(pegvaliase),其中后两者是仅有的两种被fda批准用于治疗pku的药物。在临床上,限制phe的饮食能够有效地将血浆phe水平维持在正常范围内,但是在青春期和成年期,患者很难坚持phe限制饮食,由此增加了血浆phe水平出现意外峰值的风险。沙丙蝶呤是辅助因子bh4的合成形式,对轻度pku患者非常有效,但在大多数患者中,使用沙丙喋呤的同时也需要进行phe限制饮食以使phe水平完全正常化。2018年fda批准了首个用于治疗pku的酶替代疗法pegvaliase,其是苯丙氨酸解氨酶的聚乙二醇衍生物(peg-pal)的口服形式,可将phe代谢为氨和反式肉桂酸。ⅲ期临床试验数据表明,60.7%的患者在使用pegvaliase 24个月时能够达到低于指南推荐的360μmol/l的血液phe水平。对于pku成年患者,pegvaliase是一种很有前途的新治疗选择。然而,peg-pal的作用不能持续很长时间,并且可能会在一些患者中诱发严重的过敏反应。
4.基因治疗,是以改变或纠正人的遗传物质为基础,将人正常或有治疗作用的基因通过相应的载体导入人体靶细胞,以发挥纠正或补偿有缺陷基因的作用,从而达到治疗相应疾病的目的。靶向体细胞的基因治疗可以通过直接注射给予病毒后实现(in vivo therapy),也可以通过将体细胞分离后在体外培养,经携带正常基因的病毒载体感染修饰后再回输宿主(ex vivo therapy)以达到治疗目的。pku是一类典型的肝脏代谢异常的遗传疾病,主要是由于编码苯丙氨酸羟化酶(phenylalanine hydroxylase,pah)的基因发生了错义突变。肝脏细胞不能进行体外处理,随着载体技术(如aav)的发展,能实现靶向定位修饰,因此利用病毒载体的体内基因治疗是首选。
5.基于多种机制的pku基因疗法正在开发。2020年,苯丙酮尿症基因疗法bmn307(aav5-pah)在美国获得了治疗pku的快速通道指定(ftd)。在该疾病的小鼠模型中,该疗法被证明可导致phe水平终生正常化。hmi-102也是一项针对pku的aav基因疗法,被美国fda授予孤儿药资格(odd)和快速通道资格(ftd)。hmi-102治疗可以恢复一种pku模型的phe代谢通路途径,使血液苯丙氨酸水平正常化。但是,这两种药物的临床研究因致瘤性和肝损伤等潜在严重安全风险被fda叫停。随着对aav载体的深入研究,发现其存在包括免疫反应、引起插入诱变和诱导癌症、肝脏毒性(转氨酶升高、肝衰竭)等安全性问题。
6.尽管pku治疗方法已进行数十年的探索,但是,pku的现有治疗方法均有一定临床局限性,包括长期反复用药或限制饮食、依从性差、安全风险大以及经济负担重等。因此,研
究治疗pku的新方法极为迫切,而延长pah蛋白的半衰期以降低给药频率并提高治疗的安全性是pku治疗急需解决难题。
技术实现要素:
7.本发明的目的在于提供一种表达pah的基因修饰细胞药物,以解决上述技术问题中的至少一个。
8.本发明的另一个目的在于提供上述表达pah的基因修饰细胞药物的制备方法。
9.本发明的又一个目的在于提供上述表达pah的基因修饰细胞药物在制备治疗苯丙酮尿症的药物中的应用。
10.根据本发明的一个方面,提供了一种表达pah的基因修饰细胞药物,包括利用人正常苯丙氨酸羟化酶(pah)基因,或核苷酸序列具有与人正常pah基因核苷酸序列至少75%同源性的核酸分子修饰的细胞,该细胞可以在体内/外持续、稳定地表达pah,用作细胞治疗药物应用于治疗苯丙酮尿症时,在体内可作为生产pah的“药物工厂”,长时间持续表达pah,从而可以有效解决现有苯丙酮尿症治疗方法中pah蛋白半衰期短以及终生频繁用药的弊端。
11.人正常pah的核苷酸序列如seq id no:1所示,氨基酸序列如seq id no:2所示。核苷酸序列具有与人正常pah基因核苷酸序列至少75%同源性的核酸分子可以为基于人正常pah基因核苷酸序列进行密码子优化、降低cpg二核苷酸含量、在有义和反义方向上移除任何额外的orf等操作中的至少一种后得到的、核苷酸序列具有与人正常pah基因核苷酸序列至少75%同源性、能正常编码人正常pah的核酸分子。
12.在一些实施方式中,可用于进行pah基因修饰的细胞(下称为“宿主细胞”)可以选自干细胞、外周血单个核细胞中的至少一种。
13.在一些实施方式中,宿主细胞可以为干细胞;其中,干细胞的类型包括但不限于间充质干细胞、造血干细胞、诱导多能干细胞(ips)等。
14.在一些实施方式中,间充质干细胞可以选自脐带间充质干细胞、脂肪间充质干细胞、牙髓间充质干细胞中的至少一种。
15.在一些实施方式中,宿主细胞可以为脐带间充质干细胞。脐带间充质干细胞具有取材方便、无创、来源广泛、体外分离培养简单和无论理学争议等优点,且其免疫原性较低、无致瘤性,用作细胞治疗药物的宿主细胞,不会产生同种异体免疫排斥反应,安全性高。
16.在一些实施方式中,基因递送载体可以选自病毒载体、转座子、基因敲入、脂质体、纳米金颗粒、外泌体中的至少一种。
17.在一些实施方式中,基因递送载体可以为病毒载体;其中,病毒载体的类型包括但不限于慢病毒载体、逆转录病毒载体、腺病毒载体、疱疹病毒载体等。
18.在一些实施方式中,基因递送载体可以为慢病毒载体;其中,慢病毒载体的包装系统包括但不限于三质粒包装系统和四质粒包装系统。
19.根据本发明的另一个方面,提供了上述表达pah的基因修饰细胞药物的制备方法,包括如下步骤:
20.构建含有如seq id no:1所示的核苷酸序列,或含有具有与seq id no:1所示的核苷酸序列至少75%同源性的核苷酸序列的基因递送载体;然后将该基因递送载体导入细胞中,即得。
21.在一些实施方式中,基因递送载体可以为慢病毒载体,细胞可以为脐带间充质干细胞。
22.在一些实施方式中,慢病毒载体主要通过将重组慢病毒表达质粒、慢病毒包装质粒和慢病毒包膜质粒包装重组慢病毒制得;重组慢病毒表达质粒含有ef1α启动子和目的基因序列,目的基因序列如seq id no:1所示或为具有与seq id no:1所示的核苷酸序列至少75%同源性的核苷酸序列。
23.在一些实施方式中,重组慢病毒表达质粒主要通过将ef1α启动子和目的基因序列连接至prrlsin质粒中制得;其制备方法具体可以包括如下步骤:
24.(1)人工合成pah基因的dna序列并克隆到prrlsin质粒中,将构建得到的载体命名为:prrlsin-pah;
25.(2)通过pcr扩增nhe i-ef1α-mlu i片段;
26.(3)利用nhe i酶和miu i酶分别对nhe i-ef1α-mlu i片段和载体prrlsin-pah进行双酶切,并回收酶切产物;
27.(4)将回收的两种酶切产物进行连接,连接产物转化大肠杆菌trans 5α化学感受态细胞并划线涂板培养;
28.(5)挑取单克隆菌落通过菌落pcr鉴定重组载体,取阳性克隆摇菌后提取质粒,将质粒通过测序进一步验证,序列正确的质粒即为重组慢病毒表达质粒,命名为prrlsin-ef1α-pah。
29.在一些实施方式中,慢病毒载体的制备使用四质粒包装系统;其中,慢病毒包装质粒可以为pmdlg/prre(kan
)质粒和prsv-rev(kan
)质粒,慢病毒包膜质粒可以为pmd2.g(kan
)质粒。
30.在一些实施方式中,慢病毒载体的制备包括如下步骤:
31.将重组慢病毒表达质粒prrlsin-ef1α-pah、慢病毒包装质粒pmdlg/prre(kan
)和prsv-rev(kan
)、慢病毒包膜质粒pmd2.g(kan
)通过转染试剂共转染至慢病毒包装细胞中,包装出慢病毒并对其进行纯化,即得慢病毒载体。
32.在一些实施方式中,转染试剂可以为聚醚酰亚胺(polysciences,pei)。
33.在一些实施方式中,慢病毒包装细胞可以为hek293t细胞。
34.在一些实施方式中,将慢病毒载体导入脐带间充质干细胞中的方法具体可以包括如下步骤:
35.用慢病毒载体和聚凝胺处理脐带间充质干细胞,18-24h后用培养基换液,继续培养48-54h后收获细胞;其中,慢病毒载体的moi可以为1-10,聚凝胺的终浓度可以为1-10μg/ml。
36.本发明针对苯丙酮尿症提出了一种体外基因治疗方法,首次提出利用人脐带间充质干细胞作为产生pah的“药物工厂”,提供的表达pah的基因修饰的脐带间充质干细胞通过在体外对脐带间充质干细胞进行修饰制得,具有良好的安全性并且可以在体内长时间持续表达高水平的pah,安全有效,可应用于制备治疗苯丙酮尿症的药物。
附图说明
37.图1为琼脂糖凝胶电泳检测nhei-ef1α-mlui片段的pcr扩增产物;
38.图2为琼脂糖凝胶电泳检测prrlsin-pah酶切产物;
39.图3为菌落pcr鉴定重组慢病毒表达质粒prrlsin-ef1α-pah;
40.图4为重组慢病毒表达质粒prrlsin-ef1α-pah粒图谱;
41.图5为流式细胞术检测msc细胞表型;
42.图6为western blotting检测慢病毒感染后msc对pah的表达情况;
43.图7为western blotting检测慢病毒感染后在不同时间点msc对pah的表达情况。
具体实施方式
44.下面结合实施方式对本发明作进一步详细的说明。实施例仅用于解释而不以任何方式限制本发明。如无特殊说明,实施例中所用原料和试剂为可以通过市售获得的常规产品;实施例中未注明具体条件的实验方法,通常按照本领域常规条件或按照制造厂商建议的条件。
45.实施例1表达pah的基因修饰的脐带间充质干细胞的制备
46.1、构建重组慢病毒表达质粒prrlsin-ef1α-pah
47.(1)根据ncbi提供的人苯丙氨酸羟化酶基因序列(nm_000277.3),其核苷酸序列如seq id no:1所示,由通用生物(安徽)股份有限公司人工合成pah基因的dna序列并克隆到prrlsin质粒的mlu i和sal i酶切位点之间,构建得到的载体命名为prrlsin-pah。
48.本发明所用prrlsin质粒由广州安捷生物医学技术有限公司提供,为在prrlsin.cppt.pgk-gfp.wpre慢病毒表达质粒的基础上进行改造得到的慢病毒表达质粒,连接ef1α启动子和pah后的prrlsin质粒的图谱如图4所示。
49.(2)在pah基因前面插入ef1α启动子,构建重组慢病毒表达质粒prrlsin-ef1α-pah,具体过程如下:
50.s1:以plvx-ef1α-ires-puro(广州安捷生物医学技术有限公司提供)为模板,nhe i-ef1α-f/ef1α-mlu i为引物扩增nhei-ef1α-mlui片段,其中,引物序列如下:
51.nhe i-ef1α-f:5
’‑
ctagctagcgctccggtgcccgtcag-3’(seq id no:3)
52.ef1α-mlu i:5
’‑
cgacgcgttcacgacacctgaaatgg-3’(seq id no:4)
53.pcr反应参数:预变性:95℃,5min;变性:94℃,30s;退火:55℃,30s;延伸:72℃,75s;循环32次;72℃延伸10min;4℃,forever。
54.用1%琼脂糖凝胶电泳鉴定并分离nhe i-ef1α-mlu i片段的pcr扩增产物,鉴定结果如图1所示,其中lane 1和lane 2为nhe i-ef1α-mlu i片段。
55.采用dna凝胶回收试剂盒回收并纯化nhe i-ef1α-mlu i扩增片段。
56.s2:利用nhe i酶和miu i酶分别对nhe i-ef1α-mlu i扩增片段和载体prrlsin-pah进行双酶切,其中nhe i-ef1α-mlu i扩增片段的酶切产物直接回收,载体prrlsin-pah的酶切产物经琼脂糖凝胶电泳鉴定后切胶回收,鉴定结果如图2所示,其中lane 1为载体prrlsin-pah的酶切片段。
57.s3:将nhe i-ef1α-mlu i扩增片段和载体prrlsin-pah的酶切产物用t
4 dna连接酶进行连接,连接产物转化大肠杆菌trans 5α化学感受态细胞(北京全式金生物技术有限公司提供)并划线涂板培养。
58.s4:挑取10个单菌落,以nhe i-ef1α-f/ef1α-mlu i为引物通过菌落pcr进行鉴定,
结果如图3所示,lane 8和lane 9克隆扩增出目的条带且条带明显,说明可能是阳性克隆。
59.s5:取阳性克隆摇菌后用ue质粒小量制备试剂盒(苏州优逸兰迪生物科技有限公司)提取质粒,将质粒测序,测序结果显示序列均正确,表明重组慢病毒表达质粒已成功构建,命名为prrlsin-ef1α-pah,质粒图谱如图4所示。
60.s6:用无内毒素质粒大提试剂盒(endo-free plasmid maxi kit,omega)提取质粒,置于-20℃冰箱保存。
61.2、慢病毒包装与纯化
62.(1)取冻存的hek293t细胞复苏,用dmem完全培养基(dmem培养基 10%fbs)传代培养。将hek293t细胞接种至10层细胞工厂,加入dmem完全培养基,过夜培养使细胞能达到80~90%的融合度,进行质粒转染。
63.(2)将重组慢病毒表达质粒prrlsin-ef1α-pah、慢病毒包装质粒pmdlg/prre(kan
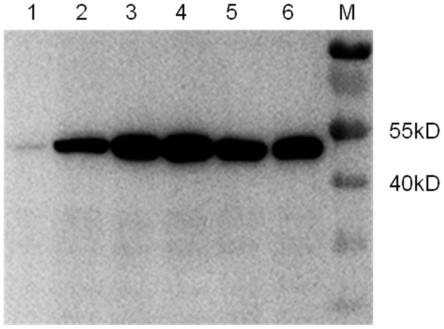
)和prsv-rev(kan
)、慢病毒包膜质粒pmd2.g(kan
)加入无血清dmem中,混匀后静置5min,得质粒混合液;
64.将pei加入无血清dmem中,混匀后静置5min,得转染试剂;
65.将转染试剂加入质粒混合液中,充分混匀,静置20min,形成dna-pei复合物;
66.(3)将dna-pei复合物加入1l含5%fbs的dmem培养基中,充分混匀,替换掉步骤(1)中的10层细胞工厂中的培养液,置于37℃、5%co2培养箱培养;
67.(4)于转染后的48h和72h收集培养上清液,置于2~8℃冰箱中保存;
68.(5)将收集的培养上清液混合,使用囊式滤器(sartorius)去掉细胞和细胞碎片;然后将澄清过滤的慢病毒上清通过仕必纯切向流过滤系统(kr2i)浓缩10~15倍,浓缩液经过0.45μm滤膜过滤后,进行层析纯化;将纯化的慢病毒经过0.22μm滤器(sartorius)除菌过滤,分装,-80℃冰箱保存。所得慢病毒记为prrlsin-ef1α-pah慢病毒。
69.3、脐带间充质干细胞(msc)的分离培养
70.收集足月健康胎儿脐带,浸没于含1%的青霉素和链霉素的pbs中,低温(2~8℃)转运至实验室。取出脐带至10cm培养皿中,并剪成若干小段,用含青霉素和链霉素的生理盐水和生理盐水分别洗涤3次。取洗涤后的脐带放入新的10cm培养皿中,去除动脉和静脉,分离华通胶并充分剪碎成1mm3组织块,用生理盐水离心(500g,5min)洗涤两次。将剪碎的华通胶加入含无血清培养基的培养瓶中,轻微振荡使组织块分散均匀,置于37℃、5%co2培养箱培养。培养5-7天进行半换液,在培养箱继续培养直至有长梭形细胞从组织块边缘长出。待细胞覆盖瓶底约50%时,弃去培养瓶中培养基及组织块,加入生理盐水洗涤2次。加入胰酶消化,进行传代培养,标记为p1。待贴壁细胞覆盖瓶底的90%时加入胰酶消化,按1:5的比例进行传代扩增,通过流式细胞术检测表型,结果如图5所示,cd105、cd73、cd90阳性,cd34阴性,说明成功分离msc细胞。用冻存液冻存细胞,建立脐带间充质干细胞库,标记好相应代次。
71.4、制备pah基因修饰的脐带间充质干细胞
72.(1)取细胞库中的msc细胞,复苏后加入无血清培养基进行传代培养。
73.(2)将生长状态良好的msc接种至培养瓶,置于37℃、5%co2培养箱培养过夜后,加入prrlsin-ef1α-pah慢病毒(moi=5)和聚凝胺(polybrene,终浓度6μg/ml),离心感染(700g,1.5h)后置于37℃、5%co2培养箱培养。
74.(3)慢病毒感染24h后换液,加入无血清培养基,置于37℃、5%co2培养箱继续扩增培养。
75.(4)慢病毒感染72h后分别收获细胞和培养上清。其中,收获的细胞即为可表达pah的pah基因修饰的脐带间充质干细胞。
76.以未感染慢病毒的msc细胞和培养上清、空载慢病毒感染的msc细胞和培养上清作为对照,通过western blotting检测pah的表达,结果如图6所示,lane1-3分别为msc上清、空载慢病毒感染msc上清、prrlsin-ef1α-pah慢病毒感染msc上清,lane4-6分别为msc细胞裂解液、空载慢病毒感染msc裂解液、prrlsin-ef1α-pah慢病毒感染msc裂解液,仅在lane3和lane6检测到单一条带且大小符合预期,说明prrlsin-ef1α-pah慢病毒感染msc后,msc能成功表达人正常pah且能分泌到细胞外,表明成功制备了表达苯丙氨酸羟化酶的基因修饰细胞。
77.试验例1
78.(1)取细胞库中的msc细胞,复苏后加入无血清培养基进行传代培养。
79.(2)将生长状态良好的msc接种至6孔板,置于37℃、5%co2培养箱培养过夜后,加入prrlsin-ef1α-pah慢病毒(moi=5)和聚凝胺(polybrene,终浓度6μg/ml),离心感染(700g,1.5h)后置于37℃、5%co2培养箱培养。
80.(3)于慢病毒感染后24h收集上清并换液,加入无血清培养基,置于37℃、5%co2培养箱继续培养,分别收集慢病毒感染后48h、72h、96h、120h、144h的培养上清。
81.(4)通过western blotting检测慢病毒感染后不同时间苯丙氨酸羟化酶(pah)的表达。
82.结果如图7所示,lane1-6分别为prrlsin-ef1α-pah慢病毒感染msc细胞后24h、48h、72h、96h、120h、144h培养上清中pah的表达,结果显示在所有时间点均能检测到单一条带且大小符合预期,并且蛋白表达水平随着时间的增加而增加,在96h达到峰值,随后降低,但在144h仍然维持在较高水平,说明prrlsin-ef1α-pah慢病毒感染msc后,msc能持续表达人正常pah且能持续将pah分泌到细胞外。
83.因此,本发明提供的苯丙氨酸羟化酶基因修饰细胞可作为苯丙酮尿症的治疗药物,移植体内后在体内可作为生产pah的“药物工厂”,持续产生苯丙氨酸羟化酶(pah),从而代偿因pah基因突变导致的苯丙氨酸(phe)累积,解决现有治疗方法pah蛋白的半衰期短和终生频繁用药的弊端。
84.以上所述的仅是本发明的一些实施方式。对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
