艾萨妥昔单抗用于治疗复发性和/或难治性多发性骨髓瘤的用途
1.相关申请的交叉引用
2.本技术要求2019年12月6日提交的美国临时申请号62/944,809;2020年4月17日提交的欧洲专利申请号20315186.5;2020年5月11日提交的美国临时申请号63/023,198;2020年6月10日提交的美国临时申请号63/037,353;以及2020年10月21日提交的美国临时申请号63/094,833的优先权;将其每一个的内容通过引用以其整体并入本文。
3.ascii文本文件序列表的提交
4.将以下提交的ascii文本文件的内容通过引用以其全文并入本文:计算机可读形式(crf)的序列表(文件名:183952033041seqlist.txt,记录日期:2020年12月4日,大小:10kb)。
技术领域
5.本公开文本涉及通过施用抗cd38抗体与卡非佐米和地塞米松的组合来治疗多发性骨髓瘤的方法。
背景技术:
6.多发性骨髓瘤(mm)是恶性浆细胞疾病,其特征在于骨髓(bm)中浆细胞的克隆增殖和过量单克隆免疫球蛋白(通常为igg或iga型或游离尿轻链,即副蛋白、m蛋白或m组分)的产生。患有mm的患者可经历骨痛、骨裂、疲劳、贫血、感染、血钙过多和肾脏问题(rollig等人(2015)lancet.385(9983):2197-208)。cd38的表达在mm中尤其显著,因为》98%的患者对此蛋白质呈阳性(goldmacher等人(1994)blood.84(9):3017-25;lin等人(2004)am j clin pathol.121(4):482-8)。cd38在恶性单克隆mm细胞上的强且均匀的表达与在正常细胞上的有限表达模式形成对比,这表明此抗原可用于特异性靶向肿瘤细胞。
7.mm治疗的当前目标是尽可能有效地控制疾病,使生活质量最大程度地提高并延长存活。对于每位患者而言疾病轨迹不同,但复发是不可避免的,并且在复发后对每种治疗的反应的深度和持续时间通常减少。一般而言,mm患者将在其一生中接受包括如下的此类药剂(单独或组合)的治疗方案:如蛋白酶体抑制剂(例如硼替佐米、伊沙佐米和卡非佐米)和免疫调节剂或(例如,来那度胺、泊马度胺和沙利度胺)、单克隆抗体(例如艾洛珠单抗)、组蛋白脱乙酰化酶(hdac)抑制剂(例如帕比司他)。然而,一旦患者变成那些药剂难治的,则存活有限并且在患者在干细胞移植(sct)、化学疗法、蛋白酶体抑制剂和免疫调节药物无效之后需要更新的治疗选项治疗患者。尽管使用更新治疗的患者结果中有显著改善,但mm仍是不可治愈的疾病。因此,已经接受针对多发性骨髓瘤的一至三个先前治疗线的患者的治疗仍然是未满足的医学需求。
8.本文中引用的所有参考文献,包括专利申请、专利出版物和uniprotkb/swiss-prot登录号均通过引用以其整体并入本文,如同每个单独的参考文献被特别地且单独地指出通过引用并入。
技术实现要素:
9.提供了一种治疗患有多发性骨髓瘤的人类个体的方法,其包括向所述个体施用抗cd38抗体、卡非佐米和地塞米松的方法,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dyw mq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqkf qg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(seqid no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的至少一种先前疗法(例如,一至三种先前疗法),并且其中所述治疗延长了所述个体的无进展存活期(pfs)。在一些实施方案中,所述治疗延长了所述个体的总存活期(os)。提供了一种治疗患有多发性骨髓瘤的人类个体的方法,其包括向所述个体施用抗cd38抗体、卡非佐米和地塞米松,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgd gdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygs nsldy(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的多于三种先前疗法,并且其中所述治疗延长了所述个体的无进展存活期(pfs)。在一些实施方案中,所述治疗延长了所述个体的总存活期(os)。
10.还提供了一种治疗患有多发性骨髓瘤的人类个体的方法,其包括向所述个体施用抗cd38抗体、卡非佐米和地塞米松的方法,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dy wmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqk fqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(se q id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的至少一种先前疗法(例如,一至三种先前疗法),并且其中所述治疗延长了所述个体的总存活期(os)。
11.还提供了一种治疗患有多发性骨髓瘤的人类个体的方法,其包括向所述个体施用抗cd38抗体、卡非佐米和地塞米松,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(seq idno:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qq hysppyt(seq id no:6)的cdr-l3,其中将所述抗cd38抗体以10mg/kg的
剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的多于三种先前疗法,并且其中所述治疗延长了所述个体的总存活期(os)。
12.在一些实施方案中,提供了一种治疗患有多发性骨髓瘤的人类个体的方法,其包括向所述个体施用抗cd38抗体、卡非佐米和地塞米松的方法,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiy pgdgdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdy ygsnsldy(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的至少一种先前疗法(例如,一至三种先前疗法),并且其中所述个体在治疗后呈10-5
或更小的阈值下的微小残留病阴性。
13.在一些实施方案中,所述个体接受过针对多发性骨髓瘤的一种先前疗法。在一些实施方案中,所述个体接受过针对多发性骨髓瘤的多于一种先前疗法(例如,如两种先前疗法或三种先前疗法)。在一些实施方案中,所述个体接受过针对多发性骨髓瘤的多于三种先前疗法。在一些实施方案中,所述个体接受过采用蛋白酶体抑制剂的先前疗法。在一些实施方案中,所述个体接受过采用免疫调节药物(例如,沙利度胺、来那度胺和/或泊马度胺)的先前疗法。在一些实施方案中,所述个体接受过采用蛋白酶体抑制剂和免疫调节药物的先前疗法。在一些实施方案中,在开始治疗时,根据多发性骨髓瘤的修订的国际分期系统(revised international staging system for multiple myeloma,r-iss)将所述个体分类为i期或ii期。在一些实施方案中,在开始治疗时根据r-iss将所述个体分类为iii期。在一些实施方案中,在开始治疗时未根据r-iss对所述个体进行分类。在一些实施方案中,所述个体具有选自以下的一种或多种细胞遗传学异常:del(17p)、t(4;14)和t(14;16)。在一些实施方案中,所述个体在开始治疗时患有肾损害。在一些实施方案中,所述个体在开始治疗时为65岁至小于75岁。在一些实施方案中,所述个体在开始治疗时年龄为75岁或更大。
14.在一些实施方案中,所述抗cd38抗体包含:含有seq id no:7的氨基酸序列的重链可变区(vh)和含有seq id no:7或seq id no:9的氨基酸序列的轻链可变区(v
l
)。在一些实施方案中,所述抗cd38抗体是艾萨妥昔单抗。
15.在一些实施方案中,将所述抗cd38抗体、所述卡非佐米和所述地塞米松在第一个28天周期中施用,其中将所述抗cd38抗体在所述第一个28天周期的第1、8、15和22天以10mg/kg的剂量施用,将所述卡非佐米在所述第一个28天周期的第1和2天以20mg/m2的剂量施用以及在第8、9、15和16天以56mg/m2的剂量施用,并且将所述地塞米松在所述第一个28天周期的第1、2、8、9、15、16、22和23天以20mg的剂量施用。在一些实施方案中,将所述抗cd38抗体、所述卡非佐米和所述地塞米松在所述第一个28天周期后的一个或多个28天周期中进一步施用,其中将所述抗cd38抗体在所述第一个28天周期后的一个或多个28天周期的第1和15天以20mg/m2的剂量施用,将所述卡非佐米在所述第一个28天周期后的一个或多个28天周期的第1、2、8、9、15和16天的每一天以56mg/m2的剂量施用,并且将所述地塞米松在
所述第一个28天周期后的一个或多个28天周期的第1、2、8、9、15、16、22和23天以20mg的剂量施用。在一些实施方案中,将所述地塞米松在所述抗cd38抗体之前施用,并且其中将所述抗cd38抗体在所述第一个28天周期的第1、8和15天在所述卡非佐米之前施用;并且其中将所述地塞米松在所述第一个28天周期的第22天在所述抗cd38抗体之前施用。在一些实施方案中,将所述地塞米松在所述抗cd38抗体之前施用,并且其中将所述抗cd38抗体在所述第一个28天周期后的每个28天周期的第1和15天在所述卡非佐米之前施用;并且其中将所述地塞米松在所述第一个28天周期后的每个28天周期的第8天在所述卡非佐米之前施用。在一些实施方案中,将所述抗cd38抗体静脉内施用。在一些实施方案中,将所述卡非佐米静脉内施用。在一些实施方案中,将所述地塞米松口服施用。
16.在一些实施方案中,所述个体在治疗后呈10-4
、10-5
、10-6
或更小的阈值下的mrd阴性。
17.本文还提供了包含抗cd38抗体的试剂盒,所述抗cd38抗体与卡非佐米和地塞米松组合用于根据本文任何一种方法治疗个体多发性骨髓瘤。
18.还提供了一种用于在治疗个体中的多发性骨髓瘤的方法中使用的抗cd38抗体,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstv va(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,所述方法包括向所述个体施用所述抗cd38抗体、卡非佐米和地塞米松,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的至少一种先前疗法(例如,一至三种先前疗法),并且其中所述治疗延长了所述个体的无进展存活期(pfs)和/或总存活期(os)。
19.还提供了一种用于在治疗个体中的多发性骨髓瘤的方法中使用的抗cd38抗体,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstv va(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3,所述方法包括向所述个体施用所述抗cd38抗体、卡非佐米和地塞米松,其中将所述抗cd38抗体以10mg/kg的剂量施用,将所述卡非佐米以20mg/m2或56mg/m2的剂量施用,并且将所述地塞米松以20mg的剂量施用,其中所述个体接受过针对多发性骨髓瘤的多于三种先前疗法,并且其中所述治疗延长了所述个体的无进展存活期(pfs)和/或总存活期(os)。
附图说明
20.该专利或申请文件含有制作的至少一张彩色附图。在请求并支付必要的费用后,官方将会提供带有彩色附图的本专利或专利申请公开物的副本。
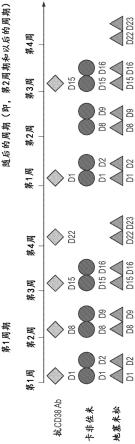
21.图1提供了实施例中描述的临床试验的研究设计的示意图。
22.图2提供了针对抗cd38抗体(例如艾萨妥昔单抗)、卡非佐米和地塞米松的示例性施用方案。
23.图3显示了对于接受艾萨妥昔单抗 卡非佐米 地塞米松(ikd)的患者相比于接受卡非佐米 地塞米松(kd)的患者的无进展存活期(pfs)的卡普兰-迈耶(kaplan-meier)曲线。
24.图4显示了无进展存活期的亚组分析的森林图。圆圈表示风险比并且水平条从风险比估计值的95%置信区间的下限延伸到上限。
25.图5显示了对于接受艾萨妥昔单抗 卡非佐米 地塞米松(ikd)的患者相比于接受卡非佐米 地塞米松(kd)的患者的到下次治疗的时间(tnt)的卡普兰-迈耶曲线。
26.图6显示了对于接受艾萨妥昔单抗 卡非佐米 地塞米松(ikd)的患者相比于接受卡非佐米 地塞米松(kd)的患者的依据微小残留病(mrd)状态的无进展存活期的kaplan-meier曲线。
27.图7显示了无进展存活期的亚组分析的另一个森林图。圆圈表示风险比并且水平条从风险比估计值的95%置信区间的下限延伸到上限。
具体实施方式
28.定义
29.除非上下文另有明确说明,否则如在本说明书及所附权利要求中所使用的,单数形式“一种/一个(a)”、“一种/一个(an)”和“所述”包括复数指示物。因此,例如,提及“一种分子”任选地包括两种或更多种这样的分子的组合等。
[0030]“持续反应”是指在停止治疗之后预防或延迟疾病(例如多发性骨髓瘤)进展和/或改善一种或多种反应标准的持续作用。例如,对于针对多发性骨髓瘤的治疗的反应可以根据以下文献中的标准来测量:kumar等人(2016)“international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma.”lancet oncol.17(8):e328-e346)和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473。(还参见本文中以下表a和表b)。在一些实施方案中,所述持续反应具有与治疗持续时间至少相同的持续时间,至少1.5x、2.0x、2.5x或3.0x治疗持续时间的长度。
[0031]
表a标准国际骨髓瘤工作组(imwg)反应标准
[0032][0033][0034]
spd,所测量病变的最大垂直直径的积之和
[0035]
术语“药物配制品”是指这样的制剂,其处于使得活性成分的生物活性有效的形式,并且不含对接受制剂的受试者具有不可接受的毒性的另外的组分。此类配制品是无菌的。“药学上可接受的”赋形剂(媒介物、添加剂)是可以合理地施用于受试哺乳动物以提供
有效剂量的所用活性成分的那些。
[0036]
如本文所用,术语“治疗”是指被设计用来在临床病理学过程中改变所治疗的疾病或细胞(例如癌细胞)的自然过程的临床介入。希望的治疗效果包括降低疾病进展速率、改善或缓和疾病状态、以及消退或者预后改善。例如,如果与癌症相关的一种或多种症状减轻或消除,则成功“治疗”个体,包括但不限于减少癌细胞的增殖(或破坏癌细胞)、减少由所述疾病产生的症状、提高患所述疾病的那些个体的生活质量、减少治疗所述疾病所需要的其他药物的剂量和/或延长个体的存活期。
[0037]
如本文所用,“延迟疾病的进展”意指推迟、阻碍、减缓、延缓、稳定和/或顺延疾病(如癌症)的发展。此延迟可以具有不同的时间长度,这取决于病史和/或所治疗的个体。对于本领域技术人员显而易见的是,足够或显著的延迟实际上可以涵盖预防,使个体不会患上疾病。例如,可能延迟晚期癌症,如转移的发展。
[0038]“有效量”至少是实现特定障碍的可测量改善或预防所需的最小量。本文的有效量可以根据如个体/患者的疾病状态、年龄、性别和体重及所述抗体在个体中引发希望的反应的能力等因素而变化。有效量还是其中治疗有益作用超过治疗的任何毒性或有害作用的量。对于预防性用途,有利或所需的结果包括以下的结果:如消除或减少风险、减轻严重性或延迟疾病(包括所述疾病的生化的、组织学的和/或行为的症状、在所述疾病发展期间存在的所述疾病的并发症和中间病理表型)的发作。对于治疗性用途,有利或所需的结果包括以下的临床结果:如减少由疾病引起的一种或多种症状、提高患有疾病的患者的生活质量、减少治疗疾病所需的其他药物的剂量、通过如靶向来增强另一种药物的效果、延迟疾病进展和/或延长存活。在癌症或肿瘤的情况下,药物的有效量可具有以下作用:减少癌细胞的数量;减小肿瘤尺寸;抑制(即,在某种程度上减慢并理想地阻止)癌细胞对周边器官的浸润;抑制(即,在某种程度上减慢并理想地阻止)肿瘤转移;在某种程度上抑制肿瘤生长;和/或在某种程度上减轻与障碍相关的一种或多种症状。可以将有效量以一次或多次施用来施用。出于本发明的目的,药物、化合物或药物组合物的有效量是足以直接地或间接地完成预防性或治疗性治疗的量。如在临床环境中所理解的,药物、化合物或药物组合物的有效量可与或可不与另一种药物、化合物或药物组合物结合来实现。因此,可在施用一种或多种治疗剂的环境中考虑“有效量”,并且如果与一种或多种其他药剂结合可实现或实现了合乎需要的结果,则可考虑以有效量施用单一药剂。
[0039]
如本文所用,术语“与
……
结合”是指除了另一种治疗模式之外还施用一种治疗模式。因此,“与
……
组合”是指在向个体施用另一种治疗模式之前、期间或之后施用一种治疗模式。
[0040]“受试者”或“个体”出于治疗目的是指分类为哺乳动物的任何动物,包括人类、家禽和农场动物,以及动物园动物、运动项目用动物或宠物如狗、马、猫、牛等。优选地,哺乳动物是人类。
[0041]
术语“抗体”在本文中以最广泛的意义使用并且具体地涵盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)以及抗体片段,只要它们展现出期望的生物学活性即可。
[0042]
通常将人轻链分类为κ和λ轻链,并且通常将人重链分类为μ、δ、γ、α或ε,并将抗体的同种型分别定义为igm、igd、igg、iga和ige。igg具有几个亚类,包括但不限于igg1、igg2、
igg3和igg4。igm具有多个亚类,包括但不限于igm1和igm2。iga被类似地细分为多个亚类,包括但不限于iga1和iga2。在全长轻链和重链内,可变结构域和恒定结构域通常通过约12个或更多个氨基酸的“j”区接合,并且重链还包括约10个或更多个氨基酸的“d”区。参见例如fundamental immunology(paul,w.编辑,raven press,第2版,1989),所述文献出于所有目的通过引用以其整体并入。每个轻/重链对的可变区通常形成抗原结合位点。抗体的可变结构域通常展现通过三个高变区(也称为互补决定区或cdr)接合的相对保守的框架区(fr)的相同总体结构。来自每一对的两条链的cdr通常通过框架区对齐,这可以使得能够结合至特异性表位。从氨基末端到羧基末端,轻链和重链可变结构域二者通常均依次包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
[0043]
术语“cdr组”是指存在于能够结合抗原的单一可变区中的一组三个cdr。这些cdr的确切边界已经根据不同系统以不同方式加以定义。由kabat所述的系统(kabat等人,sequences of proteins of immunological interest(national institutes of health,贝塞斯达(bethesda),马里兰州(md.)(1987)和(1991))不仅提供适用于抗体的任何可变区的明确残基编号系统,还提供定义三个cdr的准确残基边界。这些cdr可以被称为kabat cdr。
[0044]
如本文所用,术语“fc”是指将得自抗体消化或通过其他手段产生的非抗原结合片段的序列,其呈单体或多聚体形式,并且所述“fc”可以含有铰链区。天然fc的原始免疫球蛋白来源优选地是人来源的,并且可以是任何免疫球蛋白。fc分子由可以通过共价(即,二硫键)和非共价缔合连接成二聚体或多聚体形式的单体多肽组成。取决于类别(例如,igg、iga和ige)或亚类(例如,igg1、igg2、igg3、iga1、igga2和igg4),天然fc分子的单体亚基之间分子间二硫键的数量在1至4范围内。fc的一个例子是由igg的木瓜蛋白酶消化产生的二硫键键合的二聚体。如本文所用,术语“天然fc”是单体、二聚体和多聚体形式通用的。
[0045]
如本文所用,术语“总反应率”或“orr”是指具有严格的完全反应(scr)、完全反应(cr)、很好的部分反应(vgpr)和部分反应(pr)的个体/患者的比例,如通过irc使用以下文献中所述的imwg反应标准所评估的:kumar等人(2016)“international myeloma working group consensus crite ria for response and minimal residual disease assessment in multiple myelo ma.”lancet oncol.17(8):e328-e346和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473。还参见本文的表a和表b。
[0046]
综述
[0047]
本文提供了用于在已接受过针对多发性骨髓瘤的一种、两种、三种或多于三种先前疗法的个体中治疗多发性骨髓瘤或延迟其进展的方法或。所述方法包括向所述个体施用有效量的抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松。在一些实施方案中,所述治疗延长了所述个体的无进展存活期(pfs)和/或总存活期(os)。在一些实施方案中,与未接受治疗的个体相比,所述治疗延长了所述个体的无进展存活期(pfs)和/或总存活期(os)。在一些实施方案中,与接受采用卡非佐米和地塞米松但不采用所述抗cd38抗体(例如艾萨妥昔单抗)的治疗的个体相比,所述治疗延长了所述个体的无进展存活期(pfs)和/或总存活期(os)。在一些实施方案中,所述个体在治疗后对于微小残留病(mrd)呈阴性(例如,在10-4
或更小、10-5
或更小或10-6
或更小的阈值下)。
[0048]
抗cd38抗体
[0049]
在一些实施方案中,所述抗cd38抗体与人cd38结合。在一些实施方案中,所述抗cd38抗体是人抗体、人源化抗体或嵌合抗体。在一些实施方案中,所述抗cd38抗体包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtgyaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsldy(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3。在一些实施方案中,所述抗cd38抗体包含重链可变结构域(vh),所述重链可变结构域包含与seq id no:7具有至少90%(例如,91%、92%、94%、95%、96%、97%、98%或99%中的至少任一个,包括这些值之间的任何范围)一致性的氨基酸序列。另外地或可替代地,在一些实施方案中,所述抗cd38抗体包含轻链可变结构域(v
l
),所述轻链可变结构域包含与seq id no:8或seq id no:9具有至少90%(例如,91%、92%、94%、95%、96%、97%、98%或99%中的至少任一个,包括这些值之间的任何范围)一致性的氨基酸序列。在一些实施方案中,所述抗cd38抗体包含含有seq id no:7的vh和含有seq id no:8或seq id no:9的v
l
。
[0050][0051][0052]
在一些实施方案中,所述抗cd38抗体是艾萨妥昔单抗(cas登记号:1461640-62-9)。艾萨妥昔单抗也称为hu38sb19和sar650984,是wo2008/047242和美国专利号8,153,765中描述的抗cd38抗体,所述专利二者的内容通过引用以其整体并入本文。
[0053]
艾萨妥昔单抗的重链包含氨基酸序列:
[0054][0055]
并且艾萨妥昔单抗的轻链包含氨基酸序列:
[0056][0057]
可以使用重组方法产生抗cd38抗体。为了重组产生抗抗原抗体,将编码所述抗体的核酸分离,并将其插入可复制载体,用于进一步克隆(dna扩增)或表达。可以使用常规程序(例如,通过使用能够与编码所述抗体重链和轻链的基因特异性地结合的寡核苷酸探针)容易地分离和测序编码所述抗体的dna。许多载体是可用的。载体组分通常包括但不限于以下中的一者或多者:信号序列、复制起点、一种或多种标记基因、增强子元件、启动子和转录终止序列。载体通常被转化到适用于表达所述核酸的宿主细胞中。在一些实施方案中,所述宿主细胞是真核细胞或原核细胞。在一些实施方案中,所述真核细胞是哺乳动物细胞。有用的哺乳动物宿主细胞系的例子是经sv40转化的猴肾cv1系(cos-7,atcc crl 1651);人胚肾系(293细胞或为悬浮培养而亚克隆的293细胞,graham等人,j.gen virol.36:59(1977));幼仓鼠肾细胞(bhk,atcc ccl 10);小鼠支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1,atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);buffalo大鼠肝细胞(brl 3a,atcc crl 1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl51);tri细胞(mather等人,annals n.y.acad.sci.383:44-68(1982));mrc 5细胞;fs4细胞;和人肝癌细胞系(hep g2)。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc.natl.acad.sci.usa 77:4216(1980));和骨髓瘤细胞系,如ns0和sp2/0。关于适用于抗体产生的某些哺乳动物宿主细胞系的综述,参见例如,yazaki和wu,methods in molecular biology,第248卷(b.k.c.lo编辑,humana press,totowa,n.j.,2003),第255-268页。可使用例如羟基磷灰石色谱、疏水相互作用色谱、凝胶电泳、透析和亲和色谱(其中亲和色谱是一种通常优选的纯化步骤)来纯化由细胞制备的抗cd38抗体。通常,用于制备供研究、测试和临床应用的抗体的各种方法是本领域已完善建立的、与上文所述方法是一致的和/或被本领域技术人员认为是适当的。
[0058]
卡非佐米
[0059]
卡非佐米是由以下组成的合成的四肽:依序接合的吗啉-4-乙酰基、l-2-氨基-4-苯基丁酰基、l-亮氨酰基和l-苯丙氨酰基残基,其中c-末端经由酰胺连接被连接至(2s)-2-氨基-4-甲基-1-[(2r)-2-甲基环氧乙烷-2-基]-1-氧代戊烷-1-酮的氨基基团。卡非佐米的化学结构如下所示:
[0060][0061]
卡非佐米的分子式为c
40h57
n5o7并且分子量为719.91g/mol。卡非佐米的cas登记号为868540-17-4。卡非佐米是蛋白酶体抑制剂,其被配制用于静脉内施用。卡非佐米以商品名销售。
[0062]
地塞米松
[0063]
地塞米松的化学名是1-脱氢-16α-甲基-9α-氟氢化可的松,并且地塞米松具有以下化学结构:
[0064][0065]
地塞米松的分子式为c
22h29
fo5并且分子量为392.461g/mol。地塞米松作为用于口服和静脉内施用的配制品可商购获得。地塞米松的示例性商品名包括例如decadron、maxidex、hexadrol、dexacort、dexasone、oradexon、superprednol、dexalona等。
[0066]
药物组合物和配制品
[0067]
本文还提供了例如用于治疗多发性骨髓瘤(如难治性多发性骨髓瘤或复发性难治性多发性骨髓瘤)的药物组合物和配制品,所述药物组合物和配制品包含抗cd38抗体(如艾萨妥昔单抗)、卡非佐米或地塞米松。在一些实施方案中,所述抗cd38抗体(例如艾萨妥昔单抗)、所述卡非佐米和所述地塞米松中的每一种作为分开的药物组合物提供。在一些实施方案中,所述药物组合物和配制品进一步包含药学上可接受的载体。
[0068]
在一些实施方案中,本文所述的抗cd38抗体(如艾萨妥昔单抗)是在如下配制品中,所述配制品包含约20mg/ml(500mg/25ml)抗体、约20mm组氨酸、约10%(w/v)蔗糖、约0.02%(w/v)聚山梨酯80(ph 6.0)。在一些实施方案中,本文所述的抗cd38抗体(如艾萨妥昔单抗)是在如下配制品中,所述配制品包含约20mg/ml抗体、约100mg/ml蔗糖、2.22mg/ml组氨酸盐酸盐一水合物、约1.46mg/ml组氨酸和约0.2mg/ml聚山梨酯80。在一些实施方案中,所述配制品包含注射用水(wfi),如无菌注射用水(swfi)。在一些实施方案中,所述配制品是无菌的。在一些实施方案中,所述配制品的单次使用包含5ml的所述配制品(即100mg抗cd38抗体)。在一些实施方案中,所述单次使用的5ml配制品被提供于例如装配有弹性封闭
物的16ml型无色透明玻璃小瓶中。在一些实施方案中,已确定所述小瓶的填充体积以确保移取5ml。在一些实施方案中,填充体积是5.4ml。在一些实施方案中,所述配制品的单次使用包含25ml的所述配制品(即500mg抗cd38抗体)。在一些实施方案中,所述单次使用的25ml配制品被提供于例如装有弹性封闭物的30ml无色透明玻璃小瓶中。在一些实施方案中,已确定所述小瓶的填充体积以确保移取25ml。在一些实施方案中,所述配制品在约2℃与约8℃之间的温度下并且避光下稳定至少约6、12、18、24、30或36个月,包括这些值之间的任何范围。在一些实施方案中,将所述配制品在0.9%氯化钠或5%右旋糖中稀释以用于输注。在一些实施方案中,稀释的输注溶液在约2℃与约8℃之间稳定长达约6、12、18、24、30、36、42或48小时,包括这些值之间的任何范围。在一些实施方案中,输注用稀释溶液在约2℃与约8℃之间保存之后在室温下另外8小时(包括输注时间)内为稳定的。在一些实施方案中,输注用稀释溶液在光的存在下为稳定的。在一些实施方案中,储存输注用稀释溶液的袋由聚烯烃(po)、聚乙烯(pe)、聚丙烯(pp)、具有二(乙基己基)邻苯二甲酸酯(dehp)的聚氯乙烯(pvc)、或乙烯-醋酸乙烯酯(eva)制造。在一些实施方案中,用于输注的管件由pe、pvc(具有或不具有dehp)、聚丁二烯(pbd)或聚氨酯(pu)制造,具有管内过滤器(聚醚砜(pes)、聚砜或尼龙)。
[0069]
卡非佐米和地塞米松的药物配制品是可商购的。例如,卡非佐米以商品名为人所知。地塞米松以多种商品名(如本文其他部分所述)已知,包括decadron、maxidex和hexadrol。在一些实施方案中,所述卡非佐米和/或所述地塞米松被提供于分开的容器中。在一些实施方案中,所述卡非佐米和/或所述地塞米松各自用于和/或被制备用于向个体施用,如随可商购的产品可获得的处方信息中所述。
[0070]
治疗方法
[0071]
本文提供了用于治疗个体(例如人类个体)中的多发性骨髓瘤(如复发性多发性骨髓瘤或复发性难治性多发性骨髓瘤)或延迟其进展的方法,所述方法包括向所述个体施用有效量的抗cd38抗体(例如如下的抗cd38抗体,其包含(a)重链可变结构域(vh),所述重链可变结构域包含:含有氨基酸序列dywmq(seq id no:1)的cdr-h1、含有氨基酸序列tiypgdgdtg yaqkfqg(seq id no:2)的cdr-h2和含有氨基酸序列gdyygsnsld y(seq id no:3)的cdr-h3,以及(b)轻链可变结构域(v
l
),所述轻链可变结构域包含:含有氨基酸序列kasqdvstvva(seq id no:4)的cdr-l1、含有氨基酸序列sasyryi(seq id no:5)的cdr-l2和含有氨基酸序列qqhysppyt(seq id no:6)的cdr-l3)、卡非佐米和地塞米松,其中个体接受过针对多发性骨髓瘤的一种、两种、三种或多于三种先前疗法(或治疗线)。在一些实施方案中,所述个体接受过不多于三种先前疗法(或治疗线)。在一些实施方案中,如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松治疗延长了所述个体的无进展存活期(pfs)。在一些实施方案中,如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松的治疗延长了所述个体的总存活期(os)。在一些实施方案中,例如,与采用所述卡非佐米和地塞米松但不采用所述抗cd38抗体的治疗相比,如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松的治疗导致更低的微小残留病(mrd)。在一些实施方案中,所述个体在如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松的治疗后呈mrd阴性。在一些实施方案中,所述个体呈如下阈值下的微小残留病(mrd)阴性:治疗后10-4
或更小的阈值(例如,其中“10-4”意指在开始治疗后从所述个体获得的骨髓样品中,每104个骨髓细胞存在少于1个肿瘤细胞)、治疗后10-5
或更
小的阈值(例如,其中“10-5”意指在开始治疗后从所述个体获得的骨髓样品中,每105个骨髓细胞存在少于1个肿瘤细胞)、或治疗后10-6
或更小的阈值(例如,其中“10-6”意指在开始治疗后从所述个体获得的骨髓样品中,每106个骨髓细胞存在少于1个肿瘤细胞)。在一些实施方案中,经由下一代测序(ngs)评估mrd。在一些实施方案中,经由下一代流式细胞术(ngf)评估mrd。另外地或可替代地,在一些实施方案中,经由正电子发射断层摄影术-计算机断层摄影术(pet-ct)扫描评估mrd。在一些实施方案中,所述个体在如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松治疗之前(例如,在开始治疗时)显示出肾损害。在一些实施方案中,如果个体的肌酸清除率小于60ml/min/1.72m2(mdrd,或“肾脏病饮食改良”),则所述个体患有肾损害。在一些实施方案中,如本文所述采用所述抗cd38抗体、卡非佐米和地塞米松的治疗改善了所述个体的肾功能。
[0072]
在一些实施方案中,如果满足以下三个条件中的任何一个,则治疗被视为新治疗线:
[0073]
1.先前治疗线中止后开始新治疗线。如果治疗方案由于任何原因中止并开始不同的方案,则可以认为这是新治疗线。例如,如果已停止方案中的所有药物,则该给定方案被视为已中止。例如,如果方案的一些药物而非所有药物已中止,则认为所述方案尚未中止。在一些实施方案中,中止、添加、替代或干细胞移植(sct)的原因不影响细胞系如何计数。变化的原因可能包括,例如,计划的疗法的结束、毒性、进展、缺乏反应、反应不足。
[0074]
2.在现有方案中计划外地添加或替代一种或多种药物。由于任何原因而计划外地添加新药物或改为不同药物(或药物组合)都可以视为新治疗线。
[0075]
3.干细胞移植(sct)。在经历》1次sct的个体中,使用预定义间隔(如3个月)的计划串联sct的情况除外,每次sct(自体或同种异体)可被视为新治疗线,无论所用的调理方案是相同的还是不同的。在一些实施方案中,计划的串联sct被视为1个治疗线。在一些实施方案中,计划的诱导和/或巩固、用任何sct的维持(一线、复发、自体或同种异体)一般被视为1个治疗线。
[0076]
在一些实施方案中,所述多发性骨髓瘤难以治疗。在一些实施方案中,所述个体具有不良预后。
[0077]
在一些实施方案中,所述个体患有多发性骨髓瘤,例如复发性和/或难治性多发性骨髓瘤。在一些实施方案中,根据以下标准中的一种或多种,所述个体患有可测量的疾病:使用血清蛋白免疫电泳测量的血清m蛋白≥0.5g/dl和/或使用尿蛋白免疫电泳测量的尿m蛋白≥200mg/24h。在一些实施方案中,患有多发性骨髓瘤(例如复发性和/或难治性多发性骨髓瘤)的个体接受过针对多发性骨髓瘤的至少一种、至少两种、至少三种或不多于三种先前疗法(或治疗线)。在一些实施方案中,所述个体接受过采用蛋白酶体抑制剂的先前疗法。在一些实施方案中,所述个体接受过采用免疫调节药物(例如,沙利度胺、来那度胺和/或泊马度胺)的先前疗法。在一些实施方案中,所述个体接受过采用蛋白酶体抑制剂和免疫调节药物的先前疗法。
[0078]
在一些实施方案中,所述个体未患有原发性难治性多发性骨髓瘤。在一些实施方案中,患有原发性难治性多发性骨髓瘤的个体是在疾病过程期间用任何治疗(或治疗线)从未至少实现最小反应(mr)的个体。在一些实施方案中,所述个体未患有仅游离轻链(flc)可测量疾病。在一些实施方案中,所述个体尚未接受过采用抗cd38抗体的先前治疗。在一些实
施方案中,所述个体尚未接受过采用艾萨妥昔单抗的先前疗法(或先前治疗线)。在一些实施方案中,所述个体在采用抗cd38抗体的先前疗法(或先前治疗线)期间尚未显示出疾病进展(pd)。在一些实施方案中,所述个体在采用抗cd38抗体的治疗(或治疗线)结束之后60天内尚未显示出疾病进展。在一些实施方案中,所述个体对包含抗cd38抗体的疗法(或治疗线)未能实现至少最小反应。在一些实施方案中,已接受过包含抗cd38抗体的先前疗法(或治疗线)的个体不是所述抗cd38抗体难治的。在一些实施方案中,所述个体尚未接受过采用卡非佐米的先前治疗。在一些实施方案中,所述个体对(用于溶解卡非佐米的环糊精衍生物)不过敏(或对其不具有已知的过敏)。在一些实施方案中,所述个体对以下项不具有超敏性或尚未显示出对以下项的超敏性:蔗糖、组氨酸(作为碱和盐酸盐)、聚山梨酯80或者抗cd38抗体、卡非佐米和地塞米松中不宜用类固醇或h2阻断剂(将禁止用这些药剂进一步治疗)前驱用药的任何组分(活性物质或赋形剂)。在一些实施方案中,所述个体对于地塞米松没有禁忌。在一些实施方案中,所述个体尚未进行过关于活动性移植物抗宿主病的先前同种异体造血干细胞移植(任何等级和/或在开始治疗前的2个月内未处于免疫抑制治疗下)。在一些实施方案中,所述个体未患有已知的淀粉样变性或伴随的浆细胞白血病。在一些实施方案中,所述个体不具有需要胸腔穿刺术的胸腔积液或需要穿刺术或任何大手术(例如血浆置换术、治愈性放射疗法、大外科手术(不包括后凸成形术))的腹水。在一些实施方案中,所述个体不具有》2的东部合作肿瘤小组(ecog)体能状态(ps)。在一些实施方案中,如果《50%的骨髓(bm)有核细胞是浆细胞,则所述个体不具有《50,000个细胞/μl的血小板,如果≥50%的bm有核细胞是浆细胞,则所述个体不具有《30,000个细胞/μl的血小板。在一些实施方案中,所述个体不具有《1000μ/l(1x 109/l)的绝对嗜中性粒细胞计数(anc)。在一些实施方案中,所述个体不具有《15ml/min/1.73m2的肌酐清除率(肾脏病饮食改良[mdrd]公式)。在一些实施方案中,所述个体不具有》1.5x正常值上限(uln)的总胆红素,已知的吉尔伯特综合征除外。在一些实施方案中,所述个体不具有》14mg/dl(》3.5mmol/l)的经校正的血清钙。在一些实施方案中,所述个体不具有》3x uln的天冬氨酸转氨酶(ast)和/或丙氨酸转氨酶(alt)。在一些实施方案中,所述个体不具有》1级的来自任何先前抗骨髓瘤疗法的持续毒性(美国国立癌症研究院不良事件的通用毒性标准[nci-ctcae]v4.03)(不包括脱发和以上段落中列出的那些)。在一些实施方案中,所述个体不患有先前恶性肿瘤。在一些实施方案中,以下情况不被视为先前恶性肿瘤:经充分治疗的基底细胞或鳞状细胞皮肤或浅表性(ptis、pta和pt1)膀胱癌或低风险前列腺癌或治愈性疗法后的任何原位恶性肿瘤,以及在开始采用所述抗cd38抗体、卡非佐米和地塞米松的治疗前已经完成针对其的疗法≥5年并且所述个体已无疾病≥5年的任何其他癌症。在一些实施方案中,所述个体不患有心肌梗塞、严重/不稳定的心绞痛、冠状动脉/外周动脉搭桥术、纽约心脏协会iii或iv类充血性心力衰竭、≥3级心律失常、中风或短暂性脑缺血发作。在一些实施方案中,所述个体在开始采用所述抗cd38抗体、卡非佐米和地塞米松的治疗的六个月内不患有心肌梗塞、严重/不稳定的心绞痛、冠状动脉/外周动脉搭桥术、纽约心脏协会iii或iv类充血性心力衰竭、≥3级心律失常、中风或短暂性脑缺血发作。在一些实施方案中,所述个体不具有《40%的左心室射血分数(lvef)。在一些实施方案中,所述个体不患有或已知不患有需要抗逆转录病毒治疗的获得性免疫缺陷综合征(aids)相关疾病或hiv疾病,或活动性甲型、乙型(定义为已知的阳性乙型肝炎表面抗原(hbsag)结果)或丙型肝炎(定义为大于测定的
检测下限的已知定量丙型肝炎(hcv)核糖核酸(rna)结果,或阳性hcv抗原)感染。在一些实施方案中,所述个体在开始用所述抗cd38抗体、卡非佐米和地塞米松的治疗之前的3个月内不患有以下任何疾病:治疗抗性消化性溃疡疾病、糜烂性食管炎或胃炎、感染性或炎性肠病、憩室炎、肺栓塞或其他不受控制的血栓栓塞事件。
[0079]
在一些实施方案中,所述治疗包括在28天周期(例如,一个或多个28天周期)中施用所述抗cd38抗体、所述卡非佐米和所述地塞米松。
[0080]
在一些实施方案中,治疗包括在第一个28天周期(即第1周期)中施用所述抗cd38抗体、所述卡非佐米和所述地塞米松,其中将所述抗cd38抗体(例如,艾萨妥昔单抗)在第1、8、15和22天施用;将所述卡非佐米在第1、2、8、9、15和16天施用;并且将所述地塞米松在第1、2、8、9、15、16、22和23天施用。参见例如图2。在一些实施方案中,治疗包括在所述第一个28天周期后的一个或多个另外的28天周期中(例如,第2周期及以后)施用所述抗cd38抗体、所述卡非佐米和所述地塞米松,其中将所述抗cd38抗体(例如,艾萨妥昔单抗)在第1和15天施用;将所述卡非佐米在第1、2、8、9、15和16天施用;并且将所述地塞米松在第1、2、8、9、15、16、22和23天施用。参见例如图2。
[0081]
在一些实施方案中,治疗包括在第一个28天周期(即第1周期)中施用所述抗cd38抗体、所述卡非佐米和所述地塞米松,其中将所述抗cd38抗体(例如,艾萨妥昔单抗)在第1、8、15和22天以10mg/kg的剂量施用;将所述卡非佐米在第1和2天以20mg/m2的剂量施用以及在第8、9、15和16天以56mg/m2的剂量施用;并且将所述地塞米松在第1、2、8、9、15、16、22和23天以20mg的剂量施用。参见例如本文的表d。在一些实施方案中,治疗包括在所述第一个28天周期后的一个或多个另外的28天周期中(例如,第2周期及以后)施用所述抗cd38抗体、所述卡非佐米和所述地塞米松,其中将所述抗cd38抗体(例如,艾萨妥昔单抗)在第1和15天以10mg/kg的剂量施用;将所述卡非佐米在第1、2、8、9、15和16天以56mg/m2的剂量施用;并且将所述地塞米松在第1、2、8、9、15、16、22和23天以20mg的剂量施用。参见例如本文的表d。
[0082]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)、所述卡非佐米和所述地塞米松同时施用。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)、所述卡非佐米和所述地塞米松并行施用。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)、所述卡非佐米和所述地塞米松依序施用。在一些实施方案中,其中将所述抗cd38抗体(例如,艾萨妥昔单抗)、所述卡非佐米和所述地塞米松依序施用,在每个28天周期中施用所述抗cd38抗体、所述卡非佐米和所述地塞米中所有三种的日子,将所述地塞米松在所述抗cd38抗体之前施用,并且将所述抗cd38抗体在所述卡非佐米之前施用。在一些实施方案中,其中所述抗cd38抗体(例如,艾萨妥昔单抗)、所述卡非佐米和所述地塞米松依序施用,在每个28天周期中不施用抗cd38的日子,将所述地塞米松在所述卡非佐米之前施用。在一些实施方案中,将所述抗cd38抗体(如艾萨妥昔单抗)静脉内施用。在一些实施方案中,将所述卡非佐米静脉内施用。在一些实施方案中,将所述地塞米松静脉内或口服施用。在一些实施方案中,将所述地塞米松在每个28天周期的日子静脉内施用。
[0083]
在一些实施方案中,所述个体的pfs被测量为从开始治疗到第一次发生疾病进展(pd)的时间段。在一些实施方案中,pd是根据以下文献中评估的:kumar等人(2016)“international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma”.lancet oncol.17(8):
e328-e346)和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473。(还参见表a和表b)。在一些实施方案中,pfs被测量为从开始治疗到死亡时的时间。在一些实施方案中,与接受过包含卡非佐米和地塞米松而没有所述抗cd38抗体的治疗的患有多发性骨髓瘤(如难治性多发性骨髓瘤或复发性难治性多发性骨髓瘤)的个体相比,本文提供的方法和用途导致所述个体的改善(例如,延长)的无进展存活期(pfs)。在一些实施方案中,所述治疗增加了所述个体的pfs。
[0084]
在一些实施方案中,总存活期(os)被测量为从开始治疗到死亡的时间段。在一些实施方案中,与接受过包含卡非佐米和地塞米松而没有所述抗cd38抗体的治疗的患有多发性骨髓瘤(如难治性多发性骨髓瘤或复发性难治性多发性骨髓瘤)的个体相比,所述治疗增加了所述个体的os。
[0085]
在一些实施方案中,接受采用所述抗cd38抗体、卡非佐米和地塞米松的治疗的个体中到第一反应的时间短于接受采用卡非佐米和地塞米松的治疗的个体中到第一反应的时间。在一些实施方案中,“到第一反应的时间”是指在第一剂量的日期与第一反应体征的日期之间的持续时间(参见例如表a)。在一些实施方案中,接受采用所述抗cd38抗体、卡非佐米和地塞米松的治疗的个体的反应持续时间(dor)长于接受采用卡非佐米和地塞米松的治疗的个体的dor。在一些实施方案中,dor是指对于实现部分反应(pr)或更好的反应的一个个体(或多个个体)从反应日期到第一次记录的疾病进展(pd)或死亡(以先发生者为准)的日期的时间。
[0086]
在一些实施方案中,在采用所述抗cd38抗体、卡非佐米和地塞米松的治疗后,所述个体呈微小残留病(mrd)阴性或“mrd阴性”。在一些实施方案中,通过下一代流式细胞术(ngf)测量mrd状态。在一些实施方案中,如通过ngf测量的mrd阴性(或“流式mrd阴性”)是指在骨髓抽吸物中不存在表型异常的克隆浆细胞(如多发性骨髓瘤细胞)(例如,使用在多发性骨髓瘤中用于mrd检测的euroflowtm高通量流式细胞术标准操作程序(参见flores-montero等人(2017)leukemia.31:2094-2103)或等效方法),其中最小灵敏度为例如104个有核细胞中的1个(或“10-4”)、105个有核细胞中的1个(或“10-5”)、106个有核细胞中的1个(或“10-6”)或107个有核细胞中的1个(或“10-7”)。在一些实施方案中,通过下一代测序(ngs)测量mrd状态。在一些实施方案中,如通过ngs测量的mrd阴性(或“测序mrd阴性”)是指在骨髓抽吸物中不存在克隆浆细胞(例如,多发性骨髓瘤细胞);克隆的存在定义为在对骨髓瘤抽吸物进行dna测序之后获得至少两个相同测序读段(例如,使用高通量测序平台或等效方法),其中最小灵敏度为例如104个有核细胞中的1个(10-4
)、105个有核细胞中的1个(10-5
)、106个有核细胞中的1个(10-6
)或更高。在一些实施方案中,所述最小灵敏度是106个有核细胞中的1个细胞(“10-6”)。在一些实施方案中,所述个体在成像和mrd二者方面均呈阴性(或“成像 mrd阴性”)。在一些实施方案中,成像 mrd阴性是指(a)如通过ngf检测为mrd阴性或如通过ngs检测为mrd阴性,以及(b)在基线或先前正电子发射断层摄影术(pet)/计算机断层摄影术(ct)时发现的示踪物摄取增加的每个区域消失或者降低至《纵隔血池最大标准化摄取值或降低至小于周围正常组织的值。在一些实施方案中,所述个体呈“持续mrd阴性”。在一些实施方案中,持续mrd阴性是指个体在开始治疗之后的两个时间点已确认为成像 mrd阴性,其中所述时间点间隔不少于1年。在一些实施方案中,使用从已接受过如本文所述采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的
治疗的个体收集的骨髓样品经由ngf或ngs评估微小残留病(mrd)。在一些实施方案中,评估其mrd的个体在采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗期间或之后已实现了完全反应或更好的反应(即》cr),或已实现了很好的部分反应或更好的反应(即》vgpr)。在一些实施方案中,在开始治疗时、治疗期间或治疗之后,实现mrd阴性状态的采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗的个体患有肾损害,例如egfr《60ml/min/1.73m2。在一些实施方案中,实现mrd阴性状态的采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗的个体在诊断时被分类为iss iii期。在一些实施方案中,实现mrd阴性状态的采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗的个体具有选自以下的一种或多种细胞遗传学异常:t(4;14)和增加(1q21)。在一些实施方案中,实现mrd阴性状态的采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗的个体是经过严格预治疗的,例如已接受过针对多发性骨髓瘤的≥3个先前治疗线。在一些实施方案中,实现mrd阴性状态的采用所述抗cd38抗体(例如,艾萨妥昔单抗)、卡非佐米和地塞米松的治疗的个体在其最后方案(例如,针对多发性骨髓瘤的最后治疗方案)中是来那度胺难治的。
[0087]
在用于本文所述用途的抗cd38抗体的任何方法的一些实施方案中,所述个体小于65岁。在一些实施方案中,所述个体在65岁与小于75岁之间。在一些实施方案中,所述个体是75岁或更大。在一些实施方案中,所述个体是女性(例如,有生育能力的育龄女性)。在一些实施方案中,在所述个体为女性并且能够怀孕的情况下,所述个体可以在采用所述抗cd38抗体的治疗期间使用有效避孕方法并在最后剂量的所述抗cd38抗体之后持续五个月。
[0088]
在一些实施方案中,所述个体已经进行过针对多发性骨髓瘤的一种先前疗法(或先前治疗线)。在一些实施方案中,所述个体已经进行过针对多发性骨髓瘤的多于一种(例如,两种、三种或多于三种)先前疗法(或先前治疗线)。在一些实施方案中,所述个体已经进行过针对多发性骨髓瘤的多于一种但不多于三种的先前疗法(或先前治疗线)。在一些实施方案中,所述个体已经进行过针对多发性骨髓瘤的多于三种的先前疗法(或先前治疗线)。在一些实施方案中,所述个体根据多发性骨髓瘤的修订的国际分期系统(r-iss)是i期或ii期。在一些实施方案中,根据多发性骨髓瘤r-iss的i期被定义为(a)血清β-2微球蛋白水平小于3.5mg/l,(b)血清白蛋白大于或等于3.5g/dl,(c)通过间期荧光原位杂交(ifish)检测到的标准风险染色体/细胞遗传学异常和(d)正常血清乳酸脱氢酶(ldh)水平。在一些实施方案中,根据多发性骨髓瘤r-iss的ii期被定义为非r-iss i期或iii期。在一些实施方案中,所述个体根据多发性骨髓瘤的修订的国际分期系统(r-iss)是iii期。在一些实施方案中,根据多发性骨髓瘤r-iss的iii期被定义为(a)大于约5.5mg/l的血清β-2微球蛋白水平,以及(b)通过间期荧光原位杂交(ifish)检测到的高风险细胞遗传学异常或者(c)大于正常值上限的血清乳酸脱氢酶(ldh)水平。在一些实施方案中,所述个体具有高风险细胞遗传学异常(ca)。在一些实施方案中,所述高风险细胞遗传学异常是del(17p)、t(4:14)和/或t(14;16)中的一种或多种。在一些实施方案中,未根据r-iss对所述个体进行分类。在一些实施方案中,由于不确定的ifish,未根据r-iss对所述个体进行分类。
[0089]
在一些实施方案中,所述个体具有选自del(17p)、t(4:14)和t(14:16)的一种或多种高风险细胞遗传学异常。另外地或可替代地,在一些实施方案中,所述个体具有del(1p)、增加(1q),或del(1p)、增加(1q)两者的细胞遗传学异常。
[0090]
静脉内施用抗cd38抗体
[0091]
在一些实施方案中,将所述抗cd38抗体经由静脉内输注施用,其中每次输注来自250ml的体积(例如,固定体积)。在一些实施方案中,所述个体在经由从250ml体积的静脉内输注施用所述抗cd38抗体期间或之后没有经历输液反应(ir)。在一些实施方案中,所述个体在经由从250ml体积的静脉内输注施用所述抗cd38抗体期间或之后仅经历轻度ir。
[0092]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在第一个28天周期中施用于所述个体。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第1、8、15和22天的每一天从250ml的体积以10mg/kg的剂量施用于所述个体。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第1天经由静脉内输注以25ml/h的输注速率施用于所述个体,持续第一个小时,并且在所述第一个小时之后输注速率每30分钟增加25ml/h,增至最大输注速率150ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第1天经由静脉内输注以12.5ml/h的输注速率施用于所述个体,持续第一个30分钟,其中在所述第一个30分钟之后输注速率每30分钟增加25ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.2、6.3、6.4或6.5小时,包括这些值之间的任何范围。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约3.3小时与约6.1小时之间,包括该范围内的任何值。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约3.2与5.5小时之间,如在约3.36与约5.32小时之间。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约3.8与4.2小时之间,如约3.94小时。在一些实施方案中,输注的持续时间包括在所述输注完成之前的暂时中断。
[0093]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第8天经由静脉内输注以50ml/h的输注速率施用于所述个体,持续第一个30分钟,以100ml/h持续第二个30分钟,以200ml持续第三个30分钟以及在第三个30分钟之后以300ml/h持续直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第8天经由静脉内输注以25ml/h的输注速率施用于所述个体,持续第一个30分钟,并且在所述第一个30分钟之后输注速率每30分钟增加50ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,在所述第一个28天周期的第8天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.5小时与约3.5小时之间,包括该范围内的任何值。在一些实施方案中,在所述第一个
28天周期的第8天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.4与2.7小时之间,如在约1.52与约2.6小时之间。在一些实施方案中,在所述第一个28天周期的第8天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.5与2.0小时之间,如约1.88小时。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间包括在所述输注完成之前的暂时中断。
[0094]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第15天经由静脉内输注以200ml/h的输注速率施用于所述个体,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第15天经由静脉内输注以100ml/h的输注速率施用于所述个体,持续第一个30分钟,并且在所述第一个30分钟之后输注速率每30分钟增加50ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在所述第一个28天周期的第15天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,在所述第一个28天周期的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.2小时与约3.4小时之间,包括该范围内的任何值。在一些实施方案中,在所述第一个28天周期的第15天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与2小时之间,如在约1.03与约1.87小时之间。在一些实施方案中,在所述第一个28天周期的第15天的输注持续时间在约1与1.5小时之间,如约1.27小时。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间包括在所述输注完成之前的暂时中断。
[0095]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第22天经由静脉内输注以200ml/h的输注速率施用于所述个体,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第22天经由静脉内输注以100ml/h的输注速率施用于所述个体,持续第一个30分钟,并且其中在所述第一个30分钟之后输注速率每30分钟增加50ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在所述第一个28天周期的第22天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,在所述第一个28天周期的第22天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.1小时与约2小时之间,包括该范围内的任何值。在一些实施方案中,在所述第一个28天周期的第22天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与2小时之间,如在约1.18与约1.52小时之间。在一些实施方案中,在所述第一个28天周期的第22天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与1.5小时之间,如约1.27小时。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间包括在所述输注完成之前的暂时中断。
[0096]
在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)进一步在一个或多
个随后的28天周期中(例如,在所述第一个28天周期之后)在每个随后的28天周期的第1和15天的每一天以10mg/kg的剂量从250ml的体积施用。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在每个随后的28天周期(例如,在所述第一个28天周期之后)的第1天经由静脉内输注以200ml/h的输注速率施用于所述个体,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在每个随后的28天周期(例如,在所述第一个28天周期之后)的第1天经由静脉内输注以100ml/h的输注速率施用于所述个体,持续第一个30分钟,并且其中在所述第一个30分钟之后输注速率每30分钟增加50ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在每个随后的28天周期(例如,在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.1小时与约1.6小时之间,包括该范围内的任何值。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与2小时之间,如在约1.19与约1.41小时之间。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与1.5小时之间,如约1.27小时。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间包括在所述输注完成之前的暂时中断。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在每个随后的28天周期(例如,在所述第一个28天周期之后)的第15天经由静脉内输注以200ml/h的输注速率施用于所述个体,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,将所述抗cd38抗体(例如,艾萨妥昔单抗)在每个随后的28天周期(例如,在所述第一个28天周期之后)的第15天经由静脉内输注以100ml/h的输注速率施用于所述个体,持续第一个30分钟,并且其中在所述第一个30分钟之后输注速率每30分钟增加50ml/h,直到输注了250ml的所述抗cd38抗体(例如,艾萨妥昔单抗)。在一些实施方案中,在每个随后的28天周期(例如,在所述第一个28天周期之后)的第15天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1.2小时与约1.6小时之间,包括该范围内的任何值。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与2小时之间,如在约1.2与约1.46小时之间。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与1.5小时之间,如约1.27小时。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间包括在所述输注完成之前的暂时中断。
[0097]
在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第15天时或之后(例如,包括所述第一个28天周期的第22天和每个随后的28天周期的第1天和第15天)的每次输注的持续时间不多于以下中的任何一个:约0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0小时,包括这些值之间的任何范围。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第15天时或之后(例如,包括所述第一个28天周期的第22天和每个随后的28天周期的第1天和第15天)的每次输注的持续时间在约0.7与约3.4小时之间,包括该范围内的任何值。在一些实施方案中,所述抗cd38抗体(例如,艾萨妥昔单抗)在所述第一个28天周期的第15天时或之后(例如,包括所述第一个28天周期的第22天和每个随后的28天周期的第1天和第15天)的每次输注的持续时间在约1与约2小时之间,如在约1.13与约1.53小时之间。在一些实施方案中,在每个随后的28天周期(例如在所述第一个28天周期之后)的第1天所述抗cd38抗体(例如,艾萨妥昔单抗)的输注持续时间在约1与1.5小时之间,如约1.25小时。
[0098]
在一些实施方案中,所述个体在从250ml体积以10mg/kg的剂量施用所述抗cd38抗体(如艾萨妥昔单抗)期间或之后未经历输液反应(ir)。在一些实施方案中,从250ml体积以10mg/kg的剂量施用所述抗cd38抗体(例如,经由静脉内输注)未导致所述个体在施用期间或之后经历ir。ir是指一种特征在于对抗cd38抗体(例如,艾萨妥昔单抗)的静脉内输注的不良反应的障碍。在所述输注期间或所述输注的24小时(如从所述输注开始时的24小时)内可能发生ir。ir的体征或症状包括以下中的一种或多种:感觉异常、胸痛、咳嗽、鼻塞、打喷嚏、喉部刺激、瘙痒、晕厥、潮红、发冷、发热、荨麻疹、血管性水肿、皮疹、皮肤反应、发痒、斑状丘疹、心动过速、低血压、呼吸困难、恶心、呕吐、头痛、背痛、胸部不适或非心源性胸痛、腹痛、腹部绞痛、支气管痉挛、喉痉挛、喘息、呼吸道充血、出汗过多和红斑。(更多详情参见例如,doessegger等人(2015)clin&trans immunol.4(7):e39。)因此,在一些实施方案中,所述个体未经历这些体征或症状中的任何一种或多种。
[0099]
在一些实施方案中,所述个体未接受(例如,不需要)前驱用药,即在输注所述抗cd38抗体(例如,艾萨妥昔单抗)之前出于预防或最小化ir的目的而施用的药物。在一些实施方案中,所述个体在输注所述抗cd38抗体(例如,艾萨妥昔单抗)之后未接受(例如,不需要)用于预防或最小化ir的药物(例如,预防性药物)。在一些实施方案中,所述个体在从250ml体积以10mg/kg的剂量施用(例如,静脉内输注)所述抗cd38抗体(如艾萨妥昔单抗)之后未经历延迟的输液反应。在一些实施方案中,所述个体在从250ml体积以10mg/kg的剂量施用(例如,静脉内输注)所述抗cd38抗体(如艾萨妥昔单抗)之后约0.5、1.0、1.5、2.0、2.5或3.0小时中的任何一个时间内未经历延迟的输液反应。在一些实施方案中,所述个体未接受(例如,不需要)事后用药(post-medication),即在从250ml体积以10mg/kg的剂量输注所述抗cd38抗体(例如,艾萨妥昔单抗)之后出于预防或最小化ir的目的而施用的药物。在一些实施方案中,所述个体在从250ml体积以10mg/kg的剂量输注所述抗cd38抗体(例如,艾萨妥昔单抗)之后约0.5、1.0、1.5、2.0、2.5或3小时中的至少约任何一个时间内未接受(例如,不需要)例如出于预防或最小化ir的目的的事后用药。在一些实施方案中,所述个体在从250ml体积以10mg/kg的剂量输注所述抗cd38抗体(如艾萨妥昔单抗)之前未接受以下中任何一种或多种的出于预防或最小化ir的目的的前驱用药或事后用药:镇痛药(例如,醋氨酚
或对乙酰氨基酚)、h2拮抗剂或抗酸药(如雷尼替丁、西咪替丁、奥美拉唑或埃索美拉唑)、抗炎剂(如皮质类固醇或非类固醇抗炎药)和/或抗组胺药(如苯海拉明、西替利嗪、普鲁米近、右氯苯那敏)。
[0100]
在一些实施方案中,所述个体在施用所述抗cd38抗体(如艾萨妥昔单抗)之后经历轻度ir。在一些实施方式中,所述轻度ir不超过如在美国国立癌症研究院不良事件的通用术语标准第4.03版(nci-ctcae v.4.03)中所定义的1级或2级ir。nci-ctcae v.4.03可在evs(dot)nci(dot)nih(dot)gov/ftp1/ctcae/about(dot)html上公开获得。在一些实施方案中,在如下情况下ir为1级ir:所述个体经历轻度的短暂反应(例如,本文所述的一种或多种体征/症状,如在开始输注的24小时内),其中没有指示输注中断和/或其中没有指示干预。在一些实施方案中,在如下情况下ir为2级ir:所述个体经历反应(例如,本文所述的一种或多种体征/症状,如在开始输注的24小时内),其中输注被中断和/或其中指示干预,并且其中所述个体如在针对ir的处理的2、4、6、8、10、12、14、16、18、20或14小时中的约任何一个时间内对处理(即,对ir的一种或多种体征或症状的处理)迅速反应。在一些实施方案中,对ir的处理包括以下中的一种或多种:短期中断输注、施用氧气、施用支气管扩张剂、施用皮质类固醇、施用组胺阻断剂以及以较慢的速率重新开始输注。
[0101]
在一些实施方案中,所述个体在从250ml固定体积第一次静脉内输注10mg/kg的所述抗cd38抗体(如艾萨妥昔单抗)期间或之后(例如在所述第一个28天周期的第1天输注期间)经历轻度ir(例如,1级或2级ir)。在一些实施方案中,所述个体在从250ml固定体积第二次或随后输注所述抗cd38抗体(例如,艾萨妥昔单抗)期间未经历ir(或没有进一步ir)。例如,在一些实施方案中,所述个体在所述第一个28天周期的第8、15和22天的任何一天和在任何随后的28天周期的第1和15天的任何一天从250ml固定体积输注10mg/kg的所述抗cd38抗体(如艾萨妥昔单抗)期间未经历ir(或没有进一步ir)。
[0102]
在一些实施方案中,所述个体在例如根据本文所述的方法从250ml体积输注抗cd38抗体之后未经历中度或严重ir。在一些实施方式中,所述个体未经历如在美国国立癌症研究院不良事件的通用术语标准第4.03版(nci-ctcae v.4.03)中所定义的3、4、或5级ir。在一些实施方案中,在如下情况下ir为3级ir:所述个体经历延长的ir体征/症状(如本文所述)并且对针对ir的药物和/或输注中断没有快速反应。在一些实施方案中,在如下情况下ir为3级ir:所述个体在初始改善之后经历ir的体征/症状(如本文所述)的复发。在一些实施方案中,在如下情况下ir为3级ir:所述个体需要针对ir的体征/症状(如本文所述)住院治疗。在一些实施方案中,在如下情况下ir为4级ir:所述体征/症状(如本文所述)危及生命和/或需要紧急干预。在一些实施方案中,在如下情况下ir为5级ir:ir的体征/症状导致死亡。
[0103]
在一些实施方案中,在治疗期间,例如无论所述个体是否经历ir,从250ml体积施用的抗cd38抗体(如艾萨妥昔单抗)的剂量没有降低。
[0104]
制品或试剂盒
[0105]
在本发明的另一个实施方案中,提供了一种包含抗cd38抗体(如艾萨妥昔单抗)的制品或试剂盒。在一些实施方案中,所述制品或试剂盒进一步包含卡非佐米和/或地塞米松。在一些实施方案中,所述制品或试剂盒进一步包含包装插页,所述包装插页包含用于使用所述抗cd38抗体(例如,艾萨妥昔单抗)与卡非佐米和地塞米松的组合在已接受过针对多
发性骨髓瘤的1至3种先前疗法(或先前治疗线)的个体中治疗多发性骨髓瘤(例如,难治性多发性骨髓瘤或复发性难治性多发性骨髓瘤)或延迟其进展的说明书。在一些实施方案中,所述试剂盒包含艾萨妥昔单抗、卡非佐米和地塞米松。
[0106]
说明书被视为足以使得本领域技术人员能够实施本发明。除了本文所示和所述的那些修改之外,本发明的各种修改对于本领域技术人员而言从上文的描述将变得清楚并且落入所附权利要求的范围内。本文引用的所有公开、专利和专利申请出于所有目的据此通过引用以其整体并入本文。
[0107]
实施例
[0108]
通过参考下述实施例,会更加全面地理解本公开文本。然而,它们不应被解读为限制本发明的范围。应当理解,本文所述的实施例和实施方案仅用于说明目的,并且根据它们进行的各种修改或改变将为本领域技术人员知晓,并且应包括在本技术的精神和范围内以及所附权利要求的范围内。
[0109]
实施例1a:在患有难治性或复发性难治性多发性骨髓瘤的患者中比较艾萨妥昔单抗(sar650984)与卡非佐米和低剂量地塞米松的组合相比于卡非佐米和低剂量地塞米松的iii期随机化、开放标签、多中心研究
[0110]
本实施例描述了一项iii期、多中心、跨国、随机化、开放标签、平行小组、2组研究,其评估每周两次艾萨妥昔单抗与卡非佐米和地塞米松的组合(“ikd”组)相比于卡非佐米和地塞米松(“kd”组)在先前用1至3种先前治疗线治疗的复发性和/或难治性多发性骨髓瘤患者中的临床益处。
[0111]
i.研究目标
[0112]
a.主要目标
[0113]
本研究的主要目标(即主要终点)是证明与卡非佐米和地塞米松(kd)相比,使用imwg标准在用1至3种治疗线治疗的复发性和/或难治性mm患者中艾萨妥昔单抗与卡非佐米和地塞米松的组合(ikd)在延长pfs方面的益处。
[0114]
无进展存活期定义为从随机化的日期起到第一次记录疾病进展的日期或因任何原因而死亡的日期的时间,以先发生者为准。反应和进展是根据imwg标准(参见kumar等人(2016)“international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma.”lancet oncol.17(8):e328-e346)和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473)来确定的。基于2次连续评估,确认了基于副蛋白的进展。
[0115]
在筛查(针对合格性)时、第1周期第1天在施用研究治疗之前(反应评估的基线)、在治疗直至进展的期间每个周期的第1天、在治疗结束(eot)时、以及对于在没有pd的情况下中止研究治疗的患者,在随访直到pd的每个月,执行以下疾病评估程序(甚至是在没有pd的情况下将开始进一步抗骨髓瘤疗法的患者也是如此):
[0116]
·
m蛋白定量(血清和24小时尿、蛋白质免疫电泳和免疫固定)。在第1周第1天后,在检测不到m蛋白(血清和尿)的情况下,进行免疫固定。
[0117]
·
血清游离轻链定量。
[0118]
·
量化免疫球蛋白。
[0119]
·
在基线时(骨髓疾病受累、fish和mrd)以及随后在vgpr或更好的反应的情况下骨髓穿刺(或如临床上指示的活检)。
[0120]
·
骨病评估:
[0121]-在基线时、随后每年一次以及在研究期间临床上有指示的任何时候进行骨骼检查或小剂量全身计算机断层摄影术(ct)扫描。
[0122]
·
髓外疾病(浆细胞瘤)评估(包括骨浆细胞瘤):
[0123]-如果在基线时已知髓外疾病,则在基线时进行ct扫描或磁共振成像(mri),每12周(
±
1周)重复一次直到pd(甚至对于在没有pd的情况下将开始进一步抗骨髓瘤疗法的患者也是如此)以及在临床上指示时进行ct扫描或磁共振成像。
[0124]-如果在基线时怀疑是髓外疾病(浆细胞瘤),则在基线时进行ct扫描或mri,并且在确认浆细胞瘤的情况下,每12周(
±
1周)重复一次ct扫描或mri直到pd(甚至对于在没有pd的情况下将开始进一步抗骨髓瘤疗法的患者也是如此),以及在临床上指示时进行ct扫描或mri。
[0125]-在研究治疗期间的任何时候、在怀疑现有浆细胞瘤的进展的情况下、或在没有先前对于髓外疾病的阳性图像的患者中在临床上指示时。
[0126]
对于骨病变评估和髓外疾病,在整个研究中对每个单独患者使用相同的检查模式(骨骼检查或低剂量全身ct扫描;ct扫描或mri)。
[0127]
对于具有可测量的血清和/或尿m蛋白的患者,疾病进展(imwg标准)定义为以下中的任何一种(2次连续评估中的生物学标准):
[0128]
·
血清m组分从最低点增加≥25%(绝对增加必须≥0.5g/dl);如果起始m组分≥5g/dl,则在2次连续评估中血清m组分增加≥1g/dl足以确定复发;和/或
[0129]
·
尿m组分从最低点增加≥25%(绝对增加必须≥200mg/24h);和/或
[0130]
·
》1个病变的情况下明确发展新骨病变或软组织髓外疾病或者现有软组织髓外疾病病变的垂直直径之和从最低点增加≥50%,或者在短轴上》1cm的先前软组织髓外疾病病变的最长直径增加≥50%。
[0131]
如果独立审查委员会认为报告的临床数据支持临床进展,则pfs的主要分析中将临床恶化视为进展。在血钙过多的情况下,进行全面的疾病评估以鉴定骨髓瘤进展的任何可测量参数(例如血清和尿m蛋白、溶骨性病变评估和浆细胞瘤评估),并应排除血钙过多的潜在替代原因。仅flc进展不能诊断为进展。方案中允许患有仅flc可测量疾病的患者。如果血清和尿m蛋白均低于第1周期第1天得到的关于功效实验室的合格性水平,则根据以下表a和表b中的标准评估进展和总反应。
[0132]
表a.标准国际骨髓瘤工作组(imwg)反应标准
[0133][0134][0135]
表b:imwg微小残留病标准(要求表a中定义的cr)
[0136][0137]
表a和表b的缩写:cr=完全反应、flc=游离轻链、imwg=国际骨髓瘤工作组、m=单克隆、mrd=微小残留病、ngf=下一代流式细胞术、ngs=下一代测序、pd=疾病进展、pet=正电子发射断层摄影术、mr=微小反应、pr=部分反应、scr=严格的完全反应、sd=疾病稳定、spd=所测病变的最大垂直直径积之和、suv=最大标准化摄取值、vgpr=很好的部分反应。
[0138]
b.关键次要功效终点
[0139]
关键次要功效终点是:
[0140]
·
orr:评估每位患者的最佳总反应以确定orr,其定义为具有如使用imwg反应标准(参见表a)评估的严格的完全反应(scr)、cr、vgpr和pr作为最佳总反应的患者的比例。根据研究者的决定进行骨髓活检以用于scr评估。
[0141]
·
vgpr或更好的反应的比率:定义为具有scr、cr和vgpr的患者的比例。
[0142]
·
vgpr或更好的反应且mrd阴性的比率:定义为在研究治疗的第一剂量后的任何时候通过测序评估的mrd呈阴性的患者的比例。通过下一代测序在来自实现vgpr或更好的反应的患者的骨髓(bm)样品中评估微小残留病,从而确定分子水平上的反应深度。对于阴性的阈值为至少10-5
。在筛查时和在确认为vgpr或更好的反应时收集骨髓抽吸物(bma)。如果患者表现为vgpr或更好的反应但被确定为mrd阳性,则在3个月(3个周期)后收集另一个bm样品以鉴定最近的阴性。如果患者保持mrd阳性且仍在接受治疗,则在另外3个月后收集第三个样品。除非患者在vgpr期间进行的第三个bm样品呈mrd阳性后实现cr,否则不会获得多于3个治疗期的骨髓样品-。在这种情况下,收集了不多于3个另外的bm样品。因此,患者最多进行6个bma(每种反应类别不多于3个)。然而,由于bma是侵入性操作,因此给出以下指导,目的是尽可能限制bma的数量。
[0143]-对于没有先前vgpr记录的具有cr的患者:在确认cr时(即在显示cr的第二个时间点)收集第一骨髓用于mrd评估。如果患者被确定为mrd阳性,则在3个月(3个周期)后收集另一个bm样品以鉴定最近的阴性。如果患者保持mrd阳性且仍在接受治疗则在另外3个月后收集第三个样品。
[0144]-对于具有vgpr的患者:当在第二个时间点或基于m蛋白减少的动力学按照研究者的判断在稍晚的时间点和/或在达到稳定期(稳定被定义为12周内变化小于20%)的情况下
收集第一骨髓。如果对于第一个bma的mrd呈阳性,则在3个月后(3个周期)收集第二个bma以鉴定最近的阴性。对于在患者处于vgpr时得到的第二个bma仍然呈mrd阳性的情况下,可以推迟进行第三个bma的时间,直到实现cr。在患者变为cr且患者对于在vgpr期间进行的最后一个bma呈mrd阳性的情况下,在确认cr时将进行bma以用于mrd评估。在cr期间进行第一个bma之后,并且在患者对于该bma呈mrd阳性的情况下,可以与患者讨论方案中计划的另外bma。
[0145]
·
cr率:定义为具有scr和cr的患者的比例。当可使用抗体捕获干扰测定时,具有已证明的艾萨妥昔单抗干扰的患者将被考虑在与无干扰情况下获得的m蛋白评估相对应的bor类别中。
[0146]
·
os:定义为从随机化日期到因任何原因死亡的时间。
[0147]
c.其他次要功效终点
[0148]
其他次要功效终点如下进行评价:
[0149]
·
反应持续时间(dor):定义为从对于实现pr或更好的反应的患者首次经irc确定的反应的日期到首次记录的疾病进展(pd)或死亡的日期(以先发生者为准)的时间。
[0150]
·
到进展的时间(ttp):定义为从随机化到首次记录pd的日期的时间。
[0151]
·
pfs2:定义为从随机化日期到开始进一步抗骨髓瘤治疗后首次记录pd或因任何原因死亡的日期(以先发生者为准)的时间。
[0152]
·
到首次反应的时间:定义为从随机化到随后确认的首次反应(pr或更好的反应)的日期的时间。
[0153]
·
到最佳反应的时间:定义为从随机化到首次出现最佳总反应(pr或更好的反应)的日期的时间。
[0154]
d.安全性终点
[0155]
通过所述研究评估了关于以下项的安全性并进行了报告:治疗期间不良事件(teae)、不良事件(ae)、严重不良事件(sae)、输注相关反应(iar)、东部合作肿瘤小组体能状态(ecog ps,参见oken等人toxicity and response criteria of the eastern cooperative oncology group.am j clin oncol.1982;5:649-55)、实验室参数、生命体征和身体检查的检查结果。
[0156]
在整个研究过程中收集不良事件数据。治疗期间ae定义为在治疗期过程中发展、恶化或变得严重的ae。治疗期定义为从研究治疗的第一个剂量直至研究治疗的最后一个剂量后30天之间的时间。不良事件和实验室参数将使用nci-ctcae v4.03进行分级(参见例如,https://www(dot)eortc(dot)be/services/doc/ctc/ctcae_4.03_2010-06-14_quickreference_5x7.pdf)。
[0157]
e.患者报告结局
[0158]
患者报告结局衡量指标包括欧洲癌症研究与治疗组织(european organ isation for research and treatment of cancer,eortc)具有30个问题的生活质量问卷调查(quality of life questionnaire with 30questions,qlq c 30)、具有20个项目的eortc骨髓瘤模块(qlq-my20)和具有5个维度且每个维度具有5个水平的欧洲生活质量组衡量指标(eq-5d-5l)。(参见例如,https://qol(dot)eortc(dot)org/questionnaires/and https://euroqol(dot)org/eq-5d-in struments/eq-5d-5l-about/)。
[0159]
所有3个问卷都被设计为用于自我完成。所有患者报告结局均由患者在现场完成。为了最大程度地减少偏差,患者在临床医生评估并讨论其临床状况、治疗计划、不良事件以及可能影响患者在回答问题前的感知和感觉的任何其他相关主题之前填写epro。
[0160]
f.药代动力学
[0161]
对ikd组中的所有患者均进行了针对艾萨妥昔单抗的药代动力学(pk)评价。使用稀疏采样策略从所有接受艾萨妥昔单抗治疗的患者采集血液样品直至第10周期,以使用群体pk方法评估艾萨妥昔单抗的pk曲线。在来自ikd组的大约12名患者的亚组中,在第1周期第15天的所选择的时间点收集血液样品以用于卡非佐米pk评价。测量的pk参数包括但不限于以下表c中列出的那些。
[0162]
表c.示例性药代动力学参数
[0163][0164][0165]
f.免疫原性
[0166]
从第1周期到第10周期,仅在第1天施用艾萨妥昔单抗之前,评估对于ikd患者的针对艾萨妥昔单抗的人抗药物抗体(ada)。
[0167]
g.探索性终点
[0168]
在第1个周期的第1天收集血液样品。提取白细胞dna并分析免疫遗传决定因素(如fcγ受体多态性),并将其与临床反应的参数相关联。
[0169]
仅在ikd组中,在所有时间点都采集了另外的血液样品,以评价艾萨妥昔单抗在直至第30周期的m蛋白评估中的潜在干扰。在第30周期后仅对于在该周期时达到至少vgpr的患者收集这种样品,并持续直到疾病进展。在艾萨妥昔单抗在进展前停止的情况下,收集样品干扰测定直到3个月或pd,以先发生者为准。在第1周期第1天后,在所有患者中m蛋白为0g/dl的情况下分析免疫固定样品。另外,为了鉴定具有潜在艾萨妥昔单抗干扰的患者,还在血清m蛋白≤0.2g/dl的患者中分析了免疫固定样品。
[0170]
除了基线时通过荧光原位杂交(fish)评估的3种细胞遗传学异常(del(17p)、t(4:14)和t(14:16))以确定作为分层因素的r-iss分期以外,还评估了其他细胞遗传学异常(如但不限于del(1p)和增加(1q)缺失)并将其与临床反应的参数相关联。
[0171]
选择上文所述的每种评估用于本研究,并且所述评估被认为是完善的并且在血液肿瘤学情境下是相关的。
[0172]
ii.研究设计
[0173]
在确认合格性标准(其在下文中进一步详细描述)之后,使用交互反应技术(irt)系统以3:2比率(实验组:对照组)将患者随机分配至以下表d所示的两个组之一。预期的患者总数为300(ikd组中180名患者,并且kd组中120名患者)。研究设计的示意图也在图1中提供。
[0174]
表d:研究治疗组
[0175][0176]
依据先前治疗线的数量(1相比于多于1)和r-iss分期(i或ii相比于iii相比于未分类)对随机化进行分层。参见palumbo a,等人revised internatio nal staging system for multiple myeloma:a report from international myeloma working group.j clin oncol.2015;33(26):3863-9。对患者进行治疗,直到疾病进展、不可接受的不良事件(例如,不可接受的毒性)或患者的意愿,以先发生的为准。
[0177]
a.每名患者的研究参与持续时间
[0178]
在本研究中考虑了每名患者从签署知情同意书直到死亡、同意退出或总存活期分析截止日期(以先发生者为准)。
[0179]
本研究的患者的持续时间包括长达3周的筛选时间段。每个治疗周期的持续时间是28天。患者继续研究治疗直到疾病进展、不可接受的ae、患者的意愿或任何其他原因。报告签署知情同意书后出现的所有ae,直至在最后一次施用研究治疗后30天。
[0180]
在终止研究治疗后,患者在研究治疗的对于治疗结束而言的最后一个剂量之后30天或在开始进一步抗骨髓瘤疗法之前(以先发生者为准)、治疗结束(eot)评估时以及在研究治疗的对于hrql问卷而言的最后一个剂量之后90天返回研究地点。
[0181]
相关的ae和所有sae(无论与研究治疗中断时正在进行的研究治疗的关系如何)都在随访期内进行跟踪直到消退或稳定。在随访期内,收集与研究治疗和任何第二原发性恶性肿瘤相关的所有(严重或不严重的)新ae,并进行随访直到消退或稳定。
[0182]
因疾病稳定(pd)而中止研究治疗的患者在首次fu访视时(最后一次研究治疗后90天)进行hrql,针对进一步抗骨髓瘤疗法、第二原发性恶性肿瘤、pfs2、以及存活期每3个月(12周)随访一次,直到死亡或最终pfs分析截止日期(以先发生者为准)。在pd记录之前中止研究治疗的患者每4周随访一次,直到疾病进展(甚至对于在没有pd的情况下开始进一步抗
骨髓瘤疗法的患者也是如此),最后一次研究治疗后90天进行hrql,然后在确认疾病进展之后,针对进一步抗骨髓瘤疗法、第二原发性恶性肿瘤、pfs2和存活期每3个月(12周)随访一次,直到死亡或最终pfs分析截止日期(以先发生者为准)-。
[0183]
对于在最终pfs分析截止日期时所有活着的患者,在最终pfs分析截止日期之后大约一年收集存活状态,此后每年收集存活状态直至最终pfs分析截止日期后3年。
[0184]
在最终pfs分析截止日期或os分析截止日期时仍在接受治疗并从研究治疗中受益的患者继续研究治疗,直到疾病进展、不可接受的ae、患者对于中止进一步研究治疗的意愿或任何其他原因。对于在截止日期之后施用的周期,继续收集在该截止日期时所有正在进行的sae(相关或不相关)和所有正在进行的相关不严重ae、所有新相关ae(严重或不严重的)、ip施用和eot的原因。如果患者在最终pfs分析截止日期时接受了不足10个周期,则停止抗药物抗体(ada)/pk样品。在最后一个ada呈阳性或不确定的情况下,则在3个月后对进行另外的ada采样。即使该3个月样品呈阳性,也不会再进行ada采样。
[0185]
b.临床试验结束的确定(所有患者)
[0186]
pfs分析(主要终点分析)是事件驱动的,并且最终pfs分析截止日期是已出现过159个pfs事件(进展或死亡,以先发生者为准)时的日期(从第一个患者被随机化后大约36个月)。os分析截止日期大约是在主要pfs分析截止日期之后3年。pfs的主要分析对应于积极的期中分析或最终pfs分析。
[0187]
iii.选择患者
[0188]
a.纳入标准
[0189]
如果患者满足所有以下标准,则考虑纳入合格患者:
[0190]
·
多发性骨髓瘤。
[0191]
·
可测量的疾病:使用血清蛋白免疫电泳测量的血清m蛋白≥0.5g/dl和/或使用尿蛋白免疫电泳测量的尿m蛋白≥200mg/24h。
[0192]
·
复发性和/或难治性mm患者,其接受过至少1个先前治疗线且不多于3个先前治疗线,包括和蛋白酶体抑制剂。
[0193]
·
在执行任何与正常医疗护理无关的研究相关程序之前,患者已提供自愿的书面知情同意书。
[0194]
治疗线由以下组成:≥1个完整周期的单一药剂、由若干种药物的组合组成的方案或计划的各种方案序贯疗法。如果满足以下3个条件中的任何1个,则治疗被视为新治疗线(参见例如,rajkumar等人guidelines for the determination of the number of prior lines of therapy in multiple myeloma.blood 2015;127(7):921-2)。
[0195]
i.先前治疗线中止后开始新治疗线。
[0196]
如果治疗方案由于任何原因中止并开始不同的方案,则应认为这是新治疗线。如果已停止方案中的所有药物,则该给定方案被视为已中止。如果方案的一些药物而非所有药物已中止,则认为所述方案尚未中止。中止、添加、替代或干细胞移植(sct)的原因不影响细胞系如何计数。公认的是,变化的原因可以包括计划的疗法的结束、毒性、进展、缺乏反应、反应不足。
[0197]
ii.在现有方案中计划外地添加或替代一种或多种药物。
[0198]
由于任何原因而计划外地添加新药物或改为不同药物(或药物组合)都被视为新
治疗线。
[0199]
干细胞移植(sct):在经历》1次sct的患者中,使用预定义间隔(如3个月)的计划串联sct的情况除外,每次sct(自体或同种异体)应被视为新治疗线,无论所用的调理方案是相同的还是不同的。建议还捕获关于sct类型的数据。计划的串联sct被视为1个治疗线。计划的诱导和/或巩固、用任何sct的维持(一线、复发、自体或同种异体)被视为1个治疗线。
[0200]
iii.中断和剂量改变
[0201]
如果因任何原因中断或中止方案,并且在没有任何其他干预方案的情况下重新开始相同的药物或组合,则应将其计数为单一治疗线。然而,如果因任何原因中断或中止方案然后在稍后的时间点重新开始,但在此期间施用了1种或多种其他方案,或者通过添加1种或多种药剂对所述方案进行了修改,则应将其计数为2个治疗线。修改相同方案的给药不应视为新治疗线。
[0202]
b.排除标准
[0203]
根据以下排除标准对满足以上所有纳入标准的患者进行筛选:
[0204]
·
年龄小于18岁(或如果法定年龄》18岁,则为国家法定成年年龄)。
[0205]
·
原发性难治性mm,定义为患者在疾病过程期间使用任何治疗从未实现至少mr。
[0206]
·
患有仅血清游离轻链(flc)可测量疾病的患者。
[0207]
·
采用先前抗cd38 mab治疗的患者在结束抗cd38 mab治疗后60天时或之内进展,或未能实现对治疗的至少mr(即抗cd38难治的)。
[0208]
·
在随机化之前14天内任何抗骨髓瘤药物治疗,包括地塞米松。
[0209]
·
在随机化之前28天内已接受了任何其他研究药物或本研究禁止的疗法的患者。
[0210]
·
先前用卡非佐米治疗。
[0211]
·
对(用于使卡非佐米溶解的环糊精衍生物)没有已知的过敏史,先前对以下项的超敏性:蔗糖、组氨酸(作为碱和盐酸盐)、聚山梨酯80或者研究治疗中不宜用类固醇或h2阻断剂(将禁止用这些药剂进一步治疗)前驱用药的任何组分(活性物质或赋形剂)。
[0212]
·
有地塞米松禁忌症的患者。
[0213]
·
关于活动性移植物抗宿主病的先前同种异体造血干细胞移植(任何等级和/或在随机化前的2个月内处于免疫抑制治疗下)。
[0214]
·
已知的淀粉样变性或伴随的浆细胞白血病。
[0215]
·
随机化前14天内的需要胸腔穿刺术的胸腔积液或需要穿刺术或任何大手术(例如血浆置换术、治愈性放射疗法、大外科手术(后凸成形术不被视为大手术))的腹水。
[0216]
·
东部合作肿瘤小组(ecog)体能状态(ps)》2。
[0217]
·
如果《50%的bm有核细胞是浆细胞,则血小板《50,000个细胞/μl,并且如果≥50%的bm有核细胞是浆细胞,则血小板《30,000个细胞/μl。在筛查血液学测试之前3天内不允许血小板输液。
[0218]
·
绝对嗜中性粒细胞计数(anc)《1000μ/l(1x 109/l)。不允许使用粒细胞集落刺激因子(g-csf)达到此水平。
[0219]
·
肌酐清除率《15ml/min/1.73m2(肾脏病饮食改良[mdrd]公式:肾小球滤过率(ml/min/1.73m2)=175x(scr)-1.154x(年龄)-0.203x(如果是女性,则为0.742)x(如果是
非裔美国人,则为1.212);scr是血清肌酐,以mg/dl表示;年龄以年表示)。
[0220]
·
总胆红素》1.5x正常值上限(uln),已知的吉尔伯特综合征除外。
[0221]
·
校正的血清钙》14mg/dl(》3.5mmol/l)。
[0222]
·
天冬氨酸转氨酶(ast)和/或丙氨酸转氨酶(alt)》3x uln。
[0223]
·
》1级的来自任何先前抗骨髓瘤疗法的持续毒性(美国国立癌症研究院不良事件的通用术语[nci-ctcae]v4.03)(不包括脱发和合格性标准中列出的那些)
[0224]
·
先前的恶性肿瘤。以下情况是允许的:经充分治疗的基底细胞或鳞状细胞皮肤或浅表性(ptis、pta和pt1)膀胱癌或低风险前列腺癌或治愈性疗法后的任何原位恶性肿瘤,以及在随机化之前已经完成针对其的疗法≥5年并且所述患者已无疾病≥5年的任何其他癌症-。
[0225]
·
在随机化之前6个月内以下中的任何一种:心肌梗塞、严重/不稳定的心绞痛、冠状动脉/外周动脉搭桥术、纽约心脏协会iii或iv类充血性心力衰竭(chf)、≥3级心律失常、中风或短暂性脑缺血发作。
[0226]
·
左心室射血分数(lvef)《40%。
[0227]
·
已知的需要抗逆转录病毒治疗的获得性aids相关疾病或hiv疾病,或患有活动性甲型、乙型(定义为已知的阳性乙型肝炎表面抗原(hbsag)结果)或丙型肝炎(定义为大于测定的检测下限的已知定量hcv rna结果,或阳性hcv抗原)感染。
[0228]
·
在随机化之前3个月内的以下中的任何一种:治疗抗性消化性溃疡疾病、糜烂性食管炎或胃炎、感染性或炎性肠病、憩室炎、肺栓塞或其他不受控制的血栓栓塞事件。
[0229]
·
可能损害患者参与研究的能力或干扰研究结果的解释的任何严重急性或慢性医学状况(例如,全身感染,除非采用抗感染疗法)或者患者无法遵守研究程序。
[0230]
·
怀孕或哺乳的女性患者。
[0231]
·
未被高效的节育方法保护的具有生育潜力的女性(wocbp)和/或不愿或不能进行妊娠测试的女性。
[0232]
·
具有未被高效的节育方法保护的有生育潜力的女性伴侣的男性参与者。
[0233]
iv.研究治疗
[0234]
a.研究药物产品(imp)
[0235]
i.艾萨妥昔单抗(iv施用)
[0236]
将艾萨妥昔单抗配制为在小瓶中的输注用浓溶液,所述溶液含有在20mm组氨酸、10%(w/v)蔗糖、0.02%(w/v)聚山梨酯80、ph 6.0缓冲液中的20mg/ml(500mg/25ml)艾萨妥昔单抗。将艾萨妥昔单抗作为无菌、无热原、可注射、无色的20mg/ml输注用溶液浓缩物提供用于肠胃外施用,所述浓缩物可含有白色至灰白色微粒并包装于装配有弹性封闭物的30ml玻璃小瓶中。每个小瓶含有标称含量为500mg的艾萨妥昔单抗。确立填充体积以确保移取25ml。为了施用于患者,将适当体积的艾萨妥昔单抗在0.9%氯化钠溶液的输注袋中稀释。施用对应于艾萨妥昔单抗剂量的最终输注体积持续一定的时间段,所述时间段依赖于所施用的剂量并且基于每小时施用的蛋白质量。
[0237]
在ikd组中将艾萨妥昔单抗在第一个28天周期的第1、8、15和22天经由静脉内输注以10mg/kg剂量施用,然后在每个随后的28天周期的第1和15天施用。(所有周期的持续时间都是28天。)在毒性情况下应用剂量改变(下文中进一步详细描述)。
[0238]
ii.卡非佐米(iv施用)
[0239]
适用时,使用来自可商购的供应品的卡非佐米进行本研究;否则,申办者必须根据良好生产规范(gmp)指南重新贴上标签,然后将供应品提供给研究地点。在商业包装插页中提供了有关卡非佐米的配制、储存和操作程序的详细信息。将冻干的产品用注射用水重构为施用前2mg/ml的最终卡非佐米浓度。
[0240]
iii.地塞米松(口服或iv施用)
[0241]
适用时,使用来自可商购的供应品的地塞米松进行本研究;否则,申办者必须根据良好生产规范(gmp)指南重新贴上标签,然后将供应品提供给研究地点。在商业包装插页中提供了有关地塞米松的配制和操作程序的详细信息。
[0242]
b.非研究药物产品(nimp)-针对预防输液反应(ir)的前驱用药分配至ikd组的所有患者均在艾萨妥昔单抗输注之前接受过前驱用药,以降低通常在施用单克隆抗体时观察到的iar的风险和严重性。建议的前驱用药的药剂是:在艾萨妥昔单抗输注之前苯海拉明25-50mg iv(或等效物:例如西替利嗪、普鲁米近、右氯苯那敏,根据当地批准和可用性而定。对于至少前4次输注优选静脉内途径)、地塞米松口服/iv(下文提供的剂量)、雷尼替丁50mg iv(或等效物:其他批准的h2拮抗剂(例如,西咪替丁)、口服质子泵抑制剂(例如,奥美拉唑、埃索美拉唑)和口服醋氨酚650-1000mg 15至30分钟(但不长于60分钟)。一旦完成前驱用药方案,立即开始艾萨妥昔单抗输注。
[0243]
在艾萨妥昔单抗输注那天,将以下nimp按以下顺序施用:
[0244]
·
口服醋氨酚(对乙酰氨基酚)650mg至1000mg;然后
[0245]
·
雷尼替丁50mg iv(或等效物);然后
[0246]
·
苯海拉明25mg至50mg iv(或等效物);然后
[0247]
·
地塞米松20mg iv(其也是研究治疗的一部分)。
[0248]
当静脉内施用地塞米松时,将前驱用药按以下顺序施用:
[0249]
·
口服醋氨酚650mg至1000mg;然后
[0250]
·
雷尼替丁50mg iv(或等效物);然后
[0251]
·
苯海拉明25mg至50mg iv(或等效物);然后
[0252]
·
地塞米松40mg iv(或对于≥75岁的患者为20mg iv)。
[0253]
在没有苯海拉明或等效物的iv配制品的地区,首次艾萨妥昔单抗输注允许改为口服配制品。在这种情况下,在开始艾萨妥昔单抗输注之前其花费一到两个小时。
[0254]
在没有艾萨妥昔单抗的情况下施用卡非佐米(分配至kd组的患者,并且对于分配至ikd组的患者在第2、8和16天)时,将地塞米松在卡非佐米输注之前至少30分钟施用。
[0255]
在地塞米松过早停止并继续进行其他研究治疗的情况下,根据研究者的判断,如果仍需要针对艾萨妥昔单抗和/或卡非佐米进行iar前驱用药,则可以考虑使用甲基泼尼松龙100mg iv进行类固醇前驱用药。
[0256]
对于4次连续施用艾萨妥昔单抗后未经历iar的患者,研究者可能会重新考虑针对iar的特定艾萨妥昔单抗前驱用药的需要。
[0257]
v.剂量和时间表
[0258]
在不存在重大毒性、疾病进展或任何其他中止标准的情况下,对施用的周期数量没有限制。在实验室标准上做出的pd诊断在治疗中止之前通过2次连续测量来确认。继续治
疗直到确认pd。
[0259]
基于单独患者的耐受性,允许在随后的治疗周期中进行剂量调整(剂量延迟、剂量省略以及卡非佐米和地塞米松的剂量降低)。下面提供了有关剂量调整的另外的详细信息。对于艾萨妥昔单抗输注不允许剂量降低。
[0260]
a.研究治疗(imp)
[0261]
研究治疗定义为ikd实验组中的艾萨妥昔单抗/卡非佐米/地塞米松和kd对照组中的卡非佐米/地塞米松。
[0262]
艾萨妥昔单抗和卡非佐米两者都可以诱导iar,并且在其施用前需要前驱用药。
[0263]
分配至ikd组的患者在艾萨妥昔单抗输注之前应常规地接受也包括地塞米松在内的前驱用药,以降低通常在mab的情况下和在卡非佐米的情况下观察到的iar的风险和严重性。对于分配至kd组的患者,将地塞米松在卡非佐米之前施用。对于分配至ikd组的患者,在没有输注艾萨妥昔单抗时(如在第1周期的第2、9和16天以及在其他周期的第2、8、9和16天),将地塞米松在卡非佐米之前施用。
[0264]
在2个首次卡非佐米施用之前(在第1周期第1天和第2天)需要水化。应在第1天周期第1天之前至少48h开始口服水化。在第1周期和其他周期内针对进一步输注的水化由研究者来判断。(水化的细节在下文给出。)对于体表面积(bsa)》2.2m2的患者将使用2.2m2来确定卡非佐米剂量。
[0265]
i.ikd组(实验组)
[0266]
对于用艾萨妥昔单抗、卡非佐米和地塞米松组合治疗的患者的药物施用(如下所述在前驱用药之后)如下:
[0267]
地塞米松20mg是在28天周期中的第1、2、8、9、15、16、22和23天,在艾萨妥昔单抗之前15至30分钟之间(但不超过60分钟)或在不施用艾萨妥昔单抗的日子在卡非佐米之前至少30分钟。将地塞米松在艾萨妥昔单抗和/或卡非佐米施用的日子iv施用,并在其他的日子po施用。对于地塞米松预不需要输注后预防。
[0268]
将艾萨妥昔单抗在第一个月(例如,28天周期)内每周以10mg/kg的剂量iv施用,然后在此后的每个28天周期内q2w。艾萨妥昔单抗的输注速率以175mg/h开始。第一次输注:以175mg/h开始输注。在输注1小时后不存在iar的情况下,输注速率以每30分钟50mg/h增量增加,至400mg/h的最大值。随后的输注:以175mg/h开始输注。在输注1小时后不存在iar的情况下,输注速率以每30分钟100mg/h增量增加,至400mg/h的最大值。
[0269]
将卡非佐米在第1周期的第1和2天以20mg/m2的剂量,第8、9、15和16天以56mg/m2的剂量,然后在所有其他周期的第1、2、8、9、15和16天以56mg/m2的剂量经30分钟iv施用。卡非佐米输注是在艾萨妥昔单抗输注之后并且在艾萨妥昔单抗输注结束后立即开始。如果患者未经历任何》2级的毒性(非并发的血液毒性(毒性意指与研究治疗有关的)或恢复的肿瘤溶解综合征(tls)除外),则在第8天剂量升至56mg/m2并进行进一步施用。
[0270]
ii.kd组(对照组)
[0271]
用卡非佐米和地塞米松组合治疗的患者的药物施用如下进行:
[0272]
地塞米松20mg是在第1、2、8、9、15、16、22和23天,且在卡非佐米施用的日子在卡非佐米之前至少30min。将地塞米松在卡非佐米施用的日子iv施用,并在其他的日子po施用。
[0273]
将卡非佐米在第1周期的第1和2天以20mg/m2的剂量,第8、9、15和16天以56mg/m2的
剂量,然后在所有其他周期的第1、2、8、9、15和16天以56mg/m2的剂量经30min iv施用。如果患者未经历任何高于2级的毒性(非并发的血液毒性(毒性意指与研究治疗有关的)或恢复的tls除外),则剂量将会在第8天升至56mg/m2并进行进一步施用。
[0274]
b.卡非佐米水化
[0275]
在第1个周期第1天之前至少48小时,如下给予口服水化:30ml/kg/d(每天约6至8杯液体)持续至治疗时。在开始治疗之前评估患者依从性,如果口服水化不足,则应延迟治疗。研究人员自行决定针对在第1周期内以及第2周期和之后的周期中的输注继续口服水化。在先前研究治疗施用之后出现肿瘤溶解综合征(tls)的情况下,根据研究者的判断,进行针对随后输注的水化。
[0276]
对有心脏病(如chf和心肌病)或肺水肿病史的患者密切监测液体过多的体征。有高血压病史的患者在开始治疗之前已经控制了血压。
[0277]
在第1周期中d1和d2紧接在卡非佐米之前给予静脉内水化,并在第1周期后由研究者自行决定。静脉内水化由在卡非佐米输注之前经30至60分钟500ml生理盐水或其他适当的iv液体组成。水化程序的目标是维持稳健的尿排出量(例如,≥2l/天)。在此时间段内定期监测患者的液体过多的证据。
[0278]
在施用艾萨妥昔单抗和卡非佐米两者的日子,艾萨妥昔单抗输注体积被考虑在卡非佐米输注之前所需的水化内。如果艾萨妥昔单抗输注体积未达到至少500ml,则施用另外的水化以达到至少500ml。在这种情况下,在开始艾萨妥昔单抗输注之前施用另外的体积。水化的总体积可以小于500ml(不小于250ml)或保持在500ml。根据研究者的判断,对于具有临界左心室射血分数(lvef)的患者和/或具有心脏代偿失调风险的患者,经更长时间施用水化。在艾萨妥昔单抗输注完成之后开始卡非佐米输注。
[0279]
c.剂量改变
[0280]
基于单独患者的耐受性,允许在随后的治疗周期中进行剂量调整(剂量延迟、剂量省略以及剂量降低(仅对于卡非佐米和地塞米松))。如果出现毒性并且在计划的输注/施用日后3天内患者无法恢复,则患者可以在周期内省略剂量(艾萨妥昔单抗和/或卡非佐米和/或地塞米松)。在尽管经过适当的剂量改变仍持续的ae或根据研究者的观点许可中止的任何其他ae的情况下,中止研究治疗(艾萨妥昔单抗和/或卡非佐米和/或地塞米松)的施用。记录对研究治疗施用的所有改变。基于由研究者评估的标准,在毒性恢复后,患者接受下一个研究治疗周期。
[0281]
卡非佐米和地塞米松的剂量降低步骤分别示于下表e1和表e2中。
[0282]
表e1.对于卡非佐米剂量降低的剂量水平
[0283]
起始剂量(iv)剂量水平-1剂量水平-2剂量水平-320mg/m215mg/m211mg/m
2-56mg/m245mg/m236mg/m227mg/m2[0284]
表e2.对于地塞米松剂量降低的剂量水平
[0285][0286]
对于艾萨妥昔单抗输注不允许剂量降低。
[0287]
v.疾病评估
[0288]
研究者关于是否允许受试者继续治疗的决定是基于功效数据(从当地和/或中心实验室获得)、放射学评估、和贯穿所述研究或在根据imwg标准有所指示时进行的骨髓评估。用于评估治疗反应的参考值是在第1周期第1天在治疗前从每名患者获得的样品中测量的值(参见以上章节i.a.主要目标)。评估和时间表的概述提供于下表f中。还将记录基线时的疾病特征,包括m蛋白亚型、骨髓和髓外疾病的程度、细胞遗传学(由中心实验室评估)和r-iss。
[0289]
表f.评估和时间表。
[0290][0291][0292]
总反应和疾病进展将通过国际骨髓瘤工作组标准来评估(kumar等人2016)。
[0293]
eot访视将是在最后一次研究治疗施用后30天或开始进一步抗骨髓瘤疗法之前(以先发生者为准)。
[0294]
elisa:酶联免疫吸附测定;eortc:欧洲癌症研究与治疗组织;eot:治疗结束;eq-5d-5l:每个维度具有5个反应水平的euroqol 5维问卷;fish:荧光原位杂交;pd:疾病进展;pk:药代动力学;qlq-c30:生活质量问卷核心模块;qlq-my20:生活质量问卷骨髓瘤模块;r-iss:修订的国际分期得分。
[0295]
2016年imwg标准(参见例如,kumar s,paiva b,anderson kc等人international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma.the lancet.oncology,17(8),e328-e346(2016))用于评价反应和疾病进展。在每个周期的第一天和停止治疗时进行评估。pfs是主要功效终点,其定义为从随机化到首次记录的疾病进展的出现或患者因任何原因死亡(以最早发生者为准)的时间。在疾病进展之前中止疗法的患者中在随访期间评估反应并持续直到疾病进展。还进行了pfs的亚组分析(例如,通过细胞遗传学风险状态、先前治疗线的数量)。下一代测序(ngs)用于评估mrd。
[0296]
安全性评价包括生命体征、血液学和生物化学评估、身体检查、心电图和ae:这些在整个研究过程中被追踪。根据美国国立癌症研究院ae的通用术语标准v4.03对ae进行分级。在研究治疗期间评估免疫原性。在基线时和在开始治疗后,仅在艾萨妥昔单抗加上卡非佐米/地塞米松组中进行间接coombs测试。
[0297]
通过使用pro/hrqol和健康实用工具(欧洲癌症研究与治疗组织生活质量问卷c30和my20[eortc qlq-c30和qlqmy20]和euroqol问卷eq-5d-5l)在每个周期的第1天、治疗结束时和研究治疗施用后90天测量患者报告结局(pro)评估。
[0298]
实施例1b:实施例1a中描述的iii期研究的初步结果
[0299]
将302名患者如下进行随机化:将179名患者分配至艾萨妥昔单抗 卡非佐米 地塞米松(isa car dex)组,并且将123名患者分配至卡非佐米 地塞米松(car dex)组。患者特征在两组之间是良好平衡的。中值年龄为64岁(范围:33-90)。25.8%的患者为r-iss i期,59.6%的患者为r-iss ii期并且7.9%的患者为r-iss iii期。44%的患者接受过针对多发性骨髓瘤的1个先前治疗线,33%接受过两个先前治疗线,并且23%接受过≥3个先前治疗线。90%的患者已接受过用蛋白酶体抑制剂的先前疗法,并且78%的患者已接受过用免疫调节药物(即)的先前疗法。先前治疗线的中值数量是2。24%的患者具有高风险细胞遗传学(即以下染色体/细胞遗传学异常中的一种或多种:del(17p)、t(4;14)和t(14;16))。
[0300]
如实施例1a中所讨论,实验组中的患者在治疗持续时间内接受以下的组合:通过静脉内输注以10mg/kg的剂量每周一次艾萨妥昔单抗,持续四周,然后对于28天周期每隔一周一次;以及以20/56mg/m2剂量每周两次卡非佐米和标准剂量的地塞米松。对照组中的患者在治疗持续时间内接受以20/56mg/m2剂量每周两次卡非佐米和标准剂量的地塞米松。这项研究的主要终点是无进展存活期。次要终点包括总反应率(orr)、很好的部分反应或更好的反应的比率(≥vgpr)、微小残留病(mrd)、完全反应率(cr)、总存活期(os)和安全性。
[0301]
在中值20.7个月的随访时并且在按照irc(独立审查委员会)的103个无进展存活期(pfs)事件的情况下,isa car dex组中的中值pfs尚未达到。car dex组中的中值pfs为19.15个月(hr 0.531(99%ci 0.318-0.889),单侧p=0.0007)。因此,越过了预先指定的功效边界(p=0.005)。pfs益处在各亚组之间是一致的。总反应率(orr)(即实现部分反应(pr)
或更好的反应的患者%)在isa car dex组中为86.6%,相比之下,在car dex组中为82.9%(单侧p=0.1930)。isa car dex组中72.6%的患者实现了≥vgpr(很好的部分反应),相比之下,car dex组中为56.1%的患者(p=0.0011)。isa car dex组中39.7%的患者实现了完全反应(cr),相比之下,car dex组中为27.6%的患者。意向治疗群体中的mrd阴性率(10-5
)在isa car dex组中为29.6%(53/179),相比之下,在car dex组中为13.0%(16/123)。
[0302]
isa car dex组中52.0%的患者仍在治疗中,相比之下,car dex组中为30.9%的患者。治疗中止的主要原因是疾病进展(isa car dex组中为29.1%,相比之下,car dex组中为39.8%)和不良事件(isa car dex组中为8.4%,相比之下,car dex组中为13.8%)。在isa car dex组中76.8%的患者中观察到≥3级的治疗期间不良事件(teae),相比之下,在car dex组中为67.2%的患者。治疗期间严重不良事件(te-sae)和致命teae在两组中是相似的:在isa car dex组中59.3%的患者经历过te-sae,相比之下,在car-dex组中为57.4%的患者;并且在isa car dex组中3.4%的患者经历过致命teae,相比之下,在car dex组中为3.3%的患者。在isa car dex组中45.8%(0.6%3-4级)的患者中报告了输液反应,并且在car dex组中3.3%(0%3-4级)的患者报告了输液反应。isa car dex组中32.2%的患者中观察到≥3级的呼吸道感染(分组),相比之下,car dex组中为23.8%的患者。isa car dex组中4.0%的患者报告了≥3级的心力衰竭(分组),相比之下,car dex组中为4.1%的患者。根据实验室结果,isa car dex组中29.9%的患者报告了3-4级血小板减少症,相比之下,car dex组中为23.8%的患者;isa car dex组中19.2%的患者报告了嗜中性白血球减少症,相比之下,car dex组中为7.4%的患者。
[0303]
与标准护理卡非佐米 地塞米松(即没有艾萨妥昔单抗)相比,向卡非佐米 地塞米松添加艾萨妥昔单抗在患有复发性多发性骨髓瘤的患者中提供了优异的、统计上显著的pfs改善以及临床上有意义的反应深度(即mrd)改善。与标准护理卡非佐米 地塞米松(即没有艾萨妥昔单抗)相比,向卡非佐米 地塞米松添加艾萨妥昔单抗显著降低了疾病进展或死亡的风险。艾萨妥昔单抗 卡非佐米 地塞米松组合具有良好的耐受性以及可控的安全性和有利的受益风险特征。在这项研究中没有鉴定出新的安全性信号。
[0304]
实施例1c:实施例1a中描述的iii期研究的进一步结果
[0305]
在本实施例中提供了有关实施例1a中描述的iii期临床试验的进一步细节和试验的期中结果。
[0306]
将满足实施例1a中描述的纳入和排除标准的患有复发性多发性骨髓瘤的患者如下随机化为两个研究组:每三名患者随机化至ikd组(艾萨妥昔单抗 卡非佐米 地塞米松),2名随机化至kd臂(卡非佐米 地塞米松)。参见以上表d。所有患者已进行过针对多发性骨髓瘤的1-3个先前治疗线。所有患者均未接受过采用卡非佐米的先前疗法。所有患者均不是先前抗cd38疗法难治的。根据先前治疗线对患者进行分层(即,1个先前治疗线相比于》1个)和r-iss得分(即,i或ii相比于iii相比于未分类),以确保参与者的亚组平均分配至每组。(关于r-iss的进一步细节描述于以下文献中:参见palumbo a,等人revised international staging system for multiple myeloma:a report from international myeloma working group.j clin oncol.2015;33(26):3863-9。)
[0307]
关键患者人口统计学和基线特征显示在下表g中。患者特征在两组中是平衡的。对于细胞遗传学分析,使用50%的截断值定义del17p,并且使用30%的截断值定义t(4;14)和
4(14;16)。ikd组中的3名患者(1.7%)和kd组中的2名患者(1.6%)接受了针对多发性骨髓瘤的》3个先前治疗线。
[0308]
表g:患者人口统计学和基线特征
[0309][0310][0311]
crcl,肌酐清除率;d,地塞米松;imid,免疫调节药物;isa,艾萨妥昔单抗;itt,意向治疗;k,卡非佐米;mdrd,肾脏病饮食改良;iss,国际分期系统;pi,蛋白酶体抑制剂。
[0312]
继续治疗直到患者显示出疾病进展(pd)、经历不可接受的毒性或选择退出研究。
[0313]
如由独立审查委员会(irc)所评估,研究的主要终点包括无进展存活期(pfs)。研究的次要终点包括总反应率(orr)、》很好的部分反应(vgpr)的比率、微小残留病(mrd)阴性、完全反应率(cr)率和总存活期(os)。
[0314]
结果
[0315]
在20.7个月随访时,患者安排如下:ikd组中的179名患者中177名进行了治疗。ikd组中84名(46.9%)患者中止治疗。52名(29.1%)由于疾病进展(pd)中止;15名(8.4%)由于不良事件(ae)中止;并且6名(3.4%)因其他原因中止。ikd组中93名(52%)患者仍在治疗
中。kd组中123名患者中,122名进行了治疗。kd组中84名(68.3%)患者中止治疗。49名(39.8%)由于疾病进展(pd)中止;17名(13.8%)由于不良事件(ae)中止;并且4名(3.3%)因其他原因中止。kd组中38名(30.9%)患者仍在治疗中。与kd组相比,ikd组中有更高比例的患者仍在治疗中(即ikd组中约37%患者由于pd或ae而中止治疗,相比之下,kd组中为约54%)。
[0316]
由独立审查委员会(irc)进行的期中pfs分析表明,ikd组中尚未达到中值pfs(mpfs),而kd组中的mpfs为19.15个月(95%ci:15.770-ne)。hr 0.531(99%ci:0.318-0.889),p=0.0007。与kd组中的患者相比,接受ikd的患者显示出pfs改善,并且疾病进展或死亡的风险降低47%。参见图3。针对pfs进行了亚组分析。如图4所示,所有亚组都倾向于ikd相比于kd。在所有分析的亚组(例如,年龄、基线肾脏功能(egfr)、先前治疗线的数量、最后一个治疗线时的先前蛋白酶体抑制剂治疗、最后一个治疗线时的先前免疫调节药物治疗、高风险细胞遗传学状态、进入研究时的iss分期以及来那度胺难治的)之间,对于ikd观察到一致的治疗效果。
[0317]
与用kd治疗的患者相比,在用ikd治疗的患者中观察到更深的反应,这与pfs改善相一致。ikd组中患者的总反应率(orr)为86%,而kd组中患者的orr为82%(p=0.19,分层cochran-mantel-haenszel检验;单侧显著性水平为0.025)。ikd组中72.6%的患者实现了vgpr或更好的反应,相比之下,kd组中为56.1%的患者(p=0.0011)。ikd组中39.7%的患者实现了cr,相比之下,kd组中为27.6%的患者。此外,与kd组中相比,ikd组中更多的患者呈mrd阴性(即10-5
阈值下的“微小残留病阴性”,如通过下一代测序(ngs)所评估)。在意向治疗的患者中,ikd组中53/179(29.6%)呈mrd阴性,相比之下,kd组中为16/123(13%)。在研究中实现vgpr或更好的反应的患者中,ikd组中53/128(41.4%)呈mrd阴性,相比之下,kd组中为16/70(22.9%)。
[0318]
与用kd治疗相比,用ikd治疗导致到下一次治疗的时间明显延迟,这与pfs改善相一致。参见图5和表h。
[0319]
表h.到下一次治疗的时间。
[0320]
[0321][0322]
在20.73个月随访时,总存活期(os)数据在分析时并不成熟。
[0323]
每个治疗组中研究治疗的暴露示于表i中。ikd组中艾萨妥昔单抗和卡非佐米的高相对剂量强度证明了所述组合的可行性。
[0324]
表i:研究治疗的暴露。
[0325][0326]
与在kd组中相比,ikd中有更多的患者经历了》3级治疗期间不良事件(teae)(76.8%ikd相比于67.2%kd)。向卡非佐米 地塞米松添加艾萨妥昔单抗未增加死亡率、严重的teae或导致治疗中止的事件。ikd具有可控的安全性特征并且没有新的安全性信号。输液反应(ir)主要发生在第一次输注期间,并且大部分为1级或2级。
[0327]
结论
[0328]
向kd添加艾萨妥昔单抗导致统计上显著的pfs改善并且hr为0.531,与此对应的是进展或死亡的风险降低47%。ikd在多个亚组之间显示出一致的益处,所述亚组包括那些因未满足的高医疗需求而难以治疗的那些(老年、高风险细胞遗传学、肾损害)。与kd相比,ikd显示出了意义深远的反应深度,其中mrd阴性率为30%,相比于在itt群体中为13%。ikd在患有复发性mm的患者中显示出可控的安全性特征和有利的风险/益处。
[0329]
实施例1d:复发性多发性骨髓瘤中艾萨妥昔单抗加上卡非佐米和地塞米松的反应深度和反应动力学
[0330]
简介
[0331]
多发性骨髓瘤(mm)中微小残留病阴性(mrd-)状态的实现伴随着改善的无进展存活期(pfs)和总存活期(os)。艾萨妥昔单抗(isa)是已批准的抗cd38 iggκ单克隆抗体。分析了实施例1a中描述的研究中的反应深度,包括mrd-、长期结局和肿瘤反应动力学。还通过质谱法测量血清m蛋白,以克服标准免疫固定测定中isa的干扰。
[0332]
方法
[0333]
实施例1a描述了一项随机化、开放标签、多中心3期研究,所述研究调查了isa加上卡非佐米和地塞米松(isa-kd)相比于kd在接受过1-3个治疗线的患有复发性mm的患者中。pfs的主要终点以及总反应率(orr)、很好的部分反应或更好的反应(≥vgpr)和完全反应(cr)率的次要终点是由独立反应委员会(irc)根据国际骨髓瘤工作组(imwg)标准(参见例如,kumar等人(2016)“international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma.”[0334]
lancet oncol.17(8):e328-e346和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473)基于以下来确定的:对于m蛋白、中心成像检查和针对浆细胞浸润的局部骨髓的中心数据。实现了依据下一代测序在10-5
灵敏度水平下≥vgpr的患者的骨髓抽吸物中评估mrd(即微小残留病)。进行质谱分析以测量血清m蛋白而不受isa干扰。使用cox比例风险模型估计风险比和相应的置信区间。使用cochran mantel haenszel检验比较治疗组之间的次要终点。所有未达到mrd-或未进行mrd评估的随机化的患者均被分析为mrd 。
[0335]
结果
[0336]
如实施例1a中所讨论,将302名患者(179isa-kd,123kd)随机化。在中值20.7个月的随访时,观察到接受isa-kd的患者比接受kd的患者有更深的反应。isa-kd组中72.6%的患者实现了≥vgpr,相比之下,kd组中为56.1%的患者(标称p=0.011)。isa-kd组中39.7%的患者实现了≥cr,相比之下,kd组中为27.6%的患者。isa-kd组中53/179(30%)的患者出现mrd-,相比之下,kd组中为16/123(13%)的患者(标称p=0.0004)。(还参见例如,实施例1b和实施例1c)。isa-kd组中20.1%(36/179)的患者实现了cr和mrd-两者,相比之下,kd组中为10.6%(13/123)的患者。在两个治疗组(即,isa-kd相比于kd)中依据mrd状态的无进展存活期(pfs)示于图6中。在mrd-患者(hr 0.578,95%ci:0.052-6.405)和mrd 患者(hr 0.670,95%ci:0.452-0.993)中,风险比(hr)均倾向于isa-kd,而不是kd。mrd-患者的pfs比mrd 患者的更长。在isa-kd组中,可以在如下患者中获得mrd阴性状态,所述患者:患有肾损害,即egfr《60ml/min/1.73m2(26.5%mrd-相比于25.9%mrd );诊断时具有iss iii期(32.1%mrd-相比于27.8%mrd );具有t(4;14)[13.2%mrd-相比于11.9%mrd ];具有增加(1q21)[45.3%mrd-相比于40.5%mrd ];处于大量预治疗,≥3个先前治疗线(22.6%mrd-相比于19.0%mrd );或在最后的方案中是来那度胺难治的(18.9%mrd-相比于20.6%mrd )。在isa-kd组中,在蛋白酶体抑制剂(pi)难治的[18.9%mrd-相比于36.5%mrd ]或具有del(17p)[3.8%mrd-相比于12.7%mrd ]的患者中不较不频繁地达到mrd阴性状态。
[0337]
探索了艾萨妥昔单抗对m蛋白的干扰:通过质谱法测试来自isa-kd组中27名具有接近cr(仅血清免疫固定(if)阳性iggκ)或潜在cr(血清中保留m蛋白≤0.5g/dl且if阳性iggκ)的患者的样品。其中,有11名接近cr或潜在cr患者记录了骨髓中《5%浆细胞,并且质谱法呈阴性(残留骨髓瘤m蛋白水平低于中心实验室免疫固定的定量限(loq))。另外,在11名接近cr或潜在cr患者中,有7名也呈mrd-。这些结果支持当前cr率和mrd-cr率两者均被低估(潜在的经调整的cr率为45.8%;潜在的经调整的mrd-cr率为24%)。
[0338]
对治疗的反应在两组中很快出现。反应者中到第一反应的中值时间在isa-kd组中为32.0(28-259)天,相比之下,在kd组中为33.0(27-251)天。反应者中到最佳反应的中值时间在isa-kd中为120.0(29-568)天,相比之下,在kd组中为104.5(29-507)天。反应者中到首
次cr的中值时间在isa-kd组中为184.0(30-568)天,相比之下,在kd组中为229.5(58-507)天。反应者中到首次≥vgpr的中值时间在isa-kd组中为88.0(28-432)天,相比之下,在kd组中为90.0(29-491)天。除了反应深度增加外,按照描述性分析,在用isa-kd治疗的患者中还维持了如由欧洲癌症研究与治疗组织(eortc)生活质量问卷-c30全球健康状况得分所测量的生活质量。
[0339]
结论
[0340]
相比于用kd治疗的患者,在用isa-kd治疗的患者中具有临床上有意义的反应深度改善。由于干扰,所述研究的isa-kd组中39.7%的cr率是被低估的。质谱法结果表明,用isa-kd治疗的具有1到3个先前治疗线的患者中大约一半可以达到cr。与在kd组中相比,isa-kd组中更多患者达到mrd阴性(30%相比于13%),并且与在kd组中相比,isa kd组中至少两倍的患者达到cr mrd-(20.1%相比于10.6%;分别调整为24%和10.6%)。达到mrd阴性伴随着两组中较长的pfs。
[0341]
实施例1e:实施例1a中描述的iii期研究的进一步结果
[0342]
合格的患者患有复发性和/或难治性多发性骨髓瘤并具有一至三个先前治疗线和可测量的疾病证据(血清m蛋白≥0.5g/dl和/或尿m蛋白≥200mg/24h)。在以下情况下排除患者:患者患有根据国际骨髓瘤工作组(imwg)反应标准(kumar等人(2016)“international myeloma working group consensus criteria for response and minimal residual disease assessment in multiple myeloma.”lancet oncol.17(8):e328-e346和durie等人(2006)“international uniform response criteria for multiple myeloma.leukemia.20:1467-1473)的原发性难治性多发性骨髓瘤、患有仅血清游离轻链可测量疾病或东部合作肿瘤小组体能状态》2。在以下情况下排除患者:患者在随机化的14天内接受了抗骨髓瘤治疗、先前用卡非佐米治疗、为抗cd38抗体疗法难治的或具有地塞米松禁忌症。也排除了根据肾脏病饮食改良公式的肾小球滤过率(egfr)《15ml/min/1.73m2或左心室射血分数《40%的患者。纳入患有先前肺部并存病(包括慢性阻塞性肺病)的患者。如上所讨论将患者随机化,并且如上所讨论将随机化分层。每个组中的患者如表d中所述进行治疗。
[0343]
功效终点和评估
[0344]
按照设盲的独立反应委员会(irc),主要功效终点是无进展存活期。irc审查了针对反应和进展的疾病评估(中心放射学评价、来自中心实验室的m蛋白定量以及在需要时针对浆细胞浸润进行局部骨髓抽吸)。关键次要功效终点包括根据imwg反应标准的总反应率、很好的部分反应(vgpr)或更好的反应的比率、微小残留病(mrd)阴性率、完全反应(cr)率和总存活期。
[0345]
通过下一代测序评估mrd,其中在达到≥vgpr的患者中最小灵敏度为105个有核细胞中的1个。在通过中心实验室筛查期间通过荧光原位杂交(fish)评估了细胞遗传学,其中对于del(17p)的截断值为50%,并且对于t(4;14)、t(14;16)和增加(1q21)的截断值为30%。高风险细胞遗传学状态定义为存在del(17p)、t(4;14)或t(14;16)。
[0346]
功效评估是在每个周期的第1天以及治疗停止时完成的。安全性评估包括不良事件的记录、实验室参数(两者均按照美国国立癌症信息中心通用术语标准(ncic-ctc)第4.03版进行分级)、生命体征、心电图和东部合作肿瘤小组体能状态。对意向治疗群体进行
功效分析,并通过随机化治疗进行总结。依据在安全性群体中接受的实际治疗来评估和总结安全性分析和研究治疗的程度。
[0347]
患者与治疗
[0348]
人口统计学和临床特征在基线时是良好平衡的(表j)。中值年龄为64岁(范围33-90)。先前治疗线的中值数量为2(范围1-4)并且在组之间是相似的,其中44%、33%和23%分别接受了1、2和≥3个先前治疗线。一名患者(艾萨妥昔单抗组)和两名患者(对照组)接受过四个先前治疗线。总的来说,45%的患者是免疫调节药物难治的,包括32.8%是来那度胺难治的。在艾萨妥昔单抗组中,23.5%的患者具有高风险细胞遗传学,这与对照组(25.2%)是相似的。在基线时,艾萨妥昔单抗组中26.1%的患者患有肾损害(egfr《60ml/min/1.73m2),相比之下,对照组中为16.2%。
[0349]
表j.随机化群体中的人口统计学、基线疾病和临床特征。
[0350]
[0351]
[0352][0353]
egfr,估计的肾小球滤过率;imid,免疫调节酰亚胺药物;isa-kd,艾萨妥昔单抗-卡非佐米-地塞米松;kd,卡非佐米-地塞米松;ldh,乳酸脱氢酶;mdrd,肾脏病饮食改良;pi,蛋白酶体抑制剂;uln,正常值上限
[0354]
*根据病例报告表中按种族对患者计算的发病率:isa-kd组中为165名,kd组中为111名;
[0355]
高风险细胞遗传学状态定义为存在del(17p)和/或易位t(4;14)和/或易位t(14;16)。染色体异常(ca)如果存在于至少30%分析的浆细胞中则被视为阳性,除了其中阈值为至少50%的del(17p)。
[0356]
在分析时,中值治疗持续时间在艾萨妥昔单抗组中为80.0周(范围1-111),并且在对照组中为61.4周(范围1-114)。卡非佐米和地塞米松的中值相对剂量强度在两个组中是相似的(分别地,艾萨妥昔单抗组为91.2%和84.8%,相比之下,对照组为91.4%和88.4%)。艾萨妥昔单抗的中值相对剂量强度为94.3%。相比于对照组,艾萨妥昔单抗组中更少患者(46.9%相比于68.3%)中止。
[0357]
功效
[0358]
在中值20.7个月的随访时,向卡非佐米-地塞米松添加艾萨妥昔单抗显示出统计上显著的无进展存活期改善,其中风险比为0.531(99%ci,0.318-0.889,单侧p值=0.0007),与此对应的是进展或死亡的风险降低46.9%。kd中的中值无进展存活期为19.15个月(95%ci,15.770-未达到),与方案假设的19个月相一致。ikd组中的中值pfs尚未达到。两年后,无进展存活期概率为68.9%(ikd组)相比于45.7%(kd组)。
[0359]
在意向治疗群体中,总反应率为86.6%(ikd组)相比于82.9%(kd组),单侧p值=0.1930。在组之间的差异不是统计上显著的,因此仅出于描述性目的而提供随后的关键次要终点的p值。vgpr或更好的反应的比率为72.6%(ikd组)相比于56.1%(kd组)(p=
0.0011)。cr率为39.7%(ikd组)相比于27.6%(kd组)。通过向卡非佐米-地塞米松添加艾萨妥昔单抗,意向治疗群体中的mrd阴性率增加了一倍多:29.6%(ikd组)相比于13.0%(kd组)(p=0.0004)(表k)。实现cr和mrd阴性反应的患者比例为20.1%(ikd组)和10.6%(kd组)。尽管期中分析时总存活期并不成熟,但在艾萨妥昔单抗组和对照组中分别有17.3%和20.3%的患者死亡。
[0360]
表k.意向治疗(itt)群体中的反应概述。
[0361][0362]
[0363]
isa-kd:艾萨妥昔单抗-卡非佐米-地塞米松;kd:卡非佐米-地塞米松。
[0364]
两个连续阴性m蛋白和阴性免疫固定并且骨髓缺失
[0365]
满足所有完全反应的标准,但是免疫固定保持阳性
[0366]
§
使用clopper-pearson方法估计。
[0367]
‖根据交互反应技术对随机化因素进行分层。单侧显著性水平为0.025。
[0368]
仅对具有确认的很好的部分反应作为最佳总反应的患者评估生化完全反应和接近完全反应。确认标准不应用于接近完全反应亚类。
[0369]
出于分析的目的,在意向治疗群体中但未进行微小残留病评估的受试者将被视为具有阳性微小残留病。
[0370]
在预先指定的亚组分析中,几乎在所有组中均出现了倾向于艾萨妥昔单抗和卡非佐米-地塞米松的临床益处(图7)。肾损害患者中的中值无进展存活期在ikd组中未达到相比于在kd组中为13.41个月(95%ci,4.830-未达到),其中风险比为0.273[95%ci,0.113-0.660]。分别地,完全肾反应(在基线时egfr《50ml/min/1.73m2改善为≥60ml/min/1.73m2)出现在52%(ikd组)相比于30.8%(kd组)中,并且在32.0%(ikd组)相比于7.7%(kd组)的患者中是持久的。在老年患者(≥65岁)中观察到了倾向于艾萨妥昔单抗与卡非佐米-地塞米松的无进展存活期益处,包括对于≥75岁的患者的风险比为0.244(95%ci,0.060-1.000)。
[0371]
反应者中到第一反应的中值时间在两组中是相似的:32天(ikd组)和33天(kd组);ikd组中的反应持续时间更长,其中风险比为0.425(95%ci,0.269至0.672)。艾萨妥昔单抗加上卡非佐米-地塞米松延迟了到下一次治疗的时间(风险比,0.566;95%ci,0.380-0.841)。26.3%(ikd组)相比于43.1%(kd组)的患者接受了至少一种进一步抗骨髓瘤疗法,并且在接受了随后治疗的患者中,分别有21.3%和47.2%接受了达雷木单抗。使用艾萨妥昔单抗加上卡非佐米-地塞米松维持了健康相关生活质量,如通过qlq-c30全球健康状况得分所测量。
[0372]
讨论
[0373]
这项随机化3期研究结果显示,相比于单独卡非佐米-地塞米松,在患有复发性多发性骨髓瘤的患者中向卡非佐米-地塞米松添加艾萨妥昔单抗伴随着无进展存活期的显著益处。艾萨妥昔单抗组中疾病进展或死亡的风险低47%,由极低的风险比所指示(0.531[99%ci,0.318-0.889])。对照组中的中值无进展存活期为19.15个月,与方案假设(19个月)和一项先前的3期试验相一致,所述试验在患有复发性/难治性多发性骨髓瘤的患者中评估了卡非佐米加上地塞米松相比于硼替佐米加上地塞米松在一到三个先前治疗线后的功效。目前的结果表明,ikd组的优越性与表现不佳的对照组(即kd组)无关。
[0374]
在ikd组中的几乎所有亚组中均观察到无进展存活期的益处,所述亚组包括高风险细胞遗传学、进入研究时的国际分期系统iii期、老年患者、患有肾损害的患者、具有≥1个先前治疗线的患者、先前暴露于免疫调节药物、先前暴露于蛋白酶体抑制剂以及先前暴露于免疫调节药物和蛋白酶体抑制剂。重要的是,对所有患者均使用国际公认的fish阳性截断值对细胞遗传学风险进行集中评估,并且所述细胞遗传学风险对于88%的总体患者而言是结论性的。
[0375]
相比于kd组,ikd组中的反应深度和质量更好,其中vgpr、cr、mrd阴性和cr且mrd阴
性的比率更高。特别地,考虑到这些患者具有两个(中值)先前治疗线,ikd组中的mrd阴性率和cr且mrd阴性的比率非常高。另外,cr且mrd阴性的比率可能被低估了,因为cr是在没有使用干扰测定的情况下评估的(参见例如,实施例1d)。
[0376]
在患有复发性多发性骨髓瘤的患者中进行的这项研究中,相比于单独卡非佐米-地塞米松,向卡非佐米-地塞米松添加艾萨妥昔单抗导致显著更长的无进展存活期。艾萨妥昔单抗组中的反应深度和质量更好,包括高cr且mrd阴性比率,这是对于更好的无进展存活期和总存活期的预后因素。安全性特征可控并且是预期的,其中心血管事件没有增加。总之,这些结果证明,艾萨妥昔单抗加上卡非佐米-地塞米松代表了对于患有复发性多发性骨髓瘤的患者的潜在新标准护理。
[0377]
除非明确指示相反含义,否则本文所述的每个实施方案可以与其他任何一个或多个实施方案组合。特别地,除非明确指示相反含义,否则指示为优选或有利的任何特征或实施方案可以与指示为优选或有利的其他任何一个或多个特征或一个或多个实施方案组合。
[0378]
本技术中引用的所有参考文献均以引用的方式明确地并入本文。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。