1.本发明涉及有机化学和药物化学技术领域,具体涉及一种吲哚糖苷类化合物及吡咯糖苷类化合物及其合成方法与应用。
背景技术:
2.吲哚类化合物广泛存在于天然产物、活性药物以及农药分子中,也是非常重要的精细化工原料。因此,构建和修饰吲哚杂环一直是合成化学家和药物化学家的研究热点之一。天然来源的吲哚生物碱表现出不同的机制和结构。双吲哚生物碱的特点主要在于分子结构中涉及的两个吲哚结构,可以通过多种结构间接连接,如从长春花中分离出的抗肿瘤药物长春碱和长春新碱等。也可直接聚合形成天然双吲哚生物碱,如从streptomyces staurosporeus中获得的星孢菌素。单体二聚化在增强生物活性、减少副作用、克服耐药性以及改变药代动力学、药效学或物理化学特征方面具有极大的潜力。
3.另一方面,二十世纪九十年代,瑞士化学家首次在人体内发现了吲哚c-糖苷的结构man(a1-c)trp。随后,该类吲哚c-糖苷的结构陆续在人血清灭菌蛋白、促红细胞生成素受体、ebola病毒sgp蛋白等糖蛋白类生物大分子中被发现。体外研究表明,吲哚碳苷类化合物具有优异的生物活性。包括抗病毒作用、抑制sglt2和抗炎镇痛等作用和抗癌抗肿瘤活性。因此吲哚碳苷类化合物的研究具有极大的发展前景。
4.早期糖苷类化合物的获取主要通过对天然产物提取分离,该方法面临着分离周期长,成分复杂,分离难度大,对原料需求量大等诸多问题。到目前为止,吲哚碳苷的合成可分为以下几类:a)富电子芳香化合物,如吲哚与活化的糖基供体反应,形成吲哚碳苷(mandal,p.,et al.j.org.chem 2021,86,8516
–
8526.);b)过渡金属催化的端基炔基糖与邻氨基碘苯反应或1-碘代烯糖与邻炔基苯胺反应合成吲哚碳苷(sun,j.s.,etal.org.biomol.chem.2022,18,8834-8838.);c)端基卤代物在有机金属试剂(pd、cu、fe、ni等)催化下与吲哚反应生成吲哚碳苷(shevchenko,v.e.,et al.chem.heterocycl.compd.1981,17,561-571.subash,c.t.,et al.tetrahedron lett.2007,48,663-667.deng,z.,et al.nat.catal.2019,2,793
–
800.);d)烯糖在incl3的作用下与吲哚反应生成相应的吲哚碳苷(yang,j.s.,et al.synthetic comm.2007,37,691-701.kunwar,a.c.,et al.tetrahedron lett.2002,43,2095-2098.)。
5.已报道的方法大多需要预先活化糖基供体或吲哚;有些具有较大的离去基团或导向基团(如三氯乙酰亚胺、苯硫酚等),原子经济性差;或者使用贵金属/稀有金属催化剂。这些方法均具有选择性不高,或使用配体合成难度极大,或催化剂价格昂贵等缺陷。到目前为止,还未见糖环1,3-位双吲哚或1,3-位双吡咯取代的糖类化合物的合成方法和活性研究的报道。
技术实现要素:
6.针对现有技术的不足,本发明提供了一种吲哚糖苷类化合物及吡咯糖苷类化合物
及其合成方法与应用,解决了现有技术中吲哚或吡咯糖苷结构多样性缺乏、合成相应糖苷中催化剂大量使用和糖苷选择性差的问题。
7.为实现以上目的,本发明通过以下技术方案予以实现:
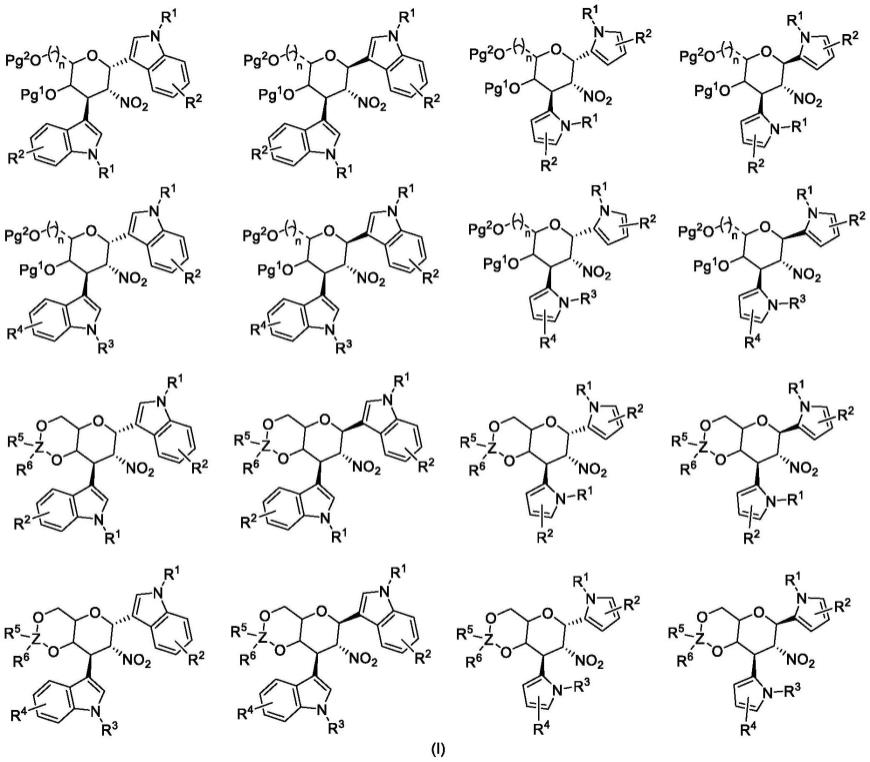
8.本发明公开了一种吲哚糖苷类化合物及吡咯糖苷类化合物,结构式如下式(ⅰ)任一结构式所示:
[0009][0010]
其中,pg1为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种;pg2为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种;或者,pg1o、pg2o分别被叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚中任意一种取代;
[0011]
r1、r4分别为氢原子、甲基、苄基、烯丙基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种;r2、r3分别为氢原子、卤素、甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种;r5、r6分别为甲基、乙基、叔丁基、苯基中的任意一种;z为碳原子或硅原子。
[0012]
优选的,当pg1和/或pg2为甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种时,pg1和/或pg2可分别被一个或多个各自独立的r
x
取代;
[0013]
或,当pg1o和/或pg2o为取代氨基、巯基、烷基硫醚、芳基硫醚中的任意一种时,pg1o和/或pg2o可分别被一个或多个各自独立的r
x
取代;
[0014]
当r1和/或r4为甲基、苄基、烯丙基、炔基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种时,r1和/或r4可分别被一个或多个各自独立的r
x
取代;
[0015]
当r2和/或r3为甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基和炔丙氧基、硝基、酯基、羰基、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种时,r2和/或r3可分别被一个或多个各自独立的r
x
取代;
[0016]
当r5和/或r6为甲基、乙基、叔丁基和苯基中的任意一种时,r5和/或r6可分别被一个或多个各自独立的r
x
取代;
[0017]
所述r
x
为氢原子、卤素、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基和磺酰胺中的任意一种。
[0018]
优选的,当r
x
为烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺中的任意一种时,r
x
可被一个或多个氢原子、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺所取代。
[0019]
相应的,上述的吲哚糖苷类化合物及吡咯糖苷类化合物的合成方法,将硝基烯糖、第一分子取代吲哚或取代吡咯、分子筛,于有机溶剂中搅拌6~12h,形成1,3-双吲哚-2-硝基糖类化合物或1,3-双吡咯-2-硝基糖类化合物。
[0020]
优选的,所述硝基烯糖与第一分子取代吲哚或取代吡咯的当量比为1:1~10,所述有机溶剂的浓度为0.001~100mol/l,反应温度为-100~200℃,所述分子筛的浓度为10~500g/mol。
[0021]
优选的,所述有机溶剂为2,2,2-三氟乙醇、2,2,2-三氯乙醇、1,1,1,3,3,3-六氟-2-丙醇、氯乙醇、2,2-二氯乙醇、二氯甲烷、氯仿、乙腈、甲醇、乙醇、叔丁醇、异丙醇、苯、甲苯、四氢呋喃、n,n-二甲基甲酰胺、dmf、dmso、1,4-二氧六环、2-甲基-四氢呋喃、乙醚、叔丁基甲基醚中的任意一种或几种溶剂任意比例的混合物。
[0022]
优选的,在硝基烯糖、取代吲哚或取代吡咯的反应体系中加入催化剂,所述催化剂的用量为0.001~10.0当量,所述催化剂包括bf3·
et2o、tmsotf、tbsotf、tesotf、金属卤化物、金属磺酸盐、高氯酸及其金属盐、三芳基硼、有机磷酸、有机羰基酸中的任意一种。
[0023]
优选的,在加入第一分子取代吲哚或取代吡咯,搅拌反应至硝基烯糖反应完全后,向反应体系中加入第二分子取代吲哚或吡咯,形成1,3-双吲哚-2-硝基糖类化合物或1,3-双吡咯-2-硝基糖类化合物,所述1,3-双吲哚-2-硝基糖类化合物或1,3-双吡咯-2-硝基糖类化合物中1-位和3-位的吲哚或吡咯不同,所述第二分子取代吲哚或吡咯的当量为1.0~10.0。
[0024]
相应的,一种药物组合物,包括上述的化合物或上述合成方法合成的化合物,或其立体异构体、互变异构体或其盐,或其前药分子,或医学上可接受的载体。
[0025]
相应的,上述的化合物或上述合成方法合成的化合物,或其中间体,或其立体异构体、互变异构体,或其盐,或其前药分子在制备治疗帕金森、癌症或肿瘤药物中的应用。
[0026]
本发明具备以下有益效果:
[0027]
1.本发明采用一步合成的策略,以2-硝基烯糖和取代吲哚(或吡咯)为原料,高效、高选择性合成一系列1,3双吲哚(或吡咯)取代的糖苷类化合物和1-吲哚(或吡咯)-2-硝基烯糖类化合物,整个合成过程中具有条件温和、产率高、选择性好操作简单等优点。
[0028]
2.本发明可以通过控制反应温度及所加吲哚或吡咯的用量,进一步高效、高立体选择性地合成糖环1位和3位不同吲哚或吡咯取代的糖衍生物。
[0029]
3.由于产物中的保护基可以在温和条件下脱除,并且产物中的硝基可以进一步经简单反应,转化成氨基并进一步发生其它反应,如脱氨基形成2-去氧糖,与羧酸形成酰胺键,经还原胺化形成胺类衍生物;产物中的硝基也可以经nef反应转化成酮羰基并进一步还原为羟基等,硝基的alpha位也可以进一步在碱性条件下与其它亲电试剂发生反应,形成多种糖衍生物。因此,本发明可以为双吲哚、双吡咯取代的糖衍生物的多样性合成及修饰,提供一条不可替代的路线。
[0030]
4.本发明所获得的部分1,3-双吲哚(或吡咯)取代的糖衍生物,表现出较好的抗帕金森病的生物活性和广泛的抗肿瘤活性。
附图说明
[0031]
图1为各化合物分别对以下肿瘤细胞和癌细胞(786-o人肾透明细胞腺癌细胞、mkn-45人胃癌细胞、a549人肺癌细胞、hct116人结肠癌细胞、5637人膀胱癌细胞、gbc-sd人胆囊癌细胞、hepg2人肝癌细胞、du145人前列腺癌细胞、mcf7人乳腺癌细胞、a-673人横纹肌肉瘤细胞、sf126人脑瘤细胞、cal-62人甲状腺癌细胞、a-375人恶性黑色素瘤细胞)的细胞毒活性图;
[0032]
图2为各化合物对mpp
损伤的shsy5y细胞拯救活性和最佳活性浓度以及有效持续时间图。
具体实施方式
[0033]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0034]
若未特别指明,实施举例中所用的技术手段为本领域技术人员所熟知的常规手段。
[0035]
1.本发明提供了一种1,3-双吲哚取代的糖衍生物及其合成方法,具体方法为:将硝基烯糖(1.0equiv)、取代吲哚(1.0~10.0equiv)、分子筛(10~500g/mol),选择性添加催化剂(0.001equiv~10.0equiv),在一定温度范围内,于有机溶剂中搅拌6~12h,形成1,3-双吲哚-2-硝基糖类化合物。
[0036]
其中,硝基烯糖包括但不限于全乙酰化葡萄糖2-硝基烯糖、全乙酰化半乳糖2-硝基烯糖、全乙酰化阿拉伯糖2-硝基烯糖、全乙酰化鼠李糖糖2-硝基烯糖等单糖制备的全乙酰化2-硝基烯糖。
[0037]
单糖6位经官能团化修饰后所形成的相应的2-硝基烯糖、二糖全乙酰化2-硝基烯糖、4,6位不同取代的2-硝基烯糖。其中,3位取代基opg包括单不限于乙酰氧基、苄氧基、苯甲酰氧基等用于糖化学中的保护基团,优选乙酰基。4位pg1,为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种;特别地,pg1o也可以被其它官能团,如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等取代。6位pg2,为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种;特别地,pg1o也可以被其它官能团,如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等
取代。
[0038]
进一步的,分子筛为(钾a型)、(钠a型)、(钙a型)等在有机合成反应中广泛应用的分子筛。
[0039]
进一步的,催化剂为路易斯酸催化剂,如bf3·
et2o、tmsotf、tbsotf、tesotf、金属卤化物(如sncl4、ticl4、fecl3、alcl3、fecl2、mgcl2、zncl2、zrcl4、bicl3、incl3、febr3、febr2、bibr3、inbr3、znbr2、mgbr2、zni2、mgi2、bix3)、金属磺酸盐(如fe(otf)2、fe(otf)3、in(otf)3、bi(otf)3、yb(otf)3、sc(otf)3、hf(otf)4等)、高氯酸及其金属盐(如mgclo4、liclo4等)、三芳基硼(如三苯基硼等)或在有机合成化学中常见氢键类有机小分子催化剂(如脲、取代脲、硫脲、取代硫脲)、质子酸类催化剂(如有机磷酸、有机羰基酸[如甲酸、乙酸、三氟乙酸、苯甲酸])中的任意一种。
[0040]
进一步的,所述有机溶剂的反应浓度为0.001~100mol/l,反应温度为-100~200℃。
[0041]
进一步的,所述有机溶剂为2,2,2-三氟乙醇、2,2,2-三氯乙醇、1,1,1,3,3,3-六氟-2-丙醇、氯乙醇、2,2-二氯乙醇、二氯甲烷(dcm)、氯仿(chcl3)、乙腈(mecn)、甲醇(meoh)、乙醇(etoh)、叔丁醇(t-buoh)、异丙醇(i-proh)、苯(phh)、甲苯(toluene)、四氢呋喃(thf)、n,n-二甲基甲酰胺(dmf)、二甲亚砜(dmso)、1,4-二氧六环、2-甲基-四氢呋喃(2-methf)、乙醚、叔丁基甲基醚中的任意一种或几种溶剂任意比例的混合物。
[0042]
反应通式如下:
[0043][0044]
其中,pg为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0045]
pg1为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0046]
pg2为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0047]
r1为氢原子、甲基、苄基、烯丙基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种。
[0048]
r2为氢原子、卤素、甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨
基中的任意一种。
[0049]
r5、r6分别为甲基、乙基、叔丁基和苯基等常用于糖化学中糖环4,6形成六元环状结构的保护基中的任意一种,z为碳原子或硅原子。
[0050]
进一步的,当pg和/或pg1和/或pg2为甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种时,pg和/或pg1和/或pg2可分别被一个或多个各自独立的r
x
取代。
[0051]
或者,pg1o、pg2o可分别被其它官能团,如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等任意一种取代,当pg1o和/或pg2o为取代氨基、巯基、烷基硫醚、芳基硫醚中的任意一种时,pg1o和/或pg2o可分别被一个或多个各自独立的r
x
取代。
[0052]
当r1为甲基、苄基、烯丙基、炔基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种时,r1可被一个或多个各自独立的r
x
取代。
[0053]
当r2为甲基、烷基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种时,r2可被一个或多个各自独立的r
x
取代。
[0054]
当r5和/或r6为甲基、乙基、叔丁基和苯基中的任意一种时,r5和/或r6可分别被一个或多个各自独立的r
x
取代。
[0055]
具体的:所述r
x
为氢原子、卤素、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基和磺酰胺中的任意一种。
[0056]
进一步的,当r
x
为烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺中的任意一种时,r
x
可被一个或多个氢原子、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺所取代。
[0057]
2.本发明提供了一种1,3-双吲哚取代的糖衍生物及其合成方法,具体方法为:将硝基烯糖(1.0equiv)、第一分子取代吲哚(1.0~5.0equiv)与分子筛(10~500g/mol),在一定温度范围(-100~200℃)内,于有机溶剂(0.001~100mol/l)中搅拌6~12h,随后,再加入第二分子取代吲哚(1.0~10.0equiv),形成1,3-双不同吲哚-2-硝基糖类化合物。
[0058]
其中,硝基烯糖、分子筛和有机溶剂的选择,与上述合成方法1中的相同。
[0059]
反应通式如下:
[0060][0061]
其中,pg为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0062]
pg1为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0063]
pg2为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0064]
r1、r4分别为氢原子、甲基、苄基、烯丙基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种。
[0065]
r2、r3分别为氢原子、卤素、甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种。
[0066]
r5、r6分别为甲基、乙基、叔丁基和苯基中的任意一种,z为碳原子或硅原子。
[0067]
进一步的,当pg和/或pg1和/或pg2为甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种时,pg和/或pg1和/或pg2可分别被一个或多个各自独立的r
x
取代。
[0068]
或者,pg1o、pg2o可分别被其它官能团如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等任意一种取代,当pg1o和/或pg2o为取代氨基、巯基、烷基硫醚、芳基硫醚中的任意一种时,pg1o和/或pg2o可分别被一个或多个各自独立的r
x
取代。
[0069]
当r1和/或r4为甲基、苄基、烯丙基、炔基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种时,r1和/或r4可分别被一个或多个各自独立的r
x
取代。
[0070]
当r2和/或r3为甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种时,r2和/或r3可分别被一个或多个各自独立的r
x
取代。
[0071]
具体的:所述r
x
为氢原子、卤素、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基和磺酰胺中的任意一种。
[0072]
进一步的,当r
x
为烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺中的任意一种时,r
x
被一个或多个氢原子、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺所取代。
[0073]
3.本发明提供了一种1,3-双吡咯取代的糖衍生物及其合成方法,具体方法为:将硝基烯糖(1.0equiv)、取代吡咯(1.0~10.0equiv)与分子筛(10~500g/mol),在一定温度范围(-100~200℃)内,于有机溶剂(0.001~100mol/l)中搅拌6~12h,形成1,3-双吡咯-2-硝基糖类化合物。
[0074]
其中,硝基烯糖、分子筛和有机溶剂的选择,与上述合成方法1中的相同。
[0075]
反应通式如下:
[0076][0077]
其中,pg为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0078]
pg1为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0079]
pg2为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0080]
r1为氢原子、甲基、苄基、烯丙基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种。
[0081]
r2为氢原子、卤素、甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨
基中的任意一种。
[0082]
r5、r6分别为甲基、乙基、叔丁基和苯基中的任意一种,z为碳原子或硅原子。
[0083]
进一步的,当pg和/或pg1和/或pg2为甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种时,pg和/或pg1和/或pg2可分别被一个或多个各自独立的r
x
取代。
[0084]
pg1o、pg2o可分别被其它官能团,如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等任意一种取代,当pg1o和/或pg2o为取代氨基、巯基、烷基硫醚、芳基硫醚中的任意一种时,pg1o和/或pg2o可分别被一个或多个各自独立的r
x
取代。
[0085]
当r1为甲基、苄基、烯丙基、炔基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种时,r1可被一个或多个各自独立的r
x
取代。
[0086]
当r2为甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种时,r2可被一个或多个各自独立的r
x
取代。
[0087]
具体的:所述r
x
为氢原子、卤素、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基和磺酰胺中的任意一种。
[0088]
进一步的,当r
x
为烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺中的任意一种时,r
x
被一个或多个氢原子、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺所取代。
[0089]
4.本发明提供了一种1,3-双吡咯取代的糖衍生物及其合成方法,具体方法为:将硝基烯糖(1.0equiv)、第一分子取代吡咯(1.0~5.0equiv)与分子筛(10~500g/mol),在一定温度范围(-100~200℃)内,于有机溶剂(0.001~100mol/l)中搅拌6~12h,随后,再加入第二分子取代吡咯(1.0~10.0equiv),形成1,3-双不同吡咯-2-硝基糖类化合物。
[0090]
其中,硝基烯糖、分子筛和有机溶剂的选择,与上述合成方法1中的相同。
[0091]
反应通式如下:
[0092][0093]
其中,pg为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0094]
pg1为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0095]
pg2为氢原子、甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基等常用于糖化学的保护基中的任意一种。
[0096]
r1、r4分别为氢原子、甲基、苄基、烯丙基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种。
[0097]
r2、r3分别为氢原子、卤素、甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基、炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种。
[0098]
r5、r6分别为甲基、乙基、叔丁基和苯基中的任意一种,z为碳原子或硅原子。
[0099]
进一步的,当pg和/或pg1和/或pg2为甲基、乙酰基、苯甲酰基、苄基、烯丙基、磺酰基、硅基中的任意一种时,pg和/或pg1和/或pg2可分别被一个或多个各自独立的r
x
取代。
[0100]
或者,pg1o、pg2o可分别被其它官能团如叠氮基、取代氨基、巯基、烷基硫醚、芳基硫醚等任意一种取代,当pg1o和/或pg2o为取代氨基、巯基、烷基硫醚、芳基硫醚中的任意一种时,pg1o和/或pg2o可分别被一个或多个各自独立的r
x
取代。
[0101]
当r1和/或r4为甲基、苄基、烯丙基、炔基、炔丙基、烷基、环烷基、磺酰基、酰基、烷氧羰基中的任意一种时,r1和/或r4可分别被一个或多个各自独立的r
x
取代。
[0102]
当r2和/或r3为甲基、烷基、甲氧基、甲氧基、苄氧基、芳环、芳杂环、烯丙氧基和炔丙氧基、硝基、酯基、羰基(包括醛羰基、酮羰基)、氰基、烷基硫醚基、芳基硫醚基、取代氨基中的任意一种时,r2和/或r3可分别被一个或多个各自独立的r
x
取代。
[0103]
具体的:所述r
x
为氢原子、卤素、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基和磺酰胺中的任意一种。
[0104]
进一步的,当r
x
为烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺中的任意一种时,r
x
被一个或多个氢原子、烷基、氟代烷基、烯基、炔基、硝基、氰基、环烷基、芳基、氨基、烷氧基、取代氨基、酰胺基、羟基、磺酰胺所取代。
[0105]
为了更加进一步的阐述本发明中1,3-双吲哚(或吡咯)取代的糖苷类化合物或1-吲哚(或吡咯)-2-硝基烯糖类化合物的合成,本发明选择性的合成了下列物质,并结合具体的实施例阐述每个化合物的合成过程。
[0106][0107]
实施例1(1r,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w1)的合成
[0108]
具体反应过程有如下5种方式:
[0109]
1.向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms 分子筛(100mg)及0.4ml干燥的dcm(干燥溶剂通常指含水量≤50ppm的溶剂),于-20℃下缓慢滴加tmsotf(54μl,0.3mmol),滴加完毕后自然升温反应过夜,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(17.3mg,产率16%)。
[0110]
反应方程式为:
[0111][0112]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0113]1h nmr(400mhz,dmso-d6)δ7.97(d,j=7.8hz,1h),7.90(s,1h),7.74(d,j=7.9hz,1h),7.55(s,1h),7.48(d,j=8.1hz,1h),7.39(d,j=7.9hz,1h),7.28
–
7.08(m,4h),6.20(d,j=6.5hz,1h),6.10(dd,j=12.1,6.5hz,1h),5.15(t,j=10.2hz,1h),4.50
–
4.40(m,1h),4.16(dd,j=12.2,5.5hz,1h),4.00
–
3.93(m,1h),3.89(s,3h),3.86(m,1h),3.74(s,3h),1.88(s,3h),1.57(s,3h);
13
c nmr(101mhz,dmso-d6)δ170.4,169.2,136.7,136.5,129.3,128.1,127.2,122.4,121.8,119.9,119.7,119.2,119.1,111.1,110.3,110.1,105.6,86.5,72.4,70.2,69.6,62.8,37.4,33.1,33.0,20.9,20.6;hrms(esi)calcd for c
28h29
n3nao7[m na]
542.1898,found 542.1897.
[0114]
2.向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)、1-[3,5-双(三氟甲基)苯基]-3-[(1s,2s)-( )-2-(二甲基氨基)环己烷]硫脲(8.0mg,5mol%)及0.4ml干燥的dcm,于65℃下反应12~24h,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(17.4mg,产率16%)。
[0115]
反应方程式为:
[0116][0117]
3.向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)、三(五氟苯基)硼烷(tpfpb,5.1mg,5mol%)及0.4ml干燥的dcm,于65℃下反应12~24h,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(17.6mg,产率17%)。
[0118]
反应方程式为:
[0119][0120]
4.向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及0.4ml干燥的1,1,1,3,3,3-六氟异丙醇(hfip),于室温下反应2~8h,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(51.9mg,产率50%)。
[0121]
反应方程式为:
[0122][0123]
5.向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及0.4ml干燥的2,2,2-三氟乙醇(tfe),于室温下反应2~8h,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(93.4mg,产率90%)。
[0124]
反应方程式为:
[0125][0126]
根据上述5种合成方式可知,方式1-4的产率较低,只有第5种合成方法最终获得产物的产率较高,因此,后续实施例均参考第5种合成方式,将不再使用催化剂。
[0127]
实施例2(1r,2r,3r,4s,5r)-2-硝基1,3-二((1-甲基-5-溴)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w2)的合成
[0128]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-5溴-吲哚(92.0mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-溴)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(59.4mg,产率44%)。
[0129]
反应方程式为:
[0130][0131]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0132]1h nmr(400mhz,dmso-d6)δ8.16(s,1h),7.99(s,1h),7.91(s,1h),7.59(s,1h),7.42(d,j=8.7hz,1h),7.33(d,j=8.7hz,1h),7.29(d,j=8.8hz,1h),7.24(d,j=8.8hz,1h),6.15(d,j=6.5hz,1h),6.04(dd,j=12.1,6.6hz,1h),5.02(t,j=10.2hz,1h),4.38(t,j=11.3hz,1h),4.10(dd,j=12.2,5.7hz,1h),3.88(m,1h),3.84(s,3h),3.80(dd,j=12.3,2.7hz,1h),3.70(s,2h),1.3(s,3h),1.55(s,3h);
13
c nmr(101mhz,dmso-d6)δ170.4,169.1,135.5,135.3,131.1,129.8,128.6,124.9,124.3,122.2,121.6,112.9,112.6,112.3,112.2,111.2,105.5,86.1,72.4,70.2,69.2,62.7,55.4,40.9,37.1,33.4,33.3,20.9,20.6;hrms(esi)calcd for c
28h27
br2n3nao7[m na]
698.0108,found 698.0108.
[0133]
实施例3(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w3)的合成
[0134]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-7-甲氧基-吲哚(70.8mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(98.4mg,产率85%)。
[0135]
反应方程式为:
[0136][0137]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0138]1h nmr(600mhz,cdcl3)δ7.66(t,j=4.8hz,2h),7.32(s,1h),6.91(s,1h),6.85-6.83(m,2h),6.77(d,j=2.2hz,1h),6.72(d,j=2.2hz,1h),6.17(d,j=6.2hz,1h),5.57(dd,j=12.5,6.2hz,1h),5.21(t,j=10.2hz,1h),4.36(dd,j=12.4,10.3hz,1h),4.17(dd,j=12.3,5.6hz,1h),3.94(dd,j=12.3,2.4hz,1h),3.88(s,3h),3.87(s,3h),3.76(s,3h),3.66(s,3h),1.97(s,3h),1.63(s,3h);
13
c nmr(151mhz,cdcl3)δ170.7,169.1,157.1,156.6,137.6,126.6,124.3,122.0,120.7,119.6,110.8,110.0,109.6,106.1,92.8,86.2,72.2,71.1,69.8,62.6,55.7,55.6,37.7,33.1,32.9,29.7,20.8,20.5;hrms(esi)calcd for c
30h34
n3o9[m h]
580.2290,found 580.2283.
[0139]
实施例4(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5,6-二甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w4)的合成
[0140]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-5,6-二甲氧基-吲哚(84.0mg,0.44mmol)、ms 分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5,6-二甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(113.7mg,产率89%)。
[0141]
反应方程式为:
[0142][0143]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0144]1h nmr(600mhz,cdcl3)δ7.28(s,1h),7.26(s,1h),7.21(s,1h),7.17(s,1h),6.89(s,1h),6.77(s,1h),6.72(s,1h),6.16(d,j=6.2hz,1h),5.54(dd,j=12.4,6.3hz,1h),5.19(t,j=10.2hz,1h),4.34
–
4.27(m,1h),4.15(dd,j=12.4,5.2hz,1h),3.99(s,3h),3.95(s,3h),3.95(s,3h),3.94(s,3h),3.87(m,1h),3.77(s,3h),3.68(s,3h),1.92(s,3h),1.64(s,3h);
13
c nmr(151mhz,cdcl3)δ170.7,169.1,147.7,147.4,145.4,144.9,131.6,131.3,125.9,123.7,120.4,110.4,105.6,101.6,101.3,92.9,92.7,86.1,72.2,71.2,69.9,62.5,56.9,56.5,56.3,56.2,37.8,33.4,33.1,29.7,20.7,20.5;hrms(esi)calcd for c
32h38
n3o
11
[m h]
640.2501,found 640.2493.
[0145]
实施例5(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-溴-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w5)的合成
[0146]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-5-溴-7-甲氧基吲哚(105.1mg,0.44mmol)、ms 分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-溴-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(91.1mg,产率62%)。
[0147]
反应方程式为:
[0148][0149]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0150]1h nmr(400mhz,dmso-d6)δ7.87(s,1h),7.78(d,j=1.6hz,1h),7.52
–
7.47(m,2h),6.83(d,j=1.6hz,1h),6.77(d,j=1.6hz,1h),6.10(d,j=6.6hz,1h),6.02(dd,j=12.0,6.6hz,1h),5.02(t,j=10.2hz,1h),4.33(t,j=11.3hz,1h),4.15(dd,j=12.2,5.5hz,1h),4.06(s,3h),3.92(s,4h),3.90(s,3h),3.88(s,3h),3.83(dd,j=12.2,2.7hz,1h),
1.89(s,3h),1.62(s,3h);
13
c nmr(101mhz,dmso-d6)δ170.4,169.2,148.5,148.1,131.5,131.3,129.2,124.9,115.2,114.4,112.8,112.0,106.8,106.1,105.6,86.0,70.1,69.1,62.7,56.5,56.3,55.4,36.9,36.76,20.9,20.6;hrms(esi)calcd for c
30h31
br2n3nao9[m na]
758.0319,found 758.0301.
[0151]
实施例6(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-炔丙氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w6)的合成
[0152]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-5炔丙氧基吲哚(81.4mg,0.44mmol)、ms 分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基1,3-二((1-甲基-5炔丙氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(90.3mg,产率72%)。
[0153]
反应方程式为:
[0154][0155]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0156]1h nmr(400mhz,cdcl3)δ7.44(s,1h),7.36(t,j=4.4hz,2h),7.21(d,j=8.8hz,1h),7.06
–
6.98(m,3h),6.19(d,j=6.2hz,1h),5.58(dd,j=12.4,6.2hz,1h),5.27(t,j=10.2hz,1h),4.82(d,j=2.4hz,2h),4.78(d,j=2.4hz,2h),4.36(dd,j=12.5,10.4hz,1h),4.18(dd,j=12.3,4.9hz,1h),4.00(dd,j=12.3,2.4hz,1h),3.87(m,1h),3.84(s,3h),3.74(s,3h),3.71(d,j=3.4hz,1h),2.57(dt,j=7.5,2.4hz,2h),2.00(s,3h),1.66(s,3h);
13
c nmr(101mhz,cdcl3)δ170.8,169.1,152.3,151.9,133.0,132.6,128.3,128.1,113.6,112.4,110.3,105.6,104.1,103.8,86.2,79.4,79.1,75.4,75.3,71.9,71.2,69.8,62.5,57.3,57.2,56.8,37.8,33.4,33.2,29.7,20.7,20.5;hrms(esi)calcd for c
34h33
n3nao9[m na]
650.2109,found 650.2114.
[0157]
实施例7(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-烯丙基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w7)的合成
[0158]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-烯丙基吲哚(69.1mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1-烯丙基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(66.2mg,产率58%)。
[0159]
反应方程式为:
[0160][0161]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0162]1h nmr(400mhz,dmso-d6)δ7.93(d,j=6.9hz,1h),7.88(s,1h),7.75(d,j=7.9hz,1h),7.57(s,1h),7.46(d,j=8.2hz,1h),7.37(d,j=7.5hz,1h),7.24
–
7.18(m,1h),7.17
–
7.09(m,3h),6.20(d,j=6.5hz,1h),6.16
–
5.91(m,3h),5.25
–
5.06(m,3h),4.99
–
4.93(m,3h),4.81
–
4.71(m,3h),4.53
–
4.39(m,1h),4.17(dd,j=12.1,5.8hz,1h),4.04
–
3.96(m,1h),3.91(dd,j=12.1,2.7hz,1h),1.87(s,3h),1.56(s,3h);
13
c nmr(101mhz,dmso-d6)δ170.4,169.2,136.2,135.9,134.9,134.8,128.5,128.2,128.1,126.9,122.4,121.9,120.1,119.7,119.4,119.3,116.9,116.3,111.2,110.8,110.5,106.3,86.7,72.0,70.6,69.6,62.9,48.5,48.3,37.7,20.9,20.6;hrms(esi)calcd for c
32h34
n3o7[m h]
572.23291,found 572.2400.
[0163]
实施例8(1r,2r,3r,4s,5r)-2-硝基-1,3-二(3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w8)的合成
[0164]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、吲哚(51.5mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得(1r,2r,3r,4s,5r)-2-硝基-1,3-二(3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(54.0mg,产率55%)。
[0165]
反应方程式为:
[0166][0167]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0168]1h nmr(400mhz,dmso-d6)δ11.40(d,j=2.6hz,1h),11.09(d,j=2.6hz,1h),7.83
–
7.77(m,2h),7.63(d,j=7.8hz,1h),7.47(d,j=8.1hz,1h),7.39(d,j=8.0hz,1h),7.23
–
7.17(m,1h),7.17
–
7.12(m,1h),7.11
–
7.02(m,3h),6.04(d,j=4.1hz,1h),5.99(t,j=10.2hz,1h),5.87(s,1h),4.20
–
3.97(m,3h),3.74(m,1h),2.01(s,3h),1.66(s,3h).
13
c nmr(101mhz,dmso)δ170.5,170.4,137.1,136.3,127.1,126.2,124.7,123.8,122.5,121.9,120.4,119.8,119.4,118.47,109.2,108.3,88.9,72.9,71.1,66.8,63.5,36.6,21.1,20.8.hrms(esi)calcd for c
26h25
n3nao7[m na]
514.1585,found514.1585.
[0169]
实施例9(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1,2,5-三甲基)3-吡咯基)-4-乙酰
氧基-5-乙酰氧亚甲基吡喃糖(w9)的合成
[0170]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、吲哚(48.0mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得(1r,2r,3r,4s,5r)-2-硝基1,3-二(1,2,5-三甲基)3-吡咯基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(52.3mg,产率55%)。
[0171]
反应方程式为:
[0172][0173]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0174]1h nmr(400mhz,cdcl3)δ6.15(s,1h),5.70(s,1h),5.59(d,j=6.7hz,1h),5.22(dd,j=12.0,6.7hz,1h),5.09(t,j=10.3hz,1h),4.21(dd,j=12.3,4.3hz,1h),4.10-4.06(m,1h),4.00
–
3.88(m,2h),3.34(s,3h),3.29(s,3h),2.21(s,6h),2.14(s,3h),2.10(s,3h),2.06(s,3h),1.87(s,3h);
13
c nmr(101mhz,cdcl3)δ170.9,168.9,129.2,127.5,127.2,126.2,113.0,109.9,105.8,102.2,87.4,77.3,71.1,70.5,69.5,63.1,37.7,30.3,30.1,20.9,20.7,12.5,10.2,10.1;hrms(esi)calcd for c
24h34
n3o7[m h]
476.2391,found 476.2385.
[0175]
实施例10(1r,2r,3r,4s,5r)-2-硝基-1,3-二((1,5-二甲基)3-吡咯基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w10)的合成
[0176]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、吲哚(41.8mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得(1r,2r,3r,4s,5r)-2-硝基1,3-二(1,5-二甲基)3-吡咯基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(78.1mg,产率87%)。
[0177]
反应方程式为:
[0178][0179]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0180]1h nmr(400mhz,cdcl3)δ6.41(d,j=3.7hz,1h),5.96(d,j=3.6hz,1h),5.85(d,j=3.7hz,1h),5.80-5.78(m,2h),5.26(dd,j=12.2,6.8hz,1h),5.07(t,j=10.2hz,1h),4.24
–
4.14(m,2h),3.91(dd,j=12.4,2.5hz,1h),3.77-3.73(m,1h),3.62(s,3h),3.51(s,3h),2.21(s,3h),2.19(s,3h),2.05(s,3h),1.84(s,3h);
13
c nmr(101mhz,cdcl3)δ170.6,
168.5,131.8,128.8,128.3,121.2,109.7,106.2,105.8,103.8,85.3,77.3,72.8,69.6,69.4,62.4,37.7,30.5,30.1,20.8,20.4,12.7,12.5;hrms(esi)calcd for c
22h30
n3o7[m h]
448.2078,found 448.2067.
[0181]
实施例11(1s,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖(w11)的合成
[0182]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-3,4-二乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖-1-烯(85.8mg,0.2mmol)、1-甲基-5-甲氧基吲哚(70.8mg,0.44mmol)、ms 分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得((1s,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖(89.8mg,产率65%)。
[0183]
反应方程式为:
[0184][0185]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0186]1h nmr(400mhz,dmso-d6)δ7.67(d,j=8.0hz,2h),7.46(d,j=7.8hz,1h),7.39
–
7.33(m,2h),7.27(dd,j=5.7,3.2hz,2h),7.22(d,j=8.0hz,2h),7.06(s,1h),6.88(dd,j=8.9,2.4hz,1h),6.79(dd,j=9.0,2.3hz,1h),5.64(dd,j=11.6,9.7hz,1h),5.35(d,j=9.6hz,1h),5.23(s,1h),4.42
–
4.29(m,1h),4.11(d,j=10.1hz,2h),3.82(s,3h),3.79(s,2h),3.74(s,3h),3.69(s,3h),2.31(s,3h),1.55(s,3h);
13
c nmr(101mhz,dmso-d6)δ169.1,154.2,153.9,145.3,132.5,132.2,130.4,129.9,128.1,126.8,112.0,111.2,111.1,108.4,76.7,75.5,69.3,56.0,33.1,21.5,20.7.hrms(esi)calcd for c
35h37
n3nao
10
s[m na]
714.2092,found 714.2090.
[0187]
实施例12(1s,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-叠氮亚甲基吡喃糖(w12)的合成
[0188]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-3,4-二乙酰氧基-5-叠氮亚甲基吡喃糖-1-烯(85.8mg,0.2mmol)、1-甲基-5-炔丙氧基吲哚(81.4mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得((1s,2r,3r,4s,5r)-2-硝基1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-叠氮亚甲基吡喃糖(106.1mg,产率87%)。
[0189]
反应方程式为:
[0190][0191]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0192]1h nmr(400mhz,dmso-d6)δ7.53(s,1h),7.45
–
7.38(m,2h),7.36(d,j=8.9hz,1h),7.30(d,j=8.9hz,1h),7.18(s,1h),6.96
–
6.81(m,2h),5.66(dd,j=11.5,9.6hz,1h),5.37(d,j=9.6hz,1h),5.25(s,1h),4.87
–
4.73(m,4h),4.24(d,j=8.6hz,1h),4.11(s,1h),3.74(s,3h),3.71(s,3h),3.57-3.52(m,3h),3.40-3.36(m,1h),1.65(s,3h).
13
c nmr(101mhz,dmso-d6)δ169.3,152.1,152.1,151.8,133.0,130.2,126.6,112.4,111.2,111.1,108.7,80.3,80.3,78.5,78.3,78.3,56.9,56.8,51.2,33.2,33.1,20.9.hrms(esi)calcd for c
32h30
n6nao7[m na]
633.2068,found 633.2066.
[0193]
实施例13(1s,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-叔丁基二甲基硅氧亚甲基吡喃糖(w13)的合成
[0194]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-3,4-二乙酰氧基-5-叔丁基二甲基硅氧亚甲基吡喃糖-1-烯(85.8mg,0.2mmol)、1-甲基吲哚(57.2mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得((1s,2r,3r,4s,5r)-2-硝基1,3-二((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基-5-叔丁基二甲基硅氧亚甲基吡喃糖(63.8mg,产率54%)。
[0195]
反应方程式为:
[0196][0197]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0198]1h nmr(400mhz,cdcl3)δ7.86(dt,j=8.0,1.0hz,1h),7.70(d,j=7.9hz,1h),7.37
–
7.29(m,2h),7.28
–
7.22(m,2h),7.20(dt,j=7.0,1.4hz,1h),7.18
–
7.12(m,1h),7.08(s,1h),7.05(s,1h),5.45(t,j=10.3hz,1h),5.36
–
5.29(m,2h),4.15(t,j=10.4hz,1h),4.00-3.95(m,1h),3.86(dd,j=11.4,2.8hz,1h),3.80(dd,j=11.4,4.8hz,1h),3.75(s,3h),3.74(s,3h),1.70(s,3h),0.92(s,9h),0.04(s,3h),0.00(s,3h).
13
c nmr(101mhz,cdcl3)δ169.1,137.3,136.9,127.5,126.8,126.0,122.3,121.9,120.2,119.8,119.3,118.8,109.5,109.5,109.4,108.3,91.3,81.4,77.2,70.7,63.1,43.7,32.9,29.7,25.9,20.6,18.3,-5.4.hrms(esi)calcd for c
32h41
n3nao6si[m na]
614.2657,found 614.2657.
[0199]
实施例14(1s,2r,3r,4s)-2-硝基-1,3-二((1-甲基)-3-吲哚基)-4-乙酰氧基吡喃糖(w14)的合成
[0200]
室温下,向反应试管中加入(3s,4s)-2-硝基-3,4-二乙酰氧基吡喃糖-1-烯(49.0mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,3r,4s)-2-硝基-1,3-二((1-甲基)-3-吲哚基)-4-乙酰氧基吡喃糖(80.5mg,产率90%)。
[0201]
反应方程式为:
[0202][0203]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0204]1h nmr(400mhz,dmso-d6)δ7.92(s,1h),7.89(d,j=7.9hz,1h),7.58(d,j=8.0hz,1h),7.55(s,1h),7.44(dd,j=8.3,2.9hz,2h),7.25
–
7.17(m,2h),7.14(t,j=7.4hz,1h),7.07(t,j=7.5hz,1h),5.70(dd,j=9.8,5.7hz,1h),5.63(d,j=9.8hz,1h),5.05(q,j=2.2hz 1h),4.50(t,j=4.5hz,1h),4.36(d,j=13.4hz,1h),3.91(d,j=13.3hz,1h),3.86(s,3h),3.77(s,3h),2.24(s,3h);
13
c nmr(101mhz,dmso-d6)δ170.5,137.1,136.3,129.1,128.4,126.7,122.2,122.1,120.0,119.7,119.6,118.4,111.2,110.5,110.2,106.6,85.0,71.4,69.2,65.5,39.0,33.1,33.0,21.6;hrms(esi)calcd for c
25h25
n3nao5[m na]
470.1686,found 470.1687.
[0205]
实施例15(1s,2r,3r,4s,5s)-2-硝基-1,3-二((1-甲基-5-甲氧基)-3-吲哚基)-4-乙酰氧基吡喃糖(w15)的合成
[0206]
室温下,向反应试管中加入(3s,4s,5s)-2-硝基-3,4-二乙酰氧基-5-甲基吡喃糖-1-烯(49.0mg,0.2mmol)、1-甲基-5-甲氧基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,3r,4s,5s)-2-硝基-1,3-二((1-甲基-5-甲氧基)-3-吲哚基)-4-乙酰氧基吡喃糖(80.5mg,产率90%)。
[0207]
反应方程式为:
[0208][0209]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0210]1h nmr(600mhz,cdcl3)δ7.65(d,j=8.7hz,1h),7.55(d,j=8.7hz,1h),6.99(s,1h),6.92(s,1h),6.87(dd,j=8.7,2.2hz,1h),6.81(dd,j=8.7,2.2hz,1h),6.73(d,j=2.2hz,1h),6.68(d,j=2.2hz,1h),5.31(t,j=10.6hz,1h),5.24(d,j=9.5hz,1h),5.16(s,1h),4.04(t,j=11.2hz,1h),4.01
–
3.95(m,1h),3.87(s,3h),3.85(s,3h),3.64(s,3h),
3.63(s,3h),1.73(s,3h),1.33(d,j=6.1hz,3h).
13
c nmr(151mhz,cdcl3)δ169.6,156.8,156.5,138.2,137.7,126.6,120.3,119.5,110.0,109.5,109.4,93.2,92.8,91.4,77.0,76.5,55.7,55.6,43.7,32.8,20.6,18.1.hrms(esi)calcd for c
28h31
n3nao7[m na]
544.2054,found 544.2049.
[0211]
实施例16(1s,2r,3r,4s,5r)-2-硝基-1,3-二((1-甲基-5-甲氧基)3-吲哚基)-乳糖(w16)的合成
[0212]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-乳糖-1-烯(121.1mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于室温下搅拌2~8h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=6:1)得(1s,2r,3r,4s,5r)-2-硝基1,3-二((1-甲基-5-甲氧基)3-吲哚基)-乳糖(101.7mg,产率62%)。
[0213]
反应方程式为:
[0214][0215]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0216]1h nmr(400mhz,dmso-d6)δ7.93(d,j=7.8hz,1h),7.83(s,1h),7.68(d,j=7.9hz,1h),7.51(s,1h),7.48(d,j=8.2hz,1h),7.35(d,j=8.0hz,1h),7.22(t,j=7.6hz,1h),7.18
–
7.05(m,3h),6.06(d,j=6.5hz,1h),5.80(dd,j=11.9,6.5hz,1h),5.06-5.02(m,2h),4.87(d,j=7.9hz,1h),4.67(dd,j=11.2,7.6hz,1h),4.45(t,j=11.2hz,1h),4.21
–
4.09(m,3h),3.97(dt,j=14.0,5.4hz,2h),3.91(s,3h),3.77(s,3h),3.41-3.38(m,1h),3.18(dd,j=11.1,6.9hz,1h),1.97(s,3h),1.89(s,3h),1.83(s,3h),1.57(s,3h),1.50(s,3h);
13
c nmr(151mhz,dmso-d6)δ170.6,170.2,170.1,170.0,169.4,136.9,136.5,129.4,128.3,128.1,122.4,121.4,120.1,119.9,119.1,118.8,111.5,110.3,109.8,105.6,98.1,88.5,78.5,70.9,70.7,69.5,69.3,68.9,67.2,63.4,60.7,37.1,33.2,32.9,30.0,21.0,20.7,20.7,20.2,20.1;hrms(esi)calcd for c
40h46
n3o
15
[m h]
808.2923,found 808.2904.
[0217]
实施例17(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-甲基-5-溴-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w17)的合成
[0218]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(27.5mg,0.21mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24h,待2-硝基烯糖反应完后,再加入1-甲基-5溴-7-甲氧基吲哚(71.7mg,0.3mmol),升至25~50℃,反应2~6h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得((1r,2r,3r,4s,5r)-2-硝基1-((1-甲基)-3-吲哚基)-3-((1-甲基-5-溴-7-甲氧基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(72.7mg,产率58%)。
[0219]
反应方程式为:
[0220][0221]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0222]1h nmr(600mhz,dmso-d6)δ7.84(d,j=7.9hz,1h),7.52(s,1h),7.49
–
7.39(m,2h),7.40-7.32(m,1h),7.20(ddd,j=8.2,7.0,1.2hz,1h),7.11(ddd,j=8.0,7.0,1.0hz,1h),6.75(d,j=1.7hz,1h),5.67(t,j=10.6hz,1h),5.37(d,j=9.5hz,1h),5.19(s,1h),4.31(s,1h),4.20(s,1h),4.14
–
4.04(m,2h),3.91(s,3h),3.87(s,3h),3.76(s,3h),1.98(s,3h),1.64(s,3h).
13
c nmr(151mhz,dmso-d6)δ170.5,169.4,148.3,137.2,129.5,126.4,122.1,120.1,119.8,112.2,110.5,109.1,106.2,90.1,77.4,75.5,63.3,56.4,36.7,33.0,21.0,20.7.hrms(esi)calcd for c
29h30
brn3nao8[m na]
650.1108,found 650.1107.
[0223]
实施例18(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-(5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉-1-)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w18)的合成
[0224]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(27.5mg,0.21mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24h,待2-硝基烯糖反应完后,再加入5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉(47.1mg,0.3mmol),升至25~50℃,反应2~6h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得1s,2r,3r,4s,5r)-2-硝基1-((1-甲基)-3-吲哚基)-3-(5,6-二氢-4h-吡咯并[3,2,1-ij]喹啉-1-)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(72.7mg,产率58%)。
[0225]
反应方程式为:
[0226][0227]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0228]1h nmr(400mhz,dmso-d6)δ7.84(d,j=7.9hz,1h),7.56
–
7.35(m,4h),7.20(t,j=7.6hz,1h),7.12(t,j=7.5hz,1h),6.95(t,j=7.5hz,1h),6.83(d,j=7.0hz,1h),5.68(t,j=10.6hz,1h),5.40(d,j=9.7hz,1h),5.31(t,j=9.5hz,1h),4.33-4.28(m,1h),4.16-4.08(m,5h),3.76(s,3h),2.89(t,j=6.2hz,2h),2.09(q,j=5.9hz,2h),1.98(s,3h),1.67(s,3h).
13
c nmr(151mhz,dmso)δ170.6,169.4,137.2,134.2,129.5,126.4,122.3,122.1,120.0,119.9,119.8,118.7,116.5,110.5,109.2,90.5,77.6,75.5,63.5,55.4,43.9,33.0,24.4,22.7,21.1,20.8.hrms(esi)calcd for c
30h31
n3nao7[m na]
568.2054,found 568.2060.
[0229]
实施例19(1s,2r,3r,4s,5s)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基吡喃糖(w19)的合成
[0230]
室温下,向反应试管中加入(3s,4s,5s)-2-硝基-3,4-二乙酰氧基-5-甲基吡喃糖-1-烯(49.0mg,0.2mmol)、1-甲基吲哚(27.5mg,0.21mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24h,待2-硝基烯糖反应完后,再加入1-甲基-5-甲氧基吲哚(55.5mg,0.3mmol),升至25~50℃,反应2~6h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,3r,4s,5s)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-甲基-5-甲氧基)3-吲哚基)-4-乙酰氧基吡喃糖(56.6mg,产率55%)。
[0231]
反应方程式为:
[0232][0233]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0234]1h nmr(400mhz,dmso-d6)δ7.84(d,j=7.9hz,1h),7.58-7.48(m,1h),7.49
–
7.40(m,2h),7.30(d,j=8.8hz,1h),7.20(m,2h),7.11(td,j=7.4,6.9,1.0hz,1h),6.85(dd,j=8.9,2.4hz,1h),5.66(dd,j=11.5,9.6hz,1h),5.33(d,j=9.6hz,1h),5.05(s,1h),4.82
–
4.78(m,2h),4.09(m,2h),3.77(s,3h),3.70(s,3h),3.54(t,j=2.3hz,1h),1.67(s,3h),1.16(d,j=6.1hz,3h).
13
c nmr(101mhz,dmso)δ169.3,151.8,137.1,129.5,126.4,122.1,119.8,111.0,110.5,109.5,90.9,80.3,78.3,76.1,75.5,56.8,33.2,33.0,20.9,18.3.hrms(esi)calcd for c
29h30
n3o6[m h]
516.2129,found 516.2131.
[0235]
实施例20(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-炔丙基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w20)的合成
[0236]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(27.5mg,0.21mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24h,待2-硝基烯糖反应完后,再加入1-炔丙基吲哚(46.5mg,0.3mmol),升至25~50℃,反应2~6h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-炔丙基)-3-吲哚基)-4-乙酰氧基-5-甲基吡喃糖(63.0mg,产率58%)。
[0237]
反应方程式为:
[0238][0239]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0240]1h nmr(400mhz,dmso-d6)δ7.87(d,j=7.9hz,1h),7.65(d,j=25.9hz,2h),7.52
–
7.41(m,3h),7.26
–
7.05(m,4h),5.74(t,j=10.6hz,1h),5.42(d,j=9.7hz,1h),5.32(s,1h),5.05(d,j=2.5hz,2h),4.33(dt,j=9.3,3.8hz,1h),4.21(s,1h),4.11(d,j=4.3hz,
2h),3.78(s,3h),3.40(d,j=3.1hz,1h),1.99(s,3h),1.62(s,3h).
13
c nmr(101mhz,dmso)δ170.6,169.4,137.2,129.6,126.4,122.2,122.1,120.1,119.9,119.9,110.7,110.5,109.2,90.2,79.4,77.5,76.2,75.5,63.4,35.7,33.0,21.1,20.7.hrms(esi)calcd for c
30h29
n3nao7[m na]
566.1898,found 566.1903.
[0241]
实施例21(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-甲基)-2-吡咯基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w21)的合成
[0242]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(27.5mg,0.21mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24h,待2-硝基烯糖反应完后,再加入1-甲基吡咯(24.0mg,0.3mmol),升至25~50℃,反应2~6h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,3r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-3-((1-甲基)-2-吡咯基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(45.0mg,产率48%)。
[0243]
反应方程式为:
[0244][0245]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0246]1h nmr(400mhz,dmso-d6)δ7.81(d,j=7.9hz,1h),7.50
–
7.40(m,2h),7.20(t,j=7.6hz,1h),7.10(t,j=7.5hz,1h),6.60(t,j=2.2hz,1h),6.30(s,1h),5.91(t,j=3.1hz,1h),5.51(t,j=10.4hz,1h),5.38(d,j=9.6hz,1h),5.12(t,j=10.2hz,1h),4.28(dt,j=9.3,4.4hz,1h),4.18
–
4.02(m,3h),3.77(s,3h),3.55(d,j=16.7hz,3h),1.98(s,3h),1.86(s,3h).
13
c nmr(101mhz,dmso)δ170.6,169.2,137.1,129.6,127.1,126.4,123.2,122.1,119.9,119.9,110.5,109.0,107.4,107.1,90.3,77.4,75.4,63.4,42.6,33.6,33.0,21.1,20.7.hrms(esi)calcd for c
24h27
n3nao7[m na]
492.1741,found 492.1740.
[0247]
实施例22(1s,2r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖-2-烯(w22)的合成
[0248]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-3,4-二乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖-1-烯(85.8mg,0.2mmol)、1-甲基吲哚(28.8mg,0.22mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24~48h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-对甲苯磺酰氧亚甲基吡喃糖-2-烯(68.0mg,产率68%)。
[0249]
反应方程式为:
[0250][0251]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0252]1h nmr(400mhz,dmso-d6)δ7.67(d,j=8.3hz,2h),7.48(d,j=8.0hz,1h),7.45(t,j=4.1hz,2h),7.26
–
7.15(m,4h),7.07(ddd,j=8.0,7.0,1.0hz,1h),6.09(dd,j=3.2,2.2hz,1h),5.57(ddd,j=8.9,3.3,1.9hz,1h),4.30
–
4.05(m,3h),3.77(s,3h),2.30(s,3h),2.04(s,3h).
13
c nmr(101mhz,dmso)δ170.0,151.6,145.4,137.1,132.2,130.8,130.7,130.4,128.1,126.2,122.1,120.0,119.2,110.6,109.0,73.1,69.6,68.8,64.0,33.0,21.5,21.1.hrms(esi)calcd for c
24h25
n2o8s[m h]
501.1326,found 501.1334.
[0253]
实施例23(1r,2r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖-2-烯(w23)的合成
[0254]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(28.8mg,0.22mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24~48h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,4s,5r)-2-硝基1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖-2-烯(34.9mg,产率45%)。
[0255]
反应方程式为:
[0256][0257]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0258]1h nmr(400mhz,dmso-d6)δ7.72(dt,j=7.9,1.0hz,1h),7.49
–
7.43(m,2h),7.33(s,1h),7.25-7.21(m,1h),7.15-7.11(m,1h),6.26(s,1h),5.60(ddd,j=8.9,2.7,1.8hz,1h),4.15(dd,j=12.3,5.5hz,1h),3.93(dd,j=12.3,2.8hz,1h),3.83-3.79(m,1h),3.78(s,3h),2.12(s,3h),1.84(s,3h).
13
c nmr(101mhz,dmso-d6)δ170.4,170.3,151.2,137.5,132.1,129.9,126.9,122.5,120.0,119.4,110.6,109.5,66.9,66.4,64.7,62.6,33.0,21.2,20.9.hrms(esi)calcd for c
19h20
n2nao7[m na]
411.1163,found 411.1175.
[0259]
实施例24(1s,2r,4s,5r)-2-硝基-1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖-2-烯(w24)的合成
[0260]
室温下,向反应试管中加入(3r,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(28.8mg,0.22mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),反应于-15℃下搅拌24~48h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1s,2r,4s,5r)-2-硝基1-((1-甲基)-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖-2-烯(65.2mg,产率78%)。
[0261]
反应方程式为:
[0262][0263]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0264]1h nmr(400mhz,dmso-d6)δ7.41(s,1h),7.33(d,j=8.9hz,1h),7.27(t,j=2.1hz,1h),7.00(d,j=2.4hz,1h),6.83(dd,j=8.9,2.4hz,1h),6.14(t,j=2.7hz,1h),5.66(dt,j=8.5,2.6hz,1h),4.29
–
4.07(m,3h),3.77(s,3h),3.72(s,3h),2.13(s,3h),2.00(s,3h).
13
c nmr(101mhz,dmso-d6)δ170.6,170.2,154.1,151.7,132.4,131.0,130.9,126.7,111.7,111.4,108.8,101.4,73.5,69.5,64.5,62.9,55.9,33.1,21.2,21.0.hrms(esi)calcd for c
20h22
n2nao8[m na]
441.1268,found 441.1274.
[0265]
实施例25(1s,2r,3r,4s,5r)-2-硝基-1,3-二(1-甲基-3-吲哚基)-4-羟基-5-羟基亚甲基吡喃糖(w25)的合成
[0266]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),于室温下反应2~8h,反应完毕后浓缩;再加入碳酸钾(13.8mg,0.1mmol)和0.4ml meoh,搅拌2h,将反应液浓缩经硅胶柱层析纯化(洗脱剂为二氯甲烷/甲醇=10:1)得(1s,2r,3r,4s,5r)-2-硝基1,3-二(1-甲基-3-吲哚基)-4-羟基-5-羟基亚甲基吡喃糖(62.6mg,产率72%)。
[0267]
反应方程式为:
[0268][0269]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0270]1h nmr(400mhz,dmso-d6)δ7.78(d,j=7.9hz,1h),7.68
–
7.63(m,1h),7.49
–
7.35(m,4h),7.22
–
6.99(m,4h),5.38(dd,j=11.4,9.6hz,1h),5.19(d,j=9.6hz,1h),5.09(d,j=6.9hz,1h),4.61(t,j=5.6hz,1h),4.23(t,j=6.5hz,1h),3.88(td,j=9.8,7.0hz,1h),3.81
–
3.77(m,2h),3.75(s,3h),3.75(s,3h),3.72
–
3.67(m,1h),3.58(dt,j=11.6,5.9hz,1h).
13
c nmr(101mhz,dmso-d6)δ137.2,137.1,132.0,129.3,129.1,128.7,126.5,122.0,121.6,120.0,119.7,119.3,119.2,110.4,110.3,110.0,92.2,84.4,75.5,61.7,46.8,32.9,32.9,19.1.hrms(esi)calcd for c
24h25
n3nao5[m na]
458.1686,found 458.1691.
[0271]
实施例26(1s,2r,3r,4s,5r)-2-氨基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w26)的合成
[0272]
室温下,向反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)及2,2,2-三氟乙醇(0.4ml),于室温下反应2~8h,反应完毕后浓缩,将2ml raney ni用10ml甲醇洗涤后溶于20ml甲醇中,将上一步浓缩的粗品溶于20ml甲醇后加入raney ni的甲醇溶液中,在h2条件下搅拌过夜,将反应液浓缩经硅胶柱层析纯化(洗脱剂为二氯甲烷/甲醇=10:1)得(1s,2r,3r,4s,5r)-2-氨基-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(35.2mg,产率36%)
[0273]
反应方程式为:
[0274][0275]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0276]1h nmr(400mhz,dmso-d6)δ7.76(d,j=8.0hz,1h),7.59(s,1h),7.34(dd,j=20.4,8.0hz,2h),7.22
–
6.94(m,6h),5.36(s,1h),4.89(d,j=9.0hz,1h),4.16-4.06(m,4h),3.78-3.74(s,2h),3.72(s,3h),3.70(s,3h),3.48(d,j=29.6hz,1h),2.01(s,3h),1.66(s,3h).
13
c nmr(101mhz,dmso-d6)δ171.4,170.2,137.6,127.9,126.6,121.6,121.4,119.5,119.0,118.7,111.7,109.2,109.1,79.1,78.0,63.3,31.5,31.5,19.4,19.2.hrms(esi)calcd for c
28h32
n3o5[m h]
490.2342,found 490.2335.
[0277]
实施例27(1r,2r,3r,4s,5r)-2-硝基-2-d-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(w27)的合成
[0278]
向干燥反应试管中加入(3s,4s,5r)-2-硝基-3,4-二乙酰氧基-5-乙酰氧亚甲基吡喃糖-1-烯(63.4mg,0.2mmol)、1-甲基-3-d-吲哚(57.6mg,0.44mmol)、ms分子筛(100mg)加入0.4ml 2,2,2-三氟乙醇-d3,于室温下反应2~8h,将反应液减压浓缩,所得粗产品经硅胶柱层析纯化(洗脱剂为正己烷/丙酮=8:1)得(1r,2r,3r,4s,5r)-2-硝基-2-d-1,3-二(1-甲基-3-吲哚基)-4-乙酰氧基-5-乙酰氧亚甲基吡喃糖(65.5mg,产率62%)。
[0279]
反应方程式为:
[0280][0281]
将所得产物在核磁共振仪上进行测定,得到的核磁共振数据为:
[0282]1h nmr(400mhz,cdcl3)δ)7.83(d,j=7.9hz,2h).,7.48(s,1h),7.40
–
7.24(m,4h),7.21(t,j=7.1hz,2h),7.07(s,1h),6.27(d,j=5.6hz,1h),5.65(dd,j=12.5,6.3hz,0.38h),5.28(t,j=10.2hz,1h),4.52
–
4.39(m,1h),4.21(dd,j=12.3,5.4hz,1h),3.97(dd,j=12.3,2.3hz,1h),3.92-3.88(m,1h),3.87(s,3h),3.77(s,3h),1.98(s,3h),1.64(s,3h);
13
c nmr(101mhz,cdcl3)δ170.8,169.2,136.9,136.8,127.8,127.7,127.6,122.7,122.1,120.0,119.9,119.3,118.9,109.6,109.4,105.9,86.2,72.0,71.0,71.0,69.8,62.6,37.7,33.2,33.0,29.7,20.8,20.0;hrms(esi)calcd for c
28h28
dn3nao7[m na]
543.1960,found 543.1959.
[0283]
实施例28活性测试
[0284]
盐酸阿霉素(dox)浓度为10μm,其余化合物(w1-w27)浓度为20μm,用cck-8法对以下癌细胞或肿瘤细胞(786-o人肾透明细胞腺癌细胞、mkn-45人胃癌细胞、a549人肺癌细胞、hct116人结肠癌细胞、5637人膀胱癌细胞、gbc-sd人胆囊癌细胞、hepg2人肝癌细胞、du145人前列腺癌细胞、mcf7人乳腺癌细胞、a-673人横纹肌肉瘤细胞、sf126人脑瘤细胞、cal-62
人甲状腺癌细胞、a-375人恶性黑色素瘤细胞)进行细胞毒活性测试。结果如图1所示,化合物w19,w20,w22对不同的癌细胞或肿瘤细胞具有较广泛的活性。
[0285]
此外,参考图2所示,化合物w23和w25在浓度为50μm时具有较好的抗帕金森活性,和模型组相比具有显著提高mpp
损伤的shsy5y细胞拯救活性。化合物w3和w25在1μm的时候,表现出显著的活性。
[0286]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。