用于治疗显性肝性脑病的利福昔明的固体分散体
1.相关申请
2.本技术要求2020年3月24日提交的美国临时申请号62/994,013和2021年3月9日提交的美国临时申请号63/158,784的优先权,所述临时申请各自的全部内容以引用的方式并入本文。
背景技术:
3.肝病的发病率正在上升,并将继续成为主要的健康负担。酒精是肝病的主要原因,但作为非酒精性脂肪酸肝病的原因的代谢综合征可能很快超过作为cld的主要原因的酒精。至少在美国,肝硬化是大部分慢性肝病(cld)的主要原因,并且是cld相关死亡的首要原因,并且肝硬化和cld组合起来是美国第11大死亡原因。使用来自全国住院患者样本(nis)数据库从1998年到2006年的数据,来自肝硬化并发症的死亡率对于腹水、肝性脑病(he)、静脉曲张出血和肝肾综合征(hrs)分别估计为大约8%、18%、10%和45%。参见例如,mol pharm.2011;8:1573
–
1581。类似地,其它研究已经证明,患有自发性细菌性腹膜炎(sbp)的患者的住院死亡率范围为10%-50%。参见例如,hepatology,1993年2月;17(2):251-7;j hepatol,2004年5月;40(5):823-30。
4.肝硬化及其并发症的管理是基于疾病严重程度以及是否出现并发症(即,失代偿性疾病)。食管静脉曲张破裂出血(evb)、腹水、自发性细菌性腹膜炎(sbp)、he或肝肾综合征(hrs)的发展对预后具有深远影响。尽管用于evb、腹水、sbp和he的当前药物治疗,但发展这些并发症中的一种的代偿性疾病患者的五年存活率为20%至50%(gastroenterology 1987;93:234
–
241;gastroenterology.1997;112:463
–
472)。发展sbp或hrs的患者的存活率特别差。对于sbp,不到一半将存活1年;i型hrs患者的中值存活率少于2周(gastroenterology.1993;104:1133
–
8;gastroenterology 1993;105:229
–
236)。sbp组中30天和3个月死亡率分别为26.1%和50.7%,hrs的30天死亡率为46.72%。
5.鉴于肝病和相关疾患的持续增加,在所述领域中对新疗法和治疗方法存在需求。
技术实现要素:
6.如本文所述,出人意料地发现,具有40mg剂量利福昔明与乳果糖的组合的作为可溶性固体分散体(ssd)的利福昔明立即释放(ir)制剂在治疗患有显性肝性脑病(ohe)的患者方面优于乳果糖。鉴于这些发现,本文描述的本发明提供了例如用于ohe的疗法,包括预防或延迟ohe的发作以及预防或延迟受试者如具有早期失代偿的受试者的肝硬化并发症。
7.作为进一步的实例,本文公开的本发明包括降低ohe的风险、降低ohe的严重程度、减少ohe的持续时间和减少he相关的住院治疗中的一者或多者,包括施用本文所述的至少一种利福昔明ssd组合物。
8.例如,利福昔明ssd ir(40mg)的优势体现在(1)通过肝性脑病分级仪(hegi)评分测量的ohe消退的时间减少(与单独的乳果糖相比);和(2)hegi评分改善的时间减少(与单独的乳果糖相比)。
9.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到ohe症状消退。
10.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
11.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
12.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
13.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
14.在一个实施方案中,本文描述的本发明包括治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种40mg利福昔明ssd ir片剂直到ohe症状消退。
15.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种40mg利福昔明ssd ir片剂持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
16.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂qd持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
17.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂bid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
18.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂tid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
19.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑
病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
20.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
21.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
22.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
23.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
24.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
25.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
26.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
27.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者同时施用乳果糖和至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
28.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
29.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
30.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
31.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
32.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
33.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
34.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
35.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
36.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
37.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
38.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
39.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
40.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
41.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
42.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
43.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种40mg利福昔明ssd ir片
剂直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
44.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种40mg利福昔明ssd ir片剂直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
45.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂qd直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
46.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂qd直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
47.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂bid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
48.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂bid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
49.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂tid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
50.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和40mg利福昔明ssd ir片剂tid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
51.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
52.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
53.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、
或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
54.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到ohe症状消退。
55.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
56.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
57.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
58.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
59.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
60.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
61.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
62.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或
至少三级。
63.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
64.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
65.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
66.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
67.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
68.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
69.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
70.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
71.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
72.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的
80mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
73.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
74.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
75.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
76.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
77.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的40mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
78.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
79.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的80mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
80.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
81.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和每日剂量的呈利福昔明ssd ir片剂剂型的120mg利福昔明直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
82.还公开了治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述
患者施用至少一种利福昔明ssd ir片剂。
83.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)直到ohe症状消退。
84.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
85.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)qd持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
86.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)bid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
87.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)tid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
88.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)直到ohe症状消退。
89.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
90.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)qd持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
91.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)bid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
92.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑
病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)tid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
93.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
94.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
95.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
96.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
97.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
98.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
99.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
100.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
101.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者同时施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
102.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
103.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三
级。
104.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
105.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
106.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
107.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的肝性脑病分级仪(hegi)评分降低至少一级、或至少二级、或至少三级。
108.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
109.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
110.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
111.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
112.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
113.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
114.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
115.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
116.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
117.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
118.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和至少一种利福昔明ssd ir组合物(例如,片剂)直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
119.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
120.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)qd直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
121.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
122.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)bid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
123.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
124.在一个实施方案中,本文描述的本发明包括一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用乳果糖和利福昔明ssd ir组合物(例如,片剂)tid直到所述患者的west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级或从1级降低至0级。
125.如本文所述,出人意料地发现,利福昔明可溶性固体分散体(ssd)制剂可有效预防
肝功能失代偿患者的肝硬化并发症或全因死亡或两者。在一个实施方案中,具有40mg剂量利福昔明的作为可溶性固体分散体(ssd)的利福昔明立即释放(ir)制剂对于全因住院治疗/全因死亡的复合终点在统计学上更有效(研究的主要终点是因任何肝硬化并发症(he、evb、sbp或hrs)的住院治疗。
126.例如,仅酒精引起的亚组中的受试者当用ssd ir 40mg治疗时与安慰剂相比在全因住院治疗/全因死亡的时间方面具有统计上显著的差异。conn评分为0的受试者对于任何利福昔明ssd治疗对比安慰剂的总体治疗比较和主要有利于ir 40mg制剂两者表现出统计学上显著的差异。对符合方案(pp)群体的敏感性分析的结果证明长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间的统计上显著的差异,与安慰剂相比其有利于具有80mg剂量利福昔明的作为可溶性固体分散体(ssd)的延长释放(ser)制剂。仅酒精引起的亚组中的受试者当用利福昔明ser 80mg qhs治疗时与安慰剂相比在全因住院治疗/全因死亡的时间方面具有统计上显著的差异。
127.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂)。
128.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
129.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
130.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
131.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂)。
132.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
133.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
134.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔
明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
135.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂)。
136.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
137.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
138.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
139.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂)。
140.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
141.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
142.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
143.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂)。
144.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
145.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
146.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
147.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂)。
148.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
149.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
150.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
151.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂)。
152.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
153.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
154.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
155.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂)。
156.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
157.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
158.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、肝性脑病(he)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
159.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
160.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、肝性脑病(he)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
161.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂)。
162.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
163.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
164.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细
菌性腹膜炎(sbp)、肝性脑病(he)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
165.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
166.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中的肝硬化并发症和全因死亡的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
167.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂)。
168.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
169.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
170.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
171.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
172.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
173.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂)。
174.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
175.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
176.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
177.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
178.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
179.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂)。
180.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水。
181.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
182.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
183.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一
种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
184.在一个实施方案中,本文描述的本发明包括一种预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的方法,所述方法包括向所述患者施用至少一种(例如,一种)80mg利福昔明ssd ser组合物(例如,片剂),其中所述患者具有记录的医学上控制的非难治性腹水,并且其中所述患者在治疗前先前未经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)、肝性脑病(he)或肝肾综合征(hrs)。
185.在涉及预防患有肝功能失代偿的患者中的肝硬化并发症或患者中的全因死亡或两者的前述实施方案中,可向所述患者施用利福昔明ssd组合物持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天。
186.在涉及预防患有肝功能失代偿的患者中的肝硬化并发症或患者的全因死亡或两者的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者。
187.在涉及预防患有肝功能失代偿的患者中的肝硬化并发症或患者中的全因死亡或两者的实施方案中,利福昔明ssd组合物可以40mg(例如,一个利福昔明ssd 40mg ir片剂)、80mg(例如,两个利福昔明ssd 40mg ir片剂)或120mg(例如,三个利福昔明ssd 40mg ir片剂)的剂量施用于患者。
188.在涉及预防患有肝功能失代偿的患者中的肝硬化并发症或患者中的全因死亡或两者的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天的时间段。
189.在涉及预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的前述实施方案中,可向所述患者施用利福昔明ssd组合物持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天。
190.在涉及预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者。
191.在涉及预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的实施方案中,利福昔明ssd组合物可以40mg(例如,一个利福昔明ssd 40mg ir片剂)、80mg(例如,两个利福昔明ssd 40mg ir片剂)或120mg(例如,三个利福昔明ssd 40mg ir片剂)的剂量施用于患者。
192.在涉及预防患有肝功能失代偿的患者中与肝硬化并发症相关的住院治疗的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天的时间段。
193.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利
福昔明ssd组合物(例如,片剂)。
194.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂)。
195.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水。
196.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水。
197.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如,片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水持续至少30天的时间段。
198.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如,片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水持续至少30天的时间段。
199.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如片剂),其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
200.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如片剂),其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
201.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利
福昔明ssd组合物(例如片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水,并且其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
202.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水,并且其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
203.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)利福昔明ssd组合物(例如片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水持续至少30天的时间段,并且其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
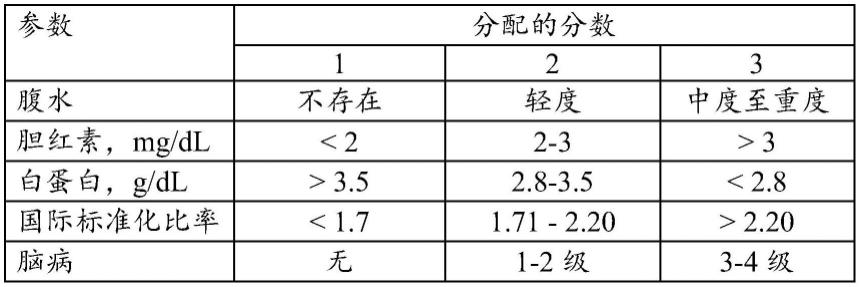
204.在一个实施方案中,本文描述的本发明包括一种延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种(例如,一种)40mg利福昔明ssd ir组合物(例如片剂),其中肝功能失代偿包括肝硬化和医学上控制的腹水持续至少30天的时间段,并且其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分。在一个实施方案中,所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。在一个实施方案中,所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。在一个实施方案中,所述患者具有在治疗前小于2的conn(west haven标准)评分。在一个实施方案中,所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
205.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方
案中,所述患者在治疗前没有表现出认知障碍。
206.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方案中,所述患者不需要穿刺术。
207.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方案中,所述患者在治疗前没有表现出认知障碍并且不需要穿刺术。
208.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方案中,可向所述患者施用利福昔明ssd组合物持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天。
209.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者。
210.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的实施方案中,利福昔明ssd组合物可以40mg(例如,一个利福昔明ssd 40mg ir片剂)、80mg(例如,两个利福昔明ssd 40mg ir片剂)或120mg(例如,三个利福昔明ssd 40mg ir片剂)的剂量施用于患者。
211.在涉及延迟患有肝功能失代偿的患者中显性肝性脑病(ohe)的发作的前述实施方案中,利福昔明ssd组合物可每天一次、两次或三次施用于所述患者持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少至少11天、或至少12天、或至少13天、或至少14天的时间段。
212.在本文所述的实施方案中,其中利福昔明与乳果糖一起施用,所述利福昔明和乳果糖可同时或依序施用于所述患者。
附图说明
213.图1示出使用包含利福昔明固体分散体的制剂,对于itt(意向治疗)群体根据治疗组的因任何肝硬化并发症的住院治疗时间分布的卡普兰-迈耶估计。
214.图2示出使用包含利福昔明固体分散体的制剂,对于itt群体根据治疗组的全因死亡时间分布的卡普兰-迈耶估计。
215.图3示出使用包含利福昔明固体分散体的制剂,对于itt群体根据治疗组的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰-迈耶估计。
216.图4示出使用包含利福昔明固体分散体的制剂,对于pp(符合方案)群体根据治疗组的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰-迈耶估计。
217.图5示出展示根据肝性脑病分级仪(hegi)的显性肝性脑病(ohe)消退的时间的表。
218.图6示出显示ohe研究中治疗突发不良事件的表。
219.图7示出用于评价利福昔明ssd-40ir用于延迟晚期肝硬化受试者中早期脑病失代偿的功效和安全性的研究设计
具体实施方式
220.本文提供了包含利福昔明和乙酸琥珀酸羟丙基甲基纤维素(hpmc-as)的固体分散体以及使用所述固体分散体治疗显性肝性脑病(ohe)的方法。
221.定义
222.术语“固体分散体”或如本文所用是指呈固体形式的利福昔明和惰性载体基质的分散体,即利福昔明与惰性载体同源混合。惰性基质通常是亲水性的(例如聚合物,如hpmc-as)并且可以是结晶的或非晶的。应当了解,支配固体分散体的性质的不一定是制备方法,而是分散体内容物的分子排列。因此,如果没有这样做的表述,或者没有结合工艺限制,固体分散体将不受其制造工艺的限制。术语“固体分散体”、“可溶性固体分散体”和缩写“sd”或“ssd”可互换使用并且各自是指所公开的利福昔明固体分散体。
223.如本文所用,术语“受试者”和“患者”可互换使用,并且意指需要治疗的哺乳动物,例如,伴侣动物(例如,狗、猫等)、农场动物(例如,牛、猪、马、绵羊、山羊等)和实验室动物(例如,大鼠、小鼠、豚鼠等)。通常,受试者是需要治疗的人。
224.措辞“治疗有效量”是指在向受试者单剂量或多剂量施用后有效地向受试者提供治疗益处的包含利福昔明固体分散体的组合物的量。
[0225]“肝性脑病”或简写的“he”被定义为被诊断为he的精神状态改变,并被定义为conn评分增加至≥2级(即,0或1至≥2)。根据与其相关的症状的严重程度,he可被视为“隐性”或“显性”he(分别che或ohe)。he可被描述为由west haven标准(whc)表示的连续体:0级
–
轻微肝性脑病,其症状可能包括复杂和持续注意力受损,或未检测到人格或行为异常;1级(che)
–
症状包括轻微缺乏意识、欣快或焦虑、注意力持续时间缩短、加减法障碍以及睡眠节律改变,其中临床发现包括轻微扑翼样震颤或震颤;2级(ohe)
–
症状包括嗜睡或冷漠、时间迷惑、明显的人格改变和不当行为,其中临床发现包括明显的扑翼样震颤、运动障碍和口齿不清;3级(ohe)
–
症状包括嗜睡至半昏迷状态、对刺激有反应、意识模糊、严重定向障碍和奇怪行为,其中临床发现包括肌肉强直、阵挛和反射亢进;和4级(ohe)
–
症状包括昏迷,其中临床发现包括去大脑姿势。ohe也可在肝性脑病分级仪(hegi)上观察,所述仪器使用临床发现(存在至少1小时)来测量患者的定向障碍,并且由此测量he发作的严重程度(根据2级至4级的量表)
–
4级是最严重,并且2级是最不严重。在一个方面,如本文所述的方法中提及的ohe是指2或更高的conn评分,例如2级、3级或4级。
[0226]“食管静脉曲张出血”或简称“evb”被定义为发生临床上显著的胃肠道出血,其被定义为1)内窥镜检查时因食管或胃静脉曲张所致的出血或2)在胃内存在明显的大静脉曲张和血液,并且在内窥镜检查期间没有观察到其它可鉴定的出血原因,并且存在以下标准中的至少一项或多项:i)在入院后的前48小时内血红蛋白下降大于2g/dl,ii)在入院后24小时内2单位血液或更多的输注需求,iii)收缩压低于100mm hg,或iv)在入院时脉率大于100次/min。
[0227]“自发性细菌性腹膜炎或简写的“sbp”被定义为大于250多形核(pmn)细胞/mm3和/或腹水中阳性单微生物培养物。
[0228]“肝肾综合征”(hrs)被定义为i)血清肌酐逐渐升高(>1.5mg/dl),停用利尿剂和白蛋白扩容至少2天后没有改善,ii)不存在实质肾脏疾病,iii)少尿,iv)不存在休克,和v)目前或近期(随机分组前3个月内)未用肾毒性药物治疗。
[0229]“发展医学上难治性腹水的时间”被定义为不再能够通过以下方式有效控制的腹水:i)低钠饮食和最大剂量的利尿剂(每天高达400mg螺内酯和160mg速尿),或ii)利尿剂,由于无法耐受最大剂量利尿剂的副作用。
[0230]
出于本技术的目的,“肝硬化(cirrhosis of the liver)”或“肝硬化(cirrhosis)”是指受试者的肝脏有疤痕和永久性损伤的疾患。可根据本领域已知的方法和/或由医疗专业人员诊断肝硬化。在一个方面,肝硬化可通过肝硬化的组织病理学证据、瞬时弹性成像、食管静脉曲张的存在和以患有慢性肝病的患者中血小板水平低于150,000为特征的血小板减少症中的一者或多者来确定。肝硬化的严重程度也可通过本领域已知的方法和/或由医疗专业人员来表征。在一个方面,肝硬化的严重程度通过child-pugh评分进行表征。
…
[0231]
child-pugh评分系统(也称为child-pugh-turcotte评分)是指如下所列的child-pugh肝病严重程度分类系统。所述分类系统根据腹水程度(通过临床评估)、血清胆红素和白蛋白浓度、国际标准化比率(inr)和脑病程度来确定肝病的严重程度。使用上文提供的conn评分系统将脑病分类为0-4级。总分5-6被认为是a级(补偿良好的疾病);7-9为b级(显著功能受损);并且10-15为c级(失代偿性疾病)。
[0232][0233]
肝硬化并发症是指由基础疾病肝硬化引起的一种或多种医学问题。在一个方面,并发症包括静脉曲张、脾肿大、黄疸、食管静脉曲张出血(evb)、门静脉高压、腹水、水肿、肝性脑病(he)、肝肺动脉高压、肝细胞癌、肝肾综合征(hrs)、自发性细菌性腹膜炎(sbp)和凝血障碍。在一个方面,肝硬化的并发症包括肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一种或多种。
[0234]
终末期肝病模型(meld)评分是指用于评估慢性肝病的严重程度的评分系统。如本文所用,meld评分使用下式计算:(0.957*ln(血清cr mg/dl) 0.378*ln(血清胆红素mg/dl) 1.120*ln(inr) 0.643)*10。meld-na评分将使用下式计算:meld-na-[0.025xmeld x(140-na)] 140。
[0235]
简易精神状态检查(mmse)在本领域中是已知的并且是指定量评估认知障碍的严重性并记录随时间推移发生的认知变化的简短筛查测试。它包括测试认知功能、定向、注意力、记忆(即时和短期回忆)、语言以及遵循简单口头和书面命令的能力的11个问题。参见例如,cullum等人,mini-mental state examination(mmse)for the detection of alzheimer’s disease and other dementias in people with mild cognitive impairment(mci).cochrane database of systematic reviews 2015,第3期.产品型号:cd010783.doi:10.1002/14651858.cd010783.pub2。
[0236]
失代偿期肝硬化(decompensated cirrhosis)或失代偿期肝硬化(decompensated liver cirrhosis)是肝硬化的晚期状态,并且通常是指肝硬化患者中的肝功能急性恶化。失代偿期肝硬化的特征可在于黄疸、腹水、肝性脑病、肝肾综合征或静脉曲张出血中的一种
或多种。在一个方面,早期失代偿性肝硬化是指被诊断患有晚期肝硬化并且具有医学上控制的腹水(》30天),不需要穿刺术(如果没有先前静脉曲张出血史,则允许进行预防性静脉曲张套扎)的受试者。
[0237]
术语“治疗(treatment)”、“治疗(treat)”和“治疗(treating)”是指逆转、减轻如本文所述的疾病或病症或其一种或多种症状、降低发展如本文所述的疾病或病症或其一种或多种症状的可能性或抑制如本文所述的疾病或病症或其一种或多种症状的进展。在一些实施方案中,治疗可在一种或多种症状已经发展之后施用,即治疗性治疗。在其它实施方案中,治疗可在没有症状的情况下施用。例如,可在症状发作之前向易感个体施用治疗(例如,根据症状史和/或根据遗传因素或其它易感性因素),即预防性治疗以预防如本文所述的疾病或病症或其一种或多种症状的发生。治疗也可在症状已经消退之后继续进行,例如,以预防或延迟其复发。
[0238]
如本文所用,当数值被术语“约”修饰时,准确的数值也被认为是公开的。
[0239]
组合物
[0240]
在第一实施方案中,本公开提供了一者包含利福昔明和hpmc-as的固体分散体。
[0241]
在第二实施方案中,本公开提供了一种包含利福昔明和hpmc-as的固体分散体,其中所述hpmc-as以约10wt%至约60wt%、约10wt%至约50wt%、约10wt%至约40wt%、约12wt%至约38wt%、约15wt%至约35wt%、约16wt%至约34wt%、约30wt%至约40wt%、约30wt%至约35wt%、约33wt%至约35wt%、约32wt%、约33wt%、约34wt%、约35wt%、约10wt%至约20wt%、约13wt%至约18wt%、约16wt%至约18wt%、约15wt%、约16wt%、约17wt%、约18wt%、约40wt%至约50wt%、约46wt%至约49wt%、约46wt%、约47wt%或约48wt%的量存在。在一个替代方案中,固体分散体中存在的hpmc-as的量是约46wt%至约49wt%、约46wt%、约47wt%、约48wt%、约33wt%至约35wt%、约33wt%、约34wt%、约35wt%、约16wt%至约34wt%、约16wt%至约18wt%、约16wt%、约17wt%或约18wt%。在另一个替代方案中,固体分散体中存在的hpmc-as的量是约46wt%、约47wt%、约48wt%、约33wt%、约34wt%、约35wt%、约16wt%、约17wt%或约18wt%hpmc-as。在另一个替代方案中,固体分散体中存在的hpmc-as的量是约46wt%、约47wt%或约48wt%。
[0242]
在第三实施方案中,固体分散体包含等量的利福昔明和聚合物。因此,例如,固体分散体包含约10wt%至约60wt%、约10wt%至约50wt%、约10wt%至约40wt%、约12wt%至约38wt%、约15wt%至约35wt%、约16wt%至约34wt%、约30wt%至约40wt%、约30wt%至约35wt%、约33wt%至约35wt%、约32wt%、约33wt%、约34wt%、约35wt%、约10wt%至约20wt%、约13wt%至约18wt%、约16wt%至约18wt%、约15wt%、约16wt%、约17wt%、约18wt%、约40wt%至约50wt%、约46wt%至约49wt%、约46wt%、约47wt%或约48wt%利福昔明和hpmc-as。在另一个方面,固体分散体包含约46wt%至约49wt%、约46wt%、约47wt%、约48wt%、约33wt%至约35wt%、约33wt%、约34wt%、约35wt%、约16wt%至约34wt%、约16wt%至约18wt%、约16wt%、约17wt%或约18wt%利福昔明和hmpc-as。在另一个方面,固体分散体包含约46wt%、约47wt%、约48wt%、约33wt%、约34wt%、约35wt%、约16wt%、约17wt%或约18wt%利福昔明和hpmc-as。在另一个方面,固体分散体包含约46wt%、约47wt%或约48wt%利福昔明和hpmc-as。
[0243]
在第四实施方案中,包含利福昔明和hpmc-as的固体分散体还包含泊洛沙姆407
(例如,f-127),其中固体分散体中存在的其余组分和量如第二或第三实施方案中所述。
[0244]
在第五实施方案中,包含利福昔明和hpmc-as的固体分散体还包含约0.5wt%至约7wt%、约0.5wt%至约5wt%、约1wt%至约5wt%、约1wt%至约4wt%、约2wt%至约4wt%、约4wt%至约6wt%、约3wt%至约5wt%、约2wt%至约4wt%、约1wt%至约2wt%、约1wt%、约2wt%、约3wt%、约4wt%、约5wt%、约5.5wt%或约6wt%的量的泊洛沙姆407(例如,f-127),其中固体分散体中存在的其余组分和量如第二、第三或第四实施方案中所述。在一个替代方案中,固体分散体包含约1wt%、约2wt%、约3wt%、约4wt%、约5wt%、约5.5wt%、约5.6wt%、约5.7wt%或约6wt%泊洛沙姆407(例如,f-127),其中固体分散体中存在的其余组分和量如第二、第三或第四实施方案中所述。在另一个替代方案中,利福昔明的固体分散体包含约5wt%、约5.5wt%或约6wt%泊洛沙姆407(例如,f-127),其中固体分散体中存在的其余组分和量如第二、第三或第四实施方案中所述。
[0245]
在第六实施方案中,提供了药物组合物,所述药物组合物包含第一、第二、第三、第四或第五实施方案中任一项所述的固体分散体。
[0246]
在第七实施方案中,提供了药物组合物,所述药物组合物包含第一、第二、第三、第四或第五实施方案中任一项所述的固体分散体以及交联羧甲基纤维素钠(交联羧甲基纤维素钠)。
[0247]
在第八实施方案中,提供了药物组合物,所述药物组合物包含第一、第二、第三、第四或第五实施方案中任一项所述的固体分散体以及基于所述药物组合物中的组分的总量(wt%)约2wt%至约15wt%、约3wt%至约14wt%、约4wt%至约14wt%、约2wt%至约13wt%、约3wt%至约13wt%、约4wt%至约13wt%、约11wt%至约14wt%、约12wt%至约14wt%、约4wt%至约10wt%、约12wt%、约12.5wt%、约13wt%、约13.5wt%、约4wt%至约6wt%、约5wt%、约8%至约10wt%或约9wt%的量的交联羧甲基纤维素钠,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六或第七实施方案中所述。在一个替代方案中,交联羧甲基纤维素钠基于所述药物组合物中的组分的总量(wt%)以约4wt%至约14wt%、约12wt%至约14wt%、约13wt%、约4wt%至约6wt%、约5wt%、约8%至约10wt%或约9wt%的量存在,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六或第七实施方案中所述。在另一个替代方案中,交联羧甲基纤维素钠基于所述药物组合物中的组分的总量(wt%)以约13wt%、约5wt%或约9wt%的量存在,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六或第七实施方案中所述。
[0248]
在第九实施方案中,本文所述的药物组合物还包含微晶纤维素,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七或第八实施方案中所述。
[0249]
在第十实施方案中,本文所述的药物组合物还包含基于所述药物组合物中的组分的总量(wt%)以约5wt%至约60wt%、约10wt%至约55wt%、约5wt%至约15wt%、约8wt%至约13wt%、约10wt%至约12wt%、约10wt%至约19wt%、约11wt%、约15wt%至约25wt%、
约17wt%至约19wt%、约18wt%、约40wt%至约60wt%、约45wt%至约55wt%、约49wt%至约55wt%、约49wt%至约51wt%、约53wt%至约55wt%、约50wt%或约54wt%的量存在的微晶纤维素,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七、第八或第九实施方案中所述。
[0250]
在第十一实施方案中,本文所述的药物组合物还包含胶体二氧化硅,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七、第八、第九或第十实施方案中所述。
[0251]
在第十二实施方案中,本文所述的药物组合物还包含基于所述药物组合物中的组分的总量(wt%)以约0.1wt%至约0.3wt%、约0.15wt%至约0.25wt%或约0.2wt%的量存在的胶体二氧化硅,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七、第八、第九、第十或第十一实施方案中所述。
[0252]
在第十三实施方案中,本文所述的药物组合物还包含硬脂酸镁,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一或第十二实施方案中所述。
[0253]
在第十四实施方案中,本文所述的药物组合物还包含基于所述药物组合物中的组分的总量(wt%)以约0.3wt%至约0.6wt%、约0.4wt%至约0.6wt%、约0.45wt%至约0.55wt%、约0.45wt%、约0.47wt%或约0.49wt%的量存在的硬脂酸镁,其中所述药物组合物中存在的其余组分和量包括并且如第二、第三、第四、第五、第六、第七、第八、第九、第十、第十一、第十二或第十三实施方案中所述。
[0254]
在第十五实施方案中,提供了一种药物组合物,所述药物组合物包含约33wt%至约35wt%利福昔明;约33wt%至约35wt%hpmc-as;约3wt%至约5wt%泊洛沙姆407;约4wt%至约14wt%交联羧甲基纤维素钠;约10wt%至约19wt%微晶纤维素;约0.15wt%至约0.25wt%胶体二氧化硅;和约0.45wt%至约0.55wt%硬脂酸镁。
[0255]
在第十六实施方案中,提供了根据第十五实施方案的药物组合物,其中交联羧甲基纤维素钠以约12wt%至约14wt%的量存在。可替代地,提供了根据第十五实施方案的药物组合物,其中交联羧甲基纤维素钠以约13%的量存在。
[0256]
在第十七实施方案中,提供了根据第十五或第十六实施方案的药物组合物,其中微晶纤维素以约10wt%至约12wt%的量存在。可替代地,提供了根据第十五或第十六实施方案的药物组合物,其中微晶纤维素以约11wt%的量存在。
[0257]
在第十八实施方案中,提供了根据第十五实施方案的药物组合物,其中交联羧甲基纤维素钠以约4wt%至约6wt%的量存在。可替代地,提供了根据第十五实施方案的药物组合物,其中交联羧甲基纤维素钠以约5wt%的量存在。
[0258]
在第十九实施方案中,提供了根据第十五或第十八实施方案的药物组合物,其中微晶纤维素以约17wt%至约19wt%的量存在。可替代地,提供了根据第十五或第十八实施方案的药物组合物,其中微晶纤维素以约18wt%的量存在。
[0259]
在第二十实施方案中,提供了根据第十五、第十六、第十七、第十八或第十九实施方案的药物组合物,其中泊洛沙姆407以约4%的量存在。
[0260]
在第二十一实施方案中,提供了根据第十五、第十六、第十七、第十八、第十九或第二十实施方案的药物组合物,其中胶体二氧化硅以约0.20wt%的量存在。
[0261]
在第二十二实施方案中,提供了根据第十五、第十六、第十七、第十八、第十九、第二十或第二十一实施方案的药物组合物,其中硬脂酸镁以约0.50wt%的量存在。
[0262]
在第二十三实施方案中,提供了根据第十五、第十六、第十七、第十八、第十九、第二十、第二十一或第二十二实施方案的药物组合物,其中利福昔明以约34%的量存在。
[0263]
在第二十四实施方案中,提供了根据第十五、第十六、第十七、第十八、第十九、第二十、第二十一、第二十二或第二十三实施方案的药物组合物,其中hpmc-as以约34%的量存在。
[0264]
在第二十五实施方案中,提供了根据第十五、第十六、第十七、第十八、第十九、第二十、第二十一、第二十二、第二十三或第二十四实施方案的药物组合物,其中利福昔明的总量是约80mg。
[0265]
在第二十六实施方案中,提供了一种药物组合物,所述药物组合物包含
[0266]
约16wt%至约18wt%利福昔明;约16wt%至约18wt%hpmc-as;约1wt%至约2wt%泊洛沙姆407;约4wt%至约10wt%交联羧甲基纤维素钠;约49wt%至约55wt%微晶纤维素;约0.15wt%至约0.25wt%胶体二氧化硅;和约0.45wt%至约0.55wt%硬脂酸镁。
[0267]
在第二十七实施方案中,提供了根据第二十六实施方案的药物组合物,其中交联羧甲基纤维素钠以约8wt%至约10wt%的量存在。可替代地,提供了根据第二十六实施方案的药物组合物,其中交联羧甲基纤维素钠以约9wt%的量存在。
[0268]
在第二十八实施方案中,提供了根据第二十六或第二十七实施方案的药物组合物,其中微晶纤维素以约49wt%至约51wt%的量存在。可替代地,提供了根据第二十六或第二十七实施方案的药物组合物,其中微晶纤维素以约51wt%的量存在。
[0269]
在第二十九实施方案中,提供了根据第二十六实施方案的药物组合物,其中交联羧甲基纤维素钠以约4wt%至约6wt%的量存在。可替代地,提供了根据第二十六实施方案的药物组合物,其中交联羧甲基纤维素钠以约5wt%的量存在。
[0270]
在第三十实施方案中,提供了根据第二十六或第二十九实施方案的药物组合物,其中微晶纤维素以约53wt%至约55wt%的量存在。可替代地,提供了根据第二十六或第二十九实施方案的药物组合物,其中微晶纤维素以约54wt%的量存在。
[0271]
在第三十一实施方案中,提供了根据第二十六、第二十七、第二十八、第二十九或第三十实施方案的药物组合物,其中胶体二氧化硅以约0.20wt%的量存在。
[0272]
在第三十二实施方案中,提供了根据第二十六、第二十七、第二十八、第二十九、第三十或第三十一实施方案的药物组合物,其中硬脂酸镁以约0.50wt%的量存在。
[0273]
在第三十三实施方案中,提供了根据第二十六、第二十七、第二十八、第二十九、第三十、第三十一或第三十二实施方案的药物组合物,其中利福昔明以约17wt%的量存在。
[0274]
在第三十四实施方案中,提供了根据第二十六、第二十七、第二十八、第二十九、第三十、第三十一、第三十二或第三十三实施方案的药物组合物,其中hmpc-as以约17wt%的量存在。
[0275]
在第三十五实施方案中,提供了根据第二十六、第二十七、第二十八、第二十九、第三十、第三十一、第三十二、第三十三或第三十四实施方案的药物组合物,其中利福昔明的总量是40mg。
[0276]
在第三十六实施方案中,本文所述的药物组合物呈片剂形式。
[0277]
在第三十七实施方案中,本文所述的药物组合物呈片剂形式,并且是立即释放或持续延长释放。在一个替代方案中,药物组合物是持续延长片剂。
[0278]
在第三十八实施方案中,本文所述的药物组合物是薄膜包衣的。包衣是本领域技术人员已知的并且可包括立即释放或持续释放包衣。薄膜包衣的实例是的opadry ii blue 85f90614。
[0279]
本公开中包括的其它固体分散体和药物组合物在下文的示例部分中描述。
[0280]
用途、制剂和施用剂型
[0281]
本文所述的发明包括通过施用本文所述的一种或多种固体分散体药物组合物治疗肝脏疾病和病症的方法,包括治疗显性肝性脑病(ohe)(例如,预防ohe的发生)的方法和预防患者(如患有早期失代偿的患者)中的肝硬化并发症的方法。
[0282]
在一些实施方案中,本发明包括使用所公开的固体分散体药物组合物来预防例如患有早期失代偿的受试者中的肝硬化并发症的方法。因此,提供了使用所公开的固体分散体药物组合物来延迟肝硬化中的脑病失代偿的方法。
[0283]
在一些实施方案中,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)本文所述的利福昔明ssd组合物(例如,片剂)。根据其它实施方案,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)40mg本文所述的利福昔明ssd ir组合物(例如,片剂)。
[0284]
在一些实施方案中,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)本文所述的利福昔明ssd组合物(例如,片剂),其中所述受试者被表征为患有肝硬化和医学上控制的腹水。
[0285]
在一些实施方案中,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)40mg本文所述的利福昔明ssd ir组合物(例如,片剂),其中所述受试者被表征为患有肝硬化和医学上控制的腹水。
[0286]
在一些实施方案中,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)本文所述的利福昔明ssd组合物(例如,片剂),其中所述受试者被表征为患有肝硬化和医学上控制的腹水持续至少30天的时间段。
[0287]
在一些实施方案中,本文所述的本发明涉及延迟患有肝硬化的受试者中的脑病失代偿,包括施用至少一种(例如,一种)40mg本文所述的利福昔明ssd ir组合物(例如,片剂),其中所述受试者被表征为患有肝硬化和医学上控制的腹水持续至少30天的时间段。在一个方面,前述受试者中的肝硬化通过肝硬化的组织病理学证据、瞬时弹性成像、食管静脉曲张的存在和以患有慢性肝病的患者中血小板水平低于150,000为特征的血小板减少症中的一者或多者来确定。在一个方面,前述受试者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分、在治疗前小于15的终末期肝病-钠模型(meld-na)评分、在治疗前小于2的conn(west haven标准)评分和在治疗前至少25的简易精神状态检查(mmse)评分中的一者或多者。在一些实施方案中,前述受试者在治疗前没有表现出认知障碍。在一个方面,前述受试者不需要穿刺术。在一个方面,前述受试者具有2或更高,例如2、3或4的conn评分。
[0288]
本文还提供了使用固体分散体及其药物组合物来预防例如也可能患有早期失代偿的肝硬化受试者中的全因死亡的方法。
[0289]
本文还提供了使用固体分散体及其药物组合物来减少与肝病并发症(例如,肝硬化并发症)相关的住院治疗的时间的方法,如例如减少因肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一者或多者住院治疗的时间。
[0290]
本文还提供了使用固体分散体及其药物组合物来预防与肝病并发症(例如,肝硬化并发症)相关的住院治疗的方法,如例如减少因肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一者或多者住院治疗的时间。
[0291]
本文还提供了使用固体分散体及其药物组合物来减少与肝病并发症(例如,肝硬化并发症)相关的全因死亡的时间的方法,如例如减少因肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一者或多者全因死亡的时间。
[0292]
本文还提供了使用固体分散体及其药物组合物来预防与肝病并发症(例如,肝硬化并发症)相关的全因死亡的方法,如例如减少因肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一者或多者全因死亡的时间。
[0293]
进一步提供了使用固体分散体及其药物组合物来减少例如患有早期失代偿性肝硬化或肝硬化并发症如he、evb、sbp或hrs的受试者中发展难治性腹水的时间的方法。
[0294]
可与本文的固体分散体和组合物一起使用的合适剂型包括但不限于胶囊、片剂、微型片剂、珠粒、小珠、丸剂、颗粒剂、颗粒和粉末。可对合适的剂型进行包衣,例如使用肠溶包衣。在一些实施方案中,固体分散体和组合物被配制为片剂、囊片或胶囊。在一个实施方案中,固体分散体和组合物被配制成片剂。
[0295]
所提供的化合物可被配制成使得可向接受这些组合物的患者施用剂量介于0.001-100mg/kg体重/天之间的抑制剂。还应了解,用于任何特定患者的具体剂量和治疗方案将取决于多种因素,包括年龄、体重、一般健康状况、性别、饮食、施用时间、排泄率、药物组合、治疗医师的判断以及所治疗的特定疾病的严重程度。
[0296]
组合物中所提供的分散体的量还将取决于组合物中的特定化合物。在一个方面,所提供的组合物中利福昔明的剂量是40mg。在另一个方面,所提供的组合物中利福昔明的剂量是80mg。
[0297]
在一个实施方案中,可溶性固体分散体片剂将包含约40mg的量的利福昔明并且将是立即释放片剂。例如,在一些实施方案中,患者可通过施用含有40mg利福昔明的两片片剂来接受80mg剂量的利福昔明。
[0298]
在一些实施方案中,本文所述的利福昔明组合物可与乳果糖组合,并且除乳果糖之外利福昔明组合物可根据前述方法施用于有需要的患者。乳果糖是不可吸收的二糖,不受本发明任一种理论限制,它可抑制肠氨产生并且乳果糖向乳酸和乙酸的转化导致肠腔的酸化。在一个实施方案中,乳果糖(与本文所述的利福昔明组合物一起)可每1至2小时以约25ml(16.7g)口服糖浆的剂量施用于患者。在一个实施方案中,乳果糖(与本文所述的利福昔明组合物一起)可每天以提供约2至3次软排便的剂量施用于患者,其可以是每天2至4次约10g至30g(15ml至45ml)。在一个实施方案中,乳果糖(与本文所述的利福昔明组合物)可每天三次以约2至3汤匙(30ml至45ml,含有20g至30g乳果糖)的口服剂量施用于患者,并且根据需要调整剂量以每天产生2至3次软便。在一些实施方案中,乳果糖(与本文所述的利福昔明组合物)可根据前述剂量无限期地施用于患有复发性或持续性肝性脑病的患者。在一些实施方案中,如果患者处于昏迷状态,乳果糖(与本文所述的利福昔明组合物一起)可在
1l水中以约300ml的剂量在6至8小时内(经鼻胃或直肠)施用于患者直到所述患者清醒到足以开始口服疗法。
[0299]
实施例
[0300]
实施例1.固体分散体的制备及其使用方法
[0301]
固体分散体的一般制备
[0302]
本文所述的固体分散体可通过多种方法制备,包括通过熔融和溶剂蒸发。本文所述的固体分散体也可根据以下中所述的程序制备:chiou wl,riegelman s:"pharmaceutical applications of solid dispersion systems",j.pharm.sci.1971;60:1281-1302;serajuddin atm:"solid dispersion of poorly water-soluble drugs:early promises,subsequent problems,and recent breakthroughs",j.pharm.sci.1999;88:1058-1066;leuner c,dressman j:"improving drug solubility for oral delivery using solid dispersions",eur.j.pharm.biopharm.2000;50:47-60;以及vasconcelos t,sarmento b,costa p:"solid dispersions as strategy to improve oral bioavailability of poor water soluble drugs",drug discovery today 2007;12:1068-1075,所述文献全部以引用的方式整体并入本文。
[0303]
在一个方面,将组分(例如,利福昔明、聚合物和甲醇)混合,然后喷雾干燥。示例性条件总结在以下表1中。
[0304]
示例性喷雾干燥工艺参数包括例如:
[0305]
·
喷雾干燥器
–
例如,psd 1;
[0306]
·
单流体或多流体喷嘴:例如,双流体niro喷嘴;
[0307]
·
喷嘴孔口
–
0.1
–
10mm;
[0308]
·
进气温度
–
75℃-150℃
±
5℃;
[0309]
·
工艺气体流量(mmh2o)
–
20
–
70,优选44;
[0310]
·
雾化气体压力
–
0.7-1巴;
[0311]
·
进料速率
–
2-7kg/hr;
[0312]
·
出口温度
–
30℃
–
70℃
±
3℃;
[0313]
·
溶液温度
–
20℃
–
50℃;和
[0314]
喷雾干燥后在20-60℃真空干燥约2与72小时之间。
[0315]
表1:
[0316][0317]
(a):利福昔明与hpmc-as的近似比率,按重量计。
[0318]
(b):流动速率在30%泵下估计。
[0319]
表2中提供了代表性批次配方。
[0320]
表2:
[0321][0322]a在干燥过程中除去;用于干燥和雾化的工艺气体;未并入产品中
[0323]
掺混/包封程序
[0324]
以下表3中证明80mg和40mg立即和持续延长释放片剂的组分和组成。
[0325]
表3:
[0326][0327][0328]
临床数据
[0329]
使用表3中描述的组合物获得以下数据。
[0330]
进行了利福昔明ssd片剂在患有早期失代偿性肝硬化的受试者中的功效(预防患有早期失代偿的受试者中因肝硬化并发症住院治疗或全因死亡)和安全性的2期、随机分组、双盲、安慰剂对照的平行多中心研究评价。具有记录的腹水且之前没有经历过sbp、evb或hrs的受试者被纳入研究。受试者完成了1至21天的筛选期、24周的治疗期和2周的随访期。大约420名成功完成筛选期的受试者以1:1:1:1:1:1分配随机分组到6个治疗组中的1个并进入治疗期。所有治疗在睡前每天施用一次。在第1天(基线)、第2、4、8、12、16、20和24周(治疗结束[eot])的门诊访视期间进行功效和安全性评估。所有受试者在第26周(或提前终止,如果适用)完成研究结束(eos)访视以进行最终安全性评估。
[0331]
纳入标准
[0332]
如果受试者他/她满足所有以下标准,则他/她有资格被纳入此研究中:
[0333]
1.受试者≥18岁。
[0334]
2.受试者是男性或女性。
[0335]
具有生育(生殖)潜力的女性必须在筛选时具有阴性血清妊娠试验,并且必须同意在参与研究的整个过程中使用可接受的避孕方法。可接受的避孕方法包括双重屏障方法(带杀精子软膏的避孕套或带杀精剂的隔膜)、激素方法(例如,口服避孕药、贴片或醋酸甲羟孕酮)或记录的失败率低于1%每年的宫内节育器(iud)。根据研究者的判断,禁欲或伴侣输精管切除术可被视为可接受的避孕方法。注意:接受过手术绝育(例如,子宫切除术或双侧输卵管结扎术)或绝经后(完全停止月经>1年)的女性不被视为“具有生育潜力的女性”。
[0336]
3.受试者通过影像学检查或体格检查具有肝硬化和记录的腹水诊断(注意:研究中允许具有1级腹水的受试者),但尚未经历任何以下肝硬化并发症:
[0337]
·
evb-临床上显著的胃肠道出血
[0338]
·
sbp-大于250多形核(pmn)细胞/mm3和/或腹水中阳性单微生物培养物
[0339]
·
在腹水存在下的肾衰竭-血清肌酐升高0.5mg/dl(大于1.5mg/dl),体格检查、影像学记录有腹水,和/或因服用利尿剂治疗腹水而入院
[0340]
·
医学难治性腹水的发展。
[0341]
4.受试者的meld评分≥12,meldna评分≥12,或child-pugh b分类(评分=7-9)。
[0342]
5.受试者能够理解研究的要求,并愿意遵守所有研究程序。
[0343]
6.受试者理解知情同意书的语言,并且能够并愿意签署知情同意书。
[0344]
7.如果适用,受试者具有可对受试者提供持续监督并在试验进行期间可供受试者所用的亲密家庭成员或其它个人联系人。
[0345]
排除标准
[0346]
如果适用任何以下标准,则受试者没有资格纳入此研究:
[0347]
1.受试者在签署知情同意书之前的过去24个月内具有研究者认为将妨碍研究的完成、干扰研究结果的分析或对受试者参与研究产生负面影响的严重精神障碍病史,包括不受控制的重度抑郁症或受控制或不受控制的精神病(精神障碍诊断和统计手册,第4版)。
[0348]
2.受试者在签署知情同意书之前的过去3个月内具有酗酒或药物滥用史(精神障碍诊断和统计手册,第4版)。
[0349]
3.受试者具有记录的原发性硬化性胆管炎(注意:研究中允许患有原发性胆汁性肝硬化的受试者)。
[0350]
4.受试者在筛选后2周内进行了预防性静脉曲张套扎或计划在研究期间进行预防性静脉曲张套扎(注意:具有先前预防性静脉曲张套扎的受试者被允许参加研究)。
[0351]
5.受试者已被诊断患有感染,针对所述感染他们目前正在服用口服或胃肠外抗生素。
[0352]
6.受试者具有显著血容量不足,或任何可能影响精神功能的电解质异常(例如,血清钠<125meq/l,血清钙>10mg/dl)。
[0353]
7.受试者患有如通过血清钾浓度<2.5meq/l定义的严重低钾血症。
[0354]
8.受试者贫血,如通过血红蛋白浓度≤8g/dl所定义。
[0355]
9.受试者患有肾功能不全,肌酐≥1.5mg/dl。
[0356]
注意:与纳入/排除标准相关的实验室测试可重复一次,然后根据研究者的判断将受试者视为筛选失败(鉴于所有其它纳入/排除标准分别是满足/不满足)。
[0357]
10.受试者显示存在肠梗阻或患有炎性肠病。
[0358]
11.受试者患有研究者认为控制不佳的1型或2型糖尿病,或在筛选前的过去3个月内或筛选访视时hba1c>12%。
[0359]
12.受试者具有癫痫发作病症病史。
[0360]
13.受试者患有按病情恶化分类的需要在随机分组后30天内改变治疗或医疗护理的不稳定心血管或肺部疾病。
[0361]
14.受试者在过去5年内患有活动性恶性肿瘤(例外:皮肤基底细胞癌,或者如果是女性,则为已手术切除的原位宫颈癌)。
[0362]
15.受试者患有肝细胞癌(hcc)。注意:甲胎蛋白(afp)浓度在筛选时进行测量。如果afp大于200ng/ml,则受试者被排除在研究之外。如果afp高于正常上限且≤200ng/ml,必须使用横截面成像或超声检查技术来排除hcc。
[0363]
16.受试者具有对受试者产生不利影响或可能导致不依从治疗或访视、可能影响临床数据的解释或可能以其它方式限制受试者参与研究的任何疾患或情况。
[0364]
17.如果是女性,受试者怀孕或有怀孕风险,或正在哺乳。
[0365]
18.随机分组后6周内已知的水痘、带状疱疹或其它严重病毒感染。
[0366]
19.已知的人免疫缺陷病毒(hiv)感染。
[0367]
20.受试者对小肠结肠炎耶尔森菌、空肠弯曲杆菌、沙门氏菌属、志贺氏菌属、卵子和寄生虫和/或艰难梭菌的粪便测试呈阳性。
[0368]
注意:粪便测试结果必须在随机分组之前确认为阴性。
[0369]
21.受试者具有结核病感染史和/或曾因肺结核感染接受治疗。如果受试者之前的结核抗原皮试呈阳性,则他们目前的阴性胸部x射线才有资格,并且不能接受先前治疗。
[0370]
22.受试者是直接参与此研究的管理、施用或支持的站点员工,或者是其直系亲属。
[0371]
23.受试者对利福昔明、利福平、利福霉素抗微生物剂或利福昔明ssd的任何组分有超敏史。
[0372]
24.受试者在随机分组前30天内使用了任何研究产品或设备,或参加了另一项研究。
[0373]
25.受试者具有记录的显性he发作(conn评分≥2),但在访视1(筛选)后30天内未
消退。
[0374]
施用的治疗
[0375]
存在如下所列的6个治疗组。组成组分在上面的表3中给出。所有治疗都是口服施用qhs(在每次睡前)。治疗持续时间是24周。
[0376]
治疗a:利福昔明ssd 40mg qhs(ir(立即释放)片剂)
[0377]
治疗b:利福昔明ssd 80mg qhs(ir片剂)
[0378]
治疗c:利福昔明ssd 40mg qhs(ser(持续延长释放)片剂)
[0379]
治疗d:利福昔明ssd 80mg qhs(ser片剂)
[0380]
治疗e:利福昔明ssd 80mg qhs(ir片剂) 利福昔明80mg qhs(ser片剂)
[0381]
治疗f:安慰剂qhs
[0382]
主要功效终点
[0383]
在24周治疗期内,研究的主要功效终点是:
[0384]
·
全因死亡的时间,或
[0385]
·
与以下肝病并发症之一相关的住院治疗时间:
[0386]
o he
–
被诊断为he的精神状态改变,并被定义为conn评分增加至≥2级(即,0或1至≥2)。
[0387]
o evb
–
临床上显著的胃肠道出血的发生被定义为:
[0388]
·
内窥镜检查时因食管或胃静脉曲张所致的出血,或
[0389]
·
胃内存在明显的大静脉曲张和血液,并且在内窥镜检查期间没有观察到其它可鉴定的出血原因。
[0390]
·
此外,必须存在以下标准中的一项或多项:
[0391]
·
在入院后前48小时内血红蛋白下降大于2g/dl,
[0392]
·
在入院后24小时内2单位血液或以上的输血需求,
[0393]
·
收缩压低于100mm hg,或
[0394]
·
在入院时脉率大于100次/分钟。
[0395]
注意:baveno iv标准也用于进一步定义静脉曲张出血事件。
[0396]
οsbp-大于250pmn细胞/mm3和/或腹水中阳性单微生物培养物
[0397]
οhrs被定义为:
[0398]
·
血清肌酐逐渐升高(>1.5mg/dl),停用利尿剂和白蛋白扩容至少2天后没有改善;
[0399]
·
不存在实质肾脏疾病;
[0400]
·
少尿;
[0401]
·
不存在休克;和
[0402]
·
目前或近期(随机分组前3个月内)未用肾毒性药物治疗。
[0403]
关键次要功效终点
[0404]
此研究的关键次要功效终点是主要终点的每个单独组成部分的总体住院率或24周治疗期内的全因死亡率。
[0405]
其它次要终点
[0406]
此研究的其它次要终点是以下:
[0407]
·
主要终点的每个单独组成部分的首次住院或全因死亡时间。
[0408]
·
24周治疗期内的全因住院率。
[0409]
·
24周治疗期内的肝硬化死亡率。
[0410]
·
发展医学上难治性腹水的时间,定义为不再能够通过以下方式有效控制的腹水:
[0411]
ο低钠饮食和最大剂量的利尿剂(每天高达400mg螺内酯和160mg速尿),或
[0412]
ο利尿剂,由于无法耐受最大剂量利尿剂的副作用。
[0413]
·
针对所有其它感染的24周治疗期内住院。
[0414]
·
由于不归因于hrs并且由以下证明的肾功能快速下降(少于48小时内)的急性肾损伤(aki)所致的住院治疗:
[0415]
ο血清肌酐升高(血清肌酐绝对升高≥0.3mg/dl(≥26.4μmol/l)或血清肌酐增加百分比≥50%),和
[0416]
ο尿排出量减少(定义为<0.5ml/kg/hr持续超过6小时)。
[0417]
·
第4、8、12、16、20和24周的健康结果指数的变化(慢性肝病问卷(cldq_,胃肠道症状评定量表(gsrs),照顾者负担问卷(cbi),爱泼沃斯嗜睡量表(ess))。
[0418]
·
评估对包括肝损伤、肾损伤和伴随药物的因素的影响的利福昔明和25-去乙酰基利福昔明的药代动力学。
[0419]
·
评估每个受试者的临界闪烁频率(cff)。使用专门的cff仪器评估cff。
[0420]
·
第2、4、8、12、16、20和24周血氨浓度相对于基线的变化。
[0421]
·
在第2、4、8、12、16、20和24周时,meld(终末期肝病模型)和meldna(终末期肝病钠模型)评分相对于基线的变化。
[0422]
·
在第2、4、8、12、16、20和24周,child-pugh评分相对于基线的变化。
[0423]
药物浓度测量值
[0424]
利福昔明和代谢物浓度数据是根据fda工业指南:群体药代动力学中推荐的全群体pk采样设计收集的。
[0425]
受试者的处置
[0426]
共计518名受试者被随机分组在研究中,其中408(78.8%)完成研究:
[0427]
·
40mg qhs ir组中的64名受试者,
[0428]
·
80mg qhs ir组中的63名受试者,
[0429]
·
40mg qhs ser组中的68名受试者,
[0430]
·
40mg qhs ser组中的68名受试者,7
[0431]
·
80mg qhs ser组中的2名受试者,
[0432]
·
组合的ir/ser组中的66名受试者,和
[0433]
·
安慰剂组中的75名受试者。
[0434]
总计109(21.0%)受试者过早中止研究,在80mg qhs ir组中观察到最多数量的中止(30.4%)。研究中报告的过早终止的最常见原因是“受试者退出”;这导致随机分组的所有受试者中44例(8.5%)过早中止。紧随其后的是“死亡”,其导致所有随机分组受试者中21例(4.1%)过早中止。在所有治疗组中,80mg qhs ir组经历了最多数量的过早中止研究(总计28名受试者),其中“受试者退出”被报告为过早中止的最常见原因(n=9)。
[0435]
所分析的数据集
[0436]
分析了两个数据集:itt群体和pp群体。
[0437]
·
itt群体被定义为服用至少1剂研究药物的所有随机分组受试者。
[0438]
·
pp群体被定义为itt群体中的所有受试者,但不满足纳入标准3或4或满足排除标准1的受试者除外。
[0439]
·
安全性群体包括服用至少1剂研究药物的所有随机分组受试者。
[0440]
对itt群体进行基线特征和功效的分析。主要功效分析也作为敏感性分析对pp群体进行。
[0441]
功效分析
[0442]
主要功效终点是与以下肝病并发症之一相关的全因死亡或住院治疗的时间:对itt群体进行24周治疗期内的he、evb、sbp或hrs。
[0443]
针对主要终点指定的任何肝硬化并发症的住院治疗或全因死亡时间的主要分析使用按分析区域分层的对数秩检验(显著性水平为0.05的双侧检验)。
[0444]
还进行了利用对数秩检验的成对治疗组比较(利福昔明ssd组对比安慰剂中的每一个)。
[0445]
此外,使用卡普兰-迈耶方法来估计每个治疗组在第28、56、84、112、140和168天因任何肝硬化并发症经历住院的受试者的比例或全因死亡率。
[0446]
主要功效终点的其它分析包括敏感性分析(使用pp群体的主要功效终点分析)和预设亚组分析。
[0447]
因任何肝硬化并发症的住院治疗或全因死亡的时间
[0448]
主要功效终点是与以下肝病并发症之一相关的全因死亡或住院治疗的时间:24周治疗期内的he、evb、sbp或hrs。因死亡以外的原因提前终止的受试者在随机分组后大约24周被联系,以确定他们是否经历了主要终点。在受试者死亡的情况下,联系受试者的照料者(如果适用)。
[0449]
因任何肝硬化并发症住院治疗或全因死亡的时间被定义为第一剂研究药物日期与因任何肝硬化并发症所致的首次住院治疗或全因死亡日期之间的持续时间。
[0450]
完成整个24周治疗期且未死亡或满足he、evb、sbp或hrs的肝硬化并发症定义的受试者在最后一次访视日期(最后一次接触日期)进行审查。在24周治疗期结束前因死亡以外的原因提前中止的受试者每月通过随访电话联系,以获取肝硬化并发症、住院治疗或死亡信息。未满足主要终点的受试者在最后一次联系日期进行审查。
[0451]
主要功效分析
[0452]
主要分析未显示任何组中长达24周的因任何肝硬化并发症住院治疗或全因死亡时间的总体统计学显著差异。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(分层对数秩p=0.8062)(表4)。图1示出对于itt群体根据治疗组的因任何肝硬化并发症的住院治疗时间分布的卡普兰-迈耶估计。基于卡普兰-迈耶估计,ser 80mg qhs治疗组在所有治疗组中呈现最高存活率,并且组合ir/ser治疗组具有最低存活率;然而,这种影响不是统计上显著的(对数秩p=0.2262)。图2示出对于itt群体根据治疗组的全因死亡时间分布的卡普兰-迈耶估计。基于卡普兰-迈耶估计,安慰剂组呈现最高存活率,随后是ser 80mg qhs治疗组,并且组合ir/ser治疗组具有最低存活率;然而,这种影响不是统
计上显著的(对数秩p=0.7573)。图3示出对于itt群体根据治疗组的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰-迈耶估计。基于卡普兰-迈耶估计,ser 80mg qhs治疗组呈现最高存活率,并且组合ir/ser治疗组具有最低存活率;这种影响是统计上显著的(对数秩p=0.0420)。
[0453]
基于pp群体的支持性分析
[0454]
基于pp群体的主要功效分析结果与基于itt群体的成对比较不一致(表4)。对pp群体的初步分析证明长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间的统计学显著差异,对比安慰剂组其有利于ser 80mg qhs治疗组(分层对数秩p=0.0464)。在剩余的活性剂治疗组与安慰剂之间没有观察到其它统计上显著的成对比较(表5)。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(分层对数秩p=0.9879)。图4示出对于pp群体根据治疗组的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰-迈耶估计。基于卡普兰-迈耶估计,ser 80mg qhs治疗组呈现最高存活率,并且组合ir/ser治疗组具有最低存活率;这种影响是统计上显著的(对数秩p=0.0182)。
[0455]
表4:长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间
–
itt群体
[0456]
[0457][0458]
ir=立即释放;itt=意欲治疗;qhs=每天睡前一次;ser=持续延长释放;ssd=固体可溶性分散体。
[0459]1在第24周审查的受试者的数量(受试者未经历事件并在第24周参加研究)。
[0460]2p值是使用分层对数秩检验获得的。
[0461]3按分析区域分层(研究中心在2个区域分组,美国中心和俄罗斯中心)
[0462]
表5:长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间
–
pp群体
[0463][0464][0465]
ir=立即释放;itt=意欲治疗;pp=符合方案;qhs=每天睡前一次;ser=持续延
长释放;ssd=固体可溶性分散体。
[0466]1itt群体中的所有受试者,不符合纳入标准3、4或满足排除标准1的受试者除外。
[0467]2在第24周审查的受试者的数量(受试者未经历事件并在第24周参加研究。
[0468]3p值是使用分层对数秩检验获得的。
[0469]4按分析区域分层(研究中心在2个区域分组,美国中心和俄罗斯中心)。
[0470]
主要功效终点的预设亚组分析
[0471]
基线meld类别
[0472]
评价了受试者的基线meld类别对主要功效分析的影响。基线meld亚组分类为meld评分≤10、11至18、19至24或≥25。在任何亚组中,对比安慰剂的成对比较不是统计上显著的。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(meld评分≤10:分层对数秩p=0.8486;meld评分:11至18分层对数秩p=0.7937;meld评分为19至24:分层对数秩p=0.3154;以及meld评分≥25:分层对数秩p=不适用[1名受试者中1个事件])。
[0473]
基线meldna类别
[0474]
评价了受试者的基线meldna类别对主要功效分析的影响。基线meldna亚组分类为meldna评分≤10、11至18、19至24或≥25。在任何亚组中,对比安慰剂的成对比较不是统计上显著的。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(meldna评分≤10:分层对数秩p=0.3200;meldna评分:11至18:分层对数秩p=0.9368;meldna评分为19至24:分层对数秩p=0.2608;以及meldna评分≥25:分层对数秩p=不适用(4名受试者中3个事件))。
[0475]
基线child-pugh分类
[0476]
评价了受试者的基线child-pugh分类对主要功效分析的影响。基线child-pugh分类亚组被分类为a类、b类或c类。对比安慰剂的成对治疗比较在任何亚组中不是统计上显著的。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(a类:分层对数秩p=不适用(零事件);b类:分层对数秩p=0.7942,和c类:分层对数秩p=0.9516)。
[0477]
基线conn评分
[0478]
评价了受试者的基线conn评分对主要功效分析的影响。基线conn评分亚组被分类为0、1或2。表6示出根据基线conn评分的主要功效终点分析。与pp群体的结果一致,在conn评分亚组0中观察到因任何肝硬化并发症的住院治疗或全因死亡时间的统计上显著差异,并且与安慰剂相比有利于ser 80mg qhs治疗组(分层对数秩p=0.0460)。这种统计显著性在conn评分亚组1或2中不明显(尽管亚组2在2名受试者中有1个事件)。
[0479]
任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响对于任何亚组不是统计上显著的(conn评分0:分层对数秩p=0.8915;conn评分1:分层对数秩p=0.8251;conn评分2:不适用[2名受试者中1个事件])。
[0480]
表6:主要功效终点分析:长达24周(第170天)根据基线conn评分的因任何肝硬化并发症的住院治疗或全因死亡时间
–
itt群体
[0481]
[0482]
[0483][0484]
ir=立即释放;itt=意欲治疗;qhs=每天睡前一次;ser=持续延长释放;ssd=固体可溶性分散体。
[0485]1在第24周审查的受试者的数量(受试者未经历事件并在第24周参加研究)。
[0486]2p值是使用分层对数秩检验获得的。
[0487]3按分析区域分层(研究中心在2个区域分组,美国中心和俄罗斯中心)
[0488]
自首次诊断肝硬化以来的时间
[0489]
评价了受试者自首次诊断肝硬化以来的时间对主要功效分析的影响。自首次诊断肝硬化的时间亚组被分类为<947天或≥947天。表7呈现根据自首次诊断肝硬化以来的时
间的主要功效终点分析。在≥947天亚组中观察到因任何肝硬化并发症的住院治疗或全因死亡时间的接近统计上显著的差异,并且与pp和基线conn评分0群体一样,与安慰剂组相比有利于ser 80mg qhs治疗组(分层对数秩p=0.0517)。任何利福昔明ssd治疗对比安慰剂的总体治疗比较影响不是统计上显著的(自首次诊断肝硬化以来的时间:<947天分层对数秩p=0.3961;自首次诊断肝硬化以来的时间:≥947天分层对数秩p=0.5689)。
[0490]
表7:主要功效终点分析:长达24周(第170天)根据分类的自首次诊断肝硬化以来的时间的因任何肝硬化并发症的住院治疗或全因死亡时间
–
itt群体
[0491][0492]
[0493][0494][0495]
ir=立即释放;itt=意欲治疗;qhs=每天睡前一次;ser=持续延长释放;ssd=固体可溶性分散体。
[0496]1在第24周审查的受试者的数量(受试者未经历事件并在第24周参加研究)。
[0497]2p值是使用分层对数秩检验获得的。
[0498]3按分析区域分层(研究中心在2个区域分组,美国中心和俄罗斯中心)。
[0499]
直至第24周(第170天)发展医学生难治性腹水的时间
[0500]
直至第24周(第170天)发展医学生难治性腹水的时间的分析呈现于表8中。
[0501]
观察到直至第24周发展医学上难治性腹水的时间的统计上显著差异与安慰剂相
比有利于ir 40mg qhs治疗组(分层对数秩p=0.0308),并且与安慰剂相比有利于ser 40mg qhs治疗组(分层对数秩p=0.0202)。对比安慰剂的其它成对治疗比较不是统计上显著的。任何利福昔明ssd治疗对比安慰剂的总体治疗比较不是统计上显著的。
[0502]
表8:次要功效终点分析:直到第24周(第170天)发展医学上难治性腹水的时间
–
itt群体
[0503][0504]
ir=立即释放;itt=意欲治疗;qhs=每天睡前一次;ser=持续延长释放;ssd=固体可溶性分散体。
[0505]1在第24周审查的受试者数量(受试者未经历事件并在第24周参加研究)。
[0506]2p值是使用分层对数秩检验获得的。
[0507]3根据分析区域分层(研究中心在2个区域内分组,美国中心和俄罗斯中心)。
[0508]
功效结论
[0509]
基于长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰迈耶估计,统计上显著的效果有利于ser 80mg qhs和组合ir/ser qhs治疗组,分别具有最
高和最低存活率。
[0510]
对pp群体的初步分析未证明长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间的统计学显著差异,对比安慰剂组其有利于ser 80mg qhs治疗组。长达24周的因任何肝硬化并发症的住院治疗或全因死亡时间分布的卡普兰迈耶估计也是统计上显著的,有利于ser 80mg qhs和组合ir/ser qhs治疗组,分别具有最高和最低存活率。
[0511]
在次要分析中,直至第24周发展医学难治性腹水的时间的统计上显著差异与安慰剂相比有利于ir 40mg qhs和ser 40mg qhs治疗组。ess总分相对于基线的变化存在统计上显著效应,在第4周在基线第25个百分位处观察到治疗对比安慰剂效应的统计学意义(p<0.0001),其中ir 40mg qhs治疗组呈现与基线相比的最大下降。
[0512]
这些研究表明,对于主要分析,长达24周的因任何肝硬化并发症住院治疗或全因死亡的总体时间与安慰剂相比有利于ser 80mg qhs治疗组。在次要分析中,统计上显著的有利影响在ir 40mg qhs治疗组中最一致地观察到以及在组合ir/ser qhs和ser 40mg qhs治疗组中的发生。
[0513]
实施例2.利福昔明ssd ir 40mg用于治疗显性肝性脑病的用途
[0514]
如表3中描述的利福昔明ssd在随机分组、双盲、安慰剂对照、剂量范围、多中心研究中进行了研究,以评估利福昔明可溶性固体分散体(ssd)片剂加乳果糖用于治疗显性肝性脑病(ohe)的功效和安全性。
[0515]
此研究的主要目的是评估利福昔明ssd加乳果糖对比安慰剂加乳果糖用于治疗显性肝性脑病(ohe)的功效。乳果糖的成人口服剂量是每天3次,每次2至3汤匙(30至45ml,含20g至30g的乳果糖)。调整剂量以每天或根据pi判断产生2至3次软便。此研究的次要目标是评估利福昔明ssd在ohe受试者中的安全性,并且评估用利福昔明ssd治疗对关键次要终点的影响。主要终点是ohe消退的时间,使用肝性脑病分级仪(hegi)确定。次要终点包括:ohe消退的时间,定义为west haven标准(whc)评分为0或1、whc评分下降1个单位的时间、第14天hegi评分相对于基线的变化或出院时间(随机分组治疗期结束)(以先发生者为准)、hegi评分改善的时间、第14天whc评分相对于基线的变化或出院时间(随机分组治疗期结束)(以先发生者为准)以及从基线到出院的住院治疗长度。
[0516]
结果
[0517]
总计71名受试者完成了试验:利福昔明40mg ir qd组中的15名受试者、利福昔明40mg ir bid组中的15名受试者、80mg ser qd组中的14名受试者、80mg ser bid组中的13名受试者以及pbo组中的14名受试者。人口统计资料和基线特征在所有治疗组之间是类似的。平均年龄是61岁。54%的受试者是男性。70%的受试者以hegi评分2进入试验,30%以hegi评分3进入试验。进入试验时的平均meld评分是21.2。进入试验前六个月中的平均he发作次数是1.2次。
[0518]
主要终点-使用肝性脑病分级仪(hegi)确定的ohe消退的时间。利福昔明bid 40mg组在统计学上显著优于安慰剂组(p=0.0208)。对于利福昔明bid 40mg组,中值消退时间是21.1小时,相比之下对于安慰剂组为62.7小时。对于此组的受试者,受试者在任何给定时间实现消退的概率是安慰剂组受试者的2.91倍。40mg qd组倾向于统计显著性,p值为0.0658。尽管不是统计上显著的,但两个80mg ser组在主要终点方面均表现出相对于pbo的总体数值优势(图5)。
[0519]
次要终点-根据whc在ohe消退的时间方面,利福昔明组与安慰剂组没有统计学上显著的差异,但显示出全面的数值优势。在whc评分下降一个单位的时间方面利福昔明组与安慰剂组没有统计学上显著的差异,但显示出全面的数值优势,尤其是40ir qd组。关于hegi评分变化的时间,利福昔明bid 40mg组在统计学上显著优于安慰剂组(p=0.0379)。在利福昔明bid 40mg组中,hegi评分变化的中值时间是2.0天,相比之下对于安慰剂组为3.0天。对于此组的受试者,受试者在任何给定时间实现hegi评分变化的概率是安慰剂组受试者的1.94倍。未鉴定安全性问题;不良事件和严重ae发生率在治疗组之间是相似的(图6)。
[0520]
结论
[0521]
当与单独的乳果糖相比时,发现含有利福昔明的ssd ir片剂(以每片剂剂量40mg bid递送)与乳果糖组合时治疗患有ohe的患者。事实上,如上所示,如通过hegi所监测,与接受单独的乳果糖的受试者相比,用上述方法治疗的患者实现ohe消退的速率高2.91倍。此外,与接受单独的乳果糖的患者相比,经受这种方法的患者实现hegi评分变化的可能性几乎是两倍(即,1.94倍)。
[0522]
实施例3.利福昔明ssd ir 40mg用于延迟患有肝失代偿的患者的显性肝性脑病(ohe)发作的用途
[0523]
如表3中描述的40mg ssd ir将在3期、随机分组、双盲、安慰剂对照的多中心研究中进行研究,以评估其在由医学上控制的腹水定义的晚期肝硬化中延迟显性肝性脑病失代偿期的首次发作的功效和安全性。通过组织病理学证据、瞬时弹性成像或食管静脉曲张的存在确定患有肝硬化并且以前没有经历过ohe、自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)的受试者将被纳入研究中。受试者将完成28天的筛选期、72周的治疗期和4周的随访期。成功完成筛选期的受试者将进入治疗期,并且将以1:1分配随机分组至如上所述的两个治疗组之一。所有治疗将每天两次(bid)施用。
[0524]
多条临床和实验证据支持利福昔明在预防肝硬化并发症中的用途。例如,并且除了本文描述的证据外,利福昔明于2010年3月被美国fda批准用于降低复发性显性he的风险;显示防止he复发,减少he相关和全因住院治疗,而不会增加不良事件(ae)的发生率或降低存活率(参见例如,conf.proc.ieee eng.med.biol.soc.20132184
–
2187);降低或维持感染、抗生素使用和其它肝硬化并发症(如腹水)的总体发生率(参见conf.proc.ieee eng.med.biol.soc.同上);并且与较高的存活率和较低的发作静脉曲张出血、he、sbp或hrs风险独立相关(参见例如,journal of gastroenterology and hepatology28(3);2012年12月)。
[0525]
受试者群体包括患有肝硬化和医学上控制的腹水且之前未经历过ohe、sbp、evb或hrs发作的≥18岁的男性和非怀孕、非哺乳期女性。
[0526]
功效和安全性评估将在第0周(第1天)、第4、8、12、20、28、36、44、52、60、68和72周(eot)的门诊访视期间以及在第16、24、32、40、48、56和64周的电话期间进行。所有受试者将在第76周完成研究结束(eos)访视,以进行最终安全性评估。如果受试者过早中止治疗,则将尽一切努力获得eot和eos评估。图7示出代表性研究设计。
[0527]
受试者将有资格被纳入此研究,如果他/她满足所有以下标准:
[0528]
1.受试者诊断为晚期肝硬化伴医学上控制的腹水(》30天),不需要穿刺术(如果没有先前静脉曲张出血史,则允许进行预防性静脉曲张套扎)。
[0529]
·
可使用以下任一者进行肝硬化诊断:
[0530]
·
肝硬化的组织病理学证据
[0531]
·
成像(声谱或横截面)
[0532]
·
fibroscan(瞬时弹性成像)
[0533]
·
食管静脉曲张的存在
[0534]
·
cld中血小板减少症(《150,000)
[0535]
2.受试者在没有ohe的情况下具有child-pugh b分类(包括7至9的评分),并且在访视1时终末期肝病-钠模型(meld-na)评分《15。
[0536]
3.受试者的conn(west haven标准)评分《2。
[0537]
4.受试者的简易精神状态检查(mmse)评分≥25,并且在检查时没有表现出认知障碍。
[0538]
5.受试者大于或等于18岁。
[0539]
6.具有生育(生殖)潜力的女性必须在筛选时具有阴性血清或尿液妊娠试验,并且同意在参与研究的整个过程中使用可接受的避孕方法。
[0540]
7.受试者必须能够阅读、理解并提供关于机构审查委员会(irb)/伦理委员会(ec)批准的知情同意书(icf)的书面知情同意,并根据当地隐私法规酌情提供授权。
[0541]
如果适用任何以下标准,则受试者将没有资格纳入此研究:
[0542]
1.受试者对利福昔明、利福平、利福霉素抗微生物剂或利福昔明的任何组分有超敏史。
[0543]
2.受试者具有sbp、原发性或继发性sbp预防、evb或hrs病史。
[0544]
3.受试者具有记录的ohe发作史(conn评分≥2)或具有550mg利福昔明和乳果糖用于疑似ohe发作的病史。
[0545]
4.受试者:a)没有腹水-或-b)具有不受控制的腹水。
[0546]
5.受试者患有可能混淆认知功能的评估的其它不可控制的神经或精神疾患(例如,痴呆、精神分裂症等)。
[0547]
6.受试者在签署icf后6周内具有酒精使用障碍的迹象,定义为audit-10评分》7。
[0548]
7.受试者在签署知情同意书前《6周具有药物滥用史,并且在研究期间不能避免滥用药物。
[0549]
8.受试者在筛选前《4周已被诊断为患有不受控制的感染。
[0550]
9.受试者在筛选前《6周已被诊断为患有因非静脉曲张来源引起的上消化道出血。
[0551]
10.受试者显示存在肠梗阻或患有炎性肠病。
[0552]
11.受试者具有用于门静脉高压症的分流手术或经颈静脉肝内门体静脉分流术(tips)病史。
[0553]
12.受试者在筛选后2周内进行了预防性静脉曲张套扎或计划在研究期间进行预防性静脉曲张套扎(注意:具有先前预防性静脉曲张套扎的受试者将被允许参加研究)。
[0554]
13.受试者患有研究者认为未得到充分控制的1型或2型糖尿病。
[0555]
14.受试者患有预期寿命《1年的严重合并症。
[0556]
15.受试者患有活动性恶性肿瘤,包括活动性肝细胞癌(hcc)。
[0557]
16.受试者需要血液透析。
[0558]
17.受试者具有对受试者产生不利影响、可能导致不依从治疗或访视、可能影响临床数据的解释、可能引起偏差或可能以其它方式限制受试者参与研究的任何疾患或情况。
[0559]
18.受试者在提供同意后30天内使用了任何研究产品或设备。
[0560]
19.具有由于诸如脑血管意外的神经系统事件所致的局灶性神经功能缺陷的受试者。
[0561]
20.受试者饮用超过适量的酒精,定义为对于女性每天一标准量且对于男性每天两标准量。
[0562]
21.受试者目前正在服用不能中止的麻醉剂、苯二氮卓类药物或精神药物。
[0563]
22.受试者已进行减肥手术或肠切除术。
[0564]
功效终点
[0565]
主要功效终点将包括需要住院治疗或急诊就诊并开始he特异性疗法(乳果糖、iv水化等)的首次ohe事件的时间。可替代地,功效终点可被定义为如由医生诊断的需要转诊到急诊科并开始he特异性疗法的首次ohe事件的时间。
[0566]
次要功效终点将包括全因住院治疗的时间。
[0567]
探索性终点将包括1)首次肝硬化非ohe并发症的时间,定义为任何以下事件:sbp、静脉曲张出血、hrs;2)meld和meld-na评分相对于基线的变化;3)使用心理测量肝性脑病评分(phes)在视觉空间功能、注意力和处理速度方面相对于基线的变化;4)根据患者报告的结果测量信息系统(promis)计算机自适应测试(cat)和36项简表(sf-36)健康调查,健康相关生活质量(hrql)相对于基线的变化;5)看护者报告的负担相对于基线的变化;6)conn评分从基线增加一分的时间;7)群体药代动力学;和8)至少对一部分患者的微生物群和代谢组分析。
[0568]
编号的实施方案
[0569]
实施方案1a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到ohe症状消退。
[0570]
实施方案2a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
[0571]
实施方案3a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
[0572]
实施方案4a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天、或至少14天。
[0573]
实施方案5a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11
天、或至少12天、或至少13天、或至少14天。
[0574]
实施方案6a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0575]
实施方案7a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种40mg利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分从4级降低至3级或从3级降低至2级。
[0576]
实施方案8a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0577]
实施方案9a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂qd直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级。
[0578]
实施方案10a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0579]
实施方案11a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂bid直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级。
[0580]
实施方案12a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0581]
实施方案13a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用40mg利福昔明ssd ir片剂tid直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级。
[0582]
实施方案14a.如实施方案1a至13a中任一项所述的方法,其中所述方法还包括向所述患者施用乳果糖。
[0583]
实施方案15a.如实施方案14a所述的方法,其中所述乳果糖和利福昔明同时施用。
[0584]
实施方案16a.如实施方案14a所述的方法,其中所述乳果糖和利福昔明依序施用。
[0585]
实施方案17a.一种如本文所述的用于治疗有需要的患者的显性肝性脑病(ohe)的方法。
[0586]
实施方案18a.一种治疗有需要的患者的显性肝性脑病(ohe)的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir片剂。
[0587]
实施方案19a.如实施方案18a所述的方法,其中施用所述至少一种利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0588]
实施方案20a.如实施方案18a或19a所述的方法,其中施用所述至少一种利福昔明ssd ir片剂直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级。
[0589]
实施方案21a.一种预防患有肝功能失代偿的患者中的肝硬化并发症或全因死亡或两者的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir片剂。
[0590]
实施方案22a.如实施方案21a所述的方法,其中肝硬化的所述并发症包括肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一种或多种。
[0591]
实施方案23a.如实施方案21a或22a所述的方法,其中所述患者具有记录的医学上控制的非难治性腹水。
[0592]
实施方案24a.如实施方案21a至23a中任一项所述的方法,其中所述患者在治疗前先前没有经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
[0593]
实施方案25a.如实施方案21a至24a中任一项所述的方法,其中所述方法还包括降低与肝硬化并发症或全因死亡或两者相关的住院治疗风险。
[0594]
实施方案26a.一种延迟患有肝功能失代偿的患者的显性肝性脑病(ohe)的发作的方法,所述方法包括向所述患者施用至少一种利福昔明ssd ir片剂。
[0595]
实施方案27a.如实施方案26所述的方法,其中肝功能失代偿包括肝硬化和医学上控制的腹水。
[0596]
实施方案28a.如实施方案27a所述的方法,其中所述腹水在医学上控制至少30天的时间段。
[0597]
实施方案29a.如实施方案27a或28a所述的方法,其中肝硬化通过肝硬化的组织病理学证据、瞬时弹性成像、食管静脉曲张的存在和以患有慢性肝病的患者中血小板水平低于150,000为特征的血小板减少症中的一者或多者来确定。
[0598]
实施方案30a.如实施方案26a至29a中任一项所述的方法,其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。
[0599]
实施方案31a.如实施方案26a至30a中任一项所述的方法,其中所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。
[0600]
实施方案32a.如实施方案26a至31a中任一项所述的方法,其中所述患者具有在治疗前小于2的conn(west haven标准)评分。
[0601]
实施方案33a.如实施方案26a至32a中任一项所述的方法,其中所述患者具有在治疗前至少25的简易精神状态检查(mmse)评分。
[0602]
实施方案34a.如实施方案26a至33a中任一项所述的方法,其中所述患者在治疗前没有表现出认知障碍。
[0603]
实施方案35a.如实施方案26a至34a中任一项所述的方法,其中ohe包括2或更高的conn评分。
[0604]
实施方案36a.如实施方案26a至35a中任一项所述的方法,其中所述患者不需要穿刺术。
[0605]
实施方案37a.如实施方案18a至36a中任一项所述的方法,其中所述至少一种利福昔明ssd ir片剂包含约40mg的利福昔明。
[0606]
实施方案38a.如实施方案18a至37a中任一项所述的方法,其中向所述患者施用所述至少一种利福昔明ssd ir片剂持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12
天、或至少13天或至少14天。
[0607]
实施方案39a.如实施方案18a至38a中任一项所述的方法,其中所述至少一种利福昔明ssd ir片剂每天一次、每天两次或每天三次施用于所述患者。
[0608]
实施方案40a.如实施方案18a至39a中任一项所述的方法,其中所述方法还包括向所述患者施用乳果糖。
[0609]
实施方案41a.如实施方案40a所述的方法,其中所述乳果糖和利福昔明同时施用。
[0610]
实施方案42a.如实施方案41a所述的方法,其中所述乳果糖和利福昔明依序施用。
[0611]
贯穿本技术中所引用的所有文献(包括参考文献、发布的专利、公布的专利申请以及共同未决的专利申请)的内容特此以引用的方式明确整体并入。除非另外定义,否则本文所用的全部技术和科学术语符合本领域的普通技术人员通常已知的含义。
[0612]
其它编号的实施方案
[0613]
实施方案1b.一种包含约40mg利福昔明的利福昔明ssd ir片剂,其用于治疗有需要的患者的显性肝性脑病(ohe)的方法中。
[0614]
根据一个优选的实施方案,向所述患者施用至少一种利福昔明ssd ir片剂。
[0615]
实施方案2b.根据实施方案1b所述使用的片剂,其中施用所述片剂直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分降低至少一级、或至少二级、或至少三级。
[0616]
实施方案3b.根据实施方案1b或2b所述使用的片剂,其中施用所述片剂直到所述患者的肝性脑病分级仪(hegi)评分或west haven标准(whc)评分从4级降低至3级、或从3级降低至2级、或从2级降低至1级。
[0617]
实施方案4b.一种包含约40mg利福昔明的利福昔明ssd ir片剂,其用于预防患有肝功能失代偿的患者中的肝硬化并发症或全因死亡或两者的方法中。
[0618]
根据一个优选的实施方案,向所述患者施用至少一种利福昔明ssd ir片剂。
[0619]
实施方案5b.根据实施方案4b所述使用的片剂,其中肝硬化的所述并发症包括肝性脑病(he)、食管静脉曲张出血(evb)、自发性细菌性腹膜炎(sbp)和肝肾综合征(hrs)中的一种或多种。
[0620]
实施方案6b.根据实施方案4b或5b所述使用的片剂,其中所述患者具有记录的医学上控制的非难治性腹水。
[0621]
实施方案7b.根据实施方案4b至6b中任一项所述使用的片剂,其中所述患者在治疗前先前没有经历过自发性细菌性腹膜炎(sbp)、食管静脉曲张出血(evb)或肝肾综合征(hrs)。
[0622]
实施方案8b.根据实施方案4b至7b中任一项所述使用的片剂,其中所述片剂进一步用于降低与肝硬化并发症或全因死亡或两者相关的住院治疗风险的方法中。
[0623]
实施方案9b.一种包含约40mg利福昔明的利福昔明ssd ir片剂,其用于延迟患有肝功能失代偿的患者的显性肝性脑病(ohe)的发作的方法中。
[0624]
根据一个优选的实施方案,向所述患者施用至少一种利福昔明ssd ir片剂。
[0625]
实施方案10b.根据实施方案9b所述使用的片剂,其中所述肝功能失代偿包括肝硬化和医学上控制的腹水。
[0626]
实施方案11b.根据实施方案10b所述使用的片剂,其中所述腹水在医学上控制至
少30天的时间段。
[0627]
实施方案12b.根据实施方案10b或11b所述使用的片剂,其中肝硬化通过肝硬化的组织病理学证据、瞬时弹性成像、食管静脉曲张的存在和以患有慢性肝病的患者中血小板水平低于150,000为特征的血小板减少症中的一者或多者来确定。
[0628]
实施方案13b.根据实施方案10b至12b所述使用的片剂,其中所述患者具有在治疗前在没有ohe的情况下7至9的child-pugh b分类评分。
[0629]
实施方案14b.根据实施方案10b至13b所述使用的片剂,其中所述患者具有在治疗前小于15的终末期肝病-钠模型(meld-na)评分。
[0630]
实施方案15b.根据实施方案10b至14b所述使用的片剂,其中所述患者具有在治疗前小于2的conn(west haven标准)评分。
[0631]
实施方案16b.根据实施方案10b至15b所述使用的片剂,其中ohe包括2或更高的conn评分。
[0632]
实施方案17b.根据实施方案9b至16b所述使用的片剂,其中所述患者不需要穿刺术。
[0633]
实施方案18b.根据实施方案1b至17b所述使用的片剂,其中向所述患者施用所述片剂持续至少一天、或至少两天、或至少3天、或至少4天、或至少5天、或至少6天、或至少7天、或至少8天、或至少9天、或至少10天、或至少11天、或至少12天、或至少13天或至少14天。
[0634]
实施方案19b.根据实施方案1b至18b所述使用的片剂,其中所述片剂每天一次、每天两次或每天三次施用于所述患者。
[0635]
实施方案20b.根据实施方案1b至19b所述使用的片剂,其中进一步向所述患者施用片剂乳果糖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。