1.本发明涉及医药,特别是一种靶向生长抑素受体2的聚合物纳米药物的制备方法及其应用。
背景技术:
2.神经内分泌前列腺癌是前列腺癌恶性程度最高的病理亚型,表现为雄激素受体低表达及神经内分泌标志物高表达的特征。神经内分泌前列腺癌对雄激素剥夺治疗、化疗及放疗均不敏感,是目前导致前列腺癌特异性死亡的主要原因之一。迄今为止,未能提供针对神经内分泌前列腺癌的有效治疗方法,尚无抗神经内分泌前列腺癌的药物获批。因此寻找一种安全高效的抗肿瘤策略,对于改善神经内分泌前列腺癌患者的预后至关重要。
3.聚乳酸-羟基乙酸共聚物(plga)作为一种生物可降解的纳米载体,已被fda批准作为辅料用于各种药物的生产和加工。早在1989年,以plga为基础的亮丙瑞林缓释微球就已经开始应用于前列腺癌患者的长期内分泌治疗,并沿用至今。此外,plga载体表面还可以进行不同的功能修饰,以便将治疗药物靶向递送到特定的细胞或器官。神经内分泌肿瘤细胞膜高表达生长抑素受体2(somatostatin receptor 2,sstr2),而奥曲肽(octreotide,oct)作为一种人工合成的天然生长抑素的八肽衍生物可以与sstr2相结合,因此奥曲肽可以作为靶向肽用于针对神经内分泌肿瘤的药物递送载体的构建。
4.此外,丝/苏氨酸pkcβ被认为参与了神经内分泌前列腺癌的进展。恩扎妥林(enza)作为pkcβ的抑制剂可以通过抑制pkcβ的表达及活性抑制神经内分泌前列腺癌的增殖并诱导其凋亡。然而,多项临床研究发现恩扎妥林的血液暴露会增加血栓形成、血小板减少、出血和丙氨酸转氨酶升高等毒副作用的发生。因此,将恩扎妥林高效递送至神经内分泌前列腺癌细胞,提高其生物利用度并降低不良并发症的发生是神经内分泌前列腺癌治疗的一个有效策略。但至今未见有使用奥曲肽作为靶向配体修饰在plga载体表面并载带pkcβ抑制剂的公开报导。
技术实现要素:
5.针对上述情况,为克服现有技术之缺陷,本发明之目的就是提供一种靶向生长抑素受体2的聚合物纳米药物的制备方法及其应用,可有效解决制备靶向生长抑素受体2的聚合物纳米药物,及其在制备治疗神经内分泌前列腺癌药物中的应用问题。
6.本发明解决的技术方案是,一种靶向生长抑素受体2的聚合物纳米药物的制备方法,利用双乳法合成载带pkcβ抑制剂的plga,大大提高了恩扎妥林的生物利用度,通过马来酰亚胺键与巯基的化学偶联反应在plga表面修饰奥曲肽。奥曲肽的修饰增加了纳米药物在神经内分泌肿瘤组织中的富集,可有效的抑制神经内分泌前列腺癌细胞的增殖、侵袭及迁移能力,达到抗肿瘤的目的,由以下方法实现:一、制备plga纳米颗粒:
1)称取10mg的plga-peg-mal溶于1ml二氯甲烷中;所述的plga-peg-mal中plga、peg、mal的质量比为2000:17000:97;2)加入200μl双蒸水,用超声波破碎仪进行初次乳化,功率设定为285w,开1s,关2s,持续3min,成混悬液;3)向初次乳化后的混悬液中加入2ml质量浓度为2%的胆酸钠水溶液,用超声波破碎仪进行复乳,功率设定为332.5w,开1s,关2s,持续5min;4)将两次乳化后的混悬液逐滴滴加到10ml质量浓度为0.5%的胆酸钠水溶液中,用磁力搅拌仪分散15min;5)在减压条件下,利用旋转蒸发仪将分散好的溶液进行旋蒸,旋蒸至无气泡产生,除去溶液中的二氯甲烷;6)将步骤5)得到的澄清透明溶液离心,设置条件为10000g,常温,15min;7)弃上清,沉淀用双蒸水洗两次,重复步骤6),将管底沉淀重悬至1ml双蒸水中,得到plga纳米颗粒混悬液;二、制备奥曲肽修饰的plga纳米载体:1)奥曲肽与plga纳米颗粒混悬液按照2:1的摩尔比混合;2)取双蒸水或者pbs缓冲液,ph值6.5-8.0;3)将奥曲肽与plga的混合物按照体积比1:1的比例加入双蒸水或pbs缓冲液中,并在混悬仪中进行反应,设定条件为,18-25℃,300rmp,持续3-12小时;4)选取截留分子量2000d-5000d的透析袋,在双蒸水中煮沸活化3-5min;5)将3)中所得溶液加入活化的透析袋中,上下用密封夹封闭,置于盛有双蒸水的玻璃烧杯中浸没,进行搅拌过夜8-12h透析,将未连接的奥曲肽去除;6)透析完毕后所得溶液即为奥曲肽修饰的纳米药物颗粒聚合物(oct-plga-enza),即靶向生长抑素受体2的聚合物纳米药物。
7.本发明方法制备的靶向生长抑素受体2的聚合物纳米药物(oct-plga-enza)具有抗癌活性,实现在制备治疗神经内分泌前列腺癌药物中的应用。
8.本发明方法易操作,设计科学合理,制备的产品性能好,有效用于制备治疗神经内分泌前列腺癌的药物,开辟了治疗神经内分泌前列腺癌药物的新途径,有显著的经济和社会效益。
附图说明
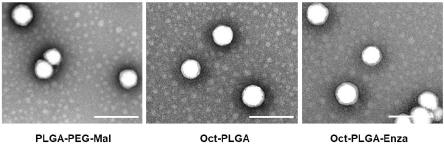
9.图1为本发明纳米药物透射电镜图。
10.图2为本发明纳米药物水合粒径及表面电势图。
11.图3为本发明纳米药物奥曲肽修饰前后核磁图。
12.图4为本发明纳米颗粒靶向性示意图。
13.图5为本发明纳米药物抑制神经内分泌前列腺癌细胞增殖图。
14.图6为本发明纳米药物抑制神经内分泌前列腺癌细胞侵袭能力图。
15.图7为本发明纳米药物抑制神经内分泌前列腺癌细胞迁移能力图。
具体实施方式
16.以下结合实施例对本发明的具体实施方式作详细说明。
17.实施例1本发明一种靶向生长抑素受体2的聚合物纳米药物的制备方法,包括以下步骤:(1)、plga-enza纳米药物的制备:称取10mg的plga-peg-mal与1mg恩扎妥林溶于1ml二氯甲烷中;加入200μl双蒸水,用超声波破碎仪进行初次超声乳化,设定功率为285w,开1s,关2s,5分钟;加入2ml质量浓度为2%的胆酸钠水溶液,用超声波破碎仪进行二次超声乳化,设定功率为332.5w,开1s,关2s,持续5min;将超声好的液体逐滴滴加到10ml质量浓度为0.5%的胆酸钠水溶液中,磁力搅拌仪分散10min;在2kpa-10kpa负压条件下,用旋转蒸发仪对分散好的混悬液进行旋蒸,直至无气泡出现,除去溶液中的二氯甲烷;将所得澄清透明溶液置于离心机离心,10000g,常温,15min;离心结束后,弃去上清,沉淀用双蒸水洗两次,再次离心,得到的纳米颗粒(plga-enza)重悬至1ml水中,备用;(2)、oct-plga-enza纳米药物的制备:plga-enza与奥曲肽按照1︰2的摩尔比进行混合,加入双蒸水或者pbs缓冲液,调整ph值6.5-8.0,置于混匀仪上,300rmp,常温混匀8h,得混合溶液;选取截留分子量3500d的透析袋,在双蒸水中煮沸活化4min,将混合溶液加入活化的透析袋中,上下用密封夹封闭,置于盛有双蒸水的玻璃烧杯中浸没,进行搅拌过夜10h透析,将未连接的奥曲肽去除,透析完毕后所得溶液即为奥曲肽修饰的纳米药物颗粒聚合物(oct-plga-enza),即靶向生长抑素受体2的聚合物纳米药物。
18.本发明使用奥曲肽作为靶向配体修饰在plga载体表面并载带pkcβ抑制剂,其优势在于:(1)解决了恩扎妥林生物利用度低的问题;(2)减少了机体其他细胞对于恩扎妥林非特异性的摄取,减少了药物毒副作用;(3)合成简便,生物可降解;(4)可装载不同机制的抗肿瘤药物,根据临床需要,灵活组合。并经实验取得了非常好的有益技术效果,有关实验资料如下:一、oct
ꢀ‑
plga-enza纳米药物的包封率和载药量测定:首先,通过酶标仪确定恩扎托林的最大吸收波长为255nm。然后,用液相-高效色谱仪对不同浓度梯度的恩扎妥林溶液进行测量并绘制标准曲线。最后,测定载药后的纳米药物中的恩扎妥林最大吸收峰下的面积,并根据绘制的标准曲线确定恩扎妥林的含量。包封率的计算公式为:包封率(%)= 纳米颗粒包载的药物质量/投入药物的总质量*100%,载药量的计算公式为:载药量(%)=纳米颗粒包载的药物质量/(投入药物的总质量 投入plga的总质量)
×
100 %。结果见表1。
19.表1纳米载体的包封率(encapsulation efficiency,ee)与载药量(drug loading rate,dlr)检测,plga的质量固定为10 mgotnps:enza10:0.2510:0.510:110:1.5ee(%)22.0578.4682.3843.81dlr(%)0.543.747.495.71二、奥曲肽通过巯基-马来酰亚胺的偶合反应修饰在plga-enza上实验:按前述方法制备plga及oct-plga纳米颗粒各1mg,低温冷冻干燥机冻干后分别溶于0.5ml氘代dmso中,置于核磁共振仪中进行检测,并用mestrenova 9.0软件进行结果判
读。如图3所示:oct-plga核磁结果中马来酰亚胺质子(6.67 ppm)的消失证明了奥曲肽在plga-peg-mal上的成功偶联。
20.三、纳米颗粒神经内分泌前列腺癌细胞靶向性实验:将构成奥曲肽的氨基酸进行随机乱序排列后合成突变的奥曲肽(mutantoctreotide,moct),作为对照肽用于后续实验。随后,选用cy5.5作为荧光染料并按照前述方法分别合成三组纳米颗粒:plga-cy5.5,oct-plga-cy5.5和moct-plga-cy5.5。
21.将h660或pc3细胞以合适的密度接种至12孔板;培养48-72h,弃去培养基,缓慢加入pbs清洗细胞,更换新的培养基(考虑h660的半贴壁半悬浮特性,离心后将悬浮的细胞再次加入到孔板中);将上述制备的包载等量荧光染料cy5.5的3种纳米颗粒加入孔板内,冰上孵育30min;胰酶消化,完全培养基终止消化,以300 g的离心力,离心3-5min,将细胞收集至1.5 ml ep管中离心,弃去上清后加入200μlpbs重悬;流式细胞仪检测。如图4所示:奥曲肽修饰的聚合物纳米颗粒具有良好的神经内分泌前列腺癌细胞靶向性。
22.四、cck-8法检测聚合物纳米药物对神经内分泌前列腺癌细胞增殖的抑制作用实验将h660或pc3细胞以合适密度接种于96孔板,置于细胞培养箱,培养24-48h。按前述方法合成oct-plga-enza纳米药物,分设3个处理组:空白对照组,恩扎妥林游离药物组及oct-plga-enza纳米药物组。设置恩扎妥林最终实验浓度为20μm。按照分组分别给予相应处理后再孵育24h,小心吸走培养基,加入含有10% cck-8的完全培养基,置于37℃细胞培养箱,孵育1h;取出96孔板,酶标仪检测450 nm处od值。如图5所示:oct-plga-enza纳米药物可以显著抑制神经内分泌前列腺癌细胞的增殖。
23.五、transwell法检测聚合物纳米药物对神经内分泌前列腺癌细胞侵袭能力的抑制作用实验将matrigel基质胶与 1640培养基按体积比1:3制备transwell小室,轻微晃动使其均匀分布,厚度约0.5-1mm,置于37℃恒温箱1h。选取生长状态好的h660或pc3细胞并设置分组:空白对照组,恩扎妥林游离药物组及oct-plga-enza纳米药物组。按前述方法合成oct-plga-enza纳米药物,设置恩扎妥林最终实验浓度为20μm。将细胞按照分组进行相应处理后加入transwell小室内,向transwell小室小下方孔内加入600μl含有10% fbs的完全培养基(确保小室与培养基充分接触,中间无气泡),37℃培养箱(5% co2)过夜。培养过夜后取出transwell小室,吸除其内液体,用棉签轻轻擦小室内表面以去除残余细胞及培养基,置于新孔中,pbs 浸洗2次,每次5min。新孔加入适量4%多聚甲醛溶液,将小室浸于其中固定,20分钟后pbs溶液洗2遍,每次5分钟。新孔加入适量5 % ttrixon,将小室浸于其中5 分钟,使用pbs洗2遍,每次5分钟,常温晾干小室膜。用1x pbs配制0.1%结晶紫染液,并量取600μl放入新孔中,在避光条件下,将晾干的小室浸入染液,染色10分钟。用pbs洗2遍,每次5分钟,室温晾干后显微镜下拍照取样,每孔取3个视野,计算穿模细胞数量。将上述实验重复3次,用spss2.0软件进行统计学分析。如图6所示:oct-plga-enza纳米药物可以显著抑制神经内分泌前列腺癌细胞的侵袭能力。
24.六、划痕实验检测聚合物纳米药物对神经内分泌前列腺癌细胞迁移能力的抑制作用实验将pc3细胞以合适密度接种于6孔板,置于细胞培养箱,培养24h。待细胞贴壁后,选
取中小号无菌枪头,保持枪头垂直,并用直尺引导,方向垂直于6孔板背面的横线朝一个方向单次划过,每孔可做三个划痕作为重复。设置3个处理组:空白对照组,恩扎妥林游离药物组及oct-plga-enza纳米药物组。按前述方法合成oct-plga-enza纳米药物,设置恩扎妥林最终实验浓度为20μm。按照分组分别给予相应处理后再培养1-2天,分别在0h,24h和48h用倒置显微镜下拍照取样。使用image j 软件分别对两组在各时间点的细胞划痕间距变化进行比较分析得出最终结论。如图7所示:oct-plga-enza纳米药物可以显著抑制神经内分泌前列腺癌细胞的迁移能力。
25.实验表明,本发明方法制备的靶向生长抑素受体2的聚合物纳米药物(oct-plga-enza)有抗癌活性,可有效用于治疗神经内分泌前列腺癌,实现在制备治疗神经内分泌前列腺癌药物中的应用,有效解决了恩扎妥林生物利用度低的问题,减少了机体其他细胞对于恩扎妥林非特异性的摄取,减少了药物毒副作用,合成简便,生物可降解,可装载不同机制的抗肿瘤药物,根据临床需要,灵活组合,开辟了治疗神经内分泌前列腺癌药物的新途径,有显著的经济和社会效益。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。