1.本发明涉及抗肿瘤疫苗技术领域,更具体地,涉及一种广谱性肿瘤疫苗增效的组合物。
背景技术:
2.恶性肿瘤即癌症,癌症发病率逐年上升,是人类健康的第一杀手。据世界卫生组织国际癌症研究机构发布的最新数据,2020年全球新发癌症病例1929万例,其中我国新发癌症病例457万例,癌症死亡病例300万例,新发癌症人数、癌症死亡人数均位居全球第一。现有治疗癌症的方法除手术切除外,清除体内癌细胞的手段主要还包括化学治疗、放射治疗以及免疫治疗等。放疗和化疗靶向性低、副作用大,给患者造成了极大的痛苦;而免疫治疗是现代科技中唯一有可能彻底清除癌细胞的方法,相对于传统的治疗手段具有巨大优势,在2013年被《科学》杂志评为十大科学突破之首,前景广阔。
3.目前免疫检查点分子pd-1和ctla4的抑制剂作为抗体药物已经被美国fda批准用于治疗黑色素瘤、肺癌、霍奇金淋巴瘤、肾癌和头颈癌,统计上可以短期内延长10-30%的癌症病人的寿命,只对有淋巴细胞浸润的“热肿瘤”起作用,对没有或者淋巴细胞浸润较少的“冷肿瘤”无效。除了免疫检查点抑制剂免疫治疗技术外,car-t细胞技术目前是免疫细胞治疗领域投资的热点,但car-t细胞目前只能对部分的血液性肿瘤治疗有效。因为实体肿瘤免疫微环境的抑制等原因,car-t细胞技术治疗实体瘤至今没有成功,因此也有一些公司转向开发t细胞受体(tcr)t细胞治疗技术,但该技术的毒副作用很难控制,临床试验还导致病人死亡,其前景有待进一步改善和验证。
4.治疗性癌症疫苗可以激活人体免疫系统,使其对肿瘤抗原产生免疫应答,从而特异性清除实体肿瘤组织并形成免疫记忆,为患者提供终身保护。相对于其他治疗方法,治疗性癌症疫苗作为一种主动免疫干预的治疗方法,可操作性更强,且不会引起强烈的副作用,因而成为一直以来的研究热点。一直以来,癌症疫苗研发使用的没有突变的肿瘤高表达“肿瘤相关抗原(taa)”,其临床治疗癌症病人的有效性交差。相反,最近3年内研究发现,癌症病人的肿瘤细胞自发突变产生的新抗原(neoantigen)能够能够被癌症病人自身的t细胞很好地识别,诱导的免疫反应非常强。因此,肿瘤新抗原已经成为癌症疫苗的新热点。值得一提的是,今年7月份《自然》杂志报道关于美国哈佛大学和德国缅因兹大学分别宣布了两项临床有关肿瘤新抗原个性化疫苗i期试验结果。其中哈佛大学研究发现,接种疫苗的6名黑色素瘤患者中,4人肿瘤完全消失,且32个月内无复发!另外2人肿瘤仍然存在,在接受辅助治疗后肿瘤也完全消失。而德国团队的结果显示,在13位接种疫苗的患者中,8人肿瘤完全消失且23月内无复发,其余5名患者由于接种疫苗时肿瘤已经扩散,有2人出现肿瘤缩小,其中1人接受辅助治疗后肿瘤完全消退!该研究结果在全世界产生轰动性效应,甚至有媒体报道使用了“个性化免疫治疗取得开天辟地成功”的报道。
5.然而,目前的新抗原肿瘤疫苗只局限于少数突变频率高的癌症类型,且肿瘤疫苗的个体化特征导致缺乏普适性也阻碍了其广泛应用。目前新抗原肿瘤疫苗研究缺乏对肿瘤
新抗原疫苗作用机制的深入探讨,也缺乏对新抗原特异性t细胞应答规律的系统性研究,限制了基于新抗原的免疫治疗技术应用,而且普适性的肿瘤疫苗设计技术一直停滞不前。
技术实现要素:
6.本发明所要解决的技术问题是克服现有技术存在的上述问题,本发明的首要目的是提供一种广谱性肿瘤疫苗增效的组合物。
7.本发明的第二个目的是提供疫苗组合物在制备降低肿瘤微环境中免疫抑制作用的药剂中的应用。
8.本发明的第三个目的是提供一种提高突变的肿瘤抗原或者肿瘤抗原的相似抗原的免疫原性的方法。
9.本发明的目的通过以下技术方案实现:
10.一种广谱性肿瘤疫苗增效的组合物,包括初次免疫用抗原、加强免疫用抗原和加强免疫用增强剂;
11.其中,所述加强免疫用抗原为天然的肿瘤抗原;所述初次免疫用抗原选自天然的肿瘤抗原的突变抗原、天然的肿瘤抗原的相似抗原;所述初次免疫用抗原和加强免疫用抗原具有交叉反应;
12.所述加强免疫用增强剂选自促炎性的佐剂、用于提高t细胞免疫应答的细胞因子或趋化因子、激活免疫反应的抗体中的至少一种;
13.所述促炎性的佐剂包括lps、poly(i:c)、cpg、mpl、锰佐剂、油佐剂;所述细胞因子或趋化因子包括il-12、il-15、il-21、ccl3、ccl4、ccl5;所述激活免疫反应的抗体包括重组cd40l蛋白、重组4-1bbl蛋白、cd40抗体、ox40抗体。
14.优选的,所述初次免疫用抗原、加强免疫用抗原包括多肽、保护所述多肽的蛋白质或者长肽、用于编码所述多肽的mrna、dna;或者是含有所述多肽的重组体(例如细胞、病毒、细菌)。
15.发明人前期研究发现了一种增强抗肿瘤免疫反应的组合物,包括第一肿瘤抗原和第二肿瘤抗原,其中,第一肿瘤抗原为突变抗原,第二肿瘤抗原为天然抗原(也成为肿瘤相关抗原),且第二肿瘤抗原是与第一肿瘤抗原同源且交叉的多肽或者其免疫原性片段;但是前期还缺乏瘤新抗原疫苗作用机制的深入探讨,也缺乏对新抗原特异性t细胞应答规律的系统性研究,本发明在前期研究的基础上,通过探讨双重异源疫苗的作用机制,以及新抗原特异性t细胞应答规律,发现可以在双重异源疫苗的基础上,添加免疫用增强剂,能够显著提高双重异源疫苗的保护作用,对肿瘤的杀伤和抑制效果显著提升。
16.虽然前期研究中,也提到可以在双重异源疫苗的基础上增加佐剂,也给出了佐剂(例如细胞因子il-1、il-2、ifn-γ、gm-csf、il-12、cpg)的一些例子,但是本发明经过实验发现,并非所有的佐剂(例如il-12、il-15)并不能提升双重异源疫苗的效果,经过研究双重异源疫苗的作用机制,以及新抗原特异性t细胞应答规律,发现促炎性的佐剂包括lps、poly(i:c);所述细胞因子或趋化因子包括ccl3、ccl4;所述激活免疫反应的抗体包括cd40抗体、ox40抗体能够显著提升双重异源疫苗对肿瘤的杀伤和抑制效果。
17.本发明上述疫苗组合物,使用了双重异源免疫的肿瘤疫苗策略,其可以诱导非疫苗成分的抗原表位的t细胞免疫应答,放大免疫反应,诱导表位扩展。从而适用于制备广谱
性肿瘤疫苗。
18.另外,本发明还通过研究发现免疫检查点抗体同样可以起到增强双重异源疫苗对肿瘤的杀伤和抑制效果,因此,另一方面,本发明还提供一种新的广谱性肿瘤疫苗增效的组合物,包括初次免疫用抗原、加强免疫用抗原和免疫检查点抗体;
19.其中,所述加强免疫用抗原为天然的肿瘤抗原;所述初次免疫用抗原选自天然的肿瘤抗原的突变抗原、天然的肿瘤抗原的相似抗原;所述初次免疫用抗原和加强免疫用抗原具有交叉反应;所述免疫检查点抗体包括pd-1抗体、pd-l1抗体、ctla-4抗体、tigit抗体、4-1bb抗体。
20.本发明通过给小鼠体内注射cd25抗体,用于删除treg细胞,发现,treg细胞删除可以提高突变的天然肿瘤抗原的突变抗原或者天然肿瘤抗原的类似抗原对天然抗原的交叉反应性t细胞免疫应答。
21.另外,在双重异源疫苗策略后,通过分析肿瘤微环境中的免疫细胞的比例,发现隋系来源的抑制性细胞(mdsc)在疫苗治疗组中显著降低,提示也可以通过降低肿瘤微环境中的免疫抑制作用,进一步提升双重异源疫苗的应用效果。
22.因此,本发明还提供另一种新的广谱性肿瘤疫苗增效的组合物,包括初次免疫用抗原、加强免疫用抗原和物质a,所述物质a用于降低肿瘤微环境中髓系来源的抑制性细胞和/或treg细胞的比例和/或功能。
23.mdscs来源于骨髓祖细胞和未成熟髓细胞,是树突状细胞(dc)、巨噬细胞和粒细胞的前体,正常情况下,其能迅速地分化为成熟的粒细胞、dcs和巨噬细胞,并进入相应的器官、组织,发挥正常免疫。在肿瘤、感染、炎症、败血症、外科损伤等其它病理条件下,受细胞因子的作用,这些髓系来源的前体细胞成熟受阻,因而停留在各个分化阶段,成为具有免疫抑制功能的mdscs。目前研究认为mdscs在小鼠中表型为cd11b gr1 ,根据其表面ly6g和ly6c的不同表达可进一步分为单核细胞来源的mdsc(monocytic-mdscs)和粒细胞来源的mdsc(granulocytic-mdscs)两个亚群。mdscs能抑制机体免疫细胞发挥正常固有性和适应性免疫功能,在固有免疫方面,mdscs通过膜结合tgf-β使nkg2d的表达下调,从而抑制nk细胞的功能,mdscs可诱导treg扩增,促进treg对免疫的负调控作用。在适应性免疫方面,mdscs可以竞争性消耗体内环境中的半胱氨酸,上调inos和arg-1的活性从而消耗l-精氨酸,使t细胞生成受阻,mdscs也可以通过产生活性氧(reactive oxygen species,ros)来抑制t细胞免疫应答反应。
24.因此,在一些具体的实施方式中,arg-1、i-nos和ros是mdsc抑制功能的关键蛋白和物质,所述物质a可以是抑制arg-1、i-nos和ros阻断mdsc功能的抑制剂。,由于il1ra、cxcr2在mdsc上高表达,可以利用il-1ra抗体、cxcr2抗体清除mdsc,所述的物质a可以是il-1ra抗体、cxcr2抗体。文献报道,吉西他滨、全反式维甲酸、维生素a、1,25-二羟维生素d3、硝化阿司匹林、cox2抑制剂、磷酸二酯酶-5可以抑制mdsc功能或者促进其分化成其它细胞,物质a也可以是这些物质。treg细胞高表达cd25、gitr、ctla4、ccr8,所述物质a因此可以是包括cd25抗体、gitr抗体、ctla4抗体、ccr4抗体、ccr8抗体,用于清除肿瘤组织treg细胞。
25.进一步的,通过进一步分析肿瘤微环境中免疫细胞的单细胞的组成,发现,肿瘤微环境中cd4 t细胞和/或树突状细胞(dc细胞)和/或nk细胞在疫苗治疗后显著升高,提示也可以通过提高肿瘤微环境中cd4 t细胞和/或树突状细胞(dc细胞)和/或nk细胞的功能和/
或比例,来提升双重异源疫苗的应用效果。
26.因此,本发明还提供另外一种新的广谱性肿瘤疫苗增效的组合物,包括初次免疫用抗原、加强免疫用抗原和物质b,所述物质b用于提高肿瘤微环境中cd4 t细胞和/或树突状细胞(dc细胞)和/或nk细胞的比例和/或功能。
27.在一些具体的实施方式中,物质b包括tigit抗体、nkg2d抗体、nkg2a抗体、重组il-15、重组il-2、i型干扰素、重组il-18、mrna或者mrna疫苗。
28.优选的,上述广谱性肿瘤疫苗增效的组合物中,所适应的肿瘤选自黑色素瘤、结直肠癌,和其他实体瘤,如乳腺癌、肺癌、胃癌、头颈部肿瘤、前列腺癌、肝癌、鼻咽癌、食道癌、宫颈癌。
29.本发明还提供上述肿瘤疫苗增效的组合物在制备降低肿瘤微环境中免疫抑制作用的药剂中的应用。
30.本发明上述肿瘤疫苗增效的组合物的其中一种使用方法如下:
31.(1)初次免疫使用初次免疫用抗原;所使用的疫苗载体为dc细胞;
32.(2)加强免疫使用加强免疫用抗原;所使用的疫苗载体为细菌或者病毒载体(细菌或者病毒包括但不限于李斯特菌、痘病毒、水泡型口炎病毒、淋巴细胞脉络丛脑炎病毒);其中加强免疫可以多次重复进行;
33.(3)加强免疫阶段使用加强免疫用增强剂。
34.本发明上述肿瘤疫苗增效的组合物的另外一种使用方法如下:
35.(1)初次免疫使用初次免疫用抗原;所使用的疫苗载体为dc细胞;
36.(2)加强免疫使用加强免疫用抗原;所使用的疫苗载体为细菌或者病毒载体(细菌或者病毒包括但不限于李斯特菌、痘病毒、水泡型口炎病毒、淋巴细胞脉络丛脑炎病毒);其中加强免疫可以多次重复进行;
37.(3)加强免疫阶段使用免疫检查点抗体。
38.本发明上述肿瘤疫苗增效的组合物的另外一种使用方法如下:
39.(1)初次免疫使用初次免疫用抗原;所使用的疫苗载体为dc细胞;
40.(2)加强免疫使用加强免疫用抗原;所使用的疫苗载体为细菌或者病毒载体(细菌或者病毒包括但不限于李斯特菌、痘病毒、水泡型口炎病毒、淋巴细胞脉络丛脑炎病毒);其中该步骤的加强免疫可以多次重复进行;
41.(3)加强免疫阶段使用物质a(如cd25、gitr等)。
42.本发明上述肿瘤疫苗增效的组合物的另外一种使用方法如下:
43.(1)初次免疫使用初次免疫用抗原;所使用的疫苗载体为dc细胞;
44.(2)加强免疫使用加强免疫用抗原;所使用的疫苗载体为细菌或者病毒载体(细菌或者病毒包括但不限于李斯特菌、痘病毒、水泡型口炎病毒、淋巴细胞脉络丛脑炎病毒);其中该步骤的加强免疫可以多次重复进行;
45.(3)加强免疫阶段使用物质b(如tigit抗体等)。
46.发明人发现肿瘤新抗原的免疫原性取决于其与天然肿瘤抗原(也称为肿瘤相关抗原)交叉反应性的强弱,同时在抗肿瘤免疫中,起主要作用的是天然肿瘤抗原的突变抗原(也称为新抗原)诱导的免疫反应中识别天然抗原(也称为肿瘤相关抗原)的那一群t细胞,因此,可以通过提高突变的肿瘤抗原(也称为新抗原)或者天然肿瘤抗原的相似抗原的免疫
原性,来提升双重异源疫苗抗肿瘤的效果。
47.在此基础上,本发明还提供了一种提高突变的肿瘤抗原或者肿瘤抗原的相似抗原的免疫原性的方法,其采用以下任一种手段实现:
48.(i)清除treg细胞;
49.(ii)对野生型肿瘤相关抗原进行突变或者优化;
50.(iii)增加肿瘤组织dc细胞的比例和数量;
51.(vi)增加肿瘤组织dc1亚群细胞的比例和数量;
52.(v)增加cd40l表达的cd4 t细胞;
53.(vi)产生非疫苗充分的抗原t细胞免疫应答,即抗原表位扩展;
54.(vii)接种双重异源疫苗,包括以下步骤:
55.a、初次免疫:接种天然的肿瘤抗原的突变抗原、天然的肿瘤抗原的相似抗原、与天然的肿瘤抗原有交叉反应的抗原、与天然的肿瘤细胞相对应的突变的肿瘤细胞或者突变的肿瘤细胞裂解物;
56.b、加强免疫:接种天然的肿瘤抗原。
57.优选的,所述初次免疫用抗原、加强免疫用抗原包括多肽、保护所述多肽的蛋白质或者长肽、用于编码所述多肽的mrna、dna;或者是含有所述多肽的重组体(例如细胞、细菌或者病毒)。
58.上述提高突变的肿瘤抗原或者肿瘤抗原的相似抗原的免疫原性的方法中,加强免疫还可以另外使用增强剂,所述增强剂选自促炎性的佐剂、用于提高t细胞免疫应答的细胞因子或趋化因子、激活免疫反应的抗体中的至少一种;
59.所述促炎性的佐剂包括lps、poly(i:c)、cpg、mpl、锰佐剂、油佐剂;所述细胞因子或趋化因子包括il-12、il-15、il-21、ccl3、ccl4、ccl5;所述激活免疫反应的抗体包括重组cd40l蛋白、重组4-1bbl蛋白、cd40抗体、ox40抗体。
60.本发明还提供一种用于治疗黑色素瘤的肿瘤疫苗增效的组合物,包括初次免疫用抗原、加强免疫用抗原;其中初次免疫用抗原为seq id no:1或/和seq id no:2所示序列的抗原,所述加强免疫用抗原为肿瘤相关抗原gp100。
61.优选的,上述用于治疗黑色素瘤的肿瘤疫苗增效的组合物还包括加强免疫用增强剂,其中,加强免疫用增强剂选自促炎性的佐剂、用于提高t细胞免疫应答的细胞因子或趋化因子、激活免疫反应的抗体中的至少一种。具体的,所述促炎性的佐剂包括lps、poly(i:c)、cpg、mpl、锰佐剂、油佐剂;所述细胞因子或趋化因子包括il-12、il-15、il-21、ccl3、ccl4、ccl5;所述激活免疫反应的抗体包括重组cd40l蛋白、重组4-1bbl蛋白、cd40抗体、ox40抗体。
62.与现有技术相比,本发明具有以下有益效果:
63.本发明系统性地研究了t细胞对肿瘤抗原及肿瘤新抗原的识别和应答机制。发现新抗原的免疫原性取决于其与野生型肿瘤抗原交叉反应性的强弱,受野生型肿瘤抗原的中枢耐受程度影响;并归纳出了肿瘤抗原特异性(或者自身抗原反应性)t细胞不是传统认为的“胸腺发育缺陷而逃逸中枢耐受的t细胞”、而是“突变的自身抗原(mutated or altered self-antigen)特异性t细胞中少数对自身抗原有交叉反应性的t细胞”的新理论。并且发现个别与野生型抗原有交叉反应性的新抗原和肿瘤相关抗原可以用于开发广谱性肿瘤疫苗,
加之“异源双重免疫”疫苗设计新思路,可以极大地提高肿瘤疫苗抗肿瘤的有效性。机制上,新的治疗性肿瘤疫苗可以诱发肿瘤免疫原性死亡,产生抗原表位扩展效应,导致抗肿瘤免疫应答的级联放大。该疫苗技术不仅可以用于与免疫检查点抑制剂联合使用,也可以与其它药物联用,增强清除肿瘤的临床治疗效果,具有广泛的临床应用前景。该新技术不仅为开发有效广谱的肿瘤疫苗提供了的新的思路,也为基于肿瘤抗原的新型免疫治疗技术及新型联合治疗方案提供理论依据和创新性思路。
附图说明
64.图1显示ccl3提高肿瘤抗原的t细胞免疫应答,其中,图1a和1b为ripova小鼠以dc-y3免疫,免疫后第3天以dc-n4加强免疫,同时腹腔注射ccl3、il-12和il15,第一次免疫后第7天取小鼠脾脏细胞,以n4刺激,流式检测分泌ifnγ和tnfα的cd8 t细胞的比例(n=4);图1c和1d为野生型c57bl/6小鼠以dc-y3免疫,免疫后第3天以dc-n4加强免疫,同时腹腔注射ccl3、il-12和il15,第一次免疫后第7天取小鼠脾脏细胞,以n4刺激,流式检测分泌ifnγ和tnfα的cd8 t细胞的比例(n=4);
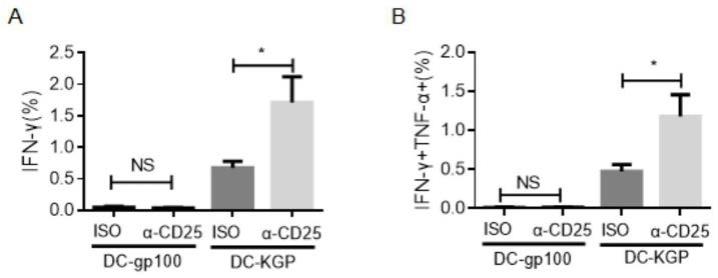
65.图2显示tregs删除不影响肿瘤抗原的免疫反应,野生型小鼠腹腔注射cd25抗体或对照抗体,注射后第4天以dc-gp100或dc-kpg免疫,免疫后第7天取小鼠脾脏细胞,以gp100刺激,检测分泌ifnγ(图2a)和以及分泌ifnγ和tnfα(图2b)的cd8 t细胞的比例(n=4);
66.图3显示双重异源疫苗联合ctla4抗体治疗黑色素瘤的效果,野生型c57/bl6小鼠接种1
×
106黑色素瘤细胞b16f10,肿瘤接种后第7天以dc-i2治疗,在第10天和第13天以dc-sd治疗同时腹腔注射400ng ccl3,在第8、11、13天腹腔注射150μg ctla4抗体(图3a),每隔2天测量肿瘤体积(图3b),并记录小鼠生存时间(图3c,n=8);
67.图4显示双重异源疫苗联合pd-1抗体治疗黑色素瘤的效果,野生型c57/bl6小鼠接种1
×
106黑色素瘤细胞b16f10,肿瘤接种后第7天以dc-i2治疗,在第10天和第13天以dc-sd治疗同时腹腔注射400ng ccl3,在第8、11、13天腹腔注射200μg pd-1抗体(图4a),每隔2天测量肿瘤体积(图4b),并记录小鼠生存时间(图4c,n=8);
68.图5显示小鼠脾脏细胞对肿瘤抗原trp2 sd的免疫应答,野生型c57/bl6小鼠接种1
×
106黑色素瘤细胞b16f10,肿瘤接种后第7天以dc-i2治疗,在第10天和第13天以dc-sd治疗同时腹腔注射400ng ccl3,在第8、11、13天腹腔注射200μg pd-1抗体,肿瘤接种后第20天,取小鼠脾脏细胞,以2μg sd多肽刺激,以ifnγelispot(图5a)检测各治疗组分泌ifnγ的细胞数(n=4);胞内染色检测分泌ifnγ,tnfα以及ifnγ和tnfα的cd8 t细胞的比例(图5b,n=4);
69.图6显示肿瘤微环境中免疫细胞的比例,其中图6a为cd8 t细胞;图6b为cd4 t细胞;图6c为dc细胞;图6d为髓源抑制性细胞;图6e为调节性t细胞(n=4);图6f为肿瘤组织切片cd8抗体染色结果(n=3);
70.图7显示肿瘤微环境中免疫细胞组分中的单细胞分析结果,其中图7a为tsne聚类结果;图7b为免疫细胞所占的比例;
71.图8显示双重异源疫苗治疗表达外源抗原的黑色素瘤细胞b16f10的效果,其中图8a为治疗流程图;图8b为肿瘤体积;图8c为小鼠存活时间;图8d为肿瘤浸润性cd8 t细胞的比例(n=4);
72.图9显示双重异源疫苗用于治疗结直肠癌的效果,其中图9a为表达外源抗原的结直肠癌细胞系mc38-gfp的构建图谱;图9b为肿瘤治疗流程图;图9c为截止到第18天的肿瘤体积;图9d为肿瘤体积;图9e为小鼠存活时间(n=8);
73.图10使用双重异源疫苗策略治疗表达外源抗原的结直肠癌,在肿瘤接种后第20天取小鼠脾脏,分别以lama4,sd,mrpl18、mitgb1,mlama4,i2刺激,用elispot检测分泌ifnγ的细胞的数目的斑点图和统计图,10a图为elispot检测脾脏细胞中分泌ifnγ的细胞的数目的斑点图,前两列为对照组,后两列为疫苗组,刺激细胞使用的抗原分别为lama4,sd,mrpl18、mitgb1,mlama4,i2;10b、10c、10d、10e分别为图10a中的统计结果;10b图以lama4刺激,10c图以mrpl18刺激,10d图以mlama4刺激,10e图以trp2 i2刺激;10f-10i图为使用双重异源疫苗策略治疗表达外源抗原的结直肠癌,在肿瘤接种后第20天取小鼠淋巴结,分别以lama4,sd,mrpl18、mlama4刺激,用elispot检测分泌ifnγ的细胞的数目的统计图(n=4);
74.图11显示gp100突变抗原的免疫反应对gp100的交叉免疫反应,其中图11a为gp100及突变抗原自身的ifnγ反应(n=4),图11b为突变抗原对gp100的交叉免疫反应(n=4);
75.图12显示异源双重免疫策略抑制小鼠肿瘤生长,其中图12a和图12b分别为双重异源免疫策略刺激产生的ifnγ 和ifnγ tnfα 的cd8 t细胞的比例(n=4);图12c和12d分别为治疗后肿瘤体积和小鼠生存时间。
具体实施方式
76.下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
77.下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
78.实施例1 ccl3可以提高dc疫苗免疫肿瘤抗原的t细胞免疫应答,具备佐剂的作用
79.研究表明,李斯特菌感染可以诱导il-12、il-15和ccl3等,并且这三个炎症因子都可以增强t细胞应答。为了阐明何种炎症因子起关键作用,我们比较这三种炎症因子对野生型肿瘤抗原dc疫苗加强免疫的佐剂作用,即采用dcy3-dcn4 炎症因子的策略免疫rip-mova小鼠。结果发现ccl3显著提高分泌iifnγ和tnfα的多功能性cd8 t细胞的比例(图1a和b)。
80.trp-2(酪氨酸酶相关蛋白酶2)是黑色素瘤b16f10携带的肿瘤相关抗原,其表位肽段svydffvwl(sd)为mhc i类分子递呈的多肽,sd的突变抗原i2(siydffvwl)对其有较高的交叉免疫反应。值得一提的是,trp2 sd抗原表位不仅在小鼠trp1蛋白上是完全一样的序列,人的黑色素瘤trp2蛋白上也是完全保守的,可以被人的mhc i(hla)识别,诱导人的t细胞免疫应答。我们以i2-sd负载的dc疫苗系统重复ccl3的作用的实验。发现加入ccl3的疫苗组比对照、加入il-12或者il-15的疫苗组相比显著提高了cd8 t细胞对天然肿瘤抗原sd的免疫反应(图1c和d)。
81.实施例2删除treg细胞可以提高突变抗原的交叉反应
82.调节性t(treg)细胞降低t细胞的免疫反应。我们给野生型小鼠腹腔注射250μg cd25抗体(α-cd25)清除treg细胞,同时注射同型对照抗体(iso)。腹腔注射后第4天,小鼠免疫黑色素瘤抗原gp100或其突变抗原kgp(kgprnqdwl)。我们发现gp100诱导的免疫应答在
treg细胞删除前后没有变化,但kgp诱导的对gp100的交叉免疫反应在treg细胞删除后显著升高(图2a和b)。这一实验结果表明,treg细胞删除并不能提高免疫原性低的野生型肿瘤抗原的免疫应答,但可以提高突变的肿瘤抗原或者肿瘤抗原的类似抗原对野生型肿瘤抗原的交叉反应性t细胞免疫应答。
83.实施例3双重异源肿瘤疫苗联合ctla4抗体治疗的协同作用
84.我们在双重异源疫苗的基础上,联合ctla4的抗体治疗小鼠黑色素瘤。即在每一次免疫后的第1天,腹腔注射150μg ctla4抗体,连续注射3次(图3a)。我们发现疫苗能够抑制小鼠黑色素瘤的生长并提高小鼠生存时间,但是联合ctla4治疗并没有提高疗效(图3b和c)。
85.小鼠黑色素瘤属于冷肿瘤,如预期其免疫治疗效果较差,双重异源肿瘤疫苗联合ctla4抗体治疗的协同作用也较差,说明双重异源肿瘤疫苗可能对热的肿瘤可能会更好。
86.实施例4双重异源肿瘤疫苗联合pd-1抗体治疗的协同作用
87.我们应用双重异源疫苗联合pd-1抗体治疗小鼠黑色素瘤。在每次免疫后第1天腹腔注射200μg pd-1抗体,共注射3次(图4a)。发现pd-1单独使用不能抑制黑色素瘤生长,但联合双重异源疫苗使用后具有显著的协同作用。肿瘤生长得到有效抑制,小鼠的存活时间也得以延长(图4b和c)。
88.这一研究结果表明,ctla-4和pd-1都表达在treg细胞上,但是前者主要表达在激活cd4 t细胞上,后者主要表达在激活的cd8t细胞上,而且其作用的配体也不一样,这可能是导致其抗体治疗的协同效果差别的原因之一。最新研究表明,ctla-4抗体治疗肿瘤后会通过增强cd28信号通路,反而导致肿瘤组织treg细胞增加,这与pd-1抗体治疗不同,可能也是导致ctla-4抗体治疗与pd-1抗体治疗效果不一样的原因。
89.肿瘤疫苗跟pd1联合治疗与ctla4抗体联合治疗不同,可能肿瘤疫苗跟不同的免疫检查点抑制剂的联合使用效果有差异,可能与免疫检查点分子本身作用机制或者肿瘤类型有关。因此,有必要根据各种免疫检查点抑制剂作用特点和肿瘤类型选择合适联合治疗组合。
90.实施例5双重异源肿瘤疫苗提高肿瘤抗原特异性t细胞的免疫应答水平
91.我们使用双重异源疫苗联合pd-1抗体治疗荷瘤小鼠,肿瘤接种后第20天,取小鼠脾脏细胞以肿瘤抗原trp2sd刺激,通过ifnγelispot实验和细胞因子染色实验发现,小鼠脾脏中分泌ifnγ的细胞(图5a),以及分泌ifnγ和tnfα的多功性能的cd8 t细胞的数量显著多于未免疫的对照组(图5b和c)。
92.实施例6双重异源肿瘤疫苗改变肿瘤微环境中免疫细胞的组成,降低肿瘤微环境免疫抑制作用
93.经过双重异源疫苗以及pd-1抗体治疗的荷瘤小鼠,在肿瘤接种后第20天,取小鼠肿瘤组织,分析肿瘤浸润性cd45 的免疫细胞的组成。发现,cd8 t细胞、cd4 t细胞和dc细胞的比例在疫苗治疗组显著升高(图6a、b、c和f)。髓系来源的抑制性细胞(mdsc)在疫苗治疗组显著降低(图6d)。有趣的是,在联合pd-1治疗后,treg细胞的比例进一步降低(图6e)。mdsc和treg细胞都是重要的免疫抑制细胞,因此这些研究结果说明新型的肿瘤疫苗免疫策略可以通过降低肿瘤微环境的免疫抑制作用,而增强抗肿瘤特异性t细胞应答;同时说明,双重异源肿瘤疫苗可以跟降低mdsc和treg细胞的免疫治疗药物联合作用提高抗肿瘤免疫
力。
94.实施例7单细胞测序分析肿瘤微环境中免疫细胞的组成
95.为了进一步研究双重异源疫苗对肿瘤微环境的影响,我们在使用双重异源疫苗治疗荷瘤小鼠后,分选cd45 的免疫细胞,使用单细胞测序的大数据分析方法研究免疫细胞的组分。
96.我们发现,肿瘤浸润性免疫细胞主要包括、cd8 t细胞、cd4 t细胞、b细胞、单核细胞、dc、巨噬细胞、nk细胞、treg(图7a)。在疫苗治疗后,cd4 t细胞、dc细胞、nk细胞的比例升高,b细胞、单核细胞、treg的比例明显降低(图7b)。单细胞分析结果也显示,新型的肿瘤疫苗免疫策略可以改善肿瘤微环境;也同时说明,其它可以升高cd4 t细胞、dc细胞、nk细胞的比例和功能的免疫治疗技术可以与肿瘤疫苗联合应用,潜在提高肿瘤疫苗的疗效。如tigit抗体就可以增强nk细胞的功能和比例。
97.实施例8双重异源肿瘤疫苗可以提高肿瘤新抗原对野生型肿瘤抗原的交叉反应性,用于开发广谱性肿瘤疫苗
98.mlama4是来自小鼠肉瘤细胞系的mhc i类分子递呈的新抗原,其对应的天然肿瘤抗原是lama4。mitgb1是来自小鼠肉瘤细胞系的mhc ii类分子递呈的新抗原,其对应的天然肿瘤抗原是itgb1。我们构建了表达mitgb1,lama4和绿色荧光蛋白gfp的黑色素瘤细胞系,b16-gfp,并接种野生型小鼠。在肿瘤接种后第7天,我们使用dc负载mlama4治疗,第10天和第13天使用dc负载lama4并联合使用ccl3进行连续治疗两次,观察记录肿瘤生长情况(图8a)。我们发现疫苗治疗组肿瘤生长显著延迟,小鼠的存活时间也延长(图8b和c),并且在小鼠的肿瘤组织中,我们检测到有更多的cd8 t淋巴细胞浸润(图8d)。
99.实施例9结合肿瘤新抗原对野生型肿瘤抗原的交叉反应性和双重异源疫苗策略,可以用于治疗直肠癌
100.mitgb1 y710(tysvgyneaivhvve)和mlama4(vgfnfrtl)都是从小鼠肉瘤细胞系鉴定到的肿瘤新抗原,前者可以被mhc-ii提呈诱导cd4 t细胞应答,后者可以被mhc-i提呈诱导cd8 t细胞应答。mc38是小鼠结肠癌细胞系,可以在c57bl/6小鼠上成瘤。为了研究肿瘤新抗原是否可以像肿瘤相关抗原一样用于广谱性肿瘤疫苗,我们构建了表达mitgb1抗原表位、野生型lama4肿瘤抗原表位(ggfnfrtl)、肿瘤相关抗原trp2 sd(svydffvwl)抗原表位和绿色荧光蛋白gfp的结直肠癌系,即mc38-gfp肿瘤细胞(图9a)。我将该细胞系接种在野生型c57bl/6小鼠上等接种7天成瘤后使用dc负载mlama4肿瘤疫苗治疗,第10天和第13天使用dc负载lama4肿瘤疫苗并联合使用ccl3进行连续治疗两次(vac组)。此外,在肿瘤接种后第7天,我们使用dc负载mlama4肿瘤疫苗治疗,在第10天和第13天使用cd40抗体加poly(i:c)加lama4肿瘤疫苗的策略连续治疗两次(α-cd40 poly(i:c)组),观察肿瘤治疗效果(图9b)。我们发现,vac组肿瘤生长显著延缓,小鼠的存活时间得到延长(图9d和e)。这表明双重异源疫苗适用于结直肠癌。我们还发现α-cd40 poly(i:c)组,肿瘤生长得到极大抑制,其效果好于vac组,这表明双重异源疫苗加强免疫阶段可以使用增强t细胞反应的佐剂代替dc ccl3的策略(图9c)。以上数据说明,可以利用肿瘤新抗原与其野生型肿瘤抗原的交叉反应性,结合双重异源免疫的增效策略,可以开发针对广泛表达的野生型肿瘤抗原的广谱性肿瘤疫苗。此外,这种广谱性疫苗可以利用多种佐剂组合进一步增强其抗肿瘤免疫应答,并且除了pd-1抗体外,其它免疫增强抗体如ctla-4、cd40等抗体也可以用于联合治疗,提高肿瘤的疗效。
101.实施例10双重异源免疫的肿瘤疫苗策略,可以诱导非疫苗成分的抗原表位的t细胞免疫应答,放大免疫反应
102.我们使用双重异源免疫策略治疗表达外源抗原的结直肠癌,在肿瘤接种后第20天取小鼠脾脏和淋巴结细胞,分别以lama4、sd,mrpl18、mitgb1,mlama4,i2刺激,用elispot检测分泌ifnγ的细胞的数目(图10a-e)。我们发现疫苗免疫组,以lama4以及mlama4刺激后,分泌ifnγ的细胞的数目显著增多,表明疫苗免疫后脾脏细胞对lama4的免疫反应增强。另外我们发现,脾脏细胞对于没有免疫的抗原,如sd、mrpl18(结直肠癌mc38自身携带的新抗原),mitgb1的免疫反应也得以增强。表明结直肠癌细胞暴露出隐藏表位,进一步诱导非疫苗成分的肿瘤抗原的t细胞免疫应答,放大抗肿瘤免疫反应,即导致机体发生表位扩展。在淋巴结中我们同样检测到sd和mrpl18特异性的t细胞免疫反应(图10f-i)。这些研究结果表明,双重异源免疫的肿瘤疫苗策略,可以诱导非疫苗成分的抗原表位的t细胞免疫应答,放大免疫反应,诱导表位扩展。
103.实施例11肿瘤相关抗原gp100的相似抗原可以诱导对天然肿瘤抗原gp100的交叉免疫反应
104.gp100蛋白是黑色素瘤高表达的肿瘤相关抗原,gp100egs抗原表位(egsrnqdwl)是黑色素瘤b16f10的另一个被mhc i类分子递呈的肿瘤多肽,其所诱导的免疫反应较低。为了研究抗原表位优化能否提高对野生型egs抗原表位的t细胞免疫应答,我们采用猴子gp100相似抗原表位kgp(kgprnqdwl)、人的gp100相似抗原表位(kvp)(kvprnqdwl)、egs表位的第二个氨基酸突变的a2抗原表位(easrnqdwl)、人的gp100相似抗原表位kvp的第二个氨基酸突变的kv抗原表位(kvsrnqdwl)以及egs第三位突变的p3抗原表位(egprnqdwl)作为突变优化后的小鼠egs抗原表位,并研究了这些多肽诱导的cd8 t细胞的反应,以及对gp100egs的交叉反应能力。我们发现kgp和a2可诱导较强的cd8 t细胞的反应(图11a),其中kgp可诱导对gp100的较强的交叉反应(图11b)。这一系列实验结果表明,野生型肿瘤相关抗原可以通过突变优化提高t细胞免疫应答及其对野生型肿瘤相关抗原的交叉反应性,开发肿瘤相关抗原表达的癌症类型的广谱性肿瘤疫苗。
105.实施例12双重异源肿瘤疫苗免疫策略适用于开发针对gp100肿瘤相关抗原的广谱性肿瘤疫苗
106.我们使用kgp-gp100系统测试了双重异源疫苗策略,发现首先使用突变肿瘤抗原kgp免疫然后使用天然肿瘤抗原gp100免疫并联合炎症因子ccl3的策略提高了分泌ifnγ和tnfα的多功能性cd8 t细胞的比例(图12a和b),并且肿瘤抑制实验表明异源双重免疫策略抑制了黑色素瘤生长,并在一定程度提高小鼠的生存时间(图12c和d)。进一步说明,双重异源肿瘤疫苗免疫策略适用于开发针对肿瘤相关抗原的广谱性肿瘤疫苗。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。