一种cho细胞宿主蛋白残留量检测方法
技术领域
1.本发明涉及生物蛋白的质量控制领域,具体涉及一种cho细胞宿主蛋白残留量检测样品处理及检测方法。
背景技术:
2.许多抗体、疫苗或蛋白类药物的制备主要是通过生物体系合成,其中cho细胞(中国仓鼠卵巢细胞)由于表达的蛋白最接近于天然蛋白分子、产物胞外分泌但很少分泌自身内源蛋白,对目标蛋白分离纯化工作十分有利,是目前被广泛使用的工程细胞具有表达遗传背景清楚、表达系统完善稳定、蛋白表达水平较高等优势。尽管采用多种方式进行纯化,但是cho细胞仍然会有少量蛋白残留在生物制品的半成品和成品中,例如cho细胞中残留的宿主蛋白(hcp)作为人类自身系统的外源蛋白,可能会在不同程度上引发机体的免疫应答,最终导致过敏反应或其他不良反应。因此需要建立合适的检测hcp的方法来监控最终生物制品或半成品的质量。
3.elisa是目前应用最广泛的hcp检测方法。该方法相对简单,精良度好,方便设定控制范围和建立技术规范。目前已经有多种商品化的elisa试剂盒可以用于hcp的检测,还可以通过自制多克隆抗体进行检测。虽然目前的检测方法给hcp的检测原理和方法提供了一种通行的指引,但是很少有人关注到检测样品处理对检测结果的影响,申请人发现如果检测样品处理不当,可能影响hcp的检测效果,如回收率、准确性、精密度等。
技术实现要素:
4.本发明为了解决现有技术中hcp检测的缺陷,提供了一种回收率高、准确度和精密度好的cho细胞宿主蛋白(hcp)残留量的elisa检测方法,包括:
5.1)配制含有表面活性剂的待测蛋白样品溶液;
6.2)通过elisa对步骤1)所述的样品溶液进行hcp残留量检测。
7.其中,所述表面活性剂选自吐温20或吐温80。在一些优选实施例中,所述表面活性剂的浓度为0.75-1.2wt%。在一些优选的实施例中,所述表面活性剂的浓度为0.83-1wt%。在一个具体的实施方案中,所述表面活性剂的浓度为0.83wt%。
8.其中所述蛋白为具有生物学会活性及临床应用价值的目标蛋白,所述蛋白可以为本领域已知的抗体、蛋白或多肽产品,也可以是本领域技术人员根据已知的生物学方法进行构建以及通过cho细胞生产获得的蛋白。在一个具体的实施例中,本发明所述的蛋白为康柏西普,具有如seq id no:1所述的氨基酸序列。
9.在一些优选实施例中,本发明所述的蛋白样品溶液的浓度为0.92mg/ml-1.38mg/ml,优选1mg/ml。
10.在一个具体的实施方案中,本发明所述的检测方法,步骤1)中所述的样品溶液采用缓冲溶液进行配制,其中所述缓冲液型号为:cygnus i028-100。
11.在一个具体的实施方案中,本发明所述的检测方法,步骤2)中,将步骤1)所述的样
品溶液加入碱性磷酸酶标记的hcp抗体中,形成抗原-抗体复合物,孵育后然后加入显色液进行显色,405nm(测定波长)/492nm(参比波长)读数,通过hcp标准曲线计算待测样品溶液中的hcp含量。
12.在一个具体的实施方案中,显色液为对-硝基苯磷酸酯。
13.在一个具体的实施方案中,本发明所述的检测方法包括:
14.1)利用cygnus i028-100缓冲溶液配制含0.83wt%吐温20或吐温80的蛋白样品溶液,其中蛋白浓度为1mg/ml;
15.2)将步骤1)所述的样品溶液加入碱性磷酸酶标记的hcp抗体中,形成抗原-抗体复合物,孵育后然后加入显色液进行显色,405nm(测定波长)/492nm(参比波长)读数,通过hcp标准曲线计算待测样品溶液中的hcp含量。
16.在步骤2)中,可通过常用的商购elisa试剂盒,并按照试剂盒的操作步骤或进行适当调整后对样品溶液进行检测,常用的elisa试剂盒型号例如:cygnus f015 cho hcp、cygnus cm015 cho hcp或cygnus f550 cho hcp。
17.本发明的技术效果在于通过大量的实验摸索提供了一种专属性强、准确度高、重复性好的cho细胞宿主蛋白残留量检测方法,对蛋白的质量控制具有重要意义。
具体实施方式
18.本发明通过以下实施例对本发明的内容作进一步的详细说明,并不能用于限制本发明的保护范围。
19.本技术所用试剂及仪器:
20.cho hcp elisa kit(cygnus,cat:f015)
21.样品稀释液(cygnus,cat:i028)
22.二硫苏糖醇(ge,17-1318-01)
23.碘乙酰氨(sigma,v900335-25g)
24.异丙醇(fisher,cat:a451-4)
25.氯化钠(成都市科龙化工试剂厂)
26.tritonx-100(sigma,x100-100ml)
27.tcep-hcl(sigma,cat:c4706-10g)
28.tween-20(j.t.baker,cat:4116-04)
29.tween-80(sigma,cat:p1754-25ml)
30.仪器设备
31.酶标仪(spectraxmax i3x)
32.实施例1专属性实验
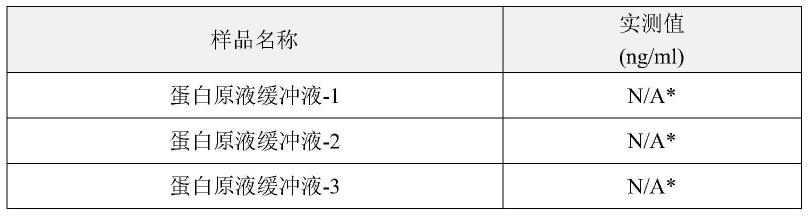
33.取康柏西普蛋白原液缓冲液(自制,不含康柏西普蛋白,辅料含有柠檬酸、蔗糖、精氨酸),采用样品稀释液1(cygnus,cat:i028)稀释3.3倍,按试剂盒(cygnus,cat:f015)操作步骤进行cho细胞蛋白含量检测,具体为:取200μl稀释后的蛋白原液缓冲液加入400μl碱性磷酸酶标记的cho hcp抗体,形成捕获抗原-抗体复合物,混匀后,25℃静置2h;静置后,200μl/孔,25℃500rpm孵育2h;洗板后加入对-硝基苯磷酸酯(pnpp)显色基底200μl/孔,室温避光静置孵育90-110min;tris缓冲液洗涤除去未反应的物质后,405nm(测定波长)/492nm(参
比波长)读数,根据protein a标准曲线计算protein a含量。做3个平行样品,结果如表1。
34.hcp标准曲线制备:取hcp标准品,用试剂盒样品稀释液1(cygnus,cat:i028)稀释至250ng/ml、75ng/ml、20ng/ml、4ng/ml、1ng/ml、0ng/ml;然后按照上述试剂盒操作步骤,测定不同浓度下hcp标准品在405nm(测定波长)/492nm(参比波长)读数,并制定hcp标准曲线。
35.表1
[0036][0037]
实验结果显示,康柏西普蛋白原液缓冲液3个平行样品的检测结果均为未检出,表明蛋白原液缓冲液对方法无明显干扰。
[0038]
实施例2稀释缓冲液摸索
[0039]
缓冲液配制
[0040]
缓冲液1:试剂盒样品稀释液(cygnus,cat:i028);
[0041]
缓冲液2:5%tritonx-100,超纯水配制;
[0042]
缓冲液3:1m nacl,超纯水配制,加入10%异丙醇;
[0043]
缓冲液4:50mm tris缓冲液,250mm arg-hcl,1m nacl,ph 8.0,超纯水配制。
[0044]
检测过程
[0045]
分别取适量上述缓冲液,加入缓冲液1,接着加入康柏西普原液(自制,蛋白具有如序列1所述的氨基酸序列,浓度为10.9mg/ml,辅料含有柠檬酸、精氨酸、蔗糖,ph为7.5-8.3)或原液缓冲液,再加入hcp蛋白标准品后获得蛋白样品溶液(2.7mg/ml或0mg/ml);按如实施例1中的试剂盒操作步骤进行hcp含量检测(根据标准曲线计算hcp含量),并按下式计算hcp加标回收率:
[0046][0047]
其中:
[0048]
原液加标检测值为康柏西普原液加入hcp标准品后经检测计算得到的hcp含量(浓度);
[0049]
原液检测值为康柏西普原液(未加入hcp标准品)经检测计算得到的hcp含量(浓度);
[0050]
理论加标量为加入的hcp标准品浓度。
[0051]
结果如表2。
[0052]
表2
[0053][0054][0055]
以上数据可以看出,采用缓冲液1的缓冲体系,康柏西普蛋白中添加cho细胞蛋白(host cell protein,hcp)标准品加标回收率为61.2%,低于80%,但是不含康柏西普蛋白的hcp加标回收率在95.9%。推测可能是康柏西普蛋白与cho细胞蛋白之间具有相互作用,导致cho细胞蛋白加标回收率偏低。
[0056]
实施例3稀释缓冲液摸索
[0057]
缓冲液配制
[0058]
缓冲液1:试剂盒样品稀释液cygnus,cat:i028;
[0059]
缓冲液5:5%tritonx-100,超纯水配制;
[0060]
缓冲液6:1m nacl,超纯水配制,10%异丙醇;
[0061]
缓冲液7:50mm tris,25mm nacl,5mm edta,1m arg-hcl,超纯水配制,ph 8.5。
[0062]
检测过程
[0063]
分别取适量上述缓冲液,加入缓冲液1,接着加入稀释康柏西普原液(10.9mg/ml)或原液缓冲液,再加入hcp标准品获得蛋白样品溶液(3.3mg/ml或0mg/ml);其中一组样品,用缓冲液1稀释后,再添加25mm dtt室温静置10min,再添加25mm iam室温静置10min;按如实施例1中的试剂盒操作步骤进行hcp含量检测(根据标准曲线计算hcp含量),并考察cho蛋白加标回收率。
[0064]
结果如表3。
[0065]
表3
[0066][0067][0068]
首先,从实施例2和实施例3中蛋白浓度分别为2.7mg/ml和3.3mg/ml的结果(回收率分别为61.2%、31.3%)可以看出,蛋白浓度对检测结果产生影响。其次,添加了表面活性剂0.3%tritonx-100(不含康柏西普)的样品加标回收率为98.2%,说明该配方不影响试剂盒抗原抗体结合,且在康柏西普蛋白浓度3.3mg/ml时的加标回收率为60.3%,明显优于其他配方的缓冲液,表明表明活性剂可能可以通过调节抗原抗体反应而影响检测结果。
[0069]
实施例4蛋白浓度摸索
[0070]
分别采用缓冲液1(cygnus,cat:i028),稀释康柏西普蛋白原液(11.0mg/ml),加入hcp标准品,使康柏西普蛋白浓度分别为2.75mg/ml、1.83mg/ml、1.38mg/ml、1.10mg/ml、0.92mg/ml、0.78mg/ml,再按如实施例1中的试剂盒操作步骤进行hcp含量检测。结果如表4所示。
[0071]
表4
[0072][0073][0074]
上述结果表明,采用缓冲液1将康柏西普原液稀释至10~12倍,即蛋白浓度0.92mg/ml~1.10mg/ml,hcp加标回收率较优。
[0075]
实施例5
[0076]
缓冲液配制
[0077]
缓冲液8:5%tritonx-100,用缓冲液1(cygnus,cat:i028)配制;
[0078]
缓冲液9:5%tritonx-100,超纯水配置,其中含有30%异丙醇;
[0079]
缓冲液10:5%tween-20,用缓冲液1配制;
[0080]
缓冲液11:6%tween-80,用缓冲液1配制。
[0081]
检测过程
[0082]
分别取上述缓冲液50μl,加入缓冲液1,加入康柏西普原液(22.0mg/ml),加入hcp标准品,使康柏西普蛋白终浓度为1.0mg/ml,样品溶液总体积300μl;再按如实施例1中的试剂盒操作步骤进行hcp含量检测。考察加标回收率,结果见表5。
[0083]
表5
[0084][0085]
从表5实验结果可以看出,含有0.83%tritonx-100的样品溶液加标回收率超过130%,加入0.83%tween-20和tween-80表明活性剂的加标回收率分别为91.2%和106.6%。
[0086]
实施例6重复性和准确度验证
[0087]
采用缓冲液1(cygnus,cat:i028)将康柏西普原液(22.0mg/ml)预稀释至3mg/ml,继续加入缓冲液1,加入tween-80,加入不同浓度的hcp标准品,使康柏西普浓度为1.0mg/ml,含有1%tween-80,样品溶液总体积300μl;再从中取200μl加入400μl碱性磷酸酶标记的hcp抗体,混匀后,25℃静置2h;静置后,200μl/孔,25℃500rpm孵育2h;洗版后加入pnpp显色基底200μl/孔,室温避光静置孵育100min;405nm(测定波长)/492nm(参比波长)读数。其中,pnpp显色液使用前,置于室温避光平衡1h,加标回收率及rsd结果见表6。
[0088]
表6
[0089][0090]
实验结果显示,不同hcp加标浓度样品回收率在93%~123%范围内,各浓度3个平行样品rsd在1%~5%范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。