一种crgd修饰的阳离子脂质体及其核酸复合物以及在抗肿瘤方面的应用
技术领域
1.本发明涉及基因治疗药物技术领域,特别涉及一种crgd修饰的阳离子脂质体及其核酸复合物以及在抗肿瘤方面的应用。
背景技术:
2.2020年,乳腺癌以发病数第一成全球第一大常见癌症,它同时也是女性第二大致死因素。乳腺癌具有高度异质性,其治疗手段的选择和疗效高度依赖于乳腺癌的分子分型。临床上,乳腺癌的治疗以药物治疗(化疗和内分泌治疗)为主,但药物治疗不可避免耐药的发生,耐药通常导致疾病复发、肿瘤转移和恶性程度加深,因此,对于乳腺癌的临床治疗亟须新的治疗手段,如基因治疗。发现乳腺癌易感基因或生物标志物或可为乳腺癌提供新的基因治疗靶点。
3.one cut domain family member 2(onecut 2),也被称为oc2,是一个新发现的onecut转录因子家族成员,其通过与特定的dna序列结合从而调控靶基因的表达。从1999年oc2的发现至2020年,oc2的异常表达逐渐被证明参与了多种癌症的发展进程。前列腺癌、胃癌、结肠癌、肾透明细胞癌、脑癌和肺癌等恶性肿瘤中均存在oc2的异常表达并与不良的临床结果显著相关,这表明它可能在侵袭性癌症中发挥更广泛的作用,但还需要进一步的研究以充分了解oc2在肿瘤异质性和肿瘤进化中的作用。作为转录因子,oc2广泛调控与细胞增殖、迁移、粘附、分化和细胞物质代谢相关的蛋白表达,但其在乳腺癌中所起的作用还不够明晰,需要进一步的研究以明确oc2能否作为乳腺癌治疗的新靶点。
4.rna干扰(rna interference,rnai)是一种由双链rna介导的序列特异性的转录后基因沉默机制,是基因治疗的重要手段之一。与化疗相比,基于rnai的治疗具有功能机制确切、潜力大、基因沉默机制特异性高等优点。在癌症治疗中使用rnai可以靶向参与肿瘤进展的各种细胞通路的多个基因,并可为特定的患者开发个性化药物。然而,基因治疗属于典型的技术驱动行业,它的临床转化高度受限于递送系统的研发。
5.脂质体是目前在临床上使用最多的非病毒载体之一,已被证明是一种安全有效的递送系统。然而,未添加任何修饰的脂质体在体内的运输不具有选择性,一般通过肿瘤的渗透与滞留增强效应(enhanced and penetration effect,epr)使其蓄积在肿瘤部位,即使仅有不超过1%的药物实现了在肿瘤内的蓄积。但由于肿瘤异质性,epr效应并不普遍适用于所有的癌症患者。因此,为增强脂质体在肿瘤内的分布,靶向脂质体技术已被广泛用于抗癌药物的载体的修饰。通过在脂质体表面添加特定配体修饰,可以实现其靶向特定细胞的能力。乳腺癌细胞和肿瘤新生血管的内皮细胞高表达整合素,整合素特异识别精氨酸-甘氨酸-天冬氨酸(arg-gly-asp,rgd)三肽序列,而crgd是c(rgdfk)环肽,crgd具有更强的穿透细胞的能力。
技术实现要素:
6.本发明的第一个目的在于克服现有技术的缺点与不足,提供一种crgd修饰的阳离子脂质体。
7.本发明的第二个目的在于提供所述crgd修饰的阳离子脂质体的制备方法。
8.本发明的第三个目的在于提供所述crgd修饰的阳离子脂质体的制备药物载体中的应用。
9.本发明的第四个目的在于提供一种crgd修饰的阳离子脂质体核酸类药物制剂。
10.本发明的第五个目的在于提供所述crgd修饰的阳离子脂质体核酸类药物制剂的制备方法。
11.本发明的目的通过下述技术方案实现:
12.一种crgd修饰的阳离子脂质体,包括阳离子脂质、中性辅助脂质、聚乙二醇的衍生物和crgd修饰的聚乙二醇化脂质。
13.所述的阳离子脂质为二油酰丙基氯化三甲铵(dotma)、(2,3-二油酰基-丙基)-三甲胺(dotap)、氨基甲酰基胆固醇(dc-chol)和双十二烷基二甲基溴化铵(ddab)中的至少一种;优选为(2,3-二油酰基-丙基)-三甲胺。
14.所述的中性辅助脂质为胆固醇(chol)、二油酰基磷脂酰乙醇胺(dope)和二油酰磷脂酰胆碱(dopc)中的至少一种;优选为胆固醇。
15.所述的聚乙二醇(peg)的分子量为500~3000;优选为2000。
16.所述的聚乙二醇的衍生物优选为1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000(dmg-peg2000)。
17.所述的crgd修饰的聚乙二醇化脂质为二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-环肽(dspe-peg2000-crgd)。
18.所述的阳离子脂质、中性辅助脂质、聚乙二醇的衍生物和crgd修饰的聚乙二醇化脂质的摩尔比为50:42:1.8~2:6;优选为50:42:2:6。
19.所述的crgd修饰的阳离子脂质体主要以阳离子脂质和中性辅助脂质为材料制成的具有磷脂双分子层的囊泡,引入了聚乙二醇的衍生物和crgd配体分别进行聚乙二醇化和crgd修饰,实现其在体内的长循环和肿瘤靶向性。
20.所述的crgd修饰的阳离子脂质体的制备方法,可以为薄膜分散法、逆向蒸发法、乙醇注入法和冷冻干燥法;优选为冷冻干燥法或乙醇注入法;更优选为用有机溶剂溶解,采用冷冻干燥法制备;具体包括如下步骤:
21.(1)将阳离子脂质、中性辅助脂质、聚乙二醇的衍生物和crgd修饰的聚乙二醇化脂质加入有机溶剂中,水浴超声下使其充分混合均匀,得到脂质体油相溶液;
22.(2)往步骤(1)中得到的脂质体油相溶液中加入蔗糖溶液,混合均匀,得到脂质体混悬液;
23.(3)将步骤(2)中得到的脂质体混悬液进行冷冻干燥,得到脂质体冻干粉;
24.(4)往步骤(3)中得到的脂质体冻干粉中加水混合均匀进行水化,然后将水化好的脂质体用脂质体挤出仪挤出,得到crgd修饰的阳离子脂质体。
25.步骤(1)中所述的阳离子脂质、中性辅助脂质、聚乙二醇的衍生物和crgd修饰的聚乙二醇化脂质的摩尔比为50:42:1.8~2:6;优选为50:42:2:6。
26.步骤(1)中所述的有机溶剂为氯仿、甲醇和叔丁醇中的至少一种;优选为叔丁醇、或氯仿和甲醇的混合液;更优选为叔丁醇。
27.步骤(1)中所述的脂质体油相溶液中阳离子脂质、中性辅助脂质、聚乙二醇的衍生物和crgd修饰的聚乙二醇化脂质的浓度均为1~5mg/ml;优选为1mg/ml。
28.步骤(2)中所述的蔗糖溶液的浓度优选为15mg/ml。
29.步骤(2)中所述的蔗糖的添加量为按其在所述体系的质量百分比7.5%添加计算。
30.步骤(2)中所述的混合均匀为采用涡旋振荡的方式混合均匀;优选为涡旋振荡20s使其混合均匀。
31.步骤(3)中所述的预冻的条件为:先在-80℃超低温中预冻12h,然后在-80℃、小于0.07mbar条件下冷冻干燥72h。
32.步骤(4)中所述的水优选为无菌超纯水。
33.步骤(4)中所述的水的用量(水化体积)按实际需要添加,一般为小于原冻干前脂质体混悬液的体积,且在冻干所用的冻干瓶中,冻干前脂质体混悬液的体积一般小于或等于冻干瓶体积的1/5,具体为:以10ml冻干瓶为例,当冻干瓶中脂质体混悬液的体积小于或等于2ml时,冻干后,再加水进行水化时的水化体积约为150~500μl(优选为300μl)。
34.步骤(4)中所述的脂质体挤出仪优选为脂质体挤出仪le-1。
35.步骤(4)中所述的挤出的条件为:依次经400nm和200nm的聚碳酸酯膜挤出;优选为依次经400nm和200nm的聚碳酸酯膜挤出11次以上。
36.所述的crgd修饰的阳离子脂质体的制备药物载体和/或抗肿瘤药物中的应用。
37.所述的药物载体为基因治疗递送载体;优选为乳腺癌基因治疗的递送载体。
38.所述的药物载体及抗肿瘤药物中药物为核酸类药物;进一步优选为shrna类药物;再进一步优选为oc2 shrna质粒,本发明提供的shrna为靶向沉默乳腺癌细胞oc2的shrna质粒,通过本发明提供的脂质体递送至肿瘤细胞,在胞内沉默oc2后实现抑制乳腺癌细胞增殖并引发肿瘤细胞凋亡的目的。
39.所述的肿瘤优选为高表达整合素的乳腺癌、卵巢癌、脑癌或前列腺癌;更优选为乳腺癌。
40.一种crgd修饰的阳离子脂质体核酸复合物(即核酸类药物制剂),含有上述crgd修饰的阳离子脂质体和核酸类药物。
41.所述的核酸类药物为shrna;优选为能够靶向沉默oc2基因表达的shrna(oc2 shrna质粒)。
42.所述的oc2 shrna质粒中的shrna序列如下所示:
43.sense:5
’‑
gccagctggaagaaatcaaca-3’;
44.anti-sense:5
’‑
tgttgatttcttccagctggc-3’。
45.所述的核酸类药物和crgd修饰的阳离子脂质体的氮磷比(n/p)为1:2~4;优选为1:4。
46.所述的crgd修饰的阳离子脂质体核酸复合物还可以含有冻干保护剂。
47.所述的冻干保护剂为蔗糖。
48.所述的蔗糖的添加量为按其在所述体系的质量百分比7.5%添加计算。
49.所述的crgd修饰的阳离子脂质体核酸复合物的制备方法,包括如下步骤:将上述
crgd修饰的阳离子脂质体和核酸类药物混合均匀,室温孵育,得到crgd修饰的阳离子脂质体核酸复合物。
50.所述的室温孵育的时间优选为25min左右。
51.所述的crgd修饰的阳离子脂质体核酸复合物在制备抗肿瘤药物中的应用。
52.所述的肿瘤优选为高表达整合素的乳腺癌、卵巢癌、脑癌、前列腺癌;更优选为乳腺癌。
53.本发明相对于现有技术具有如下的优点及效果:
54.(1)本发明提供了一种靶向整合素受体的阳离子脂质体,该阳离子脂质体是一种经crgd修饰的核酸纳米递送系统,能特异识别肿瘤细胞和新生血管内皮细胞上的整合素受体,通过其crgd配体与整合素受体通过特异性配体-受体相互作用增强脂质体对肿瘤细胞的识别能力和特异性相互作用,具备肿瘤靶向性。
55.(2)本发明中的阳离子脂质体通过简易的冻干再水化法制备,该法在工业生产上易于放大和规模化生产,制备的阳离子脂质体易于储存和运输。
56.(3)本发明中的通过配体crgd修饰特异靶向肿瘤细胞和肿瘤新生血管内皮细胞的阳离子脂质体,以包装oc2 shrna表达质粒实现靶向乳腺癌细胞并引发乳腺癌细胞凋亡的目的,即阳离子脂质体能够有效包封oc2 shrna表达质粒,在体内外能高效介导基因转染并抑制肿瘤生长,具有作为乳腺癌基因治疗的递送载体的潜力。
57.(4)长循环脂质体虽然可以在一定程度上降低血浆蛋白对脂质体的非特异性吸附,但其进入细胞的能力同时也被大大削弱,本发明通过在脂质体配方中引入crgd,显著增强了脂质体对肿瘤细胞的靶向性和转染效率,在体内,其能够将包载的基因药物oc2 shrna递送至肿瘤部位并发挥抗肿瘤效果。
58.(5)本发明提供的脂质体制备方法工艺简单,所述的冷冻干燥法保护了靶向多肽crgd的活性,制备的冻干产品稳定性好、储存时间长,适合工业化批量生产。
59.(6)本发明还提供了脂质体核酸药物制剂的制备方法,将上述阳离子脂质体与核酸室温孵育即可形成稳定的脂质体核酸复合物,其具备靶向肿瘤的能力,可用于实体肿瘤的基因治疗,如用于高表达整合素的乳腺癌、卵巢癌、脑癌、前列腺癌的靶向治疗。
附图说明
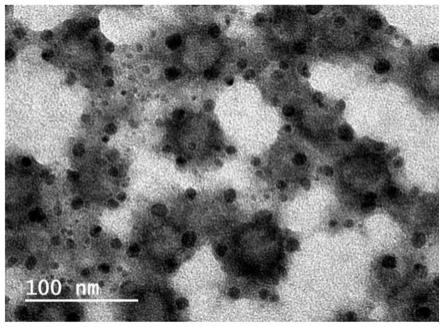
60.图1是crgd-cl的透射电镜图。
61.图2是crgd-cl的流体动力学粒径分布图。
62.图3是crgd-cl/oc2 shrna在n/p为0.5、1、2、3、4下的1%琼脂糖凝胶阻滞实验结果图。
63.图4是mcf-7细胞与fitc标记的cl和crgd-cl孵育1、2和4h后的fitc荧光强度图。
64.图5是crgd-cl和cl转染mcf-7 48h后的荧光图。
65.图6是治疗20天后收集的各组小鼠肿瘤图像。
66.图7是尾静脉注射crgd-cl至皮下移植瘤裸鼠模型3、5和8h后的活体成像图。
具体实施方式
67.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
68.本发明实施例中涉及的阳离子脂质dotap(化学名称:(2,3-二油酰基-丙基)-三甲基铵-氯盐,又称:(2,3-二油酰基-丙基)-三甲胺;cas号为132172-61-3)、聚乙二醇的衍生物peg2000-dmg(化学名称:1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000,cas:160743-62-4)以及crgd修饰的聚乙二醇化脂质dspe-peg2000-crgd(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-环肽,cas:#r-9995,ruixibio)可通过常规市售获得。
69.本发明实施例中涉及的oc2 shrna质粒,为先通过设计oc2特异性shrna,再委托吉玛基因公司合成得到;其中,
70.oc2特异性shrna序列如下:
71.sense:5
’‑
gccagctggaagaaatcaaca-3’;
72.anti-sense:5
’‑
tgttgatttcttccagctggc-3’。
73.实施例1阳离子脂质体(cl)和crgd修饰阳离子脂质体(crgd-cl)的制备
74.(1)从-20℃冰箱中取出dotap、胆固醇、peg2000-dmg和dspe-peg2000-crgd,称量各组分分别溶于叔丁醇中(室温下通过超声波清洗机水浴超声20min左右至溶质充分溶解即可),形成各脂质的油相储液(1mg/ml)。为保证制备环境的无菌无尘,接下来的操作均应在超净工作台内进行。
75.(2)用移液枪吸取344μl dotap储液、162μl胆固醇储液、49μl peg2000-dmg储液和197μl dspe-peg2000-crgd储液于同一支5ml离心管中(dotap:胆固醇:peg2000-dmg:dspe-peg2000-crgd=50:42:2:6,摩尔比)形成crgd-cl的油相溶液,以及344μl dotap储液、162μl胆固醇储液、198μl peg2000-dmg储液(dotap:胆固醇:peg2000-dmg=50:42:8,摩尔比)于同一支5ml离心管中形成cl的油相溶液。
76.(3)分别往步骤(2)制备的脂质体油相溶液中加入等体积的含15%(质量分数)蔗糖的无菌水溶液,立即涡旋振荡20s,形成脂质体混悬液。
77.(4)分别将脂质体混悬液转移至10ml冻干瓶中,盖上胶塞,在-80℃超低温冰箱中快速预冻12h后,迅速转移至-80℃冻干机隔板上,在小于0.07mbar条件下进行升华干燥72h,得到脂质体冻干粉。
78.(5)分别将无菌除尘超纯水(300ul)加入脂质体冻干粉中,立即摇匀,利用脂质体挤出仪le-1将水化好的脂质体依次经400nm和200nm聚碳酸酯膜挤出11次,即可得crgd修饰阳离子脂质体(crgd-cl)和阳离子脂质体(cl),密封并避光保存于4℃。
79.透射电镜观察crgd-cl形貌为圆球形的小单室脂质体且粒径分散均一(图1),经动态光散射法测得crgd-cl的粒径为125nm,粒径分布狭窄(图2)。
80.实施例2染料标记的crgd-cl和cl的制备
81.(1)从-20℃冰箱中取出dotap、胆固醇、peg2000-dmg和dspe-peg2000-crgd,称量各组分分别溶于叔丁醇中(室温下通过超声波清洗机水浴超声20min左右至溶质充分溶解即可),形成各脂质的油相储液(1mg/ml)。为保证制备环境的无菌无尘,接下来的操作均应在超净工作台内进行。
82.(2)用移液枪吸取344μl dotap储液、162μl胆固醇储液、44.5μl peg2000-dmg储液
和197μl dspe-peg2000-crgd储液于同一支5ml离心管中(dotap:胆固醇:peg2000-dmg:dspe-peg2000-crgd=50:42:1.8:6,摩尔比)形成crgd-cl的油相溶液,以及344μl dotap储液、162μl胆固醇储液、193μl peg2000-dmg储液(dotap:胆固醇:peg2000-dmg=50:42:7.8,摩尔比)于同一支5ml离心管中形成cl的油相溶液。向制备的脂质体油相溶液中加入等体积的含15%(质量分数)蔗糖的无菌水溶液,立即涡旋振荡20s,形成脂质体混悬液。
83.(3)分别将脂质体混悬液转移至10ml棕色冻干瓶中,避光加入0.002μmol fitc-dhpe(cas:货号:#f362,invitrogen)或0.002μmol dir lodide(cas:货号:#cd4672,coolaber),立即摇匀,形成fitc或dir标记的脂质体。
84.(4)分别在-80℃超低温冰箱中快速预冻12h后,迅速转移至-80℃冻干机隔板上,在小于0.07mbar条件下进行升华干燥72h,得到crgd-cl和cl冻干粉。
85.(5)分别将无菌除尘超纯水(300ul)加入crgd-cl和cl冻干粉中,立即摇匀,利用脂质体挤出仪le-1将水化好的脂质体依次经400nm和200nm聚碳酸酯膜挤出11次,即可得染料标记的crgd-cl和cl(fitc-cl、fitc-crgd-cl、dir-cl、dir-crgd-cl),密封并避光保存于4℃。
86.实施例3 crgd-cl对oc2 shrna质粒的包封能力测定
87.包封率是评价脂质体作为基因递送载体的重要指标之一。本实施例首先配制crgd-cl/oc2 shrna复合物,将实施例1中制备的crgd-cl均分成5份,每份60μl,分别加入64、32、16、10.7、8μg oc2 shrna质粒,混匀,室温孵育25min即得n/p比(氮磷比)为0.5、1、2、3和4的脂质体核酸复合物。直接取不同n/p比下的crgd-cl/oc2 shrna加样于1%琼脂糖凝胶中,电泳条件:110v,45min,电泳结束后于凝胶成像仪下拍照。
88.结果如图3所示:n/p比》2时crgd-cl就能完全阻滞dna在凝胶中的迁移,说明crgd-cl能够与dna形成稳定的复合物。
89.实施例4包载oc2 shrna的crgd-cl的体外靶向性评价
90.实验前一天将mcf-7细胞(中国科学院上海生物化学与细胞生物学研究所)接种在12孔板中,每孔8
×
104个细胞,过夜培养至其贴壁。弃去旧培养基,pbs缓冲液洗涤细胞2次,加入1ml opti-mem培养基,各孔分别加入实施例2中制备的含有fitc标记的cl(fitc-cl)和crgd-cl(fitc-crgd-cl)(各18μl),分别孵育1、2和4h。孵育结束后用pbs缓冲液洗涤细胞3次,每次5min,以去除游离的fitc-cl或fitc-crgd-cl。用0.25%胰酶消化细胞,离心收集细胞,最后用100μl pbs缓冲液重悬细胞,使用流式细胞仪检测fitc荧光强度,实验结束后用flow jo 7.6.1软件定量相应的荧光强度(每孔三个平行)。
91.结果如图4所示:与cl相比,crgd修饰显著增强了脂质体与肿瘤细胞的结合能力。
92.实施例5包载oc2 shrna的crgd-cl的转染效率测定
93.实验前一天将mcf-7细胞以8
×
104个/孔的密度接种于12孔板中,于37℃湿润培养箱(5%co2)内培养过夜。待细胞长至70~80%汇合度时,弃去旧培养基,用pbs缓冲液吹洗2次后,加入800μl opti-mem培养基,置于培养箱内待转染。分别用100μl opti-mem培养基稀释18μl实施例1中制备的crgd-cl或cl以及1.5μg oc2 shrna质粒于两支ep管中,将质粒稀释液加入到脂质体稀释液中,小心吹吸混匀,室温孵育25min,得到脂质体/oc2 shrna质粒复合物(cl/oc2 shrna、crgd-cl/oc2 shrna)。从37℃培养箱内取出待转染的细胞板,分别将上述制备的脂质体/oc2 shrna质粒复合物逐滴均匀加入至各孔(上述制备的200μl脂质
体/oc2 shrna质粒复合物),水平摇晃混匀。置于37℃,5%培养箱内培养48h。消化并离心收集细胞后,用100μl pbs重悬细胞,使用流式细胞仪检测细胞的gfp表达水平(oc2 shrna质粒含gfp表达标签),并用flow jo 7.6.1软件定量相应的荧光强度(每孔三个平行)。
94.结果如图5所示:与未添加靶向修饰的cl相比,脂质体中引入crgd修饰显著增强其在肿瘤细胞的转染效率。
95.实施例6包载oc2 shrna的crgd-cl在体内的抗肿瘤效果评价
96.首先,构建mcf-7皮下移植瘤裸鼠模型(balb/c裸鼠)(spf级balb/c-nu,4周龄,18g,雌性,小鼠购于北京华阜康生物科技有限公司)。将生长状态良好、处于对数生长期的mcf-7细胞用胰酶消化后,用适量生理盐水重悬,以3.0
×
106个/100μl的细胞密度接种到balb/c裸鼠的右下肢腋下,每天观察肿瘤大小。当小鼠的肿瘤体积达50~100mm3时开始给药。将荷瘤裸鼠随机分为2组,每组5只,分别尾静脉注射pbs缓冲液或crgd-cl/oc2 shrna复合物(实施例5制备),crgd-cl/oc2 shrna复合物以oc2 shrna和脂质体表示的注入量分别为2mg/kg和35mg/kg。根据肿瘤生长情况,每隔2天或1天给药1次,治疗期为20天,共给药9次。第20天时,将小鼠安乐死,剥离肿瘤,拍照。
97.结果如图6所示:与pbs组比较,经20天的给药治疗,crgd-cl/oc2 shrna组的肿瘤增长受到明显的抑制。
98.实施例7 crgd-cl在体内的肿瘤靶向性评价
99.构建mcf-7皮下移植瘤裸鼠模型:将生长状态良好、处于对数生长期的mcf-7细胞用胰酶消化后,用适量生理盐水重悬,以3.0
×
106个/100μl的细胞密度接种到balb/c裸鼠(spf级balb/c-nu,4周龄,18g,雌性,购于北京华阜康生物科技有限公司)的右下肢腋下,每天观察肿瘤大小。待肿瘤体积增长至200mm3左右时,尾静脉注射100μl实施例2中制备的dir-crgd-cl。在注射后3、5和8h的时间间隔点将小鼠经腹腔注射阿弗丁麻醉后,利用小动物活体成像仪(ivis lumina series iii)对小鼠进行荧光成像。
100.结果如图7所示:crgd-cl在5h时即可到达肿瘤部位。
101.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。