1.本发明属于医药技术领域,涉及一种阿霉素前药抗肿瘤制剂,具体涉及ph敏感型阿霉素-脂肪酸前药及其白蛋白纳米粒的构建,以及其在药物递送系统中的应用。
背景技术:
2.癌症严重威胁全人类的健康。在过去的几十年里,随着医疗技术的进步,癌症的治疗方法得到了迅速发展,包括手术疗法、化学疗法、放射疗法、免疫疗法等。化疗是肿瘤治疗的最常用方式。化疗通过一种或多种化学药物干扰dna合成、影响dna结构和功能、干扰rna转录过程、干扰蛋白质合成等方式杀死肿瘤细胞或者控制肿瘤细胞的分裂。阿霉素是一种广谱抗肿瘤抗生素,细胞毒性较强,对多种肿瘤均有抑制作用。但其毒副作用较大,尤其是其严重的心脏毒性,限制了其在临床上的应用。同时,小分子药物在血液循环过程中易被机体代谢清除,加上肿瘤组织附近特殊的环境,如错综复杂的血管网络结构、致密的间质结构以及较高的间质压力,使得药物很难到达肿瘤细胞内。这些限制条件影响了阿霉素的抗肿瘤效果。如何改善阿霉素的不良理化性质,提高治疗效果并减轻毒副作用是亟待解决的制剂学难题。
3.近年来,研究者开发了不同类型的阿霉素药物递送系统,其中最成功的代表是阿霉素脂质体,其可以有效改善阿霉素的药代动力学和体内分布,并且降低阿霉素的心脏毒性。但阿霉素脂质体即使采用主动载药的方式,载药量也仅有11%,且给药后发生肢端红斑的风险显著提高,严重影响治疗效果和患者生活质量。因此,亟需构建新型高效低毒的阿霉素纳米制剂。
4.在众多的血清蛋白中,白蛋白占总蛋白含量的50%,是药物的理想载体。由于肿瘤的快速生长,肿瘤血管的完整性并不佳,普通的纳米制剂易于从肿瘤血管中渗透出来,同时也难以通过淋巴途径重回体循环,这种增强的渗透性和保留效应被称为高渗透长滞留效应。白蛋白在血液中的浓度约为40mg/ml,在肿瘤间质的浓度约为14mg/ml,在此浓度差的条件下,白蛋白通过高渗透长滞留效应,显现出良好的肿瘤被动靶向性。此外,肿瘤细胞的快速代谢和生长需要主动摄取大量的细胞外蛋白(包括白蛋白)作为氨基酸的来源,这也使得白蛋白能够有效在肿瘤组织中蓄积。但是,阿霉素与白蛋白结合能力较差,形成的纳米粒载药量和包封率较低,粒径大小不均匀。前药策略可以通过巧妙的结构修饰来改善化疗药物的不良性质,例如提高药物的溶解性,增强靶向性,降低药物的毒副作用等。白蛋白具有7个脂肪酸结合位点,因此,阿霉素-脂肪酸前药有望增强阿霉素与白蛋白的亲和力。不同碳链长度的脂肪酸与白蛋白的亲和力不同,因此会对前药白蛋白纳米粒的制剂学性质、体内命运和抗肿瘤效果产生影响。
技术实现要素:
5.为了克服现有技术的缺陷,本发明所解决的技术问题是提供一种ph敏感型阿霉素-脂肪酸前药及其白蛋白纳米粒,该纳米粒具有载药量高、包封率高、稳定性好、毒副作用
低和细胞内智能释药的效果。本发明的ph敏感型阿霉素-脂肪酸前药及其白蛋白纳米粒明显降低了阿霉素的毒副作用,提高了阿霉素的耐受剂量。
6.本发明设计和合成了含有不同碳链长度脂肪酸的ph敏感型阿霉素前药,并制备了前药白蛋白纳米粒。实验结果表明,脂肪酸的碳链长度会影响前药白蛋白纳米粒的制剂学性质、药效学和安全性,为开发基于白蛋白的抗肿瘤药物递送系统提供新的策略和更多的选择,满足临床中对高效-低毒化疗制剂的迫切需求。
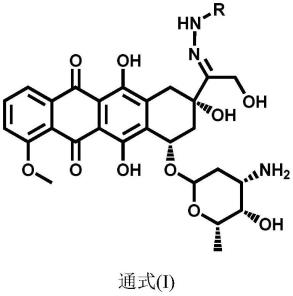
7.为了实现上述目的,本发明提供了如通式(i)所示的ph敏感型腙键桥连的阿霉素-脂肪酸前药或其药学上可接受的盐:
[0008][0009]
其中,r为c
10-c
14
饱和或不饱和脂肪酸中不含羧羟基的部分。
[0010]
进一步地,所述的r为正癸酸、肉豆蔻酸、肉豆蔻油酸、十四碳二烯酸中不含羧羟基的部分。
[0011]
具体地,所述ph敏感型阿霉素-脂肪酸前药或其药学上可接受的盐为:
[0012][0013]
进一步地,本发明提供了所述的ph敏感型阿霉素-脂肪酸前药的合成方法,包括如下步骤:
[0014]
(1)将脂肪酸、甲醇、浓硫酸回流,得到脂肪酸甲酯;
[0015]
(2)步骤(1)的脂肪酸甲酯与水合肼回流,得到脂肪酸酰肼中间产物;
[0016]
(3)将脂肪酸酰肼中间产物与盐酸阿霉素羰基反应,重结晶得ph敏感型阿霉素-脂肪酸前药,其产率在90%以上,纯度在99%以上。
[0017]
其中,步骤(1)中所述的脂肪酸为c
10-c
14
饱和脂肪酸或不饱和脂肪酸;
[0018]
脂肪酸(摩尔):甲醇(毫升):浓硫酸(毫升)的比例为:1:2000-5000:20-100,优选为1:2000-4000:40-60;
[0019]
步骤(2)中,脂肪酸甲酯与水合肼的摩尔比为1:5-30,优选为1:10-20;
[0020]
步骤(3)中,盐酸阿霉素:脂肪酸酰肼中间产物的摩尔比为1:1-5;重结晶溶剂为丙酮。
[0021]
进一步地,所述的ph敏感型阿霉素-脂肪酸前药的制备方法包括如下步骤:
[0022]
(1)合成脂肪酸甲酯:将脂肪酸和甲醇加入到圆底烧瓶中,加入浓硫酸,回流12-18小时;浓缩回收甲醇,将反应液倒入冰水中,再加入饱和碳酸氢钠,中和至中性,萃取,浓缩即得;
[0023]
其中,萃取的溶剂为乙酸乙酯或二氯甲烷。
[0024]
所述的脂肪酸为c
10-c
14
饱和脂肪酸或不饱和脂肪酸。
[0025]
(2)合成脂肪酸酰肼:将步骤(1)脂肪酸甲酯溶解于乙醇中,加入水合肼,回流8-12小时。浓缩后,将反应液倒入水中,析出固体,抽滤即得脂肪酸酰肼中间产物。
[0026]
(3)将盐酸阿霉素、冰醋酸和脂肪酸酰肼中间产物溶解于无水甲醇中,50-60℃冷
凝回流反应12-24小时,浓缩,重结晶,抽滤即得。
[0027]
其中,冰醋酸:无水甲醇的体积比为1:100-200。
[0028]
其中,盐酸阿霉素:脂肪酸酰肼中间产物的摩尔比为1:1-5。
[0029]
其中,重结晶溶剂为丙酮。
[0030][0031]
其中,r为c
9-c
13
烷基。
[0032]
本发明中所述的阿霉素-正癸酸前药与阿霉素-肉豆蔻酸前药,由于正癸酸、肉豆蔻酸自身理化性质良好,极性较大,溶解度较好,重结晶后纯度可达99.4%。而碳链更长的阿霉素-硬脂酸前药,重结晶后纯度只有85%,仍需通过制备液相分离纯化得到终产物。
[0033]
本发明提供ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒,所述的白蛋白纳米粒包含ph敏感型阿霉素-脂肪酸前药和血清白蛋白,ph敏感型阿霉素-脂肪酸前药与血清白蛋白的质量比为1:0.1-10,优选为1:1-3。
[0034]
进一步地,本发明还提供了所述的系列ph敏感型阿霉素-脂肪酸前药的白蛋白纳米粒的制备方法,所述的白蛋白纳米粒采用超声法或高压均质法制备。
[0035]
具体地,本发明提供的ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的制备方法如下:
[0036]
称取ph敏感型阿霉素-脂肪酸前药,用甲醇将其溶解,搅拌下,将所得溶液缓缓滴加到血清白蛋白水溶液中,再超声或高压均质形成均匀的白蛋白纳米粒。在25-30℃的条件下减压蒸馏除去纳米制剂中的有机溶剂。
[0037]
所述的血清白蛋白为牛血清白蛋白或人血清白蛋白。
[0038]
所述的血清白蛋白的浓度为0.1mg/ml-100mg/ml。
[0039]
所述的ph敏感型阿霉素-脂肪酸前药与血清白蛋白的质量比为1:0.1-10,优选为1:1-3。
[0040]
所述超声方法中,超声的功率为30-100w,优选为60-80w。
[0041]
所述超声的时间为1-5分钟,优选为2-3分钟。
[0042]
所述高压均质法中,压力为500-1000bar,优选为600-800bar。
[0043]
所述高压均质法中,时间为10-30分钟,优选为10-15分钟。
[0044]
本发明中,由于前药在体内必须转化成母药才能发挥药效功能,因此我们构建了腙键桥连的ph敏感型阿霉素-脂肪酸前药及其白蛋白纳米粒,纳米粒被肿瘤细胞摄取后,会首先进入内涵体和溶酶体,前药分子在内涵体和溶酶体的低ph条件下,腙键发生断裂,前药转化为母药,发挥其抗肿瘤作用,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效-低毒化疗制剂的迫切需求。
[0045]
本发明具有以下有益效果:(1)设计合成了不同碳链长度的ph敏感型阿霉素-脂肪酸前药,合成方法简单易行,通过重结晶即可使产物纯度达到99%以上;(2)制备了阿霉素-脂肪酸前药白蛋白纳米粒,制备方法简单易行,具有较高的载药量和包封率;(3)考察了前药白蛋白纳米粒在制剂学性质、细胞毒性、药动学和药效学等方面的差异,试验结果表明,阿霉素-脂肪酸前药白蛋白纳米粒均具有良好的抗肿瘤效果,并能有效降低阿霉素的毒副作用,且不同结构的前药抗肿瘤活性和安全性也各不相同,为开发高效-低毒化疗制剂提供了新的策略。
附图说明
[0046]
图1为本发明实施例1的阿霉素-正癸酸前药(dox-c
10
)的质谱图。
[0047]
图2为本发明实施例1的阿霉素-正癸酸前药(dox-c
10
)的1hnmr谱图。
[0048]
图3为本发明实施例2的阿霉素-肉豆蔻酸前药(dox-c
14
)的质谱图。
[0049]
图4为本发明实施例2的阿霉素-肉豆蔻酸前药(dox-c
14
)的1hnmr谱图。
[0050]
图5为本发明实施例3的阿霉素-硬脂酸前药(dox-c
18
)的质谱图。
[0051]
图6为本发明实施例3的阿霉素-硬脂酸前药(dox-c
18
)的1hnmr谱图。
[0052]
图7为本发明实施例6的阿霉素-脂肪酸前药白蛋白纳米粒的4t1细胞毒性图。
[0053]
图8为本发明实施例7的阿霉素-脂肪酸前药白蛋白纳米粒的前药血药浓度-时间曲线图。
[0054]
图9为本发明实施例7的阿霉素-脂肪酸前药白蛋白纳米粒的母药血药浓度-时间曲线图。
[0055]
图10为本发明实施例7的阿霉素-脂肪酸前药白蛋白纳米粒的前药母药加和血药浓度-时间曲线图。
[0056]
图11为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠肿瘤体积变化图。
[0057]
**:p《0.01;***:p《0.001;****:p《0.0001。
[0058]
图12为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠肿瘤对比图。
[0059]
图13为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠体重变化图。
[0060]
**:p《0.01;***:p《0.001;****:p《0.0001。
[0061]
图14为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中肿瘤负荷图。
[0062]
**:p《0.01;***:p《0.001;ns:无显著性差异。
[0063]
图15为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中脾重图。
[0064]
**:p《0.01;***:p《0.001;ns:无显著性差异。
[0065]
图16为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中脾对比图。
[0066]
图17为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中
白细胞、淋巴细胞、单核细胞及中性粒细胞对比图。
[0067]
图18为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中淋巴细胞、单核细胞及中性粒细胞百分比对比图。
[0068]
图19为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中红细胞、血红蛋白及相关参数对比图。
[0069]
图20为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中血小板、血小板体积、血小板分布及血小板压积对比图。
[0070]
图21为本发明实施例8的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中谷草转氨酶、谷丙转氨酶、尿素氮及肌酐对比图。
[0071]
图22为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠肿瘤体积变化图。
[0072]
**:p《0.01;***:p《0.001;****:p《0.0001。
[0073]
图23为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠肿瘤对比图。
[0074]
图24为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中小鼠体重变化图。
[0075]
**:p《0.01;***:p《0.001;****:p《0.0001;ns:无显著性差异。
[0076]
图25为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中肿瘤负荷图。
[0077]
*:p《0.05;****:p《0.0001。
[0078]
图26为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中生存曲线图。
[0079]
图27为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中白细胞、淋巴细胞、单核细胞及中性粒细胞对比图。
[0080]
图28为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中淋巴细胞、单核细胞及中性粒细胞百分比对比图。
[0081]
图29为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中红细胞、血红蛋白及相关参数对比图。
[0082]
图30为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中血小板、血小板体积、血小板分布及血小板压积对比图。
[0083]
图31为本发明实施例9的阿霉素-脂肪酸前药白蛋白纳米粒的在体抗肿瘤实验中谷草转氨酶、谷丙转氨酶、尿素氮及肌酐对比图。
具体实施方式
[0084]
下面通过实施例的方式进一步说明本发明,但并不因此将发明限制在所述的实施例范围之中。
[0085]
实施例1:阿霉素-正癸酸(dox-c
10
)前药的合成
[0086]
将17.2g正癸酸(0.1mol)和300ml甲醇加入到圆底烧瓶中,加入5ml浓硫酸,回流12小时;浓缩后,将反应液倒入冰水中,加入饱和碳酸氢钠,中和至中性,乙酸乙酯萃取,浓缩
得到脂肪酸甲酯中间产物;将中间产物溶解于乙醇中,加入100ml水合肼,回流12小时;浓缩后,将反应液倒入水中,析出固体,抽滤后得到脂肪酸酰肼中间产物;将5.8g盐酸阿霉素(0.01mol)、10ml冰醋酸和3.6g脂肪酸酰肼中间产物(0.015mol)溶解于无水甲醇中,50-60℃回流反应12小时,浓缩,以丙酮为溶剂重结晶,抽滤。收率:94%,纯度:99%。
[0087]
采用质谱法以及核磁共振氢谱法来确定实施例1中前药的结构,结果如图1、2所示,波谱解析结果如下:
[0088]1h nmr(600mhz,dmso-d6)δ14.12(s,1h,13-oh),13.34(s,1h,6-oh),10.29(s,1h,11
’‑
nh),7.95-7.91(m,2h,h-1,h-2),7.85(s,3h,21-nh3),7.70-7.64(m,1h,h-18),5.77(s,1h,9-oh),5.56(s,1h,10
’‑
oh),5.47(s,1h,19-h),5.30(d,j=3.6hz,1h,22-oh),4.93(t,j=7.2hz,1h,h-21),4.48-4.35(m,2h,h-10’),4.02(q,j=6.7hz,1h,23-h),3.98(s,3h,17-och3),3.57(s,1h,h-11),3.36(s,1h,h-22),3.33(m,1h,h-8),2.72(d,j=17.2hz,1h,h-8),2.21-2.10(m,3h,h-10,h-12’),2.06(ddd,j=15.2,8.4,6.8hz,1h,h-10),1.89(td,j=12.7,3.8hz,1h,h-20),1.74(dd,j=12.5,4.5hz,1h,h-20),1.51(t,j=7.2hz,2h,h-13’),1.27-1.22(m,12h,h-(13
’‑
19’)),1.17(d,j=6.5hz,3h,h-23),0.86(t,j=7.0hz,3h,h-20’).ms(esi)m/z for c
37h49
n3o
11
h[m h]
:712.34327.
[0089]
实施例2:阿霉素-肉豆蔻酸(dox-c
14
)前药的合成
[0090]
将22.8g肉豆蔻酸(0.1mol)和300ml甲醇加入到圆底烧瓶中,加入5ml浓硫酸,回流12小时;浓缩后,将反应液倒入冰水中,加入饱和碳酸氢钠,中和至中性,乙酸乙酯萃取,浓缩得到脂肪酸甲酯中间产物;将中间产物溶解于乙醇中,加入100ml水合肼,回流12小时;浓缩后,将反应液倒入水中,析出固体,抽滤后得到脂肪酸酰肼中间产物;将5.8g盐酸阿霉素(0.01mol)、10ml冰醋酸和3.6g脂肪酸酰肼中间产物(0.015mol)溶解于无水甲醇中,50-60℃回流反应12小时,浓缩,以丙酮为溶剂重结晶,抽滤。收率:92%,纯度:99%。
[0091]
采用质谱法以及核磁共振氢谱法来确定实施例2中前药的结构,结果如图3、4所示,波谱解析结果如下:
[0092]1h nmr(600mhz,dmso-d6)δ10.29(s,1h,11
’‑
nh),7.94-7.90(m,2h,h-1,h-2),7.69-7.64(m,1h,h-18),5.76(t,j=4.9hz,1h,9-oh),5.53(s,1h,10
’‑
oh),5.42(d,j=6.0hz,1h,19-h),5.30(d,j=3.6hz,1h,22-oh),4.92(t,j=7.1hz,1h,h-21),4.46-4.36(m,2h,h-10’),4.03(q,j=6.7hz,1h,23-h),3.98(s,3h,17-och3),3.55(s,1h,h-11),3.36(s,1h,h-22),3.33(s,1h,h-8),2.73(d,j=17.2hz,1h,h-8),2.21-2.10(m,2h,h-10,h-12’),2.06(ddd,j=15.2,8.3,6.7hz,1h,h-10),1.87(dt,j=12.8,6.4hz,1h,h-20),1.73(dd,j=12.3,4.4hz,1h,h-20),1.35-0.92(m,26h,h-(12
’‑
23’),h-23),0.85(t,j=7.0hz,3h,h-24’).ms(esi)m/zfor c
41h57
n3o
11
h[m h]
:768.40531.
[0093]
实施例3:阿霉素-硬脂酸(dox-c
18
)前药的合成
[0094]
将28.0g硬脂酸(0.1mol)和300ml甲醇加入到圆底烧瓶中,加入5ml浓硫酸,回流12小时;浓缩后,将反应液倒入冰水中,加入饱和碳酸氢钠,中和至中性,乙酸乙酯萃取,浓缩得到脂肪酸甲酯中间产物;将中间产物溶解于乙醇中,加入100ml水合肼,回流12小时;浓缩后,将反应液倒入水中,析出固体,抽滤后得到脂肪酸酰肼中间产物;将5.8g盐酸阿霉素(0.01mol)、10ml冰醋酸和3.6g脂肪酸酰肼中间产物(0.015mol)溶解于无水甲醇中,50-60℃回流反应12小时,浓缩,以丙酮为溶剂重结晶,抽滤。收率:80%,纯度:85%。目标产物通
过制备液相色谱分离纯化,纯度99%。
[0095]
采用质谱法以及核磁共振氢谱法来确定实施例3中前药的结构,结果如图5、6所示。波谱解析结果如下:
[0096]1h nmr(600mhz,dmso-d6)δ10.31(s,1h,nh),7.89(dd,j=9.1hz,5.1hz,2h,ph-h),7.65(ddd,j=9.6hz,6.2hz and 3.2hz,1h,ph-h),5.63(s,1h,9-oh),5.58(s,1h,4
’‑
oh),5.51-5.28(s,1h,14-oh),5.28(s,1h,1
’‑
h),4.90(t,j=6.9hz,1h,7-h),4.41(q,j=14.4hz,2h,14-h),4.06-3.99(m,1h,5
’‑
h),3.97(d,j=9.8hz,3h,4-och3),3.54(s,1h,4
’‑
h),3.32(s,1h,3
’‑
h),2.73(d,j=17.2hz,1h,10-h),2.16(ddd,j=23.3hz,15.6hz and 7.5hz,2h,2
”‑
h),2.06(dd,j=15.3hz and 7.9hz,1h,8-h),2.03-1.88(m,1h,8-h),1.84(d,j=12.7hz,1h,2
’‑
h),1.68-1.57(m,1h,2
’‑
h),1.33-0.97(m,33h),0.84(t,j=7.0hz,3h,18
”‑
ch3).ms(esi)m/z for c
45h65
n3o
11
h[m h]
:824.4696.
[0097]
实施例4:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的影响因素考察
[0098]
表1阿霉素-脂肪酸前药和白蛋白在不同质量比下的粒径、粒径分布和包封率
[0099][0100]
精密称取ph敏感型阿霉素前药,用1ml的甲醇将其溶解,搅拌下,将该甲醇溶液缓缓滴加到4ml牛血清白蛋白(或人血清白蛋白和犬血清白蛋白)水溶液中,再用超声波细胞破碎仪超声形成均匀的白蛋白纳米粒,超声时间2min,超声功率60w。在25℃的条件下用旋转蒸发仪除去制剂中的有机溶剂。改变阿霉素-脂肪酸前药与白蛋白的质量比,结果如表1所示。当前药和白蛋白的质量比为1:1-3时,前药白蛋白纳米粒的粒径在50-200nm之间,粒径分布均匀;当质量比为1:2-3时,粒径、粒径分布和包封率最佳。
[0101]
实施例5:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的制备
[0102]
精密称取ph敏感型阿霉素前药4mg,用1ml的甲醇将其溶解,搅拌下,将该甲醇溶液缓缓滴加到4ml浓度为2mg/ml的牛血清白蛋白(或人血清白蛋白和犬血清白蛋白)水溶液中,使前药与白蛋白的质量比为1:2,再用超声波细胞破碎仪超声形成均匀的白蛋白纳米粒,超声时间2min,超声功率60w。在25℃的条件下用旋转蒸发仪除去纳米制剂中的有机溶剂。
[0103]
表2.ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的表征
[0104][0105]
如表2所示,阿霉素与白蛋白的亲和力差,形成的纳米粒粒径高达480nm,粒径分布高达0.6,包封率不足20%。相比之下,三种前药白蛋白纳米粒的粒径都在120nm左右,粒径分布小于0.2,包封率大于85%,成球率都在90%以上。
[0106]
实施例6:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的细胞毒性实验
[0107]
采用mtt法考察阿霉素-脂肪酸前药白蛋白纳米粒对小鼠乳腺癌(4t1)细胞的毒性。将状态良好的细胞消化,用培养液稀释至5000cells/ml,细胞吹匀后于96孔板中每孔加入细胞悬液100μl,置培养箱中孵育24小时使其贴壁。待细胞贴壁后加入阿霉素溶液剂或实施例5中制备的阿霉素-脂肪酸前药白蛋白纳米粒,并进一步孵育48小时,用未处理的细胞作为对照。孵育结束时,每孔加入20μl mtt(5mg/ml),在37℃的条件下孵育4小时。弃去培养基,每孔加入200μl dmso于振荡器上振荡10min。使用酶标仪在570nm处测定吸光度。
[0108]
细胞毒性结果如图7所示,与阿霉素溶液剂相比,前药白蛋白纳米粒的细胞毒性降低。这是因为阿霉素需要从前药纳米粒中释放出来,释药过程限制了阿霉素的细胞毒性。脂肪酸碳链长度越长,前药白蛋白纳米粒的细胞毒性越强。
[0109]
实施例7:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的药代动力学研究
[0110]
使用sd大鼠(200-250g)进行药代动力学研究。将大鼠随机分组,给药前禁食12小时,自由饮水。分别静脉注射阿霉素溶液剂以及实施例5中制备的三种阿霉素-脂肪酸前药白蛋白纳米粒。阿霉素的剂量为4mg/kg。于规定的时间点眼眶取血,分离获得血浆。通过液相色谱-质谱联用仪测定血浆中的药物浓度。
[0111]
实验结果如图8-10所示,与阿霉素溶液剂组相比,前药白蛋白纳米粒在血液中的滞留时间延长,并显著提高了阿霉素的药-时曲线下面积(auc
0-24 h
),为阿霉素的肿瘤靶向积蓄提供了保障。同时,脂肪酸碳链的长度对前药白蛋白纳米粒的药代动力学行为有显著的影响。阿霉素-正癸酸前药白蛋白纳米粒、阿霉素-肉豆蔻酸前药白蛋白纳米粒和阿霉素-硬脂酸前药白蛋白纳米粒的总体auc
0-24 h
(前药和母药的加和)分别为阿霉素溶液剂的1.37倍、5.18倍和13.73倍。
[0112]
表3.ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的药代动力学参数
[0113][0114]
实施例8:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的抗肿瘤实验
[0115]
建立4t1细胞荷瘤小鼠模型,将4t1细胞(100μl中含5
×
106个细胞)皮下接种至balb/c小鼠。当肿瘤体积长至100-150mm3左右时,将其随机分为7组(每组5只小鼠)。每隔一天尾静脉给药实施例5的阿霉素-脂肪酸前药白蛋白纳米粒,设置阿霉素溶液剂、市售盐酸阿霉素脂质体(doxil)、阿霉素马来酰亚胺前药(doxo-emch)和生理盐水为对照组,总计注射5次,剂量为等效阿霉素10mg/kg,每天测量肿瘤体积及小鼠体重。
[0116]
结果如图11-16所示,阿霉素脂质体抗肿瘤效果最好,但与生理盐水组相比,小鼠体重下降也最为明显,表现出了严重的毒副作用。阿霉素溶液剂组与doxo-emch组也具有良好的抗肿瘤效果,但是在第五次给药后,小鼠全部死亡,毒副作用非常强烈。三种前药白蛋白纳米粒都具有显著的抗肿瘤效果(图11、12)。图14荷瘤率表明,阿霉素-正癸酸前药、阿霉素-肉豆蔻酸前药与阿霉素-硬脂酸前药荷瘤率无显著性差别。但是,阿霉素-硬脂酸前药体重下降明显,而阿霉素-正癸酸前药和阿霉素-肉豆蔻酸前药组小鼠体重并未出现下降,与生理盐水组相比没有显著性差异,表明其安全性更好,毒性更低(图13)。图15-16表明,与未接瘤的正常小鼠相比,阿霉素脂质体组小鼠脾脏出现皱缩,表明其具有较强的骨髓抑制毒性,而阿霉素-正癸酸前药和阿霉素-肉豆蔻酸前药组小鼠脾脏未发生皱缩现象,表明其安全性更好。各组血常规以及肝肾功能检测结果如图17-21。可见,与碳链长度更长的阿霉素-硬脂酸前药相比,阿霉素-正癸酸前药和阿霉素-肉豆蔻酸前药白蛋白纳米粒在具有良好抗肿瘤效果的同时,具有更好的耐受性和安全性。
[0117]
实施例9:ph敏感型阿霉素-脂肪酸前药白蛋白纳米粒的抗肿瘤实验
[0118]
建立kb细胞荷瘤裸鼠模型,将kb细胞(100μl中含5
×
106个细胞)皮下接种至balb/c-nu裸鼠。当肿瘤体积长至100-150mm3左右时,将其随机分为5组(每组5只小鼠)。每隔两天尾静脉给药实施例5的阿霉素-肉豆蔻酸前药白蛋白纳米粒,设置市售盐酸阿霉素脂质体(doxil)以及生理盐水为对照组,其中生理盐水组与阿霉素-肉豆蔻酸前药白蛋白纳米粒组总计注射4次,市售盐酸阿霉素脂质体(doxil)组总计注射2次,剂量为15mg/kg与20mg/kg
(等效阿霉素15mg/kg、20mg/kg),每天测量肿瘤体积及小鼠体重。
[0119]
结果如图22-26所示,在20mg/kg的给药剂量下,阿霉素脂质体组在第八天出现死亡,第九天全部死亡,毒副作用非常强烈。在15mg/kg的给药剂量下,阿霉素脂质体组在第十天出现死亡,第十一天全部死亡(图26)。而阿霉素-肉豆蔻酸前药白蛋白纳米粒组给药四次,在15mg/kg以及20mg/kg的给药剂量下,前药白蛋白纳米粒具有显著的抗肿瘤效果(图22、23),且小鼠并未出现死亡,体重并未出现下降,与生理盐水组相比没有显著性差异,表明其安全性更好,毒性更低(图24)。各组血常规以及肝肾功能检测结果如图27-31,阿霉素-正癸酸前药和阿霉素-肉豆蔻酸前药组的白细胞和淋巴细胞等均未出现降低,均未造成明显的肝肾损伤。尤其是阿霉素-肉豆蔻酸前药白蛋白纳米粒组小鼠的白细胞和淋巴细胞等均未出现降低,表明其未发生骨髓抑制,且肝肾功能指标表明,未对肝肾造成损伤。可见,阿霉素-正癸酸前药和阿霉素-肉豆蔻酸前药组不仅具有显著的抗肿瘤效果,且毒副作用小,安全性高。而阿霉素肉豆蔻酸前药白蛋白纳米粒在具有明显抗肿瘤效果的同时,毒性最低,安全性最高。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。