1.本发明实施例涉及生物医学技术领域,尤其涉及一种血脑屏障关闭时间的确定方法、装置、电子设备及介质。
背景技术:
2.血脑屏障是脑组织与周围循环系统之间的一种生理屏障,这种结构可阻止循环系统中的有害物质进入脑组织,对于维持脑内环境稳定和中枢神经系统正常生理状态具有重要的生物学意义。同时,对于脑疾病的治疗,血脑屏障也限制大分子治疗药物进入中枢神经系统发生效用,是中枢神经系统给药的一个主要障碍。目前,在磁共振图像引导下,超声联合微泡能暂时地定点地无创地打开血脑屏障,使得药物进入脑区,提高药物作用效率。
3.虽然,磁共振引导超声开放血脑屏障技术的可行性和有效性在各种动物模型上都得到过验证,甚至在人类患者上也实现了可行性验证,但是,该技术的临床转化依然面临安全性的挑战。其中一个重要原因就是,没有有效确定血脑屏障开放后多久能够恢复,而血脑屏障的关闭时间是临床很关注的安全性问题。
技术实现要素:
4.本发明实施例提供了一种血脑屏障关闭时间的确定方法、装置、电子设备及介质,以实现对血脑屏障的关闭时间的预测。
5.第一方面,本发明实施例提供了一种血脑屏障关闭时间的确定方法,该方法包括:
6.在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱;
7.确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域;
8.针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间;
9.基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度;
10.根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间。
11.第二方面,本发明实施例还提供了一种血脑屏障关闭时间的确定装置,该装置包括:
12.磁共振图谱获取模块,用于在通过磁共振引导超声开放目标对象的目标脑部区域
的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱;
13.区域确定模块,用于确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域;
14.磁共振纵向弛豫时间确定模块,用于针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间;
15.造影剂浓度确定模块,用于基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度;
16.血脑屏障关闭时间确定模块,用于根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间。
17.第三方面,本发明实施例还提供了一种电子设备,该电子设备包括:
18.一个或多个处理器;
19.存储装置,用于存储一个或多个程序,
20.当所述一个或多个程序被所述一个或多个处理器执行,使得所述一个或多个处理器实现本发明任意实施例所提供的血脑屏障关闭时间的确定方法。
21.第四方面,本发明实施例还提供了一种计算机可读存储介质,其上存储有计算机程序,该计算机程序被处理器执行时实现本发明任意实施例所提供的血脑屏障关闭时间的确定方法。
22.本发明实施例的技术方案,在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,能够通过获取每个时刻的磁共振纵向弛豫时间图谱分别得到目标脑部区域在各个时刻的数据,然后,确定目标脑部区域的血脑屏障开放区域、与血脑屏障开放区域对应的肌肉组织区域以及与血脑屏障开放区域对应的血脑屏障闭合区域,考虑到由于造影剂在血管内的扩散效应,可以确定出与血脑屏障开放区域对应的肌肉组织区域和血脑屏障闭合区域,为准确的预测血脑屏障开放区域的恢复时间奠定基础。针对每个磁共振纵向弛豫时间图谱,分别确定血脑屏障开放区域的第一磁共振纵向弛豫时间、肌肉组织区域的第二磁共振纵向弛豫时间以及血脑屏障闭合区域的第三磁共振纵向弛豫时间,进而基于第一磁共振纵向弛豫时间确定血脑屏障开放区域的开放区域造影剂浓度,基于第二磁共振纵向弛豫时间确定肌肉组织区域的肌肉造影剂浓度,基于第三磁共振纵向弛豫时间确定血脑屏障闭合区域的闭合造影剂浓度,根据得到三个区域的造影剂浓度,最后,根据多个造影剂注射时刻对应的开放区域造影剂浓度、肌肉造影剂浓度以及闭合造影剂浓度确定血脑屏障开放区域的关闭时间。上述技术方案,通过每个造影剂时刻的磁共振纵向弛豫时间图谱,分别计算出确定出的每个各个造影剂时刻的血脑屏障开放区域、肌肉组织区域与血脑屏障闭合区
域的造影剂浓度,进而确定血脑屏障开放区域的关闭时间,解决了现有技术中无法对血脑屏障开放后恢复时间进行预测的问题,实现对血脑屏障的关闭时间的准确预测的效果。
附图说明
23.为了更加清楚地说明本发明示例性实施例的技术方案,下面对描述实施例中所需要用到的附图做一简单介绍。显然,所介绍的附图只是本发明所要描述的一部分实施例的附图,而不是全部的附图,对于本领域普通技术人员,在不付出创造性劳动的前提下,还可以根据这些附图得到其他的附图。
24.图1为本发明实施例一所提供的一种血脑屏障关闭时间的确定方法的流程示意图;
25.图2是为本发明实施例二所提供的一种血脑屏障关闭时间的确定方法的流程示意图;
26.图3是为本发明实施例二所提供的一种血脑屏障关闭时间的确定方法中获取磁共振纵向弛豫时间图谱的示意图;
27.图4是为本发明实施例二所提供的一种血脑屏障关闭时间确定方法的可选实施例的流程图;
28.图5是为本发明实施例三所提供的一种血脑屏障关闭时间的确定装置的结构示意图;
29.图6是为本发明实施例四所提供的一种电子设备的结构示意图。
具体实施方式
30.下面结合附图和实施例对本发明作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅仅用于解释本发明,而非对本发明的限定。另外还需要说明的是,为了便于描述,附图中仅示出了与本发明相关的部分而非全部结构。
31.另外还需要说明的是,为了便于描述,附图中仅示出了与本发明相关的部分而非全部内容。在更加详细地讨论示例性实施例之前应当提到的是,一些示例性实施例被描述成作为流程图描绘的处理或方法。虽然流程图将各项操作(或步骤)描述成顺序的处理,但是其中的许多操作可以被并行地、并发地或者同时实施。此外,各项操作的顺序可以被重新安排。当其操作完成时所述处理可以被终止,但是还可以具有未包括在附图中的附加步骤。所述处理可以对应于方法、函数、规程、子例程、子程序等等。
32.实施例一
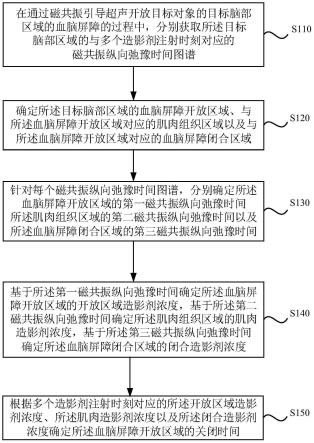
33.图1为本发明实施例一所提供的一种血脑屏障关闭时间的确定方法的流程示意图,本实施例可适用于预测血脑屏障开放后多久能够恢复的情况,该方法可以由血脑屏障关闭时间的确定装置来执行,该装置可以通过软件和/或硬件来实现,可配置于终端和/或服务器中来实现本发明实施例中的血脑屏障关闭时间的确定方法。
34.如图1所示,本实施例的方法具体可包括:
35.s110、在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前
一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱。
36.其中,目标对象可以理解为即将通过磁共振引导的超声打开血脑屏障的对象。目标脑部区域可以理解为待获取磁共振纵向弛豫时间图谱的脑部区域。该包括目标脑部区域包括但不仅限于血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域。造影剂可以理解为一种在做磁共振时为了增强影像对比效果而使用的顺磁性制剂,注射造影剂后,可以通过影像周围组织的弛豫快慢从而间接地改变组织信号的强度,增加组织或器官的对比度。
37.在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障后,可以在多个造影剂注射时刻分别向目标脑部区域注射等量的相同的造影剂。其中,每相邻两次造影剂注射对应的造影剂注射时刻之间的时间间隔可以相同也可以不同,多个造影剂注射时刻的具体注射时间以及时间间隔的具体数值在此并不做具体限定。
38.示例性地,注射造影剂的方式可以是静脉注射方式。例如具体可以是,在目标对象肢体部位的静脉注射。
39.其中,打开血脑屏障的方式可以有多种。示例性地,可以在磁共振图像的引导下,通过超声联合微泡的方式能暂时的、定点的无创的打开血脑屏障,这种方式可以控制血脑屏障的开放范围,减少对脑组织的损伤,能够容易获取血脑屏障的开放区域位置。
40.在磁共振现象中,原子核发生共振且处在高能状态,当射频脉冲停止后,迅速恢复到低能状态的现象,恢复的过程被称为弛豫过程。纵向弛豫时间通常为纵向磁化强度分量恢复到平衡状态时所需的时间,也可以用t1表示。其中,t1的大小取决于外磁场和质子与周围环境之间的相互作用(即组织的性质),是组织的固有特性,在外磁场给定后,不同组织的t1值都有相应的固定值,且存在较大差异。
41.具体的,在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,需要多次向目标脑部区域注射造影剂,并在造影剂注射的前一时刻和后一时刻分别对目标脑部区域的纵向驰豫时间图谱t1进行测量,测量方式例如可以为反转恢复技术、饱和恢复法和可变翻转角磁共振成像技术等。
42.在临床应用中,磁共振t1定量方式可以采用灌注和渗透性测量,主要使用 t1加权动态对比增强成像(dce-mri)序列来检测和表征病变和肿瘤,监测治疗,评估器官功能等。通过这些技术,能够检测由造影剂浓度变化引起的信号强度差异,以半定量的方式评估感兴趣的参数。
43.考虑到磁共振信号强度不仅反映造影剂浓度,也取决于固有的组织属性(t1, t2,和自旋密度)、成像参数(如翻转角度(fa)、重复时间(tr),回波时间(te)) 和硬件核磁共振扫描仪(例如,接收器增益),从而使得dce-mri技术的难以标准化。因此,可以采用快速准确的t1图谱测试技术可以定量描述顺磁性造影剂在分布和动态过程,通过动态测量t1可以直接定量化描述造影剂浓度的变化。
44.可选的,所述分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,包括:基于可变翻转角磁共振成像技术获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱。
45.具体的,临床磁共振应用中,可以采用如灌注和渗透性测量等将造影剂注射到目标脑部区域,而不同组织的固有特性,在外磁场给定后,不同组织的纵向弛豫时间都有相应
的固定值,且存在较大差异,因此可以根据磁共振纵向弛豫时间图谱测试技术定量的描述造影剂在不同组织中的分布和动态过程。例如可以采用可变翻转角磁共振成像技术实现快读的纵向弛豫时间定量,结合射频 b1场图谱技术对发射角空间变化进行补偿,可以在有效的采集时间内得到高精度的纵向弛豫时间图谱。
46.s120、确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域。
47.其中,血脑屏障开放区域可以理解为被磁共振引导超声打开血脑屏障的脑部区域。与血脑屏障开放区域对应的肌肉组织区域可以理解为邻近血脑屏障开放区域的肌肉组织区域。血脑屏障闭合区域可以理解为未被打开血脑屏障的脑部区域。在本发明实施例中,可选地,与血脑屏障开放区域对应的血脑屏障闭合区域可以理解为位于大脑对侧半球,且在结构上与血脑屏障开放区域对称的未被打开血脑屏障的脑部区域。其中,大脑对侧半球可以理解为与血脑屏障开放区域不同侧的脑部半球。
48.可选地,接收用户输入的用于标记确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域的标记操作,基于所述标记操作确定所述目标脑部区域的血脑屏障开放区域、所述肌肉组织区域以及所述血脑屏障闭合区域。
49.同时考虑到超声作用不可避免的对血脑屏障的开放区域附近的组织产生影响,也可以确定血脑屏障开放区域对应的肌肉组织区域。
50.s130、针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间。
51.可以理解的是,造影剂在血管内的浓度与血管信号强度成正比,造影剂注射的量越大,则血管内的造影剂浓度越高,血管信号强度越强。在造影剂浓度较高时,磁共振信号容易出现饱和的情况,在本发明实施例中,通过磁共振t1图谱计算造影剂浓度,可以有效避免磁共振信号饱和情况。
52.其中,磁共振系统有多种扫描序列可以进行t1图谱扫描。可选地,通过传统的金标准方法,执行一系列不同的反转时间t1逐个扫描,其中,各不同t1的信号强度呈现指数分布,然后,基于磁共振信号强度公式进行数学拟合,可以求出每个体素的t1值。其中,磁共振信号强度公式如下:
53.s(t)=a
·
abs(1-2
·
exp(-t/t1) exp(-tr/t1)) c
54.其中,s(t)表示利用翻转恢复磁共振成像序列,在t时刻进行翻转,测到的磁共振信号强度;a为正常情况下饱和状态的初始时刻磁共振磁化矢量信号强度; abs表示去绝对值运算;exp是指数运算符号表达式;t1表示磁共振的纵向磁豫时间;tr表示磁共振扫描序列的重复时间;c表示磁共振线圈采集的底噪平均信号。
55.可变翻转角(vfa)磁共振成像技术可以实现快读的t1定量,结合射频b1 场图谱技术对发射角空间变化进行补偿,可以在有效的采集时间内得到高精度 t1图谱。vfa技术是在不同翻转角发射下应用连续的t1加权的损毁梯度回波序列。其磁共振信号强度公式由磁共振纵向磁共振初始强度m0,组织弛豫参数t1和t2,回波时间te,重复时间tr以及翻转角α共同决定。
[0056][0057]
其中,s(α)可以表示采集到的磁共振信号强度,α可以表示磁共振射频翻转角,m0可以表示饱和状态之后的磁共振初始信号强度。
[0058]
将上述公式展开可以进一步写成一个线性方程的形式,公式如下:
[0059][0060]
其中,上述公式中的e1=exp(-tr/t1),e2=exp(-te/t2),t1表示磁共振的纵向磁豫时间,t2表示磁共振的横向弛豫时间;tr表示磁共振扫描序列的重复时间,te表示磁共振扫描序列的回波时间,tr和te是磁共振的固定扫描参数; s(α)可以表示采集到的磁共振信号强度,α可以表示磁共振射频翻转角,m0可以表示饱和状态之后的磁共振初始信号强度。
[0061]
在不同的反转角下测试得到的磁共振信号强度可以理解为一个以e1为斜率, m0(1-e1)*e2为截距的线性方程。
[0062]
在每次扫描纵向磁化达到稳态,横向磁化完全损坏且b1均匀的情况下,就可以得到t1的定量值。
[0063]
具体地,可以通过如下公式计算磁共振t1图谱的t1值:
[0064][0065]
可选地,通过采集器前的连续激发使得纵向弛豫达到饱和状态,然后进行激发采集;通过射频损毁或梯度损毁消除横向弛化残余,通过b1 mapping技术进行反转角空间均匀性补偿。
[0066]
考虑到新生血管不完整,使得注入血脑屏障的开放区域血管内的造影剂可能会扩散到周围的肌肉组织,导致血脑屏障开放区域周围的肌肉组织的纵向弛豫时间缩短,根据不同组织的固有特性,可以分别对目标脑部区域的血脑屏障的开放区域、肌肉组织区域以及血脑屏障的闭合区域进行测量,得到三个区域对应的磁共振纵向弛豫时间。
[0067]
s140、基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度。
[0068]
一般地,由于在血脑屏障完整的情况下,造影剂无法通过血脑屏障到达组织区域,因此,可以根据血脑屏障开放区域的造影剂浓度随时间的变化情况,结合与血脑屏障开放区域对应的肌肉组织区域和血脑屏障闭合区域的造影剂浓度随时间的变化情况,确定目标脑部区域的血脑屏障的开放区域。
[0069]
具体的,利用磁共振技术可以检测由造影剂浓度引起的组织信号强度的差异,根据组织信号的强度,动态测量纵向弛豫时间可以直接定量化的描述造影剂浓度的变化,从而确定第一磁共振纵向弛豫时间、第二磁共振纵向弛豫时间以及第三磁共振纵向弛豫时间对应的造影剂浓度。
[0070]
可选的,某个体素或者某个区域在注射造影剂之后的某一时刻的造影剂浓度,根据造影剂的弛豫率、未注射造影剂时该区域的第一磁共振纵向弛豫时间以及在该时刻该区
域的第一磁共振纵向弛豫时间确定。具体地,可基于如下公式确定:
[0071]
c(t)=1/r1·
(1/t1(t)-1/t
10
)
[0072]
其中,c(t)表示目标区域在t时刻的开放区域造影剂浓度,r1表示造影剂的弛豫率,t
10
表示未注射造影剂时的目标区域的第一磁共振纵向弛豫时间,t1(t) 表示t时刻的目标区域的第一磁共振纵向弛豫时间。
[0073]
在超声开放血脑屏障以及注射造影剂之前,可以对目标脑部区域进行磁共振扫描测试,得到一组磁共振定量参数基线,基于磁共振定量参数基线分别确定血脑屏障开放区域、肌肉组织区域和血脑屏障闭合区域的未注射造影剂时的第一磁共振纵向弛豫时间。
[0074]
示例性地,所述基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,包括:基于如下公式以及所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度:
[0075]cf
(t)=1/r1·
(1/t
1f
(t)-1/t
10f
)
[0076]
其中,cf(t)表示所述血脑屏障开放区域在t时刻的开放区域造影剂浓度,r1表示造影剂的弛豫率,t
10f
表示未注射造影剂时的血脑屏障开放区域的第一磁共振纵向弛豫时间,t
1f
(t)表示t时刻的血脑屏障开放区域的第一磁共振纵向弛豫时间。
[0077]
类似地,可基于如下公式以及所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度:
[0078]cm
(t)=1/r1·
(1/t
1m
(t)-1/t
10m
)
[0079]
其中,cm(t)表示所述肌肉组织区域在t时刻的开放区域造影剂浓度,r1表示造影剂的弛豫率,t
10m
表示未注射造影剂时的肌肉组织区域的第一磁共振纵向弛豫时间,t
1m
(t)表示t时刻的肌肉组织区域的第一磁共振纵向弛豫时间。
[0080]
类似地,可基于如下公式以及所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的造影剂浓度:
[0081]cc
(t)=1/r1·
(1/t
1c
(t)-1/t
10c
)
[0082]
其中,cc(t)表示所述血脑屏障闭合区域在t时刻的开放区域造影剂浓度,r1表示造影剂的弛豫率,t
10c
表示未注射造影剂时所述血脑屏障闭合区域的第一磁共振纵向弛豫时间,t
1c
(t)表示t时刻所述血脑屏障闭合区域的第一磁共振纵向弛豫时间。
[0083]
s150、根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间。
[0084]
考虑到造影剂在不同时刻,不同区域内的浓度变化的差异,以及造影剂在血管内的扩散效应,可以血脑屏障开放区域的开放区域造影剂浓度与该血脑屏障开放区域对应的血管造影剂浓度相关。其中,为了便于计算,血管造影剂浓度可以通过邻近肌肉组织区域的肌肉造影剂浓度确定。因此,可以在本发明实施例中,确定开放区域造影剂浓度时有考虑血管造影剂浓度对开放区域造影剂浓度的影响。考虑到造影剂注射到脑部区域后,即使血脑屏障未被打开,也存在一定程度的代谢和衰减,其浓度也会发生变化,因此,可以将血脑屏障闭合区域的闭合造影剂浓度作为血脑屏障开放区域是否恢复的参考标准。
[0085]
具体地,可以根据多个造影剂注射时刻血脑屏障开放区域、肌肉组织区域和血脑屏障闭合区域的造影剂浓度,分别确定在每个造影剂注射时刻在注射造影剂的前后发生的区域内造影剂浓度的跳变幅度,以及不同造影剂注射时刻之间造影剂浓度的衰减系数。进
而,基于血脑屏障开放区域、肌肉组织区域和血脑屏障闭合区域各自对应的造影剂浓度的跳变幅度和衰减系数进行血脑屏障关闭时间的预测。
[0086]
上述技术方案,通过每个造影剂时刻的磁共振纵向弛豫时间图谱,分别计算出确定出的每个各个造影剂时刻的血脑屏障开放区域、肌肉组织区域与血脑屏障闭合区域的造影剂浓度,进而确定血脑屏障开放区域的关闭时间,解决了现有技术中无法对血脑屏障开放后恢复时间进行预测的问题,实现对血脑屏障的关闭时间的准确预测的效果。
[0087]
实施例二
[0088]
图2为本发明实施例二所提供的血脑屏障关闭时间的确定方法的流程图;如图2所示,本实施例在本发明实施例中任一可选技术方案的基础上,可选地,所述根据所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间,包括:根据多个造影剂注射时刻对应的所述肌肉造影剂浓度对预先构建的肌肉造影剂浓度衰减模型进行拟合求解,得到所述肌肉造影剂浓度的衰减时间系数以及每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度;根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述衰减时间系数、所述肌肉跳变幅度对预先构建的开放区域恢复模型进行拟合求解,得到所述血脑屏障开放区域的恢复时间系数以及每个所述造影剂注射时刻下所述开放区域造影剂浓度的开放跳变幅度;基于所述闭合造影剂浓度、所述开放跳变幅度以及所述恢复时间系数确定所述血脑屏障开放区域的关闭时间。
[0089]
如图2所示,本实施例的方法具体可包括:
[0090]
s210、在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱。
[0091]
s220、确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述目标开放区域血脑屏障开放区域对应的血脑屏障闭合区域。
[0092]
s230、针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间。
[0093]
s240、基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度。
[0094]
s250、根据多个造影剂注射时刻对应的所述肌肉造影剂浓度对预先构建的肌肉造影剂浓度衰减模型进行拟合求解,得到所述肌肉造影剂浓度的衰减时间系数以及每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度。
[0095]
可选的,所述肌肉造影剂浓度衰减模型为:
[0096]cm
(t)=bp
·
e-μt
*u(t)
[0097]
其中,cm(t)表示所述肌肉组织区域在t时刻的肌肉造影剂浓度,bp表示每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,μ表示所述肌肉造影剂浓度的衰减时间系数,*表示卷积运算,u(t)表示单位输入函数。
[0098]
需要说明的是,u(t)的取值可以为0或1。在本发明实施例中,当有注射造影剂的行
为发生时,或者说,在造影剂注射时刻,u(t)的取值为1,否则,u(t)的取值为0。
[0099]
s260、根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述衰减时间系数、所述肌肉跳变幅度对预先构建的开放区域恢复模型进行拟合求解,得到所述血脑屏障开放区域的恢复时间系数以及每个所述造影剂注射时刻下所述开放区域造影剂浓度的开放跳变幅度。
[0100]
通常,血脑屏障开放在超声作用结束后即达到最大的开放程度,随后逐渐恢复。在本发明实施例中,可以假设血脑屏障开放程度是一个指数衰减过程。进一步可以通过实验数据拟合和多次造影测量求解这个衰减系数。
[0101]
具体的,血脑屏障开放区域造影剂浓度变化首先有一个聚集过程,达到峰值之后减弱。而在每次造影剂注射时,血脑屏障开放区域的造影剂浓度都具有一个冲击响应,而且该冲击响应受到单次增加注射造影剂浓度和当前血脑屏障的恢复状态相关,以及当前血管内造影剂浓度与开放区的造影浓度差影响。
[0102]
其中,所述开放区域恢复模型基于所述肌肉造影剂浓度衰减模型构建。
[0103]
可选的,开放区域恢复模型为:
[0104][0105]
其中,cf(t)表示血脑屏障开放区域在t时刻的开放区域造影剂浓度,ap表示每个所述造影剂注射时刻下所述开放区域造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,λ表示所述血脑屏障开放区域的恢复时间系数,*表示卷积运算,u(t) 表示单位输入函数,b为常数,bcm(t)表示血管造影剂浓度。
[0106]
具体地,根据多个造影剂注射时刻对应的开放区域造影剂浓度cf(t)、衰减时间系数μ、所述肌肉跳变幅度bp对开放区域恢复模型进行拟合求解,得到所述血脑屏障开放区域的恢复时间系数λ以及每个所述造影剂注射时刻下所述开放区域造影剂浓度的开放跳变幅度ap。
[0107]
s270、基于所述闭合造影剂浓度、所述开放跳变幅度以及所述恢复时间系数确定所述血脑屏障开放区域的关闭时间。
[0108]
其中,所述闭合造影剂浓度基于所述闭合造影剂浓度衰减模型确定。类似地,所述闭合造影剂浓度衰减模型也可基于指数衰减函数构建。
[0109]
可选地,所述闭合造影剂浓度衰减模型为:
[0110]cc
(t)=cp
·
e-υt
*u(t)
[0111]
其中,cc(t)表示所述肌肉组织区域在t时刻的肌肉造影剂浓度,cp表示每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,υ表示所述肌肉造影剂浓度的衰减时间系数,*表示卷积运算,u(t)表示单位输入函数。
[0112]
可选的,根据闭合造影剂浓度、开放跳变幅度以及恢复时间系数可以确定血脑屏障开放区域的关闭时间。
[0113]
具体的,基于如下公式以及所述闭合造影剂浓度、所述开放跳变幅度和所述恢复时间系数确定血脑屏障开放区域的关闭时间:
[0114]
[0115]
其中,tc表示所述血脑屏障开放区域的关闭时间,cc(t)为所述血脑屏障闭合区域在t时刻的闭合造影剂浓度,表示所述血脑屏障闭合区域在 t=tc时刻的闭合造影剂浓度,ap表示每个所述造影剂注射时刻下所述开放区域造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,λ表示所述血脑屏障开放区域的恢复时间系数。
[0116]
图3为本发明实施例二所提供的一种血脑屏障关闭时间的确定方法中获取磁共振纵向弛豫时间图谱的示意图,图4为本实施例二所提供的一种血脑屏障关闭时间确定方法的可选实施例的流程图。
[0117]
示例性地,如图3和图4所示,在磁共振引导超声开放血脑屏障之前,测试一组磁共振定量参数基线(即,qmri baseline),然后利用超声联合微泡(即, us mb)开放目标对象的血脑屏障(blood-brain barrie,bbb),并注射造影剂 (即,图3中的agent injection),在第一次血脑屏障开放后,进行第一次磁共振定量测量。其中,t1、t2、
……
、tm表示造影剂注射时刻,具体地,t1=0时刻第一次注射造影剂的时刻在t1=0时刻前后分别进行磁共振t1动态测试qmribase1和qmri measure1,以获得t1时刻对应的所述血脑屏障开放区域、肌肉组织区域以及血脑屏障闭合区域的t1磁共振纵向弛豫时间t1。在t2时刻注射与t1时刻等量的相同的造影剂,然后,进行第二次磁共振t1动态测试qmri base2和 qmri measure2,获得t2时刻对应的所述血脑屏障开放区域、肌肉组织区域以及血脑屏障闭合区域的t1磁共振纵向弛豫时间t1。重复以上测量步骤,在不同时刻共注射m次造影剂,进行m组磁共振t1动态测试qmri base(m)和qmrimeasure(m),并获得tm时刻对应的t1磁共振纵向弛豫时间t1。其中,m的取值为的正整数,具体不做限定。根据多次的测量得到的磁共振t1图谱,可以获得目标脑部区域中的血脑屏障开放区域、肌肉组织区域以及血脑屏障闭合区域的造影剂浓度。在此基础上,根据多个造影剂注射时刻对应的肌肉造影剂浓度对预先构建的肌肉造影剂浓度衰减模型进行拟合求解,可以得到肌肉造影剂浓度的衰减时间系数以及每个所述造影剂注射时刻下肌肉造影剂浓度的肌肉跳变幅度。然后,根据多个造影剂注射时刻对应的开放区域造影剂浓度、衰减时间系数、所述肌肉跳变幅度对预先构建的开放区域恢复模型进行拟合求解,得到血脑屏障开放区域的恢复时间系数以及每个造影剂注射时刻下开放区域造影剂浓度的开放跳变幅度。最后,结合血脑屏障闭合区域的闭合造影剂浓度、血脑屏障开放区域的恢复时间系数以及开放区域造影剂浓度的开放跳变幅度,预测血脑屏障开放区域的恢复时间,即,关闭时间。
[0118]
可选的,为了验证血脑屏障开放区域的关闭时间,选取血脑屏障闭合区域作为血脑屏障开放区域的在不同时刻闭合时造影剂浓度变化的参考标准,当血脑屏障开放区域内的造影剂浓度与血脑屏障闭合区域的造影剂浓度情况趋于一致时,表示血脑屏障开放区域已关闭,达到恢复状态。由此,可以通过血脑屏障闭合区域的闭合造影剂浓度验证血脑屏障开放区域的恢复时间是否预测准确。
[0119]
本实施例的技术方案,通过根据多个造影剂注射时刻对应的所述肌肉造影剂浓度对预先构建的肌肉造影剂浓度衰减模型进行拟合求解,得到所述肌肉造影剂浓度的衰减时间系数以及每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度,用以对预先构建的肌肉造影剂浓度衰减模型,利用多个时刻注射造影剂的数据进行拟合求解,得到每个注射时刻的肌肉造影剂浓度的肌肉跳变幅度。根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述衰减时间系数、所述肌肉跳变幅度对预先构建的开放区域恢复模型
进行拟合求解,得到所述血脑屏障开放区域的恢复时间系数以及每个所述造影剂注射时刻下所述开放区域造影剂浓度的开放跳变幅度,用以将开放区域造影剂浓度、衰减时间系数以及肌肉跳变幅度对预先构建的开放区域恢复模型进行拟合求解,从而得到每个注射造影剂的时刻下所述开放区域造影剂浓度的开放跳变幅度。基于所述闭合造影剂浓度、所述开放跳变幅度以及所述恢复时间系数确定所述血脑屏障开放区域的关闭时间,用以根据预先构建的模型得到的闭合造影剂浓度、开放跳变幅度以及恢复时间系数预测血脑屏障开放区域的关闭时间。解决了现有技术中无法对血脑屏障关闭时间进行预测的问题,达到了准确预测血脑屏障开放区域的关闭时间的效果。
[0120]
实施例三
[0121]
图5为本发明实施例三提供的血脑屏障关闭时间的确定装置的结构示意图,本实施例所提供的血脑屏障关闭时间的确定装置可以通过软件和/或硬件来实现,可配置于终端和/或服务器中来实现本发明实施例中的血脑屏障关闭时间的确定方法。该装置具体可包括:磁共振图谱获取模块510、区域确定模块520、磁共振纵向弛豫时间确定模块530、造影剂浓度确定模块540、血脑屏障关闭时间确定模块550。
[0122]
其中,磁共振图谱获取模块510,用于在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱;
[0123]
区域确定模块520,用于确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域;
[0124]
磁共振纵向弛豫时间确定模块530,用于针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间;
[0125]
造影剂浓度确定模块540,用于基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度;
[0126]
血脑屏障关闭时间确定模块550,用于根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间。
[0127]
上述技术方案,通过每个造影剂时刻的磁共振纵向弛豫时间图谱,分别计算出确定出的每个各个造影剂时刻的血脑屏障开放区域、肌肉组织区域与血脑屏障闭合区域的造影剂浓度,进而确定血脑屏障开放区域的关闭时间,解决了现有技术中无法对血脑屏障开放后恢复时间进行预测的问题,实现对血脑屏障的关闭时间的准确预测的效果。
[0128]
本发明实施例中任一可选技术方案的基础上,可选地,所述血脑屏障关闭时间确定模块具体包括:
[0129]
肌肉区域衰减确定子模块:用于根据多个造影剂注射时刻对应的所述肌肉造影剂
浓度对预先构建的肌肉造影剂浓度衰减模型进行拟合求解,得到所述肌肉造影剂浓度的衰减时间系数以及每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度;
[0130]
开放区域衰减确定子模块,用于根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述衰减时间系数、所述肌肉跳变幅度对预先构建的开放区域恢复模型进行拟合求解,得到所述血脑屏障开放区域的恢复时间系数以及每个所述造影剂注射时刻下所述开放区域造影剂浓度的开放跳变幅度;
[0131]
关闭时间确定子模块,用于基于所述闭合造影剂浓度、所述开放跳变幅度以及所述恢复时间系数确定所述血脑屏障开放区域的关闭时间;
[0132]
其中,所述闭合造影剂浓度基于所述闭合造影剂浓度衰减模型确定;所述开放区域恢复模型基于所述肌肉造影剂浓度衰减模型构建;所述肌肉造影剂浓度衰减模型、所述闭合造影剂浓度衰减模型均基于指数衰减函数构建。
[0133]
在本发明实施例中任一可选技术方案的基础上,可选地,所述开放区域恢复模型为:
[0134][0135]
其中,cf(t)表示血脑屏障开放区域在t时刻的开放区域造影剂浓度,ap表示每个所述造影剂注射时刻下所述开放区域造影剂浓度的跳变幅度,
·
表示乘法运算,λ表示所述血脑屏障开放区域的恢复时间系数,*表示卷积运算,u(t)表示单位输入函数,b为常数,bcm(t)表示血管造影剂浓度。
[0136]
在本发明实施例中任一可选技术方案的基础上,可选地,所述肌肉造影剂浓度衰减模型为:
[0137]cm
(t)=bp
·
e-μt
*u(t)
[0138]
其中,cm(t)表示所述肌肉组织区域在t时刻的肌肉造影剂浓度,bp表示每个所述造影剂注射时刻下所述肌肉造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,μ表示所述肌肉造影剂浓度的衰减时间系数,*表示卷积运算,u(t)表示单位输入函数。
[0139]
在本发明实施例中任一可选技术方案的基础上,可选地,所述血脑屏障关闭时间确定子模块用于:
[0140]
基于如下公式以及所述闭合造影剂浓度、所述开放跳变幅度和所述恢复时间系数确定血脑屏障开放区域的关闭时间:
[0141][0142]
其中,tc表示所述血脑屏障开放区域的关闭时间,cc(t)为所述血脑屏障闭合区域在t时刻的闭合造影剂浓度,表示所述血脑屏障闭合区域在 t=tc时刻的闭合造影剂浓度,ap表示每个所述造影剂注射时刻下所述开放区域造影剂浓度的肌肉跳变幅度,
·
表示乘法运算,λ表示所述血脑屏障开放区域的恢复时间系数。
[0143]
在本发明实施例中任一可选技术方案的基础上,可选地,所述造影剂浓度确定模块用于:
[0144]
基于如下公式以及所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的
开放区域造影剂浓度:
[0145][0146]
其中,cf(t)表示所述血脑屏障开放区域在t时刻的开放区域造影剂浓度,r1表示造影剂的弛豫率,t
10f
表示未注射造影剂时所述血脑屏障开放区域的第一磁共振纵向弛豫时间,t
1f
(t)表示t时刻所述血脑屏障开放区域的第一磁共振纵向弛豫时间。
[0147]
在本发明实施例中任一可选技术方案的基础上,可选地,所述磁共振图谱获取模块用于:
[0148]
基于可变翻转角磁共振成像技术获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱。
[0149]
上述血脑屏障关闭时间的确定装置可执行本发明任意实施例所提供的血脑屏障关闭时间的确定方法,具备执行方法相应的功能模块和有益效果。
[0150]
实施例四
[0151]
图6为本发明实施例四所提供的一种电子设备的结构示意图。图6示出了适于用来实现本发明实施方式的示例性电子设备12的框图。图6显示的电子设备12仅仅是一个示例,不应对本发明实施例的功能和使用范围带来任何限制。
[0152]
如图6所示,电子设备12以通用计算设备的形式表现。电子设备12的组件可以包括但不限于:一个或者多个处理器或者处理单元16,系统存储器28,连接不同系统组件(包括系统存储器28和处理单元16)的总线18。
[0153]
总线18表示几类总线结构中的一种或多种,包括存储器总线或者存储器控制器,外围总线,图形加速端口,处理器或者使用多种总线结构中的任意总线结构的局域总线。举例来说,这些体系结构包括但不限于工业标准体系结构(isa) 总线,微通道体系结构(mac)总线,增强型isa总线、视频电子标准协会(vesa) 局域总线以及外围组件互连(pci)总线。
[0154]
电子设备12典型地包括多种计算机系统可读介质。这些介质可以是任何能够被电子设备12访问的可用介质,包括易失性和非易失性介质,可移动的和不可移动的介质。
[0155]
系统存储器28可以包括易失性存储器形式的计算机系统可读介质,例如随机存取存储器(ram)30和/或高速缓存存储器32。电子设备12可以进一步包括其它可移动/不可移动的、易失性/非易失性计算机系统存储介质。仅作为举例,存储系统34可以用于读写不可移动的、非易失性磁介质(图6未显示,通常称为“硬盘驱动器”)。尽管图6中未示出,可以提供用于对可移动非易失性磁盘 (例如“软盘”)读写的磁盘驱动器,以及对可移动非易失性光盘(例如cd-rom, dvd-rom或者其它光介质)读写的光盘驱动器。在这些情况下,每个驱动器可以通过一个或者多个数据介质接口与总线18相连。系统存储器28可以包括至少一个程序产品,该程序产品具有一组(例如至少一个)程序模块,这些程序模块被配置以执行本发明各实施例的功能。
[0156]
具有一组(至少一个)程序模块42的程序/实用工具40,可以存储在例如系统存储器28中,这样的程序模块42包括但不限于操作系统、一个或者多个应用程序、其它程序模块以及程序数据,这些示例中的每一个或某种组合中可能包括网络环境的实现。程序模块42通常执行本发明所描述的实施例中的功能和/或方法。
[0157]
电子设备12也可以与一个或多个外部设备14(例如键盘、指向设备、显示器24等)通信,还可与一个或者多个使得用户能与该电子设备12交互的设备通信,和/或与使得该电子设备12能与一个或多个其它计算设备进行通信的任何设备(例如网卡,调制解调器等等)通信。这种通信可以通过输入/输出(i/o) 接口22进行。并且,电子设备12还可以通过网络适配器20与一个或者多个网络(例如局域网(lan),广域网(wan)和/或公共网络,例如因特网)通信。如图6所示,网络适配器20通过总线18与电子设备12的其它模块通信。应当明白,尽管图6中未示出,可以结合电子设备12使用其它硬件和/或软件模块,包括但不限于:微代码、设备驱动器、冗余处理单元、外部磁盘驱动阵列、raid 系统、磁带驱动器以及数据备份存储系统等。
[0158]
处理单元16通过运行存储在系统存储器28中的程序,从而执行各种功能应用以及数据处理,例如实现本发实施例所提供的一种血脑屏障关闭时间的确定方法。
[0159]
实施例五
[0160]
本发明实施例五还提供一种包含计算机可执行指令的存储介质,所述计算机可执行指令在由计算机处理器执行时用于执行一种血脑屏障关闭时间的确定方法,该方法包括:
[0161]
在通过磁共振引导超声开放目标对象的目标脑部区域的血脑屏障的过程中,分别获取所述目标脑部区域的与多个造影剂注射时刻对应的磁共振纵向弛豫时间图谱,其中,每个所述造影剂注射时刻对应的磁共振纵向弛豫时间图谱包括注射造影剂的前一时刻的磁共振纵向弛豫时间图谱和注射造影剂的后一时刻的磁共振纵向弛豫时间图谱;确定所述目标脑部区域的血脑屏障开放区域、与所述血脑屏障开放区域对应的肌肉组织区域以及与所述血脑屏障开放区域对应的血脑屏障闭合区域;针对每个磁共振纵向弛豫时间图谱,分别确定所述血脑屏障开放区域的第一磁共振纵向弛豫时间、所述肌肉组织区域的第二磁共振纵向弛豫时间以及所述血脑屏障闭合区域的第三磁共振纵向弛豫时间;基于所述第一磁共振纵向弛豫时间确定所述血脑屏障开放区域的开放区域造影剂浓度,基于所述第二磁共振纵向弛豫时间确定所述肌肉组织区域的肌肉造影剂浓度,基于所述第三磁共振纵向弛豫时间确定所述血脑屏障闭合区域的闭合造影剂浓度;根据多个造影剂注射时刻对应的所述开放区域造影剂浓度、所述肌肉造影剂浓度以及所述闭合造影剂浓度确定所述血脑屏障开放区域的关闭时间。
[0162]
本发明实施例的计算机存储介质,可以采用一个或多个计算机可读的介质的任意组合。计算机可读介质可以是计算机可读信号介质或者计算机可读存储介质。计算机可读存储介质例如可以是——但不限于——电、磁、光、电磁、红外线、或半导体的系统、装置或器件,或者任意以上的组合。计算机可读存储介质的更具体的例子(非穷举的列表)包括:具有一个或多个导线的电连接、便携式计算机磁盘、硬盘、随机存取存储器(ram)、只读存储器(rom)、可擦式可编程只读存储器(eprom或闪存)、光纤、便携式紧凑磁盘只读存储器 (cd-rom)、光存储器件、磁存储器件、或者上述的任意合适的组合。在本文件中,计算机可读存储介质可以是任何包含或存储程序的有形介质,该程序可以被指令执行系统、装置或者器件使用或者与其结合使用。
[0163]
计算机可读的信号介质可以包括在基带中或者作为载波一部分传播的数据信号,其中承载了计算机可读的程序代码。这种传播的数据信号可以采用多种形式,包括但不限
于电磁信号、光信号或上述的任意合适的组合。计算机可读的信号介质还可以是计算机可读存储介质以外的任何计算机可读介质,该计算机可读介质可以发送、传播或者传输用于由指令执行系统、装置或者器件使用或者与其结合使用的程序。
[0164]
计算机可读介质上包含的程序代码可以用任何适当的介质传输,包括——但不限于无线、电线、光缆、rf等等,或者上述的任意合适的组合。
[0165]
可以以一种或多种程序设计语言或其组合来编写用于执行本发明实施例操作的计算机程序代码,所述程序设计语言包括面向对象的程序设计语言—诸如 java、smalltalk、c ,还包括常规的过程式程序设计语言——诸如“c”语言或类似的程序设计语言。程序代码可以完全地在用户计算机上执行、部分地在用户计算机上执行、作为一个独立的软件包执行、部分在用户计算机上部分在远程计算机上执行、或者完全在远程计算机或服务器上执行。在涉及远程计算机的情形中,远程计算机可以通过任意种类的网络——包括局域网(lan)或广域网(wan)—连接到用户计算机,或者,可以连接到外部计算机(例如利用因特网服务提供商来通过因特网连接)。
[0166]
注意,上述仅为本发明的较佳实施例及所运用技术原理。本领域技术人员会理解,本发明不限于这里所述的特定实施例,对本领域技术人员来说能够进行各种明显的变化、重新调整和替代而不会脱离本发明的保护范围。因此,虽然通过以上实施例对本发明进行了较为详细的说明,但是本发明不仅仅限于以上实施例,在不脱离本发明构思的情况下,还可以包括更多其他等效实施例,而本发明的范围由所附的权利要求范围决定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
