1.本发明涉及一种带电材料的纯化方法,更具体地涉及一种使用包含磷酸钙化合物的吸附剂在抑制或防止溶解能力(resolution)的变化下的纯化方法。
背景技术:
2.磷酸钙化合物如羟基磷灰石具有优异的生物相容性,并且因此已经广泛用作用于液相色谱的柱(吸附装置)中的吸附剂,通过其样品液中包含的带电材料如蛋白质被吸附和脱附(例如,参见专利文献1)。
3.在这样的用于液相色谱的柱中,通过将该带电材料吸附在由磷酸钙化合物构成的吸附剂上,然后使其从吸附剂上脱附来进行样品液中的带电材料的分离。样品液中的带电材料的分离可以通过重复吸附和脱附而多次进行。
4.使用磷酸钙化合物吸附剂的带电材料的分离可以在没有时间间隔的情况下重复进行,或在前次分离后一定时间段(保存期)如七天以上的间隔后进行。在带电材料的下次分离之前的一定时间段期间,可以将吸附剂保持在保存液如高浓度氢氧化钠溶液(例如,约1.0m)或磷酸盐缓冲液(例如,约0.4m)中。
5.磷酸钙化合物吸附剂在保存液中保存一定时间段不期望地改变了与吸附剂的钙位点结合的带负电材料如酸性蛋白质的分离位置(洗脱时间),而未观察到与吸附剂的磷酸根位点结合的带正电材料如碱性蛋白质的分离位置(洗脱时间)的变化。
6.因此,通过使用已经在保存液如氢氧化钠溶液或磷酸盐缓冲液中保存的吸附剂,并且以预定量分级分离(分部分离,fractionate)从用于液相色谱的柱中流出的洗脱物,其中带负电材料被分离的级分在保存期前后不期望地发生变化。为了回收所需的带负电材料,使得必需消除要收集的级分的分离位置在保存期前后的差异,这费时又费力。
7.作为一种解决这样的问题的技术,公开了一种在将柱在保存液中保存一定时间段之后,通过将保存液改变为具有相对较低浓度的磷酸盐缓冲液并且将吸附剂在其中保持一段时间的步骤,而用于抑制带负电材料的洗脱位置在保存期前后的变化的方法(例如,参见专利文献2)。然而,因为这种方法需要在保存步骤之后使用磷酸盐缓冲液的额外步骤,所以从增强分离操作的效率的角度来看需要改进。需要进一步的改进以防止带正电材料的洗脱位置的变化。
8.专利文献
9.专利文献1:jp 2013-534252 a
10.专利文献2:wo 2019/224660
技术实现要素:
11.发明目的
12.本发明的一个目的是,在具有带电部分的化合物的纯化中,在不进行附着至用于纯化的吸附剂的保存液的置换步骤和保持步骤的情况下,抑制由保存液导致的所述化合物
的洗脱位置的变化。
13.解决问题的手段
14.作为优选实施方案,本发明包括以下实施方案中的任一个。
15.[a1]
[0016]
一种用于纯化具有带电部分的化合物的方法,所述方法包括以下步骤:
[0017]
制备含有具有带电部分的化合物的组合物;
[0018]
制备包含缓冲剂和醇的缓冲液,所述缓冲剂至少部分地含有磷酸钙化合物,具有在ph 6.0至ph 8.0范围内的缓冲能力,并且在极性溶剂中是可溶的而在非极性溶剂中是不溶的;
[0019]
将所述吸附剂保存在所述缓冲液中;
[0020]
通过使所述组合物与保存在所述缓冲液中的所述吸附剂接触而使所述化合物吸附在所述吸附剂上;以及
[0021]
通过梯度洗脱将所述化合物与所述吸附剂分离。
[0022]
[a2]
[0023]
a1中所述的纯化方法,其中在所述保存步骤之后不进行所述缓冲液的置换步骤的情况下,在使用与所述吸附步骤中使用的所述缓冲剂相同种类的缓冲剂的平衡步骤之后进行所述吸附步骤。
[0024]
[a3]
[0025]
a1或a2中所述的纯化方法,其中所述带电材料具有带负电的部分(带负电荷的部分,negatively charged portion)。
[0026]
[a4]
[0027]
a1至a3的任一项中所述的纯化方法,其中所述带电材料具有带正电的部分(带正电荷的部分,positively charged portion)。
[0028]
[a5]
[0029]
a1至a4的任一项中所述的纯化方法,其中所述缓冲剂选自由以下各项组成的组:mes、ada、pipes、aces、盐酸胆胺(氯化胆胺,cholamine chloride)、bes、tes、hepes、乙酰氨基甘氨酸、三(羟甲基)甲基甘氨酸(曲辛,tricine)、甘氨酰胺和n,n-二(羟乙基)甘氨酸(n-二(羟乙基)甘氨酸,bicine)。
[0030]
[a6]
[0031]
a1至a5的任一项中所述的纯化方法,所述纯化方法包括纯化所述具有带电部分的化合物的步骤。
[0032]
发明效果
[0033]
本发明的一个目的是在具有带电部分的化合物的纯化中,在不进行保存液的置换步骤和保持步骤的情况下,抑制由用于保存吸附剂的保存液导致的所述化合物的洗脱位置的变化。
附图说明
[0034]
图1是示出了可以应用于本发明的实施方案的纯化方法的具有吸附剂的吸附装置的一个示例的垂直横截面图。
[0035]
图2是示出了实施例1中的洗脱的结果的图。
[0036]
图3是示出了比较例1中的洗脱的结果的图。
[0037]
图4是示出了比较例2中的洗脱的结果的图。
[0038]
图5是示出了比较例3中的洗脱的结果的图。
具体实施方式
[0039]
以下将基于附图中所示的优选实施方案来详细描述本发明的纯化方法。首先,在描述本发明的纯化方法之前,将描述可以应用于本发明的纯化方法的包括吸附剂的吸附装置的一个示例。
[0040]
在以下描述的示例中,待使用吸附装置分离的带电材料是蛋白质,即,带负电材料是酸性蛋白质,而带正电材料是碱性蛋白质。
[0041]
《吸附装置》
[0042]
图1是示出了可以应用于本发明的纯化方法的包括吸附剂的吸附装置的一个示例的垂直横截面图。要说明的是,在下文中,图1中的上侧被称为“入口侧(流入侧,inlet side)”,并且图1的下侧被称为“出口侧(流出侧,outlet side)”。
[0043]
在本文中,入口侧意指在目标蛋白质的分离(纯化)中液体如样品液(包含样品的液体)、洗脱液(磷酸盐缓冲液)等通过其被供应到吸附装置中的一侧。在另一方面,出口侧意指通过其液体从吸附装置流出的与入口侧相对的一侧。
[0044]
图1中所示的用于从样品液中分离(纯化)蛋白质的吸附装置1具有柱2、粒状吸附剂(填料)3和两个过滤器构件4、5。
[0045]
柱2由柱体21以及分别附接至柱体21的入口侧端部和出口侧端部的帽(盖体)22、23构成。
[0046]
柱体21由例如圆筒形构件构成。包括主体21的柱2的各部件(构件)可以由例如各种玻璃材料、各种树脂材料、各种金属材料、各种陶瓷材料等或其任意组合形成。
[0047]
在过滤器构件4、5分别覆盖在柱体21的入口侧开口和出口侧开口上之后,将帽22、23分别(用螺钉)拧入其入口侧端部和出口侧端部中。
[0048]
在上述构造的柱2中,由柱体21和过滤器构件4、5限定吸附剂填充空间20。吸附剂填充空间20至少部分地(在本实施方案中完全地)被吸附剂3填充。
[0049]
吸附剂填充空间20的容量根据样品液的体积适当设定,而没有特别限制,但每1ml的样品液,其优选为约0.1ml以上且约100ml以下,并且更优选为约1ml以上且约50ml以下。
[0050]
配备有帽22、23的柱体21确保了其间的液密性。
[0051]
将入口管(流入管,inlet pipe)24和出口管(流出管,outlet pipe)25分别液密地紧固(固定)至帽22、23的大致中央。将液体经由入口管24和过滤器构件4供应到吸附剂3。供应到吸附剂3的液体通过吸附剂3之间的空间(间隙),然后经由过滤器构件5和出口管25从柱2流出。此时,基于对吸附剂3的吸附性的差异以及对磷酸盐缓冲液的亲和性的差异,来分离样品液(样品)中的待分离的蛋白质(在下文中,可以简称为“蛋白质”)以及可能包括除该待分离的蛋白质外的外来蛋白质(在下文中,可以简称为“外来蛋白质”)的其他材料。
[0052]
各个过滤器构件4、5具有防止吸附剂3从吸附剂填充空间20中流出的功能。各个过滤构件4、5优选地由例如不锈钢网过滤器或烧结不锈钢过滤器形成。
[0053]
吸附剂3至少部分地包含磷酸钙化合物。更优选地,至少吸附剂3的表面由磷酸钙化合物形成。待分离的蛋白质利用其固有的吸附(保留)力而特异地吸附在吸附剂3上,然后根据它们吸附力的差异从其他材料(包括外来蛋白质)中分离和纯化。
[0054]
磷酸钙化合物可以例如是羟基磷灰石[ca
10
(po4)6(oh)2]、tcp[ca3(po4)2]、ca2p2o7、ca(po3)2、dcpd(cahpo4·
2h2o)、ca4o(po4)2以及它们的至少部分地被其他原子或原子团取代的衍生物,或者可以是其两种以上的组合。
[0055]
通常,将蛋白质分类为含有相对较大量的酸性氨基酸作为其构成氨基酸的带负电的酸性蛋白质和含有相对较大量的碱性氨基酸作为其构成氨基酸的带正电的碱性蛋白质。
[0056]
磷酸钙化合物在其晶体结构中具有带正电的ca位点和带负电的磷酸根位点。
[0057]
因此,酸性蛋白质利用在磷酸钙化合物的ca位点和酸性蛋白质的酸性氨基酸残基之间的离子键而被磷酸钙化合物吸附。碱性蛋白质利用在磷酸钙化合物的磷酸根位点和碱性蛋白质的碱性氨基酸残基之间的离子键而被磷酸钙化合物吸附。蛋白质与磷酸钙化合物的结合(吸附)强度根据每种蛋白质(酸性蛋白质和碱性蛋白质)的电荷量(amount of charge,带电量)而不同。
[0058]
因此,当使用至少在表面上由磷酸钙化合物构成的吸附剂3时,可以利用蛋白质(酸性蛋白质和碱性蛋白质)与其他材料(例如,外来蛋白质等)对吸附剂3的吸附力的差异将它们分离。
[0059]
以上之中,磷酸钙化合物优选地主要由羟基磷灰石构成。因为羟基磷灰石具有与构成活体的组分特别类似的组分,所以它可以防止蛋白质在其吸附和分离中的劣化(变性)。此外,有这样的优点,即蛋白质可以例如通过提供具有盐浓度梯度的磷酸盐缓冲液(洗脱剂)而从吸附剂3特异地取出。
[0060]
磷酸钙化合物“主要由羟基磷灰石构成”意指每100质量%的磷酸钙化合物总量,羟基磷灰石的量为约50质量%以上。羟基磷灰石的量更优选为约60质量%以上,进一步优选为约70质量%以上,进一步更优选为约80质量%以上,并且最优选为约90质量%以上。
[0061]
羟基磷灰石的羟基中的至少一个可以被氟原子取代。被氟原子取代的羟基磷灰石(在下文中被称为“氟代磷灰石(fluoroapatite)”)由于在晶体结构中存在氟原子(氟离子)而可以更可靠地防止钙原子(钙离子)从其中脱离。
[0062]
要说明的是,在下文中,羟基磷灰石和具有取代的氟原子的氟代磷灰石可以统称为“磷灰石”。
[0063]
如图1所示,吸附剂3的形式(形状)优选为粒状(颗粒状)形状,并且也可以例如为团粒状(小块状)、块状(例如,相邻空隙彼此连通的多孔体状,和蜂巢状)等。因为具有颗粒状的吸附剂3具有大的表面积,所以可以改善蛋白质的分离特性。
[0064]
尽管没有特别限制,但粒状吸附剂3的平均尺寸优选为约0.5μm至约150μm,并且更优选为约10μm至约80μm。具有上述平均尺寸的吸附剂3可以可靠地防止过滤器构件5阻塞,以及充分地确保其表面积。
[0065]
吸附剂3可以完全由磷酸钙化合物构成,或者可以由表面上涂覆有磷酸钙化合物的载体(基体)形成。它们之中,完全由磷酸钙化合物构成的吸附剂3是优选的,由此进一步增强吸附剂3的吸附力。作为结果,可以获得适合于分离大量蛋白质的柱2。
[0066]
完全由磷酸钙化合物构成的吸附剂3可以例如通过以下方式获得:使用湿式合成
法或干式合成法来形成磷酸钙化合物粒子(一次粒子),将含有该磷酸钙化合物粒子的浆料干燥并且粒化以获得干燥粒子,然后将该干燥粒子烧结。
[0067]
在另一方面,由表面上涂覆有磷酸钙化合物的载体构成的吸附剂3可以例如通过将干燥粒子与由树脂等制成的载体碰撞(杂合)来获得。
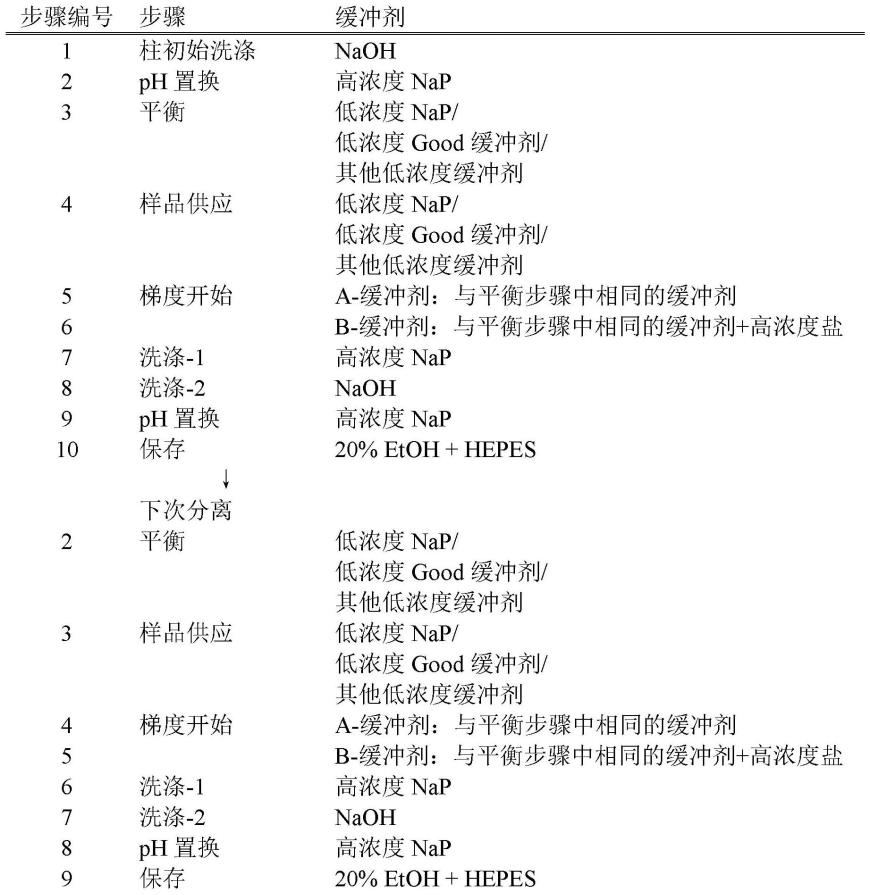
[0068]
当吸附剂填充空间20完全用吸附剂3填充时(如这个实施方案中那样),吸附剂3优选地在吸附剂填充空间20的相应部分处具有几乎相同的组成,由此提供具有特别优异的分离(纯化)蛋白质的能力的吸附装置1。
[0069]
要说明的是,吸附剂填充空间20中的一部分(例如,在入口管24的一侧上的部分)可以用吸附剂3填充,而另一部分用其他吸附剂填充。
[0070]
《纯化方法》
[0071]
以下将描述使用吸附装置1的蛋白质的纯化方法。
[0072]
[1a]制备步骤
[0073]
制备含有待分离(纯化)的蛋白质和其他材料(污染物)的样品液(组合物)。
[0074]
当蛋白质是遗传修饰的蛋白质(单克隆抗体等)时,样品液可以包括来自哺乳动物(如羊、兔、鸡等)、诸如昆虫(如蚕)的动物、动物细胞(如来源于中华仓鼠卵巢细胞的cho细胞)、微生物(如大肠杆菌(escherichia coli))等(其中导入了包含编码所述蛋白质的基因的核酸)的分泌物、其细胞质组分等,以及它们的任意组合。
[0075]
当蛋白质是天然蛋白质时,样品液可以包括例如来源于各种动物的血液(血浆)、体液如淋巴液、唾液和鼻腔分泌物等。
[0076]
在蛋白质之中,酸性蛋白质可以例如是bsa、has、纤维蛋白原、胃蛋白酶原、α-球蛋白、β-球蛋白、γ-球蛋白等。在另一方面,碱性蛋白质可以是例如溶菌酶、奇异果甜蛋白(thaumatin)、细胞色素c、核糖核酸酶、胰蛋白酶原、胰凝乳蛋白酶原、α-胰凝乳蛋白酶、组蛋白、鱼精蛋白、聚赖氨酸、应乐果甜蛋白(monellin)等。
[0077]
要说明的是,蛋白质(酸性蛋白质和碱性蛋白质)可以是通过将其氨基酸序列的一些氨基酸用其他氨基酸替换获得的变体。
[0078]
作为样品液(含有待分离的具有带电部分的化合物的组合物),来自微生物等的分泌物和来源于动物的体液可以原样使用,或者在用中性缓冲液如水和生理盐水稀释或通过膜如过滤器过滤后使用。此外,样品液可以含有多种蛋白质。
[0079]
[2a]供应步骤
[0080]
将所获得的样品液经由入口管24和过滤器构件4供应到吸附剂3,并且通过柱2(吸附装置1)的内部以与吸附剂3接触。
[0081]
作为结果,在吸附剂3上具有高吸附能力的待分离(纯化)的蛋白质以及在吸附剂3上具有相对较高吸附能力的污染物(外来蛋白质等)中的一些(蛋白质)被保持在柱2中。在吸附剂3上具有低吸附能力的其他污染物经由过滤器构件5和出口管25从柱2的内部流出。
[0082]
[3a]分级分离步骤
[0083]
将用于洗脱蛋白质的洗脱剂如磷酸盐缓冲液经由入口管24供应到柱2中。然后,经由出口管25从柱2的内部流出的洗脱物以预定量被分级分离(收集)。即,吸附在吸附剂3上的蛋白质和污染物根据它们对吸附剂3的相应吸附力的差异而在不同的时间以溶解状态流出,然后被收集(分离/纯化)到相应级分中。
[0084]
因此,蛋白质和污染物利用它们相应的固有吸附(保留)力而特异地吸附在吸附剂3上。即,在它们对吸附剂3的吸附力之间存在差异。根据吸附力的差异,蛋白质和污染物被分离并纯化。通过选择性地收集其中溶解有分离(纯化)的蛋白质的级分,可以获得纯化的蛋白质。
[0085]
用于洗脱剂的缓冲剂优选是good缓冲剂(good’s buffer)如hepes和mes、硫酸盐和磷酸盐。它们之中,具有磺酸基的缓冲剂和磷酸盐是更优选的。具有磺酸基的缓冲剂优选是mops、mes或hepes。磷酸盐可以例如是磷酸钠、磷酸钾、磷酸锂、磷酸铵等。它们之中,磷酸盐是更优选的。洗脱剂还可以含有盐如氯化钠。
[0086]
尽管从增强洗脱能力的角度来看,磷酸盐缓冲液(其中溶解有磷酸盐的溶液)的较高ph是有利的,但是磷酸盐缓冲液的ph优选地与通常用于吸附(平衡)的缓冲剂的ph几乎相同。另外,在ph几乎为中性的情况下,蛋白质几乎不变性。因此,ph值被设定为例如优选地约5.5至8.5,并且更优选地约6.5至7.5。
[0087]
从防止分离的蛋白质退化(变性)以及防止磷酸盐缓冲剂沉淀的角度来看,缓冲液(洗脱剂)的温度优选为约10至50℃,并且更优选为约20至35℃。因此,利用具有上述ph范围和温度范围的缓冲液,可以改善目标蛋白质的回收率。然而,当待分离的目标蛋白质容易变性时,缓冲液的温度可以低于上述温度范围(大约在冷藏室温度)。
[0088]
缓冲液的盐浓度优选为500mm以下,并且更优选为400mm以下。通过使用具有上述盐浓度的缓冲液来进行蛋白质的分离,可以防止磷酸盐缓冲液中的金属离子不利地影响蛋白质。
[0089]
缓冲液的盐浓度更优选为约1至400mm。另外,在蛋白质的分离中,优选地连续地或逐步地改变缓冲液的盐浓度,由此改善蛋白质分离的效率。
[0090]
缓冲液的流速优选为约0.1至10ml/min,并且更优选为约1至5ml/min。通过以上述流速分离蛋白质,目标蛋白质可以被可靠地分离,即,可以获得高纯度蛋白质,而无需长时间的分离操作。
[0091]
根据上述操作,蛋白质在预定级分中回收。因此,待分离的蛋白质在预定级分中获得,然后被纯化。
[0092]
然后,步骤1a至3a中使用的柱可以应用于如以下描述的本发明的实施方案的保存步骤。因此,步骤1a至3a可以理解为用于制备要应用于本发明的纯化方法的柱的步骤。在本发明的实施方案中,要应用于纯化方法的柱优选是已经使用过并且因此含有或可能含有改变吸附剂的吸附能力的材料的柱,或者即使未使用过但由于一些原因如存在杂质而含有吸附能力已经改变的吸附剂的柱。
[0093]
《保存》
[0094]
[4a]保存步骤
[0095]
在使用吸附装置1的传统方法中,通过如下方式来重复蛋白质的分离(纯化):在蛋白质的分离(纯化)后没有间隔期的情况下使用高浓度缓冲液(磷酸盐缓冲液等)洗脱吸附在吸附剂3上的其他材料(外来蛋白质等)来洗涤吸附装置1,然后再次使用吸附装置1用于蛋白质的下次分离。
[0096]
备选地,可以将已经保存了一定时间段(保存期)如1至30天的吸附剂3用于吸附装置1中的蛋白质的分离。在传统方法中,在带电材料的下次分离之前的一定时间段期间,出
于进一步洗脱其他材料等的目的,通常将吸附剂3保持在保存液如高浓度氢氧化钠溶液(例如,约1.0m)、磷酸盐缓冲液(例如,约0.4m)等中。
[0097]
然而,当在氢氧化钠溶液或磷酸盐缓冲液中保存一定时间段后进行使用吸附装置1的蛋白质的分离时,与磷酸根位点结合的碱性蛋白质的分离位置(洗脱时间)不发生变化,但是与钙位点结合的酸性蛋白质的分离位置(洗脱时间)与保存前相比有时发生变化。
[0098]
在另一方面,当吸附剂3在磷酸盐缓冲液(例如,约15mm的磷酸盐缓冲液)中的保存进行持续比7天长得多的时间段(例如,约30天)时,酸性蛋白质(带负电材料)的洗脱位置不发生变化,但是碱性蛋白质(带正电和带负电的材料)的洗脱位置有时发生变化。因此,当通过专利文献2中所述的方法来纯化带正电和带负电的材料时,可能需要使从其中回收带正电和带负电的材料的级分的洗脱位置复位(恢复,restore)。要说明的是,本发明人已经发现了这个问题。
[0099]
相反,在本发明的纯化方法中,通过使用包含缓冲剂(其至少部分地含有磷酸钙化合物,具有在ph 6.0至ph 8.0范围内的缓冲能力,并且在极性溶剂中是可溶的而在非极性溶剂中是不可溶的)和醇的缓冲液作为保存液(步骤“4a”),可以在不进行任何额外步骤的情况下防止洗脱时间变化(偏移,shift)。该缓冲剂可以具有在ph 6.0至ph 8.0范围内的最大缓冲能力。
[0100]
在作为保存液使用的缓冲液中含有的缓冲剂优选地选自由以下各项组成的组:mes、ada、pipes、aces、盐酸胆胺、bes、tes、hepes、乙酰氨基甘氨酸、三(羟甲基)甲基甘氨酸、甘氨酰胺和n,n-二(羟乙基)甘氨酸。这些是所谓的good缓冲剂,其具有在ph 6.0至ph 8.0范围内的缓冲能力,并且在极性溶剂中是可溶的而在非极性溶剂中是不可溶的。它们之中,缓冲剂更优选是mes或hepes,并且最优选是hepes。
[0101]
保存液中的缓冲剂的浓度优选为约1.0mm以上且约100mm以下,更优选为约2.0mm以上且约50mm以下,进一步优选为约3.0mm以上且约30mm以下,并且进一步优选为约4.0mm以上且约20mm以下。
[0102]
保存液包含醇。每100体积%的保存液总量,醇的含量优选为5体积%至40体积%,更优选为10体积%至30体积%,并且最优选为15体积%至25体积%。当将醇的含量设定为上述范围时,可以防止吸附剂的劣化,以及进一步抑制细菌等的出现。
[0103]
醇优选是低级醇。低级醇意指具有1至6个碳原子的一元醇。对低级醇没有特别限制,只要生理上或药学上可接受即可。低级醇的具体实例例如是乙醇、丙醇、异丙醇、正丁醇、仲丁醇、叔丁醇、异丁醇、戊醇和己醇。从更显著地表现出本发明的效果的角度来看,低级醇优选是乙醇、丙醇、异丙醇、正丁醇、仲丁醇、叔丁醇或异丁醇,更优选是乙醇或异丙醇,进一步优选是乙醇。低级醇可以仅由一种构成,或者由其中的两种以上的组合构成。
[0104]
在本发明的纯化方法中,在如上所述将吸附剂3保存一定时间段之后,要吸附在吸附剂3上的蛋白质的吸附能力(分离能力)的变化被抑制。作为结果,在没有用其他缓冲剂置换保存液的情况下抑制了洗脱时间的变化。
[0105]
尽管在以上描述中使用蛋白质作为带电材料的一个示例,但是除了酸性蛋白质以外,带负电材料还可以是酸性氨基酸、dna、rna、带负电的脂质体等。除了碱性蛋白质以外,带正电材料还可以是碱性氨基酸、带正电的胆固醇、带正电的脂质体等。
[0106]
尽管以上已经描述了本发明的纯化方法,但是本发明不限于此。
[0107]
在不偏离本发明的技术构思的情况下,本发明的纯化方法可以增加一个或多个步骤。
[0108]
实施例
[0109]
以下将描述本发明的具体实施例。
[0110]
1.吸附装置的制造
[0111]
吸附装置通过用作为吸附剂(填料)的羟基磷灰石(cht 40μm,类型i,可得自bio-rad laboratories,inc.)几乎完全填充不锈钢柱(内径4.0mm
×
长度100mm)的填充空间来制造。
[0112]
2.通过吸附装置的蛋白质(酸性蛋白质和碱性蛋白质)的分离
[0113]
(实施例1)
[0114]
2-1.在保存液中保存之前通过吸附装置的蛋白质的分离
[0115]
《1a》将作为酸性蛋白质的牛血清白蛋白(bsa)和作为碱性蛋白质的α-胰凝乳蛋白酶原a溶解到1.0mm磷酸钠缓冲液(ph 6.8)中以获得混合液,使得bsa的含量为10mg/ml,并且α-胰凝乳蛋白酶原a的含量为5mg/ml。然后,将混合液通过0.22μm过滤器过滤以获得样品液。
[0116]
《2a》将吸附装置安装在色谱仪上。将吸附装置用1m naoh洗涤,然后用0.4m磷酸钠缓冲液(ph 6.5,温度25℃)进行置换。然后,将10mm磷酸钠缓冲液(ph 6.5,温度25℃)以1.0ml/min的流速供应通过吸附装置以平衡该吸附装置。
[0117]
《3a》将50μl的样品液以1.0ml/min的流速供应到吸附装置中,然后将浓度梯度应用于磷酸盐缓冲液(ph 6.5),使得浓度在15分钟内从10mm增大到400mm(75%)。测量洗脱物(从吸附装置内部流出的液体)在280nm的吸光度。在测量后,将吸附装置用0.4m磷酸钠缓冲液(ph 6.5,温度25℃)洗涤,然后用水洗涤。
[0118]
《4a》将含有20%乙醇的10mm hepes缓冲液(ph 8.0)以1.0ml/min的流速供应通过吸附装置以将吸附剂浸没在hepes缓冲液中。然后,将吸附剂在此状态下保存30天。
[0119]
2-2.在保存液中保存之后通过吸附装置的蛋白质的分离
[0120]
《1b》将吸附装置安装在色谱仪上。然后,将10mm磷酸钠缓冲液(ph 6.5,温度25℃)以1.0ml/min的流速供应通过吸附装置以平衡该吸附装置。
[0121]
《2b》将50μl与步骤《1a》中制备的相同样品液以1ml/min的流速供应到吸附装置中,然后将浓度梯度应用于磷酸盐缓冲液(ph 6.5),使得浓度在15分钟内从10mm增大到400mm(75%)。测量洗脱物(从吸附装置内部流出的液体)在280nm的吸光度。实施例1中的洗脱的结果在图2中示出。酸性蛋白质和碱性蛋白质两者的洗脱位置在保存后未发生变化。
[0122]
(比较例1)
[0123]
除了在步骤4a中,将吸附剂保存在1m naoh(代替含有20%乙醇的10mm hepes缓冲液(ph 8.0))中,以及在步骤4a和步骤1b之间增加用0.4m nap(ph 6.5)置换吸附装置中的保存液的步骤外,执行与实施例1中相同的实验。要说明的是,在比较例1中,不进行在传统技术中进行的保持吸附剂浸没在磷酸盐缓冲液中的步骤。比较例1中的洗脱的结果在图3中示出。发现酸性蛋白质的洗脱位置在保存后发生了变化。
[0124]
(比较例2)
[0125]
除了在步骤4a中,将吸附剂保存在1m naoh(代替含有20%乙醇的10mm hepes缓冲
液(ph 8.0))中,以及在步骤4a之后增加用10mm nap(ph 6.5)置换吸附装置中的保存液并保持一小时以上的一定时间段的步骤外,执行与实施例1中相同的实验。比较例2中的洗脱的结果在图4中示出。比较例2表明,当保持时间越长时,缓和效果越大。
[0126]
(比较例3)
[0127]
除了在步骤4a中,将吸附剂保存在含有20%乙醇的10mm nap(ph 6.5)(代替含有20%乙醇的10mm hepes缓冲液(ph 8.0))中外,执行与实施例1中相同的实验。比较例3中的洗脱的结果在图5中示出。与在柱的保存之前相比,酸性蛋白质的洗脱位置没有发生变化,但是碱性蛋白质的洗脱位置发生了变化。
[0128]
以上实施例和比较例中的分离实验的典型实施方案易理解地总结在以下表格中,而不意图受限于此。如实施例1中所述的,在表1中,在用“高浓度nap(磷酸盐缓冲液)”置换吸附剂的ph和将吸附剂保存在“20%etoh hepes”中之前,可以增加用水或低浓度nap洗涤吸附剂的步骤。
[0129]
表1
[0130]
20%etoh hepes保存
[0131][0132]
表2
[0133]
比较例1(现有技术)
[0134]
naoh保存
[0135][0136]
表3
[0137]
比较例2(专利文献2)
[0138]
用10mm nap(ph 6.5)进行置换并且保持一小时
[0139][0140]
表4
[0141]
比较例3(现有技术)
[0142]
20%etoh 磷酸盐缓冲液保存
[0143][0144]
如专利文献2中所述的,在其中将吸附剂在1m naoh中保存7天的保存时间的情况下,当保存液用10mm nap(ph 6.5)进行置换并且将吸附剂在其中保持一小时时,bsa的洗脱位置从运行-1(走柱-1,run-1)到运行-2(走柱-2,run-2)偏移了-5(s)。当将吸附剂在naoh中长期保存时,需要一小时以上的在10mm nap(ph 6.5)中的保持步骤,并且因此似乎需要对于每个naoh保存期确定在10mm nap(ph 6.5)中的保持时间,从而导致复杂的准备。相反地,根据本发明的纯化方法,因为不需要这样的保持步骤,所以不必要确定保持时间。
[0145]
根据本发明的一个实施方案的纯化方法,由保存步骤导致的由磷酸钙化合物构成的吸附剂的吸附能力的变化被抑制。
[0146]
因此,要从吸附剂脱附的分离位置(洗脱时间)在保存液中的保存前后可以保持几乎恒定。因此,当从用于液相色谱的柱(其内填充了吸附剂)中流出的洗脱物以预定量进行分级分离以将带电材料分离成各个洗脱物级分时,可以适当地抑制或防止在保存液中的保存前后改变其中带电材料要被分离的级分的分离位置。作为结果,因为不需要更换保存液和恢复要收集的级分,所以可以在不费时且不费力的情况下进行带电材料从样品液中的分离。
[0147]
在本文中,附带有“约”的数值表示该数值可以在不产生矛盾的范围内变化。附带有“约”的数值可以例如具有正负10%的误差范围。该误差范围更优选为正负5%,进一步优
选为正负1%,最优选为零(该数值本身)。
[0148]
参考标号说明
[0149]
1:吸附装置
[0150]
2:柱
[0151]
3:吸附剂
[0152]
4:过滤器构件
[0153]
5:过滤器构件
[0154]
20:吸附剂填充空间
[0155]
21:柱体
[0156]
22:帽
[0157]
23:帽
[0158]
24:入口管
[0159]
25:出口管
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。