1.本发明涉及具有免疫调节活性的骨再生材料及其制备方法和应用,属于医用材料技术领域。
背景技术:
2.由于创伤、感染、恶性肿瘤和先天性疾病因素等所导致的骨缺损是临床中常见且较难解决的问题。骨再生是一个十分复杂的动态调节过程,骨组织再生能力与局部免疫反应的交互调节网络有密切联系。其中,巨噬细胞在骨免疫、骨再生中发挥着十分重要的作用。随着组织愈合的进展,称为m1型的促炎型巨噬细胞逐渐极化为称为m2型的抗炎型巨噬细胞,以促进组织再生。具体而言,在损伤初始阶段m1型巨噬细胞的过度活化会产生促炎细胞因子和活性氧物质破坏微环境并抑制组织愈合,而m2型巨噬细胞倾向于分泌白细胞介素(il)-10等抗炎因子,以减少炎症反应并刺激新组织形成。此外,m2型巨噬细胞还会分泌骨形态发生蛋白(bmp)-2、抑瘤素m(osm)等细胞因子调节干细胞成骨分化。因此,在骨愈合过程中,诱导巨噬细胞向m2型转变是一种促进骨修复的策略。
3.靶向调控骨缺损区的巨噬细胞是调节骨再生免疫环境更为有效的方法。甘露糖受体属于c型凝集素超家族成员,在巨噬细胞表面高表达,因此常作为巨噬细胞靶向给药的受体分子。葡甘露聚糖为中性非离子型线形多糖,是由葡萄糖和甘露糖以β-1,4糖苷键结合而形成的一种高分子化合物,有很高的粘度,胶凝性、持水性、生物相容性等,这些理化性质使之具有很好的应用前景。研究表明葡甘露聚糖可以靶向结合到巨噬细胞表面的甘露糖受体,并调控巨噬细胞向m2型转化。
4.但是,游离状态下的葡甘露聚糖存在着活性不高的问题。
技术实现要素:
5.本发明所要解决的技术问题在于:直接采用游离状态的葡甘露聚糖进行调控巨噬细胞向m2型巨噬细胞极化的过程中,存在着活性不高的问题;因此,本发明的第一目的在于提供一种基于多糖修饰的纳米羟基磷灰石用于靶向调控巨噬细胞的纳米药物,具有免疫调节活性从而促进骨修复。
6.一种具有免疫调节活性的骨再生材料,是以羟基磷灰石作为载体,其表面负载葡甘露聚糖。
7.所述的羟基磷灰石长径50-200nm,短径10-40nm。
8.所述的葡甘露聚糖的表面经过阳离子化处理;所述的羟基磷灰石的表面经过n,n-碳酰二咪唑活化处理。
9.具有免疫调节活性的骨再生材料的制备方法,包括如下步骤:
10.步骤1,葡甘露聚糖阳离子化:取葡甘露聚糖,溶于有机溶剂中,加入n,n-碳酰二咪唑,再加入乙二胺,继续反应,产物透析后冻干;
11.步骤2,将纳米羟基磷灰石分散于有机溶剂中,加入n,n-碳酰二咪唑进行活化,产
物洗涤后烘干;
12.步骤3,将步骤1和步骤2中得到的产物混合后,溶解于有机溶剂中,进行反应,产物洗涤后冻干。
13.所述的步骤1中,葡甘露聚糖和n,n-碳酰二咪唑的质量比是1:2-4;反应条件是室温下5-30h。
14.所述的步骤2中,纳米羟基磷灰石和n,n-碳酰二咪唑的质量比是1:2-5。
15.所述的步骤3中,步骤1和步骤2中得到的产物的质量比1:0.5-1.5,反应条件是室温下1-5h。
16.具有免疫调节活性的骨再生材料在用于制备调控巨噬细胞向m2型巨噬细胞转化的试剂中的用途。
17.所述的用途中,具有免疫调节活性的骨再生材料通过水凝胶作为载体制备试剂。
18.有益效果
19.1、本发明成功地将葡甘露聚糖负载于羟基磷灰石的表面上,使得在微粒状态下的配体较游离状态具有更强的甘露糖受体激活能力。
20.2、本发明制备的纳米级微粒表面呈现的重复糖单元可通过多价的交互方式与细胞表面受体结合,提高与c-型凝聚素受体结合的作用效果。
21.3、本发明通过将葡甘露聚糖修饰于纳米粒子表面制备成糖基化纳米颗粒可增强配体激活效能。
22.4、本发明中所采用的纳米羟基磷灰石具有与骨矿化物相似的化学结构、优良的生物相容性和易于表面修饰等特性,不仅可以作为仿生骨材料用于修复骨缺损,还可以作为良好的药物载体。
23.5、选择纳米羟基磷灰石作为纳米核,以葡甘露聚糖进行修饰,用以靶向巨噬细胞,调控巨噬细胞极化方向。
24.6、本发明所述的葡甘露聚糖修饰的纳米羟基磷灰石在制备治疗骨缺损、骨创伤等药物中应用。包括但不限于牙周骨缺损、颌面部骨缺损及其他躯干骨缺损区。
附图说明
25.图1.合成的葡甘露聚糖修饰的纳米羟基磷灰石的透射电镜图。所选用的为长径约100nm,短径约20nm的纳米羟基磷灰石,修饰多糖后颗粒形貌和尺寸无明显变化。bar=100nm。
26.图2.多糖修饰的纳米羟基磷灰石与巨噬细胞作用后的荧光图。bar=50μm
27.图3.多糖修饰的纳米羟基磷灰石对巨噬细胞极化的影响。
28.图4.多糖修饰的纳米羟基磷灰石对巨噬细胞炎症因子分泌的影响。
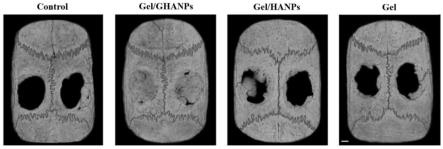
29.图5.多糖修饰的纳米羟基磷灰石对颅骨缺损修复的影响。
30.图6.多糖修饰的纳米羟基磷灰石对牙周骨缺损修复的影响。
具体实施方式
31.本发明在体外通过巨噬细胞进行了证实可以促进巨噬细胞m2极化,在体内研究中通过对大鼠颅骨骨缺损和小鼠牙周骨缺损进行了例证,表明其具有促进骨修复能力。
32.实施例1
33.1)葡甘露聚糖阳离子化
34.采用的为魔芋葡甘露聚糖(gm)。将2g gm溶于100ml二甲基亚砜(dmso),加热(80℃)下,搅拌助溶1h。待溶液冷却至室温后加入6g n,n-碳酰二咪唑(cdi)活化gm,并加入10ml乙二胺(eda),室温下反应18h。最后将产物透析、冻干。
35.在本步骤中,通过cdi可以活化gm表面的羟基,而使用eda的目的是使gm氨基化,使其具有正电,形成阳离子化多糖。
36.2)纳米羟基磷灰石(hanps)咪唑基团修饰
37.取长径为100nm,短径约为20nm的杆状纳米羟基磷灰石(hanps)100mg,丙酮洗涤后烘干。超声下(200w,40khz)逐滴滴加丙酮30ml,使hanps充分分散后加入300mg cdi活化hanps。产物经丙酮洗涤后烘干,干燥保存。
38.本步骤中,采用cdi使纳米羟磷灰石表面的羟基活化,使其含有咪唑基团。
39.3)gm修饰hanps
40.将1)中获得的阳离子化的gm与hanps以1:1溶于dmso,室温下震荡反应3h,离心,无水乙醇和无菌水进行充分洗涤后冻干,获得gm修饰的纳米羟基磷灰石(ghanps)。
41.本步骤中,氨基化的gm与含有咪唑基团的hanps可通过形成共价键相互连接。此外,氨基化的gm中带正电的nh2/nh
3
氨基基团可与羟磷灰石的po
43-通过静电作用产生较强的结合。
42.对照例1
43.与实施例1的区别在于:活化gm后,不使用乙二胺对其表面进行氨基化处理,获得未经阳离子化处理的多糖修饰的纳米羟基磷灰石组(gm/hanps)。
44.表1.合成的葡甘露聚糖修饰的纳米羟基磷灰石的zeta电位值
[0045][0046]
多糖修饰后zeta电位由负电荷变为正电荷,表明多糖成功修饰于纳米羟基磷灰石表面。zeta电位绝对值显著增大,表明多糖修饰显著改善了材料的稳定性。通过实施例1和对照例1的对比可以看出,通过乙二胺对多糖修饰使其阳离子化后可以显著提高gm在纳米羟基磷灰石表面的负载量。
[0047]
表2.元素分析
[0048][0049]
元素分析图表明纳米羟基磷灰石中仅含有少量h元素,经过多糖修饰后,多糖修饰
的纳米羟基磷灰石表面c、h元素显著增多,表明多糖成功修饰到纳米颗粒表面。
[0050]
如图2所示,培养小鼠巨噬细胞系raw264.7,接种于盖玻片培养,过夜后,加入fitc绿色荧光标记的多糖修饰的纳米羟基磷灰石(fitc-ghanps)处理(50μg/ml),并同期设置空白对照组(control)。通过激光共聚焦显微镜观察fitc-ghanps与巨噬细胞表面的甘露糖受体结合情况。结果如图所示:ghanps可以与巨噬细胞表面的甘露糖受体(mr)特异性结合,实现对巨噬细胞的靶向。
[0051]
如图3所示,其中诱导型一氧化氮合酶(inos)是促炎型巨噬细胞的代表分子,而精氨酸酶1(arg-1)是修复型巨噬细胞的代表分子。培养小鼠巨噬细胞系raw264.7,铺入6孔板中(1
×
106/孔),过夜后,加入多糖修饰的纳米羟基磷灰石(ghanps)处理(50μg/ml),并同期设置空白对照组(control),未经修饰的羟基磷灰石组(hanps),未经阳离子化处理的多糖修饰的纳米羟基磷灰石组(gm/hanps),24小时后收集各组细胞。提取细胞内rna后,通过实时荧光定量pcr检测inos和arg-1mrna的相对表达量。结果如图所示:较control组和hanps组,ghanps组inos表达下降,arg-1表达升高。表明合成的多糖修饰的纳米羟基磷灰石可以促进巨噬细胞向修复型转化;同时,与未进行阳离子化处理的gm/hanps组相比,由于葡甘露聚糖表面阳离子基团的存在可以提高其在纳米羟基磷灰石表面的负载,促进了其对巨噬细胞极化表型调控的效果。
[0052]
如图4所示,il-1β和il-10分别是重要的促炎炎症因子和抑炎炎症因子。培养小鼠巨噬细胞系raw264.7,铺入6孔板中(1
×
106/孔),过夜后,加入多糖修饰的纳米羟基磷灰石(ghanps)处理(50μg/ml),并同期设置空白对照组(control),未经修饰的羟基磷灰石组(hanps),24小时后收集各组细胞上清,通过elisa试剂盒检测il-1β和il-10的分泌水平。结果如图所示:多糖修饰的纳米羟基磷灰石处理小鼠巨噬细胞系raw264.7后可以观察到il-1β表达较control组和hanps组下降,il-10表达升高。表明合成的多糖修饰的纳米羟基磷灰石可以降低炎症水平,促进巨噬细胞向修复型转化。
[0053]
如图5所示,使用sd大鼠构建颅骨骨缺损模型,在颅骨双侧制备直径5mm,厚约1mm的圆形缺损,直至骨膜表面。以光敏型gelma水凝胶作为给药载体,以增加所制备材料在缺损部位的滞留性。分为四组:a)空白组,即control;b)负载ghanps的水凝胶组,即gel/ghanps;c)负载hanps的水凝胶组,即gel/hanps;d)空白水凝胶组,即gel。使用前,将所制备的材料进行超声震荡,充分分散,分别将5mg/ml的ghanps和hanps及等体积的pbs与水凝胶充分混匀。混匀后,将其注入颅骨缺损区,直至完全充满缺损区后用紫外光源进行固化。然后进行分层缝合。8周后进行颅骨取样,通过microct评估骨缺损愈合情况,结果显示:多糖修饰的纳米羟基磷灰石组可以显著促进颅骨缺损的愈合。
[0054]
表3.颅骨缺损的骨修复水平
[0055][0056]
与control组相比,*p《0.05;与gel组相比,
#
p《0.05;与gel/hanps组相比,
&
p《0.05。
[0057]
如图6所示,多糖修饰的纳米羟基磷灰石对牙周骨缺损修复的影响。使用c57bl/6
小鼠,通过丝线结扎双侧上颌第二磨牙,构建牙周炎小鼠模型,诱导牙周骨吸收。在结扎2周后去除结扎丝线。分为两组:a)control组;b)ghanps组。ghanps组将50μl ghanps
[0058]
(5mg/ml)注入牙周骨缺损区,control组给予等量的溶剂。1周后取样,通过microct评估骨修复情况,结果显示:多糖修饰的纳米羟基磷灰石可以显著促进牙周骨组织的修复。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。