利用微生物群和代谢物的力量治疗癌症
1.相关申请公开内容
2.本技术要求2019年11月1日提交的美国临时申请序列号62/929,340的权益,所述临时申请的公开内容特此以引用的方式整体并入。
3.序列公开内容
4.本技术包括作为其公开内容的一部分的生物序列表,所述生物序列表已通过efs-web以ascii格式提交并且特此以引用的方式整体并入。所述ascii副本创建于2020年10月30日,名称为“1159583o000001.txt”并且大小为6,261字节。
技术领域
5.本公开总体上涉及用于治疗癌症(并且在具体方面结肠直肠癌)的方法和组合物。在另一个方面,本公开涉及新的细菌菌株,以及它们的组合物和用途。
背景技术:
6.结肠直肠癌(crc)分别是西方国家女性和男性中第二常见和第三常见的恶性肿瘤(ferlay等人,2015)。除了对crc的发展至关重要的遗传畸变外,还鉴定了其他导致疾病的因素。这些包括微生物群和炎症,其中炎症可驱动或抑制crc发展。已知产生干扰素(ifn)-γ的1型辅助t(th1)细胞具有保护作用(mager等人,2016;mlecnik等人,2016;wang等人,2015),而产生白细胞介素(il)-17的th17细胞促进crc发展(galon等人,2006;grivennikov等人,2012;le gouvello等人,2008)。事实上,免疫系统的影响是如此强大,以至于与crc中的经典肿瘤-淋巴结-转移(tnm)系统相比,肿瘤中的免疫细胞浸润是更好的预后因素(anitei等人,2014;mlecnik等人,2016)。类似地,微生物群也影响crc进展(arthur等人,2012;dejea等人,2018),并且甚至可能改变化学治疗剂的功效(iida等人,2013;viaud等人,2013)。
7.免疫检查点阻断(icb)疗法是利用免疫系统的治疗潜力的有效抗癌策略。最值得注意的是,靶向细胞毒性t淋巴细胞相关抗原4(ctla-4)、程序性细胞死亡蛋白1(pd-1)或其配体(pd-l1)的icb抑制剂在各种癌症(包括黑素瘤、肾细胞癌和非小细胞肺癌)的治疗中显示了巨大成功(brahmer等人,2012;hodi等人,2010)。最近,开创性的工作表明,icb疗法的功效取决于某些促进icb的肠道细菌的存在(routy等人,2018;sivan等人,2015;vetizou等人,2015)。
8.尽管取得了这些令人兴奋的进展,但在crc中的icb治疗功效一直令人失望(brahmer等人,2012),所有crc患者中仅5%-10%有反应(le等人,2017)。此外,细菌增强icb疗法的功效的详细分子机制仍不清楚。在此,鉴定了三种促进crc中的icb功效的细菌物种,并将肌苷鉴定为促进th1介导的抗肿瘤免疫分化的关键细菌代谢物。
技术实现要素:
9.在一个方面,提供了一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方
法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌(olsenella profuse)、脐形欧尔森氏菌(olsenella umbonata)或齿龈欧陆森氏菌(olsenella uli)或它们的组合的细菌。
10.在一个方面,提供了一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属或它们的组合的细菌。
11.在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
12.在一个方面,提供了一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自以下的细菌:假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌,如以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
13.在一个方面,提供了一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自以下的细菌:假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.),如以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
14.在一个方面,提供了一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自以下的细菌:双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.),如以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
15.在一个方面,提供了免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌或它们的组合的细菌用于治疗患有癌症或疑似患有癌症的受试者的用途。所述细菌可包括以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
16.在一个方面,提供了免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属或它们的组合的细菌用于治疗患有癌症或疑似患有癌症的受试者的用途。所述细菌可包括以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
17.在一个方面,提供了免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌或它们的组合的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。所述细菌可包括以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
18.在一个方面,提供了免疫检查点抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)或它们的组合的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。所述细菌可包括以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
19.在一个方面,提供了免疫检查点抑制剂和一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.)或它们的组合的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。所述细菌可包括以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
20.在一个方面,提供了一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌或它们的组合的细菌以及任选的容器。在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
21.在一个方面,提供了一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属或它们组合的细菌以及任选的容器。在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
22.在一个方面,提供了一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌或它们的组合的细菌以及任选的容器。在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
23.在一个方面,提供了一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)的细菌以及任选的容器。在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
24.在一个方面,提供了一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.)的细菌和任选的容器。在一个示例性实施方案中,所述细菌选自以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株或以idac保藏号231020-03保藏的欧陆森氏菌属菌株或它们的组合。
25.在一个方面,提供了一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂。
26.在一个方面,提供了一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂。
27.在一个方面,提供了免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
28.在一个方面,提供了免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
29.在一个方面,提供了一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;和共刺激剂,以及任选的容器。
30.在一个实例中,所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
31.在一个示例性实施方案中,所述癌症是实体癌。在一个示例性实施方案中,所述癌症是血癌(例如,白血病或淋巴瘤)。
32.在另一个实例中,所述癌症选自非小细胞肺癌、小细胞肺癌、胃癌、睾丸癌、间皮瘤、头颈癌、胶质母细胞瘤、胸腺癌或梅克尔细胞癌。在另一个实例中,所述癌症选自白血病、骨髓增生性肿瘤(mpn)、骨髓异常增生综合征(mds)、慢性淋巴细胞性白血病(cll)、慢性髓细胞性白血病(cml)、急性淋巴母细胞性白血病(all)、急性骨髓性白血病(all)、骨髓异常增生综合征(mds)、霍奇金淋巴瘤(hl)、非霍奇金淋巴瘤(nhl)、多发性骨髓瘤(mm)、真性红细胞增多症(pv)、特发性血小板增多症(et)、原发性骨髓纤维化(pmf)、慢性嗜酸性粒细胞白血病或蕈样真菌病。
33.在一个实例中,所述癌症是错配修复缺陷,如mmrd结肠直肠癌、胃肠癌、子宫内膜癌、乳腺癌、前列腺癌、膀胱癌或甲状腺癌,和/或在患有林奇综合征的受试者中。在一个实例中,所述癌症是crc,所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。在示例性实施方案中,所述mmrd是基于一种或多种错配修复蛋白,例如mlh1、msh2、msh6和pms2基因的功能性表达的缺乏而确定。mmrd可由至少一种错配修复蛋白的功能丧失或表达降低,如由于例如mlh1基因中的基因甲基化引起。mmrd缺陷可通过错配修复蛋白的免疫组织化学分析来确定。所述mmrd可基于癌症组织学特征,例如在肿瘤的50%或更多中增加的肿瘤浸润淋巴细胞、髓质或微腺体形态和/或粘液或印戒细胞形态来确定。mmrd也可通过微卫星不稳定性(msi)的存在来鉴定。
34.在一个实例中,所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
35.在一个实例中,所述icb抑制剂是ctla-4、pd-1、pd-l1、pd-l2、lag-3、vista、ido、ido1 ido2、tigit、btla、hvem、cd226(dnam-1)、cd96(tactile)、tim-3、lair1、cd160
(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar或b7-h3的拮抗剂。
36.在一个实例中,所述icb抑制剂是ctla-4、pd-1、pd-l1、pd-l2、lag-3、vista、ido、ido1 ido2、tigit、btla、hvem、cd226(dnam-1)、cd96(tactile)、tim-3、lair1、cd160(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar或b7-h3的小分子拮抗剂。
37.在一个实例中,所述icb抑制剂包含特异性结合至ctla-4、pd-1、pd-l1、pd-l2、lag-3、vista、ido、ido1 ido2、tigit、btla、hvem、cd226(dnam-1)、cd96(tactile)、tim-3、lair1、cd160(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar或b7-h3的拮抗剂抗体。
38.在一个实例中,所述icb抑制剂包含ctla-4、pd-1、pd-l1、pd-l2、lag-3、vista、ido、ido1 ido2、tigit、btla、hvem、cd226(dnam-1)、cd96(tactile)、tim-3、lair1、cd160(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar或b7-h3的片段,或者包含前述中任一者的结合配偶体(例如,受体或配体)的片段。
39.在示例性实施方案中,所述icb抑制剂包含抗体、小分子或融合蛋白或它们的组合。在示例性实施方案中,所述icb抑制剂选自伊匹单抗(抗cdla-4抗体,bristol-myers squibb)、纳武单抗(抗pd-1抗体,bristol-myers squibb)、派姆单抗(抗pd-1抗体,merck)、阿特珠单抗(抗pd-l1抗体,roche)、阿维鲁单抗(抗pd-l1抗体,merck kgaa/pfizer)、德瓦鲁单抗(抗pd-l1抗体,medimmune/astrazeneca)、西米普利单抗(抗pd-1抗体,regeneron/sanofi)、兰布罗利珠单抗(抗pd-1抗体,merck)、匹地利珠单抗(抗pd-1和抗dll抗体,medivation)、bms-936559(抗pd-l1,bristol-myers squibb)、medi-0680(抗pd-1抗体;amp-514;astrazeneca)、regn2810(抗pd-1抗体,regeneron)、ca-170(小分子pd-1和pd-l1抑制剂;curis)、bms-1166(小分子pd-l1抑制剂,bristol-myers squibb)、amp-224(抗pd-1融合蛋白,medimmune)、斯巴达珠单抗(抗pd-1抗体,novartis)、sti-a1110(抗pd1抗体,sorrento/servier)、多塔利单抗(抗pd-1抗体,tsr-042,tesaro)、rg-7446(抗pd-l1抗体,roche)、aur-012(pd1的肽拮抗剂,aurigene)、sti-a1010(抗pd-l1抗体,sorrento)或它们的组合。
40.在一个实例中,所述双歧杆菌属在图22中呈现。
41.在一个实例中,所述乳杆菌属在图23中呈现。
42.在一个实例中,所述欧陆森氏菌属在图24中呈现。
43.在一个实例中,所述双歧杆菌属包含与seq id no:1具有至少85%,如至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列。
44.在一个实例中,所述乳杆菌属包含与seq id no:2具有至少85%,如至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列。
45.在一个实例中,所述欧陆森氏菌属包含与seq id no:3具有至少85%,如至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列。
46.在一个实例中,所述方法或用途或药盒或药盒的用途还包括施用化学治疗剂、免
疫治疗剂或放射疗法或它们的组合。
47.在一个实例中,所述受试者是人。所述人受试者可以是任何年龄,例如婴儿、儿童、青少年、成人或老年人。
48.在一个实例中,所述受试者是非人动物,如非人灵长类动物、伴侣动物(例如,哺乳动物,如犬、猫、雪貂、马、兔、豚鼠、沙鼠、仓鼠、栗鼠、大鼠、小鼠或其他小型哺乳动物;鸟;爬行动物;鱼;两栖动物;节肢动物)或家畜动物(例如,哺乳动物家畜动物,如牛、猪、绵羊、山羊、羊驼、驴、骆驼、水牛或貂;或鸡)。
49.在示例性实施方案中,所述细菌可以是提高体内或体外分泌测定中肌苷、黄嘌呤、次黄嘌呤和/或黄嘌呤一磷酸,优选肌苷或次黄嘌呤的水平的菌株。
50.在示例性实施方案中,可以有效量施用所述细菌以提高所述受试者中肌苷、黄嘌呤、次黄嘌呤和/或黄嘌呤一磷酸的水平。
51.在示例性实施方案中,可以有效量施用所述细菌以使所述癌症对用所述免疫检查点抑制剂治疗敏感。
52.在一个实例中,所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。在示例性实施方案中,所述mmrd是基于一种或多种错配修复蛋白,例如mlh1、msh2、msh6和pms2基因的功能性表达的缺乏而确定。mmrd可由至少一种错配修复蛋白的功能丧失或表达降低,如由于例如mlh1基因中的基因甲基化引起。mmrd缺陷可通过错配修复蛋白的免疫组织化学分析来确定。所述mmrd可基于癌症组织学特征,例如在肿瘤的50%或更多中增加的肿瘤浸润淋巴细胞、髓质或微腺体形态和/或粘液或印戒细胞形态来确定。mmrd也可通过微卫星不稳定性(msi)的存在来鉴定。
53.在一个实例中,所述共刺激剂是toll样受体(tlr)信号、cpg、lps、鞭毛蛋白、核苷酸结合寡聚结构域样受体(nlr)、内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物。rig-i样受体(视黄酸诱导型基因i样受体)、单链或双链rna(例如,来自病毒)、c型凝集素受体(clr)、重复甘露糖单元、c型凝集素结构域、细胞因子受体信号转导、il-12、il-18、il-33、ifn-g、通过抗原呈递细胞或其在t细胞上的对应物提供的刺激、cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40、-cgas-sting途径,例如胞质dna。
54.在另一个方面,本公开提供了一种分离的细菌,所述分离的细菌包含与seq id no:1具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性,优选与seq id no:1具有至少99.5%或具有100%同一性的16s rdna序列。
55.在另一个方面,本公开提供了一种分离的细菌,所述分离的细菌包含与seq id no:2具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性,优选与seq id no:2具有至少99.5%或具有100%同一性的16s rdna序列。
56.在另一个方面,本公开提供了一种分离的细菌,所述分离的细菌包含与seq id no:3具有至少85%,如至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性,优选与seq id no:3具有至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列。
57.在另一个方面,本公开提供了一种以idac保藏号231020-01保藏的假长双歧杆菌菌株的分离的细菌。
58.在另一个方面,本公开提供了一种以idac保藏号231020-02保藏的约氏乳杆菌菌株的分离的细菌。
59.在另一个方面,本公开提供了一种以idac保藏号231020-03保藏的欧陆森氏菌属菌株的分离的细菌。
60.在另一个方面,本公开提供了一种组合物,所述组合物包含前述细菌中的任一者的细菌和药学上可接受的载体。
61.在另一个方面,本公开提供了一种组合物,所述组合物包含有效量的用于治疗癌症的任何前述细菌,并且任选地还包含药学上可接受的载体。
62.在另一个方面,本公开提供了一种组合物,所述组合物包含两种或更多种前述细菌菌株的混合物,并且任选地还包含药学上可接受的载体。
63.在另一个方面,本公开提供了一种组合物,所述组合物包含有效量的用于治疗癌症的两种或更多种上述细菌菌株的混合物,并且任选地还包含药学上可接受的载体。
64.在另一个方面,本公开提供了一种包含前述细菌中的任一者的细菌的食品、饮料、食品补充剂、益生菌或营养制品,其优选地被配制用于摄入。
65.在示例性实施方案中,所述细菌在体外或体内测定中产生升高水平的肌苷、黄嘌呤、次黄嘌呤和/或肌苷一磷酸,优选肌苷。
66.在示例性实施方案中,所述细菌或组合物是冻干的。
67.在示例性实施方案中,所述细菌或组合物适合施用于受试者,优选人受试者。所述人受试者可以是任何年龄,例如婴儿、儿童、青少年、成人或老年人。所述受试者可以是非人动物,如非人灵长类动物、伴侣动物(例如,哺乳动物,如犬、猫、雪貂、马、兔、豚鼠、沙鼠、仓鼠、栗鼠、大鼠、小鼠或其他小型哺乳动物;鸟;爬行动物;鱼;两栖动物;节肢动物)或家畜动物(例如,哺乳动物家畜动物,如牛、猪、绵羊、山羊、羊驼、驴、骆驼、水牛或貂;或鸡)。
68.在示例性实施方案中,所述细菌或组合物适用于本文公开的任何方法,例如,如上所述的治疗癌症的方法。
69.在示例性实施方案中,所述细菌或组合物含有有效量的所述细菌,以用于根据本文公开的方法治疗患有癌症或疑似患有癌症的受试者。
附图说明
70.现在将参考附图,仅以举例的方式描述本公开的实施方案。
71.图1a-1j:在icb疗法后aom/dss肿瘤中的免疫细胞和微生物动力学。(a)aom/dss诱导的crc和icb治疗的实验设置概述。在用同种型抗pd-l1或抗ctla-4抗体治疗的动物中在诱导后140天的(b)肿瘤重量、(c)肿瘤数量、(d)ep-cam
lgr5
癌症干细胞和(e)肿瘤浸润白细胞(til)。(f)第140天肿瘤引流淋巴结中的cd8
t细胞频率。(g)cd4
或(h)cd8
t细胞中的脾脏ifn-γ
产生。(i)16s rrna基因v4区域扩增子测序以鉴定肿瘤组织中的细菌。与同种型治疗的动物相比,抗pd-l1/抗ctla-4的肿瘤中富集或减少的细菌分别以绿色或红色显示。(j)在厌氧条件下从来自抗pd-l1/抗ctla-4(icb组)或同种型(同种型组)治疗的动物的均质化肿瘤培养的细菌。描绘为绿色或红色的细菌只能分别在icb组或同种型组中培养。两
组中均存在被描绘为褐色的细菌。数据是(b-h)平均值
±
sem或(i)平均值
±
lfcse(对数倍数变化标准误差),并从三个单独实验中汇总。(b-f)n=16-20只小鼠/组,(g和h)n=4-5只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
72.图2a-2i:单独细菌物种可增强icb疗法。(a)用于评估单独细菌对抗ctla-4治疗功效的影响的实验设置的示意图。(b)肿瘤生长、(c)肿瘤重量、(d)活肿瘤细胞和(e)肿瘤的代表性图片在第18天示出。比例尺:1cm。肿瘤组织中第18天ifn-γ
和ki-67
cd8
t细胞的(f)代表性图和(g)定量。(h和i)与(f和g)相同,但针对cd4
t细胞。数据是平均值
±
sem,并从三个单独实验汇总(n=8-15只小鼠/组)。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
73.图3a-3n:b.p.、抗ctla-4和b.p.条件血清对t细胞分化和活化的影响。(a、h和k)实验设置的示意图。在第28天在所指示细菌存在下小肠(si)中cd3ε
cd4
细胞的t-bet
和t-bet
ifn-γ
事件的(b)代表性图和(c)定量。(d和e)与b和c相同,但在肠系膜淋巴结(mln)中。(f和g)与b和c相同,但在脾脏中。在第32天在所指示细菌和抗ctla-4治疗存在下,脾脏中cd3ε
cd4
t细胞的t-bet
和t-bet
ifn-γ
事件的(i)代表性图和(j)定量。(l)示出mc38肿瘤激发和随后的血清转移以及抗ctla-4治疗后32天的肿瘤生长和重量。肿瘤内ifn-γ
或ki-67
cd8
t细胞的(m)代表性图和(n)定量。数据是平均值
±
sem,并从两个单独实验汇总(a-j)n=10-11只小鼠/组。(k-n)n=5-7只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
74.图4a-4k:肌苷对t细胞分化的影响以及icb治疗功效对经典树突细胞的依赖性。(a)与c.sp.单定殖和无菌(gf)小鼠相比,抗ctla-4治疗的荷瘤b.p.单定殖小鼠的血清中非靶向代谢组学数据的散点图。灰色圆圈或虚线灰色圆圈分别描绘肌苷或肌苷片段/加合物。插图示出肌苷的提取离子色谱图(b)此图的图(a)中所示的血清中肌苷的强度(auc:曲线下面积)。(c)将初始cd4
t细胞与骨髓来源的树突细胞和ifn-γ共培养。在肌苷、a
2a
受体抑制剂(zm241385)、细胞渗透性camp(db-camp)和蛋白激酶a抑制剂(rp-8-cpt-camps)存在下共培养48小时后,t-bet
cd3ε
cd4
细胞的定量。(d)与(c)相同,无ifn-γ。(e)在存在或不存在肌苷的情况下,与抗cd3/抗cd28包被的珠粒一起培养1小时的初始cd4
t细胞中磷酸化creb(ser133)水平的代表性图和定量(左图和右图)。(f)在mc38肿瘤激发和抗ctla-4治疗期间耗减经典树突细胞的实验设置的示意性概述。肿瘤内(g)cd8
t细胞的频率(h)ifn-γ
cd8
t细胞。(i和j)与(g和h)相同,但cd4
t细胞和(k)第95天的肿瘤重量。数据是平均值
±
sem,并从两个单独实验汇总(a-b)n=5-8个样品/组(c-e)10-15个生物重复样品/组(f-k)10只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001
75.图5a-5l:肌苷促进th1活化和抗肿瘤免疫。(a)用于评估肌苷对体内th1活化的影响的实验设置的示意性概述。(b,c)mln中t-bet
ifn-γ
cd3ε
(b)cd8
或(c)cd4
t细胞的代表性点图和定量(分别为左图和右图)。(d)用于评估肌苷对抗肿瘤免疫的影响的实验设置的示意性概述。在可触及肿瘤后,将小鼠用100μg抗ctla-4i.p.(每72小时5次)且在一些组中20μg cpg i.p.(每72小时5次)治疗。此外,肌苷(300mg/kg/bw)或pbs每日口服(o)、通过管饲或通过i.p.注射全身(s)给予。示出(e)肿瘤重量和(f)cd4
或(g)cd8
细胞中的ifn-γ
细胞的定量。(h).用于评估肌苷诱导的抗肿瘤免疫对a2ar信号转导的需求的示意性概述。注射1x106个mc38细胞(s.c.)和wt或a2ar-缺陷型1x107个t细胞(i.v.6x106个cd4
和4x106个
cd8
细胞)。在可触及肿瘤后,将小鼠用100μg抗ctla-4、20μg cpg(每72小时4次,两者均i.p.)和肌苷(每日,300mg/kg/bw,通过管饲)治疗。(i)示出第20天肿瘤的图片。比例尺:1cm。示出(j)肿瘤重量和肿瘤中(k)cd8
或(l)cd4
细胞中的ifn-γ
的定量。数据是平均值
±
sem,并从两个单独实验汇总(a-l)10-11只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001。
76.图6a-6j:icb治疗功效是crc亚型依赖性的。(a、c、e和h)用于评估icb促进细菌在不同crc亚型中的作用的实验设置的示意性概述。(b和d)同种型、抗ctla-4或icb促进(b.p.l.j.o.sp.)或对照(c.sp.p.sp.)和抗ctla-4共同治疗的apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre动物。(f)肿瘤内ifn-γ
ki-67
cd8
t细胞的代表性图和定量和(g)msh2
loxp/loxp
villin-cre小鼠的肿瘤重量。(i和j)与(f和g)相同,但针对细菌抗ctla-4共同治疗和抗il-12p75共同治疗的小鼠,如所指示。数据是平均值
±
sem,并从(b和f)五个或(d和i)三个单独实验汇总。(b)n=8-9、(d)n=6-7、(f和g)n=10、(i和j)n=7-9只小鼠/组。*,p《0.05;**,p《0.01。
77.图7a-7t:icb治疗功效需要细菌。(a)确定细菌是否调节icb治疗功效的实验设置的示意性概述。(b)第28天的肿瘤重量。第28天(d)ifn-γ
和(e)ki-67
cd4
t细胞的肿瘤内(c)代表性图和定量。(f-g)与(c-e)相同,但针对cd8
t细胞。第28天(j)ifn-γ
和(k)ki-67
cd4
t细胞的脾脏(i)代表性图和定量。(l-n)与(i-k)相同,但针对cd8
t细胞。数据从两个单独实验汇总(n=5-10只小鼠/组)。(o)将spf小鼠注射1x106个mc38 s.c.并且7天后,在可触及肿瘤后,将小鼠用100μg抗ctla-4i.p.治疗。(每72小时5次)。抗生素(abx)组中的小鼠通过饮用水口服抗生素混合物(氨苄西林1mg/ml、粘菌素1mg/ml和链霉素5mg/ml),从mc38细胞注射前7天开始直到实验结束,而水组中的小鼠接受常规水。在最后一次抗ctla-4注射后三天分析肿瘤。(p)肿瘤重量,第25天肿瘤组织中的cd4
t细胞中(q)ifn-γ
和(r)ki-67
的定量。(s和t)与(q和r)相同,但cd8
细胞。(n=9-10只小鼠/组)。数据是平均值
±
sem。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
78.图8a-8c:icb治疗的动物的微生物群动力学和icb治疗后粪便样品中的富集。(a)与同种型治疗的动物相比,抗pd-l1/抗ctla-4(icb)的肿瘤中16s rrna基因v4区扩增子测序的加权unifrac pcoa分析。(b)与(a)相同,但针对粪便样品。(c)16s rrna基因v4区域扩增子测序以鉴定用icb或对照疗法治疗的小鼠的粪便样品中的细菌。与同种型治疗的动物相比,在抗pd-l1/抗ctla-4(icb)的粪便样品中富集或减少的细菌分别以绿色或红色显示。数据是平均值
±
lfcse(对数倍数变化标准误差)(n=7-14只小鼠/组)。统计数据:(a)和(b)permanova,(c)benjamini-hochberg。
79.图9a-9f:b.p.增强抗pd-l1治疗功效。(a)将无菌小鼠用b.p.或c.sp.单定殖。7天后,s.c.注射1x106个mc38细胞,并且7天后,在可触及肿瘤后,将小鼠用100μg抗pd-l1 i.p.治疗。(每72小时5次)。在最后一次抗pd-l1注射后三天分析肿瘤。(b)肿瘤重量,示出在第18天肿瘤组织中cd4
细胞中(c)ifn-γ
和(d)ki-67
的定量。(e和f)与(c和d)相同,但是cd8
细胞。数据是平均值
±
sem(n=7只小鼠/组)。*,p《0.05;**,p《0.01;***,p《0.001。
80.图10a-10j:单独细菌不会影响肿瘤发展。(a)用于确定单独b.p.是否具有抗肿瘤性质的实验设置的概述。(b)肿瘤生长,(c)肿瘤重量和(d)示出肿瘤的代表性图片,比例尺:1cm。实验结束时肿瘤内ifn-γ
(e)cd8
或(f)cd4
t细胞。实验结束时脾脏(g)ifn-γ
或(h)ki-67
cd8
或(i)ifn-γ
或(j)ki-67
cd4
t细胞。数据是平均值
±
sem。(a-j)n=7只小鼠/
组。
81.图11a-11b:细菌不会易位至肿瘤组织中。(a)抗ctla-4疗法开始后18天,所指示定殖小鼠的粪便和肿瘤组织的sytox绿色核酸染色的代表性图片。(b)所指示定殖小鼠的粪便和肿瘤组织的全长16srrna扩增子的琼脂糖凝胶。
82.图12a-12r:b.p.对t细胞的分化和活化的影响。将gf动物在分析前用b.p.、c.sp.单定殖或保持gf持续28天。表达(a)rorγt和il-17a、(b)rorγt、(c)foxp3或(d)初始t细胞(定义为rorγt-gata3-foxp3-t-bet-)的小肠cd3e
cd4
t细胞。(e)表达t-bet的小肠cd3e
cd8
t细胞。(f-j)与(a-e)相同,但为mln。(k-o)与(a-e)相同,但为脾脏。(p-q)将gf动物如所指示进行定殖植,并在定殖14天后用抗ctla-4治疗(每72小时5次)。(p)t-bet
ifn-γ
cd3e
cd8
或(q)初始(定义为rorγt-gata3-foxp3-t-bet-)cd4
脾脏t细胞的定量。(r)抗ctla-4治疗的不同定殖小鼠的肿瘤中cd8
ifn-γ
和cd4
ifn-γ
t细胞的相关性。数据是平均值
±
sem,并从两个单独实验汇总(a-q)n=5-11只小鼠/组。(p)n=46只小鼠。*,p《0.05;**,p《0.01。
83.图13a-13d.抗ctla-4治疗后屏障完整性降低。收集来自用或不用抗ctla-4治疗的单定殖小鼠的血清并评估对共生细菌的结合。(a)单定殖小鼠中抗ctla-4治疗后的全身性igg2b和igg1抗体反应。(b)收集用或不用抗ctla-4治疗的b.p.或c.sp.单定殖小鼠的空肠,并通过在尤斯灌流室(ussing chamber)中测量的跨上皮电阻来评估屏障完整性。(c)用或不用抗ctla-4治疗的b.p.或c.sp.单定殖小鼠的小肠的组织学炎症评分。由经过委员会认证的病理学家进行的盲法评分揭示没有炎症(比例尺=100μm)。(d)测量了有或没有抗ctla-4治疗(100μg i.p.,每72小时5次)的b.p.或c.sp.单定殖小鼠的血清中促炎性细胞因子的水平。来自dss治疗的spf小鼠的血清(2%dss持续5天)用作全身炎性细胞因子的阳性对照。数据是平均值
±
sem,并从两个单独实验汇总。(a)n=9-13只小鼠/组。(b)n=6-11只小鼠/组(c)n=4只小鼠/组(d)n=5只小鼠/组(阳性对照n=2只小鼠)。*,p《0.05;**,p《0.01;***,p《0.001,****,p《0.0001
84.图14a-14f:血清转移和抗ctla-4治疗后的全身抗肿瘤免疫。将gf动物用mc38肿瘤细胞激发。十天后,小鼠接受了抗ctla-4治疗的荷瘤动物的血清(i.v.)。然后用抗ctla-4额外治疗小鼠(每72小时3次)。将血清供体用b.p.、c.sp.定殖或保持gf,如所指示。肿瘤内(a)ifn-γ
或(b)ki-67
cd4
t细胞。脾脏(c)ifn-γ
或(d)ki-67
cd8
t细胞。(e和f)与(c和d)相同,但是cd4
t细胞。数据是平均值
±
sem。(a-f)n=5-8只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
85.图15a-15f:体外和体内肌苷水平。(a)与c.sp.单定殖小鼠相比,抗ctla-4治疗的荷瘤b.p.单定殖小鼠的血清中非靶向代谢组学数据的散点图。灰色圆圈标识肌苷信号。(b)与gf小鼠相比,抗ctla-4治疗的荷瘤b.p.单定殖小鼠的血清中非靶向代谢组学数据的散点图。灰色圆圈标识肌苷信号。(c)所指示细菌或bhi培养基的培养上清液中肌苷的强度(auc:曲线下面积)。(d)肌苷的平行反应监测分析(hcd设定在50ev)比较在掺杂和不掺杂50um肌苷的bhi培养基中观察到的断裂图案以及在bhi培养基中培养的b.p.。每个相应样品的提取离子色谱图显示在右图中。(e)b.p.单定殖小鼠的十二指肠、空肠或盲肠内容物中以及b.p.或c.sp单定殖且抗ctla-4治疗的小鼠的血清中的肌苷浓度。(f)未治疗(spf)的荷瘤抗ctla-4i.p.(spf 抗ctla-4)或抗ctla-4加抗生素(spf abx 抗ctla-4)治疗的spf定殖小鼠
的血清中的肌苷浓度。抗ctla4治疗:(100μg每72小时5次)。抗生素:氨苄西林1mg/ml、粘菌素1mg/ml和链霉素5mg/ml通过饮用水口服32天。数据是平均值
±
sem,并从两个单独实验汇总。(c)n=5个生物重复样品/组。(e)n=8-11只小鼠/组。(f)n=6个样品/组。**,p《0.01;***,p《0.001,****,p《0.0001。
86.图16a-16j:肌苷对th1 t细胞分化的背景依赖性影响。(a)将初始cd4
t细胞与骨髓来源的树突细胞在没有ifn-γ的情况下共培养。如所指示,在存在或不存在肌苷和抗ctla-4的情况下共培养48小时后,t-bet
cd3e
cd4
t细胞的定量。(b)将初始cd4
t细胞在没有ifn-γ的情况下以1:1的比例与抗cd3/抗cd28包被的珠粒一起培养48小时。在存在或不存在肌苷的情况下,cd4
t细胞上的il12rβ2表面表达的代表性图和定量(左图和右图)。(c)如所指示,在存在或不存在肌苷、db-camp和抗ctla-4的情况下共培养48小时后,t-bet
cd3e
cd4
t细胞的定量。(d)将初始a2ar-缺陷型cd4
t细胞在没有ifn-γ的情况下以1:1的比例与抗cd3/抗cd28包被的珠粒一起培养。在存在或不存在肌苷或db-camp的情况下共培养48小时后t-bet
cd3e
cd4
t细胞的定量(e)在刺激后1小时在存在或不存在肌苷或db-camp的情况下抗cd3/抗cd28珠粒共培养的cd4
t细胞的pcreb表达的代表性图和定量(左图和右图)。通过流式细胞仪进行分析。(f和g)用抗cd3/抗cd28包被的珠粒以1:1的比例培养初始野生型cd4
t细胞。在肌苷(1mm)刺激后24和48小时评估il12rb2和ifng基因转录物(针对gapdh归一化)。将表达针对用培养基处理的细胞归一化。通过定量pcr测定进行分析(h)将初始cd4
t细胞在没有ifn-γ的情况下以1:1的比例与抗cd3/抗cd28包被的珠粒一起培养24小时。然后在评估t细胞分化和活化之前以所指示浓度添加肌苷或媒介物再持续48小时。(i)b.p.单定殖小鼠的十二指肠、空肠或盲肠内容物中以及b.p.或c.sp.单定殖的抗ctla-4治疗的小鼠的血清中的腺苷浓度。(j)将初始cd4
t细胞在没有ifn-γ的情况下以1:1的比例与抗cd3/抗cd28包被的珠粒一起培养24小时。然后以所指示的浓度添加腺苷持续48小时,然后通过流式细胞术评估t细胞分化和活化。数据是平均值
±
sem并示出2个单独实验的汇总数据(a和b)n=10-16,(c)n=5-10个生物重复样品/组,(d和e)n=6个生物重复样品/组,(f和g)n=5个生物重复样品/组,(h)n=8个生物重复样品/组,(i)n=8只小鼠/组(j)n=6个生物重复样品/组。*,p《0.05;**,p《0.01;****,p《0.0001。
87.图17a-17b.肌苷不会直接影响肿瘤细胞活力或调节肿瘤细胞以进行t细胞介导的杀伤。(a)将mc38肿瘤细胞在体外用所指示剂量的肌苷处理72小时。通过流式细胞术评估细胞死亡和存活。(b)将表达全长卵白蛋白的mc38肿瘤细胞(mc38-ova)在体外用所指示剂量的肌苷处理72小时。并行地,将分别来自ot-ii和ot-i小鼠的脾脏的ova特异性初始cd4和cd8 t细胞用抗cd3/抗cd28珠粒和rmil-2(20iu/ml)活化72小时。然后从条件化mc38-ova细胞中洗去肌苷,并添加新鲜培养基和活化的t细胞(100,000个mc38-ova细胞 25,000个cd4细胞 25,000个cd8细胞)。72小时后,通过流式细胞术评估mc38-ova细胞的细胞死亡和存活。当与初始ova特异性cd4和cd8 t细胞共培养时,灰色和黑色点划线指示mc38-ova细胞活力和死亡。数据是平均值
±
sem,并从两个单独实验汇总。n=6个生物重复样品/条件。#,&p《0.05,**,p《0.01;(**=对比10mm,0.0001,#对比10mm,0.001和对比10mm,1)
88.图18a-18h:icb的细菌依赖性作用需要经典树突细胞。(a)经典树突细胞(mhcii
cd11c
b220-cd64-)和巨噬细胞(mhcii
cd11c
b220-,cd64
)中的il-12p70表达(b)巨噬细胞和cdc中的il-12p70表达的定量。在mc38肿瘤激发后,骨髓嵌合小鼠中的经典树突细胞被白
喉毒素(dt)耗减,然后进行抗ctla-4治疗(关于实验设置,参见图4h)。脾脏(c)ifn-γ
cd8
或(d)ki-67
cd8
t细胞的定量。(e和f)与(c和d)相同,但针对cd4
t细胞。(g和h)将1x106个mc38细胞(s.c.)注射到gf小鼠中。7天后,在可触及肿瘤后,将小鼠用100μg抗ctla-4i.p.(每72小时5次)且在一些组中20μg cpg i.p.(每72小时5次)治疗。此外,肌苷(300mg/kg/bw)或pbs每日口服(o)、通过管饲或通过i.p.注射全身(s)给予。示出ki-67
细胞的定量。数据是平均值
±
sem,并示出来自2个单独实验的汇总数据。(a-f)n=10只小鼠/组。(g-h)n=6-7只小鼠/组。*,p《0.05***,p《0.001;****,p《0.0001。
89.图19a-19f:msh2
loxp/loxp
villin-cre小鼠中icb治疗功效的细菌依赖性增强。将msh2
loxp/loxp
villin-cre小鼠用抗ctla-4、icb促进或对照细菌和/或抗il-12p75治疗(关于详细实验设置,参见图5e和h)(a)肿瘤内ifn-γ
ki-67
cd4
t细胞的代表性图和定量。(b)与(a)相同,但针对细菌抗ctla-4共同治疗和抗il-12p75共同治疗的动物,如所指示。(c)肿瘤内crc干细胞(定义为ep-cam
lgr5
)的代表性图和定量。(d)与(c)相同,但针对细菌抗ctla-4共同治疗和抗il-12p75共同治疗的动物,如所指示。(e)肿瘤浸润白细胞(til)的代表性图和定量。(f)与(e)相同,但针对细菌抗ctla-4共同治疗和抗il-12p75共同治疗的动物,如所指示。数据是平均值
±
sem,并从(a、c和e)五个或(b、d和f)三个单独实验汇总。(a、c和e)n=10(b、d和f)n=7-9只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001。
90.图20a-20d:奥沙利铂、抗pd-l1共同疗法通过icb促进细菌增强。(a)用于评估icb促进细菌在msh2
loxp/loxp villin-cre小鼠中的作用的实验装置的示意性概述。出生后319天,通过饮用水口服给予抗生素持续7天(氨苄西林1mg/ml、粘菌素1mg/ml和链霉素5mg/ml)。然后将msh2
loxp/loxp villin-cre小鼠用奥沙利铂、抗pd-l1和icb促进(b.p.、l.j.和o.sp.)或对照细菌(c.sp.和p.sp.)治疗。细菌通过管饲间隔72小时给予5次,100μg抗pd-l1间隔72小时给予5次,i.p.,奥沙利铂2.5mg/kg/bw间隔7天给予3次,i.p.。(b)msh2
loxp/loxp
villin-cre小鼠的肿瘤重量。(c)解剖肿瘤的代表性图片。(比例尺:1cm)(d)肿瘤浸润白细胞(til)的定量。数据是平均值
±
sem。n=5-7只小鼠/组**,p《0.01。
91.图21:细菌诱导的icb功效增强的机制。icb促进细菌系统性地增加肌苷水平,这与肠道屏障完整性的icb依赖性降低有关。肌苷介导的a
2a
受体参与导致细胞内camp、蛋白激酶a活化和转录因子creb的最终磷酸化增加。与通过抗ctla-4治疗进一步实现的tcr刺激一起,这导致t细胞上il12受体的表达增加。经典树突细胞(cdc)样品抗原并且是il-12的主要细胞来源。由cdc产生的il-12通过诱导t-bet(tbx21)表达和t细胞活化来诱导th1分化。cdc是th1 t细胞的微生物抗ctla-4诱导的ifn-γ(ifng)产生所必需的,其在癌症中具有保护作用。
92.图22-24.双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)和欧陆森氏菌属(o.sp.)的列表。表示出基于全长16s序列与实施例中鉴定的序列具有超过84%-95%同一性的双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)和欧陆森氏菌属(o.sp.)的序列id(分别图22、23和24)。
93.图25-27.所施用菌株的16s rdna序列,分别以idac保藏号231020-01保藏的假长双歧杆菌菌株、以idac保藏号231020-02保藏的约氏乳杆菌菌株和以idac保藏号231020-03保藏的欧陆森氏菌属菌株。seq id no:1与假长双歧杆菌球状亚种菌株ru 224的16s rrna序列具有99%同一性。seq id no:2与约氏乳杆菌菌株cip 103620的16s rrna序列具有99%同一性。seq id no:3与茂盛欧尔森氏菌菌株dsm 13989具有94%同一性,与脐形欧尔
森氏菌菌株lac31具有94%同一性,并且与齿龈欧陆森氏菌菌株dsm 7084具有94%同一性。
94.图28.与c.sp.或gf小鼠相比,用b.p.单定殖的小鼠血清中转移血清样品中的选定代谢物的水平的比较。与来自c.sp.单定殖或gf小鼠的血清相比,来自b.p.单定殖小鼠的血清中的嘌呤代谢物肌苷显著更丰富(8至9倍)。值得注意的是,黄嘌呤和次黄嘌呤(肌苷的降解产物)在b.p.单定殖小鼠的血清中也升高。
95.图29a-29f.(a)实验设置的示意图,(b)mc38荷瘤和抗ctla-4治疗(5次,间隔72小时)的单定殖小鼠中实验结束时的肿瘤和肿瘤重量。(c)在(b)中显示的小鼠的血清中测量的肌苷浓度。(d)在bhi培养基中在体外所指示细菌的次黄嘌呤产生。(e)mc38荷瘤和抗pd-1治疗(5次,间隔72小时)的单定殖小鼠中实验结束时的肿瘤和肿瘤重量。(f)mb49荷瘤和抗ctla-4治疗(4次,间隔72小时)的单定殖小鼠中实验结束时的肿瘤和肿瘤重量。数据是平均值
±
sem。n=4-5只小鼠/组。(b)双因素anova与邦弗朗尼(bonferroni)事后检验。(e和f)学生t检验。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。在图30b-30d中标记为假长双歧杆菌 对照和在图30e-30f中标记为假长双歧杆菌的菌株是以idac保藏号231020-01保藏的菌株。
96.图30a-30d.(a)与同种型治疗的动物相比,抗pd-l1/抗ctla-4(icb)的粪便中16s rrna基因v4区扩增子测序的加权unifrac pcoa分析。(b)16s rrna基因v4区域扩增子测序以鉴定用icb或对照疗法治疗的小鼠的粪便样品中的细菌。与同种型治疗的动物相比,在抗pd-l1/抗ctla-4(icb)的粪便样品中富集或减少的细菌分别以绿色或红色显示。(c)与(b)相同,但针对肿瘤样品。与同种型治疗的动物相比,(d)抗ctla-4和(e)抗pd-l1的肿瘤中富集或减少的细菌分别以绿色或红色显示。如d和e与图1i中的数据相同,但因治疗分开。数据是(a)平均值 /-lfcse(对数倍数变化标准误差)。(a-c)n=5-14只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
97.图31a-31e.单独细菌不会影响肿瘤发展。(a)实验设置的示意图,示出无菌(gf)或单定殖(假长双歧杆菌、大肠埃希菌物种、约氏乳杆菌或欧陆森氏菌属物种)mc38荷瘤小鼠中的(b)肿瘤生长、(c)肿瘤重量以及肿瘤内ifn-γ (d)cd8 和(e)cd4 t细胞的定量。数据是平均值
±
sem(b-e)n=5小鼠/组。*,p《0.05;**,p《0.01;****,p《0.0001。
98.图32.体外肌苷水平。与所指示细菌的培养上清液中的肌苷培养基相比的倍数诱导。
99.图33a-33f.b细胞及其反应对于假长双歧杆菌增强的icb治疗功效来说不是必需的。(a)将无菌(gf)野生型或igh-/-小鼠用假长双歧杆菌定殖或保持gf。7天后,s.c.注射1x106个mc38细胞,并且7天后在可触及肿瘤时,将小鼠用100μg抗ctla-4i.p.治疗。(每72小时5次)。在最后一次抗ctla-4注射后三天分析肿瘤。(b)示出第18天的肿瘤重量和肿瘤组织中的(c)cd4 和(d)cd8 细胞中的ifn-γ 的定量。(e和f)与(c和d)相同,但针对ki-67 细胞。数据是平均值 /-sem。n=4-7只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。
100.图34a-34h.嗜粘蛋白艾克曼菌和约氏乳杆菌促进抗ctla-4功效并且依赖于a2ar的t细胞表达。(a)用于评估嗜粘蛋白艾克曼菌诱导的抗肿瘤免疫对a2ar信号转导的需求的示意性概述。将无菌rag-1缺陷型小鼠管饲嗜粘蛋白艾克曼菌,并且7天后注射1x106个mc38细胞(s.c.)和wt或a2ar缺陷型1x107个t细胞(i.v.6x106个cd4 和4x106个cd8 细胞)。在可
触及肿瘤后,将小鼠用100μg抗ctla-4治疗(每72小时4次)。示出第27天的(b)肿瘤图片(比例尺:1cm)和(c)肿瘤重量。(d)示出肿瘤中cd8 或cd4 细胞中的ifn-γ 的定量。(e-h)与(a-d)相同,但在约氏乳杆菌单定殖小鼠中。数据是平均值 /-sem和(a-h)n=7只小鼠/组。p《0.05;**,p《0.01;***,p《0.001。
101.图35a-35h.肌苷和活假长双歧杆菌提高适度多样化和复杂微生物群系中的抗ctla-4治疗功效。a)用于评估肌苷对用12种细菌稳定定殖的限菌小鼠(oligo-mm12)中的抗肿瘤免疫的影响的实验设置的示意性概述。在可触及肿瘤后,将oligo-mm12定殖小鼠用100μg抗ctla-4i.p.或同种型抗体治疗(每72小时5次)。此外,每天通过管饲口服给予肌苷(300mg/kg/bw)或pbs。示出第20天的(b)肿瘤图片和(c)肿瘤重量。比例尺:1cm。(d)示出cd8 或cd4 t细胞中的肿瘤内ifn-γ 细胞的定量。(e)用于评估肌苷和假长双歧杆菌对spf小鼠中的抗肿瘤免疫的影响的实验设置的示意性概述。在mc38注射后,一些小鼠在饮用水中接受抗生素(abx),特别是氨苄西林1mg/ml、粘菌素1mg/ml和链霉素5mg/ml,持续7天。在可触及肿瘤时,除去抗生素并开始100μg抗ctla-4(每72小时5次)。小鼠同时接受通过管饲口服的pbs、肌苷(每天300mg/kg/bw)、假长双歧杆菌或热灭活(h.i.)假长双歧杆菌(每72小时5次)。示出第20天的(f)肿瘤图片和(g)肿瘤重量。比例尺:1cm。(h)示出cd8 或cd4 细胞中的肿瘤内ifn-γ 细胞的定量。数据是平均值 /-sem和(a-h)n=7只小鼠/组。p《0.05;**,p《0.01,***,p《0.001。
102.图36a-36b.在msh2loxp/loxpvillin-cre小鼠的肿瘤中双歧杆菌的富集。将spf msh2loxp/loxpvillin-cre在出生后10个月用100μg同种型抗体、抗ctla-4或抗pd-l1治疗(每72小时5次)。最后一次治疗后三天,收集肿瘤组织。评估了肿瘤组织中的(a)16s和(b)双歧杆菌dna拷贝数(针对所有16s拷贝数归一化)。通过定量pcr分测定进行分析。n=7-11个肿瘤/组(从同种型组中的4只单独小鼠和icb治疗组中的8只单独小鼠收集的肿瘤)。*,p《0.05。
103.图37a-37b.与无反应癌症患者相比,反应者中的双歧杆菌丰度。(a)接受检查点阻断疗法的非小细胞肺癌和肾细胞癌患者的粪便样品中假长双歧杆菌的丰度(n=37名无反应者和44名反应者)(8)。假长双歧杆菌丰度针对无反应者进行归一化。(b)接受检查点阻断疗法的黑素瘤患者的粪便样品中双歧杆菌的丰度(n=24名无反应者和13名反应者)(9)。双歧杆菌丰度针对无反应者进行归一化。
104.图38.体内肌苷水平。用抗ctla-4或抗pd-l1治疗的假长双歧杆菌单定殖小鼠的十二指肠、空肠或盲肠内容物中以及假长双歧杆菌或大肠埃希菌属单定殖小鼠的血清中的肌苷浓度。n=8-11只小鼠/组。***,p《0.001,****,p《0.0001。
105.图39.抗ctla-4治疗后屏障完整性降低。收集来自用或不用抗ctla-4治疗的单定殖小鼠的血清并评估对共生细菌的结合。n=6-11只小鼠/组。*,p《0.05;**,p《0.01;***,p《0.001,****,p《0.0001。
具体实施方式
106.总体上,本公开提供了用于治疗患有癌症或疑似患有癌症的受试者的化合物和/或组合物。
107.在一些实例中,所述癌症可以是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌或肾癌。
在其他实例中,所述癌症可以是乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌、子宫癌或如本文公开的其他癌症。
108.在一个具体方面,本公开提供了用于治疗患有结肠直肠癌(crc)或疑似患有crc的受试者的化合物和/或组合物。
109.在一个方面,描述了治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属物种的细菌。
110.在一个方面,描述了治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌。
111.在一个具体实例中,所述癌症可以是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌或肾癌。在其他实例中,所述癌症可以是乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌、子宫癌。
112.在一个方面,描述了治疗患有crc或疑似患有crc的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌。
113.在一个方面,描述了治疗患有crc或疑似患有crc的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)的细菌。
114.在一个方面,描述了治疗患有crc或疑似患有crc的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和一种或多种选自图22中列出的长双歧杆菌属(b.p.)、图23中列出的乳杆菌属(l.sp.)或图24中列出的欧陆森氏菌属(o.sp.)的细菌。
115.在一个方面,描述了治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和肌苷、肌苷的衍生物、肌苷的功能衍生物或肌苷的生理学功能衍生物。
116.在一个具体实例中,所述癌症可以是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌或肾癌。在其他实例中,所述癌症可以是乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌、子宫癌。
117.在一个方面,描述了治疗患有crc或疑似患有crc的受试者的方法,所述方法包括或由以下组成:施用icb抑制剂和肌苷、肌苷的衍生物、肌苷的功能衍生物或肌苷的生理学功能衍生物。
118.如本文所用,术语“免疫检查点”、“检查点途径”和“免疫检查点途径”是指免疫检查点配体与免疫检查点受体的结合调节免疫细胞活化的幅度和质量的途径。
119.免疫检查点蛋白包括但不限于细胞毒性t淋巴细胞相关抗原4(ctla-4)(也称为cd152)、程序性细胞死亡蛋白1(pd-1)(也称为cd279)、pd-1配体(pd-l1或cd274、pd-l2或cd274)、淋巴细胞活化基因3(lag-3)(也称为cd223)、b7-h3(cd276)、t细胞活化的v结构域ig抑制因子(vista)、靶向吲哚胺2'3'双加氧酶的疗法(ido、ido1和ido2)、tigit(也称为具有ig和itim结构域的t细胞免疫受体)、b和t淋巴细胞衰减子(btla)、疱疹病毒进入介质(hvem)、cd226(dnam-1)和cd96(tactile)、t细胞免疫球蛋白粘蛋白(tim-3)(也称为
havcr2)、lair1(白细胞相关免疫球蛋白样受体1;cd305)、cd160(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar或b7-h3。
120.如本文所用,术语“免疫检查点阻断”或“icb”是指施用一种或多种免疫检查点蛋白或其配体的一种或多种抑制剂。因此,术语“免疫检查点阻断”是指通过施用或表达“阻断剂”或“抑制剂”来抑制免疫检查点途径。通常,“阻断剂”阻止免疫检查点受体和配体的相互作用,从而抑制检查点途径。阻断剂可以是与免疫检查点配体或免疫检查点受体结合并抑制icr/icl复合物的形成的小分子、肽、抗体或其片段等。阻断剂也可通过阻止icr/icl复合物的信号转导而发挥作用。示例性icb剂包括抗体、融合蛋白和小分子,如伊匹单抗(抗cdla-4抗体,bristol-myers squibb)、纳武单抗(抗pd-1抗体,bristol-myers squibb)、派姆单抗(抗pd-1抗体,merck)、阿特珠单抗(抗pd-l1抗体,roche)、阿维鲁单抗(抗pd-l1抗体,merck kgaa/pfizer)、德瓦鲁单抗(抗pd-l1抗体,medimmune/astrazeneca)、西米普利单抗(抗pd-1抗体,regeneron/sanofi)、兰布罗利珠单抗(抗pd-1抗体,merck)、匹地利珠单抗(抗pd-1和抗dll抗体,medivation)、bms-936559(抗pd-l1,bristol-myers squibb)、medi-0680(抗pd-1抗体;amp-514;astrazeneca)、regn2810(抗pd-1抗体,regeneron)、ca-170(小分子pd-1和pd-l1抑制剂;curis)、bms-1166(小分子pd-l1抑制剂,bristol-myers squibb)、amp-224(抗pd-1融合蛋白,medimmune)和斯巴达珠单抗(抗pd-1抗体,novartis)。
121.如本文所用,术语“免疫检查点抑制剂”是指完全或部分减少、抑制、干扰或调节一种或多种检查点蛋白的分子。检查点蛋白调控t细胞活化或功能。这些蛋白质负责t细胞反应的共刺激性或抑制性相互作用。免疫检查点蛋白调控和维持自我耐受性以及生理免疫反应的持续时间和幅度。在一些实施方案中,可向受试者施用可增强或加工免疫反应的额外剂,例如由本文提供的结合分子(例如,bcma结合分子)、重组受体、细胞和/或组合物实现的针对疾病或疾患(例如癌症,例如本文所述的任何疾病或疾患)的免疫反应。
122.免疫检查点抑制剂包括以统计学显著方式阻断或抑制免疫系统的抑制性途径的任何剂。此类抑制剂可包括结合并阻断或抑制免疫检查点受体、配体和/或受体-配体相互作用的小分子抑制剂或可包括抗体或其抗原结合片段。在一些实施方案中,特定受体的调节、增强和/或刺激可克服免疫检查点途径组分。
123.术语“抑制”、“阻断”以及“压制”可互换使用并且是指任何统计学显著的生物活性的降低,包括活性的完全阻断。
[0124]“抑制剂”是在体外或体内抑制、阻断或遏制生物活性的活性剂。
[0125]
抑制剂包括但不限于小分子化合物;核酸,如sirna和shrna;多肽,如抗体或其抗原结合片段、显性阴性多肽、抑制性肽和融合蛋白;以及寡核苷酸或肽适体。
[0126]
在一个具体实例中,icb抑制剂是抗ctla4抗体,或抗pd-l1抗体,或抗pd-1抗体。
[0127]
共刺激剂的非限制性实例包括:toll样受体(tlr)信号,例如cpg、lps、鞭毛蛋白;核苷酸结合寡聚结构域样受体(nlr),例如内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物;rig-i样受体(视黄酸诱导型基因i样受体),例如单链或双链rna(例
如,来自病毒);c型凝集素受体(clr),例如重复甘露糖单元、c型凝集素结构域;细胞因子受体信号转导,例如il-12、il-18、il-33、ifn-g;通过抗原呈递细胞或其在t细胞上的对应物提供的刺激,例如cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40;-cgas-sting途径;例如,胞质dna。
[0128]
对于每种药物,icb疗法的“标准剂量”是本领域技术人员已知的,并且可以是处方信息中指示的剂量和/或在特定临床情况下最常施用的剂量(例如对于所使用的特定pd-1抑制剂和/或ctla-4抑制剂、所使用的特定施用途径、所治疗的crc的特定阶段、特定患者的年龄、体重和/或性别等而言)。
[0129]
如本文所用,术语“受试者”是指动物,并且可包括例家养动物(如猫、犬等)、家畜(例如,牛、马、猪、绵羊、山羊等)、实验室动物(例如,小鼠、兔、大鼠、豚鼠等)、哺乳动物、非人哺乳动物、灵长类动物、非人灵长类动物、啮齿动物、鸟类、爬行动物、两栖动物、鱼类和任何其他动物。家养动物的其他实例包括雪貂、马、兔、豚鼠、沙鼠、仓鼠、栗鼠、大鼠、小鼠或其他小型哺乳动物;鸟;爬行动物;鱼;两栖动物;节肢动物,如狼蛛或寄居蟹。另外的家畜包括驴、羊驼、骆驼、水牛、水貂或鸡。
[0130]
在一个具体实例中,受试者是人。
[0131]
本文可互换使用的术语“结肠直肠癌”或“crc”以最广泛的意义使用,并且是指(1)由小肠下方的肠道(即,大肠(结肠),包括盲肠、升结肠、横结肠、降结肠、乙状结肠和直肠)的上皮细胞引起的所有阶段和所有形式的癌症,和/或(2)影响大肠和/或直肠内壁的所有阶段和所有形式的癌症。
[0132]
在一些实例中,crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0133]
通常,在用于结肠直肠癌分类的分期系统中,结肠和直肠作为一个器官进行治疗。
[0134]
另外,如本文所用,术语“结肠直肠癌”还包括以十二指肠和小肠(空肠和回肠)细胞的癌症为特征的医学疾患。
[0135]
crc的分期是已知的。
[0136]
在一些实例中,crc可根据dukes系统、astler-coller系统或tnm系统(肿瘤/结节/转移灶)进行分期,其中后者是最常用的。美国癌症联合委员会(ajcc)的tnm系统描述原发性肿瘤的大小(t)、淋巴结受累程度(n)以及癌症是否已经形成远处转移(m),即扩散至身体的其他部位。在此,0期、ia期、ib期、iia期、iib期、iii期和iv期是基于确定的t、n和m值定义的。相应的分期方案可从ajcc的癌症分期手册中获得。用于结肠直肠癌分期的另一个系统是dukes系统,其定义癌症a期、b期、c期和d期。此系统由astler和coller改编,他们进一步细分了b期和c期(“修订的astler-coller分类”)。
[0137]
如本文所用,crc患者包括根据所使用的任何分期系统分期的患者并且与诊断的分期无关。
[0138]
如本文所用,“患有结肠直肠癌的患者”或“患有结肠直肠癌的受试者”是指在大肠/或直肠的内壁和/或上皮细胞中发展了非典型和/或恶性细胞的任何哺乳动物,特别是人患者。这包括与crc的阶段和形式无关的crc患者。
[0139]
患有结肠直肠癌的患者还包括结肠直肠癌复发的患者,即其中手术治疗后一定时间段内不再能检测到肿瘤、但其中癌症已在大肠和/或直肠的相同或不同部位复发和/或其中转移已经在患者身体的不同部位如肝脏、肺、腹膜、淋巴结、脑和/或骨中发展的患者。
[0140]
在另一个实例中,患有crc的患者是其中初始肿瘤已经通过手术治疗并且crc是非转移性的患者。
[0141]
在一些实例中,可使用肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物。
[0142]
如本文所用,术语“衍生物”、“功能衍生物”和“生理学功能衍生物”是指当如本文所述使用和/或施用时具有与指定的活性化合物相等或接近相等的生理学功能性的活性化合物。如本文所用,术语“生理学功能衍生物”包括任何药学上可接受的盐、溶剂合物、酯、前药衍生物、对映异构体或多晶型物。
[0143]
本文使用的术语“前药”是指本身不具有药学活性但在体内,例如在施用化合物的受试者中转化为其药学活性形式的化合物。
[0144]
如本文所用,术语“治疗有效量”或“有效量”是指在必要剂量和时段下有效实现所需结果的量。有效量可根据诸如受试者的疾病状态、年龄、性别和/或体重的因素而变化。将对应于这种量的给定化合物或组合物的量将根据各种因素而变化,如给定药物或化合物、药物制剂、施用途径、所治疗受试者的身份等,但仍然可由本领域技术人员常规地确定。
[0145]
如本文所用,术语“治疗(treatment)”或“治疗(treat)”是指获得有益或所需结果,包括临床结果。有益的或所需的临床结果可包括但不限于一种或多种症状或疾患的缓解或改善、疾病程度的减小、疾病状态的稳定(即不恶化)、疾病扩散的预防、疾病进程的延缓或减慢、疾病状态的改善或缓和、疾病复发的减少以及缓解(无论是部分缓解还是全部缓解),无论是可检测的还是不可检测的。“治疗(treating)”和“治疗(treatment)”还可意指与未接受治疗时预期的存活期相比,存活期延长。如本文所用,“治疗(treating)”和“治疗(treatment)”还包括预防性治疗。例如,可治疗处于疾病早期阶段的受试者以预防进展,或者可替代地,可用本文所述的化合物或组合物治疗处于缓解期的受试者以预防进展。
[0146]“预防(prevent)”或“预防(prevention)”是指预防和/或减缓靶向病理疾患或病症的发展的防治性或预防性措施。因此,需要预防的那些包括有发展所述病症的风险或易于发展所述病症的那些。在某些实施方案中,如果与未经受本发明方法的患者相比,患者短暂或永久性地发展例如与眼睛的疾病或病症相关的更少或较不严重的症状或者与所述疾病或病症相关的症状的更迟发作,则根据本文提供的方法成功地预防所述疾病或病症。
[0147]
在一些实例中,治疗导致预防或延迟受试者的疾病的发作或症状的改善或获得所需的生物学结果。
[0148]
在一些实例中,治疗方法包括向受试者施用治疗有效量的本文所述的化合物或组合物并且任选地由单次施用或施加组成,或者可替代地包括一系列施用或施加。
[0149]
如本文所用的术语“药学有效量”是指将引发研究人员或临床医生所寻求的组织、系统、动物或人的生物学或医学反应(例如结肠直肠癌的治疗)的化合物、组合物、药物或药剂的量。这种量可以是治疗有效量。
[0150]
化合物和组合物可以药学上可接受的形式提供。
[0151]
如本文所用的术语“药学上可接受的”包括适用于与受试者的组织接触而没有过量毒性、刺激性、过敏反应或其它问题或并发症、与合理的益处/风险比相称的化合物、材料、组合物和/或剂型(如单位剂量)。每种载体、赋形剂等在与制剂的其它成分相容的意义上也是“可接受的”。
[0152]
如本文所用,术语“功能衍生物”和“生理学功能衍生物”是指当如本文所述使用和/或施用时具有与指定的活性化合物相等或接近相等的生理学功能性的活性化合物。如本文所用,术语“生理学功能衍生物”包括任何药学上可接受的盐、溶剂合物、酯、前药衍生物、对映异构体或多晶型物。
[0153]
在一些实例中,化合物是前药。
[0154]
制剂可方便地以单位剂型形式呈现并且可通过制药领域中熟知的任何方法来制备。此类方法包括将活性化合物与可构成一种或多种辅助成分的载体结合的步骤。通常,通过使活性化合物与液体载体或细碎固体载体或两者均匀并紧密地结合,然后根据需要将产物成形来制备制剂。
[0155]
化合物和组合物可通过任何方便的施用途径施用于受试者,不论全身/外周还是所需作用部位,包括但不限于,口服(例如摄入);局部(包括例如经皮、鼻内、眼部、经颊和舌下);经肺(例如通过使用例如气雾剂,例如通过嘴或鼻的吸入或吹入疗法);直肠;阴道;胃肠外,例如通过注射,包括皮下、肿瘤内、皮内、肌肉内、静脉内、动脉内、心内、鞘内、脊柱内、囊内、包膜下、眶内、腹膜内、气管内、表皮下、关节内、蛛网膜下和胸骨内;通过植入贮库,例如皮下或肌肉内。优选地,包含细菌的组合物例如通过口服(如摄入)或直肠途径递送至胃肠系统。
[0156]
适于口服施用(例如摄食)的制剂可以如下形式存在:分散单位,如胶囊、扁囊剂或片剂,各自含有预定量的活性化合物;粉末或颗粒;水性或非水性液体中的溶液或混悬液;或水包油液体乳液或油包水液体乳液;大丸剂;干药糖剂;或糊剂。
[0157]
适于胃肠外施用(例如通过注射,包括皮肤、皮下、肌肉内、静脉内和皮内)的制剂包括水性和非水性等渗、无热原、无菌注射溶液,其可含有抗氧化剂、缓冲剂、防腐剂、稳定剂、抑菌剂,以及使得制剂与预期接受者的血液等渗的溶质;以及水性和非水性无菌混悬液,其可包括悬浮剂和增稠剂,以及脂质体或被设计来将化合物靶向血液组分或一个或多个器官的其它微粒系统。用于在此类制剂中使用的合适等渗媒介物的实例包括氯化钠注射液、林格氏溶液或乳酸化林格氏注射液。
[0158]
制剂可被包装于单剂量或多剂量密封容器中,例如安瓿和小瓶,并且可以储存于冷冻干燥(冻干)的条件下,仅需在使用前即刻添加无菌液体载体(例如水)以供注射。临时注射溶液和混悬液可由无菌粉末、颗粒和片剂制备。制剂可呈脂质体或被设计来将活性化合物靶向血液组分或一个或多个器官的其它微粒系统的形式。
[0159]
本文所述的化合物和/或组合物可取决于待治疗的疾患同时(或基本上同时)或顺序施用,并且可与其他治疗组合施用。其他治疗可同时(或基本上同时)或顺序施用。
[0160]
如本文所用,术语
‘
减轻crc的至少一种症状’是指可检测症状的定性或定量减轻,包括但不限于对疾病恢复速度或疾病进展速度或严重程度的可检测影响。
[0161]
如本文所用,关于受试者的术语
‘
有发展crc的风险”被理解为是指由于受试者的医学状况而易于发展crc的受试者。
[0162]
在一些实例中,患有crc'的受试者是已经被“诊断为患有crc'”的受试者。
[0163]
术语
‘
被诊断为患有crc”是指受试者表现出crc'的一种或多种症状。诊断crc'的方法在本领域中是已知的。
[0164]
药物组合物可取决于施用方法以各种单位剂型施用。例如,适用于口服施用的单
位剂型包括粉末、片剂、丸剂、胶囊和锭剂。
[0165]
本文所述的药物组合物可用于胃肠外施用,如静脉内施用、腹膜内施用或施用至体腔或器官或关节的内腔中。
[0166]
术语“药物组合物”是指处于允许活性成分的生物活性有效的形式并且不含对将向其施用所述组合的受试者具有不可接受的毒性的另外组分的制剂。药物组合物可多种剂型中的任一种施用,例如片剂、胶囊、液体、溶液、软胶囊、悬浮剂、乳剂、糖浆、酏剂、酊剂、薄膜、粉末、水凝胶、软膏、糊剂、乳膏、洗剂、凝胶、摩丝、泡沫、漆、喷雾剂、气雾剂、吸入器、雾化剂、滴眼剂、贴剂、栓剂和/或灌肠剂。药物组合物通常包含药学上可接受的载体,并且可包含以下中的一者或多者:缓冲剂(例如乙酸盐、磷酸盐或柠檬酸盐缓冲剂)、表面活性剂(例如聚山梨醇酯)、稳定剂(例如人白蛋白)、防腐剂(例如苯甲醇)、用于增强生物利用度的吸收促进剂和/或其他常规的增溶剂或分散剂。剂型和赋形剂的选择取决于待递送的活性剂和待治疗或预防的疾病或病症,并且对于本领域普通技术人员来说是常规的。
[0167]
在一些实例中,用于施用的组合物通常将包含溶解在药学上可接受的载体,例如水性载体中的本公开的结合剂的溶液。可使用各种水性载体,例如缓冲盐水等。组合物可含有接近生理条件所需的药学上可接受的辅助物质,诸如ph调节剂和缓冲剂、毒性调节剂等,例如乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。这些制剂中的本公开的结合剂的浓度可广泛地变化,并且将根据所选的特定施用方式和患者的需求,主要基于流体体积、粘度、体重等进行选择。示例性载体包括水、盐水、林格氏溶液(ringer's solution)、右旋糖溶液以及5%人血清白蛋白。
[0168]
任选地,将所述治疗与适用于治疗crc的另一个部分组合。
[0169]
根据本发明的至少一些实施方案,提供了可与crc的护理标准或新的治疗组合的如本文所述的治疗剂和/或包含所述治疗剂的药物组合物的组合的用途。
[0170]
例如,用于患有结肠直肠癌的患者的治疗方法(特别是在切除原发性肿瘤后)可包括化学疗法、放射疗法、靶向疗法和免疫疗法。
[0171]
如本文所用,术语“化学疗法”涉及用抗肿瘤药物治疗受试者。
[0172]
术语“放射疗法(radiation therapy)”和“放射疗法(radiotherapy)”涉及使用电离辐射来治疗或控制癌症如crc。
[0173]
如本文所用,术语“靶向疗法”涉及将已知通过干扰已知为肿瘤发生或癌症或癌细胞生长所必需的特定分子来阻断癌细胞的生长的化学物质施加至患者。
[0174]
如本文所用的术语“免疫疗法”涉及通过调节受试者的免疫反应来治疗癌症。所述调节可以是诱导、增强或抑制所述免疫反应,例如通过施用至少一种细胞因子和/或至少一种特异性地识别癌细胞的抗体。术语“基于细胞的免疫疗法”涉及包括向受试者施加免疫细胞,例如t细胞、优选肿瘤特异性nk细胞的癌症疗法。
[0175]
如本文所用,就对治疗的临床反应而言,患者或肿瘤是否“有反应”可使用指示对患者的益处的任何终点来评估,包括但不限于(1)在一定程度上抑制肿瘤生长,包括减慢和完全生长停滞;(2)肿瘤细胞的数量减少;(3)肿瘤体积减小或缩小;(4)抑制(即减少、减慢或完全停止)肿瘤细胞浸润至邻近的外周器官和/或组织中;(5)抑制转移;(6)抗肿瘤免疫反应增强,可能导致肿瘤消退或排斥;(7)在一定程度上缓解与肿瘤相关的一种或多种症状;(8)治疗后存活长度增加;和/或(9)在治疗后的给定时间点死亡率降低。反应性也可用
临床结果的各种度量来表示。阳性临床结果也可在个体结果相对于具有可比临床诊断的患者群体的结果的背景下被考虑。在一个实例中,阳性临床反应的可能性增加对应于癌症复发的可能性降低。
[0176]
在另一个实例中,对治疗的临床反应可基于疾病控制(dc)来测量,其中显示疾病控制的肿瘤包括对治疗的反应是完全反应(cr)、部分反应(pr)或稳定疾病(sd)的肿瘤。在一个实例中,表现出疾病控制的肿瘤不包括处于进行性疾病(pd)状态的肿瘤。
[0177]
在另一个实例中,对治疗的临床反应可基于客观肿瘤反应(例如肿瘤缩小)来测量,其中经历客观肿瘤反应的肿瘤包括经历完全反应(cr)或部分反应(pr)的肿瘤。在一个实施方案中,经历客观肿瘤反应的肿瘤不包括表现出疾病稳定(sd)的肿瘤或处于进行性疾病(pd)状态的肿瘤。
[0178]
除非明确规定或从上下文显而易见,否则如本文所用,术语“约”应理解为在本领域的正常公差范围内,例如在平均值的2个标准偏差以内。约可以被理解为在所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%,或0.01%之内。除非从上下文显而易见,否则本文提供的所有数值可由术语约修饰。
[0179]
在本文中变量的任何定义中引述化学基团的清单包括定义所述变量作为任何单一基团或所列基团的组合。在本文中引述变量或方面的实施方案包括作为任何单一实施方案或与任何其它实施方案组合或其部分的所述实施方案。
[0180]
在此提供的任何组合物或方法可以与在此提供的一种或多种任何其他组合物和方法进行组合。
[0181]
本文提供的范围应理解为所述范围内的所有值的速记法。例如,一个1到50的范围应当理解为包括来自下组的任何数字、数字的组合或子范围,该组由以下各项组成:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50。
[0182]
如本文所用,“一个或多个”被理解为每个值1、2、3、4、5、6、7、8、9、10以及大于10的任何值。
[0183]
本发明的方法通过以药盒的形式提供用于这种方法中的化合物和/或组合物来方便地实施。这种药盒优选含有所述组合物。这种药盒优选含有其使用说明书。
[0184]
为了更好地理解本文所述的本发明,阐述了以下实施例。应理解,这些实施例仅用于说明目的。因此,它们不应以任何方式限制本发明的范围。
[0185]
实施例
[0186]
概述
[0187]
癌症是全球主要的死亡原因。免疫检查点阻断疗法为许多癌症提供有前景的新治疗策略,但对结肠直肠癌相对无效。先前的研究表明,免疫检查点疗法的功效受微生物群的调节。因此,假设可利用特定肠道细菌来促进用于结肠直肠癌的免疫疗法。在此,鉴定了增强免疫检查点阻断疗法在结肠直肠癌中的功效的三种共生细菌物种和微生物代谢物肌苷。显示肌苷与t细胞上的腺苷a
2a
受体相互作用,从而导致肠th1细胞分化。由免疫检查点阻断诱导的肠道屏障功能降低增加了细菌代谢物的易位,并且促进了癌症保护性th1细胞活化。这种新的微生物-代谢物-免疫回路可为一类新的细菌引发的检查点阻断疗法提供机制。表明,这种机制的功效在结肠直肠癌的亚型中有所不同,并且强调了这种新型细菌共同疗法
对于癌症的优势和潜在局限性。
[0188]
方法
[0189]
通过16s扩增子测序的微生物群组成
[0190]
使用qiaamp fast dna粪便提取试剂盒(qiagen)从粪便和癌症上皮细胞中提取和纯化dna。在以下循环条件下,使用kapa hifi聚合酶(roche)用带条形码引物(kozich等人,2013)扩增16s rrna基因的v4区域:初始变性98℃持续2分钟,98℃持续30秒、55℃持续30秒、72℃持续20秒的25个循环和在72℃下7分钟的最终延伸。ngs(macherey-nagel)用于pcr净化和大小选择,然后根据制造商的方案使用sequalprep
tm
归一化板试剂盒(thermofisher)进行pcr产物归一化。汇集单独pcr文库,然后在高灵敏度d1000 screentape站(agilent)和qubit荧光计(thermofisher)上进行定性和定量评估。在miseq平台(illumina)上使用v2-500循环盒(illumina)进行16s rrna v4基因扩增子测序。使用r中的dada2管道(callahan等人,2016)对序列进行解复用和处理。将正向和反向读段分别修剪为230和210个碱基对。合并解复用的序列,并使用removebimeradenovo函数鉴定和移除嵌合体。使用greengenes数据库(desantis等人,2006)分配分类学。使用deseq2(love等人,2014)鉴定差异丰富的分类群,拟合至平均值(基本平均强度阈值20)并应用benjamini-hochberg校正来计算经调整的p值。对于加权unifrac分析,使用了permanova(9999个排列)。
[0191]
细菌的体外培养和全16srrna基因测序
[0192]
使用钢珠和tissuelyser ii(qiagen)在无菌培养基(参见下文)中均质化aom/dss肿瘤。在厌氧条件下(whitley,a95工作站)在均补充有血红素(5μg/ml)、甲萘醌(0.5μg/ml)、粘蛋白(250μg/ml)、半胱氨酸-hcl(250μg/ml)和九水合硫化钠(250μg/ml)(所有试剂来自sigma)的脑心浸液琼脂(bhi)和营养苛求性厌氧琼脂(faa)上对均质化裂解物进行划线。48小时后挑取单个菌落并在含有与琼脂板相同的补充剂的bha或faa培养基中培养。液体培养48小时后,裂解细菌并进行全长16s rrna pcr,然后进行标准桑格测序。通过使用blast鉴定细菌。使用以下引物进行16s rrna全长pcr:正向:aga gtt tga tcc tgg ctc ag,以及反向1:aga gtt tga tca tgg ctc ag,反向2:acg gtt acc ttg tta cga ctt两者的混合物。
[0193]
动物实验
[0194]
c57bl/6j和b6(cg)-zbtb46
tm1(hbegf)mnz
/j(cdc-dtr)(meredith等人,2012)以及c;129s-adora2a
tm1jfc
/j小鼠获自jackson,然后在室内饲养和维持。apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre和msh2
loxp/loxp
villin-cre由kevin haigis博士和winfried edelman博士友情提供。c57bl/6-tg(tcratcrb)1100mjb/j(hogquist等人,1994)(ot-i)小鼠在室内饲养。b6.cg-tg(tcratcrb)425cbn/j(barnden等人,1998)(ot-ii)小鼠由markus geuking博士友情提供。global b.6-adora2a
tm1jfc
/j(allard等人,2019)获自john stagg博士(barnden等人,1998)。所有动物都按标准4%脂肪食物保持12小时的明暗循环。断奶后将不同spf(无特定病原体)繁殖对的后代放在一起,以尽量减少笼子效应。将无菌c57bl/6j和rag1-/-小鼠在加拿大university of calgary imc的柔性薄膜隔离器中饲养和维持。通过依赖培养和不依赖培养的方法定期监测无菌状态,并独立确认所有小鼠均无病原体。对于实验,无菌和单定殖小鼠被圈养在hepa过滤的isocages(tecniplast)中。介于7-12周之间的雄性和雌性小
鼠用于实验。在每个实验中,小鼠的年龄和性别都匹配,并随机分配到不同的实验组。所有实验均按照alberta的道德法律和健康科学动物护理委员会批准的方案(ac17-0090和ac17-0011)进行,遵循加拿大动物护理委员会制定的指导方针。
[0195]
单细胞制备和流式细胞术
[0196]
从脾脏、小肠、肠系膜、结肠引流和腹股沟淋巴结中分离单细胞。清除脾脏和淋巴结中的脂肪和结缔组织,切碎并在补充有ia型胶原酶(sigma)1mg/ml和dna酶i(roche)10iu/ml的rpmi-1640中的振荡孵育箱(220rpm)中在37℃下消化20分钟。然后通过40μm细胞过滤器(thermo fisher)过滤组织,并用2%热灭活胎牛血清(fbs)和2mm edta重新悬浮在pbs中。从小肠中取出脂肪、结缔组织和派尔集合淋巴结(peyer’s patch),然后将其切成0.5
–
1cm小块。将组织块在振荡孵育箱(220rpm)中在37℃下在含有5mm edta(sigma)的预热的不含钙和镁的hbss(sigma)中洗涤20分钟,两次。弃去含有肠上皮细胞和上皮内淋巴细胞的上清液。然后将剩余的组织块重新悬浮在含有viii型胶原酶(sigma)1mg/ml的预热的不含钙和镁的hbss中,并在振荡孵育箱(220rpm)中在37℃下消化20-25分钟。将上清液首先通过100μm、然后通过40μm细胞过滤器(thermo fisher)过滤。对于细胞内染色,将细胞在96孔u型底板(greiner bio-one)中涂铺于补充有10%fbs、0.05mm 2-巯基乙醇、50ng/ml佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)、750ng/ml离子霉素和10μg/ml布雷菲德菌素-a(全部sigma)的200μl imdm中并在37℃、5%co2下孵育4小时。然后将细胞在fcγ受体阻断抗体(bd biosciences)中在4℃下孵育10分钟,然后在4℃下表面染色25分钟。对于细胞内染色,根据制造商的方案,使用ebioscience
tm foxp3固定/透化试剂盒(ebioscience)将细胞固定和透化。然后在4℃下用细胞内标记物对细胞进行染色过夜。在采集之前,洗涤细胞并在facscanto(bd biosciences)上进行流式细胞术。使用flowjo v10.5.3(treestar)分析数据。所使用的抗体列表如下:
[0197]
表1.
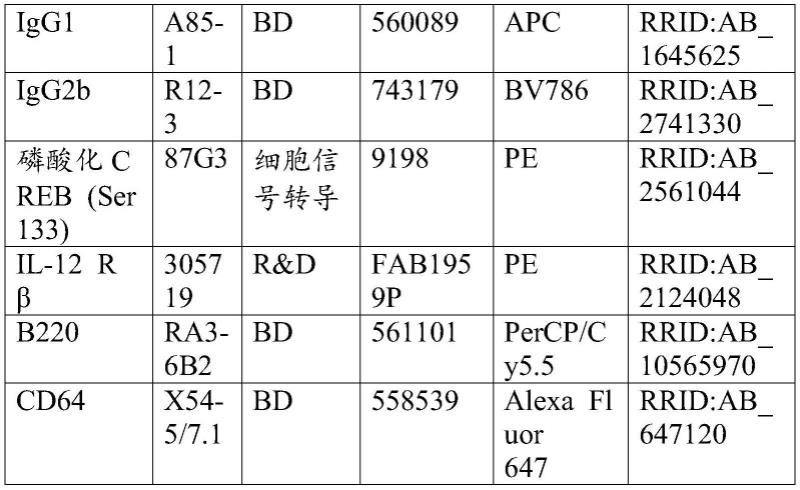
[0198][0199]
结肠直肠癌模型和治疗
[0200]
如前所述在c57bl/6j小鼠中诱导aom/dss肿瘤(mager等人,2017;mertz等人,
2016)。简言之,将aom(10mg/kg/bw)(sigma)在第0天和第19天注射了两次。在第7、19和29天向动物给予3次1%dss(mpbio)的水溶液持续5天,然后是常规水。从第122天开始,每72小时(100μg/注射)腹膜内(i.p.)注射同种型、抗ctla-4或抗pd-l1抗体(全部bio x cell)5次。apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre小鼠先前已进行了描述(haigis等人,2008)。简言之,动物出生后的中值存活期为70天。从第47天开始,每72小时(100μg/注射)i.p.注射5次同种型或抗ctla-4抗体。在微生物转移共同疗法的情况下,将抗生素(氨苄西林1mg/ml(sigma)、粘菌素1mg/ml(cayman chemical)和链霉素5mg/ml(sigma))与水混合并从出生后第40天开始随意给予7天。从第47天开始,每72小时通过口服和直肠管饲给予细菌5次。msh2
loxp/loxp
villin-cre小鼠中的肿瘤发展先前进行了描述(kucherlapati等人,2010)。msh2
loxp/loxp
villin-cre动物的中值存活期是出生后365天。因此,在出生后319天开始使用同种型、抗ctla-4或抗il12p40(500μg,bio x cell)抗体治疗,每72小时5次。在微生物转移共同疗法的情况下,与上述相同的抗生素从第312天开始给予持续7天,并且从第319天开始通过管饲口服提供细菌,每72小时5次。对于异位癌症模型,在无菌、单定殖或spf小鼠的侧腹中皮下(s.c.)注射1x106个癌细胞。一旦肿瘤可触及(注射后7-10天),就每72小时5次注射同种型或抗ctla-4抗体(100μg/注射i.p.)。对于血清转移实验,无菌小鼠接受了来自图2中所示的来自动物的合并血清。每72小时静脉内(i.v.)转移血清3次(每次200μl血清)。伴随血清转移,小鼠i.p.接受抗ctla-4 3次,每72小时使用卡尺测量肿瘤(长度x宽度x高度xπ/6)。所有肿瘤均在精细秤(mettler toledo)上称重。
[0201]
树突状细胞耗减实验
[0202]
对于dc耗减实验,嵌合小鼠产生改编自先前的报告(mager等人,2015;meredith等人,2012)。简言之,将c57bl/6j小鼠gamma细胞提取器40(nordion)中用1100cgy进行致死性照射,分成550cgy每4小时一次的两个阶段。然后将小鼠i.v.注射来自cdc-dtr小鼠的1x107全骨髓,然后进行饮用水中的两周抗生素治疗(氨苄西林1mg/ml、粘菌素1mg/ml和链霉素5mg/ml)。然后使小鼠接受正常饮用水,并用icb促进细菌(b.p.、l.j.、o.sp.)的混合物管饲。在第8周在侧腹中s.c.注射1x106个癌细胞,并在照射和骨髓重建后9周,用白喉毒素(每48小时100ng,i.p.,sigma)开始dc耗减。在第一次白喉毒素注射后一天开始抗ctla-4,并且每72小时给予5次。使用卡尺(长度x宽度x高度xπ/6)每72小时测量肿瘤,并在实验结束时在精细秤(mettler toledo)上称重。
[0203]
细胞培养
[0204]
mc38亲本菌株、mc38-egfp和mc38-ova结肠直肠癌细胞由charles drake博士友情提供。最初对细胞进行污染测试(charles river),然后每6-8周筛查是否存在支原体(pcr支原体检测试剂盒,thermo scientific)。将mc38细胞在补充有10%热灭活fbs(sigma)、100单位/ml青霉素、100μg/ml硫酸链霉素、2mm l-谷氨酰胺、1mm丙酮酸钠和非必需氨基酸(全部thermo fisher)的imdm中保持在37℃、5%co2下。将mb49和b16f10细胞在补充有10%fbs(sigma)、100单位/ml青霉素的imdm中培养。
[0205]
骨髓来源的树突细胞(bmdc)由冲洗过的骨髓细胞产生,维持在补充有10%fbs、50μm 2-巯基乙醇(sigma)100单位/ml青霉素、100μg/ml硫酸链霉素和20ng/ml rm gm-csf(r&d)的rpmi-1640(sigma)中。48小时和72小时后更换培养基。培养5天后,进行磁性细胞分选步骤以富集cd11c
细胞(miltenyi biotec)。将cd11c
细胞接种在96个平底孔中,并用20ng/
ml ova
323-339
和100ng/ml lps(两者均为sigma)脉冲18小时。在一些条件下,bmdc也与10ng/ml rmifn-γ(r&d)一起培养。
[0206]
阴性选择磁性细胞分选(miltenyi biotec)用于富集初始ot-ii cd4
t细胞。然后将初始ot-ii cd4
t细胞与bmdc以2:1的比例共培养,或用抗cd3/抗cd28t细胞活化珠(thermofisher)以1:1的比例刺激48小时,然后在布雷菲德菌素-a存在下用pma/离子霉素进行再刺激并分析(关于细节,参见单细胞制备和流式细胞术)。在一些条件下,如前所述(he等人,2017;yao等人,2013)将细胞另外与2μg/ml抗ctla-4、100μm db-camp(sigma)、5μm zm 241385(sigma)、300μm rp-8-cpt-camps(cayman chemical)或2mm肌苷(sigma)的各种组合一起培养。
[0207]
定量pcr
[0208]
根据制造商的方案,将初始cd4 t细胞macs纯化(miltenyi)。使用tri试剂(sigma-aldrich)纯化rna。使用iscript
tm
(biorad)将rna转录为cdna。perfecta sybr green(quanta bio)用于检测靶基因il12rb1、ifng和gapdh(qiagen)。将基因的表达水平针对gapdh mrna归一化,并应用2
–
δδct
方法比较培养基与肌苷刺激组。
[0209]
肠屏障功能的评价
[0210]
如先前所描述(mager等人,2017)进行尤斯灌流室测量。简言之,从小肠中部收集每只小鼠一个肠道切片(大约3cm长),注意排除派尔集合淋巴结。在大约10至15分钟平衡时间后,在37%氧化hbss中测量电阻。
[0211]
如前所述(mager等人,2017)测量抗共生血清抗体。简言之,将b.p.或c.sp.在厌氧条件下培养,然后稀释至o.d.600为0.07。然后使用叠氮化钠灭活细菌。将来自用或未用抗ctla-4治疗的无菌、b.p.或c.sp.单定殖小鼠的血清热灭活并与细菌团块一起孵育。然后使用针对igg1和igg2b的荧光二抗来检测针对纯培养的细菌的全身抗体。血清细胞因子通过multiplexing laser bead technology(eve technologies)。
[0212]
代谢组学谱评估
[0213]
在50%甲醇中提取血清或细菌培养物中的代谢物,离心,并将所得上清液稀释至线性范围进行质谱分析(对于微生物培养物1:20最终稀释度,并且对于血清1:50总稀释度)。然后在负离子全扫描模式(50-750m/z)下以240,000分辨率在q exactive
tm hf质谱仪(thermo scientific)上采集超高效液相色谱质谱(uhplc-ms)数据。使用lc-ms级水(溶剂a)中的20mm甲酸铵(ph3.0)和lc-ms级乙腈(溶剂b)中的0.1%甲酸(%v/v)的二元溶剂混合物结合syncronis
tm
柱(thermo fisher scientific 97502-102130)通过uhplc分离代谢物。使用以下梯度以600ul/min的流速分析样品:0-2分钟,100%b;2-7分钟,100-80%b;7-10分钟,80%-5%b;10-12分钟,5%b;12-13分钟,5%-100%b;13-15分钟,100%b。对于所有运行,样品进样体积是2ul。使用xcms(gowda等人,2014;tautenhahn等人,2012)和maven软件包(clasquin等人,2012;melamud等人,2010)分析代谢物数据。通过将观察到的m/z信号( /-10ppm)和色谱保留时间与从商业代谢物标准品(sigma)中观察到的相匹配来鉴定代谢物。肌苷分配(本研究的关键代谢物)使用并行反应监测通过ms/ms断裂图案确认。通过将肌苷标准品掺杂至微生物提取物中来进一步验证这些分配,以证明所观察到的生物标志物与50μm肌苷标准品之间的共同保留和匹配断裂图案。
[0214]
肌苷在体内的作用
[0215]
为了评估肌苷对th1活化的影响,小鼠接受了30μg cpg、100mg endofit卵白蛋白(均为invivogen)和2μg ova
323-339
(sigma)i.p.,并且24小时后,小鼠通过i.p.注射接受了300mg/kg/bw肌苷或pbs作为对照。48小时后评估t细胞分化。为了评估icb治疗期间肌苷对肿瘤发展的影响,将1x106个癌细胞皮下(s.c.)注射到无菌小鼠的侧腹中。一旦肿瘤可触及(注射后7-10天),就每72小时5次注射i.p.而注射100μg抗ctla-4抗体和20μg cpg。在第一次抗ctla-4/cpg治疗后24小时,小鼠每天口服(管饲)或犬舍接受300mg/kg/bw肌苷(200μl i.p.和50μl s.c.)直到实验结束。使用cd4/cd8(til)microbeads(miltenyi)从脾脏中分离wt或a2a缺陷型细胞。t细胞纯度》95%,并且i.v.转移1x107个t细胞。
[0216]
细菌检测
[0217]
根据制造商的说明书进行sytox绿色核酸染色(thermo fisher)。简言之,将均质化的粪便或肿瘤组织固定在4%多聚甲醛溶液(sigma)中30分钟。随后,将样品在pbs中以1:5的比例稀释,并在图片采集前用sytox绿色核酸染色剂染色60分钟(leica dm2500)。如上文所述进行16srrna全长pcr(“细菌的体外培养和全16srrna基因测序”)。
[0218]
统计学分析
[0219]
使用了用于windows的graphpad prism v.5.04。如果组间方差是相似,则使用参数检验,如标准学生t检验或单因素anova与邦弗朗尼事后检验;在组间方差显著不同的情况下,应用非参数检验,如曼惠特尼(mann whitney)u检验或kruskal wallis与邓恩事后检验。双因素anova与邦弗朗尼事后检验用于肿瘤生长曲线。使用曼特尔-考克斯对数秩(mantel-cox log-rank)检验分析存活。其他检验在相应的图或表图例中表示。图中仅显示了统计学上显著的差异。对于所有统计学分析:*,p《0.05;**,p《0.01;***,p《0.001;****,p《0.0001。用于每个图的确切p值和统计检验在源数据中报告。
[0220]
结果
[0221]
icb治疗功效取决于肠道微生物群
[0222]
首先质疑crc中的icb治疗功效是否取决于微生物群。将异位mc38结肠直肠癌植入无菌(gf)和无特定病原体(spf)小鼠中,在可触及肿瘤发展后,开始icb治疗,这使得spf动物中的肿瘤更小(图7a和7b)。此外,在spf动物中,肿瘤内和脾脏cd4
和cd8
t细胞活化和增殖显著增加(图7c-7n)。为了确保这不仅仅是无菌小鼠的未成熟免疫系统的反映,还评估了抗生素治疗的spf小鼠中的效果和icb疗法(图7o)。与对照治疗相比,广谱抗生素也降低了荷瘤spf小鼠中的icb治疗功效(图7p-7t)。这些结果表明,在存在微生物的情况下,icb功效得以增强,从而证实了在其他肿瘤类型情况下的先前报告(vetizou等人,2015)。
[0223]
crc中icb促进细菌的鉴定
[0224]
在临床上,众所周知,icb疗法在大多数crc病例中无效(le等人,2015),并且异位肿瘤可能无法充分模拟肠道微生物群与肠肿瘤中的局部免疫之间的空间紧密相互作用。因此,采用了更生理的crc模型来研究icb治疗背景下微生物群与免疫之间的相互作用。在spf动物中使用偶氮甲烷(aom)和硫酸葡聚糖钠(dss)诱导肠肿瘤。在肿瘤发展后,评估了icb治疗诱导抗肿瘤免疫的能力(图1a)。值得注意的是,icb治疗导致肿瘤更小且更少(图1b和c),减少癌症干细胞数量(图1d),增加免疫细胞浸润到肿瘤中(图1e),并增加肿瘤引流淋巴结中的cd8
t细胞频率连同脾脏cd4
和cd8
t细胞活化增加(图1f-h)。在此模型中,当使用相同的抗体剂量时,抗ctla-4杀肿瘤作用大于抗pd-l1治疗所诱导的那些作用。为了鉴定潜在有
益的肿瘤相关细菌,对从均质化肿瘤以及均质化肿瘤组织的厌氧培养物分离的基因组dna进行了16s rrna基因v4区域扩增子测序。微生物测序揭示,icb治疗的肿瘤的肿瘤相关细菌群落组成与对照治疗的肿瘤不同(图8a和图1i)。此外,能够从肿瘤组织中培养21种不同的细菌。值得注意的是,这些培养的细菌中有7种仅在icb治疗组中发现,而4种仅在对照组中发现(图1j)。
[0225]
尽管在icb治疗的小鼠与对照小鼠之间的总体粪便细菌组成(β-多样性)中没有观察到显著变化(图30a),但一些细菌家族的丰度差异很大(图8c)。相比之下,肿瘤相关细菌群落的测序揭示了β-多样性的差异(图30b),并且在icb治疗的肿瘤中额外的细菌属丰度差异很大(图30c和30d)。
[0226]
令人感兴趣地,最近鉴定可增强抗pd-l1和抗pd-1治疗在肺癌和肾癌中的功效的嗜粘蛋白艾克曼菌(routy等人,2018)是仅从icb治疗的肿瘤中培养的七种细菌之一。还对来自对照组和icb组的粪便样品进行了16s rrna基因v4扩增子测序,但发现微生物群组成没有显著差异(图8b-8c),从而表明肿瘤相关细菌群落为鉴定crc中的icb-促进细菌提供了更好的来源。
[0227]
为了解决发现在icb治疗的肿瘤中富集的细菌是否能够加强icb疗法的功效,选择了五种分离的可培养细菌物种用于gf小鼠的单定殖。向单定殖或gf小鼠注射mc38肿瘤细胞,在可触及肿瘤发展后用抗ctla-4治疗,并评估对肿瘤生长和抗肿瘤免疫的影响(图2a)。为这种方法选择了crc的异位模型,因为在微生物群有限的动物中原位crc的发展严重减少(schwabe and jobin,2013)。在所测试的五种细菌中,与gf小鼠或用大肠埃希菌属(c.sp.)或普雷沃菌属(p.sp.)单定殖的小鼠相比,用假长双歧杆菌(b.p.)、约氏乳杆菌(l.j.)和欧陆森氏菌属(o.sp.)单定殖显著增强了抗ctla-4治疗的功效(图2b-e)。所施用的假长双歧杆菌菌株、约氏乳杆菌菌株和欧陆森氏菌属菌株的rdna序列显示在图25-27中。所述菌株保藏在加拿大国际保藏机构(idac,位于加拿大公共卫生署国家微生物实验室,1015arlington street,winnipeg,manitoba,canada r3e 3r2),如下:假长双歧杆菌,idac保藏号231020-01,2020年10月23日保藏;约氏乳杆菌,idac保藏号231020-02,2020年10月23日保持;和欧陆森氏菌属,idac保藏号231020-03,2020年10月23日保藏。
[0228]
此外,在b.p.、l.j.和o.sp.单定殖动物的肿瘤中cd4
和cd8
t细胞活化和增殖显著增加(图2f-i)。与c.sp.对照菌株相比,分离的icb促进b.p.菌株还提高了抗pd-l1治疗在mc38异位肿瘤模型中的功效(图9),尽管程度低于针对抗ctla-4治疗(在相同剂量下)所观察到的程度,这与在aom/dss模型中的观察结果相似。由于观察到的功效更大,所以使用抗ctla-4治疗进行了所有后续机制研究。值得注意的是,抗肿瘤免疫依赖于抗ctla-4或抗pd-l1共同疗法,因为单独用b.p.单定殖不能减少肿瘤生长(图10a-10d和图31a-31c)或诱导抗肿瘤免疫(图10e-10j和图31d-31e),类似于之前使用其他icb促进剂细菌的研究(routy等人,2018;vetizou等人,2015)。
[0229]
通过icb促进细菌诱导th1免疫
[0230]
为了研究鉴定的细菌增强icb疗法的机制,选择了b.p.作为有益细菌的代表,因为它似乎具有最强的icb促进作用。gf或c.sp.单定殖充当阴性对照。先前的研究揭示了一些细菌在肿瘤环境中累积的能力,其中它们局部刺激免疫系统并通过有毒代谢物杀死肿瘤细胞(zheng等人,2018)。尽管细菌大量存在于b.p.和c.sp.单定殖小鼠的粪便中,但无法从这
些小鼠的异位肿瘤中检测到细菌或扩增16s rdna(图11),从而表明细菌在此模型中的有益作用不需要细菌驻留在肿瘤本身内。与gf或c.sp.单定殖小鼠相比,b.p.单定殖诱导小肠固有层cd4
t细胞中th1主转录调控因子t-bet的表达显著增加。类似地,尽管程度较低,b.p.诱导肠系膜淋巴结(mln)中的cd4
t细胞中的t-bet表达,但不诱导脾脏中(图3a-g)。令人感兴趣地,b.p.未活化th1细胞的效应功能,因为t-bet
-ifn-γ
双阳性细胞在所评估的任何组织中在b.p、c.sp.或gf组之间没有差异。总之,在不存在肿瘤和icb疗法的情况下,单独b.p.促进th1转录分化而不增加肠道和引流淋巴结中的局部效应功能,但不是全身性的。虽然b.p.对小肠中的其他cd4
t细胞亚群没有影响,但它还增加了cd8
t-bet
t细胞(图12a-12e。此外,b.p.对mln和脾脏中的th17和treg细胞的影响很小(图12f-12o)。
[0231]
icb促进细菌的全身作用
[0232]
因为单独b.p.在稳态期间仅促进局部而非全身性th1分化,接下来询问b.p.单定殖和抗ctla-4疗法的组合(在没有肿瘤的情况下)是否诱导全身性th1活化。事实上,与c.sp.单定殖或gf动物相比,当与抗ctla-4组合时,b.p.能够显著增强脾脏th1细胞活化和效应器功能,如通过ifn-γ产生所证明(图3h-j、图12p和12q)。得出结论,b.p.诱导th1分化,并与抗ctla-4一起活化th1 t细胞。令人感兴趣地,最近定义的由11种细菌组成的聚生体被发现优先在cd8
t细胞中诱导ifn-γ产生,并在没有免疫疗法的情况下促进抗肿瘤免疫(tanoue等人,2019)。相比之下,b.p.诱导cd4
和cd8
t细胞中的ifn-γ产生(图12r),并且需要icb治疗来实现杀肿瘤功能。
[0233]
对b.p.在稳态期间诱导th1转录分化与icb治疗后活化效应功能的能力很感兴趣。胃肠道炎症是抗ctla-4治疗的常见免疫相关不良反应(hodi等人,2010),并且推断这可能是由于肠道屏障完整性的改变。事实上,与对照相比,用抗ctla-4治疗的动物全身血清抗共生抗体增加,特别是th1相关igg2b(germann等人,1995),并且小肠跨上皮电阻降低(图13a和13b;图39)。尽管抗ctla-4治疗导致肠道屏障完整性受损,但它不会诱导局部或全身炎症(图13c和13d)。icb促进作用不需要在icb治疗后全身性抗细菌抗体诱导,因为抗ctla-4治疗对缺乏b细胞和抗体的假长双歧杆菌单定殖小鼠也有效(图33)。由于细菌未在(异位)肿瘤中累积,并且抗ctla-4降低了肠道屏障的完整性,假设代谢物的全身易位增加可能是icb治疗期间b.p.的全身效应的原因。为了解决这个问题,收集了来自用抗ctla-4治疗的荷瘤gf b.p.或c.sp.单定殖小鼠的血清(参见图2a)并将其与抗ctla-4同时转移至gf mc38荷瘤小鼠中。值得注意的是,来自ctla-4治疗的b.p.单定殖小鼠而不是来自gf或c.sp.单定殖小鼠的血清足以减少肿瘤生长并在gf小鼠的肿瘤和脾脏中引发强烈抗肿瘤免疫(图3k-n,图14a-14f)。总之,这些数据表明来源于b.p.或由b.p.诱导的可溶性因子负责观察到的icb促进作用。
[0234]
th1免疫细胞分化的分子机制
[0235]
为了鉴定可能负载转移的血清的抗肿瘤作用的推定代谢物,确定了转移血清样品的代谢组学谱,并鉴定了与c.sp.或gf小鼠相比,用b.p.单定殖的小鼠的血清中增加的代谢物。非靶向代谢组学分析揭示,与c.sp.单定殖和gf小鼠相比,来自b.p.的血清中几种代谢物的水平增加(图4a和图15a、15b)。值得注意的是,与来自c.sp.单定殖或gf小鼠的血清相比,嘌呤代谢物肌苷是唯一一种在来自b.p.单定殖小鼠的血清中显著更丰富(8至9倍)的代谢物(图4b)。值得注意的是,黄嘌呤和次黄嘌呤(肌苷的降解产物)在b.p.单定殖小鼠的血
清中也升高(图28)。细菌培养上清液的分析揭示b.p.产生的肌苷量大约是在相同培养条件下培养的c.sp.的10倍,从而揭示肌苷是由b.p.产生的细菌代谢物(图15c;图32)。通过断裂分析确认肌苷的身份(图15d)。为了确定体内的生理肌苷水平,接下来测量了b.p.单定殖小鼠的十二指肠、空肠和盲肠中的肌苷浓度。肌苷浓度在十二指肠中最高,并且沿胃肠道逐渐降低(十二指肠66.13
±
14.23μm》空肠29.26
±
9.38μm》盲肠0.5
±
0.05μm;图15e;图38)。还定量了b.p.(26.16
±
3.32μm)和c.sp.(3.26
±
1.01μm)单定殖小鼠的血清中的肌苷浓度(图15e),验证了我们之前的结果。此外,spf小鼠血清中的肌苷水平(4.08
±
1.12μm)在抗ctla-4治疗后显著增加(11.65
±
2.09μm),并且在抗生素治疗的spf小鼠中大大降低(2.03
±
0.86μm)(图15f)。这些数据表明,上胃肠道中的细菌产生可能是b.p.单定殖小鼠中全身肌苷的主要来源。
[0236]
接下来研究了肌苷是否能够直接增强抗肿瘤th1细胞分化。为了测试这一点,在存在或不存在肌苷的情况下,将活化的ova
323-339
肽脉冲的骨髓源性树突细胞(bmdc)与初始ova
323-339
特异性ot-ii cd4
t细胞共同培养。令人感兴趣地,肌苷导致cd4
t细胞分化的背景依赖性诱导或抑制。具体地,在外源性ifn-γ存在下,肌苷强烈增强初始t细胞的th1分化(图4c),而在不存在ifn-γ的情况下,肌苷减少th1诱导(图4d和图16a)。然后剖析了肌苷增强th1分化的分子机制,并且发现添加zm241385(腺苷a
2a
受体(a
2a
r)信号转导的药理学抑制剂)完全消除了肌苷的作用(图4c)。此外,添加细胞渗透性环状amp(db-camp)(a
2a
r下游的信号转导分子)恢复了th1分化并绕过对肌苷的需求。此外,蛋白激酶a(pka)(camp的下游效应分子)的抑制同样消除了肌苷驱动的th1分化(图4c)。最后,肌苷-a
2a
r-camp-pka信号转导级联导致转录因子camp反应元件结合蛋白(creb)(关键th1分化因子如il-12受体和ifn-γ的已知增强子)的磷酸化(图4e)(samten等人,2005;samten等人,2008;yao等人,2013)。实际上,还观察到il12rβ2的肌苷依赖性上调(图16b)。肌苷的作用是t细胞固有的,并且不是通过dc间接介导的,因为将肌苷添加至已用抗cd3/抗cd28包被的珠粒活化的初始t细胞也增强了th1分化,即使在没有ifn-γ的情况下也是如此(图16c)。此外,当用肌苷刺激a2ar缺陷型t细胞时,不存在th1分化和creb磷酸化的诱导(图16d,16e)。相比之下,通过使用db-camp绕过对a2ar信号转导的需求增加了th1分化和a2ar缺陷型t细胞中creb的磷酸化,从而证实肌苷的th1促进作用取决于a2ar信号转导(图16d、16e)。此外,由于已知pcreb与关键th1靶基因结合,所以还证实肌苷刺激导致cd4 t细胞中il12rb2和ifng基因转录的持续上调(图16f,16g)。重要的是,肌苷剂量反应实验揭示,在b.p.而不是c.sp.单定殖小鼠的血清中观察到的肌苷的生理浓度足以诱导th1活化(图16h)。由于腺苷也与a2ar结合,我所以还测量了腺苷水平,并且发现肠内容物中的水平极低,并且重要的是,b.p.与c.sp.单定殖小鼠之间的血清水平没有差异(图16i),从而表明腺苷不能介导b.p.的icb促进作用。此外,腺苷剂量反应实验表明,血清中的腺苷水平不足以促进th1活化和效应功能(图16j)。
[0237]
接下来想知道肌苷是否能够直接影响肿瘤细胞存活或对t细胞介导的杀伤的易感性。mc38肿瘤细胞在体外直接暴露于肌苷对肿瘤细胞活力没有任何影响(图17a)。此外,在与活化的肿瘤特异性t细胞共培养之前预处理mc38肿瘤细胞不会促进或抑制t细胞介导的肿瘤细胞杀伤(图17b)。这些数据表明肌苷的抗肿瘤作用是通过t细胞介导的。
[0238]
综合起来,这些数据表明,肌苷对t细胞的作用需要足够的共刺激(可能通过dc)、il-12受体参与th1分化和ifn-γ产生以实现有效的抗肿瘤免疫。与巨噬细胞相比,发现经
典树突细胞(cdc)是il-12的主要来源(图18a和18b)。因此,评估了cdc在癌症和icb细菌共同疗法期间的影响。为此,将来自cdc-dtr小鼠的骨髓(bm)细胞转移到致死性γ照射的受体(spf)小鼠中,以允许cdc的诱导型条件耗减。在bm重组后,将小鼠用抗生素治疗,然后用之前鉴定的三种icb促进细菌b.p.、l.j.和o.sp.的混合物管饲。γ-照射后十周,将小鼠皮下注射mc38 crc细胞,并且当建立可触及肿瘤时,通过注射白喉毒素耗减cdc,然后在一天后进行抗ctla-4治疗(图4f)。cdc的耗减导致肿瘤内cd8
和cd4
t细胞频率和ifn-γ产生显著降低(图4g-j),这导致更大的肿瘤(图4k)。类似地,在cdc耗减的动物中,脾脏cd8
和cd4
t细胞的ifn-γ产生和增殖也显著降低(图18c-18f)。因此,cdc的耗减大大降低了细菌引发的icb减少已建立肿瘤的功效,这表明cdc需要持续抗原呈递、il-12产生和t细胞共刺激以实现有效icb疗法。
[0239]
肌苷在体内促进th1免疫和杀肿瘤作用
[0240]
为了证实体外肌苷介导的th1促进作用是否也适用于体内条件,用卵白蛋白与cpg的组合作为共刺激物对gf小鼠进行免疫。一天后,小鼠仅腹膜内接受肌苷或媒介物。肌苷增加了mln中t-bet
、ifn-γ
cd8
和cd4
t细胞的比例(图5a-c),验证了我们的体外结果。为了评估肌苷的作用是否也促进抗肿瘤免疫,用mc38肿瘤细胞激发gf小鼠。在可触及肿瘤后,肌苷或pbs与抗ctla-4治疗和cpg组合口服或全身给予,如所指示(图5d)。与pbs相比,肌苷与抗ctla-4和cpg一起给予时,无论口服还是全身给药途径都导致肿瘤重量减轻并提高抗肿瘤免疫(图5e-g和图18g、18h)。相比之下,在没有cpg作为共刺激物的情况下,肌苷增加了肿瘤重量并降低了抗肿瘤免疫(图5e-g和图18g、18h)。这些结果验证了之前的体外研究结果,即肌苷的作用基于存在的共刺激的量是背景依赖性的。
[0241]
然后证实肌苷诱导的抗肿瘤免疫依赖于体内a2ar信号转导。用mc38肿瘤细胞激发无菌rag1缺陷型动物,并且同时接受wt或a2ar缺陷型t细胞。7天后,肌苷与抗ctla-4和cpg组合口服给予(图5h)。在接受wt但不接受a2ar缺陷型t细胞的动物中,肌苷增强了抗ctla-4/cpg介导的抗肿瘤免疫(图5i-l)。具体而言,在肌苷存在下,wt而不是a2ar缺陷型t细胞在肿瘤内表现出增加的ifn-γ产生,并且随后仅接受wt t细胞的gf小鼠表现出肿瘤重量减少(图5i-l)。这证明了肌苷-icb共同疗法的抗肿瘤作用依赖于t细胞中的a2ar信号转导。
[0242]
由于在icb治疗的肿瘤中检测到之前已证明可提高icb治疗功效并在体外产生肌苷的嗜粘蛋白艾克曼菌,因此进一步研究了嗜粘蛋白艾克曼菌是否也依赖a2ar信号转导来增强icb治疗功效。发现用嗜粘蛋白艾克曼菌与抗ctla-4的组合单定殖导致更小的肿瘤和增加的抗肿瘤免疫力,并且这取决于a2ar的t细胞表达(图34a-34d)。虽然用约氏乳杆菌单定殖能够促进抗ctla-4的抗肿瘤作用,但在体外培养物中次黄嘌呤(a2ar的另一种配体)而非肌苷升高。尽管如此,约氏乳杆菌的icb促进作用虽然不如假长芽孢杆菌和嗜粘蛋白艾克曼菌的作用强,但也部分依赖于a2ar的t细胞表达(图34e-34h)。
[0243]
接下来测试了肌苷是否也能够在复杂微生物群的存在下促进抗ctla-4疗法的功效。首先使用了一种限菌模型,在所述模型中,将小鼠用限定微生物群稳定定殖,所述微生物群由12种细菌物种组成,称为寡聚体-小鼠-微生物群-12(oligo-mm12),其缺乏假长双歧杆菌。发现肌苷能够促进抗ctla-4的抗肿瘤作用,减小肿瘤大小并增加肿瘤内ifn-γ cd8 和ifn-γ cd4 t细胞,即使在限菌oligo-mm12小鼠中也是如此(图35a-35d)。还发现肌苷可促进spf小鼠中抗ctla-4的功效,所述小鼠含有高度多样化的微生物群(图35e-35h)。然后
检查了假长双歧杆菌是否需要有活力才能增强抗ctla-4功效。虽然在有或没有抗生素预处理的情况下管饲活的假长双歧杆菌增强了spf小鼠中的抗ctla-4作用,但热灭活的假长双歧杆菌不能加强icb治疗法的效果,可能是由于无法产生肌苷(图35e至35h)。
[0244]
总之,肌苷-a2ar信号转导在体内驱动或抑制抗肿瘤免疫,这取决于存在的共刺激的量。
[0245]
icb促进细菌对crc亚型的不同影响
[0246]
最后,检查了鉴定的icb促进细菌在两种不同的crc模型中的作用,所述模型模拟人类crc的不同亚型。首先,测试了b.p.、l.j.和o.sp.在apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre(haigis等人,2008)spf小鼠中的icb促进作用,其具有条件性apc缺乏和特别是结肠细胞中的kras活化。在此crc模型中,与同种型治疗的动物相比,单独抗ctla-4治疗并没有提高存活率(图6a,b)。为了测试添加icb促进细菌是否能够在此模型中将无反应转变为反应效应,将spf小鼠用广谱抗生素的混合物治疗7天以克服定殖抗性(lee等人,2013),然后进行细菌转移和用抗ctla-4治疗。尽管icb促进细菌在肠道定殖,但这种联合方法并没有增强存活(图6c,d),从而揭示了此模型中细菌共同疗法的局限性。接下来,检查了icb促进细菌在spf中的作用在肠上皮细胞中具有msh2条件性失活的msh2
loxp/loxp
villin-cre(kucherlapati等人,2010)动物。在此模型中,单独抗ctla-4治疗(不添加icb促进细菌)导致肿瘤重量和癌症干细胞减少,并增加肿瘤中的t细胞活化和免疫细胞浸润(图6e-g,图19a、19c和19e)。值得注意的是,与对照细菌相比,与icb促进细菌共同治疗增强了抗ctla-4的作用,导致肿瘤重量和癌症干细胞数量进一步显著减少,同时肿瘤中的t细胞胞活化和免疫细胞浸润显著增强(图6h-j、图19b、19d和19f)。为了支持il12rβ2的肌苷依赖性上调对t细胞和cdc il-12产生和功能的关键作用,抗il-12p75治疗几乎完全消除了icb促进抗ctla-4共同疗法在msh2
loxp/loxp
villin-cre肿瘤中的作用,在使用抗il-12p40治疗同时耗减il-12和il-23后证实了类似的发现。(routy等人,2018;vetizou等人,2015)最后,由于奥沙利铂-抗pd-l1共同治疗是临床上更常用的治疗方法,所以证实了icb促进细菌也促进了奥沙利铂-抗pd-l1治疗在spf msh2
loxp/loxp
villin-cre(kucherlapati等人,2010)动物中的功效(图20)。
[0247]
由于假长双歧杆菌在icb治疗动物的aom/dss肿瘤中富集,并且双歧杆菌之前与癌症患者中icb治疗功效提高有关,所以想知道双歧杆菌是否也富集在icb治疗小鼠的msh2
loxp/loxp
villin-cre肿瘤中。虽然肿瘤相关细菌的总量没有随着抗ctla-4或抗pd-l1治疗而改变(图36a),但icb治疗导致肿瘤相关双歧杆菌的特异性富集(图36b)。
[0248]
总之,结果揭示了一种新的细菌-肌苷-免疫途径,所述途径增强cdc依赖性th1 t细胞回路,从而大大增强icb疗法在crc中的作用(图21)。
[0249]
另外的双歧杆菌属物种对icb疗法的影响
[0250]
接下来,研究了icb促进性质是否是多种双歧杆菌属物种的保守特征。为了测试这一点,用不同双歧杆菌属物种对gf小鼠进行单定殖,用mc38结肠直肠癌细胞激发这些小鼠,并用抗ctla-4治疗它们。令人感兴趣地,一些但并非所有测试的双歧杆菌属物种提高了icb治疗功效(图29a和b)。属于假长双歧杆菌的所有三种细菌菌株在其他测试的双歧杆菌属物种中具有更大的icb促进作用。这些结果表明icb促进作用是物种依赖性的。与研究结果一致,改善icb的双歧杆菌属物种具有升高的血清肌苷水平(图29c),并且相应的细菌在体外产生增加量的a2a配体次黄嘌呤(肌苷的降解产物),而没有改善icb治疗的双歧杆菌不产生
次黄嘌呤(图29d)。
[0251]
此外,还测试了由我们分离的假长双歧杆菌菌株是否提高了另一种icb抗pd-1的功效。实际上,与对照细菌(大肠埃希菌属)相比,假长双歧杆菌与抗pd-1一起提高了针对mc38肿瘤细胞的抗肿瘤免疫(图29e)。最后,与大肠埃希菌属相比,假长双歧杆菌还提高了抗ctla-4针对膀胱癌细胞系(mb49)的功效(图29f)。这表明假长双歧杆菌在不同肿瘤类型中提高了icb功效。
[0252]
论述
[0253]
icb疗法在crc中产生了相当令人失望的结果,只有40%的错配修复缺陷(mmrd)亚型crc患者有客观反应,仅占所有crc的4%(le等人,2015)。现在已经鉴定了一种新的微生物-代谢物-免疫回路,其在两种crc小鼠模型中增强icb疗法。这些数据表明,微生物群的修饰可为crc中的icb提供有希望的辅助疗法。值得注意的是,当两种抗体以相同剂量给药时,与抗pd-l1相比,抗ctla-4在aom/dss和异位肿瘤模型中诱导更强的抗肿瘤作用。在这一点上,很难知道这是否是由于在这些模型中阻断ctla-4与pd-l1的生物学效应存在差异,但应该注意的是,与抗ctla4 mab相比,其他实验研究通常使用更高剂量的抗pd-1 mab(routy等人,2018)。
[0254]
通过分离肿瘤相关细菌,已经鉴定了被发现在用icb治疗后仅与肿瘤相关的几种细菌,这些细节中的三种能够显著增强icb疗法在crc中的功效。这表明,在临床环境中,从肠肿瘤活检而不是粪便中分离细菌物种可能是限定crc中icb促进细菌的更好方法。虽然从小鼠中分离,但在人中也发现了所有三种icb促进细菌,从而表明它们具有临床转化的潜力(dewhirst等人,2001;pridmore等人,2008;turroni等人,2009)。此外,分析了公开的人粪便微生物群系宏基因组数据集,并且发现了一种趋势,尽管并不显著,其中与无反应的癌症患者相比,假长双歧杆菌在反应者中富集[高达2.4倍](图37a)。在属水平上,相对于非反应者,双歧杆菌在反应者中也富集(尽管不显著)[5.9倍;图37b],长双歧杆菌和青春双歧杆菌物种显著富集。虽然双歧杆菌属物种如短双歧杆菌和长双歧杆菌以前一直与抗肿瘤免疫相关(sivan等人,2015),但据报告,其他双歧杆菌属物种提供对抗ctla-4诱导的小肠结肠炎的保护,但对肿瘤生长没有影响(wang等人,2018)。假长双歧杆菌广泛分布在哺乳动物肠道中,许多不同的菌株表现出基因组多样性和不同的代谢能力(lugli等人,2019),从而表明了菌株依赖性功能和对微生物疗法的精确方法的需求。约氏乳杆菌以前不与抗肿瘤免疫相关,相比之下,它已被证明具有抗炎作用(bereswill等人,2017)。关于欧陆森氏菌属物种的功能知之甚少。
[0255]
研究结果证明了细菌代谢物肌苷在设定局部粘膜组织中的基线th1水平中的关键作用。最初,这是出人意料地,因为先前的报告已经证明肌苷和a
2a
r总体上参与对体外th1分化和体内抗肿瘤免疫的抑制作用(csoka等人,2008;hasko等人,2000;he等人,2017;ohta等人,2006)。事实上,支持腺苷和a2ar信号转导的免疫抑制作用的大量数据已导致开发新的免疫检查点抑制剂靶标如靶向cd73、cd39和cd38的mab,以及a2ar的药理学拮抗剂,其中许多目前正在临床试验(综述于(vigano等人,2019)中)。然而,一小部分文献表明肌苷可以是促炎性的,并且a2ar信号转导能够维持小鼠的th1/抗肿瘤免疫(cekic and linden,2014;lasek等人,2015;lioux等人,2016)。研究结果通过揭示基于共刺激量的肌苷-a2a受体信号转导的背景依赖性效应来调和这些对比观察结果。从机制上讲,肌苷通过camp与a2a受体结
合并活化转录因子creb。creb连同辅因子以及与atf-2和/或c-jun形成异二聚体一起调节关键th1基因(包括il12rb2和ifng)的转录(samten等人,2008)。值得注意的是,除了camp信号转导外,肌苷(与腺苷相比)具有明显的a2ar依赖性信号转导偏好,对erk1/2磷酸化具有3.3倍偏爱。根据研究结果,在癌症免疫疗法中阻断肌苷
‑‑
a2a受体信号转导可消除由有益微生物提供的积极作用。认为a2a受体信号转导可能是细菌-icb共同疗法的完整抗肿瘤途径。事实上,tanoue等人最近鉴定了由11种提高icb疗法的细菌组成的聚生体(tanoue等人,2019),所述细菌与这项工作中鉴定的细菌无关。值得注意的是,在用11种细菌的聚生体定殖的小鼠的盲肠和血清中,含量最高的代谢物中的两种是肌苷一磷酸和次黄嘌呤(分别是肌苷的底物和产物),两者均是a2a受体激动剂如肌苷(welihinda等人,2016)。肌苷-a2a受体信号转导的这种背景依赖性效应的鉴定特别重要,因为肌苷目前被用作各种th1相关疾病的临床试验中的干预措施(clinical.trials.gov),所述疾病包括多发性硬化症、肌萎缩性侧索硬化和帕金森氏病(bettelli等人,2004;kustrimovic等人,2018;lovett-racke等人,2004;saresella等人,2013)。
[0256]
将cdc及其il-12产生鉴定为有效诱导在有益细菌存在下由icb疗法引发的抗肿瘤t细胞免疫的必要组分。最近在抗pd-1治疗中也报告了cdc和il-12的重要参与(garris等人,2018)。
[0257]
guinney等人的开创性工作揭示了crc的四种分子共有亚型(guinney等人,2015);mmrd、规范、代谢和间充质。与临床环境中mmrd患者中icb的阳性结果一致(le等人,2015),在我们的mmrd动物模型(msh2
loxp/loxp
villin-cre)中,确实观察到了抗ctla-4单一疗法的一些功效。然而,与icb促进细菌的共同疗法强烈增强了抗ctla-4的杀肿瘤作用。因此,细菌共同疗法可优化mmrd crc患者的治疗方案。其次,icb疗法是有效的,并且在crc的aom/dss模型中与假长双歧杆菌、约氏乳杆菌和欧陆森氏菌属相关。aom/dss肿瘤已被用于模拟炎症相关crc。aom/dss肿瘤还表现出上皮细胞向间充质细胞转化的特征(lin等人,2015),如e-钙粘着蛋白减少、n-钙粘着蛋白、波形蛋白和snail表达增加,以及炎症和tgf-β表达增加(becker等人,2004;mager等人,2017),它们是间充质共有分子crc亚型的标志(guinney等人,2015)。因此,我们的结果表明细菌共同疗法在这种亚型中也具有益处。规范和代谢crc亚型均以apc的失活为特征,规范crc亚型另外还以wnt途径为特征,并且代谢crc亚型以kras活化为特征(guinney等人,2015)。这些标志在apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre动物模型中得到了很好的体现;并且令人感兴趣地,细菌共同疗法并未改善抗ctla-4治疗。与apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre模型相比,msh2
loxp/loxp
villin-cre-中icb促进细菌的不同作用令人感兴趣,并且在这个阶段只能推测潜在的原因。在msh2
loxp/loxp
villin-cre肿瘤中可能更高的突变负荷和相关的新抗原数量肯定影响icb疗法的功效(havel等人,2019)。此外,抗ctla-4在apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre模型中对本身没有影响;并且单独细菌不会影响异位肿瘤发展。还表明b.p.增加th1细胞池,并且释放它们的抗肿瘤作用,然后是有效icb疗法。因此,推断需要在apc
2lox14/
;kras
lsl-g12d/
;fabpl-cre模型中发现新的检查点阻断靶标或其他具有自身作用的疗法来实现有效的细菌共同疗法以治疗crc患者的类似亚型。
[0258]
总之,这项工作为治疗包括crc在内的癌症的新方法铺平了道路。
[0259]
参考文献
[0260]
allard,b.,cousineau,i.,allard,d.,buisseret,l.,pommey,s.,chrobak,p.,and stagg,j.(2019).adenosine a2a receptor promotes lymphangiogenesis and lymph node metastasis.oncoimmunology 8,1601481.
[0261]
anitei,m.g.,zeitoun,g.,mlecnik,b.,marliot,f.,haicheur,n.,todosi,a.m.,kirilovsky,a.,lagorce,c.,bindea,g.,ferariu.d.,et al.(2014).prognostic and predictive values of the immunoscore in patients with rectal cancer.clin cancer res 20,1891-1899.
[0262]
arthur,j.c.,perez-chanona,e.,muhlbauer,m.,tomkovich,s.,uronis,j.m.,fan,t.j.,campbell,b.j.,abujamel,t.,dogan,b.,rogers,a.b.,et al.(2012).intestinal inflammation targets cancer-inducing activity of the microbiota.science338,120-123.
[0263]
bamden,m.j.,allison,j.,heath,w.r.,and carbone,f.r.(1998).defective tcr expression in transgenic mice constructed using cdna-based alpha-and beta-chain genes under the control of heterologous regulatory elements.immunol cell biol 76,34-40.
[0264]
becker,c.,fantini,m.c.,schramm,c.,lehr,h.a.,wirtz,s.,nikolaev,a.,burg,j.,strand,s.,kiesslich,r.,huber,s.,et al.(2004).tgf-beta suppresses tumor progression in colon cancer by inhibition of il-6 trans-signaling.immunity 21,491-501.
[0265]
bereswill,s.,ekmekciu,i.,escher,u.,fiebiger,u.,stingl,k.,and heimesaat,m.m.(2017).lactobacillus johnsonii ameliorates intestinal,extra-intestinal and systemic pro-inflammatory immune responses following murine campylobacter jejuni infection.sci rep7,2138.
[0266]
bettelli,e.,sullivan,b.,szabo,s.j.,sobel,r.a.,glimcher,l.h.,and kuchroo,v.k.(2004).loss of t-bet,but not stat1,prevents the development of experimental autoimmune encephalomyelitis.j exp med 200,79-87.
[0267]
brahmer,j.r.,tykodi,s.s.,chow,l.q.,hwu,w.j.,topalian,s.l.,hwu,p.,drake,c.g.,camacho,l.h.,kauh,j.,odunsi,k.,et al.(2012).safety and activity of anti-pd-l1 antibody in patients with advanced cancer.n engl j med 366,2455-2465.
[0268]
callahan,b.j.,mcmurdie,p.j.,rosen,m.j.,han,a.w.,johnson,a.j.,and holmes,sp.(2016).dada2:high-resolution sample inference from illumina amplicon data.nat methods 13,581-583.
[0269]
cekic,c.,and linden,j.(2014).adenosine a2a receptors intrinsically regulate cd8 t cells in the tumor microenvironment.cancer res 74,7239-7249.
[0270]
clasquin,m.f.,melamud,e.,and rabinowitz,j.d.(2012).lc-ms data processing with maven:a metabolomic analysis and visualization engine.curr protoc bioinformatics chapter 14,unit14 11.
[0271]
clinical.trials.gov at.
mouse for studying intestinal cancer and testing anticancer agents.gastroenterology 138,993-1002 e1001.
[0293]
kustrimovic,n.,comi,c.,magistrelli,l.,rasini,e.,legnaro,m.,bombelli,r.,aleksic,i.,blandini,f.,minafra,b.,riboldazzi,g.,et al.(2018).parkinson
′
s disease patients have a complex phenotypic and functional th1 bias:cross-sectional studies of cd4 th1/th2/t17 and treg in drug-naive and drug-treated patients.j neuroinflammation 15,205.
[0294]
lasek,w.,janyst,m.,wolny,r.,zapala,l.,bocian,k.,and drela,n.(2015).immunomodulatory effects of inosine pranobex on cytokine production by human lymphocytes.acta pharm 65,171-180.
[0295]
le,d.t.,durham,j.n.,smith,k.n.,wang,h.,bartlett,b.r.,aulakh,l.k.,lu,s.,kemberling,h.,wilt,c.,luber,b.s.,et al.(2017).mismatch repair deficiency predicts response of solid tumors to pd-1 blockade.science 357,409-413.
[0296]
le,d.t.,uram,j.n.,wang,h.,bartlett,b.r.,kemberling,h.,eyring,a.d.,skora,a.d.,luber.b.s.,azad,ns.,laheru,d.,et al.(2015).pd-1 blockade in tumors with mismatch-repair deficiency.n engl j med 372,2509-2520.
[0297]
le gouvello,s.,bastuji-garin,s.,aloulou,n.,mansour,h.,chaumette,m.t.,berrehar,f.,seikour,a.,charachon,a.,karoui,m.,leroy,k.,et al.(2008).high prevalence of foxp3 and il17 in mmr-proficient colorectal carcinomas.gut 57,772-779.
[0298]
lee,s.m.,donaldson,g.p.,mikulski,z.,boyajian,s.,ley,k.,and mazmanian,s.k.(2013).bacterial colonization factors control specificity and stability of the gut microbiota.nature 501,426-429.
[0299]
lin,l.,sun,y.,wang,d.,zheng,s.,zhang,j.,and zheng,c.(2015).celastrol ameliorates ulcerative colitis-related colorectal cancer in mice via suppressing inflammatory responses and epithelial-mesenchymal transition.front pharmacol 6,320.
[0300]
lioux,t.,mauny,m.a.,lamoureux,a.,bascoul,n.,hays,m.,vernejoul,f.,baudru,a.s.,boularan,c.,lopes-vicente,j.,qushair,g.,et al.(2016).design,synthesis,and biological evaluation of novel cyclic adenosine-inosine monophosphate(caimp)analogs that activate stimulator of interferon genes(sting).j med chem 59,10253-10267.
[0301]
love,m.i.,huber,w.,and anders,s.(2014).moderated estimation of fold change and dispersion for rna-seq data with deseq2.genome biol 15,550.
[0302]
lovett-racke,a.e.,rocchini,a.e.,choy,j.,northrop,s.c.,hussain,r.z.,ratts,r.b.,sikder,d.,and racke,m.k.(2004).silencing t-bet defines a critical role in the differentiation of autoreactive t lymphocytes,immunity 21,719-731.
[0303]
lugli,g.a.,duranti,s.,albert,k.,mancabelli,l.,napoli,s.,viappiani,a.,
natl acad sci u s a 115,157-161.
[0326]
wang,l.,wang,y.,song,z.,chu,j.,and qu,x.(2015).deficiency of interferon-gamma or its receptor promotes colorectal cancer development.j interferon cytokine res 35,273-280.
[0327]
welihinda,a.a.,kaur,m.,greene,k.,zhai,y.,and amento,e.p.(2016).the adenosine metabolite inosine is a functional agonist of the adenosine a2a receptor with a unique signaling bias.cell signal28,552-560.
[0328]
yao,c.,hirata,t.,soontrapa,k.,ma,x.,takemori,h.,and narumiya,s.(2013).prostaglandin e(2)promotes th1 differentiation via synergistic amplification of il-12 signalling by camp and pi3-kinase.nat commun 4,1685.
[0329]
zheng,d.w.,chen,y.,li,z.h.,xu,l.,li,c.x.,li,b.,fan,j.x.,cheng,s.x.,and zhang,x.z.(2018).optically-controlled bacterial metabolite for cancer therapy.nat commun 9,1680.
[0330]
本文所述的实施方案意图仅为实施例。本领域技术人员可对特定实施方案进行更改、修改和改变。权利要求的范围不应当受到本文所阐述的特定实施方案的限制,而是应当以与整个说明书一致的方式进行解释。
[0331]
本说明书中提及的所有出版物、专利和专利申请均指示本发明所属领域的技术人员的技术水平,并以引用的方式并入本文,就如每个单独的出版物、专利或专利申请被具体地和单独地指出以引用的方式并入的程度一样。
[0332]
如此描述了本发明,显然可以多种方式改变本发明。不将此类变化视为与本发明的精神和范围背离,并且如将对本领域技术人员明显的所有此类修改意图包括在以下权利要求书的范围内。
[0333]
本发明的示例性实施方案
[0334]
本发明的示例性方面由以下实施方案指定。
[0335]
e1.一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌。
[0336]
e2.一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属的细菌。
[0337]
e3.如实施方案e1或e2所述的方法,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0338]
e4.如实施方案e3所述的方法,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0339]
e5.一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌。
[0340]
e6.一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或
由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)的细菌。
[0341]
e7.一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.)的细菌。
[0342]
e8.如实施方案e5至e7中任一项所述的方法,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0343]
e9.如实施方案e1至e8中任一项所述的方法,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
[0344]
e10.如实施方案e1至e9中任一项所述的方法,其中所述双歧杆菌属在图22中呈现。
[0345]
e11.如实施方案e1至e10中任一项所述的方法,其中所述乳杆菌属在图23中呈现。
[0346]
e12.如实施方案e1至e11中任一项所述的方法,其中所述欧陆森氏菌属在图24中呈现。
[0347]
e13.如实施方案e1至e12中任一项所述的方法,所述方法还包括施用化学治疗剂、免疫治疗剂或放射疗法。
[0348]
e14.如实施方案e1至e13中任一项所述的方法,其中所述受试者是人。
[0349]
e15.免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0350]
e16.免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属的细菌用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0351]
e17.如实施方案e15或e16所述的用途,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0352]
e18.如实施方案17所述的用途,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0353]
e19.免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。
[0354]
e20.免疫检查点抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。
[0355]
e21.免疫检查点抑制剂和一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.)的细菌用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的用途。
[0356]
e22.如实施方案e19至e21中任一项所述的用途,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0357]
e23.如实施方案e15至e22中任一项所述的用途,其中所述icb抑制剂是抗ctla4抗
体,或抗pd-l1抗体或抗pd-1抗体。
[0358]
e24.如实施方案e15至e23中任一项所述的用途,其中所述双歧杆菌属在图22中呈现。
[0359]
e25.如实施方案e15至e24中任一项所述的用途,其中所述乳杆菌属在图23中呈现。
[0360]
e26.如实施方案e15至e25中任一项所述的用途,其中所述欧陆森氏菌属在图24中呈现。
[0361]
e27.如实施方案e15至e26中任一项所述的用途,所述用途还包括使用化学治疗剂、免疫治疗剂或放射疗法。
[0362]
e28.如实施方案e15至e27中任一项所述的用途,其中所述受试者是人。
[0363]
e29.一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌以及任选的容器。
[0364]
e30.一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属的细菌以及任选的容器。
[0365]
e31.如实施方案e29或e30所述的药盒,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0366]
e32.如实施方案e31所述的药盒,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0367]
e33.一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌、约氏乳杆菌、茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌的细菌以及任选的容器。
[0368]
e34.一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自假长双歧杆菌(b.p.)、约氏乳杆菌(l.j)或欧陆森氏菌属(o.sp.)的细菌以及任选的容器。
[0369]
e35.一种用于治疗患有或疑似患有结肠直肠癌(crc)的受试者的药盒,所述药盒包括或由以下组成:施用免疫检查点抑制剂和一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属(o.sp.)的细菌和任选的容器。
[0370]
e36.如实施方案e33至e35中任一项所述的药盒,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0371]
e37.如实施方案e29至e36中任一项所述的药盒,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
[0372]
e38.如实施方案e29至e37中任一项所述的药盒,其中所述双歧杆菌属在图22中呈现。
[0373]
e39.如实施方案e29至e38中任一项所述的药盒,其中所述乳杆菌属在图23中呈现。
[0374]
e40.如实施方案e29至e39中任一项所述的药盒,其中所述欧陆森氏菌属在图24中
呈现。
[0375]
e41.如实施方案e29至e40中任一项所述的药盒,所述药盒还包括施用化学治疗剂、免疫治疗剂或放射疗法。
[0376]
e42.如实施方案e29至e41中任一项所述的药盒,其中所述受试者是人。
[0377]
e42.一种治疗患有癌症或疑似患有癌症的受试者的方法,所述方法包括或由以下组成:施用:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂。
[0378]
e43.如实施方案e42所述的方法,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0379]
e44.如实施方案e43所述的方法,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0380]
e45.一种治疗患有或疑似患有结肠直肠癌(crc)的受试者的方法,所述方法包括或由以下组成:施用:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂。
[0381]
e46.如实施方案e45所述的方法,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0382]
e47.如实施方案e42至e46中任一项所述的方法,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
[0383]
e48.如实施方案e42至e47中任一项所述的方法,所述方法还包括施用化学治疗剂、免疫治疗剂或放射疗法。
[0384]
e49.如实施方案e42至e48中任一项所述的方法,其中所述共刺激剂是toll样受体(tlr)信号、cpg、lps、鞭毛蛋白、核苷酸结合寡聚结构域样受体(nlr)、内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物。rig-i样受体(视黄酸诱导型基因i样受体)、单链或双链rna(例如,来自病毒)、c型凝集素受体(clr)、重复甘露糖单元、c型凝集素结构域、细胞因子受体信号转导、il-12、il-18、il-33、ifn-g、通过抗原呈递细胞或其在t细胞上的对应物提供的刺激、cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40、-cgas-sting途径,例如胞质dna。
[0385]
e50.如实施方案e42至e48中任一项所述的方法,其中所述受试者是人。
[0386]
e51.免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;以及共刺激剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0387]
e52.如实施方案e51所述的用途,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0388]
e53.如实施方案e52所述的用途,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0389]
e54.免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或
肌苷的生理学功能衍生物;以及共刺激剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0390]
e55.如实施方案e51至e54中任一项所述的用途,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
[0391]
e56.如实施方案e51至e55中任一项所述的用途,所述用途还包括使用化学治疗剂、免疫治疗剂或放射疗法。
[0392]
e57.如实施方案e51-e56中任一项所述的用途,其中所述toll样受体(tlr)信号、cpg、lps、鞭毛蛋白、核苷酸结合寡聚结构域样受体(nlr)、内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物。rig-i样受体(视黄酸诱导型基因i样受体)、单链或双链rna(例如,来自病毒)、c型凝集素受体(clr)、重复甘露糖单元、c型凝集素结构域、细胞因子受体信号转导、il-12、il-18、il-33、ifn-g、通过抗原呈递细胞或其在t细胞上的对应物提供的刺激、cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40、-cgas-sting途径,例如胞质dna。
[0393]
e58.如实施方案e51至e57中任一项所述的用途,其中所述受试者是人。
[0394]
e59.一种用于治疗患有癌症或疑似患有癌症的受试者的药盒,所述药盒包括或由以下组成:免疫检查点抑制剂;肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物;和共刺激剂,以及任选的容器。
[0395]
e60.如实施方案e59所述的药盒,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌。
[0396]
e61.如实施方案e60所述的方法,其中所述crc是错配修复缺陷(mmrd)crc或炎症相关crc。
[0397]
e62.如实施方案e59至e61中任一项所述的药盒,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体或抗pd-1抗体。
[0398]
e63.如实施方案e59至e62中任一项所述的药盒,所述药盒还包括化学治疗剂、免疫治疗剂或放射疗法。
[0399]
e64.如实施方案e59至e63中任一项所述的药盒途,其中所述toll样受体(tlr)信号、cpg、lps、鞭毛蛋白、核苷酸结合寡聚结构域样受体(nlr)、内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物。rig-i样受体(视黄酸诱导型基因i样受体)、单链或双链rna(例如,来自病毒)、c型凝集素受体(clr)、重复甘露糖单元、c型凝集素结构域、细胞因子受体信号转导、il-12、il-18、il-33、ifn-g、通过抗原呈递细胞或其在t细胞上的对应物提供的刺激、cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40、-cgas-sting途径,例如胞质dna。
[0400]
e65.如实施方案e59至e64中任一项所述的药盒,其中所述受试者是人。
[0401]
本发明的另外示例性实施方案
[0402]
本发明的另外示例性方面由以下实施方案指定。
[0403]
a1.一种或多种选自双歧杆菌属(b.sp.)、乳杆菌属(l.sp.)或欧陆森氏菌属
(o.sp.)或它们的组合的细菌和免疫检查点抑制剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0404]
a2.如实施方案a1所述的用途,其中所述细菌包括图22中呈现的一种或多种双歧杆菌属、图23中呈现的乳杆菌属和/或图24中呈现的欧陆森氏菌属或它们的组合。
[0405]
a3.如前述实施方案中任一项所述的用途,其中所述细菌包括包含与seq id no:1具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列的双歧杆菌属。
[0406]
a4.如前述实施方案中任一项所述的用途,其中所述细菌包括包含与seq id no:2具有至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列的乳杆菌属。
[0407]
a5.如前述实施方案中任一项所述的用途,其中所述细菌包括包含与seq id no:3具有至少85%,如至少90%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%或具有100%同一性的16s rdna序列的欧陆森氏菌属。
[0408]
a6.如前述实施方案中任一项所述的用途,其中所述细菌包括假长双歧杆菌、约氏乳杆菌或欧陆森氏菌属或它们的组合。
[0409]
a7.如前述实施方案中任一项所述的用途,其中所述细菌包括欧陆森氏菌属,包括茂盛欧尔森氏菌、脐形欧尔森氏菌或齿龈欧陆森氏菌或它们的组合。
[0410]
a8.如前述实施方案中任一项所述的用途,其中所述细菌包括以idac保藏号231020-01保藏的所述假长双歧杆菌菌株。
[0411]
a9.如前述实施方案中任一项所述的用途,其中所述细菌包括以idac保藏号231020-02保藏的所述约氏乳杆菌菌株。
[0412]
a10.如前述实施方案中任一项所述的用途,其中所述细菌包括以idac保藏号231020-03保藏的所述欧陆森氏菌属菌株。
[0413]
a11.如前述实施方案中任一项所述的用途,其中所述细菌包括以idac保藏号231020-01保藏的所述假长双歧杆菌菌株、以idac保藏号231020-02保藏的所述约氏乳杆菌菌株和以idac保藏号231020-03保藏的所述欧陆森氏菌属菌株中的至少两者。
[0414]
a12.如前述实施方案中任一项所述的用途,其中所述细菌在体外或体内测定中产生升高水平的肌苷、黄嘌呤、次黄嘌呤和/或肌苷一磷酸,优选肌苷。
[0415]
a13.如前述实施方案中任一项所述的用途,其中所述细菌在施用于所述受试者时产生升高水平的肌苷、黄嘌呤、次黄嘌呤和/或肌苷一磷酸,优选肌苷。
[0416]
a14.如前述实施方案中任一项所述的用途,其中所述细菌用于施用至所述受试者的胃肠道,优选经口或经直肠。
[0417]
a15.免疫检查点抑制剂和选自肌苷、肌苷的衍生物、肌苷的功能衍生物、肌苷的前药或肌苷的生理学功能衍生物的另外剂;以及共刺激剂用于治疗患有癌症或疑似患有癌症的受试者的用途。
[0418]
a16.如实施方案a15所述的用途,其中所述另外的剂包括肌苷、黄嘌呤、次黄嘌呤、肌苷一磷酸或它们的组合。
[0419]
a17.如实施方案a15所述的用途,其中所述另外的剂包括a2a激动剂。
[0420]
a18.如实施方案a15至a17中任一项所述的用途,其中所述另外的剂用于以有效增
强所述icb抑制剂对所述癌症的治疗作用的量施用。
[0421]
a19.如实施方案a15至a18中任一项所述的用途,其中所述共刺激剂包括一种或多种toll样受体(tlr)信号、cpg、lps、鞭毛蛋白、核苷酸结合寡聚结构域样受体(nlr)、内消旋二氨基庚二酸、胞壁酰二肽、atp、细胞外葡萄糖、尿酸单钠的晶体、焦磷酸钙二水合物、明矾、胆固醇或环境刺激物;二氧化硅;石棉;uv照射和皮肤刺激物。rig-i样受体(视黄酸诱导型基因i样受体)、单链或双链rna(例如,病毒rna)、c型凝集素受体(clr)、重复甘露糖单元、c型凝集素结构域、细胞因子受体信号转导、il-12、il-18、il-33、ifn-g、通过抗原呈递细胞或其在t细胞上的对应物提供的刺激、cd80-cd28、cd86-cd28、cd40cd40l、ox-40l-ox40、-cgas-sting途径或胞质dna。
[0422]
a20.如前述实施方案中任一项所述的用途,其中所述癌症是结肠直肠癌(crc)、肺癌、黑素瘤、膀胱癌、肾癌、乳腺癌、前列腺癌、胃癌、肝癌、食道癌、胰腺癌、脑癌、宫颈癌、卵巢癌、甲状腺癌、唇癌、口腔癌、喉癌、鼻咽癌或子宫癌,优选crc。
[0423]
a21.如实施方案a1-a19中任一项所述的用途,其中所述癌症选自非小细胞肺癌、小细胞肺癌、胃癌、睾丸癌、间皮瘤、头颈癌、胶质母细胞瘤、胸腺癌或梅克尔细胞癌。在另一个实例中,所述癌症选自白血病、骨髓增生性肿瘤(mpn)、骨髓异常增生综合征(mds)、慢性淋巴细胞性白血病(cll)、慢性髓细胞性白血病(cml)、急性淋巴母细胞性白血病(all)、急性骨髓性白血病(all)、骨髓异常增生综合征(mds)、霍奇金淋巴瘤(hl)、非霍奇金淋巴瘤(nhl)、多发性骨髓瘤(mm)、真性红细胞增多症(pv)、特发性血小板增多症(et)、原发性骨髓纤维化(pmf)、慢性嗜酸性粒细胞白血病或蕈样真菌病。
[0424]
a22.如前述实施方案中任一项所述的用途,其中所述癌症是错配修复缺陷(mmrd)癌症或炎症相关癌症。
[0425]
a23.如前述实施方案中任一项所述的用途,其中所述癌症是错配修复缺陷(mmrd)结肠直肠癌、胃肠癌、子宫内膜癌、乳腺癌、前列腺癌、膀胱癌或甲状腺癌。
[0426]
a24.如前述实施方案中任一项所述的用途,其中所述癌症是患有林奇综合征的受试者中的错配修复缺陷(mmrd)癌症。
[0427]
a25.如前述实施方案中任一项所述的用途,其中所述癌症是错配修复缺陷(mmrd)crc或炎症相关crc。
[0428]
a26.如实施方案a22至a25中任一项所述的用途,其中所述mmrd包括(1)选自mlh1、msh2、msh6和pms2的mmrd蛋白的表达降低或消除;和/或(2)选自mlh1、msh2、msh6和pms2,优选mlh1的mmrd基因的甲基化;和/或(3)微卫星不稳定性。
[0429]
a27.如实施方案a22至a26中任一项所述的用途,其中所述用途还包括通过包括以下的方法检测所述癌症中的mmrd:(1)测量所述癌症或其样品中选自mlh1、msh2、msh6和pms2的mmrd蛋白的表达,如通过免疫组织化学分析;和/或(2)检测所述癌症或其样品中选自mlh1、msh2、msh6和pms2,优选mlh1的mmrd基因的甲基化;和/或(3)检测所述癌症或其样品中的微卫星不稳定性。
[0430]
a28.如前述实施方案中任一项所述的用途,其中所述icb抑制剂包括ctla-4、pd-1、pd-l1、pd-l2、lag-3、vista、ido、ido1ido2、tigit、btla、hvem、cd226(dnam-1)、cd96(tactile)、tim-3、lair1、cd160(by55)、cd244(2b4)、vtcn1(b7-h4)、kir、a2ar、b7-h3或它们的组合的拮抗剂。
[0431]
a29.如前述实施方案中任一项所述的用途,其中所述icb抑制剂包括伊匹单抗(抗cdla-4抗体,bristol-myers squibb)、纳武单抗(抗pd-1抗体,bristol-myers squibb)、派姆单抗(抗pd-1抗体,merck)、阿特珠单抗(抗pd-l1抗体,roche)、阿维鲁单抗(抗pd-l1抗体,merck kgaa/pfizer)、德瓦鲁单抗(抗pd-l1抗体,medimmune/astrazeneca)、西米普利单抗(抗pd-1抗体,regeneron/sanofi)、兰布罗利珠单抗(抗pd-1抗体,merck)、匹地利珠单抗(抗pd-1和抗dll抗体,medivation)、bms-936559(抗pd-l1,bristol-myers squibb)、medi-0680(抗pd-1抗体;amp-514;astrazeneca)、regn2810(抗pd-1抗体,regeneron)、ca-170(小分子pd-1和pd-l1抑制剂;curis)、bms-1166(小分子pd-l1抑制剂,bristol-myers squibb)、amp-224(抗pd-1融合蛋白,medimmune)、斯巴达珠单抗(抗pd-1抗体,novartis)、sti-a1110(抗pd1抗体,sorrento/servier)、多塔利单抗(抗pd-1抗体,tsr-042,tesaro)、rg-7446(抗pd-l1抗体,roche)、aur-012(pd1的肽拮抗剂,aurigene)、sti-a1010(抗pd-l1抗体,sorrento)或它们的组合。
[0432]
a30.如前述实施方案中任一项所述的用途,其中所述icb抑制剂是抗ctla4抗体,或抗pd-l1抗体、抗pd-l2抗体或抗pd-1抗体。
[0433]
a31.如前述实施方案中任一项所述的用途,其中所述用途还包括在施用之前,测量所述受试者的血清中的肌苷水平,其中任选地,所述受试者在施用之前具有降低的肌苷水平。
[0434]
a32.如前述实施方案中任一项所述的用途,其中所述用途还包括在施用之前,测量所述受试者的胃肠道中的所述细菌的水平,其中任选地,所述受试者在施用之前具有降低的或不存在的所述细菌的水平。
[0435]
a33.如前述实施方案中任一项所述的用途,其中所述受试者在所述施用之前诸如至多一天、两天、三天、四天、五天、六天、一周、至多两周、至多三周或至多四周之前完成单剂量抗生素或抗生素疗程。
[0436]
a34.如前述实施方案中任一项所述的用途,其中所述用途还包括向所述受试者施用化学治疗剂、免疫治疗剂或放射疗法。
[0437]
a35.如前述实施方案中任一项所述的用途,其中所述受试者是人。
[0438]
a36.如前述实施方案中任一项所述的用途,其中细菌用于以包括所述细菌的介于106与10
12
个菌落形成单位(cfu)之间,如所述细菌的介于107与10
11
cfu之间、所述细菌的介于108与10
11
cfu之间、所述细菌的介于109与10
11
cfu之间或所述细菌的介于109与10
10
cfu之间的量施用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。