t细胞受体融合蛋白及应用
【技术领域】
1.本发明涉及免疫学领域,尤其涉及一种t细胞受体融合蛋白及应用。
背景技术:
2.car-t疗法从癌症病人身上分离免疫t细胞,利用基因工程技术为t细胞引入一个能够识别肿瘤细胞并同时激活t细胞的嵌合抗原受体,然后将扩增好的car-t细胞回输到病人体内,起到杀伤肿瘤细胞作用。近年来,car-t细胞疗法在治疗b细胞白血病和淋巴瘤临床试验中有着显著的疗效,显示出持续的疾病缓解效果,被认为是最有前景的肿瘤治疗方式之一。
3.1989年,美国科学院院刊pnas报道了第一代car-t疗法。t细胞激活是通过cd3z链或fcerig上的酪氨酸激活基序完成的。cd3z链能够提供t细胞激活、裂解靶细胞、调节il-2分泌以及体内发挥抗肿瘤活性所需的第1信号。但第一代car改造t细胞的抗肿瘤活性在体内受到了限制,t细胞增殖减少最终导致t细胞的凋亡。虽然很快投入临床试验,但疗效却差强人意。第二代car-t细胞在胞内增加了一个新的共刺激信号,与第一代car相比,抗原特异性不变,t细胞增殖、细胞因子分泌增加,增加对肿瘤细胞裂解的记忆效应以及car介导的杀伤效应。目前,用于临床治疗研究的主要为第2代cart细胞技术,常用的共刺激分子为cd28和cd137(4-1bb)。
4.虽然第二代car-t细胞免疫疗法在治疗白血病、淋巴瘤以及骨髓瘤等恶性血液肿瘤中取得了重大突破,但是car-t细胞治疗过程中常常发生细胞因子释放综合征等副作用,导致危险的高热和急剧的血压下降,严重威胁到混着的生命健康安全。在美国虽然有2款car-t药物上市,但是只有少数顶级的医院、具有完备的预案及抢救设备实施才可以使用,从而限制了car-t药物的应用范围。为了增加肿瘤特异性t细胞治疗的安全性,一种可行的方法是对嵌合抗原受体的结构进行改进或者替换,使之更类似天然t细胞攻击肿瘤细胞的机制,从而降低细胞因子风暴风险。
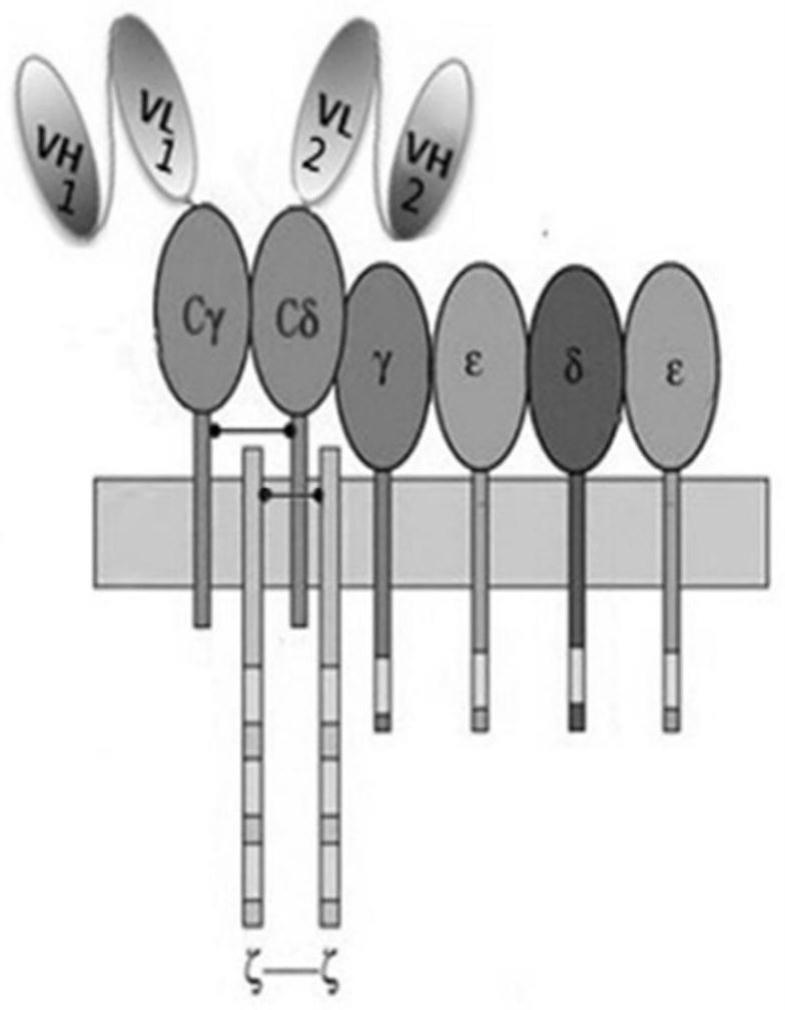
5.tcr是由两条不同肽链构成的异二聚体,根据t细胞抗原受体类型的不同,t细胞分为α/β型t细胞和γ/δ的t细胞。α/β型t细胞,其表面的t细胞受体(tcrs)由α链和β链两条糖蛋白链组成,γ/δ其tcrs由γ链和δ链组成。每条肽链又可分为可变区(v区)和恒定区(c区)两部分,其中恒定区又包括胞外区、跨膜区和胞内末端三部分;其特点是胞内区很短。tcr分子属于免疫球蛋白超家族,其抗原特异性存在于v区。任一t细胞只表达α/β或γ/δ之一。人类外周血中大多数t细胞为α/βt细胞,γ/δt细胞仅占外周血的0.5%-5%,主要存在于上皮和粘膜组织,比如皮肤、肠道等。
6.tcr受体α/β或γ/δ能与含有γ/ε、δ/ε和ζ/ζ六个亚基的共受体cd3组成tcr-cd3受体复合物,其中α/β或γ/δ主要功能是识别结合抗原,cd3分子的主要功能是参与tcr/cd3复合体的装配和稳定以及信号转导。
7.美国t细胞受体治疗公司的专利201680032042将抗原结合结构域与tcrα/β链融合,构建的重组tcr受体在肿瘤抗原刺激的条件下可以激活t细胞,启动肿瘤杀伤作用。但是
如上文所述,人体内95%左右的t细胞都存在α链和β链。这种重组tcr受体容易与t细胞内存在的α链和β链发生错配,从而导致脱靶效应,增加t细胞免疫治疗的风险。国内外大量研究结果表明,即使通过基因转导技术,使γ/δt细胞表达tcrα或者β链,γ链依然只能与δ链发生配对(michael t bethune,marvin h gee mario bunse,etc.domain-swapped t cell receptors improve the safety of tcr gene therapy[j].elife,2016;jonathan fisher,imagejohn anderson.engineering approaches in human gamma delta t cells for cancer immunotherapy[j].front.immunol,2018)。由于体内t细胞绝大多数都表达tcrα链和β链,基于α链和β链构建的人工tcr受体容易与原有的α链和β链发生错配,增加细胞过继性免疫细胞治疗风险。
技术实现要素:
[0008]
本发明的目的在于提供一种t细胞受体融合蛋白及应用,以解决现有技术中t细胞受体融合蛋白与t细胞内源表达的cd3亚基亲和力低导致的不利于增强t细胞相关信号转导的技术问题。
[0009]
本发明的技术方案如下:提供一种t细胞受体融合蛋白,包括:
[0010]
第一链,包括信号肽、第一抗体结构域以及γ链恒定区;
[0011]
第二链,包括信号肽、第二抗体结构域以及δ链恒定区。
[0012]
可选地,所述第一抗体结构域和所述第二抗体结构域与靶抗原的同一抗原表位特异性结合;或,所述第一抗体结构域和所述第二抗体结构域分别与靶抗原的不同抗原表位特异性结合;或,所述第一抗体结构域和所述第二抗体结构域分别与不同靶抗原的抗原表位特异性结合。
[0013]
可选地,所述靶抗原选自cd19,cd20,cd22,egfr,her2,psca,cd123,cea,fap,cd133,egfrviii,bcma,gpcr5d,psma,ca125,epha2,c-met,l1cam,vegfr,cs1,ror1,ec,ny-eso-1,muc1,muc16,mesothelin,lewisy,gpc3,gd2,epg,dll3,cd99,5t4,cd22,cd30,cd33,cd38,cd70,cd138,cd171,mage3,mage4,afp或gd2。
[0014]
可选地,所述γ链恒定区的氨基酸序列如seq id no.1或seq id no.2所示,所述δ链恒定区的氨基酸序列如seq id no.3所示;
[0015]
所述第一抗体结构域包括第一抗体轻链可变区、第一抗体重链可变区以及连接所述第一抗体轻链可变区和所述第一抗体重链可变区的连接序列;
[0016]
所述第二抗体结构域包括第二抗体轻链可变区、第二抗体重链可变区以及连接所述第二抗体轻链可变区和所述第二抗体重链可变区的连接序列。
[0017]
可选地,所述第一抗体和所述第二抗体相同;
[0018]
所述第一链的氨基酸序列如seq id no.12所示,所述第二链的氨基酸序列如seq id no.13所示;或,所述第一链的氨基酸序列如seq id no.16所示,所述第二链的氨基酸序列如seq id no.17所示。
[0019]
可选地,所述第一抗体和所述第二抗体不同;所述第一链的氨基酸序列如seq id no.12所示,所述第二链的氨基酸序列如seq id no.17所示。
[0020]
可选地,所述γ链恒定区的氨基酸序列如seq id no.8所示,所述δ链恒定区的氨基酸序列如seq id no.9所示。
[0021]
本发明的另一技术方案如下:提供一种生物材料,所述生物材料为a1)至a9)中的任一种:
[0022]
a1)编码所述第一链的核酸分子;
[0023]
a2)编码所述第二链的核酸分子;
[0024]
a3)编码上述的t细胞受体融合蛋白的核酸分子;
[0025]
a4)含有a1)所述核酸分子的重组载体;
[0026]
a5)含有a2)所述核酸分子的重组载体;
[0027]
a6)含有a3)所述核酸分子的重组载体;
[0028]
a7)含有a4)所述重组载体的转基因动物细胞系;
[0029]
a8)含有a5)所述重组载体的转基因动物细胞系;
[0030]
a9)含有a6)所述重组载体的转基因动物细胞系。
[0031]
本发明的另一技术方案如下:提供一种生物制剂,所述生物制剂为b1)至b4)中的任一种:
[0032]
b1)包括表达上述的t细胞受体融合蛋白的细胞群;
[0033]
b2)包含b1)所述细胞群的药物组合物;
[0034]
b3)表达上述的t细胞受体融合蛋白的t细胞;
[0035]
b4)包含编码上述的t细胞受体融合蛋白的核酸分子的检测试剂。
[0036]
本发明的另一技术方案如下:提供上述的t细胞受体融合蛋白在制备肿瘤抑制剂或肿瘤细胞抑制剂或抗感染药物中的应用。
[0037]
本发明的有益效果在于:本发明的t细胞受体融合蛋白,包括第一链和第二链,第一链包括信号肽、第一抗体结构域以及γ链恒定区,第二链包括信号肽、第二抗体结构域以及δ链恒定区;通过上述方式,该t细胞受体融合蛋白与t细胞内源表达的cd3亚基(ε,δ,γ,ζ)具有更高的亲和力,当该t细胞受体融合蛋白与t细胞内源表达的cd3亚基形成复合体且被靶抗原激活时,有利于增强t细胞相关信号转导。
【附图说明】
[0038]
图1为本发明t细胞受体融合蛋白的结构示意图;
[0039]
图2为本发明t细胞受体融合蛋白的序列结构示意图;
[0040]
图3为本发明实施例1的t细胞受体融合蛋白在t细胞中的表达流式图;
[0041]
图4为本发明实施例1的t细胞受体融合蛋白对肿瘤细胞的体外杀伤效果图;
[0042]
图5为本发明实施例1的t细胞受体融合蛋白介导t细胞激活能力表征图;
[0043]
图6为本发明实施例2的t细胞受体融合蛋白在t细胞中的表达流式图;
[0044]
图7为本发明实施例2的t细胞受体融合蛋白对肿瘤细胞的体外杀伤效果图;
[0045]
图8为本发明实施例2的t细胞受体融合蛋白介导t细胞激活能力表征图;
[0046]
图9为本发明实施例3的t细胞受体融合蛋白在t细胞中的表达流式图;
[0047]
图10为本发明实施例3的t细胞受体融合蛋白对肿瘤细胞的体外杀伤效果图。
【具体实施方式】
[0048]
下面将结合本发明实施例中的附图,对发明实施例中的技术方案进行清楚、完整
地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0049]
在本文中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本发明的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本文所描述的实施例可以与其它实施例相结合。
[0050]
下述实施例中的实验方法,如无特殊说明,均为常规方法。
[0051]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0052]
请参阅图1和图2所示,本发明的t细胞受体融合蛋白包括第一链和第二链,其中,第一链包括信号肽、第一抗体结构域以及γ链恒定区,第二链包括信号肽、第二抗体结构域以及δ链恒定区。
[0053]
在一个可选的实施方式中,第一链由信号肽、第一抗体结构域以及γ链恒定区融合形成;第二链由信号肽、第二抗体结构域以及δ链恒定区融合形成。
[0054]
其中,所述第一抗体结构域和所述第二抗体结构域与靶抗原的同一抗原表位特异性结合;或,所述第一抗体结构域和所述第二抗体结构域分别与靶抗原的不同抗原表位特异性结合;或,所述第一抗体结构域和所述第二抗体结构域分别与不同靶抗原的抗原表位特异性结合。例如,所述靶抗原选自cd19,cd20,cd22,egfr,her2,psca,cd123,cea,fap,cd133,egfrviii,bcma,gpcr5d,psma,ca125,epha2,c-met,l1cam,vegfr,cs1,ror1,ec,ny-eso-1,muc1,muc16,mesothelin,lewisy,gpc3,gd2,epg,dll3,cd99,5t4,cd22,cd30,cd33,cd38,cd70,cd138,cd171,mage3,mage4,afp或gd2。
[0055]
其中,γ链恒定区和δ链恒定区可以来源于人或鼠,例如为人源性γ链恒定区以及人源性δ链恒定区的突变体,或,为鼠源性γ链恒定区以及人源性δ链恒定区的突变体。
[0056]
在一些可选的实施方式中,所述γ链恒定区的氨基酸序列如seq id no.1或seq id no.2所示,所述δ链恒定区的氨基酸序列如seq id no.3所示;
[0057]
所述第一抗体结构域包括第一抗体轻链可变区、第一抗体重链可变区以及连接所述第一抗体轻链可变区和所述第一抗体重链可变区的连接序列;
[0058]
所述第二抗体结构域包括第二抗体轻链可变区、第二抗体重链可变区以及连接所述第二抗体轻链可变区和所述第二抗体重链可变区的连接序列。
[0059]
其中,请继续参阅图1和图2所示,第一链和第二链通过p2a序列连接,当t细胞受体融合蛋白在t细胞中表达时,翻译形成含有p2a序列的t细胞受体融合蛋白,随后,该t细胞受体融合蛋白被p2a对应的蛋白酶切割形成两个独立的蛋白亚基(第一链和第二链),两个独立的蛋白亚基在t细胞内自发相互配对,形成靶向抗原的新型重组tcr受体。
[0060]
进一步地,所述第一抗体和所述第二抗体相同;所述第一链的氨基酸序列如seq id no.12所示,所述第二链的氨基酸序列如seq id no.13所示;或,所述第一链的氨基酸序列如seq id no.16所示,所述第二链的氨基酸序列如seq id no.17所示。
[0061]
进一步地,所述第一抗体和所述第二抗体不同;所述第一链的氨基酸序列如seq id no.12所示,所述第二链的氨基酸序列如seq id no.17所示。
[0062]
在一些可选的实施方式中,所述γ链恒定区的氨基酸序列如seq id no.8所示,所
述δ链恒定区的氨基酸序列如seq id no.9所示。
[0063]
本发明还提供生物材料,为a1)至a9)中的任一种:
[0064]
a1)编码所述第一链的核酸分子;
[0065]
a2)编码所述第二链的核酸分子;
[0066]
a3)编码上述的t细胞受体融合蛋白的核酸分子;
[0067]
a4)含有a1)所述核酸分子的重组载体;
[0068]
a5)含有a2)所述核酸分子的重组载体;
[0069]
a6)含有a3)所述核酸分子的重组载体;
[0070]
a7)含有a4)所述重组载体的转基因动物细胞系;
[0071]
a8)含有a5)所述重组载体的转基因动物细胞系;
[0072]
a9)含有a6)所述重组载体的转基因动物细胞系。
[0073]
其中,所述载体是质粒以及微环dna。进一步地,所述载体选自逆转录病毒载体、慢病毒载体、腺病毒载体和腺相关病毒载体。
[0074]
其中,所述细胞为t细胞,所述t细胞选自:细胞毒性t细胞、辅助t细胞或自然杀伤t细胞。
[0075]
本发明还提供生物制剂,为b1)至b4)中的任一种:
[0076]
b1)包括表达上述的t细胞受体融合蛋白的细胞群;
[0077]
b2)包含b1)所述细胞群的药物组合物;
[0078]
b3)表达上述的t细胞受体融合蛋白的t细胞;
[0079]
b4)包含编码上述的t细胞受体融合蛋白的核酸分子的检测试剂。
[0080]
本发明的t细胞受体融合蛋白还可以应用于制备肿瘤抑制剂或肿瘤细胞抑制剂或抗感染药物。
[0081]
其中,所述肿瘤为白血病、淋巴瘤、多发性骨髓瘤、肺癌、乳腺癌、肾上腺皮质癌、膀胱癌、子宫颈癌、胆管癌、结肠直肠癌、食道癌、神经胶母细胞瘤、神经胶质瘤、肝细胞癌、头颈癌、肾癌、黑素瘤、间皮瘤、胰脏癌、嗜铬细胞瘤、浆细胞瘤、神经母细胞瘤、卵巢癌、前列腺癌、肉瘤、胃癌、子宫癌及甲状腺癌等。
[0082]
实施例1
[0083]
t细胞受体融合蛋白的结构
[0084]
本实施例提供了一种t细胞受体融合蛋白,包括:
[0085]
第一链,由信号肽、第一抗体结构域以及γ链恒定区融合形成;
[0086]
第二链,由信号肽、第二抗体结构域以及δ链恒定区融合形成;
[0087]
其中,所述γ链恒定区的氨基酸序列如seq id no.1所示,所述δ链恒定区的氨基酸序列如seq id no.3所示;
[0088]
第一抗体和第二抗体相同,第一抗体结构域和第二抗体结构域均为特异性结合cd19抗原的结构域,于是,所述第一抗体结构域和所述第二抗体结构域均包括依次连接的fcm63轻链可变区(fcm63 vl,氨基酸序列如seq id no.5所示)、连接序列、fcm63重链可变区(fcm63 vh,氨基酸序列如seq id no.4所示);本实施例中,第一抗体结构域(fcm63 scfv)和第二抗体结构域(fcm63 scfv)的氨基酸序列如seq id no.10所示。
[0089]
其中,第一链和第二链中的信号肽均为cd8a信号肽(氨基酸序列如seq id no.11
所示),所述第一链(cd19-gdbrr-γ)的氨基酸序列如seq id no.12所示,所述第二链(cd19-gdbrr-δ)的氨基酸序列如seq id no.13所示,第一链(cd19-gdbrr-γ)和第二链(cd19-gdbrr-δ)通过p2a序列连接,本实施例的t细胞受体融合蛋白(cd19-gdbrr)的氨基酸序列如seq id no.14所示。
[0090]
本实施例的t细胞受体融合蛋白在t细胞中表达时,翻译形成氨基酸序列如seq id no.14所示的t细胞受体融合蛋白,随后,该t细胞受体融合蛋白被p2a对应的蛋白酶切割形成两个独立的蛋白亚基(第一链和第二链),两个独立的蛋白亚基在t细胞内自发相互配对,形成靶向cd19的新型重组tcr受体(cd19-gdbrr)。
[0091]
靶向cd19的新型重组tcr受体(cd19-gdbrr)的载体构建
[0092]
合成编码t细胞受体融合蛋白(cd19-gdbrr)的第一dna序列,该第一dna序列即为编码如seq id no.14所示氨基酸序列的核苷酸序列。
[0093]
将第一dna序列通过限制性内切酶切位点noti和clai插入进慢病毒表达载体phage-fullef1a-mcs-izsgreen中。
[0094]
cd19-gdbrr质粒提取及病毒包装
[0095]
将测序结果正确的菌接种在lb液体培养基中,过夜培养。使用具有去内毒素功能的试剂盒提取质粒。质粒浓度用nanodrop测量,质粒终浓度在1000ng/ul左右,a260/a280值大于1.8。将携带目标基因的phage载体与包装质粒pmd2g与pspax2按照2:1:1的比例通过pei试剂转染进293t细胞。48小时后收集细胞培养基上清,经过0.45um滤膜过滤后,超离离心机25000rpm离心2小时可得病毒沉淀。用小体积的培养基重悬,起到病毒浓缩的效果。
[0096]
人类原代t细胞的分离、培养和慢病毒感染
[0097]
人外周血pbmc细胞中,按照cd3/cd28磁珠:pbmc细胞3:1的比例添加,纯化并激活t细胞。48小时后可观察到t细胞体积变大、聚团生长以及形状发生极化等现象。此时,用慢病毒病载体按照moi=10将目标基因转入t细胞,感染时添加7ug/ml的聚凝胺(polybrene),32℃下1500rpm离心感染2小时。病毒感染后,在含20%血清和200iu il-2的rpmi1640培养基中培养至足够数量。
[0098]
cd19-gdbrr重组受体在t细胞的表达
[0099]
取得人外周血细胞,使用t细胞分离试剂盒将其中cd4 和cd8 t细胞纯化出来。然后将t细胞用抗cd3/cd28的抗体刺激激活48小时后,用慢病毒载体将基因转入t细胞,构建cd19-gdbrr-t细胞。扩增7天后取部分cd19-gdbrr-t细胞与fitc荧光标记的cd19蛋白(acro,cd9-hf2h2)共孵育,洗涤后经过流式细胞仪检测。结果如图3所示,结果显示,39.92%的t细胞成功表达cd19-gdbrr重组受体。
[0100]
cd19-gdbrr-t细胞对cd19阳性raji细胞株体外杀伤作用
[0101]
cd19-gdbrr-t细胞和raji细胞准备好后,严格参考cytoxtox96@说明书操作实验,根据实验反应的原理,设置cd19-gdbrr-t自发ldh释放组,raji细胞自发ldh释放组,raji最大ldh释放组,体积对照组和培养基组,具体如下;
[0102]
1.cd19-gdbrr-t细胞自发ldh释放组:将cd19-gdbrr-t细胞稀释成不同浓度,向96孔板中按照效靶比加入对应体积的细胞,用培养基定容到100ul,每组3个复孔。
[0103]
2.raji细胞ldh自发释放组:将2*104/孔的raji细胞添加到3个复孔中,加的时候轻轻操作,加完后轻轻吹打,避免产生气泡,之后用培养基调整至100ul/孔。
[0104]
3.raji细胞ldh最大释放组:将2*104/孔的raji细胞加入到3个复孔中,加的时候轻轻操作,终体积100ul,每100ul培养基加10ul的lysis solution(10x)。
[0105]
4.体积对照组:将10ul lysis solution加入到含有100ul培养基(不含细胞)的3个复孔中。
[0106]
5.培养基组:每孔100ul培养基,每组3个复孔。
[0107]
6.实验组:各实验孔中每孔加入2*104/孔的raji细胞。加3组不同浓度的cd19-gdbrr-t细胞,每组3个复孔,终体积100ul。
[0108]
7.加完后加完后,水平轻轻摇晃细胞板,将细胞板用封口膜封口,之后250g离心4分钟,以确保效应细胞与靶细胞充分接触。
[0109]
8.结束后将96孔板放入原处孵育4小时后吸取上清。再孵育3小时15分,向raji细胞最大ldh释放组最大释放孔加入10μl的lysis solution(10x)。
[0110]
9.孵育4小时后,取出细胞板,再次250g离心4分钟;离心的过程中准备一个新的96孔板,依照原先96孔板的标记方式在对应区域做好标记,结束将50ul上层液体吸入到另外完全对应位置的孔板中。
[0111]
10.assay buffer使用前需要融解,一般放在37度水浴中进行,之后取出对应体积,其他的放回原处。待取出的assay buffer降至室温时,将其放到一瓶substrate mix中,轻接颠倒摇晃使底物溶解,溶解后立即使用。
[0112]
11.将底物加到新的细胞板中每孔50ul让它们反应半小时。
[0113]
12.反应后,每孔加入50ul stop solution,用酶标仪测量波长为492nm处的吸光度值。
[0114]
13.按下述公式计算细胞杀伤效果:
[0115]
将所有实验化
[0116]
a.raji细胞ldh自发释放组和cd19-gdbrr-t细胞ldh自发释放组的吸光值减去培养基背景吸光值的平均值。
[0117]
b.将raji细胞ldh最大释放组的吸光值减去体积校正对照组吸光值的平均值。
[0118]
c.将步骤a和b中获得的经过校正的值带入下面公式,计算每个效靶比所产生的细胞毒性百分比。
[0119]
公式为:%细胞毒性=(实验组-cd19-gdbrr-t细胞ldh自发释放组-raji细胞ldh自发释放组)/(raji细胞ldh最大释放组-raji ldh自发释放组)x100%。
[0120]
试验结果如图4所示:cd19-gdbrr-t细胞对cd19阳性raji细胞株具有显著的细胞杀伤作用。
[0121]
cd19-gdbrr-t细胞与cd19阳性raji细胞株共孵育细胞因子释放
[0122]
接种1.5x105个raji细胞至24孔板中,离心收集cd19-gdbrr-t细胞,将cd19-gdbrr-t细胞与raji细胞按照1:1至5:1的数量比例进行共培养。共培养16小时后,通过elisa方法检测培养基上清中ifn-γ以及il-2释放量。
[0123]
试验结果如图5所示:raji靶细胞对cd19-gdbrr-t细胞有明显的激活作用。
[0124]
实施例2
[0125]
t细胞受体融合蛋白的结构
[0126]
本实施例提供了一种t细胞受体融合蛋白,包括:
[0127]
第一链,由信号肽、第一抗体结构域以及γ链恒定区融合形成;
[0128]
第二链,由信号肽、第二抗体结构域以及δ链恒定区融合形成;
[0129]
其中,所述γ链恒定区的氨基酸序列如seq id no.1所示,所述δ链恒定区的氨基酸序列如seq id no.3所示;
[0130]
第一抗体和第二抗体相同,第一抗体结构域和第二抗体结构域均为特异性结合cd22抗原的结构域,于是,所述第一抗体结构域和所述第二抗体结构域均包括依次连接的m971轻链可变区(m971 vl,氨基酸序列如seq id no.7所示)、连接序列、m971重链可变区(m971 vh,氨基酸序列如seq id no.6所示);本实施例中,第一抗体结构域(m971 scfv)和第二抗体结构域(m971 scfv)的氨基酸序列如seq id no.15所示。
[0131]
其中,第一链和第二链中的信号肽均为cd8a信号肽(氨基酸序列如seq id no.11所示),所述第一链(cd22-gdbrr-γ)的氨基酸序列如seq id no.16所示,所述第二链(cd22-gdbrr-δ)的氨基酸序列如seq id no.17所示,第一链(cd22-gdbrr-γ)和第二链(cd22-gdbrr-δ)通过p2a序列连接,本实施例的t细胞受体融合蛋白(cd22-gdbrr)的氨基酸序列如seq id no.18所示。
[0132]
本实施例的t细胞受体融合蛋白在t细胞中表达时,翻译形成氨基酸序列如seq id no.18所示的t细胞受体融合蛋白,随后,该t细胞受体融合蛋白被p2a对应的蛋白酶切割形成两个独立的蛋白亚基(第一链和第二链),两个独立的蛋白亚基在t细胞内自发相互配对,形成靶向cd22的新型重组tcr受体(cd22-gdbrr)。
[0133]
靶向cd22的新型重组tcr受体(cd22-gdbrr)的载体构建
[0134]
合成编码t细胞受体融合蛋白(cd22-gdbrr)的第二dna序列,该第二dna序列即为编码如seq id no.18所示氨基酸序列的核苷酸序列。
[0135]
将第二dna序列通过限制性内切酶切位点noti和clai插入进慢病毒表达载体phage-fullef1a-mcs-izsgreen中。
[0136]
cd22-gdbrr质粒提取及病毒包装
[0137]
将测序结果正确的菌接种在lb液体培养基中,过夜培养。使用具有去内毒素功能的试剂盒提取质粒。质粒浓度用nanodrop测量,质粒终浓度在1000ng/ul左右,a260/a280值大于1.8。将携带目标基因的phage载体与包装质粒pmd2g与pspax2按照2:1:1的比例通过pei试剂转染进293t细胞。48小时后收集细胞培养基上清,经过0.45um滤膜过滤后,超离离心机25000rpm离心2小时可得病毒沉淀。用小体积的培养基重悬,起到病毒浓缩的效果。
[0138]
人类原代t细胞的分离以及cd22-gdbrr-t细胞制备
[0139]
人外周血pbmc细胞中,按照cd3/cd28磁珠:pbmc细胞3:1的比例添加,纯化并激活t细胞。48小时后可观察到t细胞体积变大、聚团生长以及形状发生极化等现象。此时,用慢病毒病载体按照moi=10将目标基因转入t细胞,感染时添加7ug/ml的聚凝胺(polybrene),32℃下1500rpm离心感染2小时。病毒感染后,在含20%血清和200iu il-2的rpmi1640培养基中培养至足够数量。
[0140]
cd22-gdbrr重组受体在t细胞的表达
[0141]
取得人外周血细胞,使用t细胞分离试剂盒将其中cd4 和cd8 t细胞纯化出来。然后将t细胞用抗cd3/cd28的抗体刺激激活48小时后,用慢病毒载体将基因转入t细胞,构建cd22-gdbrr-t细胞。扩增7天后取部分cd22-gdbrr-t细胞与fitc荧光标记的cd22蛋白
(acro,si2-hf2h6)共孵育,洗涤后经过流式细胞仪检测。结果如图6所示,结果显示,63.51%的t细胞成功表达cd22-gdbrr重组受体。
[0142]
cd22-gdbrr-t细胞对肿瘤细胞的体外杀伤作用
[0143]
cd22-gdbrr-t细胞和raji细胞准备好后,严格参考cytoxtox96@说明书以及实施例1中cd19-gdbrr-t对raji细胞株杀伤操作实验。
[0144]
试验结果如图7所示:cd22-gdbrr-t细胞对cd22阳性raji细胞株具有显著的细胞杀伤作用。
[0145]
cd22-gdbrr-t细胞与cd22阳性raji细胞株共孵育细胞因子释放
[0146]
接种1.5x105个raji细胞至24孔板中,离心收集cd19-gdbrr-t细胞,将cd19-gdbrr-t细胞与raji细胞按照1:1至5:1的数量比例进行共培养。共培养16小时后,通过elisa方法检测培养基上清中ifn-γ以及il-2释放量。
[0147]
试验结果如图8所示:raji靶细胞对cd22-gdbrr-t细胞有明显的激活作用。
[0148]
实施例3
[0149]
t细胞受体融合蛋白的结构
[0150]
本实施例提供了一种t细胞受体融合蛋白,包括:
[0151]
第一链,由信号肽、第一抗体结构域以及γ链恒定区融合形成;
[0152]
第二链,由信号肽、第二抗体结构域以及δ链恒定区融合形成;
[0153]
其中,所述γ链恒定区的氨基酸序列如seq id no.1所示,所述δ链恒定区的氨基酸序列如seq id no.3所示;
[0154]
第一抗体和第二抗体不同,第一抗体结构域为特异性结合cd19抗原的结构域,于是,所述第一抗体结构域包括依次连接的fcm63轻链可变区(fcm63 vl,氨基酸序列如seq id no.5所示)、连接序列、fcm63重链可变区(fcm63 vh,氨基酸序列如seq id no.4所示);本实施例中,第一抗体结构域(fcm63 scfv)的氨基酸序列如seq id no.10所示。第二抗体结构域为特异性结合cd22抗原的结构域,于是,所述第二抗体结构域包括依次连接的m971轻链可变区(m971 vl,氨基酸序列如seq id no.7所示)、连接序列、m971重链可变区(m971 vh,氨基酸序列如seq id no.6所示);本实施例中,第二抗体结构域(m971 scfv)的氨基酸序列如seq id no.15所示。
[0155]
其中,第一链和第二链中的信号肽均为cd8a信号肽(氨基酸序列如seq id no.11所示),所述第一链(cd19-gdbrr-γ)的氨基酸序列如seq id no.12所示,所述第二链(cd22-gdbrr-δ)的氨基酸序列如seq id no.17所示,第一链(cd19-gdbrr-γ)和第二链(cd22-gdbrr-δ)通过p2a序列连接,本实施例的t细胞受体融合蛋白(cd19-cd22-gdbrr)的氨基酸序列如seq id no.19所示。
[0156]
本实施例的t细胞受体融合蛋白在t细胞中表达时,翻译形成氨基酸序列如seq id no.19所示的t细胞受体融合蛋白,随后,该t细胞受体融合蛋白被p2a对应的蛋白酶切割形成两个独立的蛋白亚基(第一链和第二链),两个独立的蛋白亚基在t细胞内自发相互配对,形成靶向cd19和cd22的新型重组tcr受体(cd19-cd22-gdbrr)。
[0157]
靶向cd19和cd22的新型重组tcr受体(cd19-cd22-gdbrr)的载体构建
[0158]
合成编码t细胞受体融合蛋白(cd19-cd22-gdbrr)的第三dna序列,该第三dna序列即为编码如seq id no.19所示氨基酸序列的核苷酸序列。
[0159]
将第三dna序列通过限制性内切酶切位点noti和clai插入进慢病毒表达载体phage-fullef1a-mcs-izsgreen中。
[0160]
cd19-293t和cd22-293t细胞系构建
[0161]
将编码人cd19和cd22蛋白质的基因序列分别通过ecor1和xbai酶切位点克隆到plvx-puro慢病毒载体。病毒包装完成后,293t稳定感染后采用终浓度为0.4ug/ml的puromycin筛选稳定表达cd19或cd22的细胞系,分别记为cd19-293t和cd22-293t。
[0162]
cd19-cd22-gdbrr质粒提取及病毒包装
[0163]
将测序结果正确的菌接种在lb液体培养基中,过夜培养。使用具有去内毒素功能的试剂盒提取质粒。质粒浓度用nanodrop测量,质粒终浓度在1000ng/ul左右,a260/a280值大于1.8。将携带目标基因的phage载体与包装质粒pmd2g与pspax2按照2:1:1的比例通过pei试剂转染进293t细胞。48小时后收集细胞培养基上清,经过0.45um滤膜过滤后,超离离心机25000rpm离心2小时可得病毒沉淀。用小体积的培养基重悬,起到病毒浓缩的效果。
[0164]
人类原代t细胞的分离以及cd19-cd22-gdbrr-t细胞制备
[0165]
人外周血pbmc细胞中,按照cd3/cd28磁珠:pbmc细胞3:1的比例添加,纯化并激活t细胞。48小时后可观察到t细胞体积变大、聚团生长以及形状发生极化等现象。此时,用慢病毒病载体按照moi=10将目标基因转入t细胞,感染时添加7ug/ml的聚凝胺(polybrene),32℃下1500rpm离心感染2小时。病毒感染后,在含20%血清和200iu il-2的rpmi1640培养基中培养至足够数量。
[0166]
cd-19-cd22-gdbrr重组受体在t细胞的表达
[0167]
取得人外周血细胞,使用t细胞分离试剂盒将其中cd4 和cd8 t细胞纯化出来。然后将t细胞用抗cd3/cd28的抗体刺激激活48小时后,用慢病毒载体将基因转入t细胞,构建cd22-gdbrr-t细胞。扩增7天后取部分cd22-gdbrr-t细胞与fitc荧光标记的cd22蛋白(acro,si2-hf2h6)共孵育,洗涤后经过流式细胞仪检测。结果如图9所示,结果显示,大约30.06%的t细胞成功表达cd19-cd22-gdbrr重组受体。
[0168]
cd19-cd22-gdbrr-t细胞对cd19-293t和cd22-293t细胞的体外杀伤作用
[0169]
293t细胞、cd19-293t细胞和cd22-293t细胞分别稀释成1
×
105cells/ml后,取100ul,添加到96孔板中,按照1:1、1:5、1:10和1:20的效靶比加入对应数量的cd19-cd22 gdbr-t细胞,反应总体积为200ul。通过乳酸脱氢酶法检测细胞杀伤效率,具体操作方法同上。
[0170]
试验结果如图10所示:cd19-cd22-gdbrr-t细胞对293t细胞无明显杀伤作用,对cd19-293t细胞和cd22-293t细胞均具有显著杀伤作用。
[0171]
以上所述的仅是本发明的实施方式,在此应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出改进,但这些均属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。