1.本发明属于酶活力测定技术领域,具体涉及的是一种蛋白酶活力的测定方法。
背景技术:
2.蛋白酶是水解蛋白质肽链的一类酶的总称。近年来,因其在食品、医药、医疗诊断、饲料和环境等领域具有较大的应用价值而倍受关注。按蛋白酶水解多肽的方式,可以将其分为内肽酶和外肽酶两类。酶活力是衡量酶活性的重要指标,一般采用测定酶促反应初速度的方法来测定酶活力,所测的酶活力为上述两类酶的总酶活力。以色氨酸为酶活力单位计量的标准物质为例,蛋白酶的活力单位可被定义为在一定酶解条件下,每毫升反应液中,每分钟产生1μmol相当于色氨酸的量为一个酶活力单位。
3.现阶段对酶活力的测定方法有:电泳法、偶氮酪蛋白法、荧光光度法、紫外法和lowrry法等,但是这些方法测定蛋白酶活力均存在缺陷,如电泳法只能通过条带定性分析出蛋白酶对蛋白底物的破坏情况,但较难量化酶活力;偶氮酪蛋白法所用底物为合成底物而非天然底物,且价格昂贵,不仅如此,其酶活力定义也只能采用增加0.01个吸光度值来表示1个蛋白酶活力单位,很难做到广泛的普及应用;荧光法的测定灵敏度较高,但所用底物是合成底物,存在的问题与偶氮酪蛋白法类似;紫外法《gb/t 33410-2016生化试剂中蛋白酶k活性检测方法》利用酶解产生的酪氨酸在275nm附近有紫外吸收,直接通过275nm处的吸光度值的变化进行酶活力测定,该方法虽操作简单,但酶浓度曲线偏离原点。现有技术lowrry法以酪蛋白作为天然底物,具有相对较高的灵敏度,则可部分解决上述问题,然而,在《gb/t 28715-2012饲料添加剂酸性、中性蛋白酶的活力测定分光光度法》中也存在偏离原点等问题,会因酶的稀释倍数不同而影响酶活力的准确测定。
技术实现要素:
4.针对现有技术蛋白酶活力测定方法存在的酶浓度曲线偏离原点的问题,本发明提供一种蛋白酶活力的测定方法
‑‑
mbth法,通过改进酶解反应终止剂三氯乙酸的浓度,改进mbth试剂、检测波长、采用牛血清白蛋白或色氨酸绘制标准曲线以计算酶活力,该方法灵敏度、准确度均较高。
5.本发明的目的是通过以下技术方案来实现的:
6.一种蛋白酶活力的测定方法,包括以下步骤:
7.(1)配制酪蛋白上清液和蛋白酶溶液:
8.a.用碱性溶液将酪蛋白溶解,调ph值至待测ph值,再用待测ph值的缓冲液定容,得到酪蛋白溶液ⅰ,此酪蛋白溶液ⅰ适用于测定碱性蛋白酶和中性蛋白酶活力;利用该配制方法所得到的酪蛋白溶液ⅰ澄清透明,远优于现有技术。
9.用碱性溶液将酪蛋白溶解,再将溶解的酪蛋白溶液逐滴加入到缓冲液的共轭酸溶液中并剧烈搅拌,调ph值至待测ph值,再用待测ph值的缓冲液定容,得到酪蛋白溶液ⅰ,此酪蛋白溶液ⅰ适用于测定酸性蛋白酶活力;利用该配制方法所得到的酪蛋白溶液ⅰ澄清透明,
中,而是加入到三氯乙酸溶液中,充分混匀后迅速向其加入酪蛋白溶液ⅰ(此顺序不可颠倒),离心或过滤,得到酶解空白溶液的上清液,其具体方法为,将步骤a中的酪蛋白溶液ⅰ温育与步骤(3)相同的温度相同的时间,从中取出作为底物空白,按照酶空白(与步骤(3)酶解反应相同的酶溶液,与底物空白相同的预热和温育条件)、底物空白的添加顺序逐一迅速加入到装有三氯乙酸溶液的离心管中,其加量比例与步骤(3)的相同,迅速混匀,离心或过滤,得到酪蛋白酶解空白溶液的上清液。
25.(5)测定酶解液和酶解空白溶液:根据步骤
②
的方法分别测定酶解液和酶解空白溶液的上清液,从而根据步骤(2)的标准曲线计算得到单位时间内酶解产生的低聚肽浓度,进而得到蛋白酶活力。
26.在本发明中,酪蛋白溶液ⅱ加入三氯乙酸后的体系中ccl3coo-浓度在0.035-0.05mol/l,h
浓度在0.03-0.15mol/l范围内,酶浓度曲线都能够较好的过原点,所述的步骤(1)-(4)中的三氯乙酸浓度都是相同的,作为优选,三氯乙酸浓度在0.037mol/l时吸光度值最大,方法灵敏度最高。
27.作为优选,所述的步骤(2)中,碱性试剂为naoh溶液或koh溶液。
28.作为优选,所述的步骤b中的离心方法为于9580-16200rcf离心,作为优选,所述的步骤b中的过滤的方法为用孔径≤0.45μm的滤芯过滤。在本发明提供的实施例1,2,3中,步骤(2)、(3)和(4)中的离心步骤的离心条件为11600rcf离心15min,实施例4,5中,步骤(2)、(3)和(4)中的离心步骤的离心条件为13800rcf离心15min,与现有技术过滤采用的中速定性滤膜相比,本发明方法所用滤膜孔径更小,能更彻底的将沉出的酪蛋白与溶液分离,但是采用滤芯过滤也存在耗时过长以及成本较高的问题。
29.作为优选,步骤(2)中,所述的酸性铁试剂的组成中,可溶性fe
3
盐为硫酸铁、硝酸铁、氯化铁、硫酸铁铵中的至少一种,强酸为氨基磺酸、盐酸或硫酸中的至少一种,更优选酸性铁试剂由硫酸铁铵和氨基磺酸溶液配制而成。
30.作为优选,所述的步骤(2),在加入mbth溶液后反应体系中,oh-浓度为0.1-0.2mol/l,mbth的初始浓度范围为0.95-3.6mmol/l。
31.在加入酸性铁试剂后反应体系中,h
浓度为0.1-0.2mol/l,fe
3
的初始浓度范围为3-5mmol/l。
32.在本发明提供的实施例中,体系中mbth溶液的浓度为2.1mmol/l,在对色氨酸标准曲线mbth溶液浓度筛选时从标准曲线的斜率、截距、线性来分析mbth溶液的最佳浓度为2.1mmol/l,标准曲线吸光度值随着mbth溶液浓度的增加是逐渐降低的。
33.作为优选,所述的步骤(2),标准物质溶液或碱性酶解液或碱性酶解空白溶液与mbth溶液的反应温度为75-85℃,反应时间为9-17min。在本发明提供的实施例中,标准物质或酶解产生的低聚肽与mbth的反应温度为80℃,反应时间为13min。当反应至13min时,反应液吸光度值达到最大且随着反应时间的延长吸光度值几乎不变。
34.作为优选,所述步骤(2),趁热加入酸性铁试剂,室温下冷却,显色稳定后测定吸光度值。
35.作为优选,所述步骤(2)中的显色时间为50-180min,更优选显色时间为50-120min,在该显色时间内测定在590-630nm范围内的吸光度值。
36.所述的步骤(3),蛋白酶的酶解反应,酶解时间优选1-60min,更优选3-40min,再优
选10-30min,只要酶解反应发生,就可以采用本发明的方法测定酶活力,较长的酶解时间,有利于大批量测定,但也不能太长,以避免酶解过程中酶活性降低;酶解温度不能太高以免发生底物的非酶降解。作为优选,在37℃进行酶解反应10-30min。
37.由于该法灵敏度较高,酶解过程为零级反应,因此单位时间内的酶解速度是相同的,因此可以用酶解时间段的产物的生成量来计算酶解速度从而获得酶活力。
38.本发明具有以下有益效果:
39.1.利用本发明配制酪蛋白溶液的方法,所得酪蛋白溶液澄清透明,解决了现有技术中酪蛋白无法完全溶解的问题。
40.2.本发明提供了一种mbth法测定蛋白酶活力的方法。
41.3.相较于现有技术测酶活力的方法,本发明的酶浓度曲线过原点,即酶浓度曲线的截距更接近于0,不会因酶溶液稀释倍数不同而影响酶活力测定的准确性。
42.4.在本发明的mbth法中,所用的体系中三氯乙酸浓度范围为0.035-0.05mol/l之间均可保证酶浓度曲线过原点,远优于现有技术紫外法和lowrry法。
43.5.本发明方法操作简便,成本低廉,方法准确可靠、重复性高。
附图说明
44.图1为本发明方法配制的酪蛋白溶液ⅰ及其与现有技术的对比图,现有技术为在《gb/t28715-2012饲料添加剂酸性、中性蛋白酶的活力测定分光光度法》。图中1、2、3、4号样品分别为采用不同方法得到的酪蛋白溶液ⅰ,酪蛋白浓度均为10mg/ml,总体积为100ml。1号样品:用30ml磷酸钠溶液(0.05mol/l)溶解后,逐滴加入到磷酸溶液(0.05mol/l)中并剧烈搅拌,再用ph 3.0的磷酸盐缓冲液(0.05mol/l)定容;2号样品为现有技术;3号样品:用10ml naoh溶液(0.5mol/l)溶解后,逐滴加入到乳酸溶液(0.1mol/l)中并剧烈搅拌,再用ph 3.0的乳酸盐缓冲液(0.1mol/l)定容;4号样品于3号的类似,只是将大量乳酸溶液加入到10毫升的酪蛋白溶液中,然后用乳酸盐缓冲液定容。现象:现有技术溶解的酪蛋白溶液ⅰ有明显的沉淀分层,说明酪蛋白并没有完全溶解;本发明方法1、3通过“逐滴加入”所得酪蛋白溶液ⅰ澄清透明;4号方法无沉淀,但是较为浑浊。
45.图2为现有技术lowrry法中na2co3法酶浓度曲线图。现象:酶浓度曲线偏离原点。会因酶溶液稀释倍数不同导致酶活力的不同。
46.图3为现有技术lowrry法中folina法酶浓度曲线图。现象:酶浓度曲线偏离原点。会因酶溶液稀释倍数不同导致酶活力的不同。
47.图4为现有技术紫外法酶浓度曲线图。现象:酶浓度曲线偏离原点。会因酶溶液稀释倍数不同导致酶活力的不同。
48.图5为本发明方法木瓜蛋白酶所测得的酶浓度曲线图,在酶解液中三氯乙酸浓度为0.037mol/l。在610nm条件下测得的吸光度值。现象:酶浓度曲线较好的过原点。
49.图6为本发明方法胃蛋白酶所测得的酶浓度曲线图,在酶解液中三氯乙酸浓度为0.04mol/l。在610nm条件下测得的吸光度值。现象:酶浓度曲线较好的过原点。
50.图7为本发明方法碱性蛋白酶所测得的酶浓度曲线图,在酶解液中三氯乙酸浓度为0.037mol/l。在610nm条件下测得的吸光度值。现象:酶浓度曲线较好的过原点。
51.图8为本发明方法-牛血清白蛋白(bsa)标准曲线图,在610nm条件下测得的吸光度
值。
52.图9为本发明方法色氨酸标准曲线图,在610nm条件下测得的吸光度值。
53.图10为色氨酸不加底物以及不同加底物方式对标准曲线绘制的影响图(a为不加底物色氨酸的标准曲线,b为本发明方法中以酪蛋白溶液加三氯乙酸后的上清液为溶剂溶解色氨酸的标准曲线,c为酪蛋白溶液和色氨酸溶液混合后加三氯乙酸取上清液的标准曲线),在610nm条件下测得的吸光度值。现象:色氨酸加底物与否对色氨酸的标准曲线影响很大,所以加底物的标准曲线是非常有必要的,加底物方式的不同同样对标准曲线的影响很大,对比三种标准曲线,发现不加底物色氨酸的标准曲线斜率最大,本发明方法中以酪蛋白溶液加三氯乙酸后的上清液为溶剂溶解色氨酸的标准曲线斜率次之,酪蛋白溶液和色氨酸溶液混合后加三氯乙酸取上清液的标准曲线斜率最低。对比两个不同的加底物方式,加底物对本发明方法的标准曲线影响小。
54.图11为本发明不同种类的可溶性fe
3
盐条件下色氨酸标准曲线图,在610nm条件下测得的吸光度值。现象:三种可溶性铁盐条件下的标准曲线斜率相差并不大。说明三种可溶性铁盐均可用应用于蛋白酶活力的测定。
55.图12为不同mbth浓度下的色氨酸标准曲线图,在610nm条件下测得的吸光度值。现象:mbth浓度在6.4mmol/l-12.8mmol/l的范围内,标准曲线的斜率是随着mbth浓度的增大而降低的。
56.图13为三氯乙酸浓度(酶解液中,0.037mol/l、0.040mol/l、0.043mol/l、0.046mol/l)对酶浓度曲线的影响图,均为610nm条件下测得的吸光度值。现象:三氯乙酸浓度在0.037-0.046mol/l的范围内,酶浓度曲线的斜率是随着三氯乙酸浓度的增大而降低的。
57.图14为本发明方法各种标准物质浓度为200μg/ml在610nm吸光度值图。现象:能够与mbth发生反应的有色氨酸、半胱氨酸、胱氨酸、牛血清白蛋白、谷氨酸,其所产生显色液的摩尔吸光系数依次降低。
58.图15为两种酶解空白设置吸光度值对照图(空白1为本发明方法按照酶空白、底物空白的添加顺序加入到三氯乙酸溶液中;空白2为对照方法按照底物空白、酶空白的添加顺序加入到三氯乙酸溶液中),在610nm条件下测得的吸光度值。现象:空白1的设置方式随酶浓度的增加吸光度值基本保持不变,空白2的设置方式随酶浓度的增加吸光度值也逐渐增大。两个空白设置方式对比,空白1的吸光度值基本不受酶浓度的影响,该空白对酶浓度曲线影响较小。
59.图16为不同tca浓度对底物沉淀的影响图(a底物浓度为10mg/ml,b底物浓度为5mg/ml,图中标的三氯乙酸浓度0.45%、0.5%、0.55%、0.6%、0.65%、0.7%、0.75%、0.8%、0.85%、0.9%、2.5%、3.27%(w/v)对应的三氯乙酸摩尔浓度为0.028mol/l、0.031mol/l、0.034mol/l、0.037mol/l、0.040mol/l、0.043mol/l、0.046mol/l、0.049mol/l、0.052mol/l、0.055mol/l、0.153mol/l、0.200mol/l)现象:三氯乙酸浓度越高,沉淀分层越明显,且三氯乙酸的浓度从0.037mol/l开始就已经出现分层。
具体实施方式
60.下面将结合本发明中的实施例,对本发明中的技术方案清楚、完整的描述。
61.以下实施例采用的主要仪器及试剂如下:
62.主要仪器:水浴恒温振荡器,shz-82型,常州智博瑞有限公司;fe2实验室ph计,梅特勒-托利多仪器有限公司;bio-rad 680酶标仪,伯乐生命医学产品(上海)有限公司;uv-2600紫外可见分光光度计,shimadzu(岛津);al204电子天平,梅特勒-托利多仪器有限公司;ct14rd离心机,上海天美生化仪器设备工程有限公司。
63.主要试剂:酪蛋白,阿拉丁,西格玛奥德里奇贸易有限公司;牛血清白蛋白标准品购自生工生物工程(上海)股份有限公司;木瓜蛋白酶,阿拉丁,武汉新华扬生物股份有限公司;中性蛋白酶,阿拉丁;碱性蛋白酶,武汉新华扬生物股份有限公司;色氨酸标准品、folin试剂、3-甲基-2-苯并噻唑啉酮腙盐酸盐一水合物(mbth)购自西格玛奥德里奇贸易有限公司;胃蛋白酶、三氯乙酸(tca)、氨基磺酸、硫酸铁铵试剂购自国药集团化学试剂有限公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
64.以色氨酸为例,酶活力按照如下公式计算:
[0065][0066]
式中:u-蛋白酶活力,μmol/(ml
·
min);
[0067]
a-酶解液的吸光度值;
[0068]a0-酶解空白溶液的吸光度值;
[0069]
b-色氨酸标准曲线的截距;
[0070]
k-色氨酸标准曲线的斜率,ml/μmol;
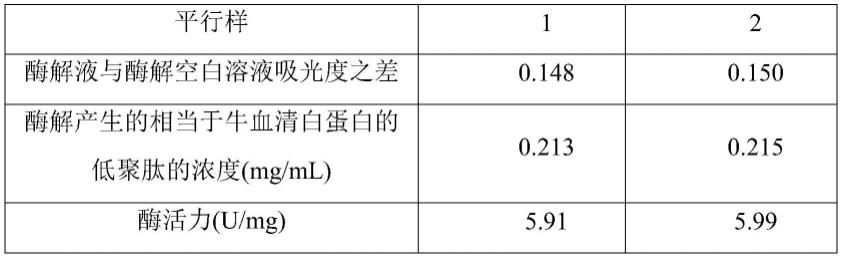
[0071]
t-酶解时间,min。
[0072]
实施例1:
[0073]
步骤(1),将精密称取的酪蛋白溶解于0.05mol/l的磷酸钠溶液中,再用0.05mol/l的磷酸溶液调ph至7.0,再用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0074]
步骤(2),将步骤(1)的酪蛋白溶液与步骤(1)的磷酸-磷酸钠缓冲液等体积混合,将该混合液与0.073mol/l的tca溶液按照体积比为1:1混匀,11000rpm离心15min,离心得到酪蛋白上清液;以上述的酪蛋白上清液为溶剂,分别配制浓度为0、50、100、150、200、250、300、350μg/ml的牛血清白蛋白标准溶液,每种浓度的牛血清白蛋白标准溶液中取500μl,加入500μl 0.5mol/l的naoh溶液,混匀,再加入500μl新鲜配制的1.5mg/ml(6.4mmol/l)mbth溶液,体系中oh-浓度为0.15mol/l,mbth的初始浓度为2.1mmol/l。于80℃水浴加热13min,然后,趁热加入1000μl硫酸铁铵试剂,室温静置50min,充分混匀,于波长610nm处测定牛血清白蛋白的吸光度值,每个浓度做三个平行样。根据每组牛血清白蛋白溶液浓度与测得的相应牛血清白蛋白吸光度值之间的关系绘制标准对应关系曲线。所述的硫酸铁铵试剂由fenh4(so4)2·
12h2o、氨基磺酸和盐酸组成,其浓度分别为5g/l(10.5mmol/l)、0.05mol/l和0.5mol/l,在加入酸性铁试剂后的反应体系中,h
浓度为0.13mol/l,fe
3
的初始浓度为4.2mmol/l。
[0075]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(1号木瓜蛋白酶,6μg/ml,用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液配制),迅速混匀起始酶解反应,30min后取出800μ
l酶解液,迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀以终止酶反应。11000rpm离心15min(离心前混匀),得到酪蛋白酶解液的上清液。
[0076]
步骤(4),制备酶解空白溶液的具体方法是,取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,继续温育30min,从中取出400μl作为底物空白,按照酶空白(与上述酶解反应相同的酶溶液,与底物空白相同的预热和温育条件,400μl)、底物空白的添加顺序逐一迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀,11000rpm(11600rcf)离心15min(离心前混匀),得到酪蛋白酶解空白溶液的上清液。
[0077]
步骤(5),从酪蛋白酶解液的上清液和酪蛋白酶解空白溶液的上清液分别取出500μl与500μl 0.5mol/l的naoh溶液充分混匀,得到碱性酶解液和碱性酶解空白溶液。根据步骤(2)的方法进行mbth反应,测定碱性酶解液和碱性酶解空白溶液,从而获得酶解产生的低聚肽浓度,进而得到蛋白酶活力。
[0078]
在上述酶解条件下,1个酶活力单位可被定义为每分钟产生相当于1μg牛血清白蛋白的量。
[0079]
表1实施例1蛋白酶活力测定结果
[0080][0081]
实施例2:
[0082]
步骤(1),将精密称取的酪蛋白溶解于0.05mol/l的磷酸钠溶液中,再用0.05mol/l的磷酸溶液调ph至7.0,再用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0083]
步骤(2),将步骤(1)的酪蛋白溶液与步骤(1)的磷酸-磷酸钠缓冲液等体积混合,将该混合液与0.073mol/l的tca溶液按照体积比为1:1混合,11000rpm离心15min(离心前混匀),离心得到酪蛋白上清液;以上述的酪蛋白上清液为溶剂,分别配制浓度0、50、100、150、200、250、300、350μg/ml的色氨酸标准溶液,每种浓度的牛血清白蛋白标准溶液中取500μl,加入500μl 0.5mol/l的naoh溶液,混匀,再加入500μl新鲜配制的1.5mg/ml(6.4mmol/l)mbth溶液,体系中,oh-浓度为0.15mol/l,mbth的初始浓度为2.1mmol/l。于80℃水浴加热13min,然后,趁热加入1000μl硫酸铁铵试剂,室温静置50min,充分混匀,于波长610nm处测定色氨酸的吸光度值,每个浓度做三个平行样。根据每组色氨酸溶液浓度与测得的相应色氨酸吸光度值之间的关系绘制标准对应关系曲线。所述的硫酸铁铵试剂由fenh4(so4)2·
12h2o、氨基磺酸和盐酸组成,其浓度分别为5g/l(10.5mmol/l)、0.05mol/l和0.5mol/l,在加入酸性铁试剂后的反应体系中,h
浓度为0.13mol/l,fe
3
的初始浓度为4.2mmol/l。
[0084]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(2号木瓜蛋白酶,6μg/ml,用
0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液配制),迅速混匀起始酶解反应,30min后取出800μl酶解液,迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀以终止酶反应。11000rpm离心15min(离心前混匀),得到酪蛋白酶解液的上清液。
[0085]
步骤(4),制备酶解空白溶液的具体方法是,取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,继续温育30min,从中取出400μl作为底物空白,按照酶空白(与上述酶解反应相同的酶溶液,与底物空白相同的预热和温育条件,400μl)、底物空白的添加顺序逐一迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀,11000rpm(11600rcf)离心15min(离心前混匀),得到酪蛋白酶解空白溶液的上清液。
[0086]
步骤(5),从酪蛋白酶解液的上清液和酪蛋白酶解空白溶液的上清液分别取出500μl与500μl 0.5mol/l的naoh溶液充分混匀,得到碱性酶解液和碱性酶解空白溶液。根据步骤(2)的方法进行mbth反应,测定碱性酶解液和碱性酶解空白溶液,从而获得酶解产生的低聚肽浓度,进而得到蛋白酶活力。
[0087]
表2实施例2蛋白酶活力测定结果
[0088][0089]
实施例3:
[0090]
步骤(1),将精密称取的酪蛋白溶解于0.05mol/l的磷酸钠溶液中,再用0.05mol/l的磷酸溶液调ph至7.0,再用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0091]
步骤(2),将步骤(1)的酪蛋白溶液与步骤(1)的磷酸-磷酸钠缓冲液等体积混合,将该混合液与0.073mol/l的tca溶液按照体积比为1:1混合,11000rpm离心15min(离心前混匀),离心得到酪蛋白上清液;以上述的酪蛋白上清液为溶剂,分别配制不同浓度0、50、100、150、200、250、300、350μg/ml的色氨酸标准溶液,从中取500μl,加入500μl 0.5mol/l的naoh溶液,混匀,再加入500μl新鲜配制的1.5mg/ml(6.4mmol/l)mbth溶液,体系中,oh-浓度为0.15mol/l,mbth的初始浓度为2.1mmol/l。于80℃水浴加热13min,然后,趁热加入1000μl硫酸铁铵试剂,室温静置50min,充分混匀,于波长610nm处测定色氨酸的吸光度值,每个浓度做三个平行样。根据每组色氨酸溶液浓度与测得的相应色氨酸吸光度值之间的关系绘制标准对应关系曲线。所述的硫酸铁铵试剂由fenh4(so4)2·
12h2o、氨基磺酸和盐酸组成,其浓度分别为5g/l(10.5mmol/l)、0.05mol/l和0.5mol/l,在加入酸性铁试剂后的反应体系中,h
浓度为0.13mol/l,fe
3
的初始浓度为4.2mmol/l。
[0092]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(中性蛋白酶,10μg/ml,用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液配制),迅速混匀起始酶解反应,30min后取出800μ
l酶解液,迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀以终止酶反应。11000rpm离心15min(离心前混匀),得到酪蛋白酶解液的上清液。
[0093]
步骤(4),制备酶解空白溶液的具体方法是,取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,继续温育30min,从中取出400μl作为底物空白,按照酶空白(与上述酶解反应相同的酶溶液,与底物空白相同的预热和温育条件,400μl)、底物空白的添加顺序逐一迅速加入到装有800μl 0.073mol/l的tca溶液的离心管,迅速混匀,11000rpm(11600rcf)离心15min(离心前混匀),得到酪蛋白酶解空白溶液的上清液。
[0094]
步骤(5),从酪蛋白酶解液的上清液和酪蛋白酶解空白溶液的上清液分别取出500μl与500μl 0.5mol/l的naoh溶液充分混匀,得到碱性酶解液和碱性酶解空白溶液。根据步骤(1)的方法进行mbth反应,测定碱性酶解液和碱性酶解空白溶液,从而获得酶解产生的低聚肽浓度,进而得到蛋白酶活力。
[0095]
表3实施例3蛋白酶活力测定结果
[0096][0097]
实施例4:
[0098]
步骤(1),将精密称取的酪蛋白溶解于0.1mol/l的氢氧化钠溶液中,再将溶解的酪蛋白溶液缓慢加入到0.1mol/l的乳酸溶液中并剧烈搅拌,后调ph至3.0,再用1mol/l ph 3.0的乳酸-乳酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0099]
步骤(2),将步骤(1)的酪蛋白溶液与步骤(1)的乳酸-乳酸钠缓冲液等体积混合,将该混合液与0.080mol/l的tca溶液按照体积比为1:1混合,12000rpm离心15min(离心前混匀),离心得到酪蛋白上清液;以上述的酪蛋白上清液为溶剂,分别配制不同浓度0、50、100、150、200、250、300、350μg/ml的色氨酸标准溶液,从中取500μl,加入500μl 0.5mol/l的naoh溶液,混匀,再加入500μl新鲜配制的1.5mg/ml(6.4mmol/l)mbth溶液,体系中,oh-浓度为0.15mol/l,mbth的初始浓度为2.1mmol/l。于80℃水浴加热13min,然后,趁热加入1000μl硫酸铁铵试剂,室温静置50min,充分混匀,于波长610nm处测定色氨酸的吸光度值,每个浓度做三个平行样。根据每组色氨酸溶液浓度与测得的相应色氨酸吸光度值之间的关系绘制标准对应关系曲线。所述的硫酸铁铵试剂由fenh4(so4)2·
12h2o、氨基磺酸和盐酸组成,其浓度分别为5g/l(10.5mmol/l)、0.05mol/l和0.5mol/l,在加入酸性铁试剂后的反应体系中,h
浓度为0.13mol/l,fe
3
的初始浓度为4.2mmol/l。
[0100]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(胃蛋白酶,16μg/ml,用1mol/l ph 3.0的乳酸-乳酸钠缓冲溶液配制),迅速混匀起始酶解反应,30min后取出800μl酶解液,迅速加入到装有800μl 0.080mol/l的tca溶液的离心管,迅速混匀以终止酶反应。12000rpm
离心15min(离心前混匀),得到酪蛋白酶解液的上清液。
[0101]
步骤(4),制备酶解空白溶液的具体方法是,取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,继续温育30min,从中取出400μl作为底物空白,按照酶空白(与上述酶解反应相同的酶溶液,与底物空白相同的预热和温育条件,400μl)、底物空白的添加顺序逐一迅速加入到装有800μl 0.080mol/l的tca溶液的离心管,迅速混匀,12000rpm(13800rcf)离心15min(离心前混匀),得到酪蛋白酶解空白溶液的上清液。
[0102]
步骤(5),从酪蛋白酶解液的上清液和酪蛋白酶解空白溶液的上清液分别取出500μl与500μl 0.5mol/l的naoh溶液充分混匀,得到碱性酶解液和碱性酶解空白溶液。根据步骤(1)的方法进行mbth反应,测定碱性酶解液和碱性酶解空白溶液,从而获得酶解产生的低聚肽浓度,进而得到蛋白酶活力。
[0103]
表4实施例4蛋白酶活力测定结果
[0104][0105]
实施例5:
[0106]
步骤(1),将精密称取的酪蛋白溶解于少量的氢氧化钠溶液中,调ph值至10.5,再用ph 10.5的硼酸-氢氧化钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0107]
步骤(2),将步骤(1)的酪蛋白溶液与步骤(1)的硼酸-氢氧化钠缓冲液等体积混合,将该混合液与0.092mol/l的tca溶液按照体积比为1:1混合,12000rpm离心15min(离心前混匀),离心得到酪蛋白上清液;以上述的酪蛋白上清液为溶剂,分别配制不同浓度0、50、100、150、200、250、300、350μg/ml的色氨酸标准溶液,从中取500μl,加入500μl0.5mol/l的naoh溶液,混匀,再加入500μl新鲜配制的1.5mg/ml(6.4mmol/l)mbth溶液,体系中,oh-浓度为0.15mol/l,mbth的初始浓度为2.1mmol/l。于80℃水浴加热13min,然后,趁热加入1000μl硫酸铁铵试剂,室温静置50min,充分混匀,于波长610nm处测定色氨酸的吸光度值,每个浓度做三个平行样。根据每组色氨酸溶液浓度与测得的相应色氨酸吸光度值之间的关系绘制标准对应关系曲线。所述的硫酸铁铵试剂由fenh4(so4)2·
12h2o、氨基磺酸和盐酸组成,其浓度分别为5g/l(10.5mmol/l)、0.05mol/l和0.5mol/l,在加入酸性铁试剂后的反应体系中,h
浓度为0.13mol/l,fe
3
的初始浓度为4.2mmol/l。
[0108]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(碱性蛋白酶,16μg/ml,用ph 10.5的硼酸-氢氧化纳缓冲液配制),迅速混匀起始酶解反应,30min后取出800μl酶解液,迅速加入到装有800μl 0.092mol/l的tca溶液的离心管,迅速混匀以终止酶反应。12000rpm离心15min(离心前混匀),得到酪蛋白酶解液的上清液。
[0109]
步骤(4),制备酶解空白溶液的具体方法是,取步骤(1)中的10mg/ml的酪蛋白溶液
1ml加入到试管中于37℃的水浴摇床中预热5min,继续温育30min,从中取出400μl作为底物空白,按照酶空白(与上述酶解反应相同的酶溶液,与底物空白相同的预热和温育条件,400μl)、底物空白的添加顺序逐一迅速加入到装有800μl 0.092mol/l的tca溶液的离心管,迅速混匀,12000rpm(13800rcf)离心15min(离心前混匀),得到酪蛋白酶解空白溶液的上清液。
[0110]
步骤(5),从酪蛋白酶解液的上清液和酪蛋白酶解空白溶液的上清液分别取出500μl与500μl 0.5mol/l的naoh溶液充分混匀,得到碱性酶解液和碱性酶解空白溶液。根据步骤(1)的方法进行mbth反应,测定碱性酶解液和碱性酶解空白溶液,从而获得酶解产生的低聚肽浓度,进而得到蛋白酶活力。
[0111]
表5实施例5蛋白酶活力测定结果
[0112][0113]
对比例1:
[0114]
步骤(1),将精密称取的酪蛋白溶解于0.05mol/l的磷酸钠溶液中,再用0.05mol/l的磷酸溶液调ph至7.0,再用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0115]
步骤(2),配制不同浓度0、10、20、30、40、50、60μg/ml的酪氨酸标准溶液,从中取1ml酪氨酸标准溶液,加入5ml 0.4mol/l的na2co3溶液和1ml folin试剂(原液与水1:2稀释),混匀,置于40℃水浴反应20min,取出,置于冷水中,迅速冷却至室温,在680nm处测吸光度,根据每组酪氨酸溶液浓度与测得的相应酪氨酸吸光度值之间的关系绘制标准对应关系曲线。。
[0116]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(2号木瓜蛋白酶,4μg/ml、6μg/ml、8μg/ml、10μg/ml、12μg/ml、14μg/ml,用0.05mol/l ph 7.0的磷酸-磷酸钠缓冲液配制),迅速混匀起始酶解反应,10min后迅速准确加入2ml 0.4mol/l的tca溶液,迅速混匀以终止酶反应,对酶解液进行过滤,得到酶解液的上清液。
[0117]
步骤(4),取1ml与步骤(3)相同时间、相同温度预热的待测蛋白酶溶液,10min后迅速准确加入2ml 0.4mol/l的tca溶液,于试管加入1ml步骤(1)中的10mg/ml的酪蛋白溶液,混匀,对酶解空白溶液进行过滤,得到酶解空白液的上清液。
[0118]
步骤(5),从酪蛋白酶解液和酪蛋白酶解空白溶液分别取出1ml,加入5ml 0.4mol/l的na2co3溶液和1ml folin试剂,混匀,置于40℃水浴反应20min,取出,置于冷水中,迅速冷却至室温,在680nm处测吸光度。根据标准对应关系曲线得到蛋白酶活力。
[0119]
表6对比例1蛋白酶活力测定结果
[0120][0121]
该对比例与实施例2所用的蛋白酶为同一蛋白酶,对比与实施例2同样的酶浓度6μg/ml,测定的酶活力均值由13.05下降到0.693,说明本发明方法的灵敏度很高。该对比例不同的酶浓度下计算出来的酶活力值相差较大,与酶活力曲线不过原点相对应。
[0122]
对比例2:
[0123]
步骤(1),将精密称取的酪蛋白溶解于0.1mol/l的氢氧化钠溶液中,再将溶解的酪蛋白溶液缓慢加入到0.1mol/l的乳酸溶液并调ph至3.0,再用0.1mol/l ph 3.0的乳酸-乳酸钠缓冲液定容,配制成浓度为10mg/ml酪蛋白溶液。
[0124]
步骤(2),配制不同浓度0、10、20、30、40、50、60μg/ml的酪氨酸标准溶液,从中取1ml酪氨酸标准溶液,加入5ml 0.4mol/l的na2co3溶液和1ml folin试剂(原液与水1:2稀释),混匀,置于40℃水浴反应20min,取出,置于冷水中,迅速冷却至室温,在680nm处测吸光度,根据每组酪氨酸溶液浓度与测得的相应酪氨酸吸光度值之间的关系绘制标准对应关系曲线。
[0125]
步骤(3),取步骤(1)中的10mg/ml的酪蛋白溶液1ml加入到试管中于37℃的水浴摇床中预热5min,加入1ml预热至相应温度的待测蛋白酶溶液(胃蛋白酶,128、256、512μg/ml,用0.1mol/l ph 3.0的乳酸-乳酸钠缓冲液配制),迅速混匀起始酶解反应,10min后迅速准确加入2ml 0.4mol/l的tca溶液,迅速混匀以终止酶反应,对酶解液进行过滤,得到酶解液的上清液。
[0126]
步骤(4),取1ml与步骤(3)相同时间、相同温度预热的待测蛋白酶溶液,10min后迅速准确加入2ml 0.4mol/l的tca溶液,于试管加入1ml步骤(1)中的10mg/ml的酪蛋白溶液,混匀,对酶解空白溶液进行过滤,得到酶解空白液的上清液。
[0127]
步骤(5),从酪蛋白酶解液和酪蛋白酶解空白溶液分别取出1ml,加入5ml 0.4mol/l的na2co3溶液和1ml folin试剂,混匀,置于40℃水浴反应20min,取出,置于冷水中,迅速冷却至室温,在680nm处测吸光度。根据标准对应关系曲线得到蛋白酶活力。
[0128]
表7对比例2蛋白酶活力测定结果
[0129][0130]
该对比例与实施例4所用的蛋白酶为同一蛋白酶,同样该对比例不同的酶浓度下计算出来的酶活力值相差较大,与酶活力曲线不过原点相对应。
[0131]
以上描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。