1.本公开涉及临床分析领域,尤其涉及处理全血样品且确定该样品血浆成分中分析物浓度的方法和装置。本公开尤其涉及处理全血样品、定量确定血细胞比容且在考虑该全血样品的血细胞比容的同时定量确定血浆成分中的一种或多种分析物的浓度的侧流检测方法和装置。
背景技术:
2.血液检查是现代医学的基石,目前已经能够对多达数百种分析物的存在和浓度进行确定。血液检查用于确定患者的生理和生化状态,其结果在营养状况、健康状况、各种疾病的存在与否、治疗有效性、器官功能的确定方面至关重要。血液检查还例如用于检测药物滥用。针对这一目的的方法和装置下至相对简易的测试条,上至盛有对同一样品进行数百次测试的试剂的自动化临床仪器。
3.全血由悬浮于血浆中的红细胞、血小板及白细胞组成。在健康人的血液中,红细胞明显占各种细胞的大多数。红细胞也称红血细胞(rbc),含有赋予血液红色且具有氧结合能力的血红蛋白(hb)。血浆主要由水(约93%)组成,但同时含有盐,各种蛋白质和脂质,以及其他组分,如葡萄糖。血浆还含有数百乃至数千种痕量生化化合物,其中的大量化合物已确定为临床分析物,而其余化合物尚处于研究当中。实验室环境中进行的检测或化验常常基于血浆或血清。然而,对于即时医疗(poc)应用,在有全血样品可用的情况下优选使用全血样品,以避免在将样品应用于检测之前的血清或血浆分离步骤。
4.血红蛋白
5.血红蛋白(hb)为一种含铁的金属蛋白,负责所有脊椎动物红血细胞内氧的转运。在哺乳动物中,hb占红血细胞干含量的约96%重量百分比,以及总含量的约35%重量百分比。
6.hb测量方法首创于一百多年之前,成为可供临床医生使用的最早的诊断性血液检查之一。如今,hb浓度测量为最常见的血液检查之一,通常作为全血细胞计数的一个环节。例如,献血前后通常会进行hb浓度测量。测量结果以g/l为单位,有时以g/dl或mol/l为单位。男性的正常水平为14~18g/dl,女性为12~16g/dl(孕妇为11~14g/dl),儿童为11~16g/dl(比利特(billett),1990年)。
7.如果浓度低于正常值,则称为贫血。贫血的原因可以为失血、红细胞生成减少以及红细胞分解增加。除了献血之外,失血的原因还包括创伤以及胃肠道出血等。红血细胞生成减少可由缺铁、维生素b12的缺乏、地中海贫血以及若干种骨髓肿瘤引起。红血细胞分解增加的原因可以为镰刀形细胞贫血等若干种遗传疾病,疟疾等感染以及某些自身免疫性疾病。
8.首创于1950年代的氰化高铁血红蛋白(hicn)检测法仍然是国际血液学标准化委员会(icsh)推荐的对所有新的hb浓度测量方法进行评判和标准化的方法。icsh成立于1966年,而且自彼时起一直活跃于制定和修订标准化hicn法的各建议版本,以及组织和监督具
有确切已知浓度的无菌安瓿瓶装hicn溶液这一国际标准制品的生产和分销。
9.便携式血红蛋白计,如201设备(海莫库公司(hemocue ab),瑞典)能够在即时医疗情形中以及献血中心内实现精确的血红蛋白测定。此类设备本质上是能够对溶液的颜色强度进行测量的光度计。
10.此类测量在同时用作反应容器的一次性微量比色皿内进行。使红细胞释放hb以及将hb转化为稳定的有色产物所需的试剂以干态形式处于比色皿壁上。测量时,只需将少量(通常为10μl)毛细血管、静脉或动脉血样引入微量比色皿且将微量比色皿插入仪器中即可。此类仪器在出厂前利用上述hicn标准预先校准,而且被测溶液的吸光度自动转换为总血红蛋白(cthb)浓度。结果会在一分钟之内显示。
11.自2006年以来,市场上开始出现无试剂分析仪(301),最近又推出diaspect tm(ekf诊断有限公司(ekf diagnostics plc)/戴尔斯派德医疗有限公司(diaspect medical gmbh)),此类分析仪使用无试剂比色皿和光度法,而且在大约一秒钟内提供结果。
12.众所周知,在将血红蛋白及其衍生物(除硫化血红蛋白之外)在碱性的铁氰化钾和氰化钾溶液(都氏(drabkin)试剂)的存在下氧化为高铁血红蛋白后,可在540nm处进行hb的定量比色测定。高铁血红蛋白与氰化钾反应形成在540nm处达到最大吸收的氰化高铁血红蛋白。540nm处测得的颜色强度与总血红蛋白浓度成正比。
13.此外,yang等人在2013年公开一种用于测量hb的纸基检测法(yang等人,2013年)。在该检测法中,将20μl的血液与都氏试剂的混合液滴滴在图案化的色谱层析纸上。所产生的血迹晾干25分钟后,进行扫描,并根据红绿蓝(rgb)颜色模型对数字图像进行分析。绿色通道的线性拟合效果最佳,因此选择用于对血样中的hb进行量化。
14.血细胞比容
15.血样中压积红血细胞的体积比例称为血细胞比容(hct),并且表示为样品总体积的百分比。正常hct水平非常稳定,成年男性处于40%~54%范围,成年女性处于36%~48%范围(亨尼(henny)
·h·
比利特,1990年,同上)。偏离这些标准水平通常被认为是严重疾病的征兆,如贫血、白血病、肾脏感染或饮食不足,但也可能表示怀孕、甚至大量运动等某种明确的状况。
16.在测量血浆或血清内不同分析物的浓度时,hct的干扰被认为是一个重要问题。对于所有的定性和定量临床血液分析检测,hct的差异均可导致严重的误差。
17.为了说明了解hct的重要性,可以考虑两份全血样品,一份来自低hb(100g/l)患者,另一份来自高hb(180g/l)患者,此两值均具有生理学上的意义。第一名患者的hct约为30%,而第二名患者的hct约为54%。对于25μl的样本量,这表示,对于第一名患者而言,需17.5μl的血浆供分析之用,而对于第二名患者而言,仅需11.5μl即可。在确定血浆中的分析物浓度时,此类差异可具有非常重要的意义。
18.目前,已提出采用非接触式漫反射光谱法的hct预测方法(卡皮奥(capiau)等人,2016年)。结果表明,仅需对干血斑进行扫描,便足以得出近似hct。利用以肝素锂作为抗凝剂的采血管,对同意采血的健康志愿者采集静脉血。在采血当天,通过将25μl的血沉积在沃特曼903滤纸上,制备干血斑。血斑始终在环境条件下干燥至少2个小时。所得干血斑要么在干燥后立刻分析,要么在干燥剂的存在下存放于带拉链的塑料袋中,以待分析。经发现,干
血斑在室温下稳定至少5个月,在温度升高(60℃)后,稳定3天以内的时间。干血斑以10w的卤钨光源照射,并以光谱仪记录354nm和1042nm之间反射光强与波长之间的依存关系。
19.2017年提出的一种分析技术将直方图用于血液血细胞比容的比色定量分析,研究人员还开发了一种基于智能手机的“直方图应用程序”,用于血细胞比容的测定,该程序通过定制的光学平台,将智能手机的内置相机与微流控芯片整合于一起(贾拉勒(jalal)等人,2017年)。
20.us 8,730,460(yan等人,血液血红蛋白浓度的纸基分光光度检测)公开了血液hb浓度的分光光度检测,其中,分光光度技术用于测量光在指定波长下透过内含血样的纸质介质时的透射状况。随后,光的透射信息用于计算血液hb浓度。在某些实施方式中,在对光的透射信息进行测量之前,先对纸质介质进行化学处理,以将血样溶血。
21.wo 2017/087834(康奈尔大学(cornell university),埃里克森(erickson)等人)提出了一种多重诊断检测盒通用概念,用于检测多种目标分子。一种实施方式涉及一种多重诊断检测盒,具有预处理模块以及远离加样孔的针对铁蛋白免疫检测的并行检测区、c反应蛋白免疫检测区以及血红蛋白比色检测区。
22.现有技术的hct测定方法主要依赖外部或辅助的设备(如离心机、血红蛋白计等)、试剂(如氰化钾)和/或血样的变性(例如,通过与试剂混合且/或将样品干燥)。因此,实现在以尽可能简单且快速的方式基本上同时或直接按顺序测量同一样品的血细胞比容及分析物的同时保持高准确度或甚至与已有待测分析物的快速检测法相较提高准确度这一点仍是一项难题。
技术实现要素:
23.本发明人发现,通过确定血细胞比容且在计算分析物浓度时将其考虑在内,可以显著提高全血样品内分析物的测量精度,而且更重要的一点是,这一方式能够在无需辅助设备、试剂且/或使血样变性的情况下,在侧流检测情形中进行。
24.相应地,本公开第一方面涉及一种处理全血样品且确定该样品血浆成分内分析物水平的侧流检测方法,包括确定样品的血细胞比容值且在确定血浆成分内分析物水平时应用该血细胞比容值的步骤,其中,该方法包括如下步骤:
25.1)以基本上不溶血的缓冲液将样品稀释至预定稀释系数,制得稀释样品;
26.2)将稀释样品施加至侧流检测装置的基底;
27.3)在自施加样品已被吸收于基底内起的1~600秒内拍摄基底图像;
28.4)分析图像,以从图像确定至少一种参数的值;
29.5)将该值与针对具有已知血细胞比容值的样品获得的值相关联,以获得样品的血细胞比容值;
30.6)在下游的侧流检测装置中确定分析物的水平,在确定血浆内的分析物的水平时,应用(1)中使用的稀释系数以及(5)中获得的样品的血细胞比容值。
31.在上文中,在步骤3)中拍摄图像时,基底优选在预定波长处照射,其中,波长根据步骤1)中使用的稀释系数选择。
32.作为替代方案,基底以白光照射,且步骤3)中拍摄的图像以透射预定波长的光的滤光片拍摄,其中,被透射的波长根据步骤1)中使用的稀释系数选择。
33.根据待测分析物、分析物的生理浓度以及检测灵敏度,样品优选以等渗缓冲液稀释至1~2500区间的稀释系数。样品体积可由本领域技术人员选择,而且根据检测装置的结构,可例如为10μl、20μl、25μl、50μl、100μl。
34.根据上述第一方面的一种实施方式,当稀释系数为1(无稀释)至10时,在以具有处于约600至约950nm区间的波长的光对具有被施加样品的基底进行照射的同时,拍摄图像。
35.根据上述第一方面的另一实施方式,当稀释系数大于10但小于50时,在以具有处于约575nm至约950nm区间的波长的光对具有被施加样品的基底进行照射的同时,拍摄图像。
36.根据上述第一方面的另一实施方式,当稀释系数为50至2500时,在以具有处于约400nm至约575nm区间的波长的光对具有被施加样品的基底进行照射的同时,拍摄图像。
37.根据上述第一方面的一种替代实施方式,当稀释系数为1(无稀释)至10时,在以白光且使用透射具有约600nm至约950nm区间的波长的光的滤光片对具有被施加样品的基底进行照射的同时,拍摄图像。
38.根据上述第一方面的另一替代实施方式,当稀释系数大于10但小于50时,在以白光且使用透射具有约575nm至约950nm区间的波长的光的滤光片对具有被施加样品的基底进行照射的同时,拍摄图像。
39.根据上述第一方面的另一替代实施方式,当稀释系数为50至2500时,在以白光且使用透射具有约400nm至约575nm区间的波长的光的滤光片对具有被施加样品的基底进行照射的同时,拍摄图像。
40.根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,可与待测分析物轭合的试剂设于侧流检测装置的流动路径内,例如设于侧流装置流动路径的轭合部分内,或者设于构成流动路径一部分的单独轭合物垫中。
41.根据上述第一方面的可与其所有实施方式自由组合的另一实施方式,可与待测分析物轭合的试剂含于稀释缓冲液中。
42.根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,4)中确定的至少一种参数为具有施加于其上的样品的基底的反射率。
43.优选地,反射率测量为图像所含像素的平均强度。
44.根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,在自样品已被吸收于基底内起的约1至约600秒内,优选约1至约360秒内,更优选约1至约180秒内,最优选约1至约90秒内,拍摄图像。
45.最优选地,在自样品已被吸收于基底内起的约1至约30秒内,拍摄图像。
46.根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,基底为能够分离红血细胞和血浆的纤维基底。
47.优选地,纤维基底适于基本上避免样品内的红血细胞的溶血。
48.根据第一方面的一种实施方式,该方法包括在稀释样品加样前拍摄基底图像的步骤。
49.样品可以不同缓冲液稀释,基本上不溶血的缓冲液的一例为tris缓冲的等渗盐水溶液,但本领域技术人员还了解且/或能够制备其他非溶血性缓冲液。
50.根据第一方面及其任何实施方式,该方法可应用于能够自血浆中检出的任何在临
床上或科学上具有意义的分析物。举例而言,分析物可选自铁蛋白、转铁蛋白、血浆钙卫蛋白、c反应蛋白(crp)、胱抑素c、血浆降钙素原(pct)、n端脑钠肽前体、肌钙蛋白t、肌钙蛋白i及抗ccp抗体。
51.第二方面涉及一种处理全血样品且确定该样品血浆成分内分析物浓度的侧流检测装置,该装置适于执行根据第一方面及其任何实施方式的方法。
52.根据第二方面的侧流检测装置可应用于能够自血浆中检出的任何具有临床意义的分析物。举例而言,分析物可选自铁蛋白、转铁蛋白、血浆钙卫蛋白、c反应蛋白(crp)、胱抑素c、血浆降钙素原(pct)、n端脑钠肽前体、肌钙蛋白t、肌钙蛋白i及抗ccp抗体。
53.根据第二方面的一种实施方式,分析物为铁蛋白,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗铁蛋白抗体的轭合物垫,具有至少一条固定的抗铁蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
54.作为替代方案,分析物为铁蛋白,而且该装置包括配置为容纳以含与标志物轭合的抗铁蛋白抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗铁蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
55.根据第二方面的另一实施方式,分析物为转铁蛋白,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗转铁蛋白抗体的轭合物垫,具有至少一条固定的抗转铁蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
56.作为替代方案,分析物为转铁蛋白,而且该装置包括配置为容纳以含与标志物轭合的抗转铁蛋白抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗转铁蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
57.根据第二方面的另一实施方式,分析物为血浆钙卫蛋白,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗钙卫蛋白抗体的轭合物垫,具有至少一条固定的抗钙卫蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
58.作为替代方案,分析物为血浆钙卫蛋白,而且该装置包括配置为容纳以含与标志物轭合的抗钙卫蛋白抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗钙卫蛋白抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
59.根据第二方面的另一实施方式,分析物为胱抑素c,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗胱抑素c抗体的轭合物垫,具有至少一条固定的抗胱抑素c抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
60.作为替代方案,分析物为胱抑素c,而且该装置包括配置为容纳以含与标志物轭合的抗胱抑素c抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗胱抑素c抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
61.根据第二方面的另一实施方式,分析物为血浆降钙素原,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗降钙素原抗体的轭合物垫,具有至少一条固定的抗降钙素原抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、
膜及吸收垫形成侧流路径。
62.作为替代方案,分析物为血浆降钙素原,而且该装置包括配置为容纳以含与标志物轭合的抗降钙素原抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗降钙素原抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
63.根据第二方面的另一实施方式,分析物为c反应蛋白(crp),而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗crp抗体的轭合物垫,具有至少一条固定的抗crp抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
64.作为替代方案,分析物为c反应蛋白(crp),而且该装置包括配置为容纳以含与标志物轭合的抗crp抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗crp抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
65.根据第二方面的另一实施方式,分析物为抗ccp抗体,而且该装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的一条或多条ccp肽的轭合物垫,具有至少一条固定的一条或多条ccp肽的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
66.作为替代方案,分析物为抗ccp抗体,而且该装置包括配置为容纳以含与标志物轭合的一条或多条ccp肽的缓冲液稀释的全血样品的基底,具有至少一条固定的一条或多条ccp肽的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
67.根据第二方面的另一实施方式,分析物为n端脑钠肽前体,而且该装置包括配置为容纳可选以缓冲液稀释的全血样品的基底,含与标志物轭合的抗n端脑钠肽前体抗体的轭合物垫,具有至少一条固定的n端脑钠肽前体抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
68.作为替代方案,分析物为n端脑钠肽前体,而且该装置包括配置为容纳以含与标志物轭合的抗n端脑钠肽前体抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗n端脑钠肽前体抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
69.根据第二方面的另一实施方式,分析物为肌钙蛋白t,而且该装置包括配置为容纳可选以缓冲液稀释的全血样品的基底,含与标志物轭合的抗肌钙蛋白t抗体的轭合物垫,具有至少一条固定的肌钙蛋白t抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
70.作为替代方案,分析物为肌钙蛋白t,而且该装置包括配置为容纳以含与标志物轭合的抗肌钙蛋白t抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗肌钙蛋白t抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
71.根据第二方面的另一实施方式,分析物为肌钙蛋白i,而且该装置包括配置为容纳可选以缓冲液稀释的全血样品的基底,含与标志物轭合的抗肌钙蛋白i抗体的轭合物垫,具有至少一条固定的肌钙蛋白i抗体的检测线的膜,以及吸收垫;而且其中,基底、轭合物垫、膜及吸收垫形成侧流路径。
72.作为替代方案,分析物为肌钙蛋白i,而且该装置包括配置为容纳以含与标志物轭合的抗肌钙蛋白i抗体的缓冲液稀释的全血样品的基底,具有至少一条固定的抗肌钙蛋白i抗体的检测线的膜,以及吸收垫;而且其中,基底、膜及吸收垫形成侧流路径。
73.第三方面涉及一种配置为执行根据第一方面及其任何实施方式的方法的处理器。
74.第四方面涉及一种计算机程序产品包括存储于存储器内的软件指令,该软件指令适于促使装置执行根据第一方面及其任何实施方式的方法。
75.以上发明内容部分仅旨在于说明,并不旨在以任何方式构成限制。除了上述用于说明的各个方面、实施方式及特征,通过参考以下附图及具体实施方式部分,其他方面、实施方式及特征将变得显而易见。
附图说明
76.以下,参考附图且以举例方式,对本发明进行描述,附图中:
77.图1为包括单色cmos相机(101),聚焦光学器件(102)以及设有一组带通滤光片(105)的滤光片转盘的照片拍摄装置示意图。与垂直支架(108)附接的水平支架(103)以及高度调节旋钮(104)共同协作,进行精确聚焦,以实现清晰的图像。设有散光器(107)的一个或多个白光源(106)对置于样品架(110)上的样品(109)进行均匀照射。为了阻止环境光对测量造成干扰,所有图像在拍摄时均以厚黑布遮罩整个装置。样品(109)仅示意性示出,而且在此处示为侧流检测样品。在各种实验中,使用了各种不同样品,下至通过切割过滤材料和其他纤维基底获得的条片,上至带或不带塑料壳体的部分或完全组装侧流检测流动路径。样品的性质公开于各个实施例中。
78.图2所示为在稀释血样被吸收于基底内后如何自稀释血样的照片图像识别有价值像素。根据样品与背景之间的对比度,通过将样品屏蔽而识别有价值像素,以供进一步分析。
79.图3为根据本发明一种实施方式的一种侧流装置的截面示意图。该侧流装置包括样品垫(1)或基底等用于容纳全血样品的部分,该部分设置为与设于支承物或背衬(10)上的其他基底、介质或滤膜(2,3,6)流体连接。图中示为(2)的该介质或滤膜可例如为轭合物垫,该轭合物垫含能够与分析物特异性结合的试剂或轭合物。然而,也可在样品垫(1)内设置轭合物区。图中的(4)和(5)所示分别为t(检测)线和c(对照)线。应该可以想到的是,当例如在对样品中多于一种分析物进行测定的所谓的多重分析情形中,可以设置多条检测线和对照线,这一做法可与本文公开的任何实施方式自由组合。
80.图4为根据本发明另一实施方式的一种装置的截面示意图,该装置适合用于如下方法:试剂或轭合物含于缓冲液内,或含于样品垫(1)内靠近其与硝酸纤维素滤膜(3)过渡之处的部分内,而且在样品加至基底(1)之前,样品与缓冲液混合物内例如在分析物与该分析物的特异性抗体之间形成轭合物。在该情形中,侧流检测装置可包括其上设置t线和c线(4,5)的滤膜(3)以及吸收垫(6),此两者均优选设于背衬(10)上。此处,同样应该可以想到的是,当例如在对样品中多于一种分析物进行测定的所谓的多重分析情形中,可以设置多条检测线和对照线,这一做法可与本文公开的任何实施方式自由组合。此外,也可在基底(3)的处于基底(1)与t线和c线(4,5)之间的部分中设置轭合物区。
81.图5为根据图3所示实施方式的一种装置的俯视示意图。
82.图6为根据图4所示实施方式的一种装置的俯视示意图,其中,该侧流检测装置不包括单独的轭合物垫。在此类设置方式中,可在样品垫(1)的一部分中设置轭合物区。
83.图7所示为侧流检测装置组装中使用的中间产品,该中间产品具有支承物或背衬
(10)以及设于该支承物上的介质或滤膜(1),(2),(3),(6)。当将该中间产品沿截面方向切开时,会形成侧流检测条,其中,(1)对应于基底或加样垫,(2)为轭合物垫,(3)为可供检测线(4)和对照线(5)设置的滤膜,(6)为吸收垫或芯吸垫,所有这些部件均设置于支承物或背衬(10)上。
84.图8为检测装置原型的截面图,该图示出了壳体(200),该壳体内封滤膜或支承物(1),(2),(3),(6)等部件,并且具有点样口(201)和分别暴露出检测线(4)和对照线(5)的一个或多个开口(202)。此处,同样应该可以想到的是,当例如在对样品中多于一种分析物进行测定的所谓的多重分析情形中,可以设置多条检测线和对照线,这一做法可与本文公开的任何实施方式自由组合。
85.图9a由三幅照片组成,从左到右依次为:未添加样品的基底(vf2,通用电气健康护理(ge healthcare)),即所谓的“空白”基底或零测量基底;加有“低hct”样品的相同基底;加有“高hct”样品的相同基底。图内正方形的白色轮廓线表示置于加样区域中心的roi方块(大小为1000
×
1000像素)。基底以白光照射,而且在相机前设置滤光片。
86.图9b由三幅照片组成,从左到右均为以红色led照射的加样孔,相机前不设滤光片。各图像(已裁剪)均来自esequant flex读取器(迪亚鲁诺(dialunox)),样品在施加至置于dcn塑料壳体内的fusion 5血液滤膜(思拓凡)前以10这一稀释因子稀释。
87.图10为实施例9的结果图,示为平均像素强度-hct(%)曲线。在该实验中,样品的稀释因子为4。
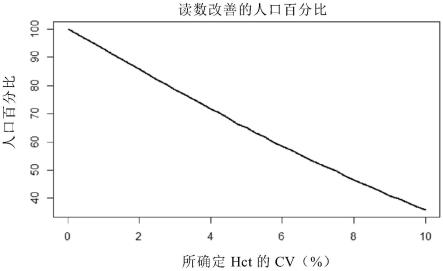
88.图11基于实施例9所示结果,而且所示为稀释因子为4时与真实hct水平的相对偏差。
89.图12为实施例10的结果图,示为平均像素强度-hct(%)曲线。在该实验中,样品以8这一稀释因子稀释。
90.图13基于实施例10所示结果,而且所示为样品稀释因子为8时与真实hct水平的相对偏差。
91.图14所示为根据实施例11所示结果且基于样品施加后30分钟内以不同时间间隔拍摄的图像得出的hct预测质量随时间的劣化情况。
92.图15为0分钟(恰好为样品施加时间)以及样品施加后30分钟内以五分钟间隔拍摄的一系列照片。可以看出,样品外观在前三幅照片中基本上保持不变,但随后开始发生变化。该结果对应于可从图14看出的趋势。
93.图16为施加至fusion 5滤膜的稀释血样(低hb和高hb)平均像素强度图。各图像得自通过led以ir和不同颜色(红色、绿色、蓝色)照射的esequant flex读取器(迪亚鲁诺)。
94.图17为称为“对比度”的定性度量值与稀释系数关系曲线图,该图示出了在一系列稀释系数下以400nm~950nm波长区间内的不同led(ir、红色、绿色、蓝色)进行的ir及不同颜色照射的血样hb浓度测定表现。一般情况下,对比度值越高,hb浓度测定精度越高。
95.图18为hb预测模型的估算精度(cv%)图。其中,针对图16和图17使用的数据根据低hb和高hb下测量值的标准差以及hb与平均像素强度之间线性相关这一假设转换成cv%。图中示出了不同波长(ir、红色、绿色及蓝色)下不同稀释系数的估算精度。
96.图19中的图a)和图b)所示分别为a)10倍稀释下红色led照射及b)100倍稀释下绿色led照射这两种情形中稀释血样的平均像素强度。每一hb浓度下测量5次。圆点代表平均
值,误差线代表1个标准差。每一数据集均拟合出一个幂函数,用作直接根据平均像素强度预测hb浓度的模型。
97.图20中的两幅图所示为图19中公式化的两种hb浓度预测模型的表现:a)10倍稀释下红色led照射情形的模型具有0.10
±
4.20%的相对误差;b)100倍稀释下绿色led照射情形的模型具有0.15
±
4.36%的相对误差。
98.图21为健康女性和男性的假设hct水平分布图。
99.图22为使用本发明方法时读取可得到改善的人口百分比。
具体实施方式
100.在描述本发明之前,需要理解的是,本文使用的术语仅用于描述具体实施方式的目的,并不旨在构成限制,本发明范围仅由下附各项权利要求及其等同物限定。
101.必需注意的是,就本说明书和下附各项权利要求中的使用而言,除非上下文另有明确规定,否则单数形式“一”、“一个”及“所述一个”包括复数指代内容。
[0102]“全血样品”中的“样品”一词是指已从人体或动物体采集或提取且以物理方式移离的样品,此样品不再归还至该人体或动物体。
[0103]
就本文中的使用而言,“全血”一词是指保有其全部组分的血液。也就是说,全血同时包含红细胞、白细胞及血小板等血细胞以及供血细胞悬浮于其中的血浆。
[0104]
就本文中的使用而言,“全血”或“血浆成分”一词是指血液的液体介质,而且基本上为含水、血浆蛋白质以及其他痕量物质的水溶液,其他痕量物质例如为血清白蛋白、凝血因子、免疫球蛋白(抗体)、激素、二氧化碳、各种其他蛋白质以及各种电解质(主要为钠和氯离子)。
[0105]
就本文中的使用而言,“血清”一词是指已去除凝血蛋白的血浆。
[0106]“稀释系数”一词定义为溶液的最终体积与最初体积之间的比率,其中,最终体积为稀释后的溶液体积,最初体积为用于稀释的原始溶液体积。
[0107]
在其他实施方式中,施加至基底上的样品为未经溶血的全血样品。就本文中的使用而言,“未经溶血”一词是指,样品采集后,以最大程度减小或优选基本上防止溶血(即破坏红细胞)的方式处理样品。因此,“未经溶血”一词不包括破坏性样品处理,例如,为了对样品进行存放而使全血变干(例如,在滤纸上),通过重新溶解于水而使干后的血样复原,等等。然而,“未经溶血”一词并不排除以等渗的非溶血性缓冲液将全血样品精心稀释的情形。
[0108]
此外,样品的存放(例如,冰箱或冰柜内的存放)本身不应视作如上所述的处理步骤。因此,既可在样品采集后将其立刻施加于基底上,也可在样品存放一小或多个小时至一天或多天或一周或多周后,将其引入设备。
[0109]
此外,由于全血样品含有会在样品长期存放后导致形成血块的凝血因子,而且血块的存在可能会对后续分析造成干扰,因此抗凝剂(即凝血抑制剂)的添加也不应视作本发明意义中的样品处理。本领域存在多种众所周知用作抗凝剂的化合物。抗凝剂例如包括天然或合成(即通过化学合成和/或重组dna技术获得)维生素k拮抗剂、天然或合成直接凝血酶抑制剂、柠檬酸盐、草酸盐、肝素及乙二胺四乙酸(edta)等。
[0110]
在其他实施方式中,来自受试对象的全血样品直接(即以如上所述的未经溶血的形式)施加至基底上。全血样品可尤其通过受试对象的指尖穿刺获得。例如,将指尖刺破后,
可通过将渗出的血液与毛细管接触而采血,从而使得血液经毛细管力引入,无需外部操作。随后,可将毛细管与所使用的检测装置相对设置,以使得血液可通入或被主动转移至该装置内。或者,可将刺破的指尖置于与下文详细描述的装置的其中一个开口紧邻之处(例如,通过将指尖直接按于此类开口上),以使得因穿刺而渗出的血液可引入装置内。优选地,毛细管通入具有确切体积的等渗缓冲液,从而使得样品以已知的预定稀释比率或稀释系数稀释。从稀释后的样品中提取预定体积后,将其施加至侧流装置。
[0111]
加至侧流装置的样品稀释系数及样品量随侧流装置中进行的检测种类的不同而不同。然而,稀释的目的在于,向样品中加入缓冲液,以及使得样品更加适合于下游的侧流检测中进行的分析物或生物标志物的分析。同时,样品基本上未经溶血这一做法因很大程度上避免了溶血导致的褪色,因此使得样品能够应用于通过光学方式进行读数的检测。如此,可将hct的测定整合至侧流检测中,其中,hct的测定在侧流检测条的上游部分进行,而分析物的测定在与侧流检测条相同的流动路径中的下游进行。
[0112]
对于采自人体或动物体的血样的获得和处理,目前有标准化的方法,涉及对针头、注射器、微量比色皿等的使用。此类方法为本领域技术人员所熟知。目前,最受青睐的样品类型为经肝素锂处理的全血样品。若干种含喷涂肝素锂的采血管随时能够从各种商业供应商处获得,如加拿大安大略省奥克维尔的碧迪医疗(bd)提供的bd
[0113]
样品的稀释优选为自动化稀释,目前有现成的方法和装置用于自动采取确定体积的全血,并将其引入确定体积的缓冲液,以值得以预定稀释系数稀释的未经溶血的样品。
[0114]“基底”一词指任何能够容纳供分析的全血样品的基底,优选具有均匀颜色的平坦基底,最优选纤维基底,如能够分离红血细胞和血浆且适于基本上避免样品中的红血细胞发生溶血的基于纤维素或基于玻璃纤维的过滤基底。
[0115]“血细胞比容值”或“血细胞比容水平”一词指红血细胞(rbc)在血液中所占的体积百分比(体积%)。其测量值取决于红血细胞的数量和大小,并因性别、年龄及医疗状况而异。成年男性通常为40%~54%,成年女性通常为36%~48%。由于红血细胞的目的在于将氧从肺部转运至身体组织,因此血样的血细胞比容水平(hct),即红血细胞体积百分比可作为血液输氧能力的参考点。过高或过低的hct水平可能表明存在血液疾病、缺水或其他医疗状况。异常低的hct水平可能表明存在贫血,即红血细胞总量减少,而异常高的hct水平称为红细胞增多症。
[0116]
hct的检测既可采用将hct与反射率等被测变量相关联的直接方式,也可采用将hct与hb等变量相关联且将该变量进一步与反射率等被测变量相关联的间接方式。
[0117]
本公开中的“分析物”一词指血液和血浆中任何及所有具有临床意义的分析物,如抗体、激素及蛋白质,蛋白质例如但不限于为铁蛋白、血浆钙卫蛋白、胱抑素c、降钙素原、n端脑钠肽前体、肌钙蛋白t、肌钙蛋白i以及c反应蛋白。抗体例如包括:自身抗体;针对病毒和细菌等传染原的抗体,如抗ccp抗体、抗链球菌溶血素o抗体、抗hiv抗体、抗肝炎抗体(抗hbc抗体、抗hbs抗体等);针对疏螺旋体的抗体;以及针对微生物蛋白的特异性抗体。
[0118]
本公开的第一方面涉及一种处理全血样品且确定该样品血浆成分内分析物水平的侧流检测方法,包括确定样品的血细胞比容值且在确定血浆成分内分析物水平时应用该血细胞比容值的步骤,其中,本方法包括如下步骤:
[0119]
1)以基本上不溶血的缓冲液将样品稀释至预定稀释系数,从而制得稀释样品;
[0120]
2)将稀释样品施加至侧流检测装置的基底上;
[0121]
3)自所施加的样品已被吸收于基底内的时间起,在1~600秒内拍摄基底的图像;
[0122]
4)分析图像,以从该图像中确定至少一种参数的值;
[0123]
5)将该值与针对具有已知血细胞比容值的样品获得的值相关联,以获得样品的血细胞比容值;
[0124]
6)在下游的侧流检测装置中确定分析物水平,在确定血浆中分析物水平时,应用(1)中使用的稀释系数以及(5)中获得的样品血细胞比容值。
[0125]
在以上当中,在步骤3)中拍摄图像时,优选以预定波长照射基底,其中,波长根据步骤1)中使用的稀释系数选择。
[0126]
可以使用不同光源,例如但不限于,发光二极管(led)。led可从许多不同商业供应商处获得,最常获得的颜色为红色、绿色、蓝色、黄色、琥珀色及白色。就本技术目的而言,各种颜色及红外(ir)定义如下:
[0127]
400~475nm
–
蓝色
[0128]
475~550nm
–
绿色
[0129]
550~625nm
–
黄色
[0130]
625~700nm
–
红色
[0131]
700~1000nm
–
红外
[0132]
或者,基底以白光照射,而且步骤3)中拍摄的图像利用透射预定波长的光的滤光片拍摄,其中,所透射的波长根据步骤1)中使用的稀释系数选择。当组合使用白光源及合适的滤光片时,透射包括ir在内的所需波长的光。商业供应商提供从紫外线(uv)到红外(ir)的一整套滤光片。
[0133]
样品优选以等渗缓冲液稀释至1~2500区间内的稀释系数。
[0134]
根据本方面的一种实施方式,通过手动方式进行稀释,其中,例如,从手指刺破后的血滴中将毛细管血液采集至具有预定体积的毛细管,然后将毛细管清空至内盛预定体积的缓冲液的试管中,并例如通过摇动试管而混合。然而,根据优选实施方式,稀释为自动化稀释,这表示,其最大程度减少所需的手动操作,并以高度可重复的方式进行。自动样品制备系统可通过商售获得,例如从德国的耶拿分析仪器股份公司(analytik jena ag)、德国的凯米斯彼得技术股份公司(chemspeed technologies ag)以及美国的贝克顿
·
迪金森公司(becton,dickinson&co)。在自动化稀释操作中,由装置计量预定体积的样品后,将其与预定体积的缓冲液接触,缓冲液既可以单纯为等渗缓冲液,也可以为还含有待检测分析物的特异性抗体等试剂的等渗缓冲液。自动化既可极其初级如样品采集管,也可完全自动化如上述任何公司提供的完全自动化样品制备系统。
[0135]
根据本方面的一种实施方式,a)中的血细胞比容值测定包括如下步骤:在添加稀释样品之前,拍摄基底的图像,以产生“空白”或“零”测量值。这一做法优选用于检查相机以及包括执行分析的处理器在内的分析流程是否正常运行,而“空白”或“零”测量值还可用于将基底背景值纳入考虑之中。“空白”或“零”测量的频度取决于方法的稳定性以及基底的均匀性。对于稳定的方法和/或均匀的基底而言,通过每天或甚至每周一次的“空白”或“零”测量进行仪器的校准即可。然而,有时可能需要更为频繁地进行零测量,在该情形中,可以通过在每轮实际侧流检测中添加样品之前拍摄图像,或者通过不用于患者样品的专用校准测
试进行零测量。
[0136]
根据另一实施方式,缓冲液为适于将样品保持为基本上未经溶血的形式的等渗缓冲液。本领域技术人员了解如何制备等渗的非溶血性缓冲溶液,而且此类溶液还可通过商售获得。其中一例为等渗盐水溶液,但等渗的非溶血性缓冲液一般还包括ph稳定剂,如磷酸钠或磷酸钾。作为追加方案或替代方案,可以使用乙酸盐、硼酸盐、碳酸盐、柠檬酸盐或谷氨酸盐缓冲液。可含于等渗缓冲液内的其他添加剂例如为牛血清白蛋白以及吐温20等去污剂以及叠氮化钠等防腐剂。
[0137]
稀释系数可以为适于具有临床意义的待测分析物浓度的系数。当具有临床/诊断意义的分析物浓度较高时,可使用比具有临床/诊断意义的分析物浓度较低时更高的稀释系数。稀释系数也可以为适于侧流检测要求的系数,以使得足量体积的样品迁移通过轭合物垫,与试剂反应,并迁移通过t线和c线。重要的一点是,本方法和装置可在不限制hct测定准确度的情况下实现此类稀释。
[0138]
根据可与上述实施方式自由组合的另一实施方式,缓冲液内含有能够与待测分析物形成轭合物的试剂。此类试剂例如包括但不限于对待测分析物具有特异性亲和力的抗体。优选地,此类试剂(如抗体)固定于标志物上,如胶体金纳米颗粒、有色乳胶纳米颗粒、铕颗粒等。最优选地,标志物选择为不对hct测定造成干扰的标志物,即选择为在hb或hct测量所使用的波长下无反射率或仅有极小反射率的标志物。除上述试剂之外,非溶血性缓冲液还可含有其他组分,如防腐剂、稳定剂、光学增强剂以及密度调节剂,只要其不会使得缓冲液导致全血样品的溶血即可。
[0139]
当上述试剂含于缓冲液内或含于样品垫内时,如图4和图6所示,侧流检测装置可免于设置单独的轭合物垫。如此,可使得侧流检测装置更为简单且成本更低,还使得分析物与试剂之间的反应更加高效,并有可能会提高检测的灵敏度和可重复性。相应地,根据一种替代实施方式,可将轭合物设于样品垫的一部分中,且无需设置单独的轭合物垫,从而同样简化侧流检测的实现。
[0140]
虽然不希望受理论的束缚,但本发明人认为,与在侧流检测装置中设置轭合物垫的情形相比,分析物与试剂在液体缓冲液内可更为有效地反应,而且反应完成的速度更快。有基于此,发明人认为,无需进行温育,只需测量预定体积的样品,通过将其加入一定体积的缓冲液而达到预定稀释系数(如1~2500区间内的稀释系数),摇晃或以其他方式混合样品,然后将一定体积的样品加至侧流检测基底上即可。随后,基本上立即,或至少自样品已被吸收于基底内后的前600秒之内,进行hct测量。分析物的浓度可通过在来自c线的信号指示样品已迁移通过滤层/膜层的时间点上测量来自t线的信号的方式读取。
[0141]
根据上述第一方面的一种实施方式,当稀释系数为1(无稀释)至10时,在以具有处于约600至约950nm区间的波长的光对已施加样品的基底进行照射的同时,拍摄图像。
[0142]
根据上述第一方面的另一实施方式,当稀释系数大于10但小于50时,在以具有处于约575nm至约950nm区间的波长的光对已施加样品的基底进行照射的同时,拍摄图像。
[0143]
根据上述第一方面的另一实施方式,当稀释系数为50至2500时,在以具有处于约400nm至约575nm区间的波长的光对已施加样品的基底进行照射的同时,拍摄图像。
[0144]
例如,作为上述第一方面的一种实施方式,当稀释系数处于20至100区间时,在以具有处于约535nm至约615nm区间的波长的光对已施加样品的基底进行照射的同时,拍摄图
像。
[0145]
根据上述第一方面的一种替代实施方式,当稀释系数为1(无稀释)至10时,在以白光以及透射具有处于约600nm至约950nm区间的波长的光的滤光片对已施加样品的基底进行照射的同时,拍摄图像。
[0146]
根据上述第一方面的另一替代实施方式,当稀释系数大于10但小于50时,在以白光以及透射具有处于约575nm至约950nm区间的波长的光的滤光片对已施加样品的基底进行照射的同时,拍摄图像。
[0147]
根据上述第一方面的另一替代实施方式,当稀释系数为50至2500时,在以白光以及透射具有处于约400nm至约575nm区间的波长的光的滤光片对已施加样品的基底进行照射的同时,拍摄图像。
[0148]
例如,作为上述第一方面的另一替代实施方式,当稀释系数处于20至100区间时,在以白光以及透射具有处于约535nm至约615nm区间的波长的光的滤光片对已施加样品的基底进行照射的同时,拍摄图像。
[0149]
根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,可与待测分析物轭合的试剂提供于侧流检测装置的流动路径中,如提供于侧流装置流动路径的轭合部分中,或提供于构成流动路径一部分的单独轭合物垫中。
[0150]
根据上述第一方面的可与其所有实施方式自由组合的另一实施方式,可与待测分析物轭合的试剂含于稀释缓冲液中。
[0151]
根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,4)中确定的至少一种参数为其上施加有样品的基底的反射率。
[0152]
优选地,反射率测量为图像所含像素的平均强度。
[0153]
根据上述第一方面的可与其所有实施方式自由组合的一种实施方式,自样品已被吸收于基底内的时间起,在约1至约600秒内,优选在约1至约360秒内,更优选在约1至约180秒内,最优选在约1至约90秒内拍摄图像。
[0154]
图14所示结果表明,自样品施加至基底上后的前10分钟(600秒)内,hct测量的准确度基本稳定,但自施加后的10~15分钟开始,准确度迅速下降。图15所示照片进一步表明,在前10分钟内,样品外观几乎不发生变化。
[0155]
最优选地,自样品已被吸收于基底内的时间起,在约1至约30秒内拍摄图像。判断样品是否已被吸收于基底内可通过手动方式实现,例如通过观察样品体积是否仍旧以液滴形式处于基底表面上的方式实现,或者可通过光学方式实现,例如根据反射率实现。在被吸收前,样品体积的液体表面呈现出光泽和高度反射性,但当其已被吸收后,可以看到基底的表面纹理。
[0156]
优选地,纤维基底适于基本上避免样品中的红血细胞发生溶血。举例而言,通过在基底上添加肝素,或者通过调节基底的亲水性,可对基底的溶血特性施加影响。有迹象表明,聚合物越亲水,其溶血活性越低。同样地,目前有所谓血液滤膜的商售基底,能够从血浆中分离红细胞而不会导致溶血。
[0157]
根据可与前述实施方式自由组合的另一实施方式,本方法进一步包括校准步骤,用于通过离心确定参考样品的参考血细胞比容水平。
[0158]
在替代实施方式中,本方法进一步包括校准步骤,用于通过如下方式确定参考血
细胞比容水平:首先,利用商售血红蛋白计或hicn检测法等独立的标准化方法,通过光学方式确定样品内血红蛋白的浓度;然后,将血红蛋白浓度转换为血细胞比容水平。
[0159]
本方法适用于能够从血浆成分中检测出的任何分析物,例如但不限于铁蛋白、转铁蛋白、血浆钙卫蛋白、c反应蛋白(crp)、胱抑素c、血浆降钙素原(pct)、n端脑钠肽前体、肌钙蛋白t、肌钙蛋白i及抗ccp抗体。
[0160]
本公开的另一方面涉及一种处理全血样品且确定样品血浆成分内分析物浓度的侧流检测装置,本装置适于实施根据第一方面及其任一实施方式的方法。
[0161]
本文公开的方法适用于可从血浆中检出的任何具有临床意义的分析物,例如但不限于选自铁蛋白、转铁蛋白、血浆钙卫蛋白、c反应蛋白(crp)、胱抑素c、血浆降钙素原(pct)、n端脑钠肽前体、肌钙蛋白t、肌钙蛋白i及抗ccp抗体的分析物。
[0162]
根据一种具体实施方式,分析物为铁蛋白,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗铁蛋白抗体的轭合物垫,具有至少一条固定抗铁蛋白抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0163]
在替代实施方式中,缓冲液含有与标志物轭合的抗铁蛋白抗体,而且侧流检测条中省略轭合物垫。
[0164]
根据一种具体实施方式,分析物为转铁蛋白,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗转铁蛋白抗体的轭合物垫,具有至少一条固定抗转铁蛋白抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0165]
在替代实施方式中,缓冲液含有与标志物轭合的抗转铁蛋白抗体,而且侧流检测中省略轭合物垫。
[0166]
根据一种具体实施方式,分析物为血浆钙卫蛋白,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗钙卫蛋白抗体的轭合物垫,具有至少一条固定抗钙卫蛋白抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0167]
在替代实施方式中,缓冲液含有与标志物轭合的抗钙卫蛋白抗体,而且侧流检测中省略轭合物垫。
[0168]
根据另一具体实施方式,分析物为胱抑素c,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗胱抑素c抗体的轭合物垫,具有至少一条固定抗胱抑素c抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0169]
在替代实施方式中,缓冲液含有与标志物轭合的抗胱抑素c抗体,而且侧流检测条中省略轭合物垫。
[0170]
根据侧流检测的一种具体实施方式,分析物为血浆降钙素原,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗降钙素原抗体的轭合物垫,具有至少一条固定抗降钙素原抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0171]
在替代实施方式中,缓冲液含有与标志物轭合的抗降钙素原抗体,而且侧流检测条中省略轭合物垫。
[0172]
另一实施方式为侧流检测,其中,分析物为c反应蛋白(crp),而且本装置包括配置
为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗crp抗体的轭合物垫,具有至少一条固定抗crp抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0173]
在替代实施方式中,缓冲液含有与标志物轭合的抗crp抗体,而且侧流检测条中省略轭合物垫。
[0174]
又一实施方式为侧流检测装置,其中,分析物为抗ccp抗体,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的一条或多条ccp肽的轭合物垫,具有至少一条与标志物轭合的一条或多条固定ccp肽的检测线的膜层,具有至少一条固定抗体检测线的膜层,以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0175]
在替代实施方式中,缓冲液含有与标志物轭合的一条或多条ccp肽,而且侧流检测条中省略轭合物垫。
[0176]
另一实施方式为根据第二方面的侧流检测装置,其中,分析物为n端脑钠肽前体,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗n端脑钠肽前体抗体的轭合物垫,具有至少一条固定抗n端脑钠肽前体抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0177]
在替代实施方式中,缓冲液含有与标志物轭合的抗n端脑钠肽前体抗体,而且侧流检测中省略轭合物垫。
[0178]
另一实施方式为根据第二方面的侧流检测装置,其中,分析物为肌钙蛋白t,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗肌钙蛋白t抗体的轭合物垫,具有至少一条固定抗肌钙蛋白t抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0179]
在替代实施方式中,缓冲液含有与标志物轭合的抗肌钙蛋白t抗体,而且侧流检测中省略轭合物垫。
[0180]
另一实施方式为根据第二方面的侧流检测装置,其中,分析物为肌钙蛋白i,而且本装置包括配置为容纳以缓冲液稀释的全血样品的基底,含与标志物轭合的抗肌钙蛋白i抗体的轭合物垫,具有至少一条固定抗肌钙蛋白i抗体检测线的膜层以及吸收垫,基底、轭合物垫、膜层以及吸收垫构成侧流路径。
[0181]
在替代实施方式中,缓冲液含有与标志物轭合的抗肌钙蛋白i抗体,而且侧流检测中省略轭合物垫。
[0182]
其他方面涉及一种处理器,配置为根据针对已知血细胞比容水平获得的反射率存储值,将反射率值转换为血细胞比容水平。此外,该处理器配置为在全血样品已经过分析的情况下计算血浆中存在的另一分析物的值时将样品的血细胞比容水平考虑在内。该处理器由能够执行存储于存储器内且因而可以为计算机程序产品的软件指令的合适的中央处理单元(cpu)、多处理器、微控制器、数字信号处理器(dsp)、专用集成电路等当中的一者或多者的任何组合实现。该处理器可配置为执行本文公开的方法,如下附权利要求所限定的方法当中的任何一种。
[0183]
上述存储器可以为随机存取存储器(ram)和只读存储器(rom)的任何组合。该存储器还包括永久存储器,其例如可以为磁存储器、光存储器、固态存储器或甚至远程安装存储器当中的任何一者或任何组合。
[0184]
此外,还提供数据存储器,用于在软件指令在处理器内执行的过程中读取和/或存储数据。该数据存储器可以为随机存取存储器(ram)和只读存储器(rom)的任何组合。
[0185]
本文公开的侧流检测装置和/或系统可进一步包括用于与其他外部实体通信的i/o接口。可选地,该i/o接口进一步包括用户界面。
[0186]
为了不使本文提出的概念变得费解,此类装置的其他部件省略。
[0187]
令人惊异的是,血浆中存在的上述分析物能够在应用于侧流检测的全血样品中得到准确测量,而且在不涉及稀释系数的情况下,可以对hct差异进行校正。本文公开的方法和装置在诊断领域,尤其即时医疗情形中提供多项益处。
[0188]
本文公开的方法的一项重要优点在于,其不依赖于使用任何试剂进行hct和/或hb测定。如此,不但使分析得到简化,而且降低了成本。另外,考虑到hb测量中最常用的试剂为铁氰化钾和氰化钾这两种剧毒化学品,其还降低了风险。
[0189]
消除铁氰化钾和氰化钾等试剂带来一项额外优点,即由于此类及其他试剂易于吸收水分且/或与检测中的其他成分反应,因此侧流检测装置在存放过程中变得更为稳定,而且可在更长保质期下获批。
[0190]
另一项优点为快速响应时间,其使得在医生或诊所处筛查献血者等过程中,便可获得结果。快速响应时间还使得hb和hct测定能够整合至用于确定血浆中其他分析物浓度的检测中,并可实现hct差异的校正。本发明人已证明,与使用平均hct(针对总人口的平均值或针对患者性别的平均值)的测量相比,如此可显著提高全血样品血浆成分内存在的分析物的测量精度。与根据患者的性别、年龄,并可能进一步根据健康状况对hct进行估计的方法相比,hct综合测量的可靠性显著提升。此外,与以外部设备进行单独分析后手动校正分析物测量值的情形相比,hct综合测量同样更为可靠。
[0191]
除此之外的另一项优点在于,与需要对样品进行长时间干燥的现有技术方法相比,即时测量有助于避免样品混淆,避免患者长时间等待,或者在自动化方法的情形中,实现更高的吞吐量。
[0192]
除了快速和简单之外,本文公开的方法还具有令人惊异的准确性。根据发明人迄今为止的经验,准确度约为
±
7g/l hb或约为
±
2% hct。
[0193]
另一项优点在于,相机传感器技术或者任何其他适于此间目的的检测器装置相对较为便宜并且易于获得,从而使得采用本发明构思的分析装置在搭建上较为经济。作为另一项重要优点,本发明还非常适于自动化。相机传感器可适于读取用于量化hct的参数以及用于量化分析物(t线)及对照物(c线)浓度的相同或不同参数。
[0194]
如第一方面的具体实施方式中所述,既可在以具有预定波长的光(或ir)对样品进行照射的同时,也可在结合使用透射所需波长的光的滤光片的情况下以白光照射的同时,拍摄图像。这一替代方式在构造用于侧流检测的读取器方面提供了极大的灵活性。
[0195]
一项尤为重要的优点在于,由于允许对全血样品进行稀释,因此hct测定可成为任何侧流检测的组成部分,从而避免需要多个步骤,或将样品分割后单独处理,或分别进行多项单独检测。
[0196]
举例而言,当样品应用于从血浆中分离红血细胞的所谓血液滤膜时,本文公开的方法还可作为样品制备中的单独步骤,且作为检测装置内样品处理的初始步骤,整合至现有和未来临床分析方法中,或者与其同时或依次执行。在这一情形中,一项显著的优点在
于,波长区间(范围),尤其400nm至950nm这一区间能够等同应用于所有能够从血浆中分离红血细胞的纤维基底。hct的测定无需对血液进行溶血也是一项优点,这是因为如此使得本方法能够整合至不希望发生溶血的检测中,不希望发生溶血的原因在于血浆的褪色会对结果的读取造成干扰,或者在于溶血会释放出对分析物或试剂造成干扰的物质,从而有损于检测。
[0197]
此外,处理全血样品的能力消除了对血浆的分离或提取等准备步骤的需求,并使得本方法和检测非常适合于即时医疗用途。本方法和装置还使得能够根据每种分析物的具有生理及临床意义的浓度或参考浓度进行样品的稀释,从而使得能够在针对特定分析物对每项检测进行精调的同时,依据将hct的个体差异考虑在内的能力而保持高准确度。
[0198]
实施例
[0199]
实施例1:基于侧流的铁蛋白定量检测
[0200]
材料和方法
[0201]
实施例中使用的通用侧流检测结构示于图7和图8。
[0202]
通过将人肝铁蛋白(代码:p103-7,bbi解决方案(bbi solutions))稀释于由10mm tris-hcl、140mm nacl、1ml/l proclin 950及1% bsa组成且ph=7.4的缓冲液中而制备铁蛋白标准品(60ng/ml、120ng/ml、180ng/ml、240ng/ml、300ng/ml、360ng/ml、420ng/ml、480ng/ml、540ng/ml、600ng/ml,以及1ng/ml、10ng/ml、100ng/ml、1000ng/ml)。
[0203]
抗铁蛋白抗体(igg)得自bbi解决方案(铁蛋白pab代码:bp230-3),并利用英国伊克斯派德恩有限公司(expedeon ltd.)的铕轭合试剂盒且按照制造商方案制备与抗铁蛋白抗体轭合的铕。使用约2.3
×
10e10个铕颗粒/ml(0.01%)的溶液,并将其保存于含2mm硼酸盐、10%海藻糖及1ml/l proclin 950且ph=9.5的缓冲液内。通过将玻璃纤维垫(gfcp203000,默克密理博有限公司(millipore/merck kgaa),德国)浸泡于上述溶液且随后在烘箱中37℃下干燥过夜,制备轭合物垫(2)。
[0204]
在第二例中,以与抗人铁蛋白抗体轭合的胶体金制备轭合物垫。其中,按照制造商方案,将金纳米颗粒(20od 80nm gold金轭合试剂盒,伊克斯派德恩有限公司,英国)与抗铁蛋白抗体(bbi解决方案,代码:bp230-3)轭合。轭合后的纳米颗粒以由2mm硼酸盐、10%海藻糖以及1ml/l proclin 950组成且ph=9.5的缓冲液稀释至1.1
×
10e10个颗粒/ml(od=1)。通过将玻璃纤维垫(gfcp203000,默克密理博有限公司,德国)浸泡于上述溶液且随后在烘箱中37℃下干燥过夜,制备轭合物垫(2)。
[0205]
在第三例中,以与抗人铁蛋白抗体轭合的有色乳胶微珠制备轭合物垫。其中,按照制造商方案,将黑色乳胶微珠(400nm黑色乳胶轭合试剂盒,伊克斯派德恩有限公司,英国)与抗铁蛋白抗体(bbi解决方案,代码:bp230-3)轭合。轭合后的乳胶微珠以由2mm硼酸盐、10%海藻糖以及1ml/l proclin 950组成且ph=9.5的缓冲液稀释至约2.8
×
10e9个颗粒/ml(0.01%)。通过将玻璃纤维垫(gfcp203000,默克密理博有限公司,德国)浸泡于上述溶液且随后在烘箱中37℃下干燥过夜,制备轭合物垫(2)。
[0206]
通过将选自两种不同玻璃纤维滤膜(lf1和mf1,均来自通用电气健康护理)的样品垫(1),轭合物垫(2)以及吸收垫(6)贴至衬膜背板(10)上而制成侧流检测条,衬膜背板上预先贴有选自两种不同硝酸纤维素膜(hi-flow plus 90(hf090mc100)以及hi-flow plus 180(hf180mc100),均来自默克密理博有限公司,德国)的膜层(3),其中,90和180表示芯吸
速率,即液体在膜层中行进4cm所花的时间为90或180秒。为了确保良好的芯吸效果,不同组成部分在组装时形成约2mm的重叠。
[0207]
使用印度mdi膜技术有限公司(mdi membrane technologies ltd.)的easy printer
tm
在膜层(3)上印制检测线(4)和对照线(5),其中,检测线(4)使用1mg/ml的抗铁蛋白抗体(igg)溶液,对照线(5)使用1mg/ml的抗igg抗体(山羊抗兔igg抗体,西格玛奥德里奇(sigma aldrich),代码:sab3700883-2mg)溶液。膜层和衬膜背板在烘箱中37℃下干燥过夜后,喷洒封闭液(superblock
tm
t20(tbs)封闭缓冲液,代码:37536,赛默飞世尔科技(thermo fisher scientific)),并在37℃下再干燥2个小时。如此,获得如图7所示的中间产品。
[0208]
使用裁纸刀裁切约4mm宽且约60mm长的细条,并将这些细条放入如图8所示的塑料壳体中。塑料壳体(200)具有暴露出部分样品垫(1)的点样口(201)以及暴露出检测线(4)和对照线(5)的窗口(202)。
[0209]
1.1肝铁蛋白标准品
[0210]
使用自动移液管将10μl的每一标准品在由100mm tris-hcl、50mm nacl、1.5%吐温、1% bsa组成且ph=7.4的检测缓冲液中预先稀释至最终体积。将75μl的预先稀释的标准品添加至样品垫。
[0211]
在以轭合有抗人铁蛋白抗体的铕微珠进行检测时,以在约365nm处产生光的紫外led照射膜层,并以配备二向色滤光片的ccd传感器在约610nm处测量发射光。5分钟后读数。结果表明,在100ng/ml这一有意义的浓度区间,获得良好的灵敏度。
[0212]
在以轭合有抗人铁蛋白抗体的金纳米颗粒进行检测时,以在约525nm处产生光的led照射膜层,并以ccd传感器捕获反射光。5分钟后读数。初步结果表明,在100ng/ml这一有意义的浓度区间,获得良好的灵敏度。
[0213]
在以轭合有抗人铁蛋白抗体的有色乳胶微珠进行检测时,以在约525nm处产生光的led照射膜层,并以ccd传感器捕获反射光。5分钟后读数。初步结果表明,在100ng/ml这一有意义的浓度区间,获得良好的灵敏度。
[0214]
检测线强度与浓度几乎呈线性相关。此外,可以注意到,对照线几乎保持不变,从而表明检测颗粒不太可能发生显著聚集。
[0215]
1.2血样—仅检测铁蛋白
[0216]
从健康志愿者获得全血样品后,以本文公开的的侧流检测法进行检测。将血样(10μl)预先稀释于90μl的检测缓冲液(70mm tris-hcl、80mm nacl、1%吐温20、1%bsa及0.01%proclin 950,ph=7.4)中后,以自动移液管移至样品垫(mf1,通用电气健康护理)。5分钟后,以ccd相机评价检测线和对照线的强度。
[0217]
在以轭合有抗人铁蛋白抗体的铕微珠进行检测时,以在约365nm处产生光的紫外led照射膜层,并以配备二向色滤光片的ccd传感器在约610nm处测量发射光。该样品中的血浆铁蛋白浓度以临床化学分析仪architect c4000(雅培核心实验室(abbot core laboratory),雅培科技园(abbot park),伊利诺伊州,美国)通过朗道(randox)铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0218]
在以轭合有抗人铁蛋白抗体的金纳米颗粒进行检测时,以在约525nm处产生光的led照射膜层,并以ccd传感器捕获反射光。该样品中的血浆铁蛋白浓度以architect c4000通过朗道铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0219]
在以轭合有抗人铁蛋白抗体的有色乳胶微珠进行检测时,以在约525nm处产生光的led照射膜层,并以ccd传感器测量反射光。该样品中的血浆铁蛋白浓度以architect c4000通过朗道铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0220]
1.3血样—以同一测试条同时检测hb和铁蛋白
[0221]
从健康志愿者获得全血样品后,以本文公开的的侧流检测法进行检测。将血样(10μl)预先稀释于90μl的检测缓冲液(70mm tris-hcl、80mm nacl、1%吐温20、1%bsa及0.01%proclin 950,ph=7.4)中后,以自动移液管移至样品垫(mf1)。
[0222]
样品施加后,立刻在加样窗口中读取hb水平。纸条以暖led聚光灯(约2800~3000k)照射,并以cmos传感器测量反射光(如图1示意图所示)。
[0223]
hb读取后5分钟,以ccd相机评价铁蛋白检测线和对照线的强度。该样品的hb以手动朗道法、都氏试剂以及hemocue 201的平均值确定。
[0224]
在以轭合有抗人铁蛋白抗体的铕微珠进行检测时,以在约365nm处产生光的紫外led照射膜层,并以配备二向色滤光片的ccd传感器在约610nm处测量发射光。该样品中的血浆铁蛋白浓度以architect c4000通过朗道铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0225]
在以轭合有抗人铁蛋白抗体的金纳米颗粒进行检测时,以暖led聚光灯(约2800~3000k)照射膜层,并以cmos传感器测量反射光。该样品中的血浆铁蛋白浓度以architect c4000通过朗道铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0226]
在以轭合有抗人铁蛋白抗体的有色乳胶微珠进行检测时,以在约525nm处产生光的led照射膜层,并以ccd传感器测量反射光。该样品中的血浆铁蛋白浓度以architect c4000通过朗道铁蛋白免疫分析法(https://www.randox.com/ferritin/)评价。
[0227]
实施例2:hct对铁蛋白测量的影响
[0228]
组装一种包括基于玻璃纤维的样品垫,以及与其流体连接的含抗铁蛋白抗体的轭合物垫和下游处于过滤介质上的固定抗铁蛋白抗体或片段的侧流检测装置,并对其进行测试。在将预先稀释的全血样品施加于样品垫后的1~10秒内,对血样的反射率进行测量,并根据这一读数,计算血细胞比容体积比例。
[0229]
在温育约5分钟的时间后,读取血浆铁蛋白浓度,并在考虑之前计算的样品hct的同时,提供该铁蛋白浓度。考虑到男性和女性hct的正态分布(处于亨尼
·h·
比利特(1990年,同上)给出的区间内),以实测hct代替各性别的平均值或所有患者的平均值,可提高大多数患者的准确性。
[0230]
实施例3:血浆钙卫蛋白
[0231]
血浆和血液中的钙卫蛋白是炎症和感染的有用生物标志物,如果poc检测能够确定全血样品中的钙卫蛋白,则将会成为一项显著的进步。然而,其中,由于hct差异会影响供检测使用的血浆量,因此将正确的hct考虑在内这一点变得极为重要。在一种理论示例中,发明人认为在成年男性和女性正常范围内的高或低hct值情形中,1.5mg/l这一血浆中钙卫蛋白值可能存在显著的低估和高估。
[0232]
如下表所示,对于具有处于正常hct范围内的高hct的男性患者而言,1.5mg/ml这一真正的血浆内钙卫蛋白值将显示为1.30mg/l。与此相反,对于具有低hct的患者而言,该值将被显著高估——具有低hct的男性患者为1.70mg/l;具有低hct的女性患者为1.66mg/
l。此类误差可能会导致诊断错误。
[0233]
对于hct值处于正常范围之外的患者,此类误差将会更加显著。
[0234]
表1:hct水平对血浆钙卫蛋白测定的影响
[0235][0236]
上述数据在使用配备用于分离血浆且用于允许进行即时hct测量的玻璃纤维滤膜的侧流检测平台的后续实际实验中得到证实。
[0237]
钙卫蛋白为可能适于中等程度稀释(稀释因子例如为10~50)的分析物一例。
[0238]
实施例13展现了稀释程度与照射光颜色(ir/红色/绿色/蓝色)对基于图像的反射率测量的hb测定能力的影响。
[0239]
实施例4:胱抑素c
[0240]
胱抑素c为一种小蛋白,其具有作为肾功能的另一标志物的碱性等电点。将胱抑素c用作肾功能标志物的理由与肌酐的基本逻辑相同。由于胱抑素c既不会得到分泌,也不会返回血流,而是被肾小管上皮细胞重新吸收并随后降解,因此其避免了肌肉质量、年龄或性别等会使其他内源性标志物的使用变得复杂的非肾作用因素。
[0241]
已经证明,胱抑素c水平的升高与所有原因导致的死亡的风险的升高相关,而且五档胱抑素c水平当中最高的一档(≥1.29mg/l)与多因素校正后心血管原因、心肌梗塞及中风导致的死亡的风险的显著升高相关。经总结确定,与肌酐相比,胱抑素c更加能够预测老年人的死亡和心血管事件风险(希普莱克(shiplak)等人,2005年)。
[0242]
发明人认为,在成年男性和女性正常范围内的高或低hct值情形中,血浆中胱抑素c值可能存在显著的低估和高估。如下表2所示,1.03mg/ml这一真正的血浆中值对于具有处于正常hct范围内的高hct的男性患者而言显示为0.89mg/l,对于具有处于正常hct范围内的高hct的女性患者而言显示为0.92mg/l。与此相反,对于具有低hct的患者而言,该值将被显著高估。此类误差可能会导致诊断错误。
[0243]
对于未确诊的异常者,即具有极低hct或极高hct的患者而言,其血浆胱抑素c值的测量将极不准确,而且肾小球滤过率也无法准确估算。
[0244]
表2:hct水平对胱抑素c测定的影响
[0245][0246]
[0247]
实施例5:铁蛋白
[0248]
众所周知,血浆中的铁蛋白浓度反应体内铁储备量的大小。在针对各种人群的大规模铁状态调查中,已对铁蛋白进行了研究。除此之外还发现,铁蛋白在临床铁代谢疾病的评估方面具有使用价值。在单纯性缺铁性贫血的诊断方面,低血浆铁蛋白水平具有较高的预测价值。血液中铁蛋白的正常范围为每毫升20至500纳克(成年男性)以及每毫升20至200纳克(成年女性)。最近,有人将铁蛋白与血红蛋白比率作为预测晚期非小细胞肺癌患者(nsclc)生存率的有用工具。作为一种潜在的肿瘤进展参数,铁蛋白与血红蛋白比率为晚期nsclc患者总体生存率的重要预后因素,与晚期nsclc患者的生存时间直接相关(李洙京(sookyung lee)等人,2019年)。
[0249]
发明人认为,血浆中铁蛋白及所有生物标志物的测量在很大程度上取决于血细胞比容,而且在成年男性和女性正常范围内的高或低hct值情形中,铁蛋白浓度可能存在显著的低估和高估。这一点随着铁蛋白浓度的新的诊断应用的出现而变得愈加重要。下表所示为hct差异对铁蛋白测量的影响。
[0250]
表3:hct水平对血浆(肝)铁蛋白测定的影响
[0251][0252]
发明人认为,对于具有低hct的患者,血浆铁蛋白值会被高估,而对于具有高hct的患者,血浆铁蛋白值会被低估,从而可能导致低铁蛋白值被忽视。
[0253]
本发明人通过实验对其上述设想进行了检验。其中,以17
×
5mm样品垫(vf2,通用电气健康护理),8
×
5mm轭合物释放垫(8964玻璃纤维膜层,奥斯龙-明士克公司(ahlstrom-ab)),25
×
5mm硝酸纤维素膜(cn180,25mm,赛多利斯(sartorius))以及17
×
5mm吸收垫(17mm grade 222,奥斯龙-明士克)组装侧流检测条。轭合物释放垫预先以80nm金轭合物(innovacoat gold 80nm,伊克斯派德恩有限公司)处理。在将金颗粒施加于轭合物垫上前,根据制造商说明书将金纳米颗粒与多克隆兔抗人铁蛋白抗体(产品编号:bp230-3,bbi解决方案)轭合,并将其在含2mm硼酸盐、10%蔗糖及1ml/l叠氮化钠(10%溶液)且ph=9.5的缓冲液中最终稀释至od=20。轭合物施加量为5μl/cm。检测线(t线)以浓度为0.7mg/ml的相同多克隆兔抗人铁蛋白抗体印制于硝酸纤维素上,印制量为5μl/cm。对照线(c线)以浓度为1mg/ml的山羊抗兔igg抗体(产品编号:sab3700883,西格玛(sigma))印制,印制量为5μl/cm。测试条壳组装于壳体(因普拉斯特公司(inplastor ab))内。
[0254]
从健康志愿者获得血样后,利用该血样,通过将红血细胞(rbc)成分与血浆成分以不同比例混合而制备具有不同血细胞比容水平(hct)的五份不同的等分血样。所有样品中的血浆铁蛋白浓度相等。每一样品的hct水平通过离心法(haematokrit 200离心机,安德烈
亚斯海蒂诗两合公司(andreas hettich gmbh&co.kg),图特林根,德国)确定,hb水平通过hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定。hct水平处于约38%~约52%范围。将12.5μl的全血样品与87.5μl不导致rbc溶血的缓冲液(0.1m tris-hcl、0.05m nacl、1% bsa及1%吐温20,ph=7.4)混合后,以移液管将75μl的血样/缓冲液混合物移至vf2样品垫上,并在样品被吸收于基底内后,读取hct。
[0255]
15分钟后,以cube读取器(奥普瑞垦光学技术开发有限公司(optricon gmbh),柏林,德国)测量t(检测)线和c(对照)线强度。每一hct水平进行10次重复测量,总进行50次测量。t线和c线强度以奥普瑞垦的cube读取器软件(平均函数)分别定量。50次测量中的每次测量均对t/c比率进行定量。t/c比率与样品的铁蛋白水平相关。在不考虑hct水平差异的情况下,t/c比率的精度计算为cv=12.5%。在考虑所确定的hct水平的情况下,精度提高至cv=10.6%,从而表明,hct水平差异的定量和校正改善了总体检测精度。这表明,对于需对血浆蛋白质进行准确定量的全血侧流检测,正确的hct测定和校正能够增加额外的价值。
[0256]
实施例6:pct—血浆降钙素原
[0257]
在另一理论示例中,发明人认为,在成年男性和女性正常范围内的高或低hct值情形中,0.15μg/l这一血浆降钙素原值可能存在显著的低估和高估。如下表所示,对于具有处于正常hct范围内的高hct的患者而言,0.15μg/l这一真正的血浆内值将显示为0.13μg/l。与此相反,对于具有低hct的患者而言,该值将被显著高估(0.17μg/l)。此类误差可能会导致诊断错误。
[0258]
对于hct值处于正常范围之外的患者,此类误差将会更加显著。
[0259]
表4:hct水平对血浆降钙素原测定的影响
[0260][0261]
一般注意事项(根据梅奥诊所实验室(mayo clinic laboratories)的资料):对于72小时以上的儿童以及成人,当水平低于0.15ng/ml时,不会诊断为严重的细菌感染。当降钙素原(proct)处于0.15和2.0ng/ml之间时,由于局部感染(无全身症状)可能会与此类低水平相关,因此不能排除感染。当水平高于2.0ng/ml时,则强烈表明存在全身性细菌感染/脓毒症或严重的局部细菌感染,如严重的肺炎、脑膜炎或腹膜炎。此外,此类高水平也可在严重的非感染性炎症刺激之后出现,如严重烧伤、严重创伤、急性多器官衰竭或较大的腹部或心胸手术。在非感染性水平升高的情形中,proct水平应在24至48小时后开始下降。
[0262]
自身免疫性疾病、慢性炎症过程、病毒感染以及轻度局部细菌感染鲜少会导致proct水平升至0.5ng/ml以上。
[0263]
实施例7:c反应蛋白(crp)
[0264]
在该理论示例中,发明人认为,在成年男性和女性正常范围内的高或低hct值情形中,5mg/l这一血浆内crp值可能存在显著的低估和高估。如下表所示,对于具有处于正常hct范围内的高hct的男性患者而言,5mg/ml这一真正的血浆内值将显示为4.34mg/l。与此
或零测量基底;加入“低hct”样品的相同基底;以及加入“高hct”样品的相同基底。正方形的白色轮廓线表示置于加样区域中心的roi方块(大小为1000
×
1000像素)。图9b所示为将稀释样品施加至样品垫且将流动路径封于塑料壳体内的装置的相应图像,其中,样品“框于”加样孔内。
[0276]
每一血样图像以三个未添加任何样品的mf1样品垫(所谓的空白基底)的平均图像进行校正(逐像素划分)。从图像中央部分提取平均像素值后,将背景校正后的roi方块内平均像素强度(800nm处)与所设置的hct值相关联。
[0277]
对于每一样品,均分别计算空白、高hct样品以及低hct样品的平均像素强度、“平均值的平均值”以及与平均值的标准差,并确定每一基底的cv(%)。所评价的基底样品示于表6,同时示出所得结果,该结果的形式为高和低hct样品值之间的差异以及平均标准差。前一参数表示基底的区分能力,后一参数表示结果的重现性。
[0278]
表6:不同基底的评价
[0279][0280]
随后,对gfdva和mf1基底进行扩展评价。每一种类型的基底均制备25枚测试条(见上)。此外,制备以下五种不同的血样:h1(hct=31.3%且hb=101g/l);h2(hct=37.5%且hb=122g/l);h3(hct=44.6%且hb=145.5g/l);h4(hct=51.7%且hb=168g/l);h5(hct=58.0%且hb=187.5g/l)。这些样品跨越有生理意义的hct水平(约25~60%)。通过将血样和等渗追踪缓冲液以12.5μl血样/87.5μl缓冲液这一比率混合,制备数量上足以供五次检测所用的样品。
[0281]
由于gfdva具有更大的体积容量,因此在实验中,mf1基底上加75μl的上述混合物,gfdva基底上加150μl的上述混合物。针对每一hct水平,共进行5次检测,并且按照与其他实施例一致的方式进行图像的拍摄和分析。
[0282]
实施例9:mf1基底与稀释系数=4的评价
[0283]
以17
×
5mm样品垫(mf1,通用电气健康护理),7
×
5mm轭合物释放垫(gfcp203000,默克密理博),25
×
5mm硝酸纤维素膜(hi-flow plus 90,默克密理博)以及17
×
5mm吸收垫(cfsp001700,默克密理博)组装侧流检测条。从健康志愿者获得血样后,通过将红血细胞
(rbc)成分与血浆成分以不同比例混合而制备具有不同血细胞比容水平(hct)的五份更小的等分血样。
[0284]
每一样品的hct水平通过离心法(haematokrit 200离心机,安德烈亚斯海蒂诗两合公司,图特林根,德国)确定,而且hb水平以hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定。hct水平处于约25%~约55%范围。在每次测量中,均将25μl全血样品与75μl不会导致rbc溶血的缓冲液(0.1m tris-hcl、0.05m nacl、1% bsa以及1%吐温20,ph=7.4)混合。以移液管将75μl的这一血样/缓冲液混合物移至mf1样品垫上后,立刻拍摄图像。与上述一致,针对每一hct水平,均进行五次重复检测(即n=5)。该玻璃纤维滤膜样品垫的图像以配备vzm 100i视频镜头(埃德蒙光学)以及800nm光学带通滤波器(fb800-10,索雷博)的pixelink pl-d795mu-5mp单色相机(5mp,2/3传感器)拍摄。
[0285]
图像拍摄为无伽马校正的16比特tif(2048
×
2448像素)图像。曝光时间设置为1500ms。两个色温约为2700k的50w led聚光灯用于照射。图像分析以r软件进行,其中,将roi方块(大小为1000
×
1000像素)置于样品中心,并计算方块中的平均像素值。每一血样图像以三个未添加任何样品的mf1样品垫(所谓的空白基底)的平均图像进行校正(逐像素划分)。背景校正后的roi方块内平均像素强度(800nm处)与所设置的hct值相关联。在本实施例中,将二次多项式拟合至测量值(见图10)。
[0286]
该二次多项式的反函数用作根据平均像素强度预测hct水平的模型。经发明人计算,通过将该预测模型运用至按上述方式获得的图像得到的预测hct水平与所确定的水平的偏离cv对应于13.8%(见图11)。
[0287]
实施例10:mf1基底与稀释系数=8的评价
[0288]
以17
×
5mm样品垫(mf1,通用电气健康护理),7
×
5mm轭合物释放垫(gfcp203000,默克密理博),25
×
5mm硝酸纤维素膜(hi-flow plus 90,默克密理博)以及17
×
5mm吸收垫(cfsp001700,默克密理博)组装侧流检测条。从健康志愿者获得血样后,通过将红血细胞(rbc)成分与血浆成分以不同比例混合而制备具有五种不同血细胞比容水平(hct)的五等分血样。
[0289]
每一样品的hct水平通过离心法(haematokrit 200离心机,安德烈亚斯海蒂诗两合公司,图特林根,德国)确定,而且hb水平以hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定。hct水平处于约30%~约60%范围。在每次测量中,均将12.5μl全血样品与87.5μl不会导致rbc溶血的缓冲液(0.1m tris-hcl、0.05m nacl、1% bsa以及1%吐温20,ph=7.4)混合。以移液管将75μl的这一血样/缓冲液混合物移至mf1样品垫上后,立刻拍摄图像。与上述一致,针对每一hct水平,均进行五次重复检测(即n=5)。该玻璃纤维滤膜样品垫的图像以配备vzm 100i视频镜头(埃德蒙光学)以及800nm光学带通滤波器(fb800-10,索雷博)的pixelink pl-d795mu-5mp单色相机(5mp,2/3传感器)拍摄。
[0290]
图像拍摄为无伽马校正的16比特tif(2048
×
2448像素)图像。曝光时间设置为1500ms。两个色温约为2700k的50w led聚光灯用于照射。图像分析以r软件进行,其中,将roi方块(大小为1000
×
1000像素)置于样品中心,并计算方块中的平均像素值。每一血样图像以三个未添加任何样品的mf1样品垫(所谓的空白基底)的平均图像进行校正(逐像素划分)。背景校正后的roi方块内平均像素强度(800nm处)与所设置的hct值相关联。在本实施例中,将二次多项式拟合至测量值(见图12)。
[0291]
该二次多项式的反函数用作根据平均像素强度预测hct水平的模型。经发明人计算,通过将该预测模型运用至按上述方式获得的图像得到的预测hct水平与所确定的水平的偏离cv对应于8.3%(见图11)。此外,编号为5的测量值似乎为异常值,其可能原因在于相机的技术问题。当将编号为5的测量值舍弃之后,cv改善至7.4%。
[0292]
实施例11:mf1基底与稀释系数=4的延时拍摄测量
[0293]
以17
×
5mm样品垫(mf1,通用电气健康护理),7
×
5mm轭合物释放垫(gfcp203000,默克密理博),25
×
5mm硝酸纤维素膜(hi-flow plus 90,默克密理博)以及17
×
5mm吸收垫(cfsp001700,默克密理博)组装侧流检测条。从健康志愿者获得血样后,通过将红血细胞(rbc)成分与血浆成分以不同比例混合而制备具有五种不同血细胞比容水平(hct)的五等分血样。
[0294]
每一样品的hct水平通过离心法(haematokrit 200离心机,安德烈亚斯海蒂诗两合公司,图特林根,德国)确定,而且hb水平以hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定。所制备的其中一个样品用于样品图像的延时拍摄研究。样品通过将25μl的全血与不会导致rbc溶血的缓冲液(0.1m tris-hcl、0.05m nacl、1% bsa以及1%吐温20,ph=7.4)混合的方式制备。75μl的这一血样/缓冲液混合物通过移液管移至mf1样品垫上。
[0295]
样品图像以配备vzm 100i视频镜头(埃德蒙光学)以及800nm光学带通滤波器(fb800-10,索雷博)的pixelink pl-d795mu-5mp单色相机(5mp,2/3传感器)拍摄。图像拍摄为无伽马校正的16比特tif(2048
×
2448像素)图像。曝光时间设置为1500ms。两个色温约为2700k的50w led聚光灯用于照射。图像分别在t=0分钟、3分钟、5分钟、7分钟、10分钟、13分钟、15分钟、18分钟、20分钟、23分钟、25分钟、28分钟及30分钟时拍摄。图像分析以r软件进行,其中,将roi方块(大小为1000
×
1000像素)置于样品中心,并计算方块中的平均像素值。每一血样图像以三个未添加任何样品的mf1样品垫(所谓的空白基底)的平均图像进行校正(逐像素划分)。在本实施例中,以如结合图10和图12所述将平均像素强度与hct水平相关联的预测模型预测血样的相应hct水平。
[0296]
可以清楚地看到,随着样品老化,预测hct水平随时间推移而下降。这一点示于图14中。在前10分钟内,所确定的血细胞比容水平略有下降,预测值下降3.2%。在10和15分钟之间,下降加速,而且在15分钟之后,预测值急速下降。该值在15分钟时为7.2%,低于t=0时的值,而且在30分钟之后,下降率对应于57.6%。如结合图11和图13所述,该hct预测模型的预测能力在血样/缓冲液混合物施加于样品垫(mf1)上后大约保持10分钟。10分钟以后,样品开始干化,样品在样品垫上的外观也发生变化(见图14),而且模型所预测的hct水平似乎也越来越低。
[0297]
实施例12:轭合物在缓冲液内混合(无轭合物垫)
[0298]
以24
×
5mm样品垫(mf1,通用电气健康护理),25
×
5mm硝酸纤维素膜(cn180,25mm,赛多利斯)以及17
×
5mm吸收垫(17mm grade 222,奥斯龙-明士克)组装侧流检测条。以浓度为0.7mg/ml的多克隆兔抗人铁蛋白抗体(产品编号:bp230-3,bbi解决方案)在硝酸纤维素膜上印制检测线(t线),印制量为5μl/cm,并且以浓度为1mg/ml的山羊抗兔igg抗体(产品编号:sab3700883,西格玛)印制对照线(c线),印制量为5μl/cm。测试条示意图如图4和图6所示。
[0299]
各测试条组装于与图8所示壳体相似但不完全相同的壳体(因普拉斯特公司,瑞
典)内。根据制造商说明书,将金纳米颗粒(innovacoat gold 80nm,伊克斯派德恩有限公司)与多克隆兔抗人铁蛋白抗体(产品编号:bp230-3,bbi解决方案)轭合。轭合物在含0.1m tris-hcl、0.05m nacl、1% bsa及1%吐温20且ph=7.4的样品缓冲液中稀释至od=0.6。
[0300]
从健康志愿者获得血样后,通过将红血细胞(rbc)成分与血浆成分以不同比例混合而制备具有不同血细胞比容水平(hct)的五份不同血样。所有样品中的血浆铁蛋白浓度相等。每一样品的hct水平通过离心法(haematokrit 200离心机,安德烈亚斯海蒂诗两合公司,图特林根,德国)确定,hb水平通过hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定。hct水平处于约38%~约52%范围。
[0301]
将20μl的全血样品与140μl不导致rbc溶血的样品缓冲液(0.1m tris-hcl、0.05m nacl、1% bsa及1%吐温20,ph=7.4,金轭合物od=0.6)混合后,以移液管将100μl的血样/缓冲液混合物移至mf1样品垫上。15分钟后,以cube读取器(奥普瑞垦光学技术开发有限公司,德国)测量t线和c线强度。每一hct水平进行10次重复测量,总进行50次测量。t线和c线强度以奥普瑞垦的cube读取器软件(平均函数)分别定量。50次测量中的每次测量均对t/c比率进行定量。t/c比率与样品的铁蛋白水平相关。在不考虑hct水平差异的情况下,t/c比率的精度计算为cv=12.5%。在考虑所确定的hct水平的情况下,精度提高至cv=10.6%,从而表明,hct水平差异的定量和校正改善了总体检测精度。
[0302]
发明人认为,当进一步改善方法,例如,当以自动化设备,而非当前测试条制备所使用的手动方式,惯例性地制造侧流检测条时,还可实现精度的进一步提高。
[0303]
然而,该实验表明,轭合物垫为一次性消耗品,而且当将轭合物含于样品垫或缓冲液中时,可以极大地简化侧流检测条的使用。该实验表明,一种仅包括将样品与缓冲液混合至预定稀释系数这一个步骤的简化方法能够在考虑样品hct值的同时,实现全血中生物标志物的准确测定。
[0304]
通过去除轭合物垫且改而将样品混合(即轭合)于缓冲液内,轭合反应的反应动力学得到改善。在纤维轭合物垫内,混合和轭合取决于样品如何均匀且有效地迁移通过轭合物垫,而且还取决于试剂如何均匀地沉积于轭合物垫上。在缓冲液这一液体介质中进行轭合反应消除了产生此方面差异的可能性,并提高了检测的可重复性。
[0305]
在本实施例中,使用与多克隆兔抗人铁蛋白抗体轭合的金纳米颗粒。在优选实施方式中,为了避免或最大程度减小聚集,使用单克隆抗体。此外,金纳米颗粒可由其他标志物替代,如由蓝色乳胶纳米颗粒替代。优选地,标志物选择为不对hct测量造成干扰,也就是说,选择为hct测量所选波长下具有极小的反射率。
[0306]
实施例13:稀释程度和照射光颜色(ir及红色/绿色/蓝色)如何影响以使用基于相机的侧流检测读取器的基于图像的反射率测量确定hb时的能力
[0307]
通过将22
×
300mm样品垫/轭合物垫(fusion 5,目录号:29009399,沃特曼),25
×
300mm硝酸纤维素膜(fp120hp,部件编号:10547001,沃特曼/ge)以及17
×
300mm吸收垫(cfsp001700,默克密理博)组装于标准60
×
300mm衬膜背板(部件编号:miba-040,dcn)上,制备侧流检测条。随后,将组装好的60
×
300mm板体以cm5000闸刀式切纸机(拜奥-多特(biodot))切为5mm宽的细条。各个细条随后放入标准侧流检测壳体(部件编号:mica-200bottom/top,dcn)内。对于此类基于图像的反射率测量,硝酸纤维素膜上不施加抗体。
[0308]
对健康志愿者进行静脉穿刺采血,并将血样收集至一个真空采血管(肝素锂,碧迪
医疗)内。通过将红血细胞(rbc)成分与血浆成分按照预定比率混合,制备血红蛋白(hb)水平差异较大的两种不同血样。此两种样品的hb水平通过hemocue 201 (海莫库公司,恩厄尔霍尔姆)分别确定为105.5g/l(“低hb”)和206.5g/l(“高hb”)。此两值为并行测定结果的平均值。
[0309]
两种血样在不导致rbc溶血的缓冲液内以稀释因子2.5、10、25、100、250、1000及2500稀释。所使用的缓冲液为tris盐水缓冲液,ph=7.5且含有0.5%的吐温及0.5%的脱脂奶粉。将75μl的稀释血样施加至检测装置(即封于壳内的测试条)的加样孔内。在稀释血样完全吸收于样品垫/轭合物垫(fusion 5)内后,在先以esequant flex读取器(迪亚鲁诺)的ir led照射,然后以红色led照射,然后以绿色led照射,最后以蓝色led照射的同时,拍摄检测装置加样孔的图像。ir led照射虽非是默认选项,但仍单独定制。针对每种颜色,所得图像为10幅图像的平均图像。在每种稀释系数下,低hb样品和高hb样品均重复5次拍摄过程。因此,在该实验中,(在每种照射颜色下),共拍摄70幅图像(2种hb水平;7种稀释系数;5次重复)。需要注意的是,由于无法在低hb样品和高hb样品之间进行对比,因此有意省略蓝色led的2.5倍稀释和ir led的2500倍稀释情形。
[0310]
图像分析以r软件(版本4.0.3)的rstudio(版本1.3.1093)集成开发环境(ide)进行。从各图像中,通过“阈值”函数,分离出构成已吸收稀释血样的fusion 5滤膜的像素(对应于圆形加样孔,见图9b),随后计算分离区域的平均像素值,该值与fusion 5滤膜的总反射光量直接相关。图16所示为该平均像素强度如何取决于稀释程度(稀释系数)和照射颜色(ir/红色/绿色/蓝色)。图中包含了低hb样品和高hb样品两种情形。
[0311]
为了对根据各幅图像预测血样hb浓度的能力进行估计,发明人定义了一种对比因子,并针对每种照射颜色(ir、红色、绿色、蓝色)和每种稀释系数(2.5、10、25、100、250、1000及2500),计算该对比因子。对固定的一种稀释系数和照射颜色,该对比因子的计算同时考虑稀释后“低hb”样品的5幅图像以及稀释后“高hb”样品的5幅图像。针对每一hb水平,均计算“平均像素强度”(ampi)的平均值以及“平均像素强度”(sdmpi)的标准差。对比因子定义如下:
[0312]
对比因子=[ampi
低hb
–
ampi
高hb
]/[平均(sdmpi
低hb
:sdmpi
高hb
)]
[0313]
文字表达来说,对比因子定义为低hb样品和高hb样品之间的反射率之差(在某一稀释度之下)与反射率测量值波动性的关系。
[0314]
不同照射颜色和稀释系数的对比因子计算结果示于图17。结果清楚表明,对于hb浓度测定,红色led照射在稀释系数为2.5~50倍时提供了更高的可能性,而绿色或蓝色led照射更适合于50倍~2500倍稀释。
[0315]
图17所示数据根据低hb和高hb下的测量值以及hb与平均像素强度之间线性关联这一假设,转换为hb预测模型中的估算精度(cv%)。不同波长以及不同稀释系数下的估算精度示于图18。
[0316]
实施例14:确立和比较使用红色和绿色led照射的基于图像的反射率测量在两种不同稀释系数(10倍和100倍)下的hb预测能力
[0317]
按照实施例1中描述的方式制备侧流检测条。针对此类基于图像的反射率测量,不在硝酸纤维素膜上施加抗体。
[0318]
对健康志愿者进行静脉穿刺采血,并将血样收集至一个真空采血管(肝素锂,碧迪
医疗)内。通过将红血细胞(rbc)成分与血浆成分按照预定比率混合,制备五种不同血样,其血红蛋白(hb)浓度跨越有生理意义的浓度范围的最佳部分。此五种样品的hb浓度以hemocue 201 (海莫库公司,恩厄尔霍尔姆)确定为103.5g/l、128.0g/l、158.5g/l、183.5g/l及209.5g/l。这些值为并行确定结果的平均值。
[0319]
这五种血样在不导致rbc溶血的缓冲液内以10倍和100倍这两种稀释因子稀释。缓冲液组成与实施例13所公开的相同。
[0320]
将75μl的稀释血样施加至检测装置(即封于壳内的测试条)的加样孔内。在稀释血样完全吸收于样品垫/轭合物垫(fusion 5)内后,在先以esequant flex读取器(迪亚鲁诺)的红色led照射,然后以绿色led照射的同时,拍摄检测装置加样孔的图像。针对每种颜色,所得图像为10幅图像的平均图像。在每种稀释系数下,5种稀释血样均重复5次拍摄过程,因此在该实验中(在每种照射颜色下),共拍摄50幅图像(5种hb水平;2种稀释系数;5次重复)。
[0321]
图像分析以r软件(版本4.0.3)的rstudio(版本1.3.1093)集成开发环境(ide)进行。从各图像中,通过“阈值”函数,分离出构成已吸收稀释血样的fusion 5滤膜的像素(对应于圆形加样孔),随后计算分离区域的平均像素值,该值与fusion 5滤膜所吸收的稀释血样的总反射光量直接相关。图18所示为该平均像素强度如何取决于原始血样的hb浓度。图中所示为a)10倍稀释下红色led照射情形的结果以及b)100倍稀释下绿色led照射情形的结果。100倍稀释下红色led照射情形以及10倍稀释下绿色led照射情形所得结果(图中未包含其曲线图)与上述两种类型的结果类似。
[0322]
图19所示为以下两种情形的稀释血样平均像素强度结果:a)10倍稀释下红色led照射;以及b)100倍稀释下绿色led照射。每一hb浓度下测量5次。图中,圆点表示平均值,误差线表示1个标准差。每一数据集均拟合出一个幂函数,用作直接根据平均像素强度预测hb浓度的模型。
[0323]
根据所得平均像素强度与hb浓度之间的依赖关系,拟合出作为根据平均像素强度预测hb浓度的幂函数,每种照射颜色和稀释系数情形拟合一个模型。每一模型的性能均以作为其公式化基础的相同25个数据点进行评价。对于红色led照射,平均像素强度在10倍稀释系数下的预测表现更佳(与100倍相比)。对于绿色led照射,情况与此相反——平均像素强度在100倍稀释系数下的预测表现更佳(与10倍相比)。每一照射颜色下最佳预测模型的性能示于图20。所有四种模型的绝对和相对性能总结于表7中。
[0324]
表7:分别根据10倍和100倍稀释下红色和绿色照射情形公式化的四种hb浓度预测模型的性能。红色照射在10倍稀释下的误差更小,而绿色照射在100倍稀释下的误差更小。
[0325][0326]
从以上结果可以看出,在基于反射率的hb浓度测定中,红色led照射在低稀释系数(此处为10)下的表现远远优于绿色led照射。类似地,绿色led照射在高稀释系数(此处为
100)下的表现远远优于红色led照射。
[0327]
实施例15:天生hct差异如何直接影响全血侧流检测精度方面的理论考量
[0328]
针对全血检测中的hct测定,在考虑如何提高血浆生物标志物测定精度时,将健康人群的天生hct差异水平考虑在内是一种合理的做法,其目的在于更好地了解,总体检测精度如何受忽略此类差异的影响。此处阐述的理论考量基于如下假设:
[0329]
a.hct水平在健康人群呈正态分布,男女有别;
[0330]
b.95%的人(即
±
1.96标准差)涵盖于文献(比利特,1990年,同上)指出的正常参考区间内:
[0331]-女性:36~48%
[0332]-男性:40~54%
[0333]
图21所示为这两种分布。所有的平均值计算均考虑男女之间的均等,而且其各自的hct水平均仅基于上述分布。
[0334]
由于准确的浓度测定要求正确的血浆体积为已知量,因此hct水平差异直接影响血浆中生物标志物的浓度测定。表8中给出的计算假设相同的生物标志物量(即重量)始终给出相同的测量值,也就是说,读数与生物标志物所在的血浆体积无关。hct水平低于所考虑的水平时,浓度会被高估;反之亦然。
[0335]
表8:在考虑总体平均值(44.5%)或分性别平均值(女性42%;男性:47%)时,个人生物标志物浓度测定如何受其不同hct水平的影响
[0336][0337]
如上表8所示,在计算血浆中生物标志物浓度时,有两种基本的hct水平补偿方式。第一种方式使用所有人的平均hct水平(44.5%),第二种方式考虑性别(女为42%,男为47%)。
[0338]
通过考虑上述两种估算方式并将其与假定hct分布(图21)相关联,可以计算出此两种方式所得的hct测定精度(表示为cv)。
[0339]
当假设所有人具有44.5%的hct水平时,所得精度为9.5%(cv)。当假设所有女性均具有42%的hct水平且所有男性具有47%的hct水平时,女性所得精度为7.4%(cv),男性
所得精度为7.8%(cv)。因此,基于性别的hct水平假设的精度(cv=7.6%)远优于非基于性别的hct水平假设的精度(cv=9.5%)。
[0340]
通过对hct水平进行测量,还可进一步改善上述状况。图22所示为hct水平测定会得到改善的人的比例与hct水平测定方法精度的关系。当测定方法精度小于约7.5%时,大部分人的hct水平测定将会得到改善。
[0341]
此外,值得注意的是,对于具有极端hct水平(极低或极高)的人而言,与沿用基于健康人群平均值的做法相比,其更有可能从hct水平测量中获益。
[0342]
当hct测定精度对应于cv=5%时,平均而言,hct水平处于40.6%~43.5%区间之外的女性的读取将会得到改善,而且平均而言,hct水平处于45.5%~48.7%区间之外的男性的读取将会得到改善。图22所示为所有人中hct水平测定会得到改善的人的比例与本方法精度之间的关系。
[0343]
从方法比较的角度上说,本发明hct测定方法的精度远远优于根据性别对hct水平进行估计的方法,这本身便已使得本发明具有可信度。此外,就这种比较而言,值得注意的是,本发明所考虑hct水平参考区间针对健康成人。除了特定的疾病状态(如红细胞增多症(wouters(沃特斯)等人,2020年)),还有许多因素会使得hct水平偏离普通人水平。
[0344]
与上述参考区间相比,婴儿的hct区间稍宽,而且可具有更高的hct水平,而幼儿、孕妇(史蒂文斯(stevens)等人,2013年)以及老年人(特达文迪(tettamanti)等人,2010)往往具有更低的hct水平。饥荒和营养不良也会在群体层面上导致hct水平降低。另一方面,生活在较高海拔(海水平以上》1500米)以及吸烟等外部因素也往往会导致hct水平升高。
[0345]
鉴于所有上述对hct水平具有影响的因素,依赖于通过假设特定人群的平均hct水平而校正血浆标志物浓度的检测方法面临极大困难。
[0346]
总而言之,更为精确的hct测定可抑制目标生物标志物被低估或高估的风险。鉴于生物标志物的生理特性,如此可降低有可能做出不利医治决定的风险。例如,对于在某些疾病状态中被上调的生物标志物(如胱抑素c或crp),最好不应被低估,这是因为其可能会导致患者的治疗被延误,从而有可能产生严重后果。
[0347]
此外,对于利用生物标志物水平高于或低于某个阈值(所谓的决策点)推断某种感染源于细菌还是病毒(如钙卫蛋白)并进而指导医生做出治疗决定的情形而言,低估会导致对细菌感染的治疗被延误,从而可能导致其恶化至脓毒症这一严重状况。另一方面,高估会导致无必要地使用抗生素。在献血情形中,如果对铁蛋白的量有所高估,则可能会导致铁状态本来不足以供献血的献血者被判定为适合献血。
[0348]
无需赘言,本领域技术人员应能够通过包括实施例在内的本说明书达到本发明的最大利用。此外,虽然本文中结合作为发明人当前已知最佳模式的优选实施方式对本发明进行了描述,但是应该理解的是,在不脱离下附权利要求中阐明的本发明范围的情况下,还可做出对本领域普通技术人员而言显而易见的变化和修饰。
[0349]
因此,虽然本文公开了各个方面和实施方式,但对于本领域技术人员而言,其他方面和实施方式也是显而易见的。本文公开的各个方面和实施方式出于说明目的且并不旨在构成限制,真正的范围和精神如下附权利要求所示。
[0350]
参考文献
[0351]
非专利文献
[0352]
阿提亚(attia)等人,人血红蛋白衍生物的测定,血红蛋白,2015年;39(5):371~374
[0353]
比利特
·h·
h,第151章,临床方法中的血红蛋白和血细胞比容:历史、体格检查及实验室检查,沃克(walker)
·h·
k,霍尔(hall)
·w·
d,赫斯特(hurst)
·j·
w,版本:波士顿:巴特沃斯(butterworths),1990年第三版
[0354]
卡皮奥等人,一种使用非接触式漫反射光谱法且基于干血斑的新型非破坏性血细胞比容预测方法,分析化学,2016年,88,6538~6546
[0355]
贾拉勒等人,基于智能手机的快速血细胞比容测定直方图分析,生物医学光学快报,2017年7月1日,8(7):3317~3328
[0356]
希普莱克
·m·
g等人,胱抑素c以及老年人死亡及心血管事件风险,2005年5月19日,新英格兰医学杂志,2005年,352:2049~2060
[0357]
李洙京等人,晚期非小细胞肺癌患者的铁蛋白与血红蛋白比率预后值,癌症杂志,2019年,10(7):1717~1725,doi:10.7150/jca.26853
[0358]
史蒂文斯
·g·
a等人,1995至2011年间血红蛋白浓度及儿童、孕妇、非怀孕女性的总贫血和严重贫血患病率的全球、区域及国家趋势,人口代表性数据的系统性分析,柳叶刀,第1卷,第1期,e16~e25,2013年7月1日
[0359]
特达文迪
·
m等人,老年人轻度贫血的患病率、发病率及类型:基于“健康和贫血”人群的研究,血液学,2010年11月,95(11):1849~1856
[0360]
沃特斯
·h·j·c·
m等人,普通人群的红细胞增多症:临床特征以及与克隆性造血的关联,血液病前沿,2020年12月22日,4(24):6353~6363
[0361]
杨等人,用于在资源有限情况下测量血液血红蛋白浓度的简易纸基检测法,临床化学,(2013)59:10,1506~1513
[0362]
专利文献
[0363]
us 8,730,460,颜等人,血液血红蛋白浓度的纸基分光光度检测,公开于2021年10月11日
[0364]
wo 2017/087834,埃里克森等人,用于多种目标分子检测的多重诊断检测盒,公开于2017年5月26日
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。