结合lag3的工程化抗体
1.相关申请的交叉引用
2.本技术要求于2020年4月3日提交的第63/004798号美国临时专利申请的优先权,该临时申请出于所有目的通过引用全部并入本文。
3.在本技术中,引用了各种出版物、专利和/或专利申请。在此通过引用将所述出版物、专利和/或专利申请的公开内容全部并入本技术中,以便更充分地描述本公开内容所涉及的最接近的现有技术。如果通过引用合并的任何材料与本技术的明示内容相冲突,则以明示内容为准。
4.序列表
5.本技术包含一份序列表,该序列表以ascii格式以电子方式提交,并通过引用将其全部内容并入本文。上述ascii的副本创建于2021年1月14日,命名为2021-01-14_01223-0075-00pct_seq_list_st25.txt,大小为23793字节。
发明领域
6.本发明提供了完全人抗lag3 igg类抗体,其被工程化成在其重链可变区和/或轻链可变区中具有改良的抗原结合、细胞结合、t细胞活化和细胞因子释放能力的氨基酸序列。
背景技术:
7.淋巴细胞活化基因-3(或lag3)(又称为cd223)是免疫球蛋白超基因家族的成员且与cd4在结构上和遗传上相关。lag3在静止周边血液淋巴细胞上不表达但在活化的t细胞和nk细胞上表达。lag3是通过cd4基因附近的位于染色体12的短臂的远程部分上的基因编码的膜蛋白,这表明了lag3基因可透过基因复制而进化(triebel等人(1990)《实验医学杂志(j.exp.med.)》171:1393-1405)。
8.类似于cd4,已证实lag3与ii类mhc分子相互作用,但不同于cd4的是,lag3不与人免疫缺陷病毒gp120蛋白相互作用(baixeras等人(1992)《实验医学杂志》176:327-337)。使用可溶性lag3免疫球蛋白融合蛋白(slag3ig)的研究证实lag3直接并且特异性结合至细胞表面上的ii类mhc(huard等人(1996)《欧洲免疫学杂志(eur.j.immunol.)》26:1180-1186)。
9.在抗原特异性t细胞反应的体外研究中,抗lag3抗体的添加导致t细胞增殖增加,活化抗原(诸如cd25)的表达更高,以及细胞因子(诸如干扰素-γ和白细胞介素-4)的浓度更高,支持lag3/ii类mhc相互作用在下调cd4
t淋巴细胞的抗原独立性刺激中的作用(huard等人(1994)《欧洲免疫学杂志》24:3216-3221)。已证实lag3的胞质内区域与称为lap的蛋白质相互作用,所述蛋白质被认为是参与cd3/tcr活化途径的下调的信息转导分子(iouzalen等人(2001)《欧洲免疫学杂志》31:2885-2891)。此外,已经显示cd4
cd25
调节t细胞(t
reg
)在活化时表达lag3且针对lag3的抗体在体外和体内均抑制通过诱导的t
reg
细胞的抑制,这表明了lag3有助于t
reg
细胞的抑制因子活性(huang,c.等人(2004)《免疫学(immunity)》21:503-513)。又进一步地,已经显示lag3在t细胞依赖性和独立性机制中均通
过调节t细胞负向调节t细胞稳态(workman和vignali(2005)《免疫学杂志(j.immunol.)》174:688-695)。
10.在某些情况下,也已经显示lag3具有免疫刺激效应。例如,与未转染的肿瘤细胞相比,移植至同基因小鼠中的经lag3转染的肿瘤细胞显示生长减少或完全消退,这表明了肿瘤细胞上的lag3表达通过经由ii类mhc分子触发抗原lag3呈递细胞来刺激抗肿瘤反应(prigent等人(1999)《欧洲免疫学杂志》29:3867-3876)。另外,已经显示可溶性lag3ig融合蛋白在与抗原一起施用于小鼠时可同时刺激体液和细胞免疫反应,这指示可溶性lag3ig可用作疫苗佐剂(el mir和triebel(2000)《免疫学杂志》164:5583-5589)。此外,已经显示可溶性人lag3ig扩增i型肿瘤特异性免疫的体外产生(casati等人(2006)《癌症研究(cancer res.)》66:4450-4460)。lag3的功能活性进一步参见triebel(2003)《免疫学进展(trends immunol.)》24:619-622。有鉴于以上,用于调节lag3的活性的另外试剂是令人关注的。
技术实现要素:
11.本领域中仍需要基于lag3,特别是抗lag3抗体的有效治疗。本发明提供了被工程化成展现与亲本抗体相比更高的结合至其靶抗原的亲和力和改良的细胞杀死能力的抗体。本发明包括以下实施例。实施例1是完全人抗lag3抗体,其包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的重链可变区;和包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的轻链可变区。
12.实施例2是包含重链可变区和轻链可变区的lag3结合蛋白,其中所述重链可变区包含seq id no:4、6、8或10所示的cdr1、cdr2和cdr3序列;且所述轻链可变区包含seq id no:5、7、9或11所示的cdr1、cdr2和cdr3序列。
13.实施例3是实施例2的lag3结合蛋白,其中所述重链可变区包含seq id no:4所示的cdr1、cdr2和cdr3序列且所述轻链可变区包含seq id no:5所示的cdr1、cdr2和cdr3序列;或所述重链可变区包含seq id no:6所示的cdr1、cdr2和cdr3序列且所述轻链可变区包含seq id no:7所示的cdr1、cdr2和cdr3序列;或所述重链可变区包含seq id no:8所示的cdr1、cdr2和cdr3序列且所述轻链可变区包含seq id no:9所示的cdr1、cdr2和cdr3序列;或所述重链可变区包含seq id no:10所示的cdr1、cdr2和cdr3序列且所述轻链可变区包含seq id no:11所示的cdr1、cdr2和cdr3序列。
14.实施例4是实施例2或3的lag3结合蛋白,其是抗体或抗体片段。
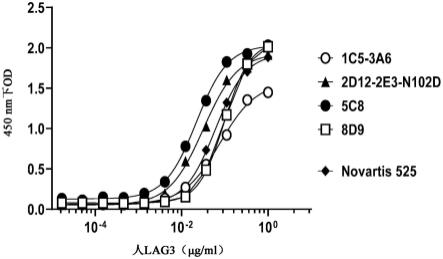
15.实施例5是实施例1的完全人抗lag3抗体或实施例2至4中任一项的lag3结合蛋白,其中所述重链可变区序列和轻链可变区序列包含seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)或seq id no:10和11(本文称为8d9)。
16.实施例6是fab完全人抗lag3抗体,其包含来自重链的可变结构域区和来自轻链的可变结构域区,其中所述来自重链的可变结构域区包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的序列,且其中所述来自轻链的可变结构域区包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的序列。
17.实施例7是实施例6的fab完全人抗lag3抗体,其中所述来自重链的可变结构域区和所述来自轻链的可变结构域区包含seq id no:4和5(本文称为1c5-3a6)、seq id no:6和
7(seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
18.实施例8是单链人抗-lag3抗体,其包含来自重链的可变结构域区和来自轻链的可变结构域区,其中所述来自重链的可变结构域区包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的序列,且其中所述来自轻链的可变结构域区包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的序列。
19.实施例9是实施例2至5中任一项的lag3结合蛋白或实施例8的单链人抗lag3抗体,其中所述来自重链的可变结构域区和所述来自轻链的可变结构域区与肽连接子接合在一起。
20.实施例10是实施例8的单链人抗lag3抗体,其中所述来自重链的可变结构域区和所述来自轻链的可变结构域区包含seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
21.实施例11是前述实施例中任一项的lag3结合蛋白或完全人抗lag3抗体,其中所述抗体以10-8
m或更小的kd结合人lag3。
22.实施例12是实施例1至7中任一项的lag3结合蛋白或完全人抗lag3抗体,其中所述抗体以10-6
m或更小的kd结合食蟹猕猴lag3。
23.实施例13是前述实施例中任一项的lag3结合蛋白或完全人抗lag3抗体,其包含igg4类抗体。
24.实施例14是一种药物组合物,其包含药学上可接受的赋形剂和前述实施例中任一项的lag3结合蛋白或完全人抗lag3抗体。
25.实施例15是一种试剂盒,其包括实施例1至13中任一项的lag3结合蛋白、fab完全人抗lag3抗体、单链人抗lag3抗体或完全人抗lag3抗体。
26.实施例16是一种核酸,其编码实施例1至13中任一项的lag3结合蛋白或完全人抗lag3抗体的重链可变区。
27.实施例17是一种核酸,其编码实施例1至13中任一项的lag3结合蛋白或完全人抗lag3抗体的轻链可变区。
28.实施例18是一种核酸,其编码(a)(i)实施例1至13中任一项的完全人抗lag3抗体的重链可变区,和(ii)实施例1至13中任一项的完全人抗lag3抗体的轻链可变区;或(b)实施例2至5、9、或11至13中任一项的lag3结合蛋白。
29.实施例19是一种载体,其包含实施例16的核酸。
30.实施例20是一种载体,其包含实施例17的核酸。
31.实施例21是一种载体,其包含实施例18的核酸。
32.实施例22是一种宿主细胞,其携带实施例19的载体。
33.实施例23是实施例22的宿主细胞,其中所述载体包含表达载体,且其中所述宿主细胞表达重链可变区。
34.实施例24是一种宿主细胞,其携带实施例20的载体。
35.实施例25是实施例24的宿主细胞,其中所述载体包含表达载体,且其中所述宿主细胞表达轻链可变区。
36.实施例26是一种宿主细胞,其携带包含实施例19的载体的第一载体和包含实施例20的载体的第二载体。
37.实施例27是实施例26的宿主细胞,其中所述第一载体包括第一表达载体,其中所述第二载体包括第二表达载体,且其中所述宿主细胞表达重链可变区和轻链可变区。
38.实施例28是一种宿主细胞,其携带实施例21的载体。
39.实施例29是实施例28的宿主细胞,其中所述载体包含表达载体,且其中所述宿主细胞表达重链可变区和轻链可变区。
40.实施例30是一种用于制备lag3结合蛋白、或完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区的方法,所述方法包括:在适于表达完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区的条件下培养实施例23的宿主细胞群体。
41.实施例31是实施例30的方法,所述方法进一步包括:从宿主细胞回收lag3结合蛋白、或完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的重链可变区。
42.实施例32是一种用于制备完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的方法,所述方法包括:在适于表达完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的条件下培养实施例25的宿主细胞群体。
43.实施例33是实施例32的方法,所述方法进一步包括:从宿主细胞回收完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的轻链可变区。
44.实施例34是一种用于制备(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的方法,所述方法包括:在适于表达(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的条件下培养实施例27的宿主细胞群体。
45.实施例35是实施例34的方法,所述方法进一步包括:从宿主细胞回收(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的轻链可变区。
46.实施例36是一种用于制备(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的方法,所述方法包括:在适于表达(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的轻链可变区的条件下培养实施例29的宿主细胞体。
47.实施例37是实施例36的方法,所述方法进一步包括:从宿主细胞回收(i)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的重链可变区,和(ii)完全人抗lag3抗体、或fab完全人抗lag3抗体、或单链人抗lag3抗体的所表达的轻链可变
区。
48.实施例38是一种用于治疗患有与lag3过表达相关的疾病的个体的方法,所述方法包括:对个体施用有效量的包含实施例1至13中任一项的lag3结合蛋白或人抗lag3抗体的治疗组合物。
49.实施例39是实施例1至13中任一项的lag3结合蛋白或人抗lag3抗体,其用于治疗与lag3过表达相关的疾病。
50.实施例40是实施例38的方法,或如实施例39使用的lag3结合蛋白或人抗lag3抗体,其中所述疾病为骨癌、胰腺癌、皮肤癌、头部或颈部癌症、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门部位的癌症、胃癌、睪丸癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、慢性或急性白血病(包括急性骨髓性白血病、慢性骨髓性白血病、急性淋巴母细胞性白血病、慢性淋巴细胞性白血病)、儿童实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾脏或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发的癌症或石棉诱发的癌症。
51.实施例41是实施例1至13中任一项的lag3结合蛋白或人抗lag3抗体,其用于实施例38中任一项的方法。
附图说明
52.图1显示来自人(seq id no:1)、食蟹猕猴(seq id no:2)和小鼠(seq id no:3)的lag3靶抗原的氨基酸序列。
53.图2显示完全人抗lag3抗体1c5-3a6(seq id no:4和5)、2d12-2e3-n102d(seq id no:6和7)、5c8(seq id no:8和9)、和8d9(seq id no:10和11)的重链可变区和轻链可变区的氨基酸序列。
54.图3显示对可溶性人lag3抗原的剂量依赖性结合的elisa分析的结果。实验描述于实例1中。
55.图4显示抗lag3抗体的结合动力学的一系列spr感应图和其测得的kd值。biacore实验描述于实例2中。
56.图5为显示各种抗lag3抗体与人、小鼠或食蟹猕猴lag3蛋白交叉反应性的elisa分析的结果的条形图。实验描述于实例3中。
57.图6是比较各种抗lag3抗体对表达人lag3/nfat-luc的报告子jurkat细胞系的结合能力的图。实验描述于实例4中。
58.图7a是比较各种抗lag3抗体对经金黄色葡萄球菌肠毒素(staphylococcal enterotoxin)(seb)活化的食蟹猕猴pbmc的结合能力的图。沿着y轴的值为δmfi。实验描述于实例5中。
59.图7b是使用从描述于图7a中的实验产生的相同数据比较各种抗lag3抗体对经金黄色葡萄球菌肠毒素(seb)活化的食蟹猕猴pbmc的结合能力的图。沿着y轴的值为δlag3 细胞。实验描述于实例5中。
60.图8a是比较在表达人lag3/nfat-luc的报告子jurkat细胞系和经金黄色葡萄球菌
肠毒素(seb)活化的raji细胞存在下各种抗lag3抗体的功能活性的条形图。实验#1描述于实例6中。
61.图8b是比较在表达人lag3/nfat-luc的报告子jurkat细胞系和经金黄色葡萄球菌肠毒素(seb)活化的raji细胞存在下各种抗lag3抗体的功能活性的条形图。实验#2描述于实例6中。
62.图9是显示比较本文描述的抗lag3抗体和竞争者抗lag3抗体的结合的表位图谱(epitope mapping)分析的结果的条形图。实验描述于实例7中。
63.图10a是使用来自供体#1的pbmc比较由各种抗lag3抗体诱导的干扰素-γ释放的条形图。实验描述于实例8中。
64.图10b是使用来自供体#2的pbmc比较由各种抗lag3抗体诱导的干扰素-γ释放的条形图。实验描述于实例8中。
具体实施方式
65.定义
66.除非另有定义,否则本文所使用的技术和科学术语具有一般技术者通常理解的含义,除非另有定义。一般来说,有关本文描述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学、转基因细胞产生、蛋白质化学和核酸化学和杂交的术语是众所周知的且通常用于本领域中。除非另有指示,否则本文所提供的方法和技术一般根据本领域中众所周知且如本文引用且论述的各种一般且更具体的参考文献中所述的常规程序进行。参见,例如sambrook等人《分子克隆实验指南(molecular cloning:alaboratory manual)》,第2版,cold spring harbor laboratory press,cold spring harbor,n.y.(1989)和ausubel等人,《分子生物学实验室指南(current protocols in molecular biology)》,greene publishing associates(1992)。许多基本文字描述标准抗体产生方法,包括borrebaeck(编)《抗体工程(antibody engineering)》,第2版freeman and company,ny,1995;mccafferty等人,《抗体工程实用方法(antibody engineering,a practical approach)》irl at oxford press,oxford,england,1996;和paul(1995)《抗体工程方案(antibody engineering protocols)》humana press,towata,n.j.,1995;paul(编),《基础免疫学(fundamental immunology)》,raven press,n.y,1993;coligan(1991)《免疫学实验室指南(current protocols in immunology)》wiley/greene,ny;harlow和lane(1989)《抗体:实验指南(antibodies:alaboratory manual)》cold spring harbor press,ny;stites等人(编)《基础与临床免疫学(basic and clinical immunology)》(第4版)lange medical publications,los altos,calif.,和其中引用的参考文献;《编码单克隆抗体:原则与实践(coding monoclonal antibodies:principles and practice)》(第2版)academic press,new york,n.y.,1986,和kohler和milstein《自然(nature)》256:495-497,1975。本文引用的所有参考文献以全文引用的方式并入本文中。酶促反应和富集/纯化技术也是众所周知的且如本领域中通常达成或如本文所述根据制造商的说明书进行。本文描述的与分析化学、合成有机化学和药物和医药化学以及其实验室程序和技术搭配使用的术语是众所周知的且通常用于本领域中。标准技术可用于化学合成、化学分析、药物制备、配制和递送以及患者的治疗。
67.本文所提供的标题不是对本发明的各种方法的限制,所述方法可通过整体上参考本说明书来理解。
68.除非本文上下文另外要求,否则单数术语应包括复数且复数术语应包括单数。除非明文且明确地受限于一个指示物,否则单数形式“一”、“一个”和“所述”和任何词语的单数使用包括多个指示物。
69.应了解,本文使用替代(例如“或”)意指替代中的任一者或二者或其任何组合。
70.本文所使用的术语“和/或”意指特定公开指定特征或组件中的每一者,连同或不连同另一者。例如,如本文词组诸如“a和/或b”中所使用的术语“和/或”意图包括“a和b”、“a或b”、(仅)“a”和(仅)“b”。同样地,如词组诸如“a、b和/或c”中所使用的术语“和/或”意图涵盖以下方法中的每一者:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;(仅)a;(仅)b;和(仅)c。
71.如本文所用,术语“包含(comprising)”、“包括(including)”、“具有(having)”和“含有(containing)”和其语法变化形式如本文所用意图是非限制性的,使得列表中的一个项目或多个项目不排除可替换或添加至所列项目的其它项目。应了解,本文每当用语言“包含”描述方法时,还提供了以“由......组成”和/或“基本上由......组成”描述的另外的类似方法。
72.如本文所用,术语“约”是指在如由一般技术者确定的特定值或组成的可接受的误差范围内的值或组成,所述误差范围将部分地取决于所述值或组成的测定或确定方式,即测量系统的限制。例如,“约”或“近似”可意指根据本领域实践在一个或超过一个标准偏差内。或者,取决于测量系统的限制,“约”或“近似”可意指高达10%(即
±
10%)或更大的范围。例如,约5mg可包括在4.5mg与5.5mg之间的任何数字。此外,特别是关于生物系统或工艺,所述术语可意指高达一个数量级或高达某一值的5倍。当本发明中提供特定值或组成时,除非另有说明,否则“约”或“近似”的含义应假设为在所述特定值或组成的可接受的误差范围内。
73.本文使用的术语“肽”、“多肽”和“蛋白质”和其它相关术语可互换使用且是指氨基酸的聚合物且不受限于任何特定的长度。多肽可包含天然和非天然氨基酸。多肽包括重组或化学合成形式。多肽还包括尚未进行裂解(例如通过分泌性信息肽的裂解或通过在某些氨基酸残基处的非酶促裂解)的前体分子。多肽包括已经历裂解的成熟分子。这些术语涵盖蛋白质序列的天然和人造蛋白质、蛋白质片段和多肽类似物(诸如突变蛋白、变体、嵌合蛋白和融合蛋白)以及翻译后或另外共价或非共价修饰的蛋白质。本文描述了包含使用重组程序制备的结合lag3的结合蛋白(例如抗lag3抗体或其抗原结合部分)的氨基酸序列的多肽。
74.本文使用的术语“核酸”、“多核苷酸”和“寡核苷酸”和其它相关术语可互换使用且是指核苷酸的聚合物且不受限于任何特定的长度。核酸包括重组和化学合成形式。核酸包括dna分子(cdna或基因组dna)、rna分子(例如mrna)、使用核苷酸类似物(例如肽核酸和非天然生成的核苷酸类似物)产生的dna或rna的类似物,和其杂种。核酸分子可为单链或双链。在一个实施例中,本发明的核酸分子包含编码抗体或其片段或scfv、衍生物、突变蛋白或变体的连续开放阅读框架。在一个实施例中,核酸包含一种类型的多核苷酸或两种或更多种不同类型的多核苷酸的混合物。本文描述了编码抗体轻链、抗体重链、抗lag3抗体或其
抗原结合部分的核酸。在一个实施例中,核酸编码包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的重链可变区。在一个实施例中,核酸编码包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的轻链可变区。
75.术语“回收(recover)”或“回收(recovery)”或“回收(recovering)”和其它相关术语是指从宿主细胞培养基或从宿主细胞裂解物或从宿主细胞膜获得蛋白质(例如抗体或其抗原结合部分)。在一个实施例中,所述蛋白质通过宿主细胞表达为重组蛋白,所述重组蛋白与介导所表达的蛋白质的分泌的分泌信息肽序列融合。可从宿主细胞培养基回收分泌的蛋白质。在一个实施例中,所述蛋白质通过宿主细胞表达为重组蛋白,所述重组蛋白缺乏可从宿主细胞裂解物回收的分泌信息肽序列。在一个实施例中,所述蛋白质通过宿主细胞表达为膜结合蛋白,所述膜结合蛋白可使用清洁剂回收以从宿主细胞膜释放所表达的蛋白质。在一个实施例中,无论用于回收蛋白质的方法如何,均可对所述蛋白质进行从所回收的蛋白质移除细胞碎片的程序。例如,可对所回收的蛋白质进行色谱法、凝胶电泳和/或透析。在一个实施例中,色谱法包括任何一种或任何组合或两种或更多种程序,包括亲和色谱法、羟基磷灰石色谱法、离子交换色谱法、反相色谱法和/或在二氧化硅上的色谱法。在一个实施例中,亲和色谱法包含蛋白a或g(来自金黄色葡萄球菌的细胞壁组分)。
76.术语“分离的”是指基本上不含其它细胞物质的蛋白质(例如抗体或其抗原结合部分)或多核苷酸。通过分离,使用本领域中众所周知的蛋白质纯化技术,可使蛋白质基本上不含天然相关组分(或与细胞表达系统或用于产生抗体的化学合成方法相关的组分)。术语分离的在一些实施例中还指基本上不含相同种类的其它分子(例如分别具有不同氨基酸或核苷酸序列的其它蛋白质或多核苷酸)的蛋白质或多核苷酸。可使用本领域中众所周知的技术(包括低分辨率方法(诸如凝胶电泳)和高分辨率方法(诸如hplc或质谱法))来分析所需分子的同质性纯度。在一个实施例中,可分离本文描述的抗体轻链、抗体重链、抗lag3抗体或抗原结合蛋白中的任一者。
77.本文使用的“抗原结合蛋白”和相关术语(例如lag3结合蛋白)是指包含结合至抗原(例如lag3)的部分和视需要的允许抗原结合部分采用促进抗原结合蛋白结合至抗原的构象的支架或框架部分的蛋白质。抗原结合蛋白的实例包括抗体、抗体片段(例如抗体的抗原结合部分)、抗体衍生物和抗体类似物。抗原结合蛋白可包括例如具有接枝cdr或cdr衍生物的替代蛋白支架或人造支架。这类支架包括但不限于包含被引入来例如稳定抗原结合蛋白的三维结构的突变的抗体衍生的支架以及包含例如生物相容性聚合物的全合成支架。参见,例如korndorfer等人,2003,《蛋白质:结构、功能和生物信息学(proteins:structure,function,and bioinformatics)》,第53卷,第1期:121-129;roque等人,2004,《生物技术进展(biotechnol.prog.)》20:639-654。另外,可使用肽抗体模拟物(“pam”)以及利用纤维连接蛋白(fibronection)组分作为支架的基于抗体模拟物的支架。本文描述结合lag3的抗原结合蛋白。
78.抗原结合蛋白可具有例如免疫球蛋白的结构。在一个实施例中,“免疫球蛋白”是指由两对相同多肽链组成的四聚体分子,每对具有一条“轻链”(约25kda)和一条“重链”(约50至70kda)。每条链的氨基端部分包括主要负责抗原识别的约100至110个或更多个氨基酸的可变区。每条链的羧基端部分界定主要负责效应功能的恒定区。人轻链分类为κ或λ轻链。重链分类为μ、δ、γ、α或ε,且将抗体的同型物分别定义为igm、igd、igg、iga和ige。在轻链和
重链内,可变区和恒定区通过约12个或更多个氨基酸的“j”区接合,其中所述重链还包括约10个氨基酸的“d”区。一般参见《基础免疫学》第7章(paul,w.编,第2版raven press,n.y.(1989))(其出于所有目的以全文引用的方式并入)。每个轻链/重链对的可变区形成抗体结合位点,使得完整免疫球蛋白具有两个抗原结合位点。在一个实施例中,抗原结合蛋白可为具有不同于四聚体免疫球蛋白分子但仍结合靶抗原或结合两种或更多种靶抗原的结构的合成分子。例如,合成抗原结合蛋白可包含抗体片段、1至6个或更多个多肽链、多肽的不对称组装或其它合成分子。本文描述了具有特异性结合至lag3的免疫球蛋白样特性的抗原结合蛋白。
79.免疫球蛋白链的可变区展现通过三个超变区(又称为互补决定区或cdr)接合的相对保守框架区(fr)的相同一般结构。从n端至c端,轻链和重链均包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
80.可将一个或多个cdr共价或非共价地并入分子中以使其成为抗原结合蛋白。抗原结合蛋白可将cdr作为较大多肽链的一部分并入,可将cdr共价地连接到另一个多肽链,或可非共价地并入cdr。cdr允许抗原结合蛋白特异性结合至所关注的特定抗原。
81.氨基酸至每个结构域的分配是根据kabat等人在《具有免疫学意义的蛋白质序列(sequences of proteins of immunological interest)》,第5版,us dept.of health and human services,phs,nih,nih公开案第91-3242号,1991中的定义。免疫球蛋白链中氨基酸的其它编号系统包括imgt.rtm.(国际immunogenetics信息系统;lefranc等人,《发育和比较免疫学(dev.comp.immunol.)》29:185-203;2005)和aho(honegger与pluckthun,《分子生物学杂志(j.mol.biol.)》309(3):657-670;2001);chothia(al-lazikani等人,1997《分子生物学杂志(journal of molecular biology)》273:927-948);contact(maccallum等人,1996《分子生物学杂志》262:732-745),和aho(honegger和pluckthun 2001《分子生物学杂志》309:657-670)。
82.本文使用的“抗体(antibody)”和“抗体(antibodies)”和相关术语是指特异性接合至抗原的完整免疫球蛋白或其抗原结合部分。抗原结合部分可通过重组dna技术或通过完整抗体的酶促或化学裂解来产生。抗原结合部分尤其包括fab、fab'、f(ab')2、fv、结构域抗体(dab)、和互补决定区(cdr)片段、单链抗体(scfv)、嵌合抗体、双功能抗体(diabodies)、三功能抗体(triabodies)、四功能抗体(tetrabodies),和多肽,所述多肽包含足以对所述多肽赋予特异性抗原结合的免疫球蛋白的至少一部分。
83.抗体包括重组产生的抗体和抗原结合部分。抗体包括非人类、嵌合、人源化和完全人抗体。抗体包括单特异性、多特异性(例如双特异性、三特异性和更高阶特异性)。抗体包括四聚体抗体、轻链单体、重链单体、轻链二聚体、重链二聚体。抗体包括f(ab')2片段、fab'片段和fab片段。抗体包括单域抗体、单价抗体、单链抗体、单链可变片段(scfv)、骆驼化抗体、亲和体(affibodies)、二硫键连接的fvs(sdfv)、抗独特型抗体(anti-id)、迷你抗体(minibodies)。抗体包括单克隆和多克隆群体。本文描述了包含轻链和/或重链的抗lag3抗体。
84.本文使用的“抗原结合结构域”、“抗原结合区”或“抗原结合位点”和其它相关术语是指抗原结合蛋白的一部分,其含有与抗原相互作用且有助于抗原结合蛋白针对抗原的特异性和亲和力的氨基酸残基(或其它部分)。对于特异性结合至其抗原的抗体,该抗体将包
含其cdr结构域中的至少一者的至少一部分。本文描述了来自抗lag3抗体的抗原结合结构域。
85.如本文在抗体或抗原结合蛋白或抗体片段的上下文中所用的术语“特异性结合(specific binding/specifically binds/specifically binding)”和其它相关术语是指相对于其它分子或部分对抗原的非共价或共价优先结合(例如相对于其它可用抗原,抗体特异性结合至特定抗原)。在一个实施例中,如果抗体以10-5
m或更小,或10-6
m或更小,或10-7
m或更小,或10-8
m或更小,或10-9
m或更小,或10-10
m或更小的解离常数kd结合至抗原,那么所述抗体特异性结合至靶抗原。本文描述了特异性结合lag3的抗lag3抗体。
86.在一个实施例中,解离常数(kd)可使用biacore表面等离子体共振(spr)分析来测量。表面等离子体共振是指一种光学现象,其允许通过例如使用biacore系统(biacore life sciences division of ge healthcare,piscataway,nj)检测生物传感器矩阵中蛋白质浓度的变化来分析实时相互作用。
87.如本文所用的“表位”和相关术语是指被抗原结合蛋白(例如被抗体或其抗原结合部分)结合的抗原的一部分。表位可包含被抗原结合蛋白结合的两个或更多个抗原的一部分。表位可包含抗原或两个或更多个抗原的不连续部分(例如在抗原的一级序列中不连续但在抗原的三级和四级结构的情况下彼此足够接近而被抗原结合蛋白结合的氨基酸残基)。一般来说,抗体的可变区(特别是cdr)与表位相互作用。本文描述了结合lag3多肽(抗原)的表位的抗lag3抗体和其抗原结合蛋白。
88.本文使用的“抗体片段”、“抗体部分”、“抗体的抗原结合片段”或“抗体的抗原结合部分”和其它相关术语是指除完整抗体以外的分子,其包含结合完整抗体所结合的抗原的完整抗体的一部分。抗体片段的实例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;fd;和fv片段、以及dab;双功能抗体;线性抗体;单链抗体分子(例如scfv);多肽,其包含足以对所述多肽赋予特异性抗原结合的抗体的至少一部分。抗体的抗原结合部分可通过重组dna技术或通过完整抗体的酶促或化学裂解来产生。抗原结合部分尤其包括fab、fab'、f(ab')2、fv、结构域抗体(dab)、和互补决定区(cdr)片段、嵌合抗体、双功能抗体、三功能抗体、四功能抗体,和多肽,所述多肽包含足以对抗体片段赋予抗原结合特性的免疫球蛋白的至少一部分。本文描述了抗lag3抗体的抗原结合片段。
89.术语“fab”、“fab片段”和其它相关术语是指包含可变轻链区(v
l
)、恒定轻链区(c
l
)、可变重链区(vh)和第一恒定区(c
h1
)的单价片段。fab能够结合抗原。f(ab')2片段为包含在铰链区通过双硫桥连接的两个fab片段的二价片段。f(ab')2具有抗原结合能力。fd片段包含vh和c
h1
区域。fv片段包含v
l
和vh区域。fv可结合抗原。dab片段具有vh结构域、v
l
结构域、或vh或vl结构域的抗原结合片段(美国专利6,846,634和6,696,245;美国公开申请第2002/02512号、第2004/0202995号、第2004/0038291号、第2004/0009507号、第2003/0039958号;和ward等人,《自然》341:544-546,1989)。本文描述了包含来自抗lag3抗体的抗原结合部分的fab片段。
90.单链抗体(scfv)为其中v
l
和vh区经由连接子(例如氨基酸残基的合成序列)接合以形成连续蛋白质链的抗体。优选地,连接子足够长以允许蛋白质链自身折叠且形成单价抗原结合位点(参见,例如bird等人,1988,《科学(science)》242:423-26和huston等人,1988,《美国国家科学院院刊(proc.natl.acad.sci.usa)》85:5879-83)。本文描述了包含来自抗
lag3抗体的抗原结合部分的单链抗体。
91.双功能抗体为包含两条多肽链的二价抗体,其中每条多肽链包含通过连接子接合的vh和v
l
域,所述连接子过短而无法允许相同链上的两个结构域之间配对,因此允许每个结构域与另一多肽链上的互补结构域配对(参见,例如holliger等人,1993,《美国国家科学院院刊》90:6444-48,和poljak等人,1994,《结构(structure)》2:1121-23)。如果双功能抗体的两条多肽链相同,则由其配对产生的双功能抗体将具有两个相同抗原结合位点。具有不同序列的多肽链可用于制备具有两个不同抗原结合位点的双功能抗体。类似地,三功能抗体和四功能抗体为分别包含三条和四条多肽链且分别形成三个和四个抗原结合位点的抗体,其可相同或不同。双功能抗体、三功能抗体和四功能抗体构建体可使用来自本文所述的任何抗lag3抗体的抗原结合部分来制备。
92.术语“人抗体”是指具有一个或多个衍生自人免疫球蛋白序列的可变区和恒定区的抗体。在一个实施例中,所有可变结构域和恒定结构域均衍生自人免疫球蛋白序列(例如完全人抗体)。这些抗体可以多种方式制备,其实例如下所述,包括透过重组方法或透过以所关注的抗原使小鼠免疫,所述小鼠被基因修饰成表达衍生自人重链和/或轻链编码基因的抗体。本文描述了完全人抗lag3抗体和其抗原结合蛋白。
[0093]“人源化”抗体是指以下抗体:具有与衍生自非人类物种的抗体的序列相差一个或多个氨基酸取代、删除和/或添加的序列,使得当将所述人源化抗体施用于人类个体时,所述人源化抗体不太可能诱导免疫反应,和/或与非人类物种抗体相比,诱导较轻免疫反应。在一个实施例中,非人类物种抗体的重链和/或轻链的框架和恒定结构域中的某些氨基酸发生突变以产生人源化抗体。在另一个实施例中,来自人抗体的恒定结构域与非人类物种的可变结构域融合。在另一个实施例中,改变非人类抗体的一个或多个cdr序列中的一个或多个氨基酸残基以降低非人类抗体在将其施用于人类个体时可能的免疫原性,其中所述改变的氨基酸残基对于抗体对其抗原的免疫特异性结合不是至关重要,或针对氨基酸序列所做的改变是保守性改变,使得人源化抗体与抗原的结合不会比非人类抗体与抗原的结合显著恶化。如何制备人源化抗体的实例可参见美国专利第6,054,297号、第5,886,152号和第5,877,293号。
[0094]
本文使用的术语“嵌合抗体”和相关术语是指包含来自第一抗体的一个或多个区域和来自一种或多种其它抗体的一个或多个区域的抗体。在一个实施例中,cdr中的一者或多者衍生自人抗体。在另一个实施例中,所有cdr均衍生自人抗体。在另一个实施例中,来自超过一种人抗体的cdr在嵌合抗体中混合且匹配。例如,嵌合抗体可包含来自第一人抗体的轻链的cdr1、来自第二人抗体的轻链的cdr2和cdr3、和来自第三抗体的重链的cdr。在另一个实例中,cdr源自不同物种,诸如人和小鼠、或人和兔子、或人和山羊。本领域的技术人员当明了,其它组合是可能的。
[0095]
此外,框架区可衍生自相同抗体中的一者,衍生自一种或多种不同抗体(诸如人抗体),或衍生自人源化抗体。在嵌合抗体的一个实例中,重链和/或轻链的一部分与来自某一特定物种或归属于特定抗体类别或子类别的抗体相同、同源或衍生自其,而所述链的其余部分与来自另一物种或归属于另一抗体类别或子类别的抗体相同、同源或衍生自其。还包括展现所需生物活性(即特异性结合靶抗原的能力)的这类抗体的片段。嵌合抗体可从本文描述的任何抗lag3抗体的一部分制备。
[0096]
如本文所用,术语“变异”多肽和多肽的“变体”是指氨基酸序列相对于参考多肽序列具有一个或多个氨基酸残基插入、删除和/或取代的多肽。多肽变体包括融合蛋白。以相同方式,变异多核苷酸包含核苷酸序列相对于另一个多核苷酸序列具有一个或多个核苷酸插入、删除和/或取代的多肽。多核苷酸变体包括融合多核苷酸。
[0097]
如本文所用,术语多肽的“衍生物”是已例如经由结合至另一化学部分,诸如例如聚乙二醇、白蛋白(例如人血清白蛋白)、磷酸化和糖基化进行化学修饰的多肽(例如抗体)。除非另有指示,否则术语“抗体”除包含两条全长重链和两条全长轻链的抗体外还包括其衍生物、变体、片段和突变蛋白,其实例如下所述。
[0098]
如本文所用的术语“fc”或“fc区”是指抗体重链恒定区的在铰链区中或铰链区之后开始且在重链的c端处终止的部分。fc区包括ch和ch3区的至少一部分且可包括或可不包括铰链区的一部分。各携带一半fc区的两条多肽链可二聚形成完整fc结构域。fc结构域可结合fc细胞表面受体和免疫补体系统的一些蛋白质。fc结构域展现效应功能,效应功能包括包含补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性吞噬作用(adp)、助噬作用和/或细胞结合中的任何一者或两种或更多种活性的任何组合。fc结构域可结合fc受体,包括fcγri(例如cd64)、fcγrii(例如cd32)和/或fcγriii(例如cd16a)。
[0099]
如本文所用的术语“经标记的抗体”或相关术语是指未标记或接合至可检测的标记或部分以进行检测的抗体和其抗原结合部分,其中所述可检测的标记或部分是放射性、比色、抗原、酶促、可检测的珠(诸如磁性或电子致密(例如金)珠)、生物素、链霉亲和素或蛋白a。可采用多种标记,包括但不限于放射性核素、荧光剂(fluorescer)、酵素、酵素底物、酵素辅因子、酵素抑制剂和配体(例如生物素、半抗原)。本文描述的任何抗lag3抗体可为未标记或可接合至可检测的标记或部分。
[0100]
本文使用的“同一性百分比”或“同源性百分比”和相关术语是指两种多肽之间或两个多核苷酸序列之间的相似性的定量测量。两个多肽序列之间的同一性百分比是两个多肽序列之间共有的所比对位置的相同氨基酸数的函数,考虑缺口数和每个缺口的长度,可能需要引入缺口以优化两个多肽序列的比对。依类似方式,两个多核苷酸序列之间的同一性百分比时两个多核苷酸序列之间共有的所比对位置的相同核苷酸数的函数,考虑缺口数和每个缺口的长度,可能需要引入缺口以优化两个多核苷酸序列的比对。两个多肽序列之间或两个多核苷酸序列之间的序列比较和同一性百分比的确定可使用数学算法来达成。例如,两个多肽或两个多核苷酸序列的“同一性百分比”或“同源性百分比”可通过使用gap计算机程序(gcg wisconsin package(10.3版)的一部分(accelrys,san diego,calif.))使用其默认参数比较所述序列来确定。诸如相对于测试序列“包含与y具有至少x%同一性的序列”的表述意指当与上述序列y比对时,测试序列包含与y的残基具有至少x%同一性的残基。
[0101]
在一个实施例中,测试抗体的氨基酸序列可与组成本文描述的抗lag3抗体或其抗原结合蛋白中的任一者的轻链和/或重链多肽的氨基酸序列中的任一者相似但不相同。测试抗体与多肽之间的相似性可为与组成本文描述的抗lag3抗体或其抗原结合部分中的任一者的轻链和/或重链多肽中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。在一个实施例中,相似多肽可在重链
和/或轻链内包含氨基酸取代。在一个实施例中,氨基酸取代包括一个或多个保守性氨基酸取代。“保守性氨基酸取代”是其中氨基酸残基经具有相似化学特性(例如电荷或疏水性)的侧链(r基团)的另一个氨基酸残基取代者。一般来说,保守性氨基酸取代基本上不改变蛋白质的功能特性。熟练技术者可在重链可变区和/或轻链可变区中引入高达5%保守性和/或非保守性氨基酸取代而不负向影响抗体的物理结构、结合能力或细胞杀死能力。用于识别且进行可变区中被设计成保留或改良抗体结合特征的保守性氨基酸取代的众所周知方法描述于:brummel等人,1993《生物化学(biochemistry)》32:1180-1187;kobayashi等人,1999《蛋白质工程(protein engineering)》12(10):879-884;和burks等人,1997《美国国家科学院院刊》94:412-417)。还已知用于识别且进行重链和/或轻链可变区中非保守性氨基酸取代以保留或改良抗原结合的方法(near等人,1993《分子免疫学(molecular immunology)》30(4):369-377)。因此,熟练技术者可预测和改变重链可变区和/或轻链可变区中多达5%的氨基酸而不显著降低抗体的抗原结合能力。在其中两个或更多个氨基酸序列通过保守性取代彼此不同的情况下,可向上调整序列同一性百分比或相似性程度以校正取代的保守性质。本领域的技术人员众所周知进行这种调整的手段。参见,例如pearson(1994)《分子生物学方法(methods mol.biol.)》24:307-331,其以全文引用的方式并入本文中。具有类似化学特性的侧链的氨基酸的基团的实例包括(1)脂族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;(2)脂族-羟基侧链:丝氨酸和苏氨酸;(3)含酰胺的侧链:天冬酰氨酸和谷氨酰胺;(4)芳族侧链:苯丙氨酸、酪氨酸和色氨酸;(5)碱性侧链:赖氨酸、精氨酸和组氨酸;(6)酸性侧链:天冬氨酸和谷氨酸,和(7)含硫侧链为半胱氨酸和甲硫氨酸。
[0102]
抗体可从包含具有变化的抗原特异性的免疫球蛋白的来源(诸如血清或血浆)获得。如果对这类抗体进行亲和纯化,则其可针对特定抗原特异性进行富集。这种富含抗体的制剂通常由少于约10%的对特定抗原具有特异性结合活性的抗体制成。将这些制剂进行几轮亲和纯化可增加对抗原具有特异性结合活性的抗体的比例。以这一方式制备的抗体通常称为“单特异性”。单特异性抗体制剂可由约10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、97%、99%或99.9%的对特定抗原具有特异性结合活性的抗体组成。抗体可使用如下所述的重组核酸技术来产生。
[0103]
本文使用的“载体”和相关术语是指可操作地连接到外来遗传物质(例如核酸转基因)的核酸分子(例如dna或rna)。载体可用作将外来遗传物质引入到细胞(例如宿主细胞)中的媒介体。载体可包括至少一个限制性内切核酸酶识别序列以用于将转基因插入到载体中。载体可包括赋予抗生素抗性或可选择特征以帮助选择携带载体-转基因构建体的宿主细胞的至少一个基因序列。载体可为单链或双链核酸分子。载体可为线性或环状核酸分子。用于采用锌指核酸酶、talen或crispr/cas的基因编辑方法的供体核酸可为载体的一种类型。载体的一种类型是“质粒”,其是指可连接到转基因,且能够在宿主细胞中复制,和转录和/或翻译转基因的线性或环状双链染色体外dna分子。病毒载体通常包含可连接到转基因的病毒rna或dna主链序列。可修饰病毒主链序列以禁用感染但保留病毒主链和共连接的转基因插入到宿主细胞基因组中。病毒载体的实例包括逆转录病毒、慢病毒、腺病毒、腺相关病毒、杆状病毒、乳多空病毒(papovaviral)、牛痘病毒、单纯疱疹病毒和爱泼斯坦巴尔病毒(epstein barr viral)载体。某些载体能够在引入其的宿主细胞(例如包含细菌复制起点的细菌载体和游离型哺乳动物载体)中自主复制。在引入到宿主细胞中时,将其它载体(例
如非游离型哺乳动物载体)整合到宿主细胞的基因组中,由此连同宿主基因组一起进行复制。
[0104]“表达载体”是可包含一个或多个调节序列(诸如诱导型和/或组成型启动子和增强子)的一种载体。表达载体可包括核糖体结合位点和/或多腺苷酸化位点。调节序列指导连接到转导至宿主细胞中的表达载体的转基因的转录,或转录和翻译。调节序列可控制转基因的表达的程度、定时和/或位置。调节序列可例如直接在转基因上,或透过一种或多种其它分子(例如结合至调节序列和/或核酸的多肽)的作用发挥其效应。调控序列可为载体的一部分。调节序列的其它实例描述于例如goeddel,1990,《基因表达技术:酶学方法(gene expression technology:methods in enzymology)》185,academic press,san diego,calif.和baron等人,1995,《核酸研究(nucleic acids res.)》23:3605-3606中。表达载体可包含编码本文描述的轻链、重链或抗lag3抗体中的任一者的至少一部分的核酸。
[0105]
本文描述可操作地连接到编码抗体轻链、抗体重链、抗lag3抗体或其抗原结合部分的核酸的载体(例如表达载体)。在一个实施例中,载体可操作地连接编码包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的重链可变区的核酸。在一个实施例中,核酸编码包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的轻链可变区。
[0106]
转基因是在转基因与载体之间存在连接时“可操作地连接”至载体以允许包含于载体中的转基因序列的功能化或表达。在一个实施例中,转基因是在调节序列影响转基因的表达(例如表达的程度、定时或位置)时“可操作地连接”至调节序列。
[0107]
本文使用的术语“转染”或“转化”或“转导”或其它相关术语是指将外源核酸(例如转基因)转移或引入到宿主细胞中的过程。“转染”或“转化”或“转导”的宿主细胞为已经被外源核酸(转基因)转染、转化或转导者。宿主细胞包括原代个体细胞和其子代。可将编码本文描述的轻链、重链或抗lag3抗体中的任一者的至少一部分的外源核酸引入到宿主细胞中。可将包含本文描述的轻链、重链或抗lag3抗体中的任一者的至少一部分的表达载体引入到宿主细胞中,且所述宿主细胞可表达包含轻链、重链或抗lag3抗体的至少一部分的多肽。
[0108]
如本文所用的术语“宿主细胞”或“宿主细胞群体”或相关术语是指已引入外来(外源或转基因)核酸的细胞(或其群体)。外来核酸可包括可操作地连接到转基因的表达载体,且所述宿主细胞可用于表达通过外来核酸(转基因)编码的核酸和/或多肽。宿主细胞(或其群体)可为培养的细胞或可从个体提取。宿主细胞(或其群体)包括原代个体细胞和其子代而无需考虑继代培养次数。与亲本细胞相比,子代细胞可携带或可不携带相同遗传物质。宿主细胞包括子代细胞。在一个实施例中,宿主细胞描述已以任何方式进行修饰、转染、转导、转化和/或操纵以表达抗体的任何细胞(包括其子代),如本文所公开。在一个实例中,宿主细胞(或其群体)可利用可操作地连接到本文描述的编码所需抗体或其抗原结合部分的核酸的表达载体引入。宿主细胞和其群体可携载被稳定整合到宿主的基因组中的表达载体或可携载染色体外表达载体。在一个实施例中,宿主细胞和其群体可携载染色体外载体,其在数次细胞分裂后存在或系瞬时存在之后存在或在数次细胞分裂后丢失。
[0109]
转基因宿主细胞可使用非病毒方法,包括众所周知的设计核酸酶(包括锌指核酸酶)、talens或crispr/cas来制备。可使用基因组编辑技术(诸如锌指核酸酶)将转基因引入
到宿主细胞的基因组中。锌指核酸酶包括一对嵌合蛋白,每一者包含融合至来自工程化锌指基元的dna结合结构域的限制性内切核酸酶(例如foki)的非特异性内切核酸酶结构域。可将dna结合结构域工程化以结合宿主的基因组中的特异性序列且核酸内切酶结构域进行双链切割。供体dna携带转基因(例如编码本文描述的car或dar构建体的核酸中的任一者)和与宿主细胞的基因组中所欲插入位点的任一侧上的区域同源的侧接序列。宿主细胞的dna修复机制可通过同源dna修复精确插入转基因。已使用锌指核酸酶制备转基因哺乳动物宿主细胞(美国专利第9,597,357号、第9,616,090号、第9,816,074号和第8,945,868号)。转基因宿主细胞可使用talen(转录活化因子样效应核酸酶)来制备,talen与锌指核酸酶的类似之处在于其包含融合至可递送精确转基因插入的dna结合结构域的非特异性核酸内切酶结构域。与锌指核酸酶类似,talen也在宿主的dna中引入双链切割。转基因宿主细胞可使用crispr(成簇的规律间隔的短回文重复序列)来制备。crispr采用被偶联至导引rna以进行靶特异性供体dna整合的cas内切核酸酶。导引rna包括在靶dna中的grna结合区的上游包含原型间隔体邻近基元(pam)序列的保守性多核苷酸,且与宿主细胞靶位点杂交,在此处cas内切核酸酶裂解双链靶dna。指导rna可设计成与特异性靶位点杂交。类似于锌指核酸酶和talen,crispr/cas系统可用于引入具有与插入位点具有同源性的侧接序列的供体dna的位点特异性插入。用于修饰基因组的crispr/cas系统的实例描述于例如美国专利第8,697,359号、第10,000,772号、第9,790,490号和美国专利申请公开案第us 2018/0346927号中。在一个实施例中,转基因宿主细胞可使用锌指核酸酶、talen或crispr/cas系统来制备,且宿主靶位点可为trac基因(t细胞受体α恒定区)。供体dna可包含例如编码本文描述的car或dar构建体的核酸中的任一者。可使用电穿孔、核染或脂质转染以锌指核酸酶、talen或crispr/cas系统将供体dna共递送至宿主细胞中。
[0110]
宿主细胞可为原核生物,例如大肠杆菌(e.coli),或其可为真核生物,例如单细胞化真核生物(例如酵母或其它真菌)、植物细胞(例如烟草或西红柿植物细胞)、哺乳动物细胞(例如人细胞、猴细胞、仓鼠细胞、大鼠细胞、小鼠细胞或昆虫细胞)或融合瘤。在一个实施例中,宿主细胞可引入可操作地连接到编码所需抗体的核酸的表达载体,由此产生转染/转化的宿主细胞,将其在适于转染/转化的宿主细胞表达抗体的条件下进行培养,且视需要从转染/转化的宿主细胞回收抗体(例如从宿主细胞裂解物回收)或从培养基回收。在一个实施例中,宿主细胞包含非人类细胞,包括cho、bhk、ns0、sp2/0和yb2/0。在一个实施例中,宿主细胞包含人细胞,包括hek293、ht-1080、huh-7和per.c6。宿主细胞的实例包括猴肾细胞的cos-7株(atcc crl 1651)(参见gluzman等人,1981,《细胞(cell)》23:175)、l细胞、c127细胞、3t3细胞(atcc ccl 163)、中国仓鼠卵巢(cho)细胞或其衍生物诸如veggie cho和相关细胞系,其生长于无血清培养基中(参见rasmussen等人,1998,《细胞技术学(cytotechnology)》28:31)或cho品系dx-b 11,其是缺乏dhfr的(参见urlaub等人,1980,《美国国家科学院院刊》77:4216-20)、hela细胞、bhk(atcc crl 10)细胞系、衍生自非洲绿猴肾细胞系cv1(atcc ccl 70)的cv1/ebna细胞系(参见mcmahan等人,1991,《欧洲分子生物学学报(embo j.)》10:2821)、人胚胎肾细胞,诸如293、293ebna或msr 293、人表皮a431细胞、人colo 205细胞、其它转化的灵长类细胞系、正常二倍体细胞、衍生自初级组织的体外培养的细胞系、初级外植体、hl-60、u937、hak或jurkat细胞。在一个实施例中,宿主细胞包括淋巴样细胞诸如y0、ns0或sp20。在一个实施例中,宿主细胞为哺乳动物宿主细胞,但不是
人宿主细胞。通常,宿主细胞为可用编码多肽的核酸转化或转染的培养细胞,所述编码多肽的核酸可然后在宿主细胞中进行表达。词组“转基因宿主细胞”或“重组宿主细胞”可用于表示已经用待表达的核酸转化或转染的宿主细胞。宿主细胞还可以为包含核酸但不以所需程度表达其的细胞,除非将调节序列引入到宿主细胞中使得其变成与核酸可操作地连接。应了解,术语宿主细胞不仅指特定个体细胞而且指这种细胞的子代或潜在子代。因为某些修饰可由于例如突变或环境影响而在后代中发生,这类子代可能事实上与亲本细胞不同,但仍包括在如本文所用的术语的范围内。
[0111]
本文描述了一种宿主细胞或宿主细胞群体,其携载可操作地连接到编码抗体轻链、抗体重链、抗lag3抗体或其抗原结合部分的核酸的载体(例如表达载体)。在一个实施例中,宿主细胞携载可操作地连接编码包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的重链可变区的核酸。在一个实施例中,核酸编码包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的轻链可变区。
[0112]
本发明的多肽(例如抗体和抗原结合蛋白)可使用本领域中已知的任何方法来产生。在一个实例中,多肽通过重组核酸方法,通过将编码多肽的核酸序列(例如dna)插入到重组表达载体中,将重组表达载体引入到宿主细胞中且通过宿主细胞在促进表达的条件下表达来产生。
[0113]
用于重组核酸操纵的一般技术描述于例如sambrook等人,《分子克隆实验指南》,第1至3卷,cold spring harbor laboratory press,第2版,1989,或f.ausubel等人,《分子生物学实验室指南》(green publishing and wiley-interscience:new york,1987)中且定期更新,其以全文引用的方式并入本文中。编码多肽的核酸(例如dna)可操作地连接到携带衍生自哺乳动物、病毒或昆虫基因的一种或多种适宜转录或翻译调节组件的表达载体。这类调节组件包括转录启动子、控制转录的可选操作子序列、编码适宜mrna核糖体结合位点的序列,和控制转录和翻译的终止的序列。表达载体可包括赋予宿主细胞中复制能力的复制起点。表达载体可包括赋予选择以促进识别转基因宿主细胞(例如转化体)的基因。
[0114]
重组dna还可编码可用于纯化蛋白质的任何类型的蛋白质标签序列。蛋白质标签的实例包括但不限于组氨酸标签、flag标签、myc标签、ha标签或gst标签。适于与细菌、真菌、酵母和哺乳动物细胞宿主一起使用的适宜克隆和表达载体可参见《分子克隆实验指南(cloning vectors:a laboratory manual)》(elsevier,n.y.,1985)。
[0115]
可使用适合宿主细胞的方法将表达载体构建体引入到宿主细胞中。本领域中已知用于将核酸引入到宿主细胞中的多种方法,包括但不限于电穿孔;采用氯化钙的转染、氯化铷、磷酸钙、deae-葡聚糖,或其它物质;病毒转染;非病毒转染;微粒轰击(microprojectile bombardment);脂质转染;和感染(例如其中所述载体为传染原(infectious agent))。适宜宿主细胞包括原核生物、酵母、哺乳动物细胞或细菌细胞。
[0116]
适宜细菌包括革兰氏阴性或革兰氏阳性生物,例如大肠杆菌(e.coli)或芽孢杆菌属(bacillus spp.)。酵母(优选来自酵母菌属(saccharomyces)物种,诸如酿酒酵母细胞(s.cerevisiae))也可用于产生多肽。还可使用各种哺乳动物或昆虫细胞培养系统以表达重组蛋白。luckow和summers(《生物技术(bio/technology)》,6:47,1988)评论用于在昆虫细胞中产生异源蛋白的杆状病毒系统。适宜哺乳动物宿主细胞系的实例包括内皮细胞、cos-7猴肾细胞、cv-1、l细胞、c127、3t3、中国仓鼠卵巢(cho)、人胚肾细胞、hela、293、293t
和bhk细胞系。纯化的多肽通过培养适宜宿主/载体系统以表达重组蛋白来制备。对于许多应用,本文公开的许多多肽的小尺寸将在大肠杆菌中的表达作为优选表达方法。然后从培养基或细胞提取物纯化蛋白质。轻链、重链或抗lag3抗体或其抗原结合蛋白中的任一者均可通过转基因宿主细胞表达。
[0117]
本文公开的抗体和抗原结合蛋白还可使用细胞翻译系统来产生。为了此目的,必须修饰编码多肽的核酸以允许体外转录产生mrna且允许mrna在利用的特定无细胞系统(真核生物(诸如哺乳动物或酵母无细胞翻译系统)或原核生物(诸如细菌无细胞翻译系统))中的无细胞翻译。
[0118]
编码本文公开的各种多肽中的任一者的核酸可化学合成。可选择密码子使用以便改良在细胞中的表达。这种密码子使用将取决于所选择的细胞类型。已开发针对于大肠杆菌和其它细菌、以及哺乳动物细胞、植物细胞、酵母细胞和昆虫细胞的专用密码子使用模式。参见例如:mayfield等人,《美国国家科学院院刊》.2003 100(2):438-42;sinclair等人《蛋白质表达与纯化》2002(1):96-105;connell n d.《生物技术当前述评》2001 12(5):446-9;makrides等人《微生物学评论(microbiol.rev.)》1996 60(3):512-38;和sharp等人《酵母(yeast)》.1991 7(7):657-78。
[0119]
本文描述的抗体和抗原结合蛋白还可通过化学合成(例如通过描述于《固相肽合成(solid phase peptide synthesis)》,第2版,1984,the pierce chemical co.,rockford,ill.中的方法)来产生。蛋白质的修饰还可通过化学合成来产生。
[0120]
本文描述的抗体和抗原结合蛋白可通过针对于蛋白质化学领域中一般已知的蛋白质分离/纯化方法来纯化。非限制性实例包括萃取、再结晶、盐析(例如用硫酸铵或硫酸钠)、离心、透析、超过滤、吸附色谱法、离子交换色谱法、疏水色谱法、正相色谱法、反相色谱法、凝胶过滤、凝胶渗透色谱法、亲和色谱法、电泳、逆流分布或这些的任何组合。纯化后,可通过本领域已知的多种方法(包括但不限于过滤和透析)中的任一者将多肽交换至不同缓冲液中和/或浓缩。
[0121]
本文描述的纯化的抗体和抗原结合蛋白优选至少65%纯,至少75%纯,至少85%纯,更优选至少95%纯,且最优选至少98%纯。不论纯度的确切数值,多肽足够纯以用作医药产品。本文描述的轻链、重链或抗lag3抗体或其抗原结合蛋白中的任一者均可通过转基因宿主细胞表达且然后使用任何本领域已知的方法纯化到约65%至98%纯度或高纯度水平。
[0122]
在某些实施例中,本文的抗体和抗原结合蛋白可进一步包含翻译后修饰。示例性翻译后蛋白质修饰包括磷酸化、乙酰化、甲基化、adp-核糖基化、泛素化、糖基化、羰基化、类泛素化、生物素化或添加多肽侧链或疏水基团。因此,经修饰的多肽可包含非氨基酸组分,诸如脂质、多糖或单糖和磷酸盐。糖基化的优选形式是唾液酸化,其将一个或多个唾液酸部分结合至多肽。唾液酸部分改良溶解度和血清半衰期同时还降低蛋白质的可能的免疫原性。参见raju等人《生物化学》.2001 31;40(30):8868-76。
[0123]
在一个实施例中,本文描述的抗体和抗原结合蛋白可被修饰成可溶性多肽,其包括将抗体和抗原结合蛋白连接到非蛋白质聚合物。在一个实施例中,非蛋白质聚合物包括聚乙二醇(“peg”)、聚丙二醇或聚氧亚烷基,以第4,640,835号、第4,496,689号、第4,301,144号、第4,670,417号、第4,791,192号或第4,179,337号中所述的方式。
[0124]
peg是水溶性聚合物,其可购买获得或可根据本领域中众所周知的方法通过乙二醇的开环聚合来制备(sandler和karo,《聚合物合成(polymer synthesis)》,academic press,new york,第3卷,第138至161页)。术语“peg”广泛用于涵盖任何聚乙二醇分子,而不考虑大小或在peg端处的修饰,且可由下式表示:x—o(ch2ch2o)n—ch2ch2oh(1),其中n为20至2300且x为h或末端修饰,例如c
1-4
烷基。在一个实施例中,peg在一端以羟基或甲氧基终止,即x为h或ch3(“甲氧基peg”)。peg可包含结合反应所需的其它化学基团;这由分子的化学合成所致的;或其为分子的部分的最优选距离的间隔基。另外,这种peg可由连接在一起的一个或多个peg侧链组成。具有超过一个peg链的peg称为多臂或分支链peg。分支链peg可例如通过将聚环氧乙烷添加至各种多元醇(包括甘油、新戊四醇和山梨糖醇)来制备。例如,四臂分支链peg可由新戊四醇和环氧乙烷来制备。分支链peg描述于例如ep-a0 473 084和美国专利第5,932,462号中。peg的一种形式包含经由赖氨酸的伯氨基连接的两个peg侧链(peg2)(monfardini等人,《生物共轭化学(bioconjugate chem.)》6(1995)62-69)。
[0125]
相对于结合多肽的未修饰的抗体和抗原结合蛋白的清除率,peg修饰的多肽的血清清除率可调节(例如增加或减少)约10%、20%、30%、40%、50%、60%、70%、80%或甚至90%。peg修饰的抗体和抗原结合蛋白可具有相对于未修饰的多肽的半衰期延长的半衰期(t
1/2
)。相对于未修饰的抗体和抗原结合蛋白的半衰期,peg修饰的多肽的半衰期可延长至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、125%、150%、175%、200%、250%、300%、400%或500%、或甚至1000%。在一些实施例中,蛋白质半衰期是在体外,诸如在缓冲盐水溶液中或在血清中测定的。在其它实施例中,蛋白质半衰期为体内半衰期,诸如蛋白质在动物的血清或其它体液中的半衰期。
[0126]
本发明提供了治疗组合物,其包含本文描述的轻链、重链或抗lag3抗体或其抗原结合蛋白中的任一者和药学上可接受的赋形剂。赋形剂涵盖运载体、稳定剂和赋形剂。药学上可接受的赋形剂的例子包括例如惰性稀释剂或填充剂(例如蔗糖和山梨糖醇)、润滑剂、助滑剂和抗粘着剂(例如硬脂酸镁、硬脂酸锌、硬脂酸、二氧化硅、氢化植物油或滑石)。其它实例包括缓冲剂、稳定剂、防腐剂、非离子清洁剂、抗氧化剂和等渗剂(isotonifier)。
[0127]
治疗组合物和其制备方法是本领域中众所周知的且参见例如“《雷明顿:药物科学和实践(remington:the science and practice of pharmacy)》”(第20版,编辑a.r.gennaro ar.,2000,lippincott williams&wilkins,philadelphia,pa.)。可被配制用于肠胃外施用的治疗组合物可包含,且可例如包含赋形剂、无菌水、盐水、聚烷二醇(诸如聚乙二醇)、植物来源的油或氢化萘。生物相容性、生物可降解的乳交酯聚合物、乳交酯/乙交酯共聚物或聚氧乙烯-聚氧丙烯共聚物可用于控制本文描述的抗体(或其抗原结合部分)的释放。纳米粒子制剂(例如生物可降解的纳米粒子、固体脂质纳米粒子、脂质体)可用于控制抗体(或其抗原结合部分)的生物分布。其它可能适用的肠胃外递送系统包括乙烯-乙酸乙烯酯共聚物颗粒、渗透泵、植入式输注系统和脂质体。抗体(或其抗原结合蛋白)在制剂中的浓度取决于许多因素(包括待施用的药物的剂量和施用途径)而变化。
[0128]
抗lag3抗体(或其抗原结合部分)中的任一者可呈药学上可接受的盐(诸如通常用于医药工业中的非毒性酸加成盐或金属络合物)施用。酸加成盐的实例包括有机酸,诸如乙酸、乳酸、扑酸、马来酸、柠檬酸、苹果酸、抗坏血酸、琥珀酸、苯甲酸、棕榈酸、辛二酸、水杨酸、酒石酸、甲磺酸、甲苯磺酸或三氟乙酸等;聚合酸,诸如单宁酸、羧甲基纤维素等;以及无
机酸,诸如盐酸、氢溴酸、硫酸、磷酸等。金属络合物包括锌、铁等。在一个实例中,抗体(或其抗原结合部分)在乙酸钠存在下配制以增加热稳定性。
[0129]
可被配制用于口服使用的抗lag3抗体(或其抗原结合部分)中的任一者包括包含活性成分与非毒性药学上可接受的赋形剂的混合物的片剂。用于口服使用的制剂也可呈可嚼片剂或呈其中所述活性成分与惰性固体稀释剂混合的硬明胶胶囊,或呈其中所述活性成分与水或油介质混合的软明胶胶囊提供。
[0130]
如本文所用的术语“个体”是指人和非人类动物,包括脊椎动物、哺乳动物和非哺乳动物。在一个实施例中,个体可为人、非人类的灵长类动物、猿猴、猿、鼠类(例如小鼠和大鼠)、牛、猪、马、犬科、猫科、山羊、狼(lupine)、蛙科或鱼类。
[0131]
术语“施用(administering/administered)”和语法变化形式是指使用本领域的技术人员已知的各种方法和递送系统中的任一者将药剂物理引入到个体。本文公开的制剂的示例性施用途径包括静脉内、肌肉内、皮下、腹膜内、脊柱或其它肠胃外施用途径,例如通过注射或输注。如本文所用的词组“肠胃外施用”意指除肠内和局部施用以外的施用模式(通常通过注射),且包括但不限于静脉内、肌肉内、动脉内、鞘内、淋巴内、病灶内、囊内、眶内、心脏内、皮内、腹膜内、经气管、皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注、以及体内电穿孔。在一些实施例中,制剂经由肠胃外途径,例如经口施用。其它肠胃外途径包括局部、表皮或粘膜施用途径,例如经鼻内、经阴道、经直肠、经舌下或经局部。施用还可例如一次、多次和/或在一个或多个延长时期内进行。本文描述的抗lag3抗体(或其抗原结合蛋白)中的任一者可使用本领域已知的方法和递送途径施用于个体。
[0132]
术语“有效量”、“治疗有效量”或“有效剂量”或相关术语可互换使用且是指在施用于个体时足以实现与肿瘤或癌症抗原表达相关的疾病或疾患的可测量的改良或预防的抗体或抗原结合蛋白(例如本文描述的抗lag3抗体或其抗原结合部分中的任一者)的量。当单独或组合使用时,本文提供的抗体的治疗有效量将取决于抗体和组合的相对活性(例如在抑制细胞生长中)且取决于所治疗的个体和疾病病症、个体的体重和年龄和性别、个体的疾病病状严重度、施用方式等而变化,这可由本领域的技术人员容易地确定。
[0133]
在一个实施例中,治疗有效量将取决于待治疗的个体的某些方法和待治疗的疾患且可由本领域的技术人员使用已知技术来确定。一般来说,多肽以约0.01g/kg/天至约50mg/kg/天,优选0.01mg/kg/天至约30mg/kg/天,最优选0.1mg/kg/天至约20mg/kg/天施用。多肽可每天(例如每天一次、每天两次、每天三次或每天四次)或优选较不频繁(例如每周、每两周、每三周、每月或每季度)施用。另外,如本领域中已知,可能需要针对年龄以及体重、一般健康、性别、饮食、施用时间、药物相互作用和疾病的严重度加以调整。
[0134]
本发明提供了用于治疗患有与lag3的表达相关的疾病的个体的方法。所述疾病包括表达肿瘤相关抗原的癌症或肿瘤细胞。在一个实施例中,癌症或肿瘤包括前列腺癌、乳腺癌、卵巢癌、头颈癌、膀胱癌、皮肤癌、结肠直肠癌、肛门癌、直肠癌、胰腺癌、肺癌(包括非小细胞肺癌和小细胞肺癌)、平滑肌瘤、脑癌、神经胶质瘤、神经胶质母细胞瘤、食道癌、肝癌、肾癌、胃癌、结肠癌、子宫颈癌、子宫癌、子宫内膜癌、外阴癌、喉头癌、阴道癌、骨癌、鼻腔癌、鼻旁窦癌、鼻咽癌、口腔癌、口咽癌、喉头癌、下喉部癌、唾液腺癌、输尿管癌、尿道癌、阴茎癌和睾丸癌。
[0135]
在一个实施例中,癌症包括血液学癌症,包括白血病、淋巴瘤、骨髓瘤和b细胞淋巴
瘤。血液学癌症包括多发性骨髓瘤(mm)、非霍奇金淋巴瘤(non-hodgkin's lymphoma)(nhl)(包括伯基特淋巴瘤(burkitt's lymphoma)(bl))、b慢性淋巴细胞性白血病(b-cll)、全身性红斑狼疮(sle)、b和t急性淋巴细胞性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、弥漫性大b细胞淋巴瘤、慢性骨髓性白血病(cml)、毛细胞白血病(hcl)、滤泡淋巴瘤、瓦尔登斯特伦巨球蛋白血症(waldenstrom's macroglobulinemia)、套细胞淋巴瘤(mantle cell lymphoma)、霍奇金淋巴瘤(hodgkin's lymphoma)(hl)、浆细胞骨髓瘤、前体b细胞淋巴母细胞性白血病/淋巴瘤、浆细胞瘤、巨细胞骨髓瘤、浆细胞骨髓瘤、重链骨髓瘤、轻链或本斯-琼斯氏(bence-jones)骨髓瘤、淋巴瘤样肉芽肿病、移植后淋巴增生性病变、免疫调节失调症、类风湿性关节炎、重症肌无力症、特发性血小板减少性紫癜、抗磷脂综合征、恰加斯病(chagas'disease)、格雷夫斯病(grave's disease)、韦氏肉芽肿病(wegener's granulomatosis)、结节性多动脉炎、舍格伦综合征(sjogren's syndrome)、寻常型天疱疮、硬皮病、多发性硬化症、抗磷脂综合征、anca相关血管炎、古德帕斯丘症(goodpasture's disease)、川崎病(kawasaki disease)、自体免疫溶血性贫血和快速进行性肾丝球肾炎、重链疾病、原发性或免疫细胞相关淀粉样变性病,和意义不明单克隆免疫球蛋白增高症。
[0136]
本发明提供了特异性结合lag3的工程化lag3结合蛋白,特别是抗lag3抗体或其抗原结合部分,和其用途。抗lag3抗体展现改良的特征,其中所述改良的特征包括改良的与lag3抗原的结合、改良的与lag3表达细胞的结合和/或更高程度的细胞因子释放活性。抗lag3抗体可与食蟹猕猴和/或小鼠lag3抗原交叉反应(结合)。
[0137]
本发明提供了完全人抗lag3抗体和其片段,其可充当免疫检查点抑制剂且可用于用于治疗疾患(诸如癌症)的免疫疗法中。
[0138]
在一些实施例中,本发明提供了抗原结合蛋白诸如igg类别的完全人抗体,其结合至lag3多肽(例如靶抗原)的表位或lag3多肽的片段。在一个实施例中,lag3靶抗原包含具有野生型或多态性或突变氨基酸序列的多肽。在一个实施例中,lag3靶抗原包含人lag3多肽(uniprotkb p18627;seq id no:1)、食蟹猕猴lag3多肽(ncbi登录号xp005570011.1;seq id no:2)、或小鼠lag3多肽(uniprotkb q61790;seq id no:3),或显示于图1中的这些lag3多肽中的任一者的片段。lag3靶抗原可通过重组方法来制备或可化学合成。lag3靶抗原可为呈可溶性形式或膜结合形式(例如通过细胞或噬菌体表达)。在一个实施例中,lag3靶抗原包含细胞表面lag3抗原的细胞外部分。在一个实施例中,lag3靶抗原通过细胞(例如天然表达lag3的癌细胞系或非癌细胞系)表达,或通过被工程化成表达lag3的细胞系(诸如cho、hela、hek293、jurkat或panoply
tm
(来自creative biogene,shirley,new york))表达。预期不自然表达lag3的细胞系不结合抗lag3抗体。lag3靶抗原可为融合蛋白或例如与可检测的部分(诸如荧光团)结合。lag3靶抗原可为具有或不具有亲和标签(诸如组氨酸标签)的重组多肽。lag3靶抗原可为来自人、小鼠或食蟹猕猴的生物素化lag3蛋白(例如目录号la3-h82fb,来自acrobiosystems的生物素化人lag3蛋白)。
[0139]
在一个实施例中,野生型和/或突变人lag3抗原可用于比较本文描述的抗lag3抗体中的任一者的结合能力的分析中和/或表位图谱分析中。
[0140]
本发明提供了抗原结合蛋白,诸如igg类别的完全人抗体,其中所述抗体结合lag3多肽(靶抗原)的表位,其中所述抗体包含与seq id no:4、6、8或10的氨基酸序列或其组合
2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。抗体1c5-3a6、2d12-2e3-n102d、5c8和8d9的重链可变区和轻链可变区的氨基酸序列显示于图2中。
[0148]
本发明提供了fab完全人抗体片段,其包含来自抗体重链的可变区和来自抗体轻链的可变区。在一些实施例中,来自重链的可变区的序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性,且来自轻链的可变区的序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。在一些实施例中,来自重链的可变区的序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性,且来自轻链的可变区的序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。抗体1c5-3a6、2d12-2e3-n102d、5c8和8d9的重链可变区和轻链可变区的氨基酸序列显示于图2中。
[0149]
本发明提供了fab完全人抗体片段,其包含重链可变区和轻链可变区,其中所述重链/轻链可变区氨基酸序列与以下氨基酸序列组中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0150]
本发明提供了单链完全人抗体,其包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将重链可变区和轻链可变区接合的连接子(例如肽连接子)的多肽链。在一些实施例中,重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,且轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一些实施例中,重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,且轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。
[0151]
本发明提供了单链完全人抗体,其包含具有重链可变区和轻链可变区的多肽,其中所述重链/轻链可变区氨基酸序列组与以下氨基酸序列组中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。在一个实施例中,单链完全人抗体包含将重链可变区和轻链可变区接合的可选连接子(例如肽连接子)。
[0152]
本发明提供了治疗组合物,其包含本文描述的抗lag3抗体或其抗原结合蛋白中的任一者和药学上可接受的赋形剂。赋形剂涵盖运载体和稳定剂。在一个实施例中,治疗组合物包含抗lag3抗体或其抗原结合片段,其包含重链可变区和轻链可变区,其中所述重链/轻
链可变区氨基酸序列与以下氨基酸序列组中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0153]
本发明提供了一种试剂盒,其包含所公开的完全人抗lag3抗体中的任何一者或其抗原结合片段中的任一者或本文描述的fab片段或单链抗体中的任一者。
[0154]
本发明提供了一种核酸,其编码与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体重链可变区。本发明提供了一种核酸,其编码与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体轻链可变区。
[0155]
本发明提供了第一核酸,其编码与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体重链可变区。本发明提供了第二核酸,其编码与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体轻链可变区。
[0156]
本发明提供了一种核酸,其编码与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体重链可变区,且所述核酸编码与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的抗体轻链可变区。
[0157]
本发明提供了一种核酸,其编码同时包含重链和轻链的抗体,其中所述重链/轻链可变区氨基酸序列与以下氨基酸序列组中的任一者具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0158]
本发明提供了编码fab完全人抗体片段的核酸,所述fab完全人抗体片段包含来自重链的可变区和来自轻链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。本发明提供了编码fab完全人抗体片段的核酸,所述fab完全人抗体片段包含来自重链的可变区和来自轻链的可变区,其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。
[0159]
本发明提供了编码fab完全人抗体片段的第一核酸,所述fab完全人抗体片段包含来自重链的可变区和来自轻链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少
97%同一性,或至少98%同一性,或至少99%同一性。本发明提供了编码fab完全人抗体片段的第二核酸,所述fab完全人抗体片段包含来自重链的可变区和来自轻链的可变区,其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。
[0160]
本发明提供了编码fab完全人抗体片段的核酸,所述fab完全人抗体片段包含来自重链的可变区和来自轻链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性,且所述核酸编码来自轻链的可变区,其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性。
[0161]
本发明提供了编码fab完全人抗体片段的核酸,所述fab完全人抗体片段包含重链可变区和轻链可变区,其中所述重链/轻链可变区氨基酸序列与以下氨基酸序列组中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0162]
本发明提供了编码单链完全人抗体的核酸,所述单链完全人抗体包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将重链可变区和轻链可变区接合的连接子(例如肽连接子)的多肽链。在一些实施例中,所述核酸编码重链可变区,所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,且所述核酸编码轻链可变区,所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一个实施例中,肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。
[0163]
本发明提供了编码单链完全人抗体的核酸,所述单链完全人抗体包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将重链可变区和轻链可变区接合的连接子(例如肽连接子)的多肽。在一些实施例中,重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,且轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一个实施例中,肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。
[0164]
本发明提供了编码单链完全人抗体的核酸,所述单链完全人抗体为包含具有重链可变区和轻链可变区的多肽链的单链抗体,其中所述重链/轻链可变区氨基酸序列组与以
下氨基酸序列组中的任一者具有至少95%同一性,或至少96%同一性,或至少97%同一性,或至少98%同一性,或至少99%同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。在一个实施例中,所述核酸编码包含将可变重链区和可变轻链区接合的可选连接子(例如肽连接子)的单链完全人抗体。在一个实施例中,肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。
[0165]
本发明提供了可操作地连接到编码重链可变区的第一核酸的第一载体(例如第一表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,和可操作地连接到编码轻链可变区的第二核酸的第二载体(例如第二表达载体),所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。
[0166]
本发明提供了可操作地连接到编码重链可变区的第一核酸的第一载体(例如第一表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一个实施例中,所述第一载体还可操作地连接到编码轻链可变区的第二核酸,所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。
[0167]
本发明提供了可操作地连接到编码重链可变区和轻链可变区的核酸的载体(例如表达载体),所述重链可变区和轻链可变区与以下氨基酸序列组中的任一者具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0168]
本发明提供了可操作地连接到编码fab完全人抗体片段的第一核酸的第一载体(例如第一表达载体),所述fab完全人抗体片段包含与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的重链可变区。本发明还提供了可操作地连接到编码fab完全人抗体片段的第二核酸的第二载体(例如第二表达载体),所述fab完全人抗体片段包含与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性的轻链可变区。
[0169]
本发明提供了可操作地连接到编码包含重链可变区的fab完全人抗体片段的第一核酸的第一载体(例如第一表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一个实施例中,所述第一载体还可操作地连接
到编码轻链可变区的第二核酸,所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。
[0170]
本发明提供了可操作地连接到编码包含重链可变区和轻链可变区的fab完全人抗体片段的核酸的载体(例如表达载体),所述重链可变区和轻链可变区与以下氨基酸序列组中的任一者具有至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。
[0171]
本发明提供了可操作地连接到编码单链完全人抗体的核酸的第一载体(例如第一表达载体),所述单链完全人抗体包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将重链可变区和轻链可变区接合的连接子(例如肽连接子)的多肽链,其中所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性,且其中所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性。在一个实施例中,肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。
[0172]
本发明提供了可操作地连接到编码单链完全人抗体的核酸的第一载体(例如第一表达载体),所述单链完全人抗体包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将可变轻链和重链可变区接合的连接子(例如肽连接子)的多肽链,其中所述重链可变区包含与以下氨基酸序列组中的任一者的至少95%序列同一性,或至少96%序列同一性,或至少97%序列同一性,或至少98%序列同一性,或至少99%序列同一性:seq id no:seq id no:4和5(本文称为1c5-3a6)、seq id no:6和7(本文称为2d12-2e3-n102d)、seq id no:8和9(本文称为5c8)、或seq id no:10和11(本文称为8d9)。在一个实施例中,肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。
[0173]
本发明提供了宿主细胞或宿主细胞群体,其中所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码重链可变区的第一核酸的第一载体(例如第一表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列的至少95%序列同一性,且所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码轻链可变区的第二核酸的第二载体(例如第二表达载体),所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性。在一个实施例中,第一表达载体指导重链可变区在宿主细胞或宿主细胞群体中的表达且第二表达载体指导轻链可变区在宿主细胞或宿主细胞群体中的表达。
[0174]
本发明提供了第一宿主细胞或第一宿主细胞群体,其中所述第一宿主细胞或所述来自所述第一宿主细胞群体的单个宿主细胞携载可操作地连接到编码重链可变区的第一核酸的第一载体(例如第一表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨
基酸序列的至少95%序列同一性,和第二宿主细胞或第二宿主细胞群体,其中所述第二宿主细胞或来自第二宿主细胞群体的单个宿主细胞携载可操作地连接到编码轻链可变区的第二核酸的第二载体(例如第二表达载体),所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性。在一个实施例中,第一表达载体指导重链可变区在第一宿主细胞中的表达,且第二表达载体指导轻链可变区在第二宿主细胞中的表达。
[0175]
本发明提供了宿主细胞或宿主细胞群体,其中所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码重链可变区的第一核酸的载体(例如表达载体),所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列的至少95%序列同一性,且所述宿主细胞中的载体还可操作地连接到编码轻链可变区的第二核酸,所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列的至少95%序列同一性。在一个实施例中,表达载体指导重链可变区和轻链可变区在宿主细胞中的表达。
[0176]
本发明提供了宿主细胞或宿主细胞群体,其中所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码fab完全人抗体片段的第一核酸的第一载体(例如第一表达载体),所述fab完全人抗体片段包含来自重链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性。在一个实施例中,宿主细胞或来自宿主细胞群的单个宿主细胞还携载可操作地连接到编码来自轻链的可变区的第二核酸的第二载体(例如第二表达载体),其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性。在一个实施例中,第一表达载体指导重链可变区在宿主细胞中的表达且第二表达载体指导轻链可变区在宿主细胞中的表达。
[0177]
本发明提供了第一宿主细胞或第一宿主细胞群体,其中所述第一宿主细胞或来自第一宿主细胞群体的单个宿主细胞携载可操作地连接到编码fab完全人抗体片段的第一核酸的第一载体(例如第一表达载体),所述fab完全人抗体片段包含来自重链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性。本发明还提供了第二宿主细胞或第二宿主细胞群体,其中所述第二宿主细胞或来自第二宿主细胞群体的单个宿主细胞携载可操作地连接到编码来自轻链的可变区的第二核酸的第二载体(例如第二表达载体),其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性。在一个实施例中,第一表达载体指导重链可变区在第一宿主细胞中的表达,且第二表达载体指导轻链可变区在第二宿主细胞中的表达。
[0178]
本发明提供了宿主细胞或宿主细胞群体,其中所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码fab完全人抗体片段的第一核酸的载体(例如表达载体),所述fab完全人抗体片段包含来自重链的可变区,其中所述来自重链的可变区的氨基酸序列与seq id no:4、6、8或10的氨基酸序列或其组合具有至少95%同一性,且所述宿主细胞中的载体还可操作地连接到编码轻链可变区的第二核酸,其中所述来自轻链的可变区的氨基酸序列与seq id no:5、7、9或11的氨基酸序列或其组合具有至少95%同一性。在一个实施例中,表达载体指导重链可变区和轻链可变区在宿主细胞中的表达。
[0179]
本发明提供了宿主细胞或宿主细胞群体,其中所述宿主细胞或来自所述宿主细胞群体的单个宿主细胞携载可操作地连接到编码单链完全人抗体的核酸的第一载体(例如第
一表达载体),所述单链完全人抗体包含具有来自完全人重链的可变区和来自完全人类轻链的可变区和视需要的将重链可变区和轻链可变区接合的连接子(例如肽连接子)的多肽链,其中所述重链可变区包含与seq id no:4、6、8或10的氨基酸序列或其组合的至少95%序列同一性,且其中所述轻链可变区包含与seq id no:5、7、9或11的氨基酸序列或其组合的至少95%序列同一性。在一个实施例中,第一载体包括编码肽连接子的核酸序列,所述肽连接子包含氨基酸序列(ggggs)n(seq id no:12),其中n为1至6。在一个实施例中,所述肽连接子包含氨基酸序列ggggsggggsggggs(seq id no:13)。在一个实施例中,表达载体指导单链抗体在宿主细胞中的表达。
[0180]
本发明提供了一种用于制备具有抗体重链可变区的第一多肽的方法,所述方法包括:在适于表达具有与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的抗体重链可变区的第一多肽的条件下培养携载第一表达载体的第一宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从第一宿主细胞群体回收与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的所表达的第一多肽。
[0181]
本发明提供了一种用于制备具有抗体轻链可变区的第二多肽的方法,所述方法包括:在适于表达具有与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的抗体轻链可变区的第二多肽的条件下培养携载第二表达载体的第二宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从第二宿主细胞群体回收与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的所表达的第二多肽。
[0182]
本发明提供了一种用于制备具有抗体重链可变区的第一多肽,且用于制备具有抗体轻链可变区的第二多肽的方法,所述方法包括:在适于表达具有与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的抗体重链可变区的第一多肽,且适于表达具有与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的抗体轻链可变区的第二多肽的条件下培养携载第一表达载体(其可操作地连接到编码第一多肽的第一核酸)和第二表达载体(其可操作地连接到编码第二多肽的第二核酸)的宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从宿主细胞群体回收与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的所表达的第一多肽,且从宿主细胞群体回收与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的所表达的第二多肽。
[0183]
本发明提供了一种用于制备具有抗体重链可变区的第一多肽的方法,所述方法包括:在适于表达具有与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的抗体重链可变区的第一多肽的条件下培养携载第一表达载体的第一宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从第一宿主细胞群体回收与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的所表达的第一多肽。
[0184]
本发明提供了一种用于制备具有抗体轻链可变区的第二多肽的方法,所述方法包括:在适于表达具有与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的抗体轻链可变区的第二多肽的条件下培养携载第二表达载体的第二宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从第二宿主细胞群体回收与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的所表达的第二多肽。
[0185]
本发明提供了一种用于制备具有抗体重链可变区的第一多肽,且用于制备具有抗体轻链可变区的第二多肽的方法,所述方法包括:在适于表达具有与seq id no:4、6、8或10
的氨基酸序列具有至少95%序列同一性的抗体重链可变区的第一多肽,且适于表达具有与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的抗体轻链可变区的第二多肽的条件下培养携载表达载体(其可操作地连接到编码第一多肽的第一核酸且可操作地连接到编码第二多肽的第二核酸)的宿主细胞群体(例如多个)。在一个实施例中,所述方法进一步包括:从宿主细胞群体回收与seq id no:4、6、8或10的氨基酸序列具有至少95%序列同一性的所表达的第一多肽,且从宿主细胞群体回收与seq id no:5、7、9或11的氨基酸序列具有至少95%序列同一性的所表达的第二多肽。
[0186]
本发明提供了一种用于治疗患有与lag3过表达或lag3异常表达(mal-expression)相关的疾病的个体的方法,所述方法包括:对个体施用有效量的包含本文描述的完全人抗lag3抗体中的任一者或2至3者的任何组合的治疗组合物。在一个实施例中,所述疾病是由病毒或病原性病毒或病原性细菌或病原性真菌或病原性寄生虫引起的癌症、肿瘤、自身免疫疾病或传染病。
[0187]
在一个实施例中,抗lag3抗体可与免疫疗法的其它形式(诸如细胞因子治疗(例如干扰素、gm-csf、g-csf、il-2)或双特异性抗体疗法)组合,此提供增强的肿瘤抗原呈递(参见,例如holliger(1993)《美国国家科学院院刊》90:6444-6448;poljak(1994)《结构(structure)》2:1121-1123)。
[0188]
在一个实施例中,所述疾病为选自由以下组成的群组的癌症:骨癌、胰腺癌、皮肤癌、头部或颈部癌、皮肤或眼内恶性黑色素瘤、子宫癌、卵巢癌、直肠癌、肛门部位的癌症、胃癌、睪丸癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、慢性或急性白血病(包括急性骨髓性白血病、慢性骨髓性白血病、急性淋巴母细胞性白血病、慢性淋巴细胞性白血病)、儿童实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾脏或输尿管癌、肾盂癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波西肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱发的癌症和石棉诱发的癌症。
[0189]
在一个实施例中,所述疾病为选自由以下组成的群组的癌症或肿瘤:非霍奇金淋巴瘤(nhl)、伯基特淋巴瘤(bl)、多发性骨髓瘤(mm)、b慢性淋巴细胞性白血病(b-cll)、b和t急性淋巴细胞性白血病(all)、t细胞淋巴瘤(tcl)、急性骨髓性白血病(aml)、毛细胞白血病(hcl)、霍奇金淋巴瘤(hl)、慢性骨髓性白血病(cml)、非霍奇金淋巴瘤(nhl)、急性淋巴细胞性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性骨髓性白血病(cml)、多发性骨髓瘤(mm)、乳腺癌、卵巢癌、头颈癌、膀胱癌、黑色素瘤、结肠直肠癌、胰腺癌、肺癌、平滑肌瘤、平滑肌肉瘤、胶质瘤、神经胶质母细胞瘤和实体瘤,其中实体瘤选自由以下组成的群组:乳房肿瘤、卵巢肿瘤、肺肿瘤、胰腺肿瘤、前列腺肿瘤、黑色素瘤、结肠直肠肿瘤、肺肿瘤、头颈肿瘤、膀胱肿瘤、食道肿瘤、肝脏肿瘤和肾脏肿瘤。
[0190]
在一个实施例中,所述疾病是自身免疫疾病,包括阿尔茨海默病(alzheimer's disease)、过敏、哮喘、乳糜泻、克罗恩氏病(crohn's disease)、格雷夫斯病(grave's disease)、发炎性肠病(ibd)、狼疮、多发性硬化症、重症肌无力症、风湿性多肌痛、类风湿性关节炎、i型糖尿病或血管炎。
[0191]
在一个实施例中,所述疾病是选自由以下组成的群组的传染病:hiv、(甲型、乙型
和丙型)肝炎、流行性感冒、疱疹、梨形鞭毛虫(giardia)、疟疾、利什曼原虫(leishmania)、金黄色葡萄球菌(staphylococcus aureus)、铜绿假单胞菌(pseudomonas aeruginosa)、黄病毒(flaviviruses)、埃克病毒(echovirus)、鼻病毒(rhinovirus)、柯萨奇病毒(coxsackie virus)、冠状病毒(coronavirus)、呼吸道融合病毒、腮腺炎病毒、轮状病毒(rotavirus)、麻疹病毒、风疹病毒、小病毒、牛痘病毒、htlv病毒、登革热病毒(dengue virus)、乳头瘤病毒、软疣病毒、脊髓灰质炎病毒、狂犬病病毒、jc病毒和虫媒病毒性脑炎病毒。
[0192]
在一个实施例中,所述疾病由病原性病毒,包括hiv、(甲型、乙型或丙型)肝炎、疱疹病毒(例如vzv、hsv-1、hav-6、hsv-ii和cmv、爱泼斯坦-巴尔病毒)、腺病毒、流行性感冒病毒、黄病毒、埃克病毒、鼻病毒、柯萨奇病毒、冠状病毒、呼吸道融合病毒、腮腺炎病毒、轮状病毒、麻疹病毒、风疹病毒、小病毒、牛痘病毒、htlv病毒、登革热病毒、乳头瘤病毒、软疣病毒、脊髓灰质炎病毒、狂犬病病毒、jc病毒和虫媒病毒性脑炎病毒引起。
[0193]
在一个实施例中,所述疾病由病原性细菌,包括衣原体、立克次体细菌(rickettsial bacteria)、分支杆菌、葡萄球菌、链球菌、肺炎球菌、脑膜炎球菌和淋球菌(gonococci)、克雷伯菌(klebsiella)、变形杆菌、沙雷氏菌(serratia)、假单胞菌、军团菌(legionella)、白喉杆菌、沙门氏菌(salmonella)、杆菌、霍乱弧菌(cholera)、破伤风杆菌、肉毒杆菌、炭疽杆菌、鼠疫菌、钩端螺旋体病菌(leptospirosis)和莱姆病(lyme disease)细菌引起。
[0194]
在一个实施例中,所述疾病由病原性真菌,包括念珠菌属(白色念珠菌(albicans)、克柔念珠菌(krusei)、光滑念珠菌(glabrata)、热带念珠菌(tropicalis)等)、新型隐球菌(cryptococcus neoformans)、曲菌(aspergillus)(烟曲菌(fumigatus)、黑曲菌(niger)等)、毛霉菌属(genus mucorales)(毛霉菌(mucor)、犁头霉(absidia)、根霉菌(rhizopus))、申克氏胞丝菌(sporothrix schenkii)、皮炎芽生菌(blastomyces dermatitidis)、巴西副球孢子菌(paracoccidioides brasiliensis)、粗球孢子菌(coccidioides immitis)或荚膜组织浆菌(histoplasma capsulatum)引起。
[0195]
在一个实施例中,所述疾病由病原性寄生虫,包括溶组织内阿米巴(entamoeba histolytica)、大肠纤毛虫(balantidium coli)、福氏耐格里阿米巴原虫(naegleriafowleri)、棘阿米巴虫属(acanthamoeba sp.)、兰氏梨形鞭毛虫(giardia lambia)、隐孢子虫属(cryptosporidium sp.)、卡氏肺囊虫(pneumocystis carinii)、间日疟原虫(plasmodium vivax)、巴贝斯原虫(babesia microti)、布氏锥虫(trypanosoma brucei)、克氏锥虫(trypanosoma cruzi)、杜氏利什曼原虫(leishmania donovani)、刚地弓形虫(toxoplasma gondii)或巴西日圆线虫(nippostrongylus brasiliensis)引起。
[0196]
实例
[0197]
以下实例意指说明性且可用于进一步理解本发明的实施例而不应以任何方式解释为限制本教示的范围。
[0198]
实例1:对可溶性lag3蛋白的剂量依赖性结合的elisa分析:
[0199]
novartis 525抗体是在内部克隆且产生的。在4℃下将抗lag3抗体(1c5-3a6、2d12-2e3-n102d、5c8和8d9)和竞争抗体(novartis 525)以5μg/ml(20μl/孔)含于1x磷酸盐缓冲盐水(pbs1x)中涂布于酶联免疫吸附分析(elisa)板上过夜。用250μl/孔的pbs-t(补充
0.05%吐温20(tween 20)的pbs1x)洗该板三次。随后,在室温(rt)下用100μl/孔的在pbs中的阻断剂酪蛋白(thermo fisher,目录号37528)阻断该板1小时。用250μl/孔的pbs-t洗三次后,将经纯化的人lag3 his标签蛋白(sino biological;目录号16498-h08h)连续稀释至孔中(最高浓度10μg/ml;稀释度1:3)且在室温下培养1小时。用250μl/孔的pbs-t洗该板三次且通过施加50μl/孔的sureblue
tm tmb-1组分微孔过氧化物酶底物(seracare;目录号5120-0075)来显示结合。通过使用25μl/孔的0.16m硫酸(h2so4)终止溶液来终止信息且在板式读取器上于450nm下读取。结果显示于图3中。
[0200]
实例2:使用表面等离子体共振(biacore)测定结合亲和力。
[0201]
使用表面等离子体共振(spr)测定抗lag3抗体(1c5-3a6、2d12-2e3-n102d、5c8和8d9)和竞争抗体(novartis 525)的结合动力学。使用标准n-羟基琥珀酰亚胺/n-乙基-n
′‑
(3-二甲基氨基丙基)碳二亚胺盐酸盐(nhs/edc)偶联方法,将抗人可结晶片段区(fc区)抗体固定于cm5传感器芯片上至约8,000ru。以10μl/分钟的流速捕获抗体(2μg/ml)60秒。将重组人lag3-his(sino biological;目录号16498-h08h)在0.01m hepes ph 7.4、0.15m nacl、3mm edta、0.05%v/v表面活性剂p20(hbs-ep )的运行缓冲液中连续稀释。所有测量均在hbs-ep 缓冲液中以30μl/分钟的流速实施。使用1:1(朗谬尔(langmuir))结合模型以拟合数据。所有biacore分析均在室温下进行。结果显示于图4中。测得的kd列于下表1中。
[0202]
表1:测得的kd值
[0203]
1c5-3a65c82d12-2e3-n102d8d9novartis 5256.43x10-11
6.15x10-12
8.42x10-10
未测量6.16x10-12
[0204]
实例3:与食蟹猕猴和小鼠lag3抗原的交叉反应性
[0205]
在4℃下将人、小鼠或食蟹猕猴lag3-his标签重组蛋白以2μg/ml含于50μl/孔的1x磷酸盐缓冲盐水(pbs1x)中涂布于ni-ntaelisa板(qiagen,目录号35061)上过夜。用250μl/孔的pbs-t(补充0.05%吐温20的pbs1x)洗该板三次。随后,在室温下用100μl/孔的在pbs中的阻断剂酪蛋白(thermo fisher,目录号37528)阻断该板1小时。用250μl/孔的pbs-t洗三次后,在室温下将纯化的抗体以2μg/ml含于pbs-t(50μl/孔)中培养1.5小时。用250μl/孔的pbs-t洗该板三次且在室温下将hrp结合山羊抗人fc二级抗体(sera care;目录号5220-0279)以稀释度1:5,000以50μl/孔培养1小时。随后,用250μl/孔的pbs-t洗该板三次且通过施加50μl/孔的sureblue
tm tmb-1组分微孔过氧化物酶底物(seracare;目录号5120-0075)来显示结合。通过使用25μl/孔的0.16m硫酸(h2so4)终止溶液来终止信息且在板式读取器上于450nm下读取。结果显示于图5中。
[0206]
实例4:对lag3表达细胞的结合
[0207]
将人lag3/nfat-luc受体jurkat细胞系(bps biosciences;目录号71278)在补充1mg/ml g418和200μg/ml潮霉素b的完全rpmi(rpmi 1640 10%fcs pen/strep)中培养。将野生型(wt)jurkat细胞在完全rpmi中培养。
[0208]
将细胞以80,000个细胞/孔接种于v型底96孔板中且使用170μl/孔的facs缓冲液(pbs 1x 2%fcs/fbs 0.1%叠氮化钠)洗两次。抗lag3和同型对照抗体以各种浓度(在10至0.003μg/ml的范围内;稀释度1:5)稀释于facs缓冲液中且在4℃下与人lag3或wt jurkat细胞以100μl/孔培养20分钟。在170μl/孔的facs缓冲液中洗2次后,在4℃下将细胞与100μl/孔的af647结合山羊抗人igg二级抗体(southern biotech;目录号2040-31,批次
k471x873c;稀释度1:2,000含在facs缓冲液中)培养20分钟。洗细胞两次,再悬浮于140μl/孔的facs缓冲液中且通过流式细胞术在attune nxt上进行采集。通过使用flowjo v10来分析数据。δmfi计算为[(表达lag3的jurkat的几何平均值)
–
(wt jurkat的几何平均值)]。结果显示于图6中。
[0209]
实例5:对seb活化的食蟹猕猴pbmc的特异性结合。
[0210]
seb活化:分离新鲜食蟹猕猴外周血单个核细胞(食蟹猕猴pbmc)且以2.0e 05个细胞/孔接种于u型底板内的200μl的完全rpmi(rpmi 1640 10%fcs pen/strep)中,该完全rpmi含有200u/ml的重组人il-2(miltenyi biotec;目录号130-097-748),含有或不含300ng/ml的来自toxin technology,inc.的金黄色葡萄球菌肠毒素b(seb)(目录号122,批次1224171)。在37℃、5%co2下将食蟹猕猴pbmc在组织培养培养箱中培养4天。
[0211]
结合分析:第4天,使用170μl/孔的facs缓冲液(pbs 1x 2%fcs/fbs 0.1%叠氮化钠)洗未处理和活化的食蟹猕猴pbmc两次且以80,000个细胞转移至v型底96孔板中。将抗lag3和同型对照抗体以各种浓度(在10至0.016μg/ml的范围内;稀释度1:5)稀释于facs缓冲液中且在4℃下与未处理和经活化的食蟹猕猴pbmc以100μl/孔培养20分钟。在170μl/孔的facs缓冲液中洗两次后,在4℃下将细胞与100μl/孔的af647结合山羊抗人igg二级抗体(southern biotech;目录号2040-31,批次k471x873c;稀释度1:2,000含在facs缓冲液中)培养20分钟。洗细胞两次,再悬浮于150μl/孔的facs缓冲液中且通过流式细胞术在attune nxt上进行采集。通过使用flowjo v10来分析数据。
[0212]
δmfi计算为[(seb活化的食蟹猕猴pbmc的几何平均值)
–
(未处理的食蟹猕猴pbmc的几何平均值)]。参见图7a。
[0213]
δlag3
细胞计算为[(seb活化的食蟹猕猴pbmc的lag3
细胞%)
–
(未处理的食蟹猕猴pbmc的lag3
细胞%)]。参见图7b。
[0214]
实例6:检测抗lag3抗体在报告子分析中的功能活性。
[0215]
分析原理:当将raji和lag3/nfat报告子jurkat细胞在超抗原(例如金黄色葡萄球菌肠毒素e)存在下共培养时,超抗原交联效应细胞(报告子jurkat)上的tcr复合物和靶细胞(raji)上的ii类mhc,导致tcr活化和nfat荧光素酶信息。
[0216]
lag3和ii类mhc相互作用防止这种交联且抑制tcr活化和nfat荧光素酶信息。
[0217]
在抗lag-3抗体存在下:lag3与mhc-ii之间的相互作用被阻断,通过超抗原和效应细胞上的nfat-荧光素酶信息促进t细胞活化。
[0218]
将人lag3/nfat-luc报告子jurkat细胞系(bps biosciences;目录号71278)在补充1mg/ml g418和200μg/ml潮霉素b的完全rpmi(rpmi 1640 10%fcs pen/strep)中培养。将raji细胞(atcc;目录号ccl-86)在完全rpmi中培养。
[0219]
lag3表达细胞的制备:将人lag3/nfat-luc报告子jurkat细胞(40,000个细胞/孔)接种于96孔白色透明底分析板(costar;目录号3610)内的完全rpmi中且与10、1或0.1μg/ml(最终浓度)的抗lag3或同型对照抗体(最终体积60μl/孔)预培养。预培养期间,在37℃、5%co2下将细胞在组织培养培养箱中维持30分钟。
[0220]
抗原呈递细胞-raji细胞的制备:将raji细胞以0.75e 06个细胞/ml再悬浮于含有来自toxin technology,inc.的0.1ng/ml金黄色葡萄球菌肠毒素e(see)(目录号et404)的完全rpmi中。预培养期间,在37℃、5%co2下将细胞在组织培养培养箱中维持30分钟。
[0221]
分析启动和读取:将see活化的raji细胞混合且取40μl直接转移于含有预培养的人lag3/nfat-luc报告子jurkat细胞(总体积100μl/孔)的孔中。在37℃、5%co2下将96孔白色透明底分析板在组织培养培养箱中培养5至6小时。通过施加100μl/孔的one-step荧光素酶分析系统(bps biosciences;目录号60690-1)来显示荧光素酶信息。将该板在缓慢搅动下置于室温下15分钟。使用tecan读取器来测定信息。通过将其它孔的发光读数减去平均背景发光(无细胞对照孔)来分析数据。nfat荧光素酶报告子表达的诱导倍率计算为[(经抗体处理的孔的减去背景的发光)/(未处理的对照孔的平均减去背景的发光)]。实施报告子分析两次,且结果显示于图8a和b中。
[0222]
实例7:表位图谱
[0223]
在4℃下将纯化的抗lag3单克隆抗体以5μg/ml含于50μl/孔的1x磷酸盐缓冲盐水(pbs1x)中涂布于elisamaxisorp
tm
平底板上过夜。用250μl/孔的pbs-t(补充0.05%吐温20的pbs1x)洗该板三次。然后,在室温下用100μl/孔的在pbs中的阻断剂酪蛋白(thermo fisher,目录号37528)阻断该板1小时。用250μl/孔的pbs-t洗三次后,在室温下将重组人lag3-fc标签蛋白(sino biological;目录号16498-h05h)以2μg/ml含于pbs-t(50μl/孔)中培养1.5小时。用250μl/孔pbs-t洗该板三次且在室温下将生物素化抗lag3novartis 525抗体克隆(nvs525-生物素是在内部经克隆,产生且生物素化的)以5μg/ml含于pbs-t(50μl/孔)中培养1小时。在pbs-t中洗三次后,将链霉亲和素-hrp分子(thermo fisher;目录号n100)以1:5,000稀释于pbs-t中且在室温下以50μl/孔培养30分钟且用于检测所结合的nvs525-生物素。用250μl/孔的pbs-t洗该板三次后,通过施加50μl/孔的sureblue
tm tmb-1组分微孔过氧化物酶底物(seracare;目录号5120-0075)来显示结合。通过使用25μl/孔的0.16m硫酸(h2so4)终止溶液来终止信息且在板式读取器上于450nm下读取。结果显示于图9中。
[0224]
实例8:细胞因子释放分析
[0225]
分离新鲜pbmc(来自两个不同供体)且以2.0e 06个细胞/ml稀释于补充重组hil-2(1,000u/ml)的完全rpmi(rpmi 1640 10%fcs pen/strep)中。将细胞以2.0e 05个细胞/孔接种于u型底板中(100μl/孔)。接下来,将抗lag-3或同型对照抗体克隆以10、1和0.1μg/ml(最终浓度)稀释于含有seb(金黄色葡萄球菌肠毒素b,list biological laboratories;目录号122)(50μl的抗体制剂与50μl的seb的混合物,二者均为2x浓度)的完全rpmi中,最终浓度为100ng/ml。将所述板置于37℃培养箱中四天。第四天,将所述细胞和上清液转移至v型底板且1,400rpm离心5分钟。将上清液转移至v型底96孔板且在-80℃下冷冻沉降直至分析细胞因子内含物(ifnγ或其它促发炎细胞因子)。
[0226]
细胞因子检测:通过遵循制造商建议使用来自meso scale discovery(msd)的促发炎小组1(人类)试剂盒(目录号k15049d)。简单地说,将分析样品在室温下解冻。同时,通过使用稀释剂2(目录号r51bb-3;批次m0020102)在eppendorf
tm
管中进行校准物1的连续稀释来制备细胞因子标准品。然后,使用稀释剂2将分析样品稀释于96-孔超低粘附板(corning;目录号7007;批次18219008)(通常需要在1:200至1:2,000的范围内的最终稀释度以在标准曲线范围内获得高数目的样品)。
[0227]
然后,将msd 96孔板去密封且用300μl/孔的kpl缓冲液(sera care,目录号5150-0008;批次10430811)洗三次。遵循先前准备的板布局,将每个稀释的样品和校准物以50μl/
孔转移至msd板上(避免气泡)。使用粘附板密封件(vwr;目录号60941-120)来密封该板且在室温于缓慢搅动下培养2小时。用300μl/孔的kpl缓冲液洗该板三次且以25μl/孔施加在稀释剂3中制备的sulfo-标签检测抗体(稀释度1:50)。密封该板且在室温于缓慢搅动下在黑暗中培养两小时。随后,用300μl/孔的kpl缓冲液洗该板三次。通过添加150μl的2x读取缓冲液且在msd仪器(meso sector s600;模型1201)上检测来显示信息。结果显示于图10a和b中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。