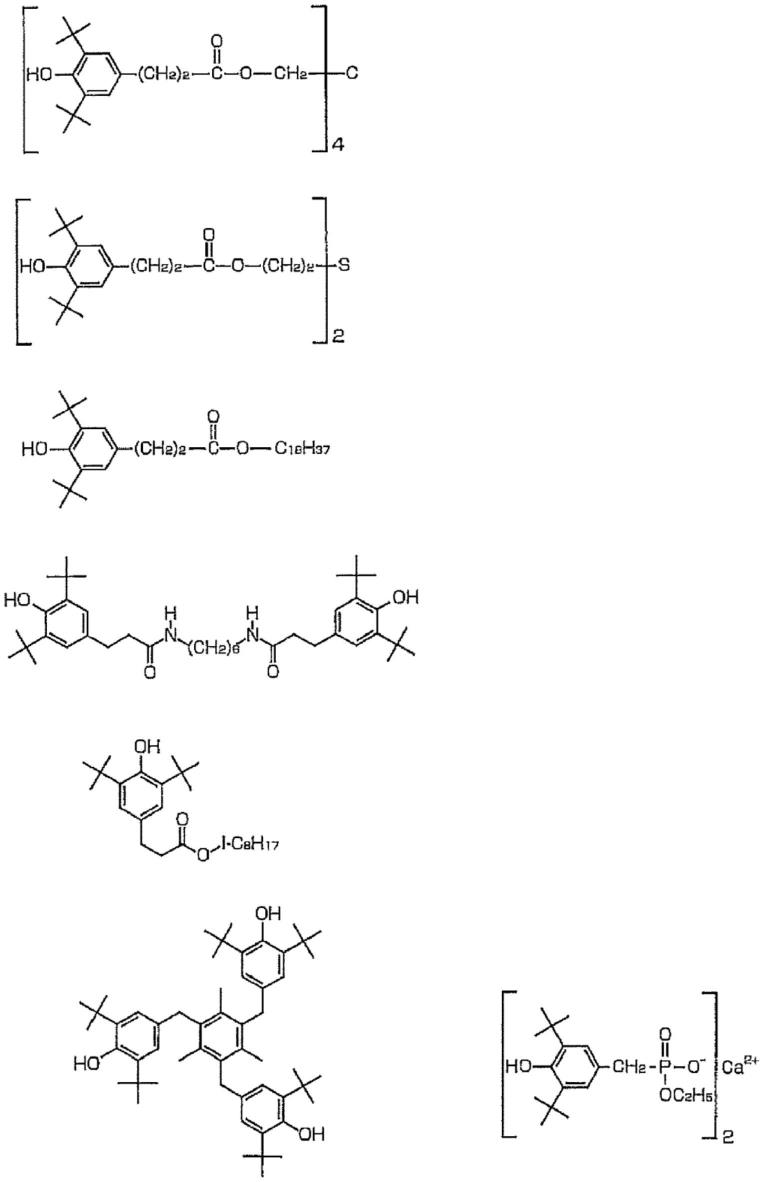
奥马环素的晶形、其合成方法及其使用方法
1.相关申请本技术要求2020年6月11日提交的美国临时申请号 63/037,807的优先权,其全部内容经此引用并入本文。
2.引言奥马环素(也被称为omc或ptk 0796)是一种9-氨甲基四环素衍生物,其目前正处于用于治疗各种细菌感染的高级临床开发阶段。下面显示奥马环素的结构:。
3.奥马环素的化学合成先前已有描述,例如在美国专利号 9,434,680、美国专利号 9,522,872和美国专利号 8,383,610中,它们各自的全部内容经此引用并入本文。用于合成奥马环素的一种示例性程序显示在以下方案1中。在该程序中,使用米诺环素(a)作为起始材料,其在第一步骤中用n-(羟甲基)邻苯二甲酰亚胺在9-位置处进行烷基化。这种转化的产物(b)与甲胺反应,这致使胺基团脱保护并提供中间体(c)。在下一步骤中,中间体(c)在还原烷基化条件下与三甲基乙醛反应以产生游离碱形式的粗制奥马环素。
4.方案1. 用于合成奥马环素的示例性程序。
5.在合成后,将粗制奥马环素游离碱纯化并转化为甲苯磺酸盐形式,其转而用于制备奥马环素的药物组合物。粗制奥马环素游离碱的纯化涉及使用高效液相色谱法(hplc)和收集含有经纯化的奥马环素游离碱的hplc级分。随后,hplc级分中的奥马环素游离碱通过用二氯甲烷萃取来进行浓缩。这种纯化程序可能是耗时的,例如需要多于70小时的加工时间以生成1千克纯奥马环素。其在溶剂蒸发过程中使奥马环素长时间暴露于较高温度,这导致降解。此外,该纯化程序需要大量溶剂,由此生成大量废物。因此,需要更简易和更高效的纯化奥马环素游离碱的程序以产生高纯产物。另外,还需要可配制成药物组合物的新型纯
形式的奥马环素。
6.发明概述因此,在一些方面,本发明提供纯化奥马环素,例如粗制奥马环素游离碱的方法。所述方法在一些实施方案中包括改性hplc程序,其利用改性剂,例如乙酸并与先前使用的方法相比带来粗制奥马环素游离碱的更快速和更高效的纯化。
7.本发明的纯化奥马环素游离碱的方法在一些实施方案中还包括在奥马环素结晶之前使用纳滤浓缩含有奥马环素游离碱的hplc级分。使用纳滤代替用溶剂,例如二氯甲烷萃取hplc级分,由此消除在纯化过程中使用大量有毒溶剂的需要。纳滤的使用也避免奥马环素长时间暴露于较高温度,长时间暴露于较高温度可引起奥马环素的降解。任选地,如果在纳滤之后用溶剂,例如二氯甲烷进行萃取,与在没有纳滤的情况下进行的萃取相比,纳滤使得奥马环素的萃取所需的溶剂量显著减少。本文所述的纯化奥马环素的方法在一些实施方案中还包括,例如在hplc纯化、纳滤和任选萃取之后,使奥马环素游离碱结晶,以产生高纯奥马环素结晶游离碱,其杂质量显著低于使用先前的方法生成的奥马环素中的杂质量。
8.本发明的新型纯化方法首次实现奥马环素结晶游离碱的合成。因此,在一些实施方案中,本发明还提供奥马环素结晶游离碱、包含奥马环素结晶游离碱的药物组合物和使用奥马环素结晶游离碱治疗细菌感染的方法。
9.本发明的奥马环素结晶游离碱也可用于合成高纯奥马环素甲苯磺酸盐。因此,在一些实施方案中,本发明还提供由奥马环素结晶游离碱制备奥马环素的甲苯磺酸盐的方法。本发明还提供通过本发明的方法制成的奥马环素甲苯磺酸盐。
10.因此,在一些方面,本发明提供奥马环素游离碱的晶形(crystalline form),其中奥马环素由式(1)表示:。
11.在进一步实施方案中,奥马环素由式(2)表示:。
12.在一些方面,本发明还提供奥马环素游离碱的晶形的多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;
在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
13.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;和在约17.86
ꢀ°
2θ处的峰。
14.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
15.在一些方面,本发明还提供一种制备如上所述的多晶型物的方法,其包括从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在进一步实施方案中,有机溶剂选自乙腈、丙酮、异丙醇和甲乙酮。在一个具体实施方案中,有机溶剂是丙酮。
16.在一些方面,本发明还提供通过如上所述的方法制备奥马环素游离碱的晶形的多晶型物。例如,在一些实施方案中,本发明提供通过一种方法制备奥马环素游离碱的晶形的多晶型物,所述方法包括:从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。
17.在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在进一步实施方案中,有机溶剂选自乙腈、丙酮、异丙醇和甲乙酮。
在一个具体实施方案中,有机溶剂是丙酮。
18.在一些实施方案中,所述多晶型物由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
19.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;和在约17.86
ꢀ°
2θ处的峰。
20.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
21.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系中。在某些方面,有机溶剂选自异丙醇、乙腈和甲乙酮。
22.在一些方面,本发明还提供一种纯化游离碱形式的奥马环素的方法,其中奥马环素由式(1)表示:所述方法包括对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液。
23.在一些实施方案中,所述改性剂是弱酸,并且其中所述弱酸选自草酸、甲磺酸(methanesulfonic acid)、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。在一些实施方案中,所述弱酸选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实施方案中,所述弱酸是乙酸。在一些实施方案中,在hplc过程中将改性剂添加到流动相中;或者其中在加载到hplc柱上之前将改性剂添加到包含粗制游离碱形式的奥马环素的溶液中。在一些实施方案中,所述流动相包含洗脱缓冲液a和洗脱缓冲液b;其中洗脱缓冲液a包含水和乙腈和/或其中洗脱缓冲液b包含乙腈。
24.在一些方面,包含经hplc纯化的游离碱形式的奥马环素的溶液中的奥马环素的β差向异构体杂质的量为包含粗制游离碱形式的奥马环素的溶液中存在的奥马环素的β差向异构体杂质的量的至多1/5倍。
25.在一些实施方案中,本发明的方法进一步包括使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液。在一个实施方案中,所述方法进一步包括收集所述渗余物。
26.在一些实施方案中,本发明的方法进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的游离碱形式的奥马环素的溶液中。在进一步实施方案中,以足以实现约0.01%至约0.5% w/v的溶液中抗氧化剂的浓度的量来加入抗氧化剂。
27.在一些实施方案中,所述膜具有约150至约500道尔顿的截留分子量(mwco)。在一些实施方案中,渗余物中奥马环素的浓度为包含经hplc纯化的游离碱形式的奥马环素的溶液中奥马环素的浓度的至少约2倍,例如至少3倍、至少4倍、至少5倍、至少6倍、至少8倍或至少10倍。
28.在一些实施方案中,本发明的方法进一步包括结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形。在一些实施方案中,从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在进一步实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在一些实施方案中,有机溶剂选自腈、醇、酮和醚。例如,有机溶剂可选自乙腈、丙酮、异丙醇和甲乙酮。在一个具体实施方案中,有机溶剂是丙酮。
29.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系
中。在一些实施方案中,有机溶剂选自异丙醇、乙腈和甲乙酮。
30.在一些实施方案中,通过本发明的方法获得的奥马环素游离碱的晶形是一种多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
31.在一些方面,本发明还提供一种制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:通过如上所述的方法纯化游离碱形式的奥马环素,由此获得经纯化的游离碱形式的奥马环素;和使经纯化的游离碱形式的奥马环素在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
32.在一些实施方案中,本发明还提供一种制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
33.在一些实施方案中,从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存
在于溶剂体系中。在一些实施方案中,有机溶剂选自乙腈、丙酮、异丙醇、甲乙酮、叔丁基甲基醚、乙酸乙酯、甲苯和四氢呋喃。在一个具体实施方案中,有机溶剂是丙酮。
34.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系中。在一些实施方案中,有机溶剂选自异丙醇、乙腈和甲乙酮。
35.在一些实施方案中,奥马环素游离碱的晶形是一种多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
36.在一些实施方案中,本发明的方法包括对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液;和从包含经hplc纯化的游离碱形式的奥马环素的溶液中结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
37.在一些实施方案中,所述改性剂是弱酸,其中所述弱酸选自草酸、甲磺酸、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。在一些实施方案中,所述弱酸选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实施方案中,所述弱酸是乙酸。
38.在一些实施方案中,在hplc过程中将改性剂添加到流动相中;或在加载到hplc柱上之前将改性剂添加到包含粗制游离碱形式的奥马环素的溶液中。在一些实施方案中,所述流动相包含洗脱缓冲液a和洗脱缓冲液b;其中洗脱缓冲液a包含水和乙腈和/或其中洗脱缓冲液b包含乙腈。
39.在一些实施方案中,本发明的方法进一步包括使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液。在一些方面,本发明的方法进一步包括收集所述渗余物。
40.在一些实施方案中,本发明的方法进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的游离碱形式的奥马环素的溶液中。在进一步实施方案中,以足以实现约0.01%至约0.5% w/v的溶液中抗氧化剂的浓度的量来加入抗氧化剂。在一些实施方案中,用于纳
滤的膜具有约150至约500道尔顿的截留分子量(mwco)。
41.在一些方面,本发明还提供制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液;使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液;从包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液中结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
42.在一些方面,本发明还提供通过如上所述的方法获得的奥马环素的甲苯磺酸盐,其中奥马环素由式(1)表示:。
43.在一些方面,本发明还提供通过如上所述的方法获得的奥马环素的结晶甲苯磺酸盐,其中奥马环素由式(1)表示:。
44.在进一步实施方案中,本发明还提供结晶甲苯磺酸盐的多晶型物,例如1型(form)多晶型物或3型多晶型物。
45.在一些方面,本发明还提供一种药物组合物,其包含如上所述的奥马环素游离碱的晶形和药学上可接受的载体。在一些实施方案中,本发明提供一种药物组合物,其包含如上所述的奥马环素游离碱的晶形的多晶型物和药学上可接受的载体。
46.在一些方面,本发明还提供一种药物组合物,其包含如上所述的奥马环素的甲苯
磺酸盐和药学上可接受的载体。在一些实施方案中,本发明还提供一种药物组合物,其包含如上所述的奥马环素的结晶甲苯磺酸盐和药学上可接受的载体。在一些实施方案中,本发明还提供一种药物组合物,其包含如上所述的奥马环素的结晶甲苯磺酸盐的多晶型物和药学上可接受的载体。
47.在一些实施方案中,所述药物组合物为片剂形式。在其它实施方案中,所述药物组合物是冻干粉形式的可注射制剂。
48.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素游离碱的晶形或药物组合物。
49.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素游离碱的晶形的多晶型物或药物组合物。
50.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的甲苯磺酸盐或药物组合物。
51.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的结晶甲苯磺酸盐或药物组合物。
52.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的结晶甲苯磺酸盐的多晶型物或药物组合物。
53.在一些实施方案中,细菌感染由革兰氏阳性或革兰氏阴性细菌引起。在一些实施方案中,细菌感染由对其它四环素化合物具有耐药性的细菌引起。在一些方面,细菌感染由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌(a. baumanii)、卡他布兰汉菌(b. catarrhalis)、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
54.在一些实施方案中,细菌感染是急性细菌性皮肤结构感染(absssi)。在进一步实施方案中,absssi由选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株(isolate))(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(grp.)(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
55.在一些实施方案中,细菌感染是社区获得性细菌性肺炎(cabp)。在进一步实施方案中,cabp由选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
56.在一些实施方案中,细菌感染由艰难梭菌种属的细菌引起。在一些方面,细菌感染由分枝杆菌引起。
57.附图简述图1是奥马环素结晶游离碱的典型xrpd谱。
58.图2是从包含乙腈和水的溶剂体系(湿乙腈)中结晶的奥马环素游离碱的xrpd谱。
59.图3是从包含异丙醇和水的溶剂体系(湿异丙醇)中结晶的奥马环素游离碱的xrpd谱。
60.图4是从包含2-丁酮和水的溶剂体系(湿2-丁酮)中结晶的奥马环素游离碱的xrpd谱。
61.图5是对照奥马环素结晶游离碱的xrpd谱。
62.图6是制备奥马环素结晶游离碱的方法的示意图。
63.图7是制备奥马环素的结晶甲苯磺酸盐的方法的示意图,所述方法包括制备奥马环素结晶游离碱。
64.发明详述奥马环素结晶游离碱本发明提供奥马环素游离碱的晶形。奥马环素是作为主要用于严重社区获得性感染,如急性细菌性皮肤和皮肤结构感染(absssi)、中度至重度社区获得性细菌性肺炎(cabp)和复杂性尿路感染(cuti)的经验疗法的一线药物(first-line agent)而开发的9-氨基甲基四环素衍生物。名称“奥马环素”在本文中与名称“omc”、“ptk 0796”或“化合物1”可互换使用。在一些实例中,奥马环素可由式(1)表示:。
65.在一些实例中,奥马环素可由式(2)表示:。
66.在其非结晶形式下,奥马环素是一种黄色无定形固体,其在暴露于空气、光和/或水分时可能特别不稳定。因此,在其固体形式下,奥马环素必须储存在低于0℃的温度下并有限暴露于空气、光和水分。超出这些有限暴露条件时,奥马环素可降解以产生降解产物,例如由式(3)和式(4)表示的空气降解产物,以及由式(5)表示的4-差向异构体。
67.奥马环素的游离碱和某些药学上可接受的盐描述在美国专利号 7553828中,且奥马环素的某些结晶盐描述在美国专利号 8,383,610中,它们各自的全部内容经此引用并入本文。但是,在本公开之前,没有已知的奥马环素游离碱的晶形或晶形的多晶型物。
68.因此,本发明提供奥马环素游离碱的晶形(化合物1)。本文所用的术语“结晶”或“晶形”是指其中原子以规则的重复型式排列的奥马环素的固体形式。在一些实施方案中,术语“结晶”无差别地包含奥马环素的多晶型形式或非无定形形式。
69.本文所用的术语“无定形”或“无定形形式”是指物质的非结晶形式,例如没有规则原子排列的固体形式。
70.本文所用的术语“多晶型物”或“多晶型形式”是指仅涉及溶质分子并具有特征性的结晶特征的有组织结构。这些术语可以是指同一分子的不同晶形。不同的多晶型物可具有由分子在晶格中的不同排列或构象引起的不同物理性质,例如熔融温度、熔化热、溶解度、溶解速率和/或振动谱。不同多晶型物表现出的物理性质的差异可影响对药物重要的参数,如储存稳定性、可压缩性和密度(在制剂和产品制造中是重要的)和溶出速率(生物利用度中的重要因素)。
71.不同多晶型物的稳定性差异也可能由化学反应性差异(例如对氧化的不同敏感性)引起。因此,由一种多晶型物组成的剂型可比由相同物质的不同多晶型物组成的剂型更快变色。不同多晶型物的稳定性差异也可能由机械性质差异(例如片剂在储存时随着动力学有利的多晶型物转化成热力学更稳定的多晶型物可能破碎);或化学和机械性质二者的差异(例如一种多晶型物的片剂在高湿度下更容易破裂)引起。由于溶解度/溶出度差异,在极端情况下,一些多晶型转变可导致效力损失,或在其它极端情况下,导致毒性。此外,晶体的物理性质在加工中可以是重要的。例如,相同物质的不同多晶型物可在它们形成溶剂化物的倾向或在它们的粒子形状和粒度分布方面表现出差异,从而影响纯化(例如一种多晶型物可比另一种多晶型物更难过滤和洗掉杂质)。
72.分子的多晶型物可通过本领域中已知的许多方法获得。这些方法可包括但不限于熔体重结晶、熔体冷却、溶剂重结晶、去溶剂化、快速蒸发、快速冷却、缓慢冷却、蒸气扩散和升华。表征多晶型物的技术可包括但不限于差示扫描量热法(dsc)、x-射线粉末衍射法(xrpd)、单晶x-射线衍射法、振动光谱术,例如红外和拉曼光谱术,固态nmr、热台光学显微术、扫描电子显微术(sem)、电子晶体学和定量分析、粒度分析(psa)、表面积分析、溶解度研究和溶出度研究。具体地,xrpd是用于表征多晶或粉状固体样品中的晶体结构、尺寸和择优
取向的技术。这种衍射也用于表征非均相固体混合物以测定存在的结晶化合物的百分比,并且可提供关于未知材料的结构信息。在本文中与术语“xrpd图”可互换使用的术语“x-射线粉末衍射图”是指通过xrpd分析收集的数据的图形图示。
73.在一些实施方案中,本发明提供奥马环素游离碱的晶形的多晶型物,在本文中也被称为“奥马环素结晶游离碱的多晶型物”。在一些实施方案中,奥马环素结晶游离碱的多晶型物由包括选自以下的至少一个峰的x-射线粉末衍射图(xrpd图)表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
74.本文所用的术语“峰”是指在xrpd图中强度比基线噪声高至少20%,例如至少30%、至少40%、至少50%或至少100%的峰。
75.本文关于xrpd图中的峰所用的术语“约”(“approximately”或“about”)是指其中峰出现在给定
°
2θ值的0.5
ꢀ°
2θ内,例如0.4、0.3、0.2、0.1、0.05或0.01
ꢀ°
2θ内的xrpd图。
76.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少两个峰的x-射线粉末衍射图(xrpd图)表征。
77.在一些实施方案中,本发明提供奥马环素的晶形的多晶型物,其由包括选自如上所列的峰的至少三个峰的x-射线粉末衍射图(xrpd图)表征。
78.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少四个峰的x-射线粉末衍射图(xrpd图)表征。
79.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少五个峰的x-射线粉末衍射图(xrpd图)表征。
80.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少六个峰的x-射线粉末衍射图(xrpd图)表征。
81.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少七个峰的x-射线粉末衍射图(xrpd图)表征。
82.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少八个峰的x-射线粉末衍射图(xrpd图)表征。
83.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少九个峰的x-射线粉末衍射图(xrpd图)表征。
84.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少十个峰的x-射线粉末衍射图(xrpd图)表征。
85.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少十一个峰的x-射线粉末衍射图(xrpd图)表征。
86.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括如上所列的所有峰的x-射线粉末衍射图(xrpd图)表征。
87.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由如图1至5中任一个所示的x-射线粉末衍射图(xrpd图)表征。
88.在一些方面,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物为至少90%纯,如通过奥马环素结晶游离碱的多晶型物的重量相对于组合物重量(w/w%)表示。例如,奥马环素结晶游离碱的多晶型物为至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯。本文所用的术语“纯”或“纯度”是指约90-100%纯,例如约95-100%纯、98-100%纯或约99-100%纯的化合物。在一些实施方案中,纯的奥马环素游离碱包含小于约10%、小于约5%、小于约2%或小于约1%的杂质。杂质可能包括,例如降解产物、氧化产物、差向异构体、溶剂和/或其它不合意杂质中的一种或多种。
89.奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物的纯度的一种量度由如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的含量限定。因此,在一些实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为通过hplc测得(即在hplc迹线上的曲线下总面积的%)的10%或更低,例如5%或更低、2%或更低、1%或更低、0.9%或更低、0.5%或更低、0.1%或更低、0.05%或更低或0.01%或更低。在一个具体实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为0.9%或更低。
90.合成奥马环素结晶游离碱的方法奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物可通过从包含有机溶剂和水的溶剂体系中结晶无定形奥马环素游离碱来制备。
91.在这样的溶剂体系中,有机溶剂和水可以以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在。例如,水可以以约95% v/v(即有机溶剂:水的比率为约5:95 v/v)、约90% v/v(即有机溶剂:水的比率为约10:90 v/v)、约80% v/v(即有机溶剂:水的比率为约20:80 v/v)、约70% v/v(即有机溶剂:水的比率为约30:70 v/v)、约60% v/v(即有机溶剂:水的比率为约40:60 v/v)、约50% v/v(即有机溶剂:水的比率为约50:50 v/v)、约40% v/v(即有机溶剂:水的比率为约60:40 v/v)、约30% v/v(即有机溶剂:水的比率为约70:30 v/v)、约20% v/v(即有机溶剂:水的比率为约80:20 v/v)、约15% v/v(即有机溶剂:水的比率为约85:15 v/v)、约10% v/v(即有机溶剂:水的比率为约90:10 v/v)、约5% v/v(即有机溶剂:水的比率为约95:5 v/v)、或约1% v/v(即有机溶剂:水的比率为约99:1 v/v)的量存在于溶剂体系中。在其它实例中,水可以以约1%至约10%、约2%至约15%、约5%至约20%、或约1%至约15%的量存在于溶剂体系中。
92.溶剂体系中存在的有机溶剂可选自腈、醇、酮和醚。例如,有机溶剂可选自乙腈、丙酮、异丙醇、甲乙酮、叔丁基甲基醚、乙酸乙酯、甲苯和四氢呋喃。在一些实例中,有机溶剂可选自乙腈、丙酮、异丙醇和甲乙酮。
93.在一个实例中,溶剂体系可包含丙酮和水。丙酮和水可以以约1:99 v/v至约99:1 v/v,例如约10:90 v/v至约90:10 v/v、约20:80 v/v至约80:20 v/v、约30:70 v/v至约70:30、约40:60 v/v至约60:40 v/v的丙酮:水的比率存在于溶剂体系中。在一个实例中,丙酮和水可以以约50/50 v/v的丙酮:水的比率存在于溶剂体系中。在另一实例中,溶剂体系可包含乙腈和水,例如以约95/5 v/v的乙腈:水的比率存在于溶剂体系中。在又一实例中,溶剂体系可包含异丙醇和水,例如以约95/5 v/v的异丙醇:水的比率存在于溶剂体系中。在另一实例中,溶剂体系可包含甲乙酮和水,例如以约95/5 v/v的甲乙酮:水的比率存在于溶剂体系中。
94.在一些实例中,在结晶之前,可通过如在本公开其它地方所述的高效液相色谱法(hplc)和/或纳滤从包含粗制奥马环素无定形游离碱的溶液中纯化奥马环素无定形游离碱。
95.在一些实施方案中,本发明提供通过上述方法制备的奥马环素结晶游离碱。
96.包含奥马环素结晶游离碱的药物组合物本发明还提供包含奥马环素结晶游离碱的药物组合物。例如,本发明的药物组合物可包含有效量的奥马环素结晶游离碱和任选地药学上可接受的载体。本发明的药物组合物可被给药于有此需求的受试者用于治疗或预防细菌感染。
97.语句“药学上可接受的载体”包括能够与奥马环素结晶游离碱共同给药并且可以能使两者都发挥它们的预期功能,例如治疗或预防细菌感染的物质。合适的药学上可接受的载体包括但不限于水、盐溶液、醇、植物油、聚乙二醇、明胶、乳糖、直链淀粉、硬脂酸镁、滑石、硅酸、粘性石蜡、香精油、脂肪酸单甘油酯和脂肪酸二甘油酯、石油醚(petroethral)脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷酮等。药物组合物可以是灭菌的并且如果需要,与不会有害地与奥马环素游离碱反应的助剂,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂、调味料和/或芳香物质等混合。
98.包含奥马环素结晶游离碱的本发明的药物组合物可适于通过口服、非肠道或外用的途径给药。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对药物的个体响应以及所选的药物组合物的类型和进行这种给药的时间周期和间隔,可能发生变化。
99.对于口服给药,奥马环素结晶游离碱可以以片剂或胶囊的形式给药。片剂或胶囊可包含各种赋形剂,例如选自微晶纤维素、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸的赋形剂。片剂或胶囊还可包含崩解剂,例如淀粉(优选玉米淀粉、马铃薯淀粉或木薯淀粉)、藻酸和某些复合硅酸盐。片剂或胶囊还可包含造粒粘合剂,例如蔗糖、明胶或阿拉伯树胶。另外,为了压片目的,也可将润滑剂,如硬脂酸镁、十二烷基硫酸钠和滑石添加到片剂或胶囊中。
100.在一些实例中,包含奥马环素结晶游离碱的口服制剂包含至少一种或多种附加成分,如稀释剂、稳定剂、助流剂、润滑剂和崩解剂。在一些实例中,稀释剂可以是乳糖或微晶纤维素,或乳糖和微晶纤维素二者的组合。在一些实例中,稳定剂可以是亚硫酸氢钠。在一些实例中,助流剂可以是胶体二氧化硅。在一些实例中,润滑剂可以是硬脂酰富马酸钠或硬脂酸镁。在一些实例中,崩解剂可以是交聚维酮。
101.在一些实施方案中,旨在口服给药的本发明的药物组合物,例如片剂或胶囊,可包
含约10至约1000 mg奥马环素结晶游离碱,例如约20至约750 mg、约50至约500 mg、约75至约400 mg、约100至约300 mg、约110至约250 mg、约120至约240 mg、约130至约210 mg、约140至约170 mg、或约150 mg奥马环素结晶游离碱。
102.对于非肠道给药(包括腹膜内、皮下、静脉内、皮内或肌内注射),本发明还提供包含奥马环素结晶游离碱的可注射制剂。这样的可注射制剂可以是干燥(例如冻干)粉末的形式,其在给药之前用载体,例如水性载体,如水进行重组。在一些实施方案中,包含奥马环素结晶游离碱的可注射制剂还可包含至少一种或多种附加成分,如冻干保护剂、抗氧化剂和ph调节化合物。
103.在一些实例中,冻干保护剂可以是糖,如蔗糖。在一些实例中,抗氧化剂可以是亚硫酸氢盐化合物,例如亚硫酸氢钠。在一些实例中,ph调节化合物可以是酸,例如无机酸,如磷酸、硝酸、硫酸或盐酸。ph调节化合物也可以是碱,例如无机碱,如氢氧化钠。在一些实例中,ph调节化合物可包含酸(例如无机酸)和碱二者,它们一起添加到包含奥马环素结晶盐的可注射制剂中以实现所需ph。在一些实施方案中,所需ph为约4.0至约4.5,例如4.2。
104.在一些实施方案中,旨在非肠道给药的本发明的药物组合物,例如冻干形式或用载体重组的可注射制剂可包含约5至约500 mg奥马环素结晶游离碱,例如约10至约400 mg、约25至约300 mg、约50至约200 mg、约50至约150 mg、约60至约140 mg、约70 mg至约130 mg、约80 mg至约120 mg、约90 mg至约110 mg、或约100 mg奥马环素结晶游离碱。
105.在一些实施方案中,包含奥马环素结晶游离碱的药物组合物可以是气溶胶药物组合物的形式。这样的气溶胶药物组合物可以是溶液、悬浮液、粉末制剂或脂质体制剂的形式。包含奥马环素结晶游离碱的气溶胶药物组合物可包含在气溶胶分配器中,其在一些实例中也可包含定量喷雾装置。在一些实例中,气溶胶分配器可以是雾化器,例如小容量雾化器(svn)、加压定量吸入器(pmdi)或干粉吸入器(dpi)。在本发明的上下文中通过气溶胶给药四环素化合物,例如奥马环素或其药学上可接受的盐对治疗肺部疾病,例如与细菌感染,如分枝杆菌感染相关的肺部疾病可以特别有用。
106.在一些实施方案中,包含奥马环素结晶游离碱的药物组合物可以是适于外用给药的药物组合物的形式。这样的药物组合物可以是凝胶、软膏、洗剂或乳膏的形式,并可包含适当地混合在药理学惰性的外用载体中的四环素化合物。药理学惰性的外用载体可包括水、甘油、醇、丙二醇、脂肪醇、甘油三酯、脂肪酸酯或矿物油。其它可行的外用载体可以是液体矿脂、棕榈酸异丙酯、聚乙二醇、乙醇、聚氧乙烯单月桂酸酯、十二烷基硫酸钠等。此外,如果需要,还可加入材料如抗氧化剂、保湿剂、粘度稳定剂等。
107.使用奥马环素结晶游离碱治疗或预防细菌感染的方法本发明还提供治疗或预防细菌感染的方法,其包括给药有此需求的受试者奥马环素结晶游离碱或包含奥马环素结晶游离碱的药物组合物。
108.在一些实施方案中,细菌感染可由革兰氏阳性或革兰氏阴性细菌引起。在一些实施方案中,细菌感染可由对其它四环素化合物具有耐药性的细菌引起。在一些实例中,细菌感染可由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌、卡他布兰汉菌、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
109.在一个实例中,细菌感染是急性细菌性皮肤结构感染(absssi)。absssi可由革兰
氏阳性或革兰氏阴性细菌,例如选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株)(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
110.在另一实例中,细菌感染是社区获得性细菌性肺炎(cabp)。cabp可由革兰氏阳性、革兰氏阴性或非典型细菌,例如选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
111.在另一实例中,细菌感染可由艰难梭菌引起。
112.在另一实例中,细菌感染可由分枝杆菌,例如属于美国专利申请号 62/726,738、美国专利申请号 62/731,410、美国专利申请号 62/746,039和美国专利申请号 62/760,131中描述的分枝杆菌种属的分枝杆菌引起,它们各自的全部内容经此引用并入本文。
113.在又一实例中,细菌感染是尿路感染(uti)。
114.术语“治疗”(“treating”或“treatment”)是指改善或减轻要治疗的病症,例如细菌感染的一种或多种症状。
115.术语“预防”(“prophylaxis”、“prevent”或“prevention”)是指预防或降低细菌感染的风险。
116.术语“耐药性”(“resistance”或“resistant”)是指如临床和实验室标准协会(clinical and laboratories standards institute)(clsi)和/或食品药品管理局(food and drug administration)(fda)定义的抗生素/生物体标准。
117.术语“受试者”包括受到细菌感染的动物。受试者的实例包括动物,如家畜(例如牛、猪、马、山羊、兔子、绵羊、鸡等)、实验室动物(小鼠、大鼠、猴子、黑猩猩等)、宠物(例如犬、猫、雪貂、仓鼠等)、鸟类(例如鸡、火鸡、鸭、鹅、乌鸦(crows)、渡鸦(ravens)、麻雀等)、灵长类动物(例如猴子、大猩猩、黑猩猩、倭黑猩猩和人类)和其它动物(例如松鼠、浣熊、小鼠、大鼠等)。在一个实施方案中,受试者是小鼠或大鼠。在一个实施方案中,受试者是牛、猪或鸡。在一个实施方案中,受试者是人。
118.术语“有效量”包括治疗或预防细菌感染所需的奥马环素结晶游离碱的量。例如,有效量描述了足以通过杀死细菌和/或抑制细菌生长来实现所需治疗效果的有效水平。在一个实施方案中,有效量足以根除引起感染的细菌(bacterium或bacteria)。
119.奥马环素结晶游离碱的给药奥马环素结晶游离碱可独自或作为药物组合物的一部分给药于有此需求的受试者。包含奥马环素结晶游离碱的任何示例性药物组合物可包含有效量的奥马环素结晶游离碱和任选地药学上可接受的载体。
120.语句“药学上可接受的载体”包括能够与奥马环素结晶游离碱共同给药并且可以能使两者都发挥它们的预期功能,例如治疗或预防细菌感染的物质。合适的药学上可接受的载体包括但不限于水、盐溶液、醇、植物油、聚乙二醇、明胶、乳糖、直链淀粉、硬脂酸镁、滑石、硅酸、粘性石蜡、香精油、脂肪酸单甘油酯和脂肪酸二甘油酯、石油醚脂肪酸酯、羟甲基
纤维素、聚乙烯吡咯烷酮等。药物组合物可以灭菌并且如果需要,与不会有害地与奥马环素结晶游离碱反应的助剂,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂、调味料和/或芳香物质等混合。
121.可用于本发明的方法的药物组合物可适于通过口服、非肠道或外用途径给药。在一些实例中,可用于本发明的方法的药物组合物也适于通过气溶胶递送。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对奥马环素结晶游离碱的个体响应以及所选的药物组合物的类型和进行这种给药的时间周期和间隔,可能发生变化。
122.对于口服给药,奥马环素结晶游离碱可以以片剂或胶囊的形式给药。片剂或胶囊可包含各种赋形剂,例如选自微晶纤维素、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸的赋形剂。片剂或胶囊还可包含崩解剂,例如淀粉(优选玉米淀粉、马铃薯淀粉或木薯淀粉)、藻酸和某些复合硅酸盐。片剂或胶囊还可包含造粒粘合剂,例如蔗糖、明胶或阿拉伯树胶。另外,为了压片目的,也可将润滑剂,如硬脂酸镁、十二烷基硫酸钠和滑石添加到片剂或胶囊中。
123.对于非肠道给药(包括腹膜内、皮下、静脉内、皮内或肌内注射),本发明还提供包含奥马环素结晶游离碱的可注射制剂。这样的可注射制剂可以是干燥(例如冻干)粉末的形式,其在给药之前用载体,例如水性载体,如水重组。在一些实施方案中,可注射制剂还可包含至少一种或多种附加成分,如冻干保护剂、抗氧化剂和ph调节化合物。
124.可适用于本发明的方法的包含奥马环素结晶游离碱的某些药物组合物描述在例如美国专利号 9,315,475中,其全部内容经此引用并入本文。
125.在本发明的方法中,奥马环素结晶游离碱也可通过气溶胶给药于受试者。包含奥马环素结晶游离碱的气溶胶药物组合物可以是溶液、悬浮液、粉末制剂或脂质体制剂的形式。包含奥马环素结晶游离碱的气溶胶药物组合物可包含在气溶胶分配器中,其在一些实例中也可包含定量喷雾装置。在一些实例中,气溶胶分配器可以是雾化器,例如小容量雾化器(svn)、加压定量吸入器(pmdi)或干粉吸入器(dpi)。
126.对于外用给药,奥马环素结晶游离碱也可作为适于外用给药的药物组合物的一部分给药于受试者。这样的组合物可以是凝胶、软膏、洗剂或乳膏的形式,并可包含适当地混合在药理学惰性的外用载体中的四环素化合物。药理学惰性的外用载体可包括水、甘油、醇、丙二醇、脂肪醇、甘油三酯、脂肪酸酯或矿物油。其它可行的外用载体可以是液体矿脂、棕榈酸异丙酯、聚乙二醇、乙醇、聚氧乙烯单月桂酸酯、十二烷基硫酸钠等。此外,如果需要,还可加入材料如抗氧化剂、保湿剂、粘度稳定剂等。
127.奥马环素结晶游离碱可以以约100至约200 mg、约100至约300 mg、约100至400 mg、约100至约500 mg、约100至约600 mg、约200至约500 mg、或约300至约600 mg奥马环素结晶游离碱的剂量,例如日剂量给药于受试者。在进一步实例中,奥马环素结晶游离碱可口服给药。在进一步实例中,奥马环素结晶游离碱可静脉内给药。
128.在一些方面,奥马环素结晶游离碱可以以约50至约150 mg、约50至约400 mg、约50至约300 mg、约50至约200 mg、约100至约300 mg或约200至约300 mg、或约100 mg的剂量给药于受试者。例如,奥马环素结晶游离碱可以以约100 mg、约150 mg、约200 mg、约250 mg或约300 mg的剂量,例如日剂量给药于受试者。在一个实施方案中,该剂量是静脉内剂量。
129.在一些方面,奥马环素结晶游离碱可以以约50至约800 mg、约100至约700 mg、约
250至约600 mg、约300至约500 mg、约100至约400 mg、约100至约600 mg、或约300 mg的剂量给药于受试者。例如,奥马环素结晶游离碱可以以约300 mg、约450 mg或约600 mg的剂量给药。在一个实施方案中,该剂量是口服剂量。
130.在一个实施方案中,奥马环素结晶游离碱可以以约100 mg、约200 mg或约300 mg的剂量静脉内给药。在另一实施方案中,奥马环素结晶游离碱可以以约300 mg、约600 mg或约900 mg的剂量口服给药。
131.在一些实例中,奥马环素结晶游离碱可作为气溶胶剂量给药,例如使用气溶胶分配器递送。在一些实例中,气溶胶分配器可包含约1至约2000 mg,例如约1至约500 mg、约25至约300 mg、约50至约400 mg、约100至约500 mg、约200至约800 mg、约500 mg至约1000 mg、约10 mg至约200 mg或约300 mg至约700 mg的奥马环素结晶游离碱剂量。在一些实例中,气溶胶分配器可包含约1 mg、约5 mg、约10 mg、约30 mg、约50 mg、约80 mg、约100 mg、约150 mg、约200 mg、约250 mg、约300 mg、约350 mg、约400 mg、约450 mg、约500 mg、约550 mg、约600 mg、约650 mg、约700 mg、约750 mg、约800 mg、约850 mg、约900 mg、约950 mg或约1000 mg的奥马环素结晶游离碱剂量。
132.在一些实例中,奥马环素结晶游离碱可外用给药,例如通过向患处施加包含奥马环素结晶游离碱的适于外用给药的药物组合物。例如,适于外用给药的药物组合物可以是溶液形式并包含浓度为基于组合物的体积计的约0.01%至约20% w/v,例如约0.01%至约10% w/v、约0.1%至约20% w/v、约0.5%至约5% w/v、约1%至约10% w/v或约5%至约20% w/v的奥马环素结晶游离碱。例如,适于外用给药的药物组合物可包含浓度为约0.01% w/v、约0.05% w/v、约0.1% w/v、约0.5% w/v、约1% w/v、约5% w/v、约10% w/v、约15% w/v或约20% w/v的奥马环素结晶游离碱。
133.在另一实例中,适于外用给药的药物组合物可包含浓度为基于组合物的体积计的约0.01%至约20% w/w,例如约0.01%至约10% w/w、约0.1%至约20% w/w、约0.5%至约5% w/w、约1%至约10% w/w或约5%至约20% w/w的奥马环素结晶游离碱。例如,适于外用给药的药物组合物可包含浓度为约0.01% w/w、约0.05% w/w、约0.1% w/w、约0.5% w/w、约1% w/w、约5% w/w、约10% w/w、约15% w/w或约20% w/w的奥马环素结晶游离碱。
134.在一些实例中,奥马环素结晶游离碱可以以如上所述的剂量每日至少一次,例如每日一次、每日两次、每日三次或每日四次给药。在进一步实例中,奥马环素结晶游离碱可以每日两次给药于受试者。在一个具体实例中,奥马环素结晶游离碱可以每日两次口服给药于受试者。
135.应该理解的是,包含上列剂量的剂量范围的给药也包括在本发明中。例如,任何上述剂量可以是本发明的方法中包括的剂量范围的下部或上部。甚至进一步,应该理解的是,本技术通篇使用的所有数值列表或集合也旨在包括数值范围,其中任何列举的数值可以是范围的下部或上部。这些范围旨在包括在本发明中。
136.在一个实施方案中,奥马环素结晶游离碱的口服剂量可为奥马环素结晶游离碱的静脉内剂量的3倍。
137.要理解的是,对于所有列举的实施方案,奥马环素结晶游离碱的剂量也是奥马环素结晶游离碱的有效量。
138.在一个实施方案中,当口服给药时,奥马环素结晶游离碱的有效量可以为约100至
约1000 mg奥马环素结晶游离碱,例如约200至约750 mg、约100至约500 mg、约200至约600或约400至约600。在进一步实例中,当口服给药时,奥马环素结晶游离碱的有效量可以为约300 mg、约450 mg或约600 mg该四环素化合物。
139.在另一实施方案中,当静脉内给药时,奥马环素结晶游离碱的有效量可以为约50至约500 mg奥马环素,例如约50至约400 mg、约100至约300 mg或约50至约200 mg。例如,当静脉内给药时,奥马环素结晶游离碱的有效量可以为约100 mg、约150 mg、约200 mg、约250 mg或约300 mg。
140.在一些实例中,奥马环素结晶游离碱在本发明的上下文中可通过口服、非肠道、全身、外用途径或通过气溶胶递送进行给药。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对药物的个体响应以及所选的药物制剂的类型和进行这种给药的时间周期和间隔,可能发生变化。
141.在一些实施方案中,奥马环素结晶游离碱可给药至少3天、至少7天、至少14天、至少21天、至少30天、至少60天、至少5周、至少10周、至少15周、至少20周、至少30周、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少13个月、至少14个月、至少15个月、至少16个月、至少17个月、至少18个月、至少19个月、至少20个月、至少21个月、至少22个月、至少23个月或至少24个月。例如,奥马环素结晶游离碱的给药可持续3天至7天、3天至14天、3天至21天、3天至30天、3天至60天、7天至14天、7天至21天、7天至30天、7天至60天、14天至21天、14天至30天、14天至60天、21天至30天、21天至60天、30天至60天、1周至5周、3周至10周、5周至20周、10周至30周、20周至35周、1周至1个月、2周至2个月、1个月至3个月、1个月至6个月、1个月至9个月、3个月至12个月、6个月至12个月、9个月至12个月、9个月至16个月、12个月至18个月、14个月至24个月、12个月至24个月、或24个月或更久。
142.例如,奥马环素结晶游离碱可给药3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41天、42天、43天、44天、45天、46天、47天、48天、49天、50天、51天、52天、53天、54天、55天、56天、57天、58天、59天、60天、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月或24个月。在其它实例中,奥马环素结晶游离碱可给药多于24个月,例如25个月、26个月、27个月、28个月、29个月、30个月、31个月、32个月、33个月、34个月、35个月、36个月、37个月、38个月、39个月、40个月、41个月、42个月、43个月、44个月、45个月、46个月、47个月、48个月或多于48个月。
143.在一些实施方案中,向受试者给药奥马环素结晶游离碱可包括给药一个或多个负荷剂量的奥马环素结晶游离碱,接着给药一个或多个维持剂量的奥马环素结晶游离碱。在一些实施方案中,所述一个或多个负荷剂量的奥马环素结晶游离碱可大于所述一个或多个维持剂量的奥马环素结晶游离碱。例如,负荷剂量可以为约450 mg日剂量,例如每日口服剂
量,而维持剂量可以为约300 mg日剂量,例如每日口服剂量。在另一实例中,负荷剂量可以为约200 mg日剂量,例如每日静脉内剂量,而维持剂量可以为约100 mg日剂量,例如每日静脉内剂量,或300 mg日剂量,例如每日口服剂量。
144.负荷剂量的奥马环素结晶游离碱和维持剂量的奥马环素结晶游离碱可通过相同途径或不同途径给药。例如,(一个或多个)负荷剂量可以静脉内给药,且维持剂量可以口服给药。在其它实施方案中,(一个或多个)负荷剂量和维持剂量都可口服给药,或(一个或多个)负荷剂量和维持剂量都可静脉内给药。
145.在一些实例中,负荷剂量的奥马环素结晶游离碱可以是每日两次给药的口服剂量或静脉内剂量,且维持剂量可以是每日一次给药的口服剂量或静脉内剂量。例如,奥马环素结晶游离碱可作为每日两次100 mg的静脉内负荷剂量,接着是每日一次100 mg的静脉内维持剂量来进行给药。在另一实例中,奥马环素结晶游离碱可作为每日两次100 mg的静脉内负荷剂量,接着是每日一次300 mg的口服维持剂量来进行给药。在又一实例中,奥马环素结晶游离碱可作为每日两次300 mg的口服负荷剂量,接着是每日一次300 mg的口服维持剂量来进行给药。
146.在另一实例中,奥马环素结晶游离碱的给药可不包含一个或多个负荷剂量的奥马环素结晶游离碱的给药。因此,在一些实例中,奥马环素结晶游离碱可在整个治疗周期以相同剂量给药于受试者。例如,奥马环素结晶游离碱可以以约100 mg、约200 mg或约300 mg的静脉内剂量给药于受试者。该静脉内剂量可在整个治疗中每日一次或两次给药于受试者。在另一实例中,奥马环素结晶游离碱可以以约300 mg、约450 mg或约600 mg的口服剂量给药于受试者。该口服剂量可在整个治疗周期每日一次给药于受试者。
147.在一些实例中,奥马环素结晶游离碱可单独或与至少一种附加治疗剂组合来给药于受试者。语句“与治疗剂组合”意在包括奥马环素结晶游离碱和治疗剂的同时给药;首先给药奥马环素结晶游离碱,接着是治疗剂;以及首先给药治疗剂,接着是奥马环素结晶游离碱。在一个实例中,该治疗剂是抗生素。
148.术语“约”是指可以比指定值大或小15%、10%、8%、5%、3%、2%、1%或0.5%的数值范围。例如,“约10%”可以是8.5%至11.5%。在一个实施方案中,术语“约”是指比指定值大或小5%的数值范围。在另一实施方案中,术语“约”是指比指定值大或小2%的数值范围。在另一实施方案中,术语“约”是指比指定值大或小1%的数值范围。
149.要理解的是,无论在本文中提供了数值还是范围,例如关于受试者群体的年龄、剂量和持续时间等,这些数值和范围涵盖的所有数值和范围都意图包含在本发明的范围内。此外,这些数值和范围内的所有数值也可以是范围的上限或下限。
150.纯化奥马环素游离碱的方法本发明还提供纯化奥马环素游离碱,例如粗制奥马环素游离碱的方法。纯化奥马环素游离碱的方法在一些实例中涉及对包含粗制奥马环素游离碱的溶液通过高效液相色谱法(hplc),例如制备hplc进行纯化的步骤,由此获得包含经hplc纯化的奥马环素游离碱的溶液。在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在hplc纯化之后,使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液,由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在纳滤步骤之后,从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱,由此产生
奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物。
151.与(如例如美国专利号 9,434,680中所述的)先前的纯化奥马环素的方法相比,本发明提供的纯化奥马环素游离碱,例如粗制奥马环素游离碱的方法能够实现奥马环素纯化的更高吞吐量和生产率。具体地,在一些实施方案中,本发明提供的纯化奥马环素的方法产生与先前方法相比包含更低量的杂质,例如如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的纯化奥马环素游离碱。在一些实施方案中,本发明提供的纯化奥马环素的方法的特征在于加工时间明显短于先前的奥马环素纯化方法。本文所用的术语“加工时间”是指由粗制奥马环素游离碱开始生产1千克奥马环素结晶游离碱所需的时间量。在一些实例中,术语“加工时间”是根据如图6中所示的程序,即包括hplc步骤、纳滤步骤和结晶步骤的程序生产1千克奥马环素结晶游离碱所需的时间。在一些实例中,术语“加工时间”不包括在结晶之后干燥奥马环素结晶游离碱所需的时间。
152.例如,与先前方法相比,本方法能使加工时间减少为先前方法所需的加工时间的最多1/2倍,例如最多约1/3倍、最多约1/4倍、最多约1/5倍、最多约1/6倍、最多约1/7倍、最多约1/8倍、最多约1/9倍、最多约1/10倍、最多约1/11倍或最多约1/12倍。在一个具体实施方案中,本方法能使加工时间减少为最多约1/12倍,即从先前方法实现的约73.9小时减少到约6.1小时。
153.高效液相色谱法在一些实例中,纯化奥马环素游离碱的方法包括对包含粗制奥马环素游离碱的溶液通过高效液相色谱法(hplc),例如制备hplc进行纯化的步骤,由此获得包含经hplc纯化的奥马环素游离碱的溶液。通过hplc纯化粗制奥马环素游离碱能够除去杂质,例如如上所述的化合物(3)、(4)和(5),以及合成副产物。包含粗制奥马环素游离碱的溶液可通过本领域中已知用于制备粗制奥马环素游离碱的任何方法获得,例如通过上述方案1中所示的程序或通过例如美国专利号 9,434,680、美国专利号 9,522,872或美国专利号 8,383,610(它们各自的全部内容经此引用并入本文)中描述的方法。
154.在一些实施方案中,hplc纯化包括使用固定相,例如反相(rp)。在本发明的上下文中可使用的固定相可以是提供粗制奥马环素游离碱的充分纯化的任何固定相。在一些实例中,rp固定相可以是c18固定相。在一些实例中,rp固定相可具有约50
ꢀå
至约200
ꢀå
,例如约50
ꢀå
至约90
ꢀå
、约80
ꢀå
至约150
ꢀå
、约120
ꢀå
至约200
ꢀå
、或约100
ꢀå
的孔径。在一些实例中,rp固定相可具有约0.5
ꢀµ
m至约20
ꢀµ
m,例如约0.5
ꢀµ
m至约5
ꢀµ
m、约2
ꢀµ
m至约15
ꢀµ
m、约5
ꢀµ
m至约20
ꢀµ
m、或约10
ꢀµ
m的粒度。在一个实例中,rp固定相可以是具有约100
ꢀå
的孔径和约10
ꢀµ
m的粒度的c18相。在一个实施方案中,rp固定相可以是来自phenomenex的luna
®ꢀ
10
ꢀµ
m prep c18(2) 100
ꢀå
, lc column 250 x 21.2 mm, axia
™ꢀ
packed, ea。在另一实施方案中,rp固定相可以是synergi polar rp10 10
ꢀµꢀ
80
ꢀå
。
155.在一些实施方案中,hplc纯化包括使用流动相,例如洗脱缓冲液,如洗脱缓冲液a和洗脱缓冲液b。洗脱缓冲液a可包含水和有机溶剂,如甲醇、乙醇、二氯甲烷或乙腈的混合物。在一个具体实施方案中,缓冲液a包含水和乙腈。洗脱缓冲液a在一些实例中还可包含无机盐,如磷酸盐(例如磷酸钾、磷酸氢二钾、磷酸钠、磷酸氢二钠或磷酸铵)、乙酸盐(例如乙酸铵、乙酸钾或乙酸钠)或甲酸盐(例如甲酸钠或甲酸钾)。洗脱缓冲液b可包含有机溶剂,如甲醇、乙醇、二氯甲烷或乙腈。在一个具体实施方案中,洗脱缓冲液b包含乙腈。
156.在一些实施方案中,洗脱缓冲液a和/或洗脱缓冲液b还可包含选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂。在其它实施方案中,在hplc纯化之前,可将选自弱酸和有机胺的改性剂添加到包含粗制奥马环素游离碱的溶液中。
157.本文所用的术语“改性剂”是指在被添加到洗脱缓冲液a、和/或洗脱缓冲液b、和/或包含粗制奥马环素游离碱的溶液中时促进通过hplc对粗制奥马环素游离碱的纯化的化学试剂。
158.本文所用的术语“弱酸”是指当溶解在溶液,例如水溶液中时不完全解离的酸。在一些实施方案中,弱酸是具有约3.0至约6.0的pka的酸。
159.在一些实施方案中,改性剂可以是弱酸。可用作本发明上下文中的改性剂的弱酸的非限制性实例可包括草酸、甲磺酸、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。例如,该弱酸可选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实例中,该弱酸可以是乙酸。
160.在其它实施方案中,改性剂可以是有机胺。可用作本发明上下文中的改性剂的有机胺的非限制性实例包括3-乙醇胺、二乙胺和三甲胺。
161.在一个具体实施方案中,改性剂是弱酸,例如乙酸。在一个进一步实例中,将弱酸,例如乙酸添加到洗脱缓冲液a中。在另一个进一步实例中,将弱酸,例如乙酸添加到洗脱缓冲液b中。在又一个进一步实例中,在hplc纯化之前,将弱酸,例如乙酸添加到包含粗制奥马环素游离碱的溶液中。
162.不希望受制于具体理论,但相信,某些改性剂,如弱酸,例如乙酸,在hplc纯化之前被添加到洗脱缓冲液a和/或洗脱缓冲液b和/或包含粗制奥马环素游离碱的溶液中时,与先前用于奥马环素的基于hplc的纯化方法相比能够通过hplc更快速和更高效地纯化奥马环素游离碱。例如如美国专利号 8,946,196(其全部内容经此引用并入本文)中所述的先前的奥马环素纯化方法利用强酸,即甲磺酸作为流动相的改性剂。不希望受制于具体理论,但相信,将弱酸,例如乙酸在hplc纯化之前添加到洗脱缓冲液a和/或洗脱缓冲液b和/或包含粗制奥马环素游离碱的溶液中产生界限分明的与奥马环素游离碱对应的hplc峰,例如具有锋利边界的hplc峰。这进而使得能够收集包含奥马环素游离碱的单个hplc级分或几个hplc级分,而非如先前的纯化方法所需的许多hplc级分。这进而能够将更多材料,即粗制奥马环素游离碱加载到hplc柱上并能在比先前的纯化方法短得多的时间内收集hplc级分,同时对于hplc也使用明显更少量的溶剂。此外,这还能够与先前的纯化方法相比实现产物,即奥马环素游离碱的更好纯化效果和/或回收率。这使得本发明的hplc纯化方法特别好地适用于纯化大量奥马环素游离碱。
163.奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物的纯度的一种量度由如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的含量限定。在一些实例中,通过hplc,例如制备hplc纯化粗制奥马环素游离碱致使除去显著量的β-差向异构体。例如,如通过在hplc迹线的曲线下的面积%测得,包含经hplc纯化的奥马环素游离碱的溶液中存在的β-差向异构体的量比包含粗制奥马环素游离碱的溶液中存在的β-差向异构体的量低至少50%,例如至少100%、至少150%、至少200%、至少250%、至少300%、至少350%、至少400%、至少450%、至少500%、至少600%、至少650%、至少700%、至少750%、至少800%、至少850%、至少900%、至少950%或至少1000%。例如,在本文描述的实施例1,表2中,β-差向异构体
的%含量从粗制奥马环素游离碱的溶液中存在的约11.13% β-差向异构体减少到经hplc纯化的奥马环素游离碱的溶液中存在的约1.71% β-差向异构体。
164.纳滤在一些实施方案中,含有经hplc纯化的奥马环素游离碱的hplc级分可以使用纳滤浓缩,以产生经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实施方案中,在纳滤之后,经hplc纯化的奥马环素游离碱的浓缩溶液可以用溶剂,例如二氯甲烷(dcm)萃取。在其它实施方案中,经hplc纯化的奥马环素游离碱的浓缩溶液没有用溶剂,例如dcm萃取,并直接用于如下所述的结晶奥马环素游离碱。
165.相较之下,例如如美国专利号 8,946,196中所述的先前的奥马环素纯化方法没有使用纳滤并且仅使用溶剂,例如dcm萃取。根据本发明的方法通过纳滤浓缩含有经hplc纯化的奥马环素游离碱的hplc级分能够显著减少在纳滤步骤之后进行的萃取所需的溶剂量。例如,如本文中的实施例3中所述,通过在用dcm萃取之前使用纳滤,需要892毫升dcm以产生包含71.04克经hplc纯化的奥马环素游离碱的浓缩溶液。相比之下,在没有纳滤的情况下,需要约43.97升dcm或约49倍多的dcm以产生包含相同量的经hplc纯化的奥马环素游离碱的浓缩溶液。因此,在包含用dcm萃取经hplc纯化的奥马环素游离碱的本发明的示例性实施方案中,纳滤能使萃取所需的溶剂,例如dcm的量减少为最多约1/5倍、最多约1/10倍、最多约1/15倍、最多约1/20倍、最多约1/25倍、最多约1/30倍、最多约1/35倍、最多约1/40倍、最多约1/45倍或最多约1/50倍。在一些实施方案中,纳滤能使经hplc纯化的奥马环素游离碱的萃取所需的溶剂,例如dcm的量减少为约1/5至约1/10倍、约1/10-至约1/20倍、约1/15至约1/30倍、约1/20至约1/40倍、或约1/25至约1/50倍。
166.在一些实例中,在没有随后用溶剂,例如dcm萃取的情况下进行纳滤以浓缩含有经hplc纯化的奥马环素游离碱的hplc级分。在这些实例中,在纳滤之后获得的包含经hplc纯化的奥马环素游离碱的浓缩溶液可直接用于如下所述的结晶奥马环素游离碱。因此,在这些实例中,纳滤的使用消除对溶剂的需要。
167.减少用于浓缩经hplc纯化的奥马环素游离碱的溶剂,例如dcm的体积或消除溶剂,例如dcm的使用降低了纯化程序的成本,并且也消除处置大量氯化废物的需要。消除用于浓缩经hplc纯化的奥马环素游离碱的溶剂,例如dcm的使用也消除了对蒸发步骤以从包含经hplc纯化的奥马环素游离碱的溶液中除去dcm的需要。蒸发步骤可导致奥马环素游离碱的降解,并且消除蒸发步骤使得奥马环素结晶游离碱的回收率提高。
168.纳滤包括通过膜过滤包含经hplc纯化的奥马环素游离碱的溶液。在纳滤过程中,正在过滤的溶液的一部分通过该膜,以形成滤液,而保留在膜上的溶液是渗余物。在本发明的方法中,大部分奥马环素游离碱保留在渗余物中,以形成包含经hplc纯化的奥马环素游离碱的浓缩溶液。因此,在本发明的一些实施方案中,纳滤步骤可进一步包括收集渗余物。
169.适用于根据本发明的方法的纳滤步骤的膜可包括能在允许溶剂通过该膜的同时保留奥马环素游离碱的任何膜。在一些实例中,纳滤膜可具有约150至约500道尔顿,例如约150至约300道尔顿、约200至约400道尔顿或约300至约500道尔顿的截留分子量(mwco)。
170.在一些实施方案中,本发明的方法可进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的奥马环素游离碱的溶液中。例如,可以以足以在包含经hplc纯化的奥马环素游离碱的溶液中实现约0.01%至约0.5% w/v抗氧化剂的抗氧化剂浓度的量来加入抗氧化
剂。
171.可添加到包含经hplc纯化的奥马环素游离碱的溶液中的抗氧化剂可选自抗坏血酸(维生素c)、谷胱甘肽、硫辛酸、胡萝卜素、α-生育酚(维生素e)、泛醇(辅酶q)、去铁胺和亚硫酸氢盐,例如亚硫酸氢钠。
172.纳滤过程得到渗余物,其是包含经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实例中,渗余物中的奥马环素浓度为包含经hplc纯化的奥马环素游离碱的溶液,即由于hplc纯化而收集的级分中的奥马环素浓度的至少约2倍,例如至少约4倍、至少约5倍、至少约8倍、至少约10倍、至少约20倍或至少约50倍。
173.结晶在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在纳滤和用溶剂萃取之后,或在纳滤而没有用溶剂萃取之后,结晶奥马环素游离碱,由此产生奥马环素结晶游离碱。可以根据如上所述的方法进行奥马环素游离碱的结晶以产生例如如上所述的奥马环素结晶游离碱的多晶型物。
174.其中在纳滤而没有用溶剂,例如dcm萃取之后从浓缩溶液中结晶奥马环素游离碱的实施方案中,可用于结晶的溶剂可选自:丙酮和水的混合物;乙腈和水的混合物;以及异丙醇和水的混合物。在一个实例中,可用于结晶的溶剂可以是丙酮和水的混合物。
175.其中在纳滤和用溶剂,例如dcm萃取后从浓缩溶液中沉淀奥马环素游离碱的实施方案中,庚烷和甲基叔丁基醚(mtbe)可用于从dcm浓缩物中沉淀无定形游离碱。
176.在一些方面,由结晶产生的奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物为通过% w/w测得的至少90%纯,例如至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯。本文所用的术语“纯”或“纯度”是指通过% w/w测得的约90-100%纯,例如约95-100%纯、98-100%纯、或约99-100%纯的化合物。在一些实施方案中,纯的奥马环素游离碱包含小于约10%、小于约5%、小于约2%或小于约1%的杂质。杂质可包括,例如降解产物、氧化产物、差向异构体、溶剂和/或其它不合意杂质中的一种或多种。
177.从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱致使奥马环素游离碱的进一步纯化——如例如通过β-差向异构体含量测得。例如,奥马环素结晶游离碱中的β-差向异构体含量与包含经hplc纯化的奥马环素游离碱的浓缩溶液中的β-差向异构体含量相比可减少至少约50%,例如至少约60%、至少约70%、至少约80%或至少约90%。β-差向异构体的%含量作为相对于在hplc迹线的曲线下总面积计的与β-差向异构体对应的%总峰面积来测量。
178.在一些实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为10%或更低,例如5%或更低、2%或更低、1%或更低、0.9%或更低、0.5%或更低、0.1%或更低、0.05%或更低或0.01%或更低。在一个具体实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为0.9%或更低。β-差向异构体的%含量作为相对于在hplc迹线的曲线下总面积计的与β-差向异构体对应的%总峰面积来测量。
179.本发明提供的纯化奥马环素游离碱的方法提供了优于(如例如美国专利号 9,434,680中所述的)先前的纯化奥马环素的方法的优点。与先前的方法相比,本发明提供的
纯化奥马环素游离碱的方法能够实现奥马环素纯化的更高吞吐量和生产率。
180.下表1提供了先前的奥马环素纯化方法和本发明的方法的比较。具体地,表1比较先前的方法和本方法的加载在hplc柱上的材料量、计算出的%回收率和总加工时间。
181.表1. 使用本方法和先前的方法的hplc纯化的结果
方法加载到hplc柱上的粗制奥马环素材料的量(g/kg树脂)计算出的回收率(%)加工时间(对该分析校正后的纯的h/kg)本方法122(对该分析校正后为78)66.656.1先前方法7.2(对该分析校正后为4.1)59.4173.9
182.括号中显示的加载到hplc柱上的粗制奥马环素材料的量是对该分析校正后的量,即对加载材料中存在的奥马环素的实际量校正后的量。该数值反映了加载到hplc柱上的粗制奥马环素材料中存在的奥马环素的实际量。可以通过将已知量的粗制奥马环素材料产生的hplc信号与使用已知高纯度的奥马环素标准品生成的校准曲线进行比较来测定对该分析校正后的粗制奥马环素材料的量。
183.可以通过将纯化之后获得的结晶奥马环素游离碱的量(对该分析校正后的量)除以加载到hplc柱上的粗制奥马环素的量(对该分析校正后的量)并乘以100%来测定计算出的%回收率。
184.表1证实奥马环素游离碱的本纯化方法能将显著更大量的粗制奥马环素加载到hplc柱上,由此显著减少hplc纯化所需的树脂量。奥马环素游离碱的本纯化方法还得到更高的计算出的回收率并将生产1千克纯奥马环素游离碱所需的加工时间从约73.9小时显著减少到约6.1小时。在与先前的奥马环素纯化方法相比提供上述益处的同时,本发明的奥马环素游离碱纯化方法还提供至少与使用先前方法获得的奥马环素一样纯的奥马环素游离碱。在一些实施方案中,本发明的奥马环素游离碱纯化方法提供通过% w/w测得的至少90%纯,例如至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯的奥马环素游离碱。
185.这些特征使得本发明的hplc纯化方法特别好地适用于纯化大量奥马环素游离碱。
186.合成奥马环素的甲苯磺酸盐的方法本发明还提供由奥马环素结晶游离碱制备奥马环素的甲苯磺酸盐的方法。例如,根据本发明的方法,奥马环素的甲苯磺酸盐可以通过使奥马环素结晶游离碱在甲苯磺酰化反应中反应来制备,由此获得奥马环素的甲苯磺酸盐。在一些实例中,奥马环素的甲苯磺酸盐是奥马环素的结晶甲苯磺酸盐,例如如美国专利号 8,383,610(其全部内容经此引用并入本文)中所述的奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。
187.由奥马环素游离碱合成奥马环素的甲苯磺酸盐,例如结晶甲苯磺酸盐,如1型多晶型物、2型多晶型物或3型多晶型物的方法是本领域中已知的并描述在例如美国专利号 8,383,610中,其全部内容经此引用并入本文。
188.在一些实例中,由包含粗制奥马环素游离碱的溶液制备奥马环素的甲苯磺酸盐的方法包括对包含粗制奥马环素游离碱的溶液通过hplc进行纯化,由此获得包含经hplc纯化的奥马环素游离碱的溶液;使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液,由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液;和
从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱,由此产生奥马环素结晶游离碱;和使奥马环素结晶游离碱在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
189.图示如上所述的制备奥马环素的甲苯磺酸盐的程序的方案显示在图7中。
190.对包含粗制奥马环素游离碱的溶液通过hplc进行纯化由此获得包含经hplc纯化的奥马环素游离碱的溶液的步骤可如本文在前述部分中所述的来进行。
191.使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液的步骤可如本文在前述部分中所述的来进行。
192.从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱由此产生奥马环素结晶游离碱的步骤可如本文在前述部分中所述的来进行。
193.本发明还提供通过如上所述的方法获得的奥马环素的甲苯磺酸盐。在一些实例中,奥马环素的甲苯磺酸盐是奥马环素的结晶甲苯磺酸盐,例如如美国专利号 8,383,610中所述的奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。
194.在一些实施方案中,本发明还提供一种药物组合物,其包含奥马环素的甲苯磺酸盐,其中奥马环素的甲苯磺酸盐通过如上所述的方法获得。奥马环素的甲苯磺酸盐可以是奥马环素的结晶甲苯磺酸盐,例如奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。包含奥马环素的甲苯磺酸盐的示例性药物组合物描述在例如美国专利号 9,314,475中,其全部内容经此引用并入本文。
195.本发明还提供在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者已根据本发明的方法制备的奥马环素的甲苯磺酸盐。本文中还提供了在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者包含已使用本发明的方法制备的奥马环素的甲苯磺酸盐的药物组合物。
196.在一些实例中,细菌感染可由革兰氏阳性或革兰氏阴性细菌引起。在一些实例中,细菌感染可由对其它四环素化合物具有耐药性的细菌引起。在一些实例中,细菌感染可由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌、卡他布兰汉菌、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
197.在一个实例中,细菌感染是急性细菌性皮肤结构感染(absssi)。在一些实施方案中,absssi可由革兰氏阳性或革兰氏阴性细菌,例如选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株)(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
198.在另一实例中,细菌感染可以是社区获得性细菌性肺炎(cabp)。在一些实施方案中,cabp可由革兰氏阳性、革兰氏阴性或非典型细菌,例如选自选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
199.在另一实例中,细菌感染是艰难梭菌感染。
200.在又一实例中,细菌感染可以是尿路感染(uti)。
201.本发明的实施例实施例1. 从丙酮中结晶奥马环素游离碱这一实施例例示从丙酮中结晶奥马环素的游离碱并表征该结晶产物的典型程序。从纳滤之后获得的渗余物中结晶奥马环素的游离碱。浓度为80-100 mg/ml的渗余物用相同体积的丙酮稀释,种晶并搅拌,以使奥马环素游离碱结晶。过滤出产物并干燥。
202.奥马环素的结晶游离碱通过xrpd分析表征,且所得xrpd谱显示在图1中。图1中的xrpd谱中存在的明显峰(
°
2θ处)列在下表2中。
203.表2. 奥马环素的结晶游离碱的xrpd谱中的明显峰峰(
°
2θ处)强度(i/io)7.251007.377810.332812.586212.813914.753816.446317.868819.326019.444819.622722.193623.382624.3335
204.由表3中所示的数据而显而易见,结晶改进奥马环素游离碱的整体纯度,尤其是在除去β-差向异构体方面。
205.表3. 在奥马环素游离碱的纯化过程中的β-差向异构体的含量纯化阶段β-差向异构体的含量(%a/a)粗制奥马环素游离碱11.13在制备hplc之后汇集的级分1.71结晶奥马环素游离碱0.90
206.实施例2. 用于结晶奥马环素游离碱的附加溶剂的鉴别这一实验的目标是鉴别可用于结晶奥马环素游离碱的除丙酮之外的附加溶剂。
207.材料和方法所用起始材料是通过将来自不同批次的奥马环素的经纯化的游离碱溶解在稀盐酸中而制备的无定形游离碱。该碱用二氯甲烷(dcm)在中性ph下萃取,并将萃取物浓缩并干燥。所得材料是橙色粉末,具有通过hplc测得的98.22%的面积%纯度和1.44%的β-差向异构体含量。
208.对0.5克规模的奥马环素进行初步结晶尝试,且溶剂的典型体积为10毫升。对于无定形奥马环素的结晶,测试41种不同的溶剂或溶剂组合。对于溶剂的二元组合,第二种溶剂的含量在大多数情况下不超过5%。将奥马环素的溶液混合物在室温下搅拌过夜。滤出所形成的任何固体,洗涤并干燥。在每种情况下,通过hplc分析固体和滤液的样品并与起始材料进行比较。关于产物结晶度的结论基于hplc结果;结晶产物应该比起始材料更纯。
209.基于这些初步hplc结果,选择三种用于结晶的溶剂,并用于1克规模下的另一次结晶。在所有情况下都包括5%水的这三种溶剂是异丙醇、乙腈和2-丁酮(甲乙酮)。然后通过对这三种结晶的产物的xrpd分析进行结晶度的确认,并与奥马环素的对照结晶游离碱进行比较。
210.结果下表4含有起始材料与三种产物之间的hplc纯度的比较。也给出输出产率。所有用于结晶的溶剂含有5%水。
211.表4. 收率和纯度结果材料奥马环素(%)β-差向异构体(%)收率(%)起始材料98.221.44na从异丙醇中结晶的产物99.560.2192从乙腈中结晶的产物99.300.4389从2-丁酮中结晶的产物99.670.2579
212.通过对表4中所列的结晶产物的xrpd分析进行结晶度的确认。图2显示从湿乙腈中结晶的奥马环素游离碱的xrpd谱。图3显示从湿异丙醇中结晶的奥马环素游离碱的xrpd谱。图4显示从湿2-丁酮中结晶的奥马环素游离碱的xrpd谱。图5显示奥马环素的对照结晶游离碱的xrpd谱。如通过比较图1至3与图4显而易见,从湿乙腈、湿异丙醇和湿2-丁酮中结晶的产物是结晶的。
213.实施例3. 使用纳滤用于浓缩奥马环素的水溶液这一实验的目标是证实纳滤可在通过制备hplc纯化之后有效用于浓缩奥马环素游离碱的水溶液。在典型实验中,通过hplc纯化150克粗制奥马环素游离碱(纯度67.4% w/w,为分析调整后为101.1克)。对于进一步加工,选择在4070毫升93:7的水/乙腈混合物中含有80.34克奥马环素(浓度为19.74 mg/ml)的级分。这种溶液分两份(2000毫升和2070毫升)通过纳滤进行浓缩。作为输出,获得浓度为80.67 mg/ml和52.46 mg/ml的两个渗余物溶液,总共含有76.09克产物。各渗余物溶液用dcm进行萃取以提供奥马环素作为干粉;对该分析校正后为71.04克。总共892毫升dcm用于进行萃取回收。相比之下,利用dcm萃取以浓缩奥马环素水溶液的过程需要约43.97升dcm才能获得相同量的产物。如果将纳滤的第二部分浓缩到与第一部分相同的水平(即~80 mg/ml),将可以进一步减少dcm体积。
214.要指出,对获自纳滤的渗余物溶液进行dcm萃取是任选的。如以下实施例4中所述,奥马环素的游离碱可直接从渗余物溶液中结晶以产生结晶奥马环素游离碱。
215.在下一步骤中,对奥马环素游离碱进行甲苯磺酰化/结晶程序以产生量为82.85克的甲苯磺酸盐(对分析调整后为59.17克)。产物的纯度在规格范围内。
216.实施例4. 通过结晶游离碱生产奥马环素的结晶甲苯磺酸盐这一实验的目标是通过结晶游离碱生产奥马环素的结晶甲苯磺酸盐。使用在通过
制备hplc纯化粗制游离碱和纳滤后获得的渗余物(含有26.4千克粗制奥马环素)进行奥马环素的游离碱的结晶。将渗余物转移到反应器中,向其中加入相同体积的丙酮,并将溶液加热至20-25℃。使用乙酸/三甲胺(acoh/tea)将溶液的ph调节至7.8-8.0,并加入在丙酮/水混合物中的晶种。反应混合物在20-25℃下搅拌8-12小时并过滤。用丙酮-水混合物洗涤黄色固体并干燥。奥马环素的结晶游离碱的校正收率为10.62千克(41.8%)。
217.为了制备奥马环素的结晶甲苯磺酸盐,在玻璃反应器中制备对甲苯磺酸在丙酮/水中的溶液。同时,在第二反应器中,在25-30℃的温度下制备在无水丙酮中含有9.76千克奥马环素结晶游离碱的溶液。随后,在25-30℃的温度下将对甲苯磺酸溶液的体积的20%添加到第二反应器中。对反应混合物进行种晶,并经2-3小时的时间转移剩余的对甲苯磺酸溶液。所得悬浮液在10-15℃下搅拌1-3小时,过滤出,洗涤并干燥。奥马环素的结晶甲苯磺酸盐的收率为11.78千克(92.2%)。
218.等同原则本领域技术人员将认识到或能够仅使用常规实验法确定本文描述的具体实施方案和方法的许多等同物。这样的等同物旨在涵盖在本发明的范围内。本文引用的所有专利、专利申请和文献参考资料特此明确地经此引用并入。
1.相关申请本技术要求2020年6月11日提交的美国临时申请号 63/037,807的优先权,其全部内容经此引用并入本文。
2.引言奥马环素(也被称为omc或ptk 0796)是一种9-氨甲基四环素衍生物,其目前正处于用于治疗各种细菌感染的高级临床开发阶段。下面显示奥马环素的结构:。
3.奥马环素的化学合成先前已有描述,例如在美国专利号 9,434,680、美国专利号 9,522,872和美国专利号 8,383,610中,它们各自的全部内容经此引用并入本文。用于合成奥马环素的一种示例性程序显示在以下方案1中。在该程序中,使用米诺环素(a)作为起始材料,其在第一步骤中用n-(羟甲基)邻苯二甲酰亚胺在9-位置处进行烷基化。这种转化的产物(b)与甲胺反应,这致使胺基团脱保护并提供中间体(c)。在下一步骤中,中间体(c)在还原烷基化条件下与三甲基乙醛反应以产生游离碱形式的粗制奥马环素。
4.方案1. 用于合成奥马环素的示例性程序。
5.在合成后,将粗制奥马环素游离碱纯化并转化为甲苯磺酸盐形式,其转而用于制备奥马环素的药物组合物。粗制奥马环素游离碱的纯化涉及使用高效液相色谱法(hplc)和收集含有经纯化的奥马环素游离碱的hplc级分。随后,hplc级分中的奥马环素游离碱通过用二氯甲烷萃取来进行浓缩。这种纯化程序可能是耗时的,例如需要多于70小时的加工时间以生成1千克纯奥马环素。其在溶剂蒸发过程中使奥马环素长时间暴露于较高温度,这导致降解。此外,该纯化程序需要大量溶剂,由此生成大量废物。因此,需要更简易和更高效的纯化奥马环素游离碱的程序以产生高纯产物。另外,还需要可配制成药物组合物的新型纯
形式的奥马环素。
6.发明概述因此,在一些方面,本发明提供纯化奥马环素,例如粗制奥马环素游离碱的方法。所述方法在一些实施方案中包括改性hplc程序,其利用改性剂,例如乙酸并与先前使用的方法相比带来粗制奥马环素游离碱的更快速和更高效的纯化。
7.本发明的纯化奥马环素游离碱的方法在一些实施方案中还包括在奥马环素结晶之前使用纳滤浓缩含有奥马环素游离碱的hplc级分。使用纳滤代替用溶剂,例如二氯甲烷萃取hplc级分,由此消除在纯化过程中使用大量有毒溶剂的需要。纳滤的使用也避免奥马环素长时间暴露于较高温度,长时间暴露于较高温度可引起奥马环素的降解。任选地,如果在纳滤之后用溶剂,例如二氯甲烷进行萃取,与在没有纳滤的情况下进行的萃取相比,纳滤使得奥马环素的萃取所需的溶剂量显著减少。本文所述的纯化奥马环素的方法在一些实施方案中还包括,例如在hplc纯化、纳滤和任选萃取之后,使奥马环素游离碱结晶,以产生高纯奥马环素结晶游离碱,其杂质量显著低于使用先前的方法生成的奥马环素中的杂质量。
8.本发明的新型纯化方法首次实现奥马环素结晶游离碱的合成。因此,在一些实施方案中,本发明还提供奥马环素结晶游离碱、包含奥马环素结晶游离碱的药物组合物和使用奥马环素结晶游离碱治疗细菌感染的方法。
9.本发明的奥马环素结晶游离碱也可用于合成高纯奥马环素甲苯磺酸盐。因此,在一些实施方案中,本发明还提供由奥马环素结晶游离碱制备奥马环素的甲苯磺酸盐的方法。本发明还提供通过本发明的方法制成的奥马环素甲苯磺酸盐。
10.因此,在一些方面,本发明提供奥马环素游离碱的晶形(crystalline form),其中奥马环素由式(1)表示:。
11.在进一步实施方案中,奥马环素由式(2)表示:。
12.在一些方面,本发明还提供奥马环素游离碱的晶形的多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;
在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
13.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;和在约17.86
ꢀ°
2θ处的峰。
14.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
15.在一些方面,本发明还提供一种制备如上所述的多晶型物的方法,其包括从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在进一步实施方案中,有机溶剂选自乙腈、丙酮、异丙醇和甲乙酮。在一个具体实施方案中,有机溶剂是丙酮。
16.在一些方面,本发明还提供通过如上所述的方法制备奥马环素游离碱的晶形的多晶型物。例如,在一些实施方案中,本发明提供通过一种方法制备奥马环素游离碱的晶形的多晶型物,所述方法包括:从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。
17.在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在进一步实施方案中,有机溶剂选自乙腈、丙酮、异丙醇和甲乙酮。
在一个具体实施方案中,有机溶剂是丙酮。
18.在一些实施方案中,所述多晶型物由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
19.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;和在约17.86
ꢀ°
2θ处的峰。
20.在一些实施方案中,所述多晶型物由包括以下峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
21.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系中。在某些方面,有机溶剂选自异丙醇、乙腈和甲乙酮。
22.在一些方面,本发明还提供一种纯化游离碱形式的奥马环素的方法,其中奥马环素由式(1)表示:所述方法包括对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液。
23.在一些实施方案中,所述改性剂是弱酸,并且其中所述弱酸选自草酸、甲磺酸(methanesulfonic acid)、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。在一些实施方案中,所述弱酸选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实施方案中,所述弱酸是乙酸。在一些实施方案中,在hplc过程中将改性剂添加到流动相中;或者其中在加载到hplc柱上之前将改性剂添加到包含粗制游离碱形式的奥马环素的溶液中。在一些实施方案中,所述流动相包含洗脱缓冲液a和洗脱缓冲液b;其中洗脱缓冲液a包含水和乙腈和/或其中洗脱缓冲液b包含乙腈。
24.在一些方面,包含经hplc纯化的游离碱形式的奥马环素的溶液中的奥马环素的β差向异构体杂质的量为包含粗制游离碱形式的奥马环素的溶液中存在的奥马环素的β差向异构体杂质的量的至多1/5倍。
25.在一些实施方案中,本发明的方法进一步包括使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液。在一个实施方案中,所述方法进一步包括收集所述渗余物。
26.在一些实施方案中,本发明的方法进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的游离碱形式的奥马环素的溶液中。在进一步实施方案中,以足以实现约0.01%至约0.5% w/v的溶液中抗氧化剂的浓度的量来加入抗氧化剂。
27.在一些实施方案中,所述膜具有约150至约500道尔顿的截留分子量(mwco)。在一些实施方案中,渗余物中奥马环素的浓度为包含经hplc纯化的游离碱形式的奥马环素的溶液中奥马环素的浓度的至少约2倍,例如至少3倍、至少4倍、至少5倍、至少6倍、至少8倍或至少10倍。
28.在一些实施方案中,本发明的方法进一步包括结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形。在一些实施方案中,从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在进一步实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在于溶剂体系中。在一些实施方案中,有机溶剂选自腈、醇、酮和醚。例如,有机溶剂可选自乙腈、丙酮、异丙醇和甲乙酮。在一个具体实施方案中,有机溶剂是丙酮。
29.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系
中。在一些实施方案中,有机溶剂选自异丙醇、乙腈和甲乙酮。
30.在一些实施方案中,通过本发明的方法获得的奥马环素游离碱的晶形是一种多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
31.在一些方面,本发明还提供一种制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:通过如上所述的方法纯化游离碱形式的奥马环素,由此获得经纯化的游离碱形式的奥马环素;和使经纯化的游离碱形式的奥马环素在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
32.在一些实施方案中,本发明还提供一种制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
33.在一些实施方案中,从包含有机溶剂和水的溶剂体系中结晶游离碱形式的奥马环素。在一些实施方案中,有机溶剂和水以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存
在于溶剂体系中。在一些实施方案中,有机溶剂选自乙腈、丙酮、异丙醇、甲乙酮、叔丁基甲基醚、乙酸乙酯、甲苯和四氢呋喃。在一个具体实施方案中,有机溶剂是丙酮。
34.在一些实施方案中,丙酮和水以约50:50 v/v的丙酮:水的比率存在于溶剂体系中。在一些实施方案中,有机溶剂选自异丙醇、乙腈和甲乙酮。
35.在一些实施方案中,奥马环素游离碱的晶形是一种多晶型物,其由包括选自以下的至少一个峰的x-射线粉末衍射图表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
36.在一些实施方案中,本发明的方法包括对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液;和从包含经hplc纯化的游离碱形式的奥马环素的溶液中结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
37.在一些实施方案中,所述改性剂是弱酸,其中所述弱酸选自草酸、甲磺酸、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。在一些实施方案中,所述弱酸选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实施方案中,所述弱酸是乙酸。
38.在一些实施方案中,在hplc过程中将改性剂添加到流动相中;或在加载到hplc柱上之前将改性剂添加到包含粗制游离碱形式的奥马环素的溶液中。在一些实施方案中,所述流动相包含洗脱缓冲液a和洗脱缓冲液b;其中洗脱缓冲液a包含水和乙腈和/或其中洗脱缓冲液b包含乙腈。
39.在一些实施方案中,本发明的方法进一步包括使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液。在一些方面,本发明的方法进一步包括收集所述渗余物。
40.在一些实施方案中,本发明的方法进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的游离碱形式的奥马环素的溶液中。在进一步实施方案中,以足以实现约0.01%至约0.5% w/v的溶液中抗氧化剂的浓度的量来加入抗氧化剂。在一些实施方案中,用于纳
滤的膜具有约150至约500道尔顿的截留分子量(mwco)。
41.在一些方面,本发明还提供制备奥马环素的甲苯磺酸盐的方法,其中奥马环素由式(1)表示:所述方法包括:对包含粗制游离碱形式的奥马环素的溶液通过高效液相色谱法(hplc)进行纯化,其中所述hplc包括使用选自弱酸和有机胺的改性剂,由此获得包含经hplc纯化的游离碱形式的奥马环素的溶液;使用纳滤浓缩包含经hplc纯化的游离碱形式的奥马环素的溶液,其中所述纳滤包括通过膜过滤包含经hplc纯化的游离碱形式的奥马环素的溶液以形成滤液和渗余物,其中渗余物是包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液;从包含经hplc纯化的游离碱形式的奥马环素的浓缩溶液中结晶游离碱形式的奥马环素,由此获得奥马环素游离碱的晶形;和使奥马环素游离碱的晶形在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
42.在一些方面,本发明还提供通过如上所述的方法获得的奥马环素的甲苯磺酸盐,其中奥马环素由式(1)表示:。
43.在一些方面,本发明还提供通过如上所述的方法获得的奥马环素的结晶甲苯磺酸盐,其中奥马环素由式(1)表示:。
44.在进一步实施方案中,本发明还提供结晶甲苯磺酸盐的多晶型物,例如1型(form)多晶型物或3型多晶型物。
45.在一些方面,本发明还提供一种药物组合物,其包含如上所述的奥马环素游离碱的晶形和药学上可接受的载体。在一些实施方案中,本发明提供一种药物组合物,其包含如上所述的奥马环素游离碱的晶形的多晶型物和药学上可接受的载体。
46.在一些方面,本发明还提供一种药物组合物,其包含如上所述的奥马环素的甲苯
磺酸盐和药学上可接受的载体。在一些实施方案中,本发明还提供一种药物组合物,其包含如上所述的奥马环素的结晶甲苯磺酸盐和药学上可接受的载体。在一些实施方案中,本发明还提供一种药物组合物,其包含如上所述的奥马环素的结晶甲苯磺酸盐的多晶型物和药学上可接受的载体。
47.在一些实施方案中,所述药物组合物为片剂形式。在其它实施方案中,所述药物组合物是冻干粉形式的可注射制剂。
48.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素游离碱的晶形或药物组合物。
49.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素游离碱的晶形的多晶型物或药物组合物。
50.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的甲苯磺酸盐或药物组合物。
51.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的结晶甲苯磺酸盐或药物组合物。
52.在一些方面,本发明还提供一种在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者有效量的如上所述的奥马环素的结晶甲苯磺酸盐的多晶型物或药物组合物。
53.在一些实施方案中,细菌感染由革兰氏阳性或革兰氏阴性细菌引起。在一些实施方案中,细菌感染由对其它四环素化合物具有耐药性的细菌引起。在一些方面,细菌感染由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌(a. baumanii)、卡他布兰汉菌(b. catarrhalis)、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
54.在一些实施方案中,细菌感染是急性细菌性皮肤结构感染(absssi)。在进一步实施方案中,absssi由选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株(isolate))(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(grp.)(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
55.在一些实施方案中,细菌感染是社区获得性细菌性肺炎(cabp)。在进一步实施方案中,cabp由选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
56.在一些实施方案中,细菌感染由艰难梭菌种属的细菌引起。在一些方面,细菌感染由分枝杆菌引起。
57.附图简述图1是奥马环素结晶游离碱的典型xrpd谱。
58.图2是从包含乙腈和水的溶剂体系(湿乙腈)中结晶的奥马环素游离碱的xrpd谱。
59.图3是从包含异丙醇和水的溶剂体系(湿异丙醇)中结晶的奥马环素游离碱的xrpd谱。
60.图4是从包含2-丁酮和水的溶剂体系(湿2-丁酮)中结晶的奥马环素游离碱的xrpd谱。
61.图5是对照奥马环素结晶游离碱的xrpd谱。
62.图6是制备奥马环素结晶游离碱的方法的示意图。
63.图7是制备奥马环素的结晶甲苯磺酸盐的方法的示意图,所述方法包括制备奥马环素结晶游离碱。
64.发明详述奥马环素结晶游离碱本发明提供奥马环素游离碱的晶形。奥马环素是作为主要用于严重社区获得性感染,如急性细菌性皮肤和皮肤结构感染(absssi)、中度至重度社区获得性细菌性肺炎(cabp)和复杂性尿路感染(cuti)的经验疗法的一线药物(first-line agent)而开发的9-氨基甲基四环素衍生物。名称“奥马环素”在本文中与名称“omc”、“ptk 0796”或“化合物1”可互换使用。在一些实例中,奥马环素可由式(1)表示:。
65.在一些实例中,奥马环素可由式(2)表示:。
66.在其非结晶形式下,奥马环素是一种黄色无定形固体,其在暴露于空气、光和/或水分时可能特别不稳定。因此,在其固体形式下,奥马环素必须储存在低于0℃的温度下并有限暴露于空气、光和水分。超出这些有限暴露条件时,奥马环素可降解以产生降解产物,例如由式(3)和式(4)表示的空气降解产物,以及由式(5)表示的4-差向异构体。
67.奥马环素的游离碱和某些药学上可接受的盐描述在美国专利号 7553828中,且奥马环素的某些结晶盐描述在美国专利号 8,383,610中,它们各自的全部内容经此引用并入本文。但是,在本公开之前,没有已知的奥马环素游离碱的晶形或晶形的多晶型物。
68.因此,本发明提供奥马环素游离碱的晶形(化合物1)。本文所用的术语“结晶”或“晶形”是指其中原子以规则的重复型式排列的奥马环素的固体形式。在一些实施方案中,术语“结晶”无差别地包含奥马环素的多晶型形式或非无定形形式。
69.本文所用的术语“无定形”或“无定形形式”是指物质的非结晶形式,例如没有规则原子排列的固体形式。
70.本文所用的术语“多晶型物”或“多晶型形式”是指仅涉及溶质分子并具有特征性的结晶特征的有组织结构。这些术语可以是指同一分子的不同晶形。不同的多晶型物可具有由分子在晶格中的不同排列或构象引起的不同物理性质,例如熔融温度、熔化热、溶解度、溶解速率和/或振动谱。不同多晶型物表现出的物理性质的差异可影响对药物重要的参数,如储存稳定性、可压缩性和密度(在制剂和产品制造中是重要的)和溶出速率(生物利用度中的重要因素)。
71.不同多晶型物的稳定性差异也可能由化学反应性差异(例如对氧化的不同敏感性)引起。因此,由一种多晶型物组成的剂型可比由相同物质的不同多晶型物组成的剂型更快变色。不同多晶型物的稳定性差异也可能由机械性质差异(例如片剂在储存时随着动力学有利的多晶型物转化成热力学更稳定的多晶型物可能破碎);或化学和机械性质二者的差异(例如一种多晶型物的片剂在高湿度下更容易破裂)引起。由于溶解度/溶出度差异,在极端情况下,一些多晶型转变可导致效力损失,或在其它极端情况下,导致毒性。此外,晶体的物理性质在加工中可以是重要的。例如,相同物质的不同多晶型物可在它们形成溶剂化物的倾向或在它们的粒子形状和粒度分布方面表现出差异,从而影响纯化(例如一种多晶型物可比另一种多晶型物更难过滤和洗掉杂质)。
72.分子的多晶型物可通过本领域中已知的许多方法获得。这些方法可包括但不限于熔体重结晶、熔体冷却、溶剂重结晶、去溶剂化、快速蒸发、快速冷却、缓慢冷却、蒸气扩散和升华。表征多晶型物的技术可包括但不限于差示扫描量热法(dsc)、x-射线粉末衍射法(xrpd)、单晶x-射线衍射法、振动光谱术,例如红外和拉曼光谱术,固态nmr、热台光学显微术、扫描电子显微术(sem)、电子晶体学和定量分析、粒度分析(psa)、表面积分析、溶解度研究和溶出度研究。具体地,xrpd是用于表征多晶或粉状固体样品中的晶体结构、尺寸和择优
取向的技术。这种衍射也用于表征非均相固体混合物以测定存在的结晶化合物的百分比,并且可提供关于未知材料的结构信息。在本文中与术语“xrpd图”可互换使用的术语“x-射线粉末衍射图”是指通过xrpd分析收集的数据的图形图示。
73.在一些实施方案中,本发明提供奥马环素游离碱的晶形的多晶型物,在本文中也被称为“奥马环素结晶游离碱的多晶型物”。在一些实施方案中,奥马环素结晶游离碱的多晶型物由包括选自以下的至少一个峰的x-射线粉末衍射图(xrpd图)表征:在约7.25
ꢀ°
2θ处的峰;在约7.37
ꢀ°
2θ处的峰;在约10.33
ꢀ°
2θ处的峰;在约12.58
ꢀ°
2θ处的峰;在约12.81
ꢀ°
2θ处的峰;在约14.75
ꢀ°
2θ处的峰;在约16.44
ꢀ°
2θ处的峰;在约17.86
ꢀ°
2θ处的峰;在约19.32
ꢀ°
2θ处的峰;在约19.44
ꢀ°
2θ处的峰;在约19.62
ꢀ°
2θ处的峰;在约22.19
ꢀ°
2θ处的峰;和在约23.38
ꢀ°
2θ处的峰。
74.本文所用的术语“峰”是指在xrpd图中强度比基线噪声高至少20%,例如至少30%、至少40%、至少50%或至少100%的峰。
75.本文关于xrpd图中的峰所用的术语“约”(“approximately”或“about”)是指其中峰出现在给定
°
2θ值的0.5
ꢀ°
2θ内,例如0.4、0.3、0.2、0.1、0.05或0.01
ꢀ°
2θ内的xrpd图。
76.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少两个峰的x-射线粉末衍射图(xrpd图)表征。
77.在一些实施方案中,本发明提供奥马环素的晶形的多晶型物,其由包括选自如上所列的峰的至少三个峰的x-射线粉末衍射图(xrpd图)表征。
78.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少四个峰的x-射线粉末衍射图(xrpd图)表征。
79.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少五个峰的x-射线粉末衍射图(xrpd图)表征。
80.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少六个峰的x-射线粉末衍射图(xrpd图)表征。
81.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少七个峰的x-射线粉末衍射图(xrpd图)表征。
82.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少八个峰的x-射线粉末衍射图(xrpd图)表征。
83.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少九个峰的x-射线粉末衍射图(xrpd图)表征。
84.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少十个峰的x-射线粉末衍射图(xrpd图)表征。
85.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括选自如上所列的峰的至少十一个峰的x-射线粉末衍射图(xrpd图)表征。
86.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由包括如上所列的所有峰的x-射线粉末衍射图(xrpd图)表征。
87.在一些实施方案中,本发明提供奥马环素结晶游离碱的多晶型物,其由如图1至5中任一个所示的x-射线粉末衍射图(xrpd图)表征。
88.在一些方面,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物为至少90%纯,如通过奥马环素结晶游离碱的多晶型物的重量相对于组合物重量(w/w%)表示。例如,奥马环素结晶游离碱的多晶型物为至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯。本文所用的术语“纯”或“纯度”是指约90-100%纯,例如约95-100%纯、98-100%纯或约99-100%纯的化合物。在一些实施方案中,纯的奥马环素游离碱包含小于约10%、小于约5%、小于约2%或小于约1%的杂质。杂质可能包括,例如降解产物、氧化产物、差向异构体、溶剂和/或其它不合意杂质中的一种或多种。
89.奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物的纯度的一种量度由如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的含量限定。因此,在一些实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为通过hplc测得(即在hplc迹线上的曲线下总面积的%)的10%或更低,例如5%或更低、2%或更低、1%或更低、0.9%或更低、0.5%或更低、0.1%或更低、0.05%或更低或0.01%或更低。在一个具体实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为0.9%或更低。
90.合成奥马环素结晶游离碱的方法奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物可通过从包含有机溶剂和水的溶剂体系中结晶无定形奥马环素游离碱来制备。
91.在这样的溶剂体系中,有机溶剂和水可以以约5:95 v/v至约95:5 v/v的有机溶剂:水的比率存在。例如,水可以以约95% v/v(即有机溶剂:水的比率为约5:95 v/v)、约90% v/v(即有机溶剂:水的比率为约10:90 v/v)、约80% v/v(即有机溶剂:水的比率为约20:80 v/v)、约70% v/v(即有机溶剂:水的比率为约30:70 v/v)、约60% v/v(即有机溶剂:水的比率为约40:60 v/v)、约50% v/v(即有机溶剂:水的比率为约50:50 v/v)、约40% v/v(即有机溶剂:水的比率为约60:40 v/v)、约30% v/v(即有机溶剂:水的比率为约70:30 v/v)、约20% v/v(即有机溶剂:水的比率为约80:20 v/v)、约15% v/v(即有机溶剂:水的比率为约85:15 v/v)、约10% v/v(即有机溶剂:水的比率为约90:10 v/v)、约5% v/v(即有机溶剂:水的比率为约95:5 v/v)、或约1% v/v(即有机溶剂:水的比率为约99:1 v/v)的量存在于溶剂体系中。在其它实例中,水可以以约1%至约10%、约2%至约15%、约5%至约20%、或约1%至约15%的量存在于溶剂体系中。
92.溶剂体系中存在的有机溶剂可选自腈、醇、酮和醚。例如,有机溶剂可选自乙腈、丙酮、异丙醇、甲乙酮、叔丁基甲基醚、乙酸乙酯、甲苯和四氢呋喃。在一些实例中,有机溶剂可选自乙腈、丙酮、异丙醇和甲乙酮。
93.在一个实例中,溶剂体系可包含丙酮和水。丙酮和水可以以约1:99 v/v至约99:1 v/v,例如约10:90 v/v至约90:10 v/v、约20:80 v/v至约80:20 v/v、约30:70 v/v至约70:30、约40:60 v/v至约60:40 v/v的丙酮:水的比率存在于溶剂体系中。在一个实例中,丙酮和水可以以约50/50 v/v的丙酮:水的比率存在于溶剂体系中。在另一实例中,溶剂体系可包含乙腈和水,例如以约95/5 v/v的乙腈:水的比率存在于溶剂体系中。在又一实例中,溶剂体系可包含异丙醇和水,例如以约95/5 v/v的异丙醇:水的比率存在于溶剂体系中。在另一实例中,溶剂体系可包含甲乙酮和水,例如以约95/5 v/v的甲乙酮:水的比率存在于溶剂体系中。
94.在一些实例中,在结晶之前,可通过如在本公开其它地方所述的高效液相色谱法(hplc)和/或纳滤从包含粗制奥马环素无定形游离碱的溶液中纯化奥马环素无定形游离碱。
95.在一些实施方案中,本发明提供通过上述方法制备的奥马环素结晶游离碱。
96.包含奥马环素结晶游离碱的药物组合物本发明还提供包含奥马环素结晶游离碱的药物组合物。例如,本发明的药物组合物可包含有效量的奥马环素结晶游离碱和任选地药学上可接受的载体。本发明的药物组合物可被给药于有此需求的受试者用于治疗或预防细菌感染。
97.语句“药学上可接受的载体”包括能够与奥马环素结晶游离碱共同给药并且可以能使两者都发挥它们的预期功能,例如治疗或预防细菌感染的物质。合适的药学上可接受的载体包括但不限于水、盐溶液、醇、植物油、聚乙二醇、明胶、乳糖、直链淀粉、硬脂酸镁、滑石、硅酸、粘性石蜡、香精油、脂肪酸单甘油酯和脂肪酸二甘油酯、石油醚(petroethral)脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷酮等。药物组合物可以是灭菌的并且如果需要,与不会有害地与奥马环素游离碱反应的助剂,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂、调味料和/或芳香物质等混合。
98.包含奥马环素结晶游离碱的本发明的药物组合物可适于通过口服、非肠道或外用的途径给药。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对药物的个体响应以及所选的药物组合物的类型和进行这种给药的时间周期和间隔,可能发生变化。
99.对于口服给药,奥马环素结晶游离碱可以以片剂或胶囊的形式给药。片剂或胶囊可包含各种赋形剂,例如选自微晶纤维素、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸的赋形剂。片剂或胶囊还可包含崩解剂,例如淀粉(优选玉米淀粉、马铃薯淀粉或木薯淀粉)、藻酸和某些复合硅酸盐。片剂或胶囊还可包含造粒粘合剂,例如蔗糖、明胶或阿拉伯树胶。另外,为了压片目的,也可将润滑剂,如硬脂酸镁、十二烷基硫酸钠和滑石添加到片剂或胶囊中。
100.在一些实例中,包含奥马环素结晶游离碱的口服制剂包含至少一种或多种附加成分,如稀释剂、稳定剂、助流剂、润滑剂和崩解剂。在一些实例中,稀释剂可以是乳糖或微晶纤维素,或乳糖和微晶纤维素二者的组合。在一些实例中,稳定剂可以是亚硫酸氢钠。在一些实例中,助流剂可以是胶体二氧化硅。在一些实例中,润滑剂可以是硬脂酰富马酸钠或硬脂酸镁。在一些实例中,崩解剂可以是交聚维酮。
101.在一些实施方案中,旨在口服给药的本发明的药物组合物,例如片剂或胶囊,可包
含约10至约1000 mg奥马环素结晶游离碱,例如约20至约750 mg、约50至约500 mg、约75至约400 mg、约100至约300 mg、约110至约250 mg、约120至约240 mg、约130至约210 mg、约140至约170 mg、或约150 mg奥马环素结晶游离碱。
102.对于非肠道给药(包括腹膜内、皮下、静脉内、皮内或肌内注射),本发明还提供包含奥马环素结晶游离碱的可注射制剂。这样的可注射制剂可以是干燥(例如冻干)粉末的形式,其在给药之前用载体,例如水性载体,如水进行重组。在一些实施方案中,包含奥马环素结晶游离碱的可注射制剂还可包含至少一种或多种附加成分,如冻干保护剂、抗氧化剂和ph调节化合物。
103.在一些实例中,冻干保护剂可以是糖,如蔗糖。在一些实例中,抗氧化剂可以是亚硫酸氢盐化合物,例如亚硫酸氢钠。在一些实例中,ph调节化合物可以是酸,例如无机酸,如磷酸、硝酸、硫酸或盐酸。ph调节化合物也可以是碱,例如无机碱,如氢氧化钠。在一些实例中,ph调节化合物可包含酸(例如无机酸)和碱二者,它们一起添加到包含奥马环素结晶盐的可注射制剂中以实现所需ph。在一些实施方案中,所需ph为约4.0至约4.5,例如4.2。
104.在一些实施方案中,旨在非肠道给药的本发明的药物组合物,例如冻干形式或用载体重组的可注射制剂可包含约5至约500 mg奥马环素结晶游离碱,例如约10至约400 mg、约25至约300 mg、约50至约200 mg、约50至约150 mg、约60至约140 mg、约70 mg至约130 mg、约80 mg至约120 mg、约90 mg至约110 mg、或约100 mg奥马环素结晶游离碱。
105.在一些实施方案中,包含奥马环素结晶游离碱的药物组合物可以是气溶胶药物组合物的形式。这样的气溶胶药物组合物可以是溶液、悬浮液、粉末制剂或脂质体制剂的形式。包含奥马环素结晶游离碱的气溶胶药物组合物可包含在气溶胶分配器中,其在一些实例中也可包含定量喷雾装置。在一些实例中,气溶胶分配器可以是雾化器,例如小容量雾化器(svn)、加压定量吸入器(pmdi)或干粉吸入器(dpi)。在本发明的上下文中通过气溶胶给药四环素化合物,例如奥马环素或其药学上可接受的盐对治疗肺部疾病,例如与细菌感染,如分枝杆菌感染相关的肺部疾病可以特别有用。
106.在一些实施方案中,包含奥马环素结晶游离碱的药物组合物可以是适于外用给药的药物组合物的形式。这样的药物组合物可以是凝胶、软膏、洗剂或乳膏的形式,并可包含适当地混合在药理学惰性的外用载体中的四环素化合物。药理学惰性的外用载体可包括水、甘油、醇、丙二醇、脂肪醇、甘油三酯、脂肪酸酯或矿物油。其它可行的外用载体可以是液体矿脂、棕榈酸异丙酯、聚乙二醇、乙醇、聚氧乙烯单月桂酸酯、十二烷基硫酸钠等。此外,如果需要,还可加入材料如抗氧化剂、保湿剂、粘度稳定剂等。
107.使用奥马环素结晶游离碱治疗或预防细菌感染的方法本发明还提供治疗或预防细菌感染的方法,其包括给药有此需求的受试者奥马环素结晶游离碱或包含奥马环素结晶游离碱的药物组合物。
108.在一些实施方案中,细菌感染可由革兰氏阳性或革兰氏阴性细菌引起。在一些实施方案中,细菌感染可由对其它四环素化合物具有耐药性的细菌引起。在一些实例中,细菌感染可由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌、卡他布兰汉菌、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
109.在一个实例中,细菌感染是急性细菌性皮肤结构感染(absssi)。absssi可由革兰
氏阳性或革兰氏阴性细菌,例如选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株)(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
110.在另一实例中,细菌感染是社区获得性细菌性肺炎(cabp)。cabp可由革兰氏阳性、革兰氏阴性或非典型细菌,例如选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
111.在另一实例中,细菌感染可由艰难梭菌引起。
112.在另一实例中,细菌感染可由分枝杆菌,例如属于美国专利申请号 62/726,738、美国专利申请号 62/731,410、美国专利申请号 62/746,039和美国专利申请号 62/760,131中描述的分枝杆菌种属的分枝杆菌引起,它们各自的全部内容经此引用并入本文。
113.在又一实例中,细菌感染是尿路感染(uti)。
114.术语“治疗”(“treating”或“treatment”)是指改善或减轻要治疗的病症,例如细菌感染的一种或多种症状。
115.术语“预防”(“prophylaxis”、“prevent”或“prevention”)是指预防或降低细菌感染的风险。
116.术语“耐药性”(“resistance”或“resistant”)是指如临床和实验室标准协会(clinical and laboratories standards institute)(clsi)和/或食品药品管理局(food and drug administration)(fda)定义的抗生素/生物体标准。
117.术语“受试者”包括受到细菌感染的动物。受试者的实例包括动物,如家畜(例如牛、猪、马、山羊、兔子、绵羊、鸡等)、实验室动物(小鼠、大鼠、猴子、黑猩猩等)、宠物(例如犬、猫、雪貂、仓鼠等)、鸟类(例如鸡、火鸡、鸭、鹅、乌鸦(crows)、渡鸦(ravens)、麻雀等)、灵长类动物(例如猴子、大猩猩、黑猩猩、倭黑猩猩和人类)和其它动物(例如松鼠、浣熊、小鼠、大鼠等)。在一个实施方案中,受试者是小鼠或大鼠。在一个实施方案中,受试者是牛、猪或鸡。在一个实施方案中,受试者是人。
118.术语“有效量”包括治疗或预防细菌感染所需的奥马环素结晶游离碱的量。例如,有效量描述了足以通过杀死细菌和/或抑制细菌生长来实现所需治疗效果的有效水平。在一个实施方案中,有效量足以根除引起感染的细菌(bacterium或bacteria)。
119.奥马环素结晶游离碱的给药奥马环素结晶游离碱可独自或作为药物组合物的一部分给药于有此需求的受试者。包含奥马环素结晶游离碱的任何示例性药物组合物可包含有效量的奥马环素结晶游离碱和任选地药学上可接受的载体。
120.语句“药学上可接受的载体”包括能够与奥马环素结晶游离碱共同给药并且可以能使两者都发挥它们的预期功能,例如治疗或预防细菌感染的物质。合适的药学上可接受的载体包括但不限于水、盐溶液、醇、植物油、聚乙二醇、明胶、乳糖、直链淀粉、硬脂酸镁、滑石、硅酸、粘性石蜡、香精油、脂肪酸单甘油酯和脂肪酸二甘油酯、石油醚脂肪酸酯、羟甲基
纤维素、聚乙烯吡咯烷酮等。药物组合物可以灭菌并且如果需要,与不会有害地与奥马环素结晶游离碱反应的助剂,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂、调味料和/或芳香物质等混合。
121.可用于本发明的方法的药物组合物可适于通过口服、非肠道或外用途径给药。在一些实例中,可用于本发明的方法的药物组合物也适于通过气溶胶递送。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对奥马环素结晶游离碱的个体响应以及所选的药物组合物的类型和进行这种给药的时间周期和间隔,可能发生变化。
122.对于口服给药,奥马环素结晶游离碱可以以片剂或胶囊的形式给药。片剂或胶囊可包含各种赋形剂,例如选自微晶纤维素、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸的赋形剂。片剂或胶囊还可包含崩解剂,例如淀粉(优选玉米淀粉、马铃薯淀粉或木薯淀粉)、藻酸和某些复合硅酸盐。片剂或胶囊还可包含造粒粘合剂,例如蔗糖、明胶或阿拉伯树胶。另外,为了压片目的,也可将润滑剂,如硬脂酸镁、十二烷基硫酸钠和滑石添加到片剂或胶囊中。
123.对于非肠道给药(包括腹膜内、皮下、静脉内、皮内或肌内注射),本发明还提供包含奥马环素结晶游离碱的可注射制剂。这样的可注射制剂可以是干燥(例如冻干)粉末的形式,其在给药之前用载体,例如水性载体,如水重组。在一些实施方案中,可注射制剂还可包含至少一种或多种附加成分,如冻干保护剂、抗氧化剂和ph调节化合物。
124.可适用于本发明的方法的包含奥马环素结晶游离碱的某些药物组合物描述在例如美国专利号 9,315,475中,其全部内容经此引用并入本文。
125.在本发明的方法中,奥马环素结晶游离碱也可通过气溶胶给药于受试者。包含奥马环素结晶游离碱的气溶胶药物组合物可以是溶液、悬浮液、粉末制剂或脂质体制剂的形式。包含奥马环素结晶游离碱的气溶胶药物组合物可包含在气溶胶分配器中,其在一些实例中也可包含定量喷雾装置。在一些实例中,气溶胶分配器可以是雾化器,例如小容量雾化器(svn)、加压定量吸入器(pmdi)或干粉吸入器(dpi)。
126.对于外用给药,奥马环素结晶游离碱也可作为适于外用给药的药物组合物的一部分给药于受试者。这样的组合物可以是凝胶、软膏、洗剂或乳膏的形式,并可包含适当地混合在药理学惰性的外用载体中的四环素化合物。药理学惰性的外用载体可包括水、甘油、醇、丙二醇、脂肪醇、甘油三酯、脂肪酸酯或矿物油。其它可行的外用载体可以是液体矿脂、棕榈酸异丙酯、聚乙二醇、乙醇、聚氧乙烯单月桂酸酯、十二烷基硫酸钠等。此外,如果需要,还可加入材料如抗氧化剂、保湿剂、粘度稳定剂等。
127.奥马环素结晶游离碱可以以约100至约200 mg、约100至约300 mg、约100至400 mg、约100至约500 mg、约100至约600 mg、约200至约500 mg、或约300至约600 mg奥马环素结晶游离碱的剂量,例如日剂量给药于受试者。在进一步实例中,奥马环素结晶游离碱可口服给药。在进一步实例中,奥马环素结晶游离碱可静脉内给药。
128.在一些方面,奥马环素结晶游离碱可以以约50至约150 mg、约50至约400 mg、约50至约300 mg、约50至约200 mg、约100至约300 mg或约200至约300 mg、或约100 mg的剂量给药于受试者。例如,奥马环素结晶游离碱可以以约100 mg、约150 mg、约200 mg、约250 mg或约300 mg的剂量,例如日剂量给药于受试者。在一个实施方案中,该剂量是静脉内剂量。
129.在一些方面,奥马环素结晶游离碱可以以约50至约800 mg、约100至约700 mg、约
250至约600 mg、约300至约500 mg、约100至约400 mg、约100至约600 mg、或约300 mg的剂量给药于受试者。例如,奥马环素结晶游离碱可以以约300 mg、约450 mg或约600 mg的剂量给药。在一个实施方案中,该剂量是口服剂量。
130.在一个实施方案中,奥马环素结晶游离碱可以以约100 mg、约200 mg或约300 mg的剂量静脉内给药。在另一实施方案中,奥马环素结晶游离碱可以以约300 mg、约600 mg或约900 mg的剂量口服给药。
131.在一些实例中,奥马环素结晶游离碱可作为气溶胶剂量给药,例如使用气溶胶分配器递送。在一些实例中,气溶胶分配器可包含约1至约2000 mg,例如约1至约500 mg、约25至约300 mg、约50至约400 mg、约100至约500 mg、约200至约800 mg、约500 mg至约1000 mg、约10 mg至约200 mg或约300 mg至约700 mg的奥马环素结晶游离碱剂量。在一些实例中,气溶胶分配器可包含约1 mg、约5 mg、约10 mg、约30 mg、约50 mg、约80 mg、约100 mg、约150 mg、约200 mg、约250 mg、约300 mg、约350 mg、约400 mg、约450 mg、约500 mg、约550 mg、约600 mg、约650 mg、约700 mg、约750 mg、约800 mg、约850 mg、约900 mg、约950 mg或约1000 mg的奥马环素结晶游离碱剂量。
132.在一些实例中,奥马环素结晶游离碱可外用给药,例如通过向患处施加包含奥马环素结晶游离碱的适于外用给药的药物组合物。例如,适于外用给药的药物组合物可以是溶液形式并包含浓度为基于组合物的体积计的约0.01%至约20% w/v,例如约0.01%至约10% w/v、约0.1%至约20% w/v、约0.5%至约5% w/v、约1%至约10% w/v或约5%至约20% w/v的奥马环素结晶游离碱。例如,适于外用给药的药物组合物可包含浓度为约0.01% w/v、约0.05% w/v、约0.1% w/v、约0.5% w/v、约1% w/v、约5% w/v、约10% w/v、约15% w/v或约20% w/v的奥马环素结晶游离碱。
133.在另一实例中,适于外用给药的药物组合物可包含浓度为基于组合物的体积计的约0.01%至约20% w/w,例如约0.01%至约10% w/w、约0.1%至约20% w/w、约0.5%至约5% w/w、约1%至约10% w/w或约5%至约20% w/w的奥马环素结晶游离碱。例如,适于外用给药的药物组合物可包含浓度为约0.01% w/w、约0.05% w/w、约0.1% w/w、约0.5% w/w、约1% w/w、约5% w/w、约10% w/w、约15% w/w或约20% w/w的奥马环素结晶游离碱。
134.在一些实例中,奥马环素结晶游离碱可以以如上所述的剂量每日至少一次,例如每日一次、每日两次、每日三次或每日四次给药。在进一步实例中,奥马环素结晶游离碱可以每日两次给药于受试者。在一个具体实例中,奥马环素结晶游离碱可以每日两次口服给药于受试者。
135.应该理解的是,包含上列剂量的剂量范围的给药也包括在本发明中。例如,任何上述剂量可以是本发明的方法中包括的剂量范围的下部或上部。甚至进一步,应该理解的是,本技术通篇使用的所有数值列表或集合也旨在包括数值范围,其中任何列举的数值可以是范围的下部或上部。这些范围旨在包括在本发明中。
136.在一个实施方案中,奥马环素结晶游离碱的口服剂量可为奥马环素结晶游离碱的静脉内剂量的3倍。
137.要理解的是,对于所有列举的实施方案,奥马环素结晶游离碱的剂量也是奥马环素结晶游离碱的有效量。
138.在一个实施方案中,当口服给药时,奥马环素结晶游离碱的有效量可以为约100至
约1000 mg奥马环素结晶游离碱,例如约200至约750 mg、约100至约500 mg、约200至约600或约400至约600。在进一步实例中,当口服给药时,奥马环素结晶游离碱的有效量可以为约300 mg、约450 mg或约600 mg该四环素化合物。
139.在另一实施方案中,当静脉内给药时,奥马环素结晶游离碱的有效量可以为约50至约500 mg奥马环素,例如约50至约400 mg、约100至约300 mg或约50至约200 mg。例如,当静脉内给药时,奥马环素结晶游离碱的有效量可以为约100 mg、约150 mg、约200 mg、约250 mg或约300 mg。
140.在一些实例中,奥马环素结晶游离碱在本发明的上下文中可通过口服、非肠道、全身、外用途径或通过气溶胶递送进行给药。一般而言,奥马环素结晶游离碱最合意地以有效剂量给药,这取决于所治疗的受试者的体重和状况以及所选的特定给药途径。根据所治疗的受试者的物种及其对药物的个体响应以及所选的药物制剂的类型和进行这种给药的时间周期和间隔,可能发生变化。
141.在一些实施方案中,奥马环素结晶游离碱可给药至少3天、至少7天、至少14天、至少21天、至少30天、至少60天、至少5周、至少10周、至少15周、至少20周、至少30周、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少13个月、至少14个月、至少15个月、至少16个月、至少17个月、至少18个月、至少19个月、至少20个月、至少21个月、至少22个月、至少23个月或至少24个月。例如,奥马环素结晶游离碱的给药可持续3天至7天、3天至14天、3天至21天、3天至30天、3天至60天、7天至14天、7天至21天、7天至30天、7天至60天、14天至21天、14天至30天、14天至60天、21天至30天、21天至60天、30天至60天、1周至5周、3周至10周、5周至20周、10周至30周、20周至35周、1周至1个月、2周至2个月、1个月至3个月、1个月至6个月、1个月至9个月、3个月至12个月、6个月至12个月、9个月至12个月、9个月至16个月、12个月至18个月、14个月至24个月、12个月至24个月、或24个月或更久。
142.例如,奥马环素结晶游离碱可给药3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41天、42天、43天、44天、45天、46天、47天、48天、49天、50天、51天、52天、53天、54天、55天、56天、57天、58天、59天、60天、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、17周、18周、19周、20周、21周、22周、23周、24周、25周、26周、27周、28周、29周、30周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、14个月、15个月、16个月、17个月、18个月、19个月、20个月、21个月、22个月、23个月或24个月。在其它实例中,奥马环素结晶游离碱可给药多于24个月,例如25个月、26个月、27个月、28个月、29个月、30个月、31个月、32个月、33个月、34个月、35个月、36个月、37个月、38个月、39个月、40个月、41个月、42个月、43个月、44个月、45个月、46个月、47个月、48个月或多于48个月。
143.在一些实施方案中,向受试者给药奥马环素结晶游离碱可包括给药一个或多个负荷剂量的奥马环素结晶游离碱,接着给药一个或多个维持剂量的奥马环素结晶游离碱。在一些实施方案中,所述一个或多个负荷剂量的奥马环素结晶游离碱可大于所述一个或多个维持剂量的奥马环素结晶游离碱。例如,负荷剂量可以为约450 mg日剂量,例如每日口服剂
量,而维持剂量可以为约300 mg日剂量,例如每日口服剂量。在另一实例中,负荷剂量可以为约200 mg日剂量,例如每日静脉内剂量,而维持剂量可以为约100 mg日剂量,例如每日静脉内剂量,或300 mg日剂量,例如每日口服剂量。
144.负荷剂量的奥马环素结晶游离碱和维持剂量的奥马环素结晶游离碱可通过相同途径或不同途径给药。例如,(一个或多个)负荷剂量可以静脉内给药,且维持剂量可以口服给药。在其它实施方案中,(一个或多个)负荷剂量和维持剂量都可口服给药,或(一个或多个)负荷剂量和维持剂量都可静脉内给药。
145.在一些实例中,负荷剂量的奥马环素结晶游离碱可以是每日两次给药的口服剂量或静脉内剂量,且维持剂量可以是每日一次给药的口服剂量或静脉内剂量。例如,奥马环素结晶游离碱可作为每日两次100 mg的静脉内负荷剂量,接着是每日一次100 mg的静脉内维持剂量来进行给药。在另一实例中,奥马环素结晶游离碱可作为每日两次100 mg的静脉内负荷剂量,接着是每日一次300 mg的口服维持剂量来进行给药。在又一实例中,奥马环素结晶游离碱可作为每日两次300 mg的口服负荷剂量,接着是每日一次300 mg的口服维持剂量来进行给药。
146.在另一实例中,奥马环素结晶游离碱的给药可不包含一个或多个负荷剂量的奥马环素结晶游离碱的给药。因此,在一些实例中,奥马环素结晶游离碱可在整个治疗周期以相同剂量给药于受试者。例如,奥马环素结晶游离碱可以以约100 mg、约200 mg或约300 mg的静脉内剂量给药于受试者。该静脉内剂量可在整个治疗中每日一次或两次给药于受试者。在另一实例中,奥马环素结晶游离碱可以以约300 mg、约450 mg或约600 mg的口服剂量给药于受试者。该口服剂量可在整个治疗周期每日一次给药于受试者。
147.在一些实例中,奥马环素结晶游离碱可单独或与至少一种附加治疗剂组合来给药于受试者。语句“与治疗剂组合”意在包括奥马环素结晶游离碱和治疗剂的同时给药;首先给药奥马环素结晶游离碱,接着是治疗剂;以及首先给药治疗剂,接着是奥马环素结晶游离碱。在一个实例中,该治疗剂是抗生素。
148.术语“约”是指可以比指定值大或小15%、10%、8%、5%、3%、2%、1%或0.5%的数值范围。例如,“约10%”可以是8.5%至11.5%。在一个实施方案中,术语“约”是指比指定值大或小5%的数值范围。在另一实施方案中,术语“约”是指比指定值大或小2%的数值范围。在另一实施方案中,术语“约”是指比指定值大或小1%的数值范围。
149.要理解的是,无论在本文中提供了数值还是范围,例如关于受试者群体的年龄、剂量和持续时间等,这些数值和范围涵盖的所有数值和范围都意图包含在本发明的范围内。此外,这些数值和范围内的所有数值也可以是范围的上限或下限。
150.纯化奥马环素游离碱的方法本发明还提供纯化奥马环素游离碱,例如粗制奥马环素游离碱的方法。纯化奥马环素游离碱的方法在一些实例中涉及对包含粗制奥马环素游离碱的溶液通过高效液相色谱法(hplc),例如制备hplc进行纯化的步骤,由此获得包含经hplc纯化的奥马环素游离碱的溶液。在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在hplc纯化之后,使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液,由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在纳滤步骤之后,从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱,由此产生
奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物。
151.与(如例如美国专利号 9,434,680中所述的)先前的纯化奥马环素的方法相比,本发明提供的纯化奥马环素游离碱,例如粗制奥马环素游离碱的方法能够实现奥马环素纯化的更高吞吐量和生产率。具体地,在一些实施方案中,本发明提供的纯化奥马环素的方法产生与先前方法相比包含更低量的杂质,例如如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的纯化奥马环素游离碱。在一些实施方案中,本发明提供的纯化奥马环素的方法的特征在于加工时间明显短于先前的奥马环素纯化方法。本文所用的术语“加工时间”是指由粗制奥马环素游离碱开始生产1千克奥马环素结晶游离碱所需的时间量。在一些实例中,术语“加工时间”是根据如图6中所示的程序,即包括hplc步骤、纳滤步骤和结晶步骤的程序生产1千克奥马环素结晶游离碱所需的时间。在一些实例中,术语“加工时间”不包括在结晶之后干燥奥马环素结晶游离碱所需的时间。
152.例如,与先前方法相比,本方法能使加工时间减少为先前方法所需的加工时间的最多1/2倍,例如最多约1/3倍、最多约1/4倍、最多约1/5倍、最多约1/6倍、最多约1/7倍、最多约1/8倍、最多约1/9倍、最多约1/10倍、最多约1/11倍或最多约1/12倍。在一个具体实施方案中,本方法能使加工时间减少为最多约1/12倍,即从先前方法实现的约73.9小时减少到约6.1小时。
153.高效液相色谱法在一些实例中,纯化奥马环素游离碱的方法包括对包含粗制奥马环素游离碱的溶液通过高效液相色谱法(hplc),例如制备hplc进行纯化的步骤,由此获得包含经hplc纯化的奥马环素游离碱的溶液。通过hplc纯化粗制奥马环素游离碱能够除去杂质,例如如上所述的化合物(3)、(4)和(5),以及合成副产物。包含粗制奥马环素游离碱的溶液可通过本领域中已知用于制备粗制奥马环素游离碱的任何方法获得,例如通过上述方案1中所示的程序或通过例如美国专利号 9,434,680、美国专利号 9,522,872或美国专利号 8,383,610(它们各自的全部内容经此引用并入本文)中描述的方法。
154.在一些实施方案中,hplc纯化包括使用固定相,例如反相(rp)。在本发明的上下文中可使用的固定相可以是提供粗制奥马环素游离碱的充分纯化的任何固定相。在一些实例中,rp固定相可以是c18固定相。在一些实例中,rp固定相可具有约50
ꢀå
至约200
ꢀå
,例如约50
ꢀå
至约90
ꢀå
、约80
ꢀå
至约150
ꢀå
、约120
ꢀå
至约200
ꢀå
、或约100
ꢀå
的孔径。在一些实例中,rp固定相可具有约0.5
ꢀµ
m至约20
ꢀµ
m,例如约0.5
ꢀµ
m至约5
ꢀµ
m、约2
ꢀµ
m至约15
ꢀµ
m、约5
ꢀµ
m至约20
ꢀµ
m、或约10
ꢀµ
m的粒度。在一个实例中,rp固定相可以是具有约100
ꢀå
的孔径和约10
ꢀµ
m的粒度的c18相。在一个实施方案中,rp固定相可以是来自phenomenex的luna
®ꢀ
10
ꢀµ
m prep c18(2) 100
ꢀå
, lc column 250 x 21.2 mm, axia
™ꢀ
packed, ea。在另一实施方案中,rp固定相可以是synergi polar rp10 10
ꢀµꢀ
80
ꢀå
。
155.在一些实施方案中,hplc纯化包括使用流动相,例如洗脱缓冲液,如洗脱缓冲液a和洗脱缓冲液b。洗脱缓冲液a可包含水和有机溶剂,如甲醇、乙醇、二氯甲烷或乙腈的混合物。在一个具体实施方案中,缓冲液a包含水和乙腈。洗脱缓冲液a在一些实例中还可包含无机盐,如磷酸盐(例如磷酸钾、磷酸氢二钾、磷酸钠、磷酸氢二钠或磷酸铵)、乙酸盐(例如乙酸铵、乙酸钾或乙酸钠)或甲酸盐(例如甲酸钠或甲酸钾)。洗脱缓冲液b可包含有机溶剂,如甲醇、乙醇、二氯甲烷或乙腈。在一个具体实施方案中,洗脱缓冲液b包含乙腈。
156.在一些实施方案中,洗脱缓冲液a和/或洗脱缓冲液b还可包含选自非甲基磺酸的强酸(例如盐酸)、弱酸和有机胺的改性剂。在其它实施方案中,在hplc纯化之前,可将选自弱酸和有机胺的改性剂添加到包含粗制奥马环素游离碱的溶液中。
157.本文所用的术语“改性剂”是指在被添加到洗脱缓冲液a、和/或洗脱缓冲液b、和/或包含粗制奥马环素游离碱的溶液中时促进通过hplc对粗制奥马环素游离碱的纯化的化学试剂。
158.本文所用的术语“弱酸”是指当溶解在溶液,例如水溶液中时不完全解离的酸。在一些实施方案中,弱酸是具有约3.0至约6.0的pka的酸。
159.在一些实施方案中,改性剂可以是弱酸。可用作本发明上下文中的改性剂的弱酸的非限制性实例可包括草酸、甲磺酸、三氟乙酸、亚硫酸、磷酸、亚硝酸、氢氟酸、苯甲酸、乙酸和甲酸。例如,该弱酸可选自草酸、甲磺酸、三氟乙酸、苯甲酸、乙酸和甲酸。在一个具体实例中,该弱酸可以是乙酸。
160.在其它实施方案中,改性剂可以是有机胺。可用作本发明上下文中的改性剂的有机胺的非限制性实例包括3-乙醇胺、二乙胺和三甲胺。
161.在一个具体实施方案中,改性剂是弱酸,例如乙酸。在一个进一步实例中,将弱酸,例如乙酸添加到洗脱缓冲液a中。在另一个进一步实例中,将弱酸,例如乙酸添加到洗脱缓冲液b中。在又一个进一步实例中,在hplc纯化之前,将弱酸,例如乙酸添加到包含粗制奥马环素游离碱的溶液中。
162.不希望受制于具体理论,但相信,某些改性剂,如弱酸,例如乙酸,在hplc纯化之前被添加到洗脱缓冲液a和/或洗脱缓冲液b和/或包含粗制奥马环素游离碱的溶液中时,与先前用于奥马环素的基于hplc的纯化方法相比能够通过hplc更快速和更高效地纯化奥马环素游离碱。例如如美国专利号 8,946,196(其全部内容经此引用并入本文)中所述的先前的奥马环素纯化方法利用强酸,即甲磺酸作为流动相的改性剂。不希望受制于具体理论,但相信,将弱酸,例如乙酸在hplc纯化之前添加到洗脱缓冲液a和/或洗脱缓冲液b和/或包含粗制奥马环素游离碱的溶液中产生界限分明的与奥马环素游离碱对应的hplc峰,例如具有锋利边界的hplc峰。这进而使得能够收集包含奥马环素游离碱的单个hplc级分或几个hplc级分,而非如先前的纯化方法所需的许多hplc级分。这进而能够将更多材料,即粗制奥马环素游离碱加载到hplc柱上并能在比先前的纯化方法短得多的时间内收集hplc级分,同时对于hplc也使用明显更少量的溶剂。此外,这还能够与先前的纯化方法相比实现产物,即奥马环素游离碱的更好纯化效果和/或回收率。这使得本发明的hplc纯化方法特别好地适用于纯化大量奥马环素游离碱。
163.奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物的纯度的一种量度由如上所示的由式(5)表示的4-差向异构体(β-差向异构体)的含量限定。在一些实例中,通过hplc,例如制备hplc纯化粗制奥马环素游离碱致使除去显著量的β-差向异构体。例如,如通过在hplc迹线的曲线下的面积%测得,包含经hplc纯化的奥马环素游离碱的溶液中存在的β-差向异构体的量比包含粗制奥马环素游离碱的溶液中存在的β-差向异构体的量低至少50%,例如至少100%、至少150%、至少200%、至少250%、至少300%、至少350%、至少400%、至少450%、至少500%、至少600%、至少650%、至少700%、至少750%、至少800%、至少850%、至少900%、至少950%或至少1000%。例如,在本文描述的实施例1,表2中,β-差向异构体
的%含量从粗制奥马环素游离碱的溶液中存在的约11.13% β-差向异构体减少到经hplc纯化的奥马环素游离碱的溶液中存在的约1.71% β-差向异构体。
164.纳滤在一些实施方案中,含有经hplc纯化的奥马环素游离碱的hplc级分可以使用纳滤浓缩,以产生经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实施方案中,在纳滤之后,经hplc纯化的奥马环素游离碱的浓缩溶液可以用溶剂,例如二氯甲烷(dcm)萃取。在其它实施方案中,经hplc纯化的奥马环素游离碱的浓缩溶液没有用溶剂,例如dcm萃取,并直接用于如下所述的结晶奥马环素游离碱。
165.相较之下,例如如美国专利号 8,946,196中所述的先前的奥马环素纯化方法没有使用纳滤并且仅使用溶剂,例如dcm萃取。根据本发明的方法通过纳滤浓缩含有经hplc纯化的奥马环素游离碱的hplc级分能够显著减少在纳滤步骤之后进行的萃取所需的溶剂量。例如,如本文中的实施例3中所述,通过在用dcm萃取之前使用纳滤,需要892毫升dcm以产生包含71.04克经hplc纯化的奥马环素游离碱的浓缩溶液。相比之下,在没有纳滤的情况下,需要约43.97升dcm或约49倍多的dcm以产生包含相同量的经hplc纯化的奥马环素游离碱的浓缩溶液。因此,在包含用dcm萃取经hplc纯化的奥马环素游离碱的本发明的示例性实施方案中,纳滤能使萃取所需的溶剂,例如dcm的量减少为最多约1/5倍、最多约1/10倍、最多约1/15倍、最多约1/20倍、最多约1/25倍、最多约1/30倍、最多约1/35倍、最多约1/40倍、最多约1/45倍或最多约1/50倍。在一些实施方案中,纳滤能使经hplc纯化的奥马环素游离碱的萃取所需的溶剂,例如dcm的量减少为约1/5至约1/10倍、约1/10-至约1/20倍、约1/15至约1/30倍、约1/20至约1/40倍、或约1/25至约1/50倍。
166.在一些实例中,在没有随后用溶剂,例如dcm萃取的情况下进行纳滤以浓缩含有经hplc纯化的奥马环素游离碱的hplc级分。在这些实例中,在纳滤之后获得的包含经hplc纯化的奥马环素游离碱的浓缩溶液可直接用于如下所述的结晶奥马环素游离碱。因此,在这些实例中,纳滤的使用消除对溶剂的需要。
167.减少用于浓缩经hplc纯化的奥马环素游离碱的溶剂,例如dcm的体积或消除溶剂,例如dcm的使用降低了纯化程序的成本,并且也消除处置大量氯化废物的需要。消除用于浓缩经hplc纯化的奥马环素游离碱的溶剂,例如dcm的使用也消除了对蒸发步骤以从包含经hplc纯化的奥马环素游离碱的溶液中除去dcm的需要。蒸发步骤可导致奥马环素游离碱的降解,并且消除蒸发步骤使得奥马环素结晶游离碱的回收率提高。
168.纳滤包括通过膜过滤包含经hplc纯化的奥马环素游离碱的溶液。在纳滤过程中,正在过滤的溶液的一部分通过该膜,以形成滤液,而保留在膜上的溶液是渗余物。在本发明的方法中,大部分奥马环素游离碱保留在渗余物中,以形成包含经hplc纯化的奥马环素游离碱的浓缩溶液。因此,在本发明的一些实施方案中,纳滤步骤可进一步包括收集渗余物。
169.适用于根据本发明的方法的纳滤步骤的膜可包括能在允许溶剂通过该膜的同时保留奥马环素游离碱的任何膜。在一些实例中,纳滤膜可具有约150至约500道尔顿,例如约150至约300道尔顿、约200至约400道尔顿或约300至约500道尔顿的截留分子量(mwco)。
170.在一些实施方案中,本发明的方法可进一步包括在纳滤之前将抗氧化剂添加到包含经hplc纯化的奥马环素游离碱的溶液中。例如,可以以足以在包含经hplc纯化的奥马环素游离碱的溶液中实现约0.01%至约0.5% w/v抗氧化剂的抗氧化剂浓度的量来加入抗氧化
剂。
171.可添加到包含经hplc纯化的奥马环素游离碱的溶液中的抗氧化剂可选自抗坏血酸(维生素c)、谷胱甘肽、硫辛酸、胡萝卜素、α-生育酚(维生素e)、泛醇(辅酶q)、去铁胺和亚硫酸氢盐,例如亚硫酸氢钠。
172.纳滤过程得到渗余物,其是包含经hplc纯化的奥马环素游离碱的浓缩溶液。在一些实例中,渗余物中的奥马环素浓度为包含经hplc纯化的奥马环素游离碱的溶液,即由于hplc纯化而收集的级分中的奥马环素浓度的至少约2倍,例如至少约4倍、至少约5倍、至少约8倍、至少约10倍、至少约20倍或至少约50倍。
173.结晶在一些实施方案中,纯化奥马环素游离碱的方法还可包括,在纳滤和用溶剂萃取之后,或在纳滤而没有用溶剂萃取之后,结晶奥马环素游离碱,由此产生奥马环素结晶游离碱。可以根据如上所述的方法进行奥马环素游离碱的结晶以产生例如如上所述的奥马环素结晶游离碱的多晶型物。
174.其中在纳滤而没有用溶剂,例如dcm萃取之后从浓缩溶液中结晶奥马环素游离碱的实施方案中,可用于结晶的溶剂可选自:丙酮和水的混合物;乙腈和水的混合物;以及异丙醇和水的混合物。在一个实例中,可用于结晶的溶剂可以是丙酮和水的混合物。
175.其中在纳滤和用溶剂,例如dcm萃取后从浓缩溶液中沉淀奥马环素游离碱的实施方案中,庚烷和甲基叔丁基醚(mtbe)可用于从dcm浓缩物中沉淀无定形游离碱。
176.在一些方面,由结晶产生的奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物为通过% w/w测得的至少90%纯,例如至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯。本文所用的术语“纯”或“纯度”是指通过% w/w测得的约90-100%纯,例如约95-100%纯、98-100%纯、或约99-100%纯的化合物。在一些实施方案中,纯的奥马环素游离碱包含小于约10%、小于约5%、小于约2%或小于约1%的杂质。杂质可包括,例如降解产物、氧化产物、差向异构体、溶剂和/或其它不合意杂质中的一种或多种。
177.从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱致使奥马环素游离碱的进一步纯化——如例如通过β-差向异构体含量测得。例如,奥马环素结晶游离碱中的β-差向异构体含量与包含经hplc纯化的奥马环素游离碱的浓缩溶液中的β-差向异构体含量相比可减少至少约50%,例如至少约60%、至少约70%、至少约80%或至少约90%。β-差向异构体的%含量作为相对于在hplc迹线的曲线下总面积计的与β-差向异构体对应的%总峰面积来测量。
178.在一些实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为10%或更低,例如5%或更低、2%或更低、1%或更低、0.9%或更低、0.5%或更低、0.1%或更低、0.05%或更低或0.01%或更低。在一个具体实例中,奥马环素结晶游离碱,例如如上所述的奥马环素结晶游离碱的多晶型物中的β-差向异构体的含量为0.9%或更低。β-差向异构体的%含量作为相对于在hplc迹线的曲线下总面积计的与β-差向异构体对应的%总峰面积来测量。
179.本发明提供的纯化奥马环素游离碱的方法提供了优于(如例如美国专利号 9,434,680中所述的)先前的纯化奥马环素的方法的优点。与先前的方法相比,本发明提供的
纯化奥马环素游离碱的方法能够实现奥马环素纯化的更高吞吐量和生产率。
180.下表1提供了先前的奥马环素纯化方法和本发明的方法的比较。具体地,表1比较先前的方法和本方法的加载在hplc柱上的材料量、计算出的%回收率和总加工时间。
181.表1. 使用本方法和先前的方法的hplc纯化的结果
方法加载到hplc柱上的粗制奥马环素材料的量(g/kg树脂)计算出的回收率(%)加工时间(对该分析校正后的纯的h/kg)本方法122(对该分析校正后为78)66.656.1先前方法7.2(对该分析校正后为4.1)59.4173.9
182.括号中显示的加载到hplc柱上的粗制奥马环素材料的量是对该分析校正后的量,即对加载材料中存在的奥马环素的实际量校正后的量。该数值反映了加载到hplc柱上的粗制奥马环素材料中存在的奥马环素的实际量。可以通过将已知量的粗制奥马环素材料产生的hplc信号与使用已知高纯度的奥马环素标准品生成的校准曲线进行比较来测定对该分析校正后的粗制奥马环素材料的量。
183.可以通过将纯化之后获得的结晶奥马环素游离碱的量(对该分析校正后的量)除以加载到hplc柱上的粗制奥马环素的量(对该分析校正后的量)并乘以100%来测定计算出的%回收率。
184.表1证实奥马环素游离碱的本纯化方法能将显著更大量的粗制奥马环素加载到hplc柱上,由此显著减少hplc纯化所需的树脂量。奥马环素游离碱的本纯化方法还得到更高的计算出的回收率并将生产1千克纯奥马环素游离碱所需的加工时间从约73.9小时显著减少到约6.1小时。在与先前的奥马环素纯化方法相比提供上述益处的同时,本发明的奥马环素游离碱纯化方法还提供至少与使用先前方法获得的奥马环素一样纯的奥马环素游离碱。在一些实施方案中,本发明的奥马环素游离碱纯化方法提供通过% w/w测得的至少90%纯,例如至少95%纯、至少96%纯、至少97%纯、至少98%纯、至少99%纯、至少99.1%纯、至少99.5%纯或至少99%纯的奥马环素游离碱。
185.这些特征使得本发明的hplc纯化方法特别好地适用于纯化大量奥马环素游离碱。
186.合成奥马环素的甲苯磺酸盐的方法本发明还提供由奥马环素结晶游离碱制备奥马环素的甲苯磺酸盐的方法。例如,根据本发明的方法,奥马环素的甲苯磺酸盐可以通过使奥马环素结晶游离碱在甲苯磺酰化反应中反应来制备,由此获得奥马环素的甲苯磺酸盐。在一些实例中,奥马环素的甲苯磺酸盐是奥马环素的结晶甲苯磺酸盐,例如如美国专利号 8,383,610(其全部内容经此引用并入本文)中所述的奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。
187.由奥马环素游离碱合成奥马环素的甲苯磺酸盐,例如结晶甲苯磺酸盐,如1型多晶型物、2型多晶型物或3型多晶型物的方法是本领域中已知的并描述在例如美国专利号 8,383,610中,其全部内容经此引用并入本文。
188.在一些实例中,由包含粗制奥马环素游离碱的溶液制备奥马环素的甲苯磺酸盐的方法包括对包含粗制奥马环素游离碱的溶液通过hplc进行纯化,由此获得包含经hplc纯化的奥马环素游离碱的溶液;使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液,由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液;和
从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱,由此产生奥马环素结晶游离碱;和使奥马环素结晶游离碱在甲苯磺酰化反应中反应,由此获得奥马环素的甲苯磺酸盐。
189.图示如上所述的制备奥马环素的甲苯磺酸盐的程序的方案显示在图7中。
190.对包含粗制奥马环素游离碱的溶液通过hplc进行纯化由此获得包含经hplc纯化的奥马环素游离碱的溶液的步骤可如本文在前述部分中所述的来进行。
191.使用纳滤浓缩包含经hplc纯化的奥马环素游离碱的溶液由此获得包含经hplc纯化的奥马环素游离碱的浓缩溶液的步骤可如本文在前述部分中所述的来进行。
192.从包含经hplc纯化的奥马环素游离碱的浓缩溶液中结晶奥马环素游离碱由此产生奥马环素结晶游离碱的步骤可如本文在前述部分中所述的来进行。
193.本发明还提供通过如上所述的方法获得的奥马环素的甲苯磺酸盐。在一些实例中,奥马环素的甲苯磺酸盐是奥马环素的结晶甲苯磺酸盐,例如如美国专利号 8,383,610中所述的奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。
194.在一些实施方案中,本发明还提供一种药物组合物,其包含奥马环素的甲苯磺酸盐,其中奥马环素的甲苯磺酸盐通过如上所述的方法获得。奥马环素的甲苯磺酸盐可以是奥马环素的结晶甲苯磺酸盐,例如奥马环素的结晶甲苯磺酸盐的1型多晶型物、2型多晶型物或3型多晶型物。包含奥马环素的甲苯磺酸盐的示例性药物组合物描述在例如美国专利号 9,314,475中,其全部内容经此引用并入本文。
195.本发明还提供在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者已根据本发明的方法制备的奥马环素的甲苯磺酸盐。本文中还提供了在有此需求的受试者中治疗或预防细菌感染的方法,其包括给药于受试者包含已使用本发明的方法制备的奥马环素的甲苯磺酸盐的药物组合物。
196.在一些实例中,细菌感染可由革兰氏阳性或革兰氏阴性细菌引起。在一些实例中,细菌感染可由对其它四环素化合物具有耐药性的细菌引起。在一些实例中,细菌感染可由选自肺炎克雷伯菌、沙门氏菌、希拉肠球菌、鲍曼不动杆菌、卡他布兰汉菌、流感嗜血杆菌、铜绿假单胞菌、屎肠球菌、大肠杆菌、金黄色葡萄球菌和粪肠球菌的种属的细菌引起。
197.在一个实例中,细菌感染是急性细菌性皮肤结构感染(absssi)。在一些实施方案中,absssi可由革兰氏阳性或革兰氏阴性细菌,例如选自金黄色葡萄球菌(对甲氧西林具有敏感性和耐药性的分离株)(包括并发菌血症的病例)、路邓葡萄球菌、酿脓链球菌、无乳链球菌、咽峡炎链球菌群(包括咽峡炎链球菌、中间链球菌和星座链球菌)、缓症链球菌、粪肠球菌(对万古霉素具有敏感性的分离株)、阴沟肠杆菌、肺炎克雷伯菌、产黑素普雷沃菌和大芬戈尔德菌的种属的细菌引起。
198.在另一实例中,细菌感染可以是社区获得性细菌性肺炎(cabp)。在一些实施方案中,cabp可由革兰氏阳性、革兰氏阴性或非典型细菌,例如选自选自肺炎链球菌(对青霉素具有敏感性且耐药性的分离株、对大环内酯具有耐药性的分离株)(包括并发菌血症的病例)、金黄色葡萄球菌(对甲氧西林具有敏感性的分离株)、流感嗜血杆菌(β-内酰胺酶阴性和阳性分离株)、副流感嗜血杆菌、肺炎克雷伯菌、嗜肺军团菌、肺炎支原体和肺炎嗜衣原体的种属的细菌引起。
199.在另一实例中,细菌感染是艰难梭菌感染。
200.在又一实例中,细菌感染可以是尿路感染(uti)。
201.本发明的实施例实施例1. 从丙酮中结晶奥马环素游离碱这一实施例例示从丙酮中结晶奥马环素的游离碱并表征该结晶产物的典型程序。从纳滤之后获得的渗余物中结晶奥马环素的游离碱。浓度为80-100 mg/ml的渗余物用相同体积的丙酮稀释,种晶并搅拌,以使奥马环素游离碱结晶。过滤出产物并干燥。
202.奥马环素的结晶游离碱通过xrpd分析表征,且所得xrpd谱显示在图1中。图1中的xrpd谱中存在的明显峰(
°
2θ处)列在下表2中。
203.表2. 奥马环素的结晶游离碱的xrpd谱中的明显峰峰(
°
2θ处)强度(i/io)7.251007.377810.332812.586212.813914.753816.446317.868819.326019.444819.622722.193623.382624.3335
204.由表3中所示的数据而显而易见,结晶改进奥马环素游离碱的整体纯度,尤其是在除去β-差向异构体方面。
205.表3. 在奥马环素游离碱的纯化过程中的β-差向异构体的含量纯化阶段β-差向异构体的含量(%a/a)粗制奥马环素游离碱11.13在制备hplc之后汇集的级分1.71结晶奥马环素游离碱0.90
206.实施例2. 用于结晶奥马环素游离碱的附加溶剂的鉴别这一实验的目标是鉴别可用于结晶奥马环素游离碱的除丙酮之外的附加溶剂。
207.材料和方法所用起始材料是通过将来自不同批次的奥马环素的经纯化的游离碱溶解在稀盐酸中而制备的无定形游离碱。该碱用二氯甲烷(dcm)在中性ph下萃取,并将萃取物浓缩并干燥。所得材料是橙色粉末,具有通过hplc测得的98.22%的面积%纯度和1.44%的β-差向异构体含量。
208.对0.5克规模的奥马环素进行初步结晶尝试,且溶剂的典型体积为10毫升。对于无定形奥马环素的结晶,测试41种不同的溶剂或溶剂组合。对于溶剂的二元组合,第二种溶剂的含量在大多数情况下不超过5%。将奥马环素的溶液混合物在室温下搅拌过夜。滤出所形成的任何固体,洗涤并干燥。在每种情况下,通过hplc分析固体和滤液的样品并与起始材料进行比较。关于产物结晶度的结论基于hplc结果;结晶产物应该比起始材料更纯。
209.基于这些初步hplc结果,选择三种用于结晶的溶剂,并用于1克规模下的另一次结晶。在所有情况下都包括5%水的这三种溶剂是异丙醇、乙腈和2-丁酮(甲乙酮)。然后通过对这三种结晶的产物的xrpd分析进行结晶度的确认,并与奥马环素的对照结晶游离碱进行比较。
210.结果下表4含有起始材料与三种产物之间的hplc纯度的比较。也给出输出产率。所有用于结晶的溶剂含有5%水。
211.表4. 收率和纯度结果材料奥马环素(%)β-差向异构体(%)收率(%)起始材料98.221.44na从异丙醇中结晶的产物99.560.2192从乙腈中结晶的产物99.300.4389从2-丁酮中结晶的产物99.670.2579
212.通过对表4中所列的结晶产物的xrpd分析进行结晶度的确认。图2显示从湿乙腈中结晶的奥马环素游离碱的xrpd谱。图3显示从湿异丙醇中结晶的奥马环素游离碱的xrpd谱。图4显示从湿2-丁酮中结晶的奥马环素游离碱的xrpd谱。图5显示奥马环素的对照结晶游离碱的xrpd谱。如通过比较图1至3与图4显而易见,从湿乙腈、湿异丙醇和湿2-丁酮中结晶的产物是结晶的。
213.实施例3. 使用纳滤用于浓缩奥马环素的水溶液这一实验的目标是证实纳滤可在通过制备hplc纯化之后有效用于浓缩奥马环素游离碱的水溶液。在典型实验中,通过hplc纯化150克粗制奥马环素游离碱(纯度67.4% w/w,为分析调整后为101.1克)。对于进一步加工,选择在4070毫升93:7的水/乙腈混合物中含有80.34克奥马环素(浓度为19.74 mg/ml)的级分。这种溶液分两份(2000毫升和2070毫升)通过纳滤进行浓缩。作为输出,获得浓度为80.67 mg/ml和52.46 mg/ml的两个渗余物溶液,总共含有76.09克产物。各渗余物溶液用dcm进行萃取以提供奥马环素作为干粉;对该分析校正后为71.04克。总共892毫升dcm用于进行萃取回收。相比之下,利用dcm萃取以浓缩奥马环素水溶液的过程需要约43.97升dcm才能获得相同量的产物。如果将纳滤的第二部分浓缩到与第一部分相同的水平(即~80 mg/ml),将可以进一步减少dcm体积。
214.要指出,对获自纳滤的渗余物溶液进行dcm萃取是任选的。如以下实施例4中所述,奥马环素的游离碱可直接从渗余物溶液中结晶以产生结晶奥马环素游离碱。
215.在下一步骤中,对奥马环素游离碱进行甲苯磺酰化/结晶程序以产生量为82.85克的甲苯磺酸盐(对分析调整后为59.17克)。产物的纯度在规格范围内。
216.实施例4. 通过结晶游离碱生产奥马环素的结晶甲苯磺酸盐这一实验的目标是通过结晶游离碱生产奥马环素的结晶甲苯磺酸盐。使用在通过
制备hplc纯化粗制游离碱和纳滤后获得的渗余物(含有26.4千克粗制奥马环素)进行奥马环素的游离碱的结晶。将渗余物转移到反应器中,向其中加入相同体积的丙酮,并将溶液加热至20-25℃。使用乙酸/三甲胺(acoh/tea)将溶液的ph调节至7.8-8.0,并加入在丙酮/水混合物中的晶种。反应混合物在20-25℃下搅拌8-12小时并过滤。用丙酮-水混合物洗涤黄色固体并干燥。奥马环素的结晶游离碱的校正收率为10.62千克(41.8%)。
217.为了制备奥马环素的结晶甲苯磺酸盐,在玻璃反应器中制备对甲苯磺酸在丙酮/水中的溶液。同时,在第二反应器中,在25-30℃的温度下制备在无水丙酮中含有9.76千克奥马环素结晶游离碱的溶液。随后,在25-30℃的温度下将对甲苯磺酸溶液的体积的20%添加到第二反应器中。对反应混合物进行种晶,并经2-3小时的时间转移剩余的对甲苯磺酸溶液。所得悬浮液在10-15℃下搅拌1-3小时,过滤出,洗涤并干燥。奥马环素的结晶甲苯磺酸盐的收率为11.78千克(92.2%)。
218.等同原则本领域技术人员将认识到或能够仅使用常规实验法确定本文描述的具体实施方案和方法的许多等同物。这样的等同物旨在涵盖在本发明的范围内。本文引用的所有专利、专利申请和文献参考资料特此明确地经此引用并入。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。