1.本发明公开涉及酶生物传感器技术领域,尤其涉及交联的聚合离子液体微球材料的修饰电极的制备方法及其电化学应用。
背景技术:
2.过氧化氢(h2o2)作为氧化剂广泛应用于制药、临床、环境保护等行业。此外,因其具有氧化还原特性,h2o2作为介质广泛应用于生物及食品行业。然而,过量的h2o2对人体的中枢神经系统具有破坏性影响,可引起阿兹海默症,帕金森病等。因此,实现h2o2快速、灵敏、准确、实用的分析检测具有重要的意义。
3.目前,应用于测定h2o2可采用色谱法、化学发光法、滴定法、分光光度法荧光法、电化学方法等。其中,电化学传感器和生物传感器因其具有高灵敏度、良好的选择性、适用实时监测、成本低、操作简单等特点被广泛应用于h2o2的分析检测。酶生物传感器在具备以上优点的同时相较于非酶传感器可有效降低工作电位,进而提高电子传递动力学以及可有效避免其他电活性物质干扰等特点被广泛关注。
4.辣根过氧化物酶(hrp)作为过氧化氢酶的一员,常被应用于过氧化氢酶结构、动力学、热力学性质的研究,特别是在制备h2o2电化学酶生物传感器最具代表性的酶。然而,由于酶生物大分子构象差,氧化还原活性中心被深埋,hrp在裸电极上难以实现直接电子转移。
技术实现要素:
5.鉴于此,本发明公开提供了一种交联的聚合离子液体微球材料的修饰电极的制备方法及其电化学应用,以实现对h2o2、nano2的良好分析检测性能及催化性能。
6.本发明提供的技术方案,具体为,一种交联的聚合离子液体微球材料的修饰电极的制备方法,包括:
7.步骤1:合成交联的聚合离子液体微球;称取单体1-乙烯基-3-乙基咪唑溴盐、交联剂n,n-亚甲基双丙烯酰胺和引发剂过硫酸铵构成分散水相,其中以pbs为分散剂;以十二烷和span 80构成油相;将分散水相逐滴加入油相,得到pil的油包水乳液,继续向油包水乳液中加入temed进一步引发pil的聚合反应,聚合后形成微球结构的凝胶颗粒,离心回收,被水膨胀的凝胶颗粒经冻干后制备得到白色粉末pil-m;
8.步骤2:制备修饰电极pil-m-hrp-nafion/gce。
9.优选地,首先取0.125g单体1-乙烯基-3-乙基咪唑溴盐,0.01g交联剂n,n-亚甲基双丙烯酰胺和0.0025g引发剂过硫酸铵构成分散水相,以0.1m pbs为分散剂,以75μl十二烷和25μl span 80构成油相。
10.优选地,步骤2所述制备修饰电极pil-m-hrp-nafion/gce包括:
11.1)预处理玻碳电极gce,d=3mm;
12.2)制备混合溶液pil-m-hrp-nafion:首先将9mg/ml的hrp的ph=7的pbs溶液与
1mg/ml pil-m水溶液等体积混合,将该混合液超声、漩涡完全混合后,加入等体积的1%nafion溶液后,继续漩涡10min,得到修饰材料混合液pil-m-hrp-nafion;
13.3)制备pil-m-hrp-nafion/gce修饰电极:取7μl的pil-m-hrp-nafion混合液,滴涂于预先处理的gce电极,放置在4℃条件下,隔夜干燥,制备得到pil-m-hrp-nafion/gce修饰电极。
14.根据上述方法制备得到的包含交联的聚合离子液体微球材料的修饰电极,其应用于对h2o2及nano2的电催化。
15.本发明提供的一种交联的聚合离子液体微球材料的修饰电极及其制备方法、应用。本发明应用油包水(w/o)乳液聚合方法合成了交联的聚合离子液体微球(pil-m)。将合成的材料pil-m与hrp结合,制备修饰电极pil-m-hrp-nafion/gce,电极pil-m-hrp-nafion/gce实现了hrp的直接电化学行为,相对于线性聚合离子液体,交联的聚合离子液体制备的修饰电极更有效的促进hrp与电极之间的电子转移过程。此外,电极pil-m-hrp-nafion/gce对h2o2,nano2也表现出更好的电催化性能,具有较宽的线性范围,低检出限,良好的选择性等。
16.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本发明的公开。
附图说明
17.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为本发明公开实施例提供的聚合离子液体pil分散在水中图片(a),聚合离子液体pil水溶液的zeta电位图(b);
20.图2为本发明公开实施例提供的交联聚合离子液体微球pil-m分散在水中图片(a),交联聚合离子液体微球pil-m水溶液的zeta电位图(b);
21.图3为本发明公开实施例提供的交联的聚合离子液体微球pil-m的sem照片;
22.图4为本发明公开实施例提供的pil-m(a)、hrp(b)、pil-m-hrp(c)的紫外-可见吸收光谱图;
23.图5为本发明公开实施例提供的hrp(a)、pil-m-hrp(b)的红外光谱对比谱图;
24.图6为本发明公开实施例提供的在含有5mm fe(cn)
63-/4-,0.1m kcl的支持电解液中bare/gce、pil/gce、pil-m/gce、pil-m-hrp/gce修饰电极的阻抗图谱;交流振幅:5mv,频率范围:0.1hz-100 khz;
25.图7为本发明公开实施例提供的pil-nafion/gce(a)、pil-m-nafion/gce(b)、pil-hrp-nafion/gce(c)、pil-m-hrp-nafion/gce(d)在ph=7的0.1m pbs溶液(n2饱和)中的循环伏安曲线图;扫描速率:200mv/s;
26.图8为本发明公开实施例提供的(a)扫描速率为100mv/s-800mv/s时pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中的循环伏安曲线图;(b)阴阳极峰值电
流与扫速的关系;
27.图9为本发明公开实施例提供的(a)pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中ph由5.5到8的循环伏安曲线图;(b)式电位与ph值的关系,扫描速率:200mv/s;(c)还原峰电流与ph值的关系;
28.图10为本发明公开实施例提供的(a)pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中50个循环伏安曲线,扫描速率:200mv/s;(b)扫描圈数与峰值电流的关系图;
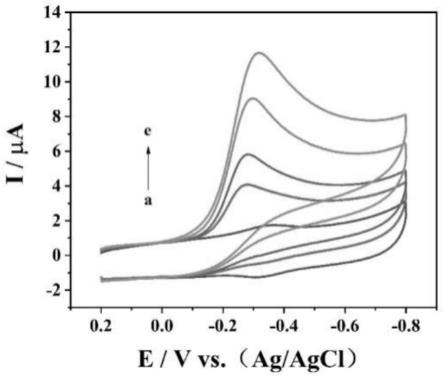
29.图11为本发明公开实施例提供的pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中含有0μm,50μm,100μm,300μm,500μm的h2o2的循环伏安曲线,扫描速率:200mv/s;
30.图12为本发明公开实施例提供的(a)pil-hrp-nafion/gce(a),pil-m-hrp-nafion/gce(b)电极在ph=7的0.1m pbs溶液(n2饱和)中连续添加不同浓度的h2o2的安培响应曲线,工作电位:-0.35v;(b)电催化电流与h2o2浓度的变化曲线;
31.图13为本发明公开实施例提供的pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中连续加入0.1mm h2o2,1mm glu,1mm aa,1mm ua,1mm da和0.1mm h2o2的安培响应曲线,工作电位:-0.35v;
32.图14为本发明公开实施例提供的pil-m-hrp-nafion/gce电极在含有100μm h2o2的ph=7的0.1m pbs溶液(n2饱和)中第一天和储存10天电流响应柱状图;
33.图15为本发明公开实施例提供的pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中含有0mm,100mm,200mm,500mm,1000mm的nano2的循环伏安曲线,扫描速率:200mv/s;
34.图16为本发明公开实施例提供的(a)pil-m-hrp-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中连续添加不同浓度的nano2的安培响应曲线,工作电位:-0.75v;(b)电催化电流与nano2浓度的变化曲线;
35.图17为本发明公开实施例提供的pil-nafion/gce(a)、pil-m-nafion/gce(b)、pil-hb-nafion/gce(c)、pil-m-hb-nafion/gce(d)在ph=7的0.1m pbs溶液(n2饱和)中的循环伏安曲线图;扫描速率:200mv/s;
36.图18为本发明公开实施例提供的(a)pil-hb-nafion/gce,(b)pil-m-hb-nafion/gce电极在ph=7的0.1m pbs溶液(n2饱和)中含有0μm,50μm,100μm,200μm,300μm的h2o2的循环伏安曲线,扫描速率:200mv/s
37.图19为本发明公开实施例提供的(a)pil-hb-nafion/gce(a),pil-m-hb-nafion/gce(b)电极在ph=7的0.1m pbs溶液(n2饱和)中连续添加不同浓度的h2o2的安培响应曲线,工作电位:-0.38v;(b)电催化电流与h2o2浓度的变化曲线。
具体实施方式
38.这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本发明相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本发明的一些方面相一致的系统的例子。
39.为实现对h2o2、nano2的良好分析检测性能及催化性能,本实施方案提供了一种包含交联的聚合离子液体微球材料的修饰电极的制备方法及其电化学应用,聚合离子液体(pil)是由可聚合的离子液体(il)单体合成的功能化离子液体。pil兼具离子液体和聚合物的优点:成膜能力强、膜稳定性好、离子导电性强、生物相容性强等,为固定酶提供稳定的,良好的生物相容性环境。本实施方案发现通过改变pil形貌为交联的聚合离子液体微球pil-m,相较于pil,pil-m其微球结构可进一步增大酶的固载量。
40.具体,一种包含交联的聚合离子液体微球材料的修饰电极的制备方法,包括:
41.步骤1:合成交联的聚合离子液体微球;称取单体1-乙烯基-3-乙基咪唑溴盐、交联剂n,n-亚甲基双丙烯酰胺和引发剂过硫酸铵构成分散水相,其中以pbs为分散剂;以十二烷和span 80构成油相;将分散水相逐滴加入油相,得到pil的油包水乳液,继续向油包水乳液中加入temed进一步引发pil的聚合反应,聚合后形成微球结构的凝胶颗粒,离心回收,被水膨胀的凝胶颗粒经冻干后制备得到白色粉末pil-m;
42.为了与上述存在对比,本实施方案还合成了聚合离子液体,具体包括如下步骤:由单体1-乙烯基-3-乙基咪唑溴盐常规的自由基聚合方法合成pil。将10g的单体与0.2g偶氮二异丁腈完全溶解于50ml氯仿中。向该混合液通30min n2,确保该溶液在饱和氮气,60℃条件下回流反应5h。聚合反应后,待反应溶液冷温度达到室温,用氯仿洗涤数次,70℃真空干燥后,得到黄白色固体pil。
43.步骤2:制备修饰电极pil-m-hrp-nafion/gce。
44.步骤1优选为:首先取0.125g单体1-乙烯基-3-乙基咪唑溴盐,0.01g交联剂n,n-亚甲基双丙烯酰胺和0.0025g引发剂过硫酸铵构成分散水相(以0.1m pbs为分散剂)。以75μl十二烷和25μl span 80构成油相。将分散水相逐滴加入油相,该过程制备得到pil的油包水乳液。继续向该溶液加入temed进一步引发了pil的聚合反应,聚合后形成微球结构的凝胶颗粒,离心回收。被水膨胀的凝胶颗粒经冻干后制备得到白色粉末pil-m。
45.步骤2制备修饰电极pil-m-hrp-nafion/gce包括如下:
46.1)预处理玻碳电极gce,d=3mm;首先分别用不同直径的(0.1μm、0.05μm、0.03μm)氧化铝抛光粉将gce抛光至镜面,超声清洗。然后在铁氰化钾电极检测液中进行循环伏安检测,当峰位差(δep)小于等于70mv时,得到预处理后的gce,n2吹干备用。
47.2)制备混合溶液pil-m-hrp-nafion:首先将9mg/ml的hrp的ph=7的pbs溶液与1mg/ml pil-m水溶液等体积混合,将该混合液超声、漩涡完全混合后,加入等体积的1%nafion溶液后,继续漩涡10min,得到修饰材料混合液pil-m-hrp-nafion;
48.3)制备pil-m-hrp-nafion/gce修饰电极:取7μl的pil-m-hrp-nafion混合液,滴涂于预先处理的gce电极,放置在4℃条件下,隔夜干燥,制备得到pil-m-hrp-nafion/gce修饰电极。
49.根据上述方法制备得到的包含交联的聚合离子液体微球材料的修饰电极可应用于对h2o2及nano2的电催化。
50.为了比较本实施方案pil-m-hrp-nafion/gce修饰电极的优异性能,采用同样方法,制备得到pil-nafion/gce、pil-m-nafion/gce、pil-hrp-nafion/gce、pil-hb-nafion/gce、pil-m-hb-nafion/gce修饰电极。
51.如图1所示,为对聚合离子液体与交联的聚合离子液体微球的zeta表征,由图1(a)
中可知,pil在水溶液中的分散实物图,长时间放置未观察到明显沉淀。因此,pil在水溶液中可以形成稳定的胶体,具有良好的稳定性。从图1(b)可知,聚合离子液体pil在中性的水溶液中的zeta电位值为40.1mv,这是由于聚合离子液体表面存在大量的咪唑基阳离子。
52.图2(a)为交联聚合离子液体微球pil-m被水溶胀后图片,pil-m为半透明悬浊液,且在一段时间内可以保持稳定,具有良好的稳定性。同样在中性水溶液中测定得到交联的聚合离子液体微球表面具有与聚合离子液体相同的电荷性,其zeta电位值为49.1mv,说明改变聚合离子液体的结构并未改变其表面的电荷性质。
53.如图3中显示了交联聚合离子液体微球pil-m的sem电镜图片。sem图片显示,干燥状态下的pil-m保持球状或椭球状,成功制备得到交联的聚合离子液体微球材料。材料pil-m呈现椭球状归因于咪唑阳离子在高粘度乳液中聚合的高剪切力。pil-m表面存在褶皱则是由于pil-m在冷冻干燥过程除去大量水,导致凝胶收缩,形成褶皱颗粒。
54.如图4所示,通过紫外-可见吸收光谱研究了hrp包埋在pil-m膜材料之间的酶蛋白结构变化。从图4可知,修饰材料pil-m(曲线a)在300-500nm吸收光谱范围内,不具有特征吸收带。hrp(曲线b)在402nm处出现明显的特征吸收峰,归属于hrp酶的典型的soret带。同样,pil-m-hrp复合物(曲线c)在402nm存在特征吸收带,与天然的hrp特征峰相符。因此,hrp成功固载在pil-m材料上并保持其固有结构。
55.红外光谱图同样是探究酶蛋白质结构的有效检测方法。因此,应用红外光谱图对pil-m-hrp复合物进行了进一步探究。如图5,曲线b为pil-m-hrp的ft-ir谱图,从图中可知1162cm-1
处存在咪唑环的c-h形变振动特征吸收带,并且在1657cm-1
和1536cm-1
处特征的吸收带归因于hrp的酰胺i(c=o)和ii(n-h)红外吸收带的形状,与曲线a中天然的hrp红外特征峰相符。进一步说明hrp与pil-m成功结合后,仍保持其酶蛋白结构。
56.电化学阻抗(eis)作为检测电极与电解液界面阻抗变化的方法,可有效检测并比较制备修饰电极界面的电子转移能力。电极的eis图谱结果显示为半圆部分和线性部分,半圆部分其直径对应于各修饰电极的电子转移阻力(r
ct
)。
57.图6可知,不同修饰电极bare/gce、pil/gce、pil-m/gce和pil-m-hrp/gce的电荷转移阻力值分别83.32ohm、24.51ohm、13.29ohm和92.51ohm。修饰电极pil/gce、pil-m/gce的电子转移阻力明显小于裸电极gce的r
ct
值。说明修饰材料pil、pil-m具有良好的电子传输性,能够有效改善修饰电极表面的电子转移能力。比较pil/gce、pil-m/gce的电荷转阻力值发现电极pil-m/gce具有更小的电荷转移阻力值,我们推测是由于修饰材料pil-m的微球结构,增大了材料的比表面积,进一步促进了电子传输过程,降低界面电阻,加快fe(cn)
63-/4-电子转移速率。从复合物pil-m-hrp修饰电极的eis曲线结果可知,r
ct
值显著增加至92.51ohm,这是由于导电性差的hrp生物大分子的存在阻碍电子转移过程,同样证明hrp被成功固载在pil-m材料上。
58.应用循环伏安法测定pil-nafion/gce(a)、pil-m-nafion/gce(b)、pil-hrp-nafion/gce(c)、pil-m-hrp-nafion/gce(d)的电化学行为。如图7显示了在ph=7的pbs溶液中、扫描速率为200mv/s实验条件下,不同修饰电极的循环伏安曲线图。可以得出,曲线a、曲线b在扫面电位窗口范围内未观察到明显的电化学响应,因此修饰电极pil-nafion/gce、pil-m-nafion/gce不具备电化学活性。曲线c中,可以观察到一对氧化还原峰,峰位置分别为e
pa
=-0.290v,e
pc
=-0.344v,计算得到峰位差δe
p
=54mv,式电位为e0=317mv,对应hrp
活性中心(fe(ⅲ)/fe(ⅱ)),即实现了hrp与电极表面的直接电子转移。曲线d可知,pil-m-hrp-nafion/gce电极存在一对明显的氧化还原峰,峰位置为e
pa
=-0.308v,e
pc
=-0.323v,其式电位e0=315.5mv对应hrp氧化还原中心电对fe(ⅲ)/fe(ⅱ)的相互转换,并且pil-m-hrp-nafion/gce修饰电极峰位差(δe
p
=15mv),相较于电极pil-nafion/gce氧化还原峰电流均得到进一步提升。实验结果表明修饰电极pil-m-hrp-nafion/gce具有良好的可逆性。此外,相对于未交联的聚合离子液体,交联的聚合离子液体微球材料可进一步加快酶与电极之间的电子转移速率,进一步说明pil-m为hrp的固定提供了具备良好生物相容性和导电性的微环境。
59.根据公式q=nfaγ*,可理论计算hrp固定在电极表面上的覆盖面积。通过计算得到,hrp固定在电极平均表面覆盖面积为2.07
×
10-11
mol/cm2,是hrp的理论表面单层覆盖率8.5
×
10-12
mol/cm2的2.44倍,说明在pil-m-hrp-nafion电极复合膜内,有多层hrp参与了直接电化学反应,这表明pil-m材料的微球结构为hrp的固载提供良好的微环境。
60.图8显示了电极pil-m-hrp-nafion/gce在ph=7的pbs溶液中,不同扫面速率下的循环伏安曲线图。在100mv/s~800mv/s扫速范围内,氧化还原峰电流随扫描速率的增加而增大,阴阳极峰值电流与扫速成线性关系(线性回归方程:阴极:y=0.1241 0.00571x,r2=0.998;阳极:y=-0.0371-0.0055x,r2=-0.998),由此说明该电极反应为表面控制过程。
61.此外,电极pil-m-hrp-nafion/gce的i
pa
与i
pc
之比接近1,nδe
p
<200mv(n为电子转移数,n=1;δe
p
为峰位差,δe
p
=15mv),则电极反应为完全准可逆过程。可根据laviron理论计算得到电子转移速率常数(ks)。
[0062][0063]
式中m为与nδe
p
相关的常数,f为法拉第常数,n为电子转移数,v为扫速,r为气体常数,t为开尔文温度。通过计算ks值为9.76s-1
,这表明制备的电极可促进hrp与电极之间的电子转移。
[0064]
图9中显示了pil-m-hrp-nafion/gce电极的直接电化学行为与缓冲溶液ph值具有密切关系。当缓冲溶液pbs的ph值由5.5增加至8.0,阴极和阳极峰电位均发生负向偏移,氧化还原峰位差基本不变。b可知,ph在5.5~8.0范围内,式电位(e0)与ph具有良好的线性关系,线性方程斜率值为-56.4mv/ph,与可逆质子耦合单电子转移过程的预期理论值-57.6mv/ph相近,表明hrp与电极之间为单质子化的电子转移。图c可知,ph对hrp响应电流大小有影响。显然,最大的峰值电流出现在ph为7,表明ph=7时,hrp具有最高的生物活性。
[0065]
评价生物传感器性能时,电极稳定性是不可缺少的重要指标。在ph=7的0.1m pbs溶液(n2饱和),扫描范围0.2~0.8v,200mv/s的扫描速度下,pil-m-hrp-nafion/gce电极连续进行50次循环伏安扫描。式电位位置保持不变,氧化还原峰值电流变化在2%内。因此,制备的修饰电极pil-m-hrp-nafion/gce具有良好的稳定性。
[0066]
采用循环伏安法探究hrp在修饰电极pil-m-hrp-nafion/gce上对h2o2的电催化性能。如图11所示,在ph=7的0.1m pbs溶液(n2饱和)中含有0μm,50μm,100μm,300μm,500μm的h2o2时修饰电极pil-m-hrp-nafion/gce的电化学响应。图中黑色曲线为不含有h2o2时两种修饰电极的cv响应,氧化还原峰电流之比接近1。随着h2o2浓度逐渐增加,阴极峰值电流增大,阳极电流减小,表明pil-m-hrp-nafion/gce电极发生对h2o2典型的电催化还原。即在加
入h2o2后,h2o2与hrp(feⅱ)还原形式反应,将其氧化为hrp(feⅲ)形式,hrp(feⅲ)在电极表面继续得到电子被还原,以致阴极峰值电流增大。因此,hrp催化h2o2的机理为:
[0067]
hrp(fe
ii
) h2o2 2h
→
hrp(fe
iii
) 2h2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)
[0068]
如图12,工作电位为-0.35v时,在pbs缓冲溶液中每40s连续添加不同浓度的h2o2时,电极pil-hrp-nafion/gce,pil-m-hrp-nafion/gce的i-t曲线图。pil-m-hrp-nafion/gce电极响应电流随h2o2浓度的增加显著增大,尽管pil-hrp-nafion/gce也表现催化电流,但随着h2o2浓度的增加,其催化电流逐渐减小。从图b电流随h2o2浓度曲线可知,电极pil-hrp-nafion/gce,pil-m-hrp-nafion/gce分别在19.41~50μm,12.57~1750μm范围内具有良好的线性关系。两电极灵敏度分别为0.25μa
·
μm-1
·
cm-2
和0.12μa
·
μm-1
·
cm-2
,检出限分别为6.47μm和4.19μm。
[0069]
表观米氏常数用于表示酶和底物的亲和能力。值越小,酶与底物的亲和能力越强,酶表现出高生物活性。当h2o2浓度较高时,电极pil-m-hrp-nafion/gce得到平台电流,表现为典型的michaelis menten动力学特征。由lineweaver burk方程可计算得到
[0070][0071]
式中i
ss
为加入底物后的稳态电流,i
max
为底物饱和条件下测得最大电流,c为加入的底物浓度。根据图2.12实验结果,计算得到为0.37mm,均小于zno-gnps纳米复合膜中hrp的值1.76mm,ldh-cmc纳米复合膜固载hrp的值11.57mm。值较小,进一步证实了pil-m纳米材料固定hrp,具有高活性,对h2o2具有较高的亲和力,说明pil-m为hrp的固载提供良好的生物相容性微环境。
[0072]
通过添加测定h2o2常见干扰物质:葡萄糖(glu)、抗坏血酸(aa)、尿酸(ua)多巴胺(da),考察了pil-m-hrp-nafion/gce电极测定h2o2的选择性。加入0.1mm h2o2电极pil-m-hrp-nafion/gce响应电流瞬间增大,继续加入浓度为h2o
2 10倍的干扰物质,其响应电流可忽略不计。因此,电极pil-m-hrp-nafion/gce对h2o2具有良好的抗干扰性。
[0073]
本实施方案还对制备生物传感器pil-m-hrp-nafion/gce重复性进行了考察。如图14检测了电极pil-m-hrp-nafion/gce储存10天后在含有100μm h2o2缓冲溶液中测得电催化信号与第一天电信号相比,pil-m-hrp-nafion/gce电流响应较弱,响应电流值由6.728μa减小至6.467μa,降值范围在5%内,表明pil-m-hrp-nafion/gce电极具有良好得储存稳定性和结果重现性。
[0074]
本实施方案中进一步考察了pil-m-hrp-nafion/gce电极对nano2电催化性能。如图15,电极pil-m-hrp-nafion/gce在含有0mm,100mm,200mm,500mm,1000mm的nano2的ph=7的0.1m pbs溶液(n2饱和)循环伏安曲线。随着nano2浓度增加,在-0.765v左右出现明显的不可逆的还原峰,还原峰值电流随浓度的增加而增大,这是由于亚硝酸根歧化反应产生的no的还原,电催化机理为:
[0075]
3no
2- 2h
→
2no no
3- h2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(4)
[0076]
hrp-fe(ii) no
→
hrp-fe(ii)-no
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(5)
[0077]
hrp-fe(ii)-no e- 2h
→
hrp-fe(ii) h2o n2o
ꢀꢀ
(6)
[0078]
如图16在-0.75v,向ph=7的0.1m pbs溶液连续加入不同浓度的nano2安培响应曲线。图a中可知,在加入一定浓度的nano2,响应电流瞬时增大,响应时间5s时,响应电流达到稳态电流的96%。此外,图b中可知在0.78~1200mm范围内,响应电流与nano2浓度具有一定的线性关系,线性回归方程为y=0.1378x 7.5446(r2=0.989)。通过计算得到修饰电极测定nano2的灵敏度为1.97μa
·
mm-1
·
cm-2
,检出限为0.26mm。
[0079]
表2.1 pil-m-hrp-nafion/gce电极在人造血浆实际样品中检测h2o2[0080][0081]
表2.2 pil-m-hrp-nafion/gce电极在火腿肠实际样品中检测nano2[0082][0083]
为考察该生物传感器应用于实际样品检测的可行性,应用标准添加法,测定了人造血浆实际样品中h2o2的含量以及实际样品火腿肠中nano2的含量。分析结果为表1,表2所示。所得结果表明,该生物传感器pil-m-hrp-nafion/gce可应用于实际样品中h2o2,nano2的检测,归因于pil-m-hrp-nafion/gce电极的高灵敏度和选择性。
[0084]
以pil-m作为修饰材料,研究另一种以铁卟啉为氧化还原中心的氧化还原酶血红蛋白酶hb的直接电化学行为,考察该修饰材料应用于制备其他氧化还原酶生物传感器其电化学行为是否具有相同影响。
[0085]
如图17为不同修饰电极的cv曲线图。在0.2v~-0.8v电位扫描范围内,修饰电极pil-nafion/gce、pil-m-nafion/gce不存在氧化还原行为。在研究的电化学窗口范围内修饰电极pil-hb-nafion/gce(曲线c),pil-m-hb-nafion/gce(曲线d)具有一对可逆的氧化还原峰,峰电位分别为e
pa1
=-0.308v、e
pc1
=-0.344v,e
pa2
=-0.308v、e
pc2
=-0.371v,计算得到式电位分别为e
01
=326mv,e
02
=339mv。与文献中hb式电位(e0=-0.338v)相一致,即实现了hb在修饰电极的直接电化学。相较于pil-hb-nafion/gce电极,pil-m-hb-nafion/gce电极氧化还原峰值电流增大,表明与线性的聚合离子液体相比,材料pil-m微球结构可进一步促进酶与电极之间得电子传输过程。所得结果与pil-m-hrp-nafion/gce电极具有相似结果,证明材料pil-m具有促进血红素类氧化还原酶直接电化学行为的普适性。
[0086]
最后,本实施方案同样考察了制备电极pil-m-hb-nafion/gce是否可以实现对h2o2的电催化。如图18随着h2o2的加入,阴极电流逐渐增大,阳极峰值电流,这表明h2o2在电极pil-m-hb-nafion/gce发生了典型的电催化还原:
[0087]
hb-heme(feⅱ) 2h
h2o2→
hb-heme(feⅲ) 2h2o
ꢀꢀ
(7)
[0088]
为进一步考察pil-hb-nafion/gce,pil-m-hb-nafion/gce电催化性能,向ph=7的0.1m pbs溶液的缓冲溶液中连续加入不同浓度的h2o2,在动态条件下进一步考察修饰电极的电催化性能。图19a显示在-0.38v工作电位下,pil-hb-nafion/gce,pil-m-hb-nafion/
gce电极在不同h2o2浓度下的i-t曲线图。每增加一定浓度的h2o2,电极pil-hb-nafion/gce,pil-m-hb-nafion/gce响应电流明显增大,而且在加入同样浓度的h2o2时pil-m-hb-nafion/gce电极响应电流明显大于pil-hb-nafion/gce电流值。从图19bh2o2浓度与电催化电流关系曲线可知,pil-m-hb-nafion/gce电极具有较宽的线性范围,浓度范围在11.07~100μm、150~350μm内具有良好的线性关系,线性方程分别为:y=0.0325x 0.1807,r2=0.998;y=0.0158x 2.1848,r2=0.994。计算得到灵敏度为0.46μa
·
μm-1
·
cm-2
,检出限为3.69μm,米氏常数k
mapp
为0.26mm。因此,生物传感器pil-m-hb-nafion/gce具有较好的电催化性能,与上述hrp酶生物传感器具有相似结构,进一步说明pil-m制备生物传感器促进血红素类酶直接电化学行为具有普适性。
[0089]
综上,本实施方案成功合成了线性的聚合离子液体以及应用油包水(w/o)乳液聚合方法合成了交联的聚合离子液体微球(pil-m)。两种材料均具有良好的水溶性及稳定性。应用zeta电位,扫面电镜等技术对合成的材料表面电荷性质,表面形貌进行系统的研究。然后,通过ft-ir和uv-vis技术考察了hrp与材料pil-m结合前后其结构是否发生改变。实验结果表明pil-m实现了hrp的成功固载的同时保持其原有的天然结构。
[0090]
将合成两种材料pil、pil-m与hrp结合,制备修饰电极:pil-hrp-nafion/gce、pil-m-hrp-nafion/gce。应用电化学方法考察了pil-hrp-nafion/gce、pil-m-hrp-nafion/gce的直接电化学行为以及电催化性能。研究结果表明,电极pil-hrp-nafion/gce、pil-m-hrp-nafion/gce均实现了hrp的直接电化学行为,但相对于线性聚合离子液体,交联的聚合离子液体制备的修饰电极更有效的促进hrp与电极之间的电子转移过程。此外,电极pil-m-hrp-nafion/gce对h2o2,nano2也表现出更好的电催化性能,具有较宽的线性范围,低检出限,良好的选择性等。
[0091]
在此基础上,应用材料pil-m制备pil-m-hb-nafion/gce电极,考察其电化学性能与电极pil-m-hrp-nafion/gce具有相似结果。结果表明pil-m在促进以血红素为氧化还原活性中心氧化还原酶的直接电子传输方面具有普适性。
[0092]
本领域技术人员在考虑说明书及实践这里公开的发明后,将容易想到本发明的其它实施方案。本技术旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本发明的一般性原理并包括本发明未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由权利要求指出。
[0093]
应当理解的是,本发明并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本发明的范围仅由所附的权利要求来限制。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。