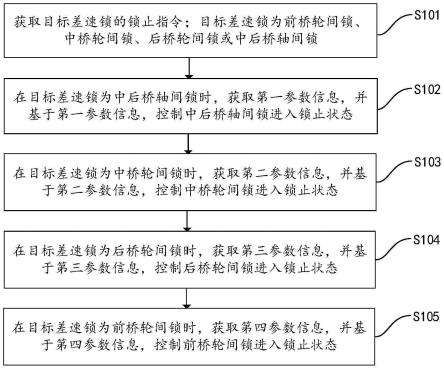
1.本发明涉及药物领域,具体涉及一种活性蛋白黏膜给药制剂及其制备方法和应用。
背景技术:
2.黏膜系统,包括口腔、鼻腔、消化道、尿道、阴道等处黏膜,是人体表面的重要保护屏障,也是外源微生物侵染、药物分子进入人体的重要途径。与普通皮肤环境相比,黏膜层的厚度在10-1000微米之间,不具备角质化表面,仅含有单层或若干层上皮细胞,利于药物分子的跨膜运输。此外,多数黏膜表面包含微绒毛结构,进一步增大了黏膜的表面积。因此具有高透过性与大表面积的黏膜可以作为药物递送的重要途径。目前已经有多种化学小分子药物可以实现通过黏膜给药。
3.另一方面根据免疫学原理,黏膜免疫可以在黏膜表面激活分泌型抗体siga的表达,将病原体直接阻挡在体外,从根本上杜绝感染的发生,从而克服普通的体液/细胞免疫下无症状感染者的形成。
4.然而,在生物大分子药物领域,目前还没有成熟的黏膜给药技术,其主要障碍在于生物大分子难以透过细胞膜或细胞间隙。研究发现,黏膜细胞,尤其是表面带有大量微绒毛结构的微皱褶细胞,倾向于大量吞噬粒径在100纳米到1微米的正电性颗粒,因此使用该类颗粒包裹生物大分子,可以实现跨黏膜的生物给药。
5.专利cn1812765b公开了一种用于活性成分经粘膜向人体或动物体给药的薄膜形给药剂型,在其制备过程中,用于制备所述给药剂型的、并且包括溶剂或溶剂的混合物、至少一种形成母质的聚合物和选自药物活性成分和芳香物质中的至少一种成分的基质的ph值接近或适应于施用该给药剂型的粘膜的生理ph值。该药剂型的应用使得在给药时,粘膜刺激降低甚至被防止。该专利的关注点在于“活性物质的快速释放”,然而对于多肽或蛋白药物而言,其吸收过程普遍慢于小分子药物,且释放后的多肽或蛋白药物在黏膜表面生理环境下的稳定性较差。因此对于多肽或蛋白药物,纳米颗粒缓释给药对比薄膜制剂快速释放给药具有更大的优势。
6.专利cn1720024公开了一种局部输送药理学有效药剂到鼻腔、口腔、阴道、阴唇或阴襄上皮或通过鼻腔、口腔、阴道、阴唇或阴囊上皮进入体循环的聚合物泡沫或膜组合物,所述组合物含有至少一种基质聚合物或基质聚合物和药理学有效药剂的混合物。该组合物进一步含有渗透促进剂、吸收促进剂、粘膜粘着剂、亲水性或疏水性释放改进剂、或其混合物,能够应用在复杂药物输送系统的表面。该专利的剂型为泡沫或膜,不具有纳米颗粒结构,根据文献,黏膜层对于100-1000nm的纳米颗粒具有高效的吸收能力,因此本纳米制剂给药系统可以更好的应用于黏膜给药吸收。此外,该专利的促渗剂依赖于“二醇衍生物”(42页15节),而本专利优选的促渗剂不包含二醇衍生物,且对照例表明本专利所选促渗剂的效果优于peg400(该专利实施例1所用二醇衍生物)。
7.专利cn108697803a公开了透粘膜给药的药物组合物,该组合物包括亲脂性活性化
合物、两种及两种以上水溶性聚合物形成的聚合物基质及快速溶解剂。至少有一种水溶性聚合物为两亲聚合物,且至少有一种是亲水聚合物或两亲聚合物,且该两新聚合物的亲水-疏水平衡性不同于第一种两亲聚合物。该专利的适用活性药物主要是“亲脂性活性化合物”,然而大多数蛋白和多肽药物并非亲脂的,因此不适用于该专利的方法。此外本专利聚焦于蛋白和多肽药物的给药,因此不需要必须含有两亲聚合物。本专利使用纯天然来源的亲水聚合物同样可以实现蛋白和多肽药物的高效的黏膜给药,可以避免工业合成两亲聚合物试剂的使用,具有更好的安全性。
技术实现要素:
8.本发明针对现有技术存在的问题,提供了一种活性蛋白黏膜给药制剂及其制备方法和应用,通过离子交联制备的纳米颗粒,以及利用该纳米颗粒载带蛋白、多肽类生物分子,实现黏膜给药的应用。
9.该纳米颗粒的组分包括成核剂、活性蛋白、促渗剂、包覆剂四种种成分。其中除活性蛋白成分以外,其余组分均来自《中国药典(2020版)》收录的药用辅料部分。其制备原理是,活性蛋白在特定ph条件下,与成核剂通过静电吸附,形成凝集核。将含有凝集核的低浓度溶液分散于含有高浓度的包覆剂的溶液,可以迅速通过成核剂与包覆剂之间的离子交联形成包载目标蛋白药物的纳米颗粒溶液。通过调控成核剂、包覆剂的浓度与离子条件,可以控制形成的纳米颗粒的大小。选取适合的纳米颗粒溶液,加入促渗剂后进行冷冻干燥,可以得到含有纳米颗粒的固体黏膜给药制剂。可以实现药物蛋白在口腔、鼻腔、消化道、尿道、阴道等处黏膜上的跨膜吸收。
10.为实现上述目的,本发明采用的技术方案如下:
11.本发明提供了一种活性蛋白黏膜给药制剂的制备方法,包括以下步骤:
12.(1)将成核剂溶液、药物蛋白溶液、磷酸盐缓冲溶液混合,得到混合液;
13.(2)将包覆剂溶液搅拌后喷入步骤(1)得到的混合液中,继续搅拌,加入促渗剂,再次搅拌,冻干,即得;
14.所述成核剂或包覆剂包括泊洛沙姆188、泊洛沙姆407、倍他环糊精、羟丙基倍他环糊精、硬脂酸聚烃氧酯、壳聚糖、羧甲基壳聚糖、卡波姆940p、海藻酸及其钠盐、透明质酸及其钠盐、聚乙烯醇2000、聚乙烯醇4000、聚乙烯醇6000、聚乙烯醇8000、聚山梨酯80、羧甲基纤维素钠、羧甲淀粉钠、聚卡波菲、聚维酮中的一种或多种。
15.优选地,所述成核剂为海藻酸。
16.优选地,所述包覆剂的原料为壳聚糖。
17.进一步地,所述促渗剂包括葡萄糖、蔗糖、麦芽糖、海藻糖、甘露醇、山梨醇、edta和egta中的一种或多种。
18.优选地,所述促渗剂为蔗糖。
19.进一步地,所述成核剂溶液的浓度为质量分数为0.01-5%的溶液,ph范围为3-10。该成核剂的离子浓度为1-500mm。制备过程中通过过滤除菌。
20.在一些具体的实施方式中,所述成核剂溶液使磷酸盐缓冲液、无菌水和成核剂进行配置得到。
21.进一步地,所述包覆剂溶液的浓度为质量分数为0.1-30%的溶液,ph范围为3-10。
该包覆剂的离子浓度为1-500mm。制备过程中通过过滤除菌。
22.在一些具体的实施方式中,所述包覆剂溶液使用乙酸和包覆剂进行配置得到。
23.在一些具体的实施方式中,所述促渗剂溶液使用促审计和无菌水进行配置得到。
24.进一步地,所述药物蛋白溶剂的浓度范围为1-100mg/ml。该药物蛋白溶剂根据活性蛋白的性质选择适宜的磷酸盐缓冲液,制备过程中通过过滤除菌。
25.进一步地,所述药物蛋白溶液为新冠抗原溶液。
26.进一步地,步骤(2)包括预冻、主干燥和解析;所述预冻时间为4-24小时,预冻温度为-80℃,主干燥段时间为4-72小时,主干燥温度为-80度至-10℃,梯度设置;解析时间为2-24小时,解析温度为-10℃~50℃,梯度设置。
27.进一步地,所述给药制剂的制备在a级洁净环境中完成。使用低温配液罐,以及带有1-1000个喷雾装置,机械搅拌器的制剂罐。每个喷头的喷雾速度为0.01-100ml/分钟。制剂温度选择范围为0-50摄氏度。
28.在一些具体的实施方式中,所述活性蛋白黏膜给药制剂的制备方法,包括以下步骤:
29.将成核剂溶液、新冠抗原溶液、磷酸盐缓冲液依次注入配液罐,控制温度为4度,混合15分钟。
30.向制剂罐中注入包覆剂溶液,将配液罐中的液体通过喷雾器喷入制剂罐中。
31.喷雾完毕后,继续搅拌,然后滴入促渗剂溶液,滴入完毕后继续搅拌。
32.使用自动灌装机,将制剂罐中的混合液分装入西林瓶中,0.5ml/瓶。分装完成后转移入冻干机,预冻。开始冻干程序。冻干完成后压盖。
33.冻干结束后,抽取样品复溶后测试蛋白含量、浊度、黏度、渗透压、粒径和表面电势。剩余的样品入库或者进行稳定性测试。
34.进一步地,本发明还提供了上述的制备方法制备得到的活性蛋白黏膜给药制剂。
35.进一步地,所述活性蛋白黏膜给药制剂的形态为固体干粉,含水量在1-10%之间,所得制剂复溶于水后形成纳米颗粒溶液,其中活性组分颗粒粒径为0.1-10μm。干粉制剂的稳定性在1年以上。
36.本发明所取得的技术效果是:
37.本发明设计了一种黏膜给药技术。该技术要点为通过纳米颗粒载药,实现蛋白和多肽药物在黏膜上的跨膜吸收。通过优化蛋白,增强蛋白本身靶向黏膜免疫细胞的能力;采用符合《中国药典》药用辅料的高分子材料,与蛋白、多肽通过静电吸附形成复合物,优化制剂的结构、黏附性、稳定性,另一方面,提高负载抗原的活性与黏膜吸收效果。本疫苗方案融合纳米技术与蛋白重组技术,通过口服/鼻喷的接种方式,可以创新性的同时有效诱导黏膜、体液、细胞三重免疫途径,具有高中和抗体产生效率、高安全性、室温稳定的特点。
附图说明
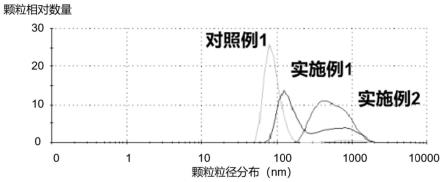
38.图1为实施例1、实施例2与对照例1的制剂粒径分布图。
39.图2为实施例1制剂中蛋白的稳定性图。
40.图3为阳性对照、实施例1-3、对照例1和阴性对照的细胞吸收对比情况。
41.图4为肌肉注射给药,以及实施例1-3和对照例1用于小鼠黏膜给药后,黏膜上中和
抗体滴度情况。
具体实施方式
42.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
43.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
44.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。
45.值得说明的是,本发明中使用的原料均为普通市售产品,因此对其来源不做具体限定。
46.实施例1、纳米颗粒的制备实验:
47.全部配液使用无菌水,在隔离器中完成,确保溶液无菌。所有试剂尽可能置于冰上,以防止降解。所得工作液分装成适宜的规格于-20℃冻存,室温下试剂仅限当天使用。
48.配制ph=8的磷酸盐缓冲液,浓度100mm,过滤除菌或者高压灭菌。
49.配制成核剂溶液,使用ph=8的磷酸盐缓冲液和无菌水配制海藻酸的质量分数为0.5%的溶液,盐浓度为100mm,体积为200ml。加入100ml的edta溶液(0.5m,ph=8)。混合均匀后过滤灭菌。
50.配制包覆剂溶液,使用1%的乙酸溶解壳聚糖,最终浓度为1%,配制约1l,高压灭菌。
51.新冠抗原溶液,浓度为5mg/ml,过滤除菌。
52.配制促渗剂溶液,称取100g蔗糖,溶解于无菌水配制20%的溶液,过滤除菌。
53.纳米颗粒配制:
54.所有操作在超净台中完成。将低温配液罐,以及带有喷雾装置,机械搅拌器的制剂罐转移至隔离器中。开启冻干机设定预冻温度-50度。
55.将300ml的成核剂溶液、600ml的新冠抗原溶液、100ml的磷酸盐缓冲液依次注入配液罐,控制温度为4度,混合15分钟。
56.向制剂罐中注入1l的包覆剂溶液,设定转速为800rpm。将配液罐中的液体通过喷雾器喷入制剂罐中,喷雾速率为50ml/分钟。喷头高度设置为30厘米。
57.喷雾完毕后,继续搅拌10分钟,然后滴入400ml的促渗剂,滴入速度为40ml/分钟,滴入完毕后继续搅拌10分钟。
58.使用自动灌装机,将制剂罐中的混合液分装入西林瓶中,0.5ml/瓶。分装完成后转移入冻干机,预冻4小时。开始冻干程序。冻干完成后压盖。
59.冻干结束后,抽取样品复溶后测试蛋白含量、浊度、黏度、渗透压、粒径和表面电势。剩余的样品入库或者进行稳定性测试。
60.实施例2、纳米颗粒的制备实验:
61.方法与实施例1相似,区别仅在于将成核剂更换为等量玻璃酸钠。
62.实施例3、纳米颗粒的制备实验:
63.方法与实施例1相似,区别仅在于将包覆剂更换为等量右旋糖酐。
64.对照例1
65.方法与实施例1相似,区别仅在于将包覆剂更换为等量聚乙烯醇400。
66.一、纳米颗粒的表征方法:
67.优选使用malvarn公司的zetasizer粒径仪对纳米颗粒的粒径、表面电势进行评估。也可以使用其他测试原理、测试能力接近的仪器完成测试。
68.随机取1只制剂产品,注入0.5ml的注射用水。颠倒摇匀10次。将溶液抽出,与0.5ml的特定ph的磷酸盐缓冲液混合,在本实施例中优选为20mm的ph=7.4的磷酸盐缓冲液。放入样品池,测量粒径。连续三次测定,取平均值。实施例1中的纳米颗粒粒径在0.3-1μm间。
69.随机取10只制剂产品,每只注入0.5ml的注射用水。颠倒摇匀10次。将溶液抽出,分别与0.5ml的连续变化的ph的磷酸盐缓冲液混合,在本实施例中优选为20mm的ph分别为6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8的磷酸盐缓冲液。按照ph顺序,各样品依次放入样品池,测量表面电势。连续三次测定,取平均值。所得表面电势对ph作图,从图中读取纳米颗粒的等电点和在生理条件下的表面电势。
70.同步做实施例1-2以及对比例1产品的相关实验,得到的纳米颗粒载药粒径分布图详见图1。
71.二、纳米颗粒蛋白载药评估:
72.随机取1只制剂产品,注入0.5ml的注射用水。颠倒摇匀10次。将溶液抽出,使用超高速离心机离心溶液,100000rpm,4摄氏度,离心24小时。吸取上清液。使用紫外分光光度法测定其中蛋白含量。对于实施例1中制剂,该上清液中蛋白含量不高于0.025mg/ml。即蛋白包载率大于96%。
73.三、纳米颗粒-蛋白稳定性评估:
74.本实验使用商业化的elisa检测试剂盒和sds-page试剂盒完成。
75.随机取10只实施例1制剂产品,储存于4度,分别依次于0天、10天、20天、30天、50天、100天、150天、200天、300天、365天时取出。随后立即注入0.5ml的注射用水。颠倒摇匀10次。将溶液抽出,使用非还原性条件下的page及elisa检测进行检测。通过elisa检测可知,经过冻干复溶的制品中相较对照组总保存率始终在80%以上。使用非还原性的page对总储存蛋白进一步分析发现,保有完整分子量大小的蛋白始终在95%以上。说明该固体制剂在4度下,1年的有效期内具有良好的稳定性。
76.本发明的纳米颗粒载药稳定性图详见图2。
77.四、纳米颗粒载药的细胞吸收评估:
78.除非另有说明,否则所有化学品均从sigma-aldrich(密苏里州圣路易斯)购买。transwell聚碳酸酯过滤器插件(12口,孔径为3mm)从康宁costar(纽约州纽约市)购买。
79.将caco-2细胞在dmem(25mm葡萄糖)中培养,具有10%(v/v)fbs(hyclone实验室,logan,ut),并将raji细胞在补充有10%(v/v)fbs的rpmi 1640培养基中培养。
80.将0.1和0.5ml dmem分别补充有10%fbs添加到横孔的顶端和基底外侧,然后将横
孔在co2培养箱中预孵育30分钟。然后将caco-2细胞扩散到转孔的顶端。孵育3小时后,更换顶端侧的培养基,并每隔一天更换上层培养基以进行下一个14d培养。将悬浮在rpmi1640/dmem(1:2)混合物中的raji细胞然后加入到横孔的基底外侧室中,并维持共培养7天。
81.随机取1只制剂产品,注入0.5ml的注射用水,颠倒摇匀10次。将溶液抽出,取100μl孵育到转孔的顶端,在对照孔中加入含125μg蛋白的100μl的生理盐水样品,在阴性对照孔中加入100μl的生理盐水。然后将横孔在co2培养箱中预孵育2h。收集培养基和caco2细胞并进行测定。测试sds-page,可以观察到在caco2细胞回收样品中,只有制剂组中观察到明显的目标蛋白信号。与标准浓度样品进行对比,判断其吸收效果大于50%。
82.同步做实施例1-3以及对比例1产品的相关实验,得到的纳米颗粒载药细胞吸收图详见图3。
83.五、纳米颗粒载药的动物模型评估:
84.选取spf级balb/c小鼠,周龄6-8w,体重约20g。饲养于洁净环境中。
85.将小鼠随机分成3组,每组10只,雌雄各半。入组后每周采血10μl测定血常规,检测3周,确定无异常。
86.给药实验于第1、3、7周进行。每次给药时,随机取1只制剂产品,注入0.5ml的注射用水,颠倒摇匀10次,将溶液抽出。制剂组每只小鼠每只鼻孔喷入25μl的制剂溶液。蛋白对照组使用含0.625mg/ml抗原蛋白的生理盐水溶液,每只小鼠每只鼻孔喷入25μl。阴性对照组每只小鼠每只鼻孔喷入25μl的生理盐水。
87.观察每次喷雾前和喷雾过程中小鼠的呼吸频率,采用秒表计数。记录呼吸频率。每次喷雾前后,对小鼠分别进行称重,记录体重数据,测量体温。
88.入组后、每次给药实验前、第3次给药后1周、2周、3周、4周、2月、3月、6月时,进行小鼠黏膜采样和静脉采血。每次抽取小鼠静脉血100μl,使用0.15mg的edta-k2抗凝,取10μl用于血常规分析仪分析,记录数据。余下血样4℃,3000rpm离心20min,取上清血浆20μl立即用于elisa活性测试,测试小鼠体内针对给药蛋白的抗体水平。余下血浆直接冻存于液氮中。采用口腔拭子采集小鼠黏膜样本,所得样品立即置于蛋白保存液中,取20μl立即用于elisa活性测试,测试小鼠黏膜上针对抗原蛋白的抗体水平。
89.小鼠第三次给药后次日,每组处死半数,采集主要器官,使用甲醛固定。其中小鼠鼻腔、肺部组织制作石蜡切片后,常规脱蜡、水化,依次以苏木素、伊红进行染色后,以梯度酒精脱水、二甲苯透明、中性树胶封片。正置高倍显微镜下拍照,以smith法进行急性损伤评分。
90.所得结果表明,本发明制剂可以高效诱导针对蛋白抗原的免疫活性,且对小鼠无明显刺激性。
91.同步做实施例1-3以及对比例1产品的相关实验,得到的纳米颗粒载药用于小鼠免疫的实验效果详见图4。
92.最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。