1.本技术属于药物技术领域,具体涉及一种双氯芬酸钠缓释片体内外相关性评价的方法。
背景技术:
2.双氯芬酸钠为非甾体抗炎药,能够通过抑制组织因炎症反应而产生的cox(环氧酶),从而减少前列腺素的合成,减轻疼痛,起到镇痛作用。还能在一定程度上能抑制脂氧酶而减少白三烯、缓激酶等产物作用。在动物和人的临床研究中证明:通过抑制下丘脑体温调节中枢前列腺素的合成,从而达到解热的作用。双氯芬酸钠主要用于缓解类风湿关节炎、骨关节炎、脊柱关节病、痛风性关节炎、风湿性关节炎等各种关节炎的关节肿痛症状;治疗非关节性的各种软组织风湿性疼痛,如肩痛、腱鞘炎、滑囊炎、肌痛及运动后损伤性疼痛等;急性的轻、中度疼痛如:手术后、创伤后、劳损后、痛经、牙痛、头痛等;对成人和儿童的发热有解热作用。
3.缓释制剂是在规定的环境中,药物按要求缓慢地非恒速释放,每日用药次数比相应的普通制剂减少或用药的时间间隔有所延长的制剂。这种制剂可使人体维持所需血药浓度达较长的时间,避免了临床每日频繁用药即由此而产生的血药浓度大幅波动现象,提高了用药的有效性、安全性和患者的依从性。缓释制剂是目前能够实际应用于临床中技术含量较高的一种剂型,开发技术相对成熟,中国药典收载了30余种口服缓/控释制剂,并制定了其指导原则,国外目前已有200余种缓/控释制剂上市,应用前景很大。
4.体内外相关性评价是用数字的模型描述药物的体外性质与药物的体内性质的关系。药物的疗效取决于有效部位的血药浓度和作用时间,然而单纯依赖体内试验获得数据,操作繁琐且实验要求高,因而,通过模拟体内环境,利用体内实验准确预测药物的体内行为就显得尤为重要。通过建立一种合适的体外溶出度测定方法,结合体内药动学实验建立体内外相关性,确定缓释制剂在不同释放体系中的体外溶出限度的范围,可以为后续该制剂生产和质量评价提供依据,可准确预测药物体内的作用特征,并最终指导和优化处方设计,确立更具代表性的溶出实验规则,合理调整制剂与工艺,并减免生物等效性研究。
5.中国专利申请202110485800.7中公开了一种氟苯尼考缓释颗粒的质量评价与控制方法,本方法通过溶出试验获得氟苯尼考缓释颗粒药物在体外的崩解、释放过程,并与药物在体内的过程建立相关性,从而制定药物在体外的溶出限度为:在模拟胃液中,30min内的累积释放度不超过20%、且2小时内的累积释放度不超过50%;以及在模拟肠液中,30min内的累积释放度不超过25%、4小时内的累积释放度不超过75%、且8小时内的累积释放度大于85%。以该发明的溶出限度为质量标准,通过对氟苯尼考缓释产品体外溶出的评价,进而控制制剂生产的产品质量,保证不同生产批次产品的体内代谢过程的一致性,为产品质量控制和评价提供依据。
6.中国专利申请202111315968.x公开了一种评价双氯芬酸钠缓释片体内外相关性 (invivo-invitrocorrelation)方法,和一种新型双氯芬酸钠缓释片。该发明的评价双氯芬
酸钠缓释片体内外相关性的方法可以很好的评价体内药代动力学特征。双氯芬酸钠缓释片的处方组成如下:双氯芬酸钠:100mg/片、蔗糖:119mg/片、十六醇:59mg/片、聚维酮k30:4mg/片、胶态二氧化硅:3mg/片、硬脂酸镁:3mg/片、薄膜包衣预混剂:10mg/片。该发明的双氯芬酸钠缓释片控制了药物的释放速度,在降低了传统双氯芬酸钠缓释片对胃的刺激性的同时,达到长时间保持在较高有效血液浓度下的给药模式。保证了药效,减少了副作用,大大便利了临床使用。
7.但是上述方法均使用溶出曲线对比的方式,使用传统的溶出仪及介质,简单模拟人体的生理环境,进行相关性评估,不能更好地达到生物等效,因此需要开发一种能够达到生物等效的体内外相关性评价的方法,从而更好的开发同原研药的体外一致性高的仿制药。
技术实现要素:
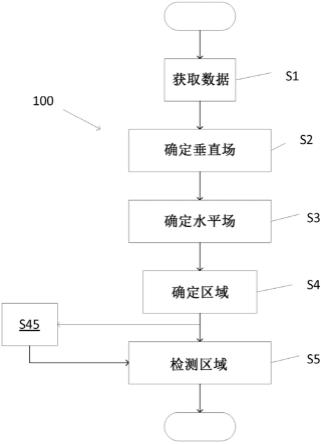
8.基于现有技术的不足,本技术旨在提供一种双氯芬酸钠缓释片体内外相关性评价的方法,具体方法如下:步骤一:对产品的体内溶出吸收过程进行剖析;步骤二:设计具备不同释放速率的处方,开发具备处方区分力的溶出方法,进行人体pk实验,获得仿制药的体内pk特征参数;步骤三:生物相关性模型建立;步骤四:根据相关性模型,指导与原研药等效的处方选择,并预测处方与原研药等效的程度。
9.其中,步骤一中所述的剖析产品吸收过程具体操作为:双氯芬酸钠为bcsii类药物,pka为4.0,在酸性条件下会存在转化:而双氯芬酸的溶解度极低,缓释片服用后在胃部双氯芬酸钠溶解后,迅速转化为双氯芬酸,继而在片剂表面形成致密的不溶性薄膜,阻止继续释放。当药物进入小肠后,由于肠道环境的ph值在6.0-6.8,高于双氯芬酸的pka,此时溶解度得到提高,片剂表面的双氯芬酸首先发生溶解,然后双氯芬酸钠逐渐溶解,且由于骨架为蜡质醇,属于溶蚀型释放的机理,片剂的溶蚀速度将会决定溶出,进而决定吸收。
10.步骤二中所述的设计具备不同释放速率的处方具体为:制备:处方一:含骨架材料蜡质醇量为1-2mg/片和处方二:含骨架材料蜡质醇量为3-5mg/片。
11.步骤二中所述的开发具备处方区分力的溶出方法,具体操作为:(2.1)介质选择:根据产品在体内将经历的生理环境ph值,选择fassgf与fassif作为溶出介质。
12.(2.2)装置选择:所述的装置为uspii法、uspiv法或uspiii法中的一种;优选为uspiii法。
13.其中,所述的uspii法为经典溶出装置,参照usp药典,采用桨法(含沉降篮)进行试验:转速:50rpm;取样体积:10ml;所述的uspiv法为模拟人体生理体液的流动,在流通池的溶出仪上进行试验:流速:8ml/min,脉流,正弦波;模式:开环;池子:大池子;所述的uspiii法为根据产品溶蚀释放的机理,选择往复筒法进行研究:筛网:上下40mesh;往复速率:10dpm;取样体积:2ml。
14.步骤二中所述的进行人体pk实验具体操作为:血浆样品采用lc-ms/ms方法测定给药后的双氯芬酸钠浓度。
15.步骤三中所述的生物相关性模型建立具体方法为:(3.1)溶出曲线模型:使用uspiii法获得的溶出曲线,并进行模型拟合;以logistic函数拟合溶出曲线,相关系数r>0.99,满足要求;以此函数,计算各处方样品的t25、t50、t60、t65、t75、t80及t90。
16.(3.2)ivivc c级相关性模型建立:由于双氯芬酸钠缓释片的体内高变异性,以及存在肝肠循环,导致无法通过pk曲线反卷积得到吸收曲线,也就无法建立体内外a级相关性,因此寻找体内pk参数同体外溶出参数之间的关联性。
17.通过对比t25-t90与cmax ratio,发现t75的时间长短同cmax ratio大小趋势正好相反,具备建立c级相关的条件;以处方二,建立c级相关模型:cmax ratio=1350
÷
t75,并对其他处方进行预测,计算预测值与实测值的pe。
18.与现有技术相比,本技术的有益效果在于:(1)本技术提供的体外区分力方法开发使用了往复筒溶出装置,对本类型的产品具备更高的区分力;(2)本技术提供的人体pk实验选择多个释药速率的处方进行实验;(3)本技术提供的生物相关性模型建立,建立了体外试验和体内试验间的数学模型cmax ratio=1350
÷
t75,可以互相转化;(4)本技术提供的处方预测,在进行人体试验前,就可以通过数学模型,模拟处方与原研的等效程度。
具体实施方式
19.本发明中提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所解释的所有特征可与任意方法形式并用,说明书中揭示的各个特征,可被任何可提供相同、均等或相似目的的取代性特征取代。因此除有特殊说明,所揭示的特征仅为均等或相似特征的一般性例子。
20.下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的实施方法,通常按照常规条件或按照制造厂商所建议的条件。
21.除非另行定义,文中所使用的所有专业与科学用语与本领域技术人员所熟知的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的优选实施方法与材料仅做示范作用。
22.本技术以下实施例中所使用的试剂均为本领域常规试剂,均可以通过商业形式购买到。
23.实施例一种双氯芬酸钠缓释片体内外相关性评价的方法具体方法如下:步骤一:对产品的体内溶出吸收过程进行剖析;双氯芬酸钠为bcsii类药物,pka为4.0,在酸性条件下会存在转化:而双氯芬酸的溶解度极低,缓释片服用后在胃部双氯芬酸钠溶解后,迅速转化为双氯芬酸,继而在片剂表面形成致密的不溶性薄膜,阻止继续释放。当药物进入小肠后,由于肠道环境的ph值在6.0-6.8,高于双氯芬酸的pka,此时溶解度得到提高,片剂表面的双氯芬酸首先发生溶解,然后双氯芬酸钠逐渐溶解,且由于骨架为蜡质醇,属于溶蚀型释放的机理,片剂的溶蚀速度将会决定溶出,进而决定吸收。
24.步骤二:设计具备不同释放速率的处方,开发具备处方区分力的溶出方法,进行人体pk实验,获得仿制药的体内pk特征参数;(2.1)制备不同释放速率的处方:处方一:含骨架材料蜡质醇量为2mg/片;处方二:含骨架材料蜡质醇量为4mg/片;(2.2)开发具备处方区分力的溶出方法,具体操作为:(2.2.1)介质选择:根据产品在体内将经历的生理环境ph值,选择fassgf与fassif作为溶出介质。
25.(2.2.2)装置选择:根据产品溶蚀释放的机理,选择往复筒法进行研究:装置:uspiii法;筛网:上下40mesh;往复速率:10dpm;取样体积:2ml。
26.结果显示该法能很好地区分不同配方下的产品,溶出趋势同缓释骨架用量一致。
27.(2.3)进行人体pk实验:
血浆样品采用lc-ms/ms方法测定给药后的双氯芬酸钠浓度。
28.具体操作为:受试者一旦入选,12名受试者随机化分成2组,每组6人。受试者禁食不禁水10小时后,试验当天早晨空腹给予受试制剂或参比制剂1片(100mg/人),240ml温水送服。除服药时饮用的水,受试者需在服药前1h和服药后2小时内禁水,并在4小时后统一进标准餐。给药前在受试者静脉埋置一次性静脉留置针,使用封管液(生理盐水)封管。每次采血前,采集0.5ml弃血弃去。分别于给药前60分钟内和给药后0.25h、0.5h、1h、1.5h、2h、2.5h、3h、3.33h、3.67h、4h、4.33h、4.67h、5h、5.5h、6h、7h、8h、10h、12h和16h(共21个采血点),每个采血点采血约4ml,置于贴好标签的edta-k2抗凝试管内。采血后立即将采血管(采血管需要提前预冷)轻轻完全颠倒3次与抗凝剂混匀。如有需要,可以通过一次性采血针静脉穿刺采集。采集后的血样管在冰水浴中静置,1小时内置于低温离心机中,4℃条件下,3500rpm离心10分钟。离心结束后,采血管置于冰水浴中,取上层血浆分装到贴好对应标签的冻存管内。检测管中血浆体积不少于1.0ml,剩余血浆置于备份管中。检测管、备份管在储存于冰箱之前将一直置于冰浴盆中保存。采血后2h内将血浆样本置于-80℃冰箱。
29.lc-ms/ms方法的具体条件为:(2.3.1)色谱条件液相条件:用zorbax eclipse plus c18 2.1mm
×
50mm 3.5μm,agilent(或效能相当的色谱柱)为洗脱色谱柱;以security guard cartriges c18 4mm
×
2.0mm id,phenomennex为预柱;以5mm乙酸铵水溶液(含0.1%甲酸)为流动相a,以乙腈为流动相b;流速为每分钟0.8ml;柱温40℃;进样体积5μl;梯度洗脱。
30.质谱条件:质谱型号:api 400;离子源:turbo spray;
(2.3.2)标准品储备液:精密称取双氯芬酸钠标准品,经质量校正系数校正后,以甲醇溶解至1.00mg/ml,得双氯酚酸标准品储备液(储备液浓度=重量
×
质量校正系数/体积),储备液于医用低温箱长期保存。
31.配制标准曲线和质控样品的储备液为两份单独称量、配制的储备液。
32.(2.3.2)标准曲线样本配制:以50%甲醇水为溶剂,将双氯芬酸钠储备液stocka按下表配制标准曲线。
33.取上述标准曲线工作液,按下表配制标准曲线样本。
34.(2.3.3)质控样本配制:以50%甲醇水为溶剂,将双氯芬酸钠储备液stockb按下表配制标准曲线。
35.取上述质控溶液,按下表配制质控样本。
36.(2.3.4)内标溶液配制精密称取双氯芬酸-d4标准品,经质量校正系数校正后,以乙腈溶解至1.00mg/ml,得双氯酚酸-d4标准品储备液(储备液浓度=重量
×
质量校正系数/体积),储备液于医用低温箱长期保存。
37.以乙腈为溶剂,将双氯酚酸-d4储备液稀释至浓度为800ng/ml的内标溶液。
38.(2.3.5)样品预处理:上述标准样品、质控样品及其他验证样品混匀后取100μl,加入400μl内标溶液(double balnk样品加400μl乙腈),涡旋约1min,15400
±
10g,4℃,离心10min,取上清液进样分析。
39.(2.3.6)检测结果:
步骤三:生物相关性模型建立:(3.1)溶出曲线模型:使用uspiii法获得的溶出曲线,并进行模型拟合:以logistic函数拟合溶出曲线,相关系数r>0.99,满足要求;以此函数,计算各处方样品的t25、t50、t60、t65、t75、t80及t90。
40.(3.2)ivivc c级相关性模型建立:由于双氯芬酸钠缓释片的体内高变异性,以及存在肝肠循环,导致无法通过pk曲线反卷积得到吸收曲线,也就无法建立体内外a级相关性,因此寻找体内pk参数同体外溶出参数之间的关联性。
41.通过对比t25-t90与cmax ratio,发现t75的时间长短同cmax ratio大小趋势正好相反,具备建立c级相关的条件;以处方二,建立c级相关模型:cmax ratio=1350
÷
t75,并对其他处方进行预测,计算预测值与实测值的pe。
42.ivivc c级模型预测
探索cmax与t75的时间存在相关性,t75时间越短cmax越大;以处方二批次cmax数据,预测其他具有体内pk数据批次的cmax,并与真实值进行对比,pe≤15%,说明体外溶出同体内pk数据至少存在ivivc的c级相关。
43.步骤四:根据相关性模型,指导与原研药等效的处方选择,并预测处方与原研药等效的程度:根据ivivc模型,预测满足生物等效的产品t75值约为13.5h,通过调整处方中蜡质醇的含量,制备了满足t75时间的处方进行人体生物等效性(be)试验。
44.结果显示,根据模型调整后的处方,cmax ratio能满足80-125%的置信区间范围,满足生物等效。
45.以上具体实施方式仅用以说明本发明的技术方案而非限制,尽管参照实例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。