通过x射线照射和原始生殖细胞移植使鸡精子再生的方法
技术领域
1.本发明涉及通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,属于生物工程技术领域。
背景技术:
2.鸡是人类第一大蛋白质食物来源,但由于鸡卵生的特殊性,使得鸡的转基因和基因编辑育种远远滞后于哺乳动物。原始生殖细胞(primordial germ cells,pgcs)起源于鸡胚透明区的胚盘,血管形成后进入血液并开始血液循环。此时可以从胚胎血液中分离得到pgcs,并用于进一步的研究。在胚胎孵化第50-55小时,pgcs迁移到生殖脊,在此阶段,pgcs通常可以通过分离性腺并经过胰蛋白酶消化获得。pgcs可以将遗传信息传递给下一代,因此是获得转基因或基因编辑鸡的理想载体。近年来,人工核酸内切酶(engineered endonuclease,een)尤其是crispr/cas系统的发现,大大降低了人类改造生物基因组的难度。crispr/cas系统是是规律间隔成簇短回文重复序列及相关核酸酶系统(clustered regularly interspaced short palindromic repeat and crispr-associated nuclease system)的简称,是原核生物的一种获得性免疫系统,用于抵抗存在于噬菌体或质粒的外源遗传元件的入侵。为存在于大多数细菌与所有古菌中的一种防御机制,以消灭外来的质体或者噬菌体的dna,现广泛应用于基因工程中。该系统分为多种类型,其中最为人熟知和广泛使用的是由cas9核酸酶及其对应的grna构成的crispr/cas9系统。该系统便于设计和使用,并且成本低廉,一经问世便成为最受欢迎的基因组编辑技术。
3.目前鸡基因组改造的方法依赖于pgcs的分离和培养。pgcs在体外培养过程中通过转染逆转录病毒载体或dna得到人们感兴趣的基因编辑pgcs,而后将目的细胞通过显微注射重新注射入14~17期(孵化53~62小时,2.5天左右)的鸡胚背主动脉和卵黄动脉,而后将注射后的鸡胚及卵清、卵黄转移至代孕蛋壳中进行孵化,pgcs会随着血液循环定植到胚胎生殖脊,并进一步分化成熟为有功能的精子。但是pgcs的胚胎注射技术存在两个重要的缺陷:一是将经过遗传修饰的pgcs重新注射回鸡胚的背主动脉和卵黄动脉,由于此时胚胎仅孵化2.5天,血管细,需要在显微镜下进行显微注射,操作复杂,难度大。同时在注射后将鸡胚转移至代孕蛋壳的过程中卵黄囊及尿囊极易破裂,胚胎孵化率很低。二是pgcs注射到胚胎后需要重新定植到生殖脊,并与胚胎中自身的pgcs嵌合并产生嵌合体,需要经过一代杂交才能得到纯合体,进一步降低了产生基因编辑后代的效率,造成后期筛选子代过程工作量大,实验动物使用量大,成本高昂。
技术实现要素:
4.针对现有技术存在的不足,本发明提供了一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法。本发明的目的是提供一种通过向x射线处理后的绝育受体公鸡睾丸异体移植原始生殖细胞使其产生供体来源精子的方法。若该方法所使用的原始生殖细胞经过转基因或基因编辑等遗传改造即可用于产生转基因或基因编辑鸡。
5.本发明的技术方案如下:一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,包括步骤如下:(1)利用剂量为4~8gy的x射线在10~15天内连续照射受体公鸡睾丸5次,每次间隔2~3天,最后一次照射两周后开始采集精液,连续4次采集无精子,得到绝育受体公鸡;(2)将体外培养的原代原始生殖细胞注射至绝育受体公鸡的睾丸中,恢复7~8周后,受体公鸡重新产生有活性的供体原代原始生殖细胞来源的精子;(3)收集重新产生有活性精子的受体公鸡的精液,人工授精给母鸡制得受精蛋,孵化受精蛋,即可得供体原代原始生殖细胞的子代鸡。
6.根据本发明优选的,步骤(1)中,所述x射线的剂量为8gy。
7.根据本发明优选的,步骤(1)中,所述连续照射具体为:在14天内连续照射受体公鸡睾丸5次。
8.根据本发明优选的,步骤(2)中,所述原代原始生殖细胞(pgcs)为体外培养2~3代的原代原始生殖细胞。
9.进一步优选的,所述原代原始生殖细胞的体外培养方法如下:将供体鸡受精蛋在37.8℃下恒温孵化4.5天,剥离鸡胚生殖脊,分离得到原代原始生殖细胞;将原代原始生殖细胞在体外培养液中传代培养至细胞个数为1
×
106~5
×
106个/ml,得到经过扩增培养的原代原始生殖细胞;所述体外培养液的配方为:每50ml中,knockout-dmem:43ml;胎牛血清:5ml;鸡血清:1ml;β-巯基乙醇:20
µ
l;非必需氨基酸:200
µ
l;浓度为6ng/ml的scf:90
µ
l;浓度为4ng/ml的bfgf:130
µ
l;lif:50
µ
l;青链霉素:500
µ
l。
10.根据本发明优选的,步骤(2)中,所述原代原始生殖细胞的注射量为1
×
106~2
×
106个/250
µ
l;进一步优选的,所述原代原始生殖细胞的注射量为1.6
×
106个/250
µ
l。
11.根据本发明优选的,步骤(2)中,所述注射的具体方法如下:在超声仪引导下,于绝育受体公鸡睾丸4~5处不同位置分别注射原代原始生殖细胞。
12.本发明中的pgcs供体可以为白来航鸡,受体公鸡可以为五黑一绿公鸡。
13.本发明未详细说明的均可以按照现有技术进行。
14.本发明的有益效果在于:1、本发明通过向绝育受体公鸡异体移植原始生殖细胞(pgcs),使其重新产生精子,并在杂交后成功孵化为健康子代个体。相较于传统胚胎显微注射,本发明提供的方法消除了初代受体公鸡的生殖系嵌合,可以对所移植的原始生殖细胞(pgcs)进行遗传学改造直接产生对应的转基因或基因编辑的精子,具有操作简单,难度低,成功率高,胚胎孵化率高,成本低的优点。
15.2、本发明通过x射线照射产生绝育受体公鸡,整个过程操作简单,绝育效果明显,并且伤害小,在注射原代原始生殖细胞7~8周内即可恢复,重新产生精子,大大地缩短了转基因鸡的育种周期。
16.3、本发明提供的通过x射线照射和原代原始生殖细胞异体移植使鸡精子再生的方法,在应用于转基因或基因编辑鸡育种时,减少了初代受体公鸡的大量筛选工作,速度更快、效率更高,需要的动物更少,为转基因鸡的生产研究提供更多的理论基础和技术支撑。
附图说明
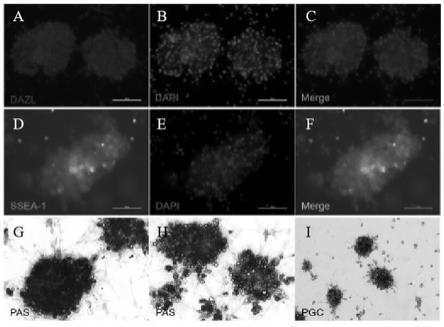
17.图1为不同标记的原代原始生殖细胞(pgcs)的免疫荧光染色结果图、pas染色结果图和正常培养细胞对照图。
18.图中,图1a-图1c为抗体dazl标记(红色,200倍);图1d-图1f为抗体ssea-1标记(绿色,200倍);图1g为pas染色,苏木素复染细胞核(紫色,200倍);图1h为pas染色,未染细胞核(紫色,200倍);图1i为正常培养的pgcs细胞(100倍)。
19.图2为受体公鸡睾丸定位及x射线照射后睾丸大小和睾酮的变化结果图。
20.图中,图2a为双侧睾丸ct定位图;图2b为pgcs移植前睾丸大小变化的超声图;图2c和2d分别为4gy剂量组、8gy剂量组和未处理组睾丸超声短轴和长轴的变化柱状图;图2e为4gy剂量组、8gy剂量组和未处理组在照射前后血液睾酮浓度的变化图。
21.图3为pgcs注射部位超声图,箭头所指位置为注射针头在睾丸中的位置。
22.图4为超声引导pgcs注射操作图。
23.图中,图4a为采用深部超声探测睾丸,对其进行定位;图4b-图4c为超声辅助下注射pgcs;图4d图中箭头所指位置为注射针孔的体表位置。
24.图5为绝育受体公鸡g12和白来航母鸡杂交及其杂交产生的f1代(2周龄)对比正常五黑一绿公鸡和白来航母鸡杂交及其杂交产生的f1代(2周龄)的示意图。
25.图6为绝育受体公鸡g12和白来航母鸡杂交所产生的f1代(6.5月龄)、f2代,以及正常五黑一绿公鸡和白来航母鸡杂交所产生子代的特征对照图。
26.图7为tvb基因的结构、实验例1中的精子测序和pcr电泳结果图。
27.图中,图7a为tvb基因结构,图7b为tvb基因测序,左图为五黑一绿公鸡测序结果,右图为绝育受体公鸡g12精子测序结果,图7c为绝育受体公鸡g12精子基因组tvb电泳图。
具体实施方式
28.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面通过实施例对本发明做进一步说明,但不限于此。同时下述实施例中所诉实验方法,如无特殊说明,均为常规方法;所述试剂和材料如无特殊说明均可从商业途径获得。
29.实施例1一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,包括步骤如下:(1)将白来航供体鸡受精蛋在37.8℃下恒温孵化4.5天,剥离鸡胚生殖脊,分离得到原代原始生殖细胞;将原代原始生殖细胞在体外培养液中传代培养至细胞个数为1
×
106个/ml,得到经过体外培养3代的原代原始生殖细胞(pgcs);所述体外培养液的配方为:每50ml中,knockout-dmem:43ml;胎牛血清:5ml;鸡血清:1ml;β-巯基乙醇:20
µ
l;非必需氨基酸:200
µ
l;scf(6ng/ml):90
µ
l;bfgf(4ng/ml):130
µ
l;lif:50
µ
l;青链霉素:500
µ
l;(2)通过ct对7~9月龄的五黑一绿公鸡的睾丸进行定位,利用剂量为8gy的x射线在14天内连续照射五黑一绿公鸡的睾丸5次,每次间隔3天,使其失去精子发生能力,睾丸成为pgcs产生精子的生物发生器,最后一次照射两周后开始采集精液,连续4次采集无精子,即得绝育受体公鸡g12;(3)将体外培养3代的pgcs,在超声仪引导下,于绝育受体公鸡睾丸5处不同位置,
按照1.6
×
106个/250
µ
l的注射量,分别注射原代原始生殖细胞,注射4周后开始采集精液进行显微镜镜检,检测有无精子产生,在注射8周后,发现绝育受体公鸡重新产生有活性的精子;(4)收集重新产生有活性的精子的受体公鸡的精液,人工授精给白来航母鸡制得受精蛋,孵化受精蛋,即可得到供体pgcs的子代鸡。
30.将本实施例体外培养的pgcs分别标记抗体dazl(红色)和ssea-1(绿色)进行免疫荧光染色,再将本实施例体外培养的pgcs进行pas染色,同时以正常培养细胞为对照,结果如图1所示。
31.由图1可知,经过体外扩增培养的细胞克隆具有pgcs特性,pgcs的细胞质中拥有大量的糖原颗粒沉积,糖原颗粒能够被pas染成紫红色。
32.本实施例pgcs注射过程如图4所示,注射部位超声结果如图3所示。
33.本实施例绝育受体公鸡g12和白来航母鸡杂交及其杂交产生的f1代(2周龄)对比正常五黑一绿公鸡和白来航母鸡杂交及其杂交产生的f1代(2周龄)的示意图如图5所示。由图5可知,本实施例通过pgcs异体移植使绝育公鸡g12再生精子成功,并产生后代。
34.实施例2一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,步骤如实施例1所述,不同之处在于,步骤(1)中所述x射线的剂量为4gy。
35.本实施例的受体公鸡的睾丸定位如图2a所示。
36.在本实施例和实施例1的受体公鸡pgcs移植前进行睾丸超声检测,睾丸大小变化如图2b所示。
37.将本实施例和实施例1的x射线照射后的受体公鸡进行睾丸超声检测,并以未处理的公鸡作为对照,4gy剂量组、8gy剂量组和未处理组睾丸超声短轴和长轴的变化如图2c和图2d所示。由图2c和图2d可知,4gy剂量组、8gy剂量组和对照组的睾丸大小没有显著差异,证明该方法有效地损害了受体公鸡的生殖细胞,但保持了睾丸的基本形态结构,说明已经成功建立受体公鸡的绝育模型,获得绝育受体公鸡。
38.测量本实施例和实施例1的受体公鸡x射线照射前后血液睾酮浓度,并以未处理的公鸡作为对照,结果如图2e所示。由图2e可知,本实施例和实施例1处理后的受体公鸡中血液睾酮浓度明显降低。
39.实施例3一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,步骤如实施例1所述,不同之处在于,步骤(1)中所述x射线的剂量为6gy。
40.实施例4一种通过x射线照射和原始生殖细胞移植使鸡精子再生的方法,步骤如实施例1所述,不同之处在于,步骤(2)中所述pgcs的注射量为2
×
106个/250
µ
l。
41.对比例1一种通过原始生殖细胞异体移植使鸡精子再生的方法,步骤如实施例1所述,不同之处在于,步骤(1)中利用γ射线进行照射,剂量与实施例1相同。
42.本对比例的绝育受体公鸡在注射pgcs后的15~18周才重新产生有活性的精子,是本发明方法时间的1.8~2.5倍,在应用于转基因鸡育种时的周期明显长于本发明。
43.实验例11、将实施例1所得的绝育受体公鸡g12与白来航母鸡的杂交f1代和正常乌黑一绿公鸡与白来航母鸡杂交f1代分别培养至6.5月龄,其特征对照图如图6所示。由图6可知,实施例1所得的五黑一绿受体公鸡g12与白来航母鸡的杂交子代具有完全的白来航鸡特征,白色羽毛、橙黄色皮肤和喙,与正常五黑一绿公鸡和白来航母鸡的杂交后代完全不同。再将f1代自交产生f2代,受体公鸡与白来航母鸡子代具备完全的白来航遗传特征,正常五黑一绿公鸡与白来航母鸡后代中出现黑色羽毛和爪的黑色被皮表型。说明本发明成功得到具有白来航鸡遗传特征的子代并且这些子代具有正常的繁殖能力。
44.2、采集实施例1所述绝育受体公鸡重新产生的有活性的精子,使用精子dna提取试剂盒提取精子基因组dna,利用tvb基因引物对精液dna进行pcr扩增,再连接t载体进行基因测序和电泳,利用五黑一绿受体公鸡和白来航鸡tvb基因a-g的点突变确定精液中是否包含pgcs基因来源的精子,结果如图7所示。本实验例中的tvb基因已经在文献biology of reproduction 2019,101(1),200-207中公开。
45.所述pcr扩增的tvb基因引物如下:tvb-f:5
′‑
tgctgtgggagctttaatgca-3
′
;tvb-r:5
′‑
gaggagctggaggagatttccaa-3
′
。
46.由图7可知,从基因层面上,本发明提供的方法成功获得了具有白来航鸡遗传特征的子代。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。