微晶态酶层的制备方法及含微晶态酶层的分析物传感器
1.相关申请的交叉引用
2.本技术要求以下专利申请的权益并要求其优先权:2021年7月8日提交的pct专利申请,申请号为pct/cn2021/105108。
技术领域
3.本发明主要涉及医疗器械领域,特别涉及一种微晶态酶层的制备方法及含微晶态酶层的分析物传感器。
背景技术:
4.正常人身体中的胰腺可自动监测人体血液中的葡萄糖含量,并自动分泌所需的胰岛素/胰高血糖素。而糖尿病患者胰腺的功能出现异常状况,无法正常分泌人体所需胰岛素。因此糖尿病是人体胰腺功能出现异常而导致的代谢类疾病,糖尿病为终身疾病。目前医疗技术尚无法根治糖尿病,只能通过稳定血糖来控制糖尿病及其并发症的发生和发展。
5.糖尿病患者在向体内注射胰岛素之前需要检测血糖。目前多数的检测手段可以对血糖连续检测,并将血糖数据实时发送至远程设备,便于用户查看,这种检测方法称为连续葡萄糖检测(continuous glucose monitoring,cgm)法。该方法需要检测装置贴在皮肤表面,将其携带的探头刺入皮下的组织液完成检测。但是,cgm装置的使用寿命往往受限于传感器的使用寿命,而且传感器的使用寿命主要受限于传感器酶层结构上酶分子的结构稳定性,当酶分子的活力中心结构被破坏,酶分子就会丧失了生物活力,从而影响传感器的使用寿命和检测准确性。
6.因此,现有技术亟需一种能使酶层结构稳定的制备方法及含有稳定的酶层结构,使用寿命较长、检测准确性高的分析物传感器。
技术实现要素:
7.鉴于以上现有技术存在的缺点,本发明实施例公开了一种微晶态酶层的制备方法,制备方法包括将电极放入酶蛋白膜液浸涂涂膜,液氮中静置,零摄氏度以下真空干燥,戊二醛水溶液中固化。通过上述步骤制备的微晶态酶层立体空间结构稳定牢固,而且在电极表面分布均匀,并且最大限度避免了酶蛋白在成膜过程中活力的损失。本发明实施例还公开了一种含微晶态酶层的分析物传感器,微晶态酶层通过前述方法制得,酶活力高,传感器对单位浓度底物的响应大,酶的立体空间结构稳定牢固,传感器的检测的准确性和稳定性好,并且能够有效延长传感器的使用寿命。
8.本发明公开了一种晶态酶层结构的制备方法,制备方法包括以下步骤:
9.步骤一:将电极放入酶蛋白膜液中采用浸涂涂膜;
10.步骤二:将涂膜后的电极放入液氮室中静置;
11.步骤三:对静置后的电极在低于零摄氏度的条件下进行真空干燥;
12.步骤四:将干燥后的电极放入含有戊二醛水溶液的固化室中进行固化。
13.根据本发明的一个方面,步骤一中涂膜的温度为30-45摄氏度,湿度为95%-100%。
14.根据本发明的一个方面,静置室的温度为零下40-80摄氏度。
15.根据本发明的一个方面,步骤三中的温度为零下10-20度。
16.根据本发明的一个方面,步骤四中的固化温度为30-45摄氏度中。
17.根据本发明的一个方面,制备方法还包括在步骤一之前的酶蛋白膜液制备步骤。
18.根据本发明的一个方面,酶蛋白膜液中添加有表面活性剂和稳定剂。
19.根据本发明的一个方面,电极表面设置有蜂窝结构。
20.根据本发明的一个方面,蜂窝结构的蜂窝直径为10-200nm,深度为50-500nm。
21.根据本发明的一个方面,蜂窝结构通过光刻技术和磁控溅射技术相结合制备得到。
22.根据本发明的一个方面,酶层为葡萄糖氧化酶层。
23.本发明还公开了一种含微晶态酶层的分析物传感器,包括基底和在基底上依次形成的电子传导层、抗干扰层,酶层、调节层和生物相容层,酶层通过前述方法制得。
24.根据本发明的一个方面,电子传导层包括多个电极,至少一电极表面设置有蜂窝结构。
25.根据本发明的一个方面,设置有蜂窝结构的电极为工作电极。
26.根据本发明的一个方面,工作电极为铂电极。
27.根据本发明的一个方面,抗干扰层和酶层为同一层。
28.与现有技术相比,本发明的技术方案具备以下优点:
29.本发明公开的含微晶态酶层通过以下步骤形成:
30.步骤一:通过浸涂的方式涂膜,使电极上的膜层保持水化状态,防止由于水分挥发而只留下膜液中的葡萄糖氧化酶干燥成膜;
31.步骤二:盛有液氮的低温室静置,低温静置可以使膜液层迅速冻结成型,为下一步低温真空干燥做准备;
32.步骤三:在低于零摄氏度的条件下真空干燥,膜液中的水冻结成冰,升华成水蒸气并被真空泵在短时间内抽出,实现快速脱去水分,可以有效降低局部浓缩效应的出现;酶蛋白在脱水过程中快速聚结结晶,并保持在膜液中的空间舒展结构状态,形成均匀的蛋白结晶体;
33.步骤四:在含有戊二醛水溶液固化室中固化,固化室为密闭空间,上述形成的均匀的蛋白结晶体在纳米铂形成的微孔内部进行填充,能与挥发的气态戊二醛充分反应,形成酶层结构。
34.通过上述步骤形成的微晶态酶层立体空间结构稳定牢固,而且在电极表面分布均匀,并且最大限度避免了酶蛋白在成膜过程中活力的损失。酶活力高,使含有微晶态酶层的分析物传感器对单位浓度底物的响应大,酶的立体空间结构稳定牢固,含有微晶态酶层的分析物传感器的检测的准确性和稳定性好,并且能够有效延长传感器的使用寿命。
35.进一步的,微晶态酶层形成在设置有纳米蜂窝结构的电极表面,微晶态酶层可以充分的填充到纳米铂形成的微孔结构中,使微晶态酶层立体空间结构稳定牢固,进一步避免了酶蛋白在成膜过程中活力的损失。
36.进一步的,由于微晶态膜层结构还能阻挡干扰物进入酶层形成干扰,从而提高传感器的抗干扰能力。因此,在微晶态酶层可以同时起到抗干扰层和酶层的作用。
37.进一步的,制备酶蛋白膜液时还可以加入表面活性剂和稳定剂,提高涂膜的均匀性,保护酶分子活力。
38.进一步的,微晶态酶层各步骤的制备环境之间还设置有缓冲区,能够有效降低在操作过程中外部大环境对控制区域的干扰,减少控制区与外部环境的热量、水汽及气体的交换,在更短的时间达到需要的稳定环境参数,使酶层分子在每一制备过程中都保持最佳状态。
39.进一步的,传感器基底的材料选自聚四氟乙烯(teflon)、聚乙烯(pe)、聚氯乙烯(pvc)、丙烯腈-丁二烯-苯乙烯共聚物(abs)、聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)、聚酰亚胺(pi)等中的一种或多种的组合,上述材料均具有优异的绝缘性能、不透水性和较高的机械强度,能延长传感器的使用寿命。
附图说明
40.图1为根据本发明实施例的分析物传感器工作电极的断面剖视图;
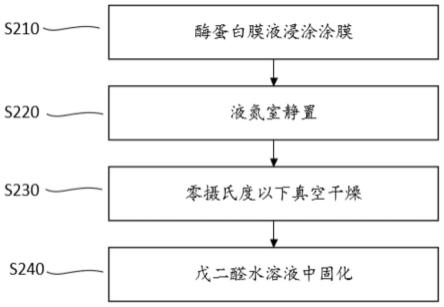
41.图2为根据本发明实施例的微晶态酶层的制备方法的流程图;
42.图3a和图3b分别为根据本发明实施例的含微晶态酶层的铂电极结构的侧视图和俯视图;
43.图4为根据本发明实施例的含有微晶态酶层传感器和含普通酶层结构传感器的电流响应与葡萄糖浓度关系对比图;
44.图5为根据本发明实施例的含有微晶态酶层传感器和含普通酶层结构传感器的电流响应随时间变化对比图。
具体实施方式
45.如前所述,现有技术的分析物传感器的酶层结构上酶分子的结构不稳定,酶分子的活力中心结构容易被破坏,酶分子容易丧失生物活力,从而影响传感器的使用寿命和检测准确性。
46.为了解决该问题,本发明提供了一种微晶态酶层的制备方法及含微晶态酶层的分析物传感器,酶层通过将电极放入酶蛋白膜液浸涂涂膜,液氮中静置,零摄氏度以下真空干燥,戊二醛水溶液中固化形成,形成的微晶态酶层立体空间结构稳定牢固,而且在电极表面分布均匀,并且最大限度避免了酶蛋白在成膜过程中活力的损失,从而提高了含微晶态酶层的分析物传感器的检测准确性和稳定性,并且能够有效延长传感器的使用寿命。
47.现在将参照附图来详细描述本发明的各种示例性实施例。应理解,除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不应被理解为对本发明范围的限制。
48.此外,应当理解,为了便于描述,附图中所示出的各个部件的尺寸并不必然按照实际的比例关系绘制,例如某些单元的厚度、宽度、长度或距离可以相对于其他结构有所放大。
49.以下对示例性实施例的描述仅仅是说明性的,在任何意义上都不作为对本发明及
其应用或使用的任何限制。这里对于相关领域普通技术人员已知的技术、方法和装置可能不作详细讨论,但在适用这些技术、方法和装置情况下,这些技术、方法和装置应当被视为本说明书的一部分。
50.应注意,相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义或说明,则在随后的附图说明中将不需要对其进行进一步讨论。
51.此外应理解,本发明中提到的一个或多个方法步骤并不排斥在所述组合步骤前后还可以存在其他方法步骤或在这些明确提到的步骤之间还可以插入其他方法步骤,除非另有说明;还应理解,本发明中提到的一个或多个设备/装置之间的组合连接关系并不排斥在所述组合设备/装置前后还可以存在其他设备/装置或在这些明确提到的两个设备/装置之间还可以插入其他设备/装置,除非另有说明。而且,除非另有说明,各方法步骤的编号仅为鉴别各方法步骤的便利工具,而非为限制各方法步骤的排列次序或限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容的情况下,当亦视为本发明可实施的范畴。
52.图1为根据本发明实施例的分析物传感器工作电极的断面剖视图。
53.传感器包括基底和在基底上依次形成的电子传导层a、抗干扰层b、酶层c、调节层d和生物相容层e。
54.基底111为具有优异绝缘性能的材料,主要来自无机非金属陶瓷、氧化硅玻璃和有机高聚物等,同时考虑到植入式电极的应用环境,还要求基底材料具有较高的不透水性和机械强度。优选的,基底的材料选自聚四氟乙烯(teflon)、聚乙烯(pe)、聚氯乙烯(pvc)、丙烯腈-丁二烯-苯乙烯共聚物(abs)、聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)、聚酰亚胺(pi)等中的一种或多种的组合。
55.电子传导层:
56.电子传导层a采用具有良好导电性和强化学惰性的材料。优选的,工作电极和对电极选自石墨电极、玻碳电极、贵金属等材料中的一种,参比电极选自ag/agcl或甘汞中的一种。考虑到良好的延展性和表面结构的稳定性的要求,贵金属电极如金电极、铂电极、银电极等成为较好的选择,进一步优选的,工作电极和对电极均为铂电极。
57.抗干扰层:
58.抗干扰层b位于酶层和电子传导层之间。干扰物是这样一类分子或物质,它们在电极表面会直接地或通过电子转移剂间接地发生电化学还原或电化学氧化,从而产生了一个干扰分析物检测的错误信号。例如,对于分析物为葡萄糖的测定来说,体内的常见干扰物有尿素、抗坏血酸、对乙酰氨基酚等等。
59.在本发明一个实施例中,抗干扰层b可以防止一个或多个干扰物渗透到电极周围的电解质中。比如,抗干扰层b会允许要在电极上测量的分析物(例如,过氧化氢)通过,而同时又可以防止其它物质(如潜在的干扰物质)的通过。在一个优选方案中,抗干扰层b可以是一层很薄的膜,旨在限制那些分子量大于34da的物质的扩散。
60.在本发明另一个实施例中,抗干扰层b可以是有机聚合物,它可以由有机硅烷和一种亲水性共聚物来制备。亲水性共聚物,更优选的是,聚乙二醇(peg),聚甲基丙烯酸2-羟乙基酯和聚赖氨酸。在优选的实施方案中,抗干扰层b的厚度范围可以是0.1微米或更小至10微米或更大。更优选的厚度范围是0.5微米到5微米。
61.在本发明另一个实施例中,抗干扰层b还可以与酶层c为同一层,下文将详述。
62.酶层:
63.酶层c上涂覆有活性酶,根据待检测分析物的种类,涂覆相应的活性酶。活性酶可以使待检测分析物产生某些化学反应,产生电子,根据不同的待检测分析物浓度,产生的电子数量不同,电子被电子传导层收集,从而形成不同的电流强度,因此电流强度信息可以用于表征分析物参数信息。
64.对于血糖检测来说,传感器用于检测体内的葡萄糖,最常用的酶是葡萄糖氧化酶(gox),葡萄糖氧化酶在体内作用的过程如下:
[0065][0066]
h2o2→
o2 2h
2e-[0067]
葡萄糖氧化酶酶层一般位于工作电极的表面,根据用户体内不同浓度的葡萄糖,葡萄糖氧化酶层可以相应得到不同数量的电子,从而产生不同的电流强度,根据电流强度信息可以得到宿主体内葡萄糖的参数信息。
[0068]
葡萄糖氧化酶的制备方法将在下文详述。
[0069]
调节层:
[0070]
调节层d位于酶层的上面。在本发明实施例中,酶层上涂覆葡萄糖氧化酶时,调节层d主要用来调控传递到酶层上的氧和葡萄糖的透过率。体液中葡萄糖含量(摩尔浓度)比氧的含量高出一个量级。然而,对于需要氧气参与的酶基传感器来说,需要供给过量的氧气以确保氧气不成为限制性物质,从而使传感器可以对葡萄糖浓度的变化线性响应,而不受氧分压的影响。也就是说,当氧气含量成为限制性因素时,葡萄糖氧监测反应的线性范围达不到预期的浓度范围。在酶层上面没有半透膜来调控氧和葡萄糖的透过时,传感器对葡萄糖线性响应的上限仅可达到约40mg/dl。然而,在临床情况下,血糖水平的线性响应上限需要到达约500mg/dl。
[0071]
调节层d主要起半透膜的作用,用来调控传递到酶层上的氧和葡萄糖的透过量,更明确地说,使氧过量成为非限制性因素。和不含调节层相比,含有调节层的传感器对葡萄糖线性响应的上限可以达到一个更高的水平。在一个优选实例中,调节层d的氧-葡萄糖透过率的比例可以到达200:1,这样就可以保证,对于皮下可能出现的各种葡萄糖和氧气浓度,都有足够的氧用于酶基反应的进行。
[0072]
在一个优选实例中,调节层d可以是有机聚合物,它可以由有机硅烷和一种亲水性共聚物来制备。亲水性共聚物,更优选的是,共聚或接枝的聚乙二醇(peg)。其他可能用到的亲水性共聚物,包括但不限于其他的二醇,如丙二醇,酯,酰胺,碳酸酯和聚丙二醇。利用有机硅聚合物,可以明显地提高氧的传输,同时有效地控制葡萄糖的透过。在优选的实施方案中,调节层d的厚度范围可以是1微米或更小至50微米或更大,更优选的厚度范围是1微米到10微米。
[0073]
生物相容层:
[0074]
生物相容层e位于电极的最外面,旨在消除机体对异物的排斥反应并减少植入电极周围屏蔽细胞层的形成。
[0075]
在一个优选实例中,生物相容层e可以由有机硅烷和一种亲水性共聚物来制备。亲
水性共聚物,更优选的是,共聚或接枝的聚乙二醇(peg)。其他可能用到的亲水性共聚物,包括但不限于其他的二醇,如丙二醇,酯,酰胺,碳酸酯和聚丙二醇。
[0076]
在优选的实施方案中,生物相容层e的厚度范围可以是1微米或更小至100微米或更大。更优选的厚度范围是10微米到30微米。
[0077]
在本发明实施例中,基底11的厚度为0.01~0.8mm,各电极为长方形,各电极宽度为0.01~1mm,面积为0.1~2mm2。
[0078]
在本发明的其他实施例中,各电极表面还设有碳纳米管层修饰层。利用碳纳米管特有的机械强度、高比表面积、快速电子传递效应和化学稳定性,在已成型的电极表面,通过物理吸附、包埋或者共价键和等方式,将碳纳米管修饰到电极表面以提高电子传递速度,同时由于其比表面积大能够作为一种优良的催化剂(酶)载体。所述碳纳米管层修饰层可通过nafion溶液分散法、共价固定法等固定于电极表面。
[0079]
图2为根据本发明实施例的微晶态酶层的制备方法的流程图。
[0080]
酶层结构的制备方法如下:
[0081]
步骤200:酶蛋白膜液制备。
[0082]
将商品化葡萄糖氧化酶(sigma公司)配制成100mg/ml水溶液,其中,含有0.1-0.5%表面活性剂,如f127、吐温20等,0.1-1%稳定剂,如海藻糖、bsa等。添加表面活性剂和稳定剂可以提高涂膜的均匀性,保护酶分子活力。
[0083]
步骤210:酶蛋白膜液浸涂涂膜。
[0084]
温度控制在30-45摄氏度,湿度控制在95%-100%的条件下,将电极缓慢匀速浸入上述配制好的酶液中1-5秒,然后缓慢匀速提出。
[0085]
采用不同涂膜工艺,如喷涂、滴涂、圈涂等,对电极进行涂膜,电极表面都会涂覆一层酶蛋白膜液,但本发明实施例中,采用浸涂的方式可以保证电极上的膜层水化状态,即在95%-100%高湿状态下,保证电极上涂布的含有葡萄糖氧化酶的溶液形成一层水膜,保持这层水膜可以防止由于水分挥发而只留下膜液中的葡萄糖氧化酶干燥成膜。
[0086]
步骤220:液氮室静置。
[0087]
将上述涂过膜的电极放入盛有液氮的温度在零下40-80摄氏度的低温室静置10-60秒。
[0088]
低温静置可以使膜液层迅速冻结成型,为下一步低温真空干燥做准备。
[0089]
步骤230:零摄氏度以下真空干燥。
[0090]
将上述经过液氮处理的电极在低于零摄氏度的低温室进行抽真空(《1帕)干燥30-180秒。优选的,低温条件为零下10-20摄氏度。
[0091]
不同的脱水干燥条件,如室温晾干、加热到37摄氏度或者45摄氏度烘干或者在低温如零下20摄氏度冷冻干燥等,会影响膜层中酶蛋白的结构状态,以及酶蛋白成膜结构及膜层厚薄均匀度,酶蛋白成膜结构包括酶蛋白成膜内孔径的大小等,可以被酶蛋白舒展或收缩状态直接影响。当膜液干燥的速度缓慢时,会导致膜液局部浓缩效应出现,因而会导致酶蛋白在电极表面分布不均,当电极表面酶蛋白分布不均时,一方面会导致酶蛋白膜在工作时发生膨胀不均进而出现破裂,影响传感器的稳定性;另一方面,会导致同等电极表面积涂布酶蛋白的量出现差异,从而影响传感器对同等浓度反应底物的响应信号强度。
[0092]
在本发明实施例中,经过低温静置后,膜液中的水冻结成冰,在真空环境下,升华
成水蒸气并被真空泵在短时间内抽出,实现快速脱去水分,可以有效降低局部浓缩效应的出现。酶蛋白在脱水过程中快速聚结结晶,并保持在膜液中的空间舒展结构状态,形成均匀的蛋白结晶体。
[0093]
步骤240:戊二醛水溶液中固化。
[0094]
将上述干燥处理电极放入固化室进行固化,固化室含有戊二醛水溶液,戊二醛从水溶液中挥发,在固化室形成戊二醛氛围,温度30-45摄氏度,固化时间30分钟-3小时。优选的,固化时间为35-40摄氏度,固化时间为2小时。
[0095]
戊二醛在密闭空间内挥发成气态并与酶蛋白进行化学反应,形成一层空间结构稳定的酶层结构。
[0096]
在本发明实施例中,酶层分子为设置在工作电极铂电极上的葡萄糖氧化酶,铂电极表面设置有纳米级的蜂窝空间结构,可利用光刻技术和磁控溅射技术相结合制备出纳米尺级峰窝空间结构,具体的,在本发明实施例中,蜂窝直径为10-200nm,深度为50-500nm。经低温真空干燥处理后形成的均匀的蛋白结晶体在纳米铂形成的微孔内部进行填充,在与戊二醛进行充分反应后,由于纳米蜂窝结构的支撑,使形成的酶层的立体空间结构稳定牢固,进一步避免了酶蛋白在成膜过程中活力的损失。
[0097]
根据本发明实施例的方法制备的含微晶态酶层的铂电极结构如图3a和3b所示,图3a为含微晶态酶层的铂电极结构的侧视图,图3b为含微晶态酶层的铂电极结构的俯视图。固化微晶态酶均匀的分布在电极表面,同时充满了铂电极表面的蜂窝纳米孔结构。这种在低温条件下,在纳米铂微孔结构中形成的微晶态酶层立体空间结构稳定牢固,而且在电极表面分布均匀,并且最大限度避免了酶蛋白在成膜过程中活力的损失。酶活力越高,传感器对单位浓度底物的响应越大,酶蛋白的立体空间结构越稳定牢固,传感器的检测的准确性和稳定性越好,并且能够有效延长传感器的使用寿命。
[0098]
当在纳米铂微孔结构中酶蛋白再次处于水化环境中,酶蛋白的多肽空间结构由于铂纳米微孔的结构支撑,不会由于自身的溶胀或者各种小分子进入而导致其空间结构被破坏,酶的活力中心结构被很好的保护起来,所以能够让酶进行长时间稳定发挥作用。同时,这种均匀细密的微晶态膜层结构还能阻挡干扰物进入酶层形成干扰,从而提高传感器的抗干扰能力。因此,在本发明实施例中,微晶态酶层可以同时起到抗干扰层和酶层的作用。
[0099]
需要说明的是,在本发明实施例中,由于在不同的步骤中均需设定不同的条件,如湿度、温度等,因此,除酶蛋白膜液的制备之外,其他每一步骤之间均设置有缓冲区,由于低温环境、饱和湿度环境和真空环境都很容易受到外部环境干扰,而且需要对设备状态进行严格控制,才能达到需要的低温、湿度和真空度参数要求,因此,缓冲区能够有效降低在操作过程中外部大环境对控制区域的干扰,减少控制区与外部环境的热量、水汽及气体的交换,在更短的时间达到需要的稳定环境参数,使酶层分子在每一制备过程中都保持最佳状态。
[0100]
本发明实施例中还制备了含普通酶层结构的传感器,普通酶层的制备条件如下:采用上述酶蛋白膜液在室温下对电极进行浸涂,电极在室温下自然晾干30分钟,然后放入固化室进行固化,固化室含有戊二醛水溶液,温度37摄氏度,固化时间2小时。在37摄氏度水浴、搅拌速度250转/分钟条件下,同时测试含微晶态酶层的传感器和普通酶层结构的传感器对不同葡糖糖浓度的电流响应。传感器电流响应与葡萄糖浓度关系如图4所示。结果表
明,在含微晶态酶层的传感器在0-1mmol/l的葡萄糖浓度范围内的电流响应均大于含普通酶层结构的传感器的电流响应,且葡萄糖浓度越大,电流响应差别越大。传感器的电流响应与传感器检测的准确性成正比,电流响应越大,传感器检测准确性越高。
[0101]
本发明实施例中还在相同的条件下,即在37摄氏度水浴、搅拌速度250转/分钟条件下,测试了含微晶态酶层的传感器和普通酶层结构的传感器在1mmol/l的葡萄糖溶液中24h的电流响应变化,测试结果如图5所示。结果表明,微晶态酶层的传感器和普通酶层结构的传感器均在测试的第30分钟左右电流响应达到最大值,含微晶态酶层的传感器的电流响应值为296na,含普通酶层结构的传感器的电流响应值为146na,在24h后,含微晶态酶层的传感器的电流响应值为228na,约为电流响应峰值的77%,而含普通酶层结构的传感器的电流响应值为33na,仅为电流响应峰值的26%,说明含微晶态酶层的传感器的检测稳定好,能够有效延长传感器的使用寿命。且含微晶态酶层的传感器在24h后的电流响应值远大于含普通酶层结构的传感器在24h后的电流响应值,进一步说明含微晶态酶层的传感器的检测准确性高于含普通酶层结构的传感器的检测准确性。
[0102]
综上所述,本发明公开了一种微晶态酶层的制备方法及含微晶态酶层的分析物传感器,酶层通过酶蛋白膜液涂膜,静置,真空干燥,固化形成,形成的微晶态酶层立体空间结构稳定牢固,而且在电极表面分布均匀,并且最大限度避免了酶蛋白在成膜过程中活力的损失,从而提高了含微晶态酶层的分析物传感器的检测准确性和稳定性,并且能够有效延长传感器的使用寿命。
[0103]
虽然已经通过示例对本发明的一些特定实施例进行了详细说明,但是本领域的技术人员应该理解,以上示例仅是为了进行说明,而不是为了限制本发明的范围。本领域的技术人员应该理解,可在不脱离本发明的范围和精神的情况下,对以上实施例进行修改。本发明的范围由所附权利要求来限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
