1.本发明涉及生物化学材料技术领域,特别涉及一种兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针及其应用。
背景技术:
2.随着纳米技术的蓬勃发展,高度集成多种功能的纳米系统具有巨大的推动纳米医学发展的潜力。将协同诊断和治疗功能集成到一个纳米平台中的光疗技术,可以实现实时诊断和原位高特异性治疗。在各种成像技术中,近红外二区(nir-ii)荧光成像凭借减小的光子散射、微弱的自发荧光和在深部组织的高信噪比,可以同时对生物体的生理过程进行定性和定量研究,为研究人员更好地了解疾病机制、筛选药物和进行精准的临床诊断开辟了一种具有重要意义的新模式。特别地,nir-ii强发射的有机材料,因为合成可控性、易于修饰、确定的化学结构和生物降解性,是现代精准医学在体内成像和临床治疗中的重要组成部分。
3.活性氧物种(reactive oxygen species,ros)或热能用于光动力疗法(photodynamic therapy,pdt)和光热疗法(photothermal therapy,ptt)是癌症患者的热门选择。开发兼具近红外光诊断与治疗功能于一身的pdt和ptt效果的新型协同光疗剂对于实现高效的1 1》2协同增强癌症治疗具有重要意义。
技术实现要素:
4.有鉴于此,本发明目的在于提供一种兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针及其应用,本发明提供的荧光探针兼具近红外光诊断与治疗功能于一身,具有良好的光动力、光热协同治疗效果。
5.为了实现上述发明目的,本发明提供以下技术方案:
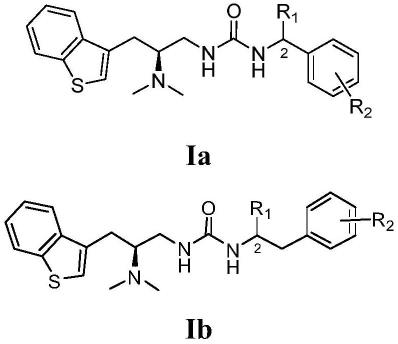
6.本发明提供了一种兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针,具有式i-a或式i-b所示结构;
[0007][0008]
式i-a或式i-b中,n=1~6。
[0009]
优选的,具有式i-a1或式i-b1所示结构;
[0010][0011]
本发明提供上述兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针的制备方法,包括以下步骤:
[0012]
将具有式ii所示结构的化合物、具有式iii-a或式iii-b所示结构的萘甲醛类化合物、有机碱催化剂和有机溶剂混合,进行脑文格反应,得到具有式i-a或式i-b所示结构的兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针;
[0013][0014]
优选的,所述具有式ii所示结构的化合物与萘甲醛类化合物的摩尔比为1:2~4。
[0015]
优选的,所述有机碱催化剂为哌啶和/或醋酸铵;所述具有式ii所示结构的化合物与有机碱催化剂的摩尔比为1:0.5~1.5。
[0016]
优选的,所述脑文格反应的温度为25~70℃,时间为12~36h。
[0017]
本发明提供了上述荧光探针在制备抗肿瘤药物或制备抗肿瘤诊断试剂中的应用。
[0018]
本发明提供了上述荧光探针在非治疗目的的癌细胞成像中的应用。
[0019]
本发明提供了一种荧光探针水分散纳米颗粒的制备方法,包括以下步骤:
[0020]
将上述荧光探针与包覆剂、有机溶剂混合,得到混合液;
[0021]
将所述混合液与水混合,进行超声共沉淀,得到荧光探针水分散纳米颗粒。
[0022]
优选的,所述包覆剂为聚乙二醇-二硬脂酰基磷脂酰乙醇胺、聚苯乙烯-g-聚乙二醇、甲氧基peg聚乳酸-羟基乙酸共聚物和泊洛沙姆f127中的一种或几种。
[0023]
本发明提供了一种兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针,具有式i-a或式i-b所示结构。本发明提供的荧光探针具有平面结构,在形成纳米粒子聚集态时,能够对癌细胞进行近红外二区荧光成像;本发明提供的荧光探针具有较大的斯托克斯位移,能够有效避免自吸收,降低背景干扰,且具有强抗光漂白能力,可长时示踪;同时,本发明提供的荧光探针有较大的共轭结构以及n杂原子掺杂,其具有活性氧与光热产生能力,能够在光激发下产生一型超氧阴离子自由基与热,可用于缺氧条件下光动力/光热协同作用杀伤癌细胞,构建兼具近红外光诊断与治疗功能于一身的诊疗试剂。
[0024]
本发明提供了上述兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针的制备方法,此法步骤简单,易于操作,适合工业化生产。
附图说明
[0025]
图1为4mnvdppnps与6mnvdpp nps的透射电子显微镜(tem)图;
[0026]
图2为4mnvdppnps与6mnvdpp nps在水相中的紫外吸收图;
[0027]
图3为4mnvdppnps与6mnvdpp nps在水相中的荧光发射图;
[0028]
图4为4mnvdpp nps与6mnvdpp nps在水相中与活性氧捕获剂dcfh混合溶液在538nm处荧光值随光照时间的变化情况;
[0029]
图5为4mnvdppnps与6mnvdppnps在水相中与超氧阴离子捕获剂dhr123混合溶液在530nm处荧光值随光照时间的变化情况;
[0030]
图6为不同浓度的4mnvdppnps在808nm激光照射下的光热性能及其光热转换效率计算;
[0031]
图7为6mnvdpp nps在808nm激光照射下,光照循环十次的光热稳定性测试;
[0032]
图8为不同浓度的6mnvdppnps在808nm激光照射下,光热性能及其光热转换效率计
算;
[0033]
图9为6mnvdppnps对hela细胞进行共定位荧光成像分析测试;
[0034]
图10为6mnvdpp nps对4t1细胞进行光动力/光热协同杀伤分析测试。
具体实施方式
[0035]
本发明提供了一种兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针,具有式i-a或式i-b所示结构;
[0036][0037]
式i-a或式i-b中,n=1~6,优选为2~5,更优选为3~4。
[0038]
在本发明中,所述兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针优选具有式i-a1或式i-b1所示结构;
[0039][0040]
本发明提供了上述兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针的制备方法,包括以下步骤:
[0041]
将具有式ii所示结构的化合物、具有式iii-a或式iii-b所示结构的萘甲醛类化合物、有机碱催化剂和有机溶剂混合,进行脑文格反应,得到具有式i-a或式i-b所示结构的兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针;
[0042][0043]
在本发明中,所述具有式ii所示结构的化合物与萘甲醛类化合物的摩尔比优选为1:2~4,更优选为1:3。
[0044]
在本发明中,所述有机碱催化剂优选为哌啶和/或醋酸铵;所述具有式ii所示结构的化合物与有机碱催化剂的摩尔比优选为1:0.5~1.5,更优选为1:1。
[0045]
本发明对所述有机溶剂的种类没有特殊的限定,采用常规的溶剂,能够溶解原料,保证脑文格反应顺利进行即可,具体如乙醇。本发明对所述有机溶剂的用量没有特殊限定,能够使反应顺利进行即可。
[0046]
在本发明中,所述脑文格反应优选在保护气体氛围下进行,所述保护气体氛围优选为氮气或氩气,更优选为氩气。
[0047]
在本发明中,所述脑文格反应的温度优选为25~70℃,更优选为50~70℃,进一步优选为60℃。在本发明中,所述脑文格反应的时间优选为12~36h,更优选为18~24h。本发
明优选使用tlc板(即薄层色谱点板)对反应进行监控。
[0048]
所述脑文格反应后,本发明优选对所得脑文格反应液进行后处理,所述后处理优选包括以下步骤:
[0049]
对所述脑文格反应液进行萃取和浓缩,得到浓缩液;
[0050]
对所述浓缩液进行柱层析分离,得到具有式i-a或式i-b所示结构的荧光探针纯品。
[0051]
在本发明中,所述萃取优选包括如下步骤:待反应体系冷却至室温后,将水加入到脑文格反应液中,用二氯甲烷对水相进行多次萃取,每次萃取所用二氯甲烷与水的体积比优选为1:1。
[0052]
本发明对所述浓缩的方式没有特殊的要求,使用本领域技术人员熟知的浓缩方式即可。
[0053]
在本发明中,所述柱层析分离的洗脱剂优选为二氯甲烷和石油醚的混合液,其中二氯甲烷和石油醚的体积比优选为1:1
[0054]
柱层析完成后,本发明优选将柱层析产物中的溶剂去除,得到式i-a或式i-b所示结构的荧光探针纯品。本发明对所述溶剂去除的方式没有特殊限定,采用常规的去除溶剂的方式即可,如旋蒸。
[0055]
本发明提供了上述荧光探针或上述制备方法制备得到的荧光探针在制备抗肿瘤药物或制备抗肿瘤诊断试剂中的应用。在本发明中,所述肿瘤优选为乳腺肿瘤细胞、肝癌细胞、宫颈癌细胞或膀胱癌细胞。
[0056]
本发明提供了上述荧光探针或上述制备方法制备得到的荧光探针在非治疗目的的癌细胞成像中的应用。
[0057]
本发明提供了一种荧光探针水分散纳米颗粒的制备方法,包括以下步骤:
[0058]
将上述荧光探针与包覆剂、有机溶剂混合,得到混合液;
[0059]
将所述混合液与水混合,进行超声共沉淀,得到荧光探针水分散纳米颗粒。
[0060]
在本发明中,所述包覆剂优选为聚乙二醇-二硬脂酰基磷脂酰乙醇胺、聚苯乙烯-g-聚乙二醇、甲氧基peg聚乳酸-羟基乙酸共聚物和泊洛沙姆f127中的一种或几种。在本发明中,所述荧光探针与包覆剂的质量比优选为1:5~8,更优选为1:5~6。
[0061]
在本发明中,所述有机溶剂优选为四氢呋喃。
[0062]
在本发明中,所述超声共沉淀的功率优选为100~200w,更优选为150w,时间优选为3~10min,更优选为5min。
[0063]
在本发明中,所述荧光探针水分散纳米颗粒的粒径优选为40~80nm,更优选为50~70nm。
[0064]
本发明将荧光探针制备成水分散纳米颗粒,有利于对癌细胞进行近红外荧光成像。
[0065]
下面结合实施例对本发明提供的兼具近红外二区荧光成像和光动力/光热协同杀伤癌细胞活性的荧光探针及其应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0066]
实施例1
[0067]
将化合物1(0.28g,1mmol)和4-甲氧基-1-萘甲醛(0.75g,4mmol)溶解在20ml无水
乙醇中。将哌啶(0.069g,0.81mmol)滴加到溶液中,混合物在60℃下回流12h。将溶液冷却至室温后,真空蒸发溶剂,将残余物溶解在二氯甲烷(20ml)中并用水(20ml)萃取。将有机相合并后用无水na2so4干燥,并通过硅胶柱色谱法使用石油醚/二氯甲烷1:1作为洗脱剂进行纯化。粗产物用正己烷重结晶,得到红棕色粉末(产率:0.52g,85%),记为4mnvdpp。
[0068][0069]
对所得固体进行表征,具体数据如下:1h nmr(500mhz,cdcl3)δ9.75(d,j=14.2hz,2h),8.68(d,j=8.5hz,2h),8.33(d,j=8.4hz,2h),7.89(s,2h),7.76(t,j=7.4hz,2h),7.58(t,j=7.5hz,2h),6.96(d,j=15.4hz,2h),6.89(d,j=8.2hz,2h),4.09(s,6h),3.96(t,j=7.4hz,4h),1.81
–
1.75(m,4h),1.56
–
1.48(m,4h),1.04(t,j=7.4hz,6h).
13
c nmr(126mhz,cdcl3)δ161.66,157.52,144.58,139.28,132.74,128.09,126.25,125.64,124.74,123.76,122.32,113.15,108.85,104.03,55.71,40.46,32.31,20.25,13.93.hrms[m h]
calcd 613.3066,found 613.3057.
[0070]
实施例2
[0071]
将化合物1(0.28g,1mmol)和6-甲氧基-2-萘甲醛(0.75g,4mmol)溶解在20ml无水乙醇中。将哌啶(0.069g,0.81mmol)滴加到溶液中,混合物在60℃下回流24h。将溶液冷却至室温后,真空蒸发溶剂,将残余物溶解在二氯甲烷(25ml)中并用水(25ml)萃取。合并有机相并用无水na2so4干燥,并通过硅胶柱色谱法使用石油醚/二氯甲烷1:3作为洗脱剂进行纯化。粗产物用正己烷重结晶,得到深蓝色粉末(产率:0.40g,65%),记为6mnvdpp。
[0072][0073]
对所得固体进行表征,具体数据如下:
[0074]1h nmr(500mhz,cdcl3)δ9.10(d,j=15.8hz,2h),8.05(s,2h),7.79
–
7.75(m,6h),7.19(dd,j=8.9,2.4hz,2h),7.15(d,j=2.1hz,2h),6.96(d,j=15.8hz,2h),3.97(s,6h),3.92(t,j=7.4hz,4h),1.81
–
1.72(m,4h),1.54
–
1.49(m,4h),1.04(t,j=7.4hz,6h).
13
c nmr(126mhz,cdcl3)δ161.54,158.89,144.64,143.49,135.59,131.74,130.33,128.98,127.49,123.71,119.44,112.62,109.10,106.13,55.41,40.52,32.25,20.27,13.90.hrms[m h]
calcd613.3066,found 613.3068.
[0075]
根据上述表征数据可知得到的具有近红外荧光成像和光动力/光热协同杀伤癌细
胞活性的荧光探针4mnvdpp和6mnvdpp分别为如式i-a1、式i-b1所示结构。
[0076]
性能测试
[0077]
(1)4mnvdpp nps与6mnvdpp nps的透射电子显微镜测试:将4mnvdpp nps与6mnvdpp nps的水溶液预先滴到铜网里,待干燥后将铜网放于透射电子显微镜上样杆中并插入仪器样品仓,进行电子显微成像。结果如图1所示。
[0078]
图1为4mnvdpp nps与6mnvdpp nps的透射电子显微镜(tem)图。其中,(a)为4mnvdpp的tem图,(b)为6mnvdpp的tem图。
[0079]
从图1可以看出,4mnvdpp与6mnvdpp纳米颗粒具有均匀的球形形态,其平均直径分别为50nm和75nm。
[0080]
(2)4mnvdpp nps与6mnvdpp nps的紫外吸收光谱测试,具体步骤如下:
[0081]
将4mnvdpp nps与6mnvdpp nps的水溶液分别配置成10μm的测试浓度,放于紫外分光光度计进行紫外吸收光谱的采集。结果如图2所示。
[0082]
图2为4mnvdpp nps与6mnvdpp nps在水中的紫外吸收图。从图2可以看出,4mnvdpp nps与6mnvdpp nps在近红外区具有强吸收能力。其中,6mnvdpp纳米颗粒的最大摩尔消光系数为3.72
×
104m-1
cm-1
(在764nm处),大于4mnvdpp纳米颗粒的摩尔吸光系数,表现出更强的近红外光捕获能力。
[0083]
(3)4mnvdpp nps与6mnvdpp nps的荧光光谱测试,具体步骤如下:
[0084]
将4mnvdpp nps与6mnvdpp nps的水溶液分别配置成10μm的测试浓度,放于荧光光谱仪进行荧光发射光谱的采集。结果如图3所示。
[0085]
图3为4mnvdpp nps与6mnvdpp nps在水相中的荧光发射图。从图3可以看出,6mnvdpp nps显示出典型的nir-ii荧光发射,在水溶液中其发射尾带延伸至1300nm,可以大大降低来自激发光的背景干扰,更适合深部组织的高对比度nir-ii荧光成像。
[0086]
(4)4mnvdpp nps与6mnvdpp nps的活性氧产生能力测试,具体步骤如下:
[0087]
2',7'-二氯二氢荧光素(dcfh)用于检测活性氧。将50μl dcfh(浓度:40μm)与4mnvdpp nps或6mnvdppnps水溶液(工作浓度:10μm)混合。通过在50μl dcfh中加入2ml pbs作为对照组。之后,将混合物暴露于808nm辐照(0.5w/cm2),并在荧光仪(激发波长:489nm)中每5秒记录约530nm的荧光强度。
[0088]
图4为4mnvdpp nps与6mnvdpp nps在水相中与活性氧捕获剂dcfh混合溶液在538nm处荧光值随光照时间的变化情况。由图4可以看出,仅dcfh存在时,溶液的信号强度在808nm激光照射120秒后显示出可忽略不计的变化。相比之下,溶液的荧光信号强度在4mnvdpp nps或6mnvdpp nps存在时逐渐增加,说明4mnvdpp nps和6mnvdpp nps表现出优异的ros生产能力。
[0089]
(5)4mnvdpp nps与6mnvdpp nps的超氧阴离子(o2·-)产生能力测试,具体步骤如下:
[0090]
以二氢罗丹明123(dhr123)作为指示剂检测溶液中的o2·-。当系统中产生o2·-时,dhr123将被氧化并在530nm处发出强荧光。将10μm 4mnvdpp nps或6mnvdpp nps溶解在含有60μm dhr 123的2ml pbs中。然后将混合物置于比色皿中并用808nm激光(0.5w/cm2)照射。用荧光分光光度计(激发波长:480nm)记录样品在530nm处的荧光变化。结果如图5所示。
[0091]
图5为4mnvdpp nps与6mnvdpp nps在水中与超氧阴离子捕获剂dhr123混合溶液在
530nm处荧光值随光照时间的变化情况。当溶液在这两种纳米颗粒存在下暴露于808nm激光照射时,dhr123探针的荧光信号大幅提升,这表明纳米颗粒具有o2
·-产生能力。
[0092]
(6)4mnvdpp nps的光热性能及其光热转换效率测试,具体步骤如下:
[0093]
光热性质测试:不同浓度的4mnvdpp nps水溶液(0μm和100μm),用0.5w/cm2808 nm激光照射3min,监测光照期间的温度变化。计算4mnvdpp nps的光热转换效率。当温度达到平台时,将4mnvdpp nps暴露于808nm 0.5w/cm2的激光下照射3min,然后关闭激光器,将溶液冷却至室温。在此过程中,每隔15s记录溶液温度变化。结果如图6所示。
[0094]
图6为不同浓度的4mnvdpp nps在808nm激光照射下的光热性能及其光热转换效率计算。随着浓度从0增加到100μm,4mnvdpp nps仅表现出约3℃的轻微温度升高,其光热转换效率为19%。
[0095]
(7)6mnvdpp纳米颗粒的光热性能及其光热转换效率测试,具体步骤与4mnvdpp nps的测试步骤相同。结果如图7所示。
[0096]
图7为6mnvdpp nps在808nm激光照射下,光照循环十次的光热稳定性测试;随着浓度从0增加到100μm,6mnvdpp nps的最高温度可以从23.6℃到71.0℃,这表明6mnvdpp nps表现出比4mnvdpp nps更高的温度增量,其光热转换效率为89%。
[0097]
(8)6mnvdpp nps的光热稳定性能测试,具体步骤如下:
[0098]
用0.5w/cm2808 nm激光照射100μm的6mnvdpp nps水溶液3min,之后降温7min,循环10次,监测这个过程中温度的变化。结果如图8所示。
[0099]
图8为6mnvdpp nps暴露于808nm 0.5w/cm2的激光下的光热稳定性能测试。结果表明6mnvdpp nps表现出优异的光热稳定性能,循环10次,仍然保持稳定的温度增量,相较于已经商业化的吲哚菁绿具有明显的光热稳定性能优势。
[0100]
(9)6mnvdpp nps的细胞共定位测试,具体步骤如下:
[0101]
将人宫颈癌(hela)细胞接种在共聚焦显微镜培养皿中并孵育至少24小时。然后加入6mnvdpp nps(30μm)孵育8小时。用pbs洗涤细胞3次,并在6mnvdpp nps处理后加入bodipy
tm 493/503(1μm)再孵育30分钟。然后,用共聚焦显微镜(zeiss)以顺序扫描模式观察细胞。6mnvdpp nps(λ
ex
=543nm,λ
em
=长通570nm)。bodipy
tm 493/503(λ
ex
=488nm,λ
em
=495-620nm)。结果如图9所示。
[0102]
图9为6mnvdpp nps对hela细胞进行共定位荧光成像分析测试。共聚焦成像结果证实,6mnvdpp nps的红色荧光与商业化的脂滴特异性探针(bodipytm 495/503)的绿色荧光重叠。表明6mnvdpp nps可以进入癌细胞并以高特异性积聚在脂滴中。
[0103]
(10)6mnvdpp nps对人乳腺癌细胞(4t1)的光动力/光热协同杀伤能力进行测试,具体步骤如下:
[0104]
将4t1细胞接种在96孔板上,在37℃、5%co2、20%o2的加湿培养箱中,rpmi 1640培养基(含10%fbs、1%青霉素/链霉素)中进行培养。然后,收获对数生长期的细胞,并以5
×
103个细胞的密度接种在96孔板中,孵育24小时。随后,将培养基更换为含有不同浓度6mnvdpp nps的新鲜培养基。进一步孵育20小时后,将细胞暴露于808nm激光照射(0.5w/cm2)15分钟。同时,没有激光照射的6mnvdpp nps孵育的细胞作黑暗对照组。进一步孵育4小时后,取出培养基并用pbs洗涤3次。然后将细胞与含有10%cck-8的新鲜无血清培养基在黑暗中孵育1小时。最后,用酶标仪在450nm波长处测定产物的吸光度。结果表示为不同处理后
的细胞相对于未经任何处理的对照细胞的存活百分比。
[0105]
单一光热性作用癌细胞杀伤效果的表征:将0.5mm自由基清除剂vc与4t1细胞共同孵育以消除光动力作用对细胞存活率的影响。
[0106]
单一光动力作用癌细胞杀伤效果的表征:在激光照射期间将4t1细胞保持在4℃冰水浴中,以消除光热作用的影响。结果如图10所示。
[0107]
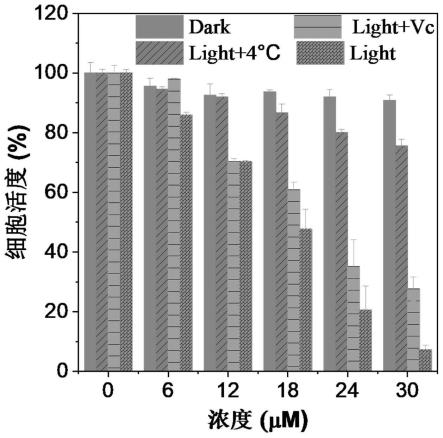
图10为6mnvdpp nps对4t1细胞进行光动力/光热协同杀伤分析测试。当6mnvdpp nps的浓度增加到30μm时,细胞活力保持》90%以上,表明6mnvdpp nps的暗细胞毒性较低。在808nm激光照射(0.5w/cm2,15min)后,观察到明显的浓度依赖光毒性,半抑制浓度(ic
50
)约为15μm。为了深入评估光动力疗法/光热疗法的协同效应,分别研究了单一光动力作用或光热作用的杀伤效果,在30μm 6mnvdpp nps孵育20h后,再用808nm激光照射15min,光动力治疗组的4t1细胞存活率为76%,光热治疗组为28%。光动力疗法/光热疗法协同光疗组的细胞活力仅为7%,证实了6mnvdpp nps具有出色的协同光治疗作用。
[0108]
由以上实施例可知,本发明提供的具有近红外荧光成像和光动力/光热协同杀伤癌细胞活性的荧光光敏剂合成步骤简单,分离纯化操作简单,具有强的i型活性氧产生能力;高效光热转换性能,对乳腺癌细胞具有强杀伤能力,可用于构建具有高效光动力/光热协同治疗效果的抗癌药物。
[0109]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。