1.本发明涉及果蔬保鲜技术领域,尤其涉及一种抑菌性琼脂及其制备方法和用途。
背景技术:
2.鲜食食品,如各种水果、蔬菜、鲜食食用菌等在采摘后会随着储藏时间的增加逐渐衰老、萎蔫,甚至腐败变质。不仅影响其销售价值,严重的还会引起食物中毒,危及身体健康,造成巨大的经济损失。鲜食果蔬及鲜食食用菌食品含水量高,自身保护组织比较脆弱,极易失水皱缩或遭受微生物侵染而腐败变质。因此,采用科学合理、绿色安全的保鲜技术延长鲜食食品的保鲜期至关重要的。
3.琼脂是从石花菜(gelidium)、江蓠(gracilaria)等红藻中提取出来的亲水性高分子多糖,是一种安全无毒的天然材料,具有很好的成膜性,将其覆于食物表面形成薄膜,可以减少水分流失和氧气与食物的直接接触,抑制果蔬的呼吸作用、减少食品中营养物质的消耗。同时,琼脂膜不会破坏食物的口感和外观,在食品保鲜应用中具有很大优势。琼脂虽然不被微生物利用,但也不能抑制微生物生长,减少食品因细菌侵染引起的腐败,而抑制微生物生长繁殖、减少腐败是保证鲜食食品良好品质的必要条件,因此,琼脂在水果保鲜领域的应用有待进一步改善。
技术实现要素:
4.本发明的目的在于提供一种可长期有效抑制大肠杆菌及链格孢霉生长的抑菌性琼脂。该抑菌性琼脂的硫酸基团含量为0.3~0.9,凝胶强度为50~100g/cm2,琼脂链中具有苯甲酰基及邻苯二甲酰基双功能基团,苯甲酰基的取代度为0.01~0.05,邻苯二甲酰基的取代度为0.01~0.05,两者具有协同抑菌作用。
5.为实现上述目的,本发明提供一种抑菌性琼脂,其特征在于,其结构式如下:
[0006][0007]
进一步,包括以下制备步骤制备得到,
[0008]
s1.将琼脂粉末分散于去离子水中得到琼脂悬浮液,在搅拌的条件下,加入苯甲酸酐后调节ph至6~9反应,得到琼脂衍生物a;
[0009]
s2.将上述非均相水溶液进行离心除去上清液,经去离子水洗涤后再加入去离子
水形成琼脂悬浮液;
[0010]
s3.将上述非均相水溶液中加入邻苯二甲酸酐反应,得到琼脂衍生物b的均相水溶液;
[0011]
s4.将上述非均相水溶液进行离心除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0012]
s5.将上述抑菌性琼脂分散于去离子水中,加热溶解,冷却后形成抑菌性琼脂溶液,再制备成抑菌性琼脂喷雾剂。
[0013]
进一步,所述s1步骤中,所述琼脂粉末的硫酸基含量为0.3-0.9w/v%,凝胶强度为300-500g/cm2;非均相水溶液中琼脂与苯甲酸酐质量比为3:1~6:1,所述反应的ph为6~9,温度为30~50℃,时间为1~3h;所述琼脂衍生物a的取代度为0.01~0.05,凝胶强度为200~300g/cm2。
[0014]
进一步,所述s2步骤中,所述离心转速为4000~5000rpm。
[0015]
进一步,所述s3步骤中,所述非均相水溶液中琼脂与邻苯二甲酸酐质量比为3:1~6:1,所述反应的ph为6~9,温度为50~70℃,时间为1~3h;所述琼脂衍生物b的取代度为0.01~0.05,凝胶强度为50~100g/cm2。
[0016]
任选的,所述离心转速为4000~5000rpm。
[0017]
进一步,所述s5步骤中,所述抑菌性琼脂喷雾剂的浓度为0.5~1.5w/v%,ph为4~8。
[0018]
本发明还提供一种所述抑菌性琼脂的制备方法,包括以下制备步骤制备得到,
[0019]
s1.将琼脂粉末分散于去离子水中得到琼脂悬浮液,在搅拌的条件下,加入苯甲酸酐后调节ph至6~9反应,得到琼脂衍生物a;
[0020]
优选的,所述琼脂粉末的硫酸基含量为0.3-0.9w/v%,凝胶强度为300-500g/cm2;非均相水溶液中琼脂与苯甲酸酐质量比为3:1~6:1,所述反应的ph为6~9,温度为30~50℃,时间为1~3h;所述琼脂衍生物a的取代度为0.01~0.05,凝胶强度为200~300g/cm2;
[0021]
s2.将上述非均相水溶液进行离心除去上清液,经去离子水洗涤后再加入去离子水形成琼脂悬浮液;
[0022]
优选的,所述离心转速为4000~5000rpm;
[0023]
s3.将上述非均相水溶液中加入邻苯二甲酸酐反应,得到琼脂衍生物b的均相水溶液;
[0024]
优选的,所述非均相水溶液中琼脂与邻苯二甲酸酐质量比为3:1~6:1,所述反应的ph为6~9,温度为50~70℃,时间为1~3h;所述琼脂衍生物b的取代度为0.01~0.05,凝胶强度为50~100g/cm2;
[0025]
s4.将上述非均相水溶液进行离心除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂;
[0026]
优选的,所述离心转速为4000~5000rpm;
[0027]
s5.将上述抑菌性琼脂分散于去离子水中,加热溶解,冷却后形成抑菌性琼脂溶液,再制备成抑菌性琼脂喷雾剂;
[0028]
优选的,所述抑菌性琼脂喷雾剂的浓度为0.5~1.5w/v%,ph为4~8。
[0029]
本发明还提供所述抑菌性琼脂用于喷雾剂的用途。
[0030]
进一步,抑菌性琼脂具有抑制大肠杆菌及链格孢霉的生长的作用。
[0031]
进一步,作为水果保鲜喷雾剂的用途。
[0032]
本发明还提供一种水果保鲜喷雾剂,其特征在于,含有所述抑菌性琼脂。
[0033]
本发明具有如下优点:
[0034]
(1)苯甲酸可通过共混技术和逐层自组装技术添加到材料中使其具有一定的抗菌性能,但上述物理方法都不能实现永久改性,其主要风险还在于共混材料在长期应用中抗菌成分的泄漏和抗菌性能的退化。本发明创造性使用苯甲酸酐及邻苯二甲酸酐对琼脂进行化学修饰,使材料具有持久的抗菌性能。
[0035]
(2)本发明提供的抑菌性琼脂能通过抑制大肠杆菌及链格孢霉的生长,并且能够降低果蔬的水分蒸发,在果蔬保鲜领域具有良好的应用前景。
附图说明
[0036]
图1是实施例1的抑菌性琼脂对大肠杆菌(a1原琼脂,a2改性琼脂)及链格孢霉(b1原琼脂,b2改性琼脂)的抑菌效果图。
[0037]
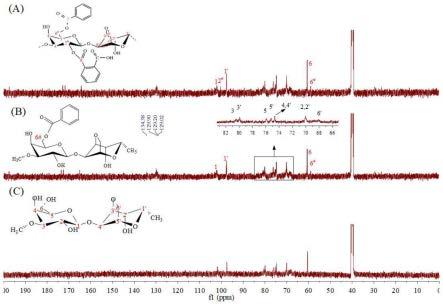
图2是琼脂衍生物a,琼脂衍生物b和琼脂的核磁结果图。
[0038]
图3是实施例2的抑菌性琼脂对大肠杆菌(a1原琼脂,a2改性琼脂)及链格孢霉(b1原琼脂,b2改性琼脂)的抑菌效果图。
[0039]
图4是实施例3的抑菌性琼脂对大肠杆菌(a1原琼脂,a2改性琼脂)及链格孢霉(b1原琼脂,b2改性琼脂)的抑菌效果图。
[0040]
图5实施例4的抑菌性琼脂对大肠杆菌(a1原琼脂,a2改性琼脂)及链格孢霉(b1原琼脂,b2改性琼脂)的抑菌效果图。
[0041]
图6实施例5的抑菌性琼脂对大肠杆菌(a1原琼脂,a2改性琼脂)及链格孢霉(b1原琼脂,b2改性琼脂)的抑菌效果图。
[0042]
图7是实施例5的抑菌性琼脂对圣女果的保鲜效果图。
具体实施方式
[0043]
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。在下面的实施例中,如未明确说明,“%”均指重量百分比。
[0044]
大肠杆菌bl21抑菌性能测定方法(1):
[0045]
分别称取细菌学蛋白胨10g,酵母提取粉5g和氯化钠10g,加入1l蒸馏水配置成lb液体培养基,调节培养基的ph为4.0后分装到培养皿上。从冰箱中取出冷藏的大肠杆菌bl21,待其解冻后转入lb液体培养基中,设置摇床中的速度的为180rpm/min,将大肠杆菌放入37℃的摇床中活化12h后,逐级稀释成10-6
浓度梯度的菌悬液。分别按表1中的配比往锥形瓶中装入一定量的琼脂样品,lb液体培养基以及蒸馏水,混匀后在121℃温度下高温灭菌。
[0046]
表1培养基配比表
[0047][0048]
在超净台中,将灭菌后的培养基分装到培养皿上,取200μl稀释到10-6
浓度梯度的大肠杆菌菌液涂布到培养皿上,放入37℃的恒温培养箱中培养18到24小时后进行菌落计数,参照国标gb 15979-2002,按照公式(1)计算抑菌率:
[0049][0050]
式中:n0是空白对照(即对照样)培养皿的菌落数;
[0051]
n1是加有改性琼脂样品(即试验样)培养皿中的菌落数。
[0052]
链格孢霉抑菌性能测定方法(2):
[0053]
配置pda培养基:按表2在锥形瓶中装入pda粉末,琼脂苯甲酸酯以及蒸馏水,混匀后在121℃的温度下高温灭菌。
[0054]
表2 pda培养基配比表
[0055][0056]
链格孢霉的接种:将灭菌后的pda培养基分装到培养皿上,使用接种铲从生长有链格孢霉的平板上挑取菌落,传菌到装有改性琼脂的培养皿上。
[0057]
将培养皿放置于28℃的生化培养箱中培养3到5天,每天观察并记录链格孢霉的菌落直径,按照公式(2)计算抑菌率:
[0058][0059]
式中:d0是用原琼脂配置的pda培养基(即对照样)上的菌落直径;
[0060]
d1是用琼脂苯甲酸酯配置的pda培养基(即试验样)上的菌落直径。
[0061]
实施例1:抑菌性琼脂的制备
[0062]
s1、将硫酸基含量为0.9%(w/v),凝胶强度为300g/cm2的琼脂粉末分散于去离子水中,在搅拌的条件下配制成浓度为10%(w/v)的琼脂悬浮液,加入苯甲酸酐,调节琼脂与苯甲酸酐质量比为3:1,反应ph为6,反应温度为30℃,反应时间为1h;得到产物(琼脂衍生物a)中琼脂衍生物的苯甲酸取代度为0.01,凝胶强度为200g/cm2。
[0063]
s2、反应完成后将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后再加入去离子水,配制成浓度为10%(w/v)的琼脂悬浮液。
[0064]
s3、在上述非均相溶液中加入邻苯二甲酸酐,调节琼脂与邻苯二甲酸酐质量比为3:1,反应ph为6,反应温度为50℃,反应时间为1h;所得产物(琼脂衍生物b)的邻苯二甲酸取代度为0.01,凝胶强度为100g/cm2。
[0065]
s4、将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0066]
s5、按测定方法(1)及测定方法(2)验证抑菌性琼脂对大肠杆菌bl21及链格孢霉的
抑菌性能,如图1所示,抑菌性琼脂对大肠杆菌的抑菌率达到80%,对链格孢霉的抑菌率达到50%。
[0067]
抑菌性琼脂的结构验证实验:
[0068]
将上述琼脂衍生物a,琼脂衍生物b;琼脂进行核磁共振实验,结果见表3和图2。
[0069]
表3核磁数据表
[0070]
碳位c-1c-1'c-2/2'~c-6/6'c-6
#
c-2
#
c-7c-8位移ppm101.7097.4660.52
–
80.4758.89100.55167.1170.22
[0071]
图2中,其中a为琼脂衍生物b;b为琼脂衍生物a;c为琼脂。
[0072]
实施例2:抑菌性琼脂的制备
[0073]
s1、将硫酸基含量0.3%(w/v),凝胶强度为500g/cm2的琼脂粉末分散于去离子水中,在搅拌的条件下配制成浓度为10%(w/v)的琼脂悬浮液,加入苯甲酸酐,调节琼脂与苯甲酸酐质量比为4.5:1,反应ph为7,反应温度为40℃,反应时间为2h;得到产物(琼脂衍生物a)中琼脂衍生物的苯甲酸取代度为0.015,凝胶强度为250g/cm2。
[0074]
s2、反应完成后将上述非均相水溶液进行离心除去上清液,离心转速为4000~5000rpm,经去离子水洗涤后再加入去离子水,配制成浓度为10%(w/v)的琼脂悬浮液。
[0075]
s3、在上述非均相溶液中加入邻苯二甲酸酐,调节琼脂与邻苯二甲酸酐质量比为4:1,反应ph为7,反应温度为60℃,反应时间为2h;所得产物(琼脂衍生物b)的邻苯二甲酸取代度为0.01,凝胶强度为100g/cm2。
[0076]
s4、将上述非均相水溶液进行离心,转速为4000~5000rpm,除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0077]
s5、按测定方法(1)及测定方法(2)验证抑菌性琼脂对大肠杆菌bl21及链格孢霉的抑菌性能,如图3所示,抑菌性琼脂对大肠杆菌的抑菌率达到88%,对链格孢霉的抑菌率达到46%。
[0078]
实施例3:抑菌性琼脂的制备
[0079]
s1、将硫酸基含量0.5%(w/v),凝胶强度为380g/cm2的琼脂粉末分散于去离子水中,在搅拌的条件下配制成浓度为10%(w/v)的琼脂悬浮液,加入苯甲酸酐,调节琼脂与苯甲酸酐质量比为6:1,反应ph为8,反应温度为50℃,反应时间为3h;得到产物(琼脂衍生物a)中琼脂衍生物的苯甲酸取代度为0.03,凝胶强度为285g/cm2。
[0080]
s2、反应完成后将上述非均相水溶液进行离心除去上清液,离心转速为4000~5000rpm,经去离子水洗涤后再加入去离子水,配制成浓度为10%(w/v)的琼脂悬浮液。
[0081]
s3、在上述非均相溶液中加入邻苯二甲酸酐,调节琼脂与邻苯二甲酸酐质量比为6:1,反应ph为6,反应温度为70℃,反应时间为3h;所得产物(琼脂衍生物b)的邻苯二甲酸取代度为0.03,凝胶强度为90g/cm2。
[0082]
s4、将上述非均相水溶液进行离心,转速为4000~5000rpm,除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0083]
s5、按测定方法(1)及测定方法(2)验证抑菌性琼脂对大肠杆菌bl21及链格孢霉的抑菌性能,如图4所示,抑菌性琼脂对大肠杆菌的抑菌率达到72%,对链格孢霉的抑菌率达到56%。
[0084]
实施例4抑菌性琼脂的制备
[0085]
s1、将硫酸基含量0.3%(w/v),凝胶强度为400g/cm2的琼脂粉末分散于去离子水中,在搅拌的条件下配制成浓度为10%(w/v)的琼脂悬浮液,加入苯甲酸酐,调节琼脂与苯甲酸酐质量比为3:1,反应ph为9,反应温度为50℃,反应时间为3h;得到产物(琼脂衍生物a)中琼脂衍生物的苯甲酸取代度为0.05,凝胶强度为220g/cm2。
[0086]
s2、反应完成后将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后再加入去离子水,配制成浓度为10%(w/v)的琼脂悬浮液。
[0087]
s3、在上述非均相溶液中加入邻苯二甲酸酐,调节琼脂与邻苯二甲酸酐质量比为6:1,反应ph为6,反应温度为65℃,反应时间为3h;所得产物(琼脂衍生物b)的邻苯二甲酸取代度为0.045,凝胶强度为70g/cm2。
[0088]
s4、将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0089]
s5、按测定方法(1)及测定方法(2)验证抑菌性琼脂对大肠杆菌bl21及链格孢霉的抑菌性能,如图5所示,抑菌性琼脂对大肠杆菌的抑菌率达到100%,对链格孢霉的抑菌率达到57%。
[0090]
实施例5抑菌性琼脂的制备
[0091]
s1、将硫酸基含量0.5%(w/v),凝胶强度为390g/cm2的琼脂粉末分散于去离子水中,在搅拌的条件下配制成浓度为10%(w/v)的琼脂悬浮液,加入苯甲酸酐,调节琼脂与苯甲酸酐质量比为5:1,反应ph为8,反应温度为40℃,反应时间为2h;得到产物(琼脂衍生物a)中琼脂衍生物的苯甲酸取代度为0.045,凝胶强度为220g/cm2。
[0092]
s2、反应完成后将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后再加入去离子水,配制成浓度为10%(w/v)的琼脂悬浮液。
[0093]
s3、在上述非均相溶液中加入邻苯二甲酸酐,调节琼脂与邻苯二甲酸酐质量比为5:1,反应ph为8,反应温度为60℃,反应时间为2h;所得产物(琼脂衍生物b)的邻苯二甲酸取代度为0.05,凝胶强度为50g/cm2。
[0094]
s4、将上述非均相水溶液进行离心,离心转速为4000~5000rpm,除去上清液,经去离子水洗涤后进行干燥,得到抑菌性琼脂。
[0095]
s5、按测定方法(1)及测定方法(2)验证抑菌性琼脂对大肠杆菌bl21及链格孢霉的抑菌性能,如图6所示,抑菌性琼脂对大肠杆菌的抑菌率达到85%,对链格孢霉的抑菌率达到50%。
[0096]
实施例6效果验证实验
[0097]
对照1:琼脂。参见表2中的对照样的配方。
[0098]
对照2:琼脂 苯甲酸。在对照1的配方基础上添加0.5%(w/v)苯甲酸。
[0099]
将新鲜的圣女果(一共三个处理,每个处理9个圣女果)浸泡在链格孢霉菌液中(109cfu/ml)浸泡2min后取出,待圣女果干燥后将圣女果分别浸泡在对照1,对照2和实施例5制备得到的抑菌性琼脂溶液中,1分钟后取出于室温下晾干,保存。分别在保存第1,3,8天的时候进行检测,结果见图5。其中(a)为对照1,(b)为对照2,(c)为实施例5所得的抑菌性琼脂。
[0100]
从图5可看出,圣女果浸泡琼脂(对照1)后经保存1天时,表皮光滑,未显示菌斑;3天时有菌斑生长,保存8天时表皮皱缩,质量损失率达13%。
[0101]
圣女果浸泡于琼脂与苯甲酸混合液(对照2)中,室温保存1天时表皮光滑,未显示菌斑;5天时,表皮光滑,未显示菌斑;8天时表皮皱缩,质量损失率达7%。
[0102]
圣女果浸泡于抑菌性琼脂溶液后,室温保存1天时,表皮光滑,未显示菌斑;5天时,表皮光滑,未显示菌斑;8天时无菌斑出现,表皮无明显皱缩,质量损失率达3%。
[0103]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。