用于检测环孢素a肾毒性相关标志物的检测试剂、试剂盒及其用途
技术领域
1.本发明涉及生物化学检测领域。更具体地说,本发明涉及用于检测环孢素a肾毒性相关标志物的检测试剂、试剂盒及其用途。
背景技术:
2.器官移植挽救了数以万计晚期器官功能衰竭患者的生命。2017年我国实施器官移植手术超过1.6万例,手术量居世界第二。其中,肾脏移植术后1年、3年肾存活率已分别达97.9%和92.65%,居国际前列。目前,我国的器官移植事业正处于由数量规模型发展向高质量和高科技含量提升、由移植大国向移植强国冲刺的历史关键时期。值得注意的是,我国器官移植尚缺乏基础性、原创性并在国际上被认可的技术创新,对临床实践指导能力较弱。
3.钙调磷酸酶抑制剂(calcineurin inhibitor,cni)是目前器官移植免疫抑制联合用药中的核心药物。环孢素a(csa)是一种高效cni,是目前器官移植的广泛使用的免疫抑制剂。但是由于csa引起的肾脏损害明显增多,给患者带来了沉重的医疗负担,给国家造成了重大经济损失。临床对csa致肾损伤的监测,主要依靠影像学和传统的体液生化分析,这些检测方法既缺乏特异性和敏感性,又无法及时指导临床治疗。因此,寻找无创、特异、敏感的生物标志物对移植肾功能的诊断及监测有着重要的意义,对csa合理、精准的药物治疗有着重大临床实践指导意义。
技术实现要素:
4.为解决现有技术的不足,发明人通过筛选大量标志物,发现本发明的标志物能够以高的灵敏度和特异性诊断环孢素a肾毒性或预测其风险。基于本发明的标志物,可以有效区分环孢素a肾毒性患者、高风险人群与肾功能正常人群。
5.更具体而言,本发明提供了2个标志物,并建立所述标志物水平与环孢素a肾毒性关系的诊断模型,该模型具有无创检测、检测安全方便、通量高、检测准确性高的优点,提升了诊断的便利性和标准化程度。
6.在一方面,本发明涉及检测试剂,其用于检测分离自个体的样品中包括游离肉碱(c0)和甘氨酸的环孢素a肾毒性相关标志物的含量。
7.在一些实施方案中,所述检测试剂包含适用于液质联用技术的标准曲线储备液和内标储备液。
8.在一些实施方案中,所述标准曲线储备液包括游离肉碱(c0)溶液和甘氨酸溶液。
9.在一些实施方案中,所述内标储备液包括c0-d9溶液、和甘氨酸-15
n,
13
c溶液。
10.在一些实施方案中,所述检测试剂还包含空白基质。
11.在一些实施方案中,所述空白基质为牛血清白蛋白溶液。
12.在一些实施方案中,所述样品选自血清、血浆、分离的血细胞或其组合。
13.在另一方面,本发明涉及试剂盒,其包含如上所述的检测试剂。
14.在另一方面,本发明还涉及如上所述的检测试剂在制备用于在个体中诊断环孢素a肾毒性或预测其风险的产品中的用途,其中与肾功能正常的对照相比,分离自个体的样品中的一种或多种标志物的含量显著上调和/或下调表明所述个体具有肾毒性或具有肾毒性高风险。
15.在一些实施方案中,与肾功能正常的对照相比,分离自个体的样品中的游离肉碱(c0)含量显著上调而甘氨酸的含量显著下调表明所述个体具有肾毒性或具有肾毒性高风险。
16.在一些实施方案中,所述样品选自血清、血浆、分离的血细胞或其组合。
17.在一些实施方案中,经logistic回归分析,游离肉碱和甘氨酸联合诊断的公式为y
联合值
==0.019208*c0浓度-0.016006*甘氨酸浓度 2.9298。
18.本发明至少包括以下有益效果:
19.本发明的代谢标志物存在于血清中,方便进行分析测定。本发明的检测试剂和试剂盒能够用于csa肾毒性的诊断,提升了肾毒性诊断的便利性和标准化程度,为预测肾毒性提供参考。
20.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
21.图1示出了采用正交偏最小二乘判别分析(opls-da)对肾功能正常组vs肾毒性组进行多元统计分析的得分图,浅谈色圆圈(c)代表肾功能正常组,深色圆圈(r)代表肾毒性组。
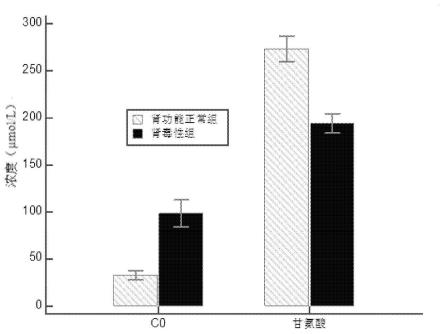
22.图2示出了具有显著性差异的标志物:游离肉碱(c0)、甘氨酸在肾功能正常组与肾毒性组中的比较。
23.图3示出了标志物游离肉碱(c0)的受试者工作曲线分析(roc)及标准值图。
24.图4示出了标志物甘氨酸的受试者工作曲线分析(roc)及标准值图。
25.图5和图6分别示出了标志物游离肉碱(c0)和甘氨酸联合诊断的受试者工作曲线分析(roc)及联合诊断值在组间的比较。
具体实施方式
26.本文所用的术语仅以描述具体的实施方案为目的而不意图限制本发明。除非上下文另有明确指示,否则本文所用的单数形式“一”、“一个”和“所述”也意图包括复数形式。应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。需要注意的是,该开放式的表述也涵盖仅由所述的组分和方法步骤组成的情形(即涵盖了封闭式表述“由
……
组成”的情形)。
27.本文中浓度、量及其它数值数据可以用范围形式来呈现。应理解所述范围形式仅为了方便和简洁起见而使用并因此应灵活地解释为不仅包括作为范围界限明确列举的数值,而且还包括所述范围内包括的所有单个数值或子范围,如同每一数值和子范围被明确列举。作为例证,“约1-约5”的数值范围应解释为不仅包括明确列举的约1-约5的值,而且还包括所指明范围内的单个值和子范围。因此,包括在该数值范围内的为单个值例如2、3和4
及子范围例如1-3、2-4和3-5等,以及单独地1、2、3、4和5。
28.样品可为取自受试者的任何生物流体(或体液)样品,包括但不限于脑脊液(csf)、血清、血浆、月经血、子宫内膜液、尿、唾液或其它体液(粪便、泪液、滑液、痰)、呼吸(例如作为浓缩呼吸),或其提取物或纯化物,或其稀释液。应当理解,本发明的方法和用途特别用于获自患者的血液、血清或血浆样品。在一个实施方案中,样品是血液或血浆样品。在另一个实施方案中,样品是血清样品。在一些实施方案中,所述样品选自血清、血浆、分离的血细胞或其组合,优选血清。
29.如本文所用的术语“检测”或“诊断”涵盖疾病状态(例如肾毒性)的鉴定、确认和/或表征。根据本发明的检测、监测和诊断方法可用于确认疾病的存在,通过评估疾病的发作和进展来监测疾病的发展,或评估疾病的改善或消退。检测、监测和诊断方法也可用于评估临床筛查、预后、疗法选择、评价治疗益处(即用于药物筛选和药物开发)的方法。
30.本发明涉及新发现的标志物的含量与环孢素a肾毒性之间的关系。本文所述标志物提供用于在个体中诊断环孢素a肾毒性或评估其风险的方法。因此,本发明的一个实施方案代表标志物的改进,所述标志物适用于诊断环孢素a肾毒性或评估其风险。本发明的检测试剂和试剂盒能够用于csa肾毒性的诊断,提升了肾毒性诊断的便利性和标准化程度,为预测肾毒性提供参考。
31.在一方面,本发明涉及检测试剂,其用于检测分离自个体的样品中包括游离肉碱(c0)和甘氨酸的环孢素a肾毒性相关标志物的含量。
32.在一些实施方案中,所述检测试剂包含适用于液质联用技术的标准曲线储备液和内标储备液。
33.在一些实施方案中,所述标准曲线储备液包括游离肉碱(c0)溶液和甘氨酸溶液。
34.在一些实施方案中,所述内标储备液包括c0-d9溶液和甘氨酸-15
n,
13
c溶液。
35.在一些实施方案中,所述检测试剂还包含空白基质。
36.在一些实施方案中,所述空白基质为牛血清白蛋白溶液。
37.在另一方面,本发明涉及试剂盒,其包含如上所述的检测试剂。任选地试剂盒的还包含使用说明书。
38.在另一方面,本发明还涉及如上所述的检测试剂在制备用于在个体中诊断环孢素a肾毒性或预测其风险的产品(例如试剂盒)中的用途,其中与肾功能正常的对照相比,分离自个体的样品中的一种或多种标志物的含量显著上调和/或下调表明所述个体具有肾毒性或具有肾毒性高风险。
39.在一些实施方案中,与肾功能正常的对照相比,分离自个体的样品中的游离肉碱(c0)含量显著上调而甘氨酸的含量显著下调表明所述个体具有肾毒性或具有肾毒性高风险。
40.在一些实施方案中,所述样品选自血清、血浆、分离的血细胞或其组合,优选血清。
41.在一些实施方案中,经logistic回归分析,游离肉碱和甘氨酸联合诊断的公式为y
联合值
==0.019208*c0浓度-0.016006*甘氨酸浓度 2.9298。
42.在一些实施方案中,使用本发明的标志物组合能够在大于80%例如大于85%或大于90%的特异性的情况下实现至少25%例如至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少81%、至少82%或至少83%的灵敏度。
43.虽然上文已描述了本发明的各种实施方案,但是应理解的是,其仅以实例的方式提供,而并非限制。对公开的实施方案的许多改变可依照本文的公开内容来进行,而不会背离本发明的精神或范围。因此,本发明的广度和范围不应受到任何上述的实施方案所限制。
44.本文提及的所有文献都通过引用结合到本文中。本技术引用的所有出版物和专利文件都为所有目的而通过引用结合,引用程度如同单独地指出各个出版物或专利文件一样。
45.实施例
46.1.目的
47.建立基于液质联用技术的csa肾毒性标志物的分析方法,分析服用csa患者的血清样本,根据统计学分析和代谢组学潜在生物标志物筛选标准找寻不良反应相关潜在生物标志物。
48.2.样本:csa肾毒性和csa肾功能正常样本等,各组样本数量见表1。
49.表1样本分组信息
[0050][0051]
3.实验方法:
[0052]
3.1材料
[0053]
乙酸铵(质谱纯,批号160267a,美国fisher scientific有限公司)、甲酸(质谱纯,批号182088,美国fisher scientific有限公司)、乙腈(色谱纯,批号213447,美国fisher scientific有限公司)、甲醇(色谱纯,批号214801,美国fisher scientific有限公司)、游离肉碱(批号vn936400u,美国chemicals forthe world公司)、甘氨酸(批号yz-140689,北京索莱宝科技有限公司)、c0-d9(批号6-lba-98-3,加拿大toronto research chemicals)、甘氨酸-15
n,
13
c(批号3-gfb-110-2,加拿大toronto research chemicals)牛血清白蛋白(批号a8020,北京索莱宝科技有限公司)。
[0054]
3.2分析方法
[0055]
3.2.1色谱条件
[0056]
色谱分离采用美国沃特世公司的acquity uplc超高效液相色谱仪对样本进行分析。
[0057]
流动相a:水(含2mmol
·
l-1
乙酸铵及0.1%甲酸),流动相b:乙腈(含0.1%甲酸);色谱柱:acquitybeh-c
18
柱(2.1mm
×
50mm,1.7μm);柱温:40℃;流速:0.25ml
·
min-1
;梯度洗脱条件如表2所示;进样量:5μl。
[0058]
表2梯度洗脱条件
[0059][0060][0061]
3.2.2质谱条件
[0062]
质谱分析采用美国沃特世公司配备电喷雾离子化源(esi)的quattro premier xe三重四极杆质谱仪。
[0063]
正离子检测模式( esi)下;毛细管电压:1.0kv;锥孔电压:30v;锥孔温度:120℃;离子源温度:350℃;脱溶剂气(n2)流速:800l
·
h-1
;锥孔反吹气流速:10l
·
h-1
。
[0064]
采用多反应离子监测扫描模式(multiple reaction monitoring,mrm)可对标志物进行定量分析,各标志物定量离子对和相关质谱参数等见表3。
[0065]
表3各标志物定量离子对和相关质谱参数
[0066]
化合物名称前体离子产物离子停留时间(s)碰撞能量(v)c0162.2103.10.02516甘氨酸76300.0256c0-d9171.2103.10.02516甘氨酸-15
n,
13
c78320.0256
[0067]
3.3检测试剂
[0068]
3.3.1标准品储备液配制
[0069]
分别精密称取游离肉碱(c0)、甘氨酸约10mg,置于5ml容量瓶中,使用50%甲醇/水溶解并稀释至刻度,分别配成浓度为2mg/ml的标准品储备液。3.3.2标准曲线工作液的配制
[0070]
使用各标准品储备液(2mg/ml)配制标准曲线样品工作液,通过甲醇溶液逐级稀释,最终配制成7.8125、15.625、31.25、62.5、125、250、500、1000和2000μg/ml的各浓度标准曲线工作液(w1-w9)。
[0071]
3.3.3内标工作液的配制
[0072]
分别准确称取标准品c0-d9 0.5mg、甘氨酸-15
n,
13
c 1mg,放入10ml容量瓶中,使用50%甲醇/水溶解并稀释至刻度,配成内标工作液。
[0073]
3.4空白基质的制备
[0074]
准确称取牛血清白蛋白100mg于10ml容量瓶中,用生理盐水溶解并定容至刻度即得空白基质。
[0075]
3.5标准曲线样品配制
[0076]
使用移液枪吸取各浓度标准曲线工作液w1-w9各50μl,分别加入到950μl空白基质中,混匀后得到1ml的基质标准曲线样品s1-s9(0.39025、0.78125、1.5625、3.125、6.25、12.5、25、50和100μg/ml),分装并编号,在-80℃条件下保存,待用。
[0077]
3.6质控样品制备
[0078]
使用移液枪吸取标准曲线工作液w9 50μl,加入到950μl空白基质中,混匀。从中吸取800μl,加入到200μl空白基质中,混匀后得到浓度为80μg/ml的质控品h;从质控品h中吸取500μl,加入到500μl空白基质中,混匀后得到浓度为40μg/ml的质控品m;从质控品m中吸取500μl,加入到500μl空白基质中,混匀后得到浓度为20μg/ml的质控品l。
[0079]
3.7样品前处理
[0080]
精密吸取50μl人血清样品(或标准曲线样品,或质控品),加入5μl内标工作液,涡旋混匀。加入450μl甲醇,涡旋震荡3min,12000rpm离心10min,吸取上清液。
[0081]
3.8数据分析
[0082]
应用美国沃特世公司masslynx 4.1定量分析软件对2种标志物进行定量分析。应用spss 22.0统计分析软件中独立样本t检验进行组间显著性差异比较(p<0.05),应用simca 14.1代谢组学分析软件进行潜在生物标志物提取(vip值》1),应用medcalc 15统计软件进行logistic回归分析及标志物的诊断效能分析。
[0083]
4.实验结果:
[0084]
4.1各标志物标准曲线和线性范围
[0085]
取各标志物系列浓度的标准曲线样品,按照“3.7”项下方法操作,从低浓度到高浓度连续进样,以待测物浓度(x)为横坐标,待测物与内标物的峰面积之比(y)为纵坐标,用masslynx(version 14.0)进行标准曲线的计算,得到标准曲线线性方程和线性相关系数值r2。结果表明,游离肉碱(c0)和甘氨酸在0.39025-100μg/ml浓度范围内,其峰面积与内标峰面积的比值与浓度线性良好,相关系数r2均大于0.99。
[0086]
4.2质控样本分析
[0087]
高(h)、中(m)、低(l)三个浓度的质控样品,按照“3.7”项下方法操作,每个浓度进行5份样品分析,连续测定3天,计算批内和批间变异。准确度在93.5%~108.1%,精密度小于15%,符合生物样本定量分析要求。
[0088]
4.3肾毒性相关人血清样品分析
[0089]
分别对肾功能正常组和肾毒性组样品进行定量分析,并进行了组间比较,通过独立样本t检验判断各标志物组间差异性,并通过simca软件采用正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,opls-da)找寻组间潜在生物标志物,见图1。各组间t检验具有显著性差异的(p<0.05)的标志物,且符合潜在生物标志物筛选标准的标志物见表4,各组间具有显著性差异标志物含量柱状图见图2。各标志物的受试者工作曲线(roc)的曲线下面积(auc)见表4,auc》0.7表示诊断价值较高。各标志物的roc曲线和标准值见图3~4。经logistic回归分析,c0和甘氨酸联合诊断的公式为y
联合值
==0.019208*c0浓度-0.016006*甘氨酸浓度 2.9298。roc曲线及诊断值组间分布见图5-6。
[0090]
表4肾毒性相关人血清各组间潜在生物标志物
[0091][0092]
5.总结:
[0093]
基于液质联用技术的标志物组学研究,通过生物统计学分析和潜在生物标志物筛选,找寻得到了肾毒性vs正常组间代谢标志物。这2种内源性代谢物(游离肉碱(c0)和甘氨酸)具有组间非常显著性差异(t检验,p<0.005),且符合潜在生物标志物筛选标准。肾毒性组的c0含量均显著上调,甘氨酸含量均显著下调。进一步,通过回归分析获得联合诊断公式,该联合诊断具有区分肾功能正常与肾毒性患者的价值,可用于临床csa肾毒性高风险的早期筛查与诊断。还根据代谢标志物提供了检测试剂。
[0094]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。