1.本发明涉及叶酸检测领域,具体而言,涉及红细胞叶酸的检测方法。
背景技术:
::2.叶酸水平与生殖健康密切相关。叶酸水平临床检测分血清(血浆)检测和红细胞检测两种。3.目前血清(血浆)检测技术比较成熟,其检测方法有三种:微生物法、蛋白结合法和液相色谱-串联质谱法(lc-ms/ms)。4.微生物法利用乳杆菌生长速度对叶酸敏感的原理,通过测量经过一定时长生长后的细菌的浑浊度来反映培养液中添加的叶酸的浓度(grossowicz,n.,etal.,determinationoffolicacidmetabolitesinnormalsubjectsandinpatientswithnutritionalmegaloblasticanemia.procsocexpbiolmed,1962.109:p.770-3.)。5.微生物法被临床营养学界公认为叶酸检测的金标准,常被新方法用来进行性能对比(yetley,e.a.,etal.,biomarkersoffolatestatusinnhanes:aroundtablesummary.amjclinnutr,2011.94(1):p.303s-312s)。微生物法的主要缺点是检测耗时长,一般需要3天时间,对无菌操作要求高,不利于商业推广。6.自从上世纪70年代,基于蛋白结合原理的商业检测试剂盒得到广泛应用一直到今天。国际上主要的试剂盒厂家包括rochefolateiii和beckmancoulteraccessfolateassay等,其检测主要是基于内源性叶酸和外源性标记的叶酸对叶酸结合蛋白的竞争性结合原理,利用化学发光产生信号的蛋白结合法(proteinbindingassay)。7.近年来基于液相色谱-串联质谱(lc-ms/ms)的检测方法也逐渐被广泛用于血清叶酸检测,并显示出非常好的特异性和敏感度(verstraete,j.,etal.,clinicaldeterminationoffolates:recentanalyticalstrategiesandchallenges.analbioanalchem,2019.411(19):p.4383-4399.)。8.血清学检测的主要缺点在于其反映的是近期叶酸摄入量,容易受一过性膳食因素的影响,波动性大,其浓度对避免出生缺陷的参考价值并没有得到学术界的广泛认可。who在一份预防神经管缺陷的营养学指南中指出育龄妇女的血清或血浆叶酸阈值对预防神经管缺陷是不充分的;红细胞叶酸浓度必须达到906nmol/l以上才能最大化的预防神经管缺陷(cordero,a.m.,etal.,optimalserumandredbloodcellfolateconcentrationsinwomenofreproductiveageforpreventionofneuraltubedefects:worldhealthorganizationguidelines.mmwrmorbmortalwklyrep,2015.64(15):p.421-3.)。9.相对血清叶酸,红细胞叶酸反映了体内叶酸长期存储水平,不易受近期叶酸摄入的影响,被很多学者认为是更好的叶酸指标(farrell,c.j.,s.h.kirsch,andm.herrmann,redcellorserumfolate:whattodoinclinicalpractice?clinchemlabmed,testingforfolatedeficiency:newfeatures?europeanjournalofhaematology,2014.92(4):p.354-359.)。这种方法由于忽略了血浆叶酸的贡献及占比的差异性,会造成红细胞叶酸浓度高估和不准确。第二种方法是先测得红细胞压积和全血叶酸浓度,再将同一管血离心取得血浆,测得血浆叶酸浓度,再根据公式“红细胞叶酸=[全血叶酸-血浆叶酸(1-红细胞压积)]/红细胞压积”估算出红细胞叶酸(hoffbrand,a.v.,b.f.a.newcombe,andd.l.mollin,methodofassayofredcellfolateactivityandthevalueoftheassayasatestforfolatedeficiency.journalofclinicalpathology,1966.19(1):p.17-28;huang,y.,etal.,quantificationofkeyredbloodcellfolatesfromsubjectswithdefinedmthfr677c》tgenotypesusingstableisotopedilutionliquidchromatography/massspectrometry.rapidcommunmassspectrom,2008.22(16):p.2403-12.)。这种方法的缺陷是需要分别做血浆和全血的叶酸检测,增加了检测误差和成本。[0016]在全血叶酸提取方面,目前常规做法是往一份edta全血中加入4-9倍体积的1%抗坏血酸,37℃或常温孵育30-120分钟左右后,将之加入固相萃取柱子中,经过洗涤后用含有甲醇、乙腈、乙酸、抗坏血酸的溶液将叶酸洗脱下来。这样经过纯净和浓缩后的叶酸可直接(fazili,z.andc.m.pfeiffer,measurementoffolatesinserumandconventionallypreparedwholebloodlysates:applicationofanautomated96-wellplateisotope-dilutiontandemmassspectrometrymethod.clinicalchemistry,2004.50(12):p.2378-2381.)或氮气吹干再复溶后进入液相色谱-串联质谱进行检测(huang,y.,etal.,quantificationofkeyredbloodcellfolatesfromsubjectswithdefinedmthfr677c》tgenotypesusingstableisotopedilutionliquidchromatography/massspectrometry.rapidcommunmassspectrom,2008.22(16):p.2403-12.)。这些提取方法程序繁琐,即增加了成本,降低了效率,也有可能因步骤多而增加了检测误差。技术实现要素:[0017]针对现有技术的不足,本发明人进行了广泛深入的研究,并完成了本发明。[0018]本发明的目的是提供一种新的红细胞叶酸的检测方法。本发明方法主要包括质谱检测前的红细胞准备,运输,叶酸提取和浓度计算的新方法,使红细胞中的叶酸可以被lc-ms/ms方法测量。[0019]一方面,本发明提供了一种红细胞叶酸的检测方法,该方法包括以下步骤:[0020](1)红细胞准备程序[0021]s1,将空腹静脉血样置于抗凝管中,置于0至4℃保存和运输,最长72小时内进行如下操作:使用0至4℃等渗无毒性液体润洗红细胞至少1次并制成红细胞悬液;检测红细胞悬液的红细胞压积(hct);或者,[0022]s1’,将空腹静脉血样置于抗凝管中,置于0至4℃保存或运输,最长72小时内进行如下操作:使用0至4℃等渗无毒性液体润洗红细胞至少1次,离心,收集红细胞,在-40至-80℃(优选在-80℃或在干冰中)冻存(按此条件冻存后可长时间保存和运输);向冻存的红细胞中加入两倍红细胞体积的1%抗坏血酸溶液,使红细胞解冻混悬,制成红细胞裂解液;检测红细胞裂解液的血红蛋白浓度;[0023](2)叶酸提取和检测[0024]分别向s1中得到的红细胞悬液或s1’中得到的红细胞裂解液和叶酸标准品溶液中加入叶酸提取液,37℃孵育30min-2h;再使用能够沉淀蛋白质的化学试剂去蛋白,得到上清液,直接对上清液进行叶酸lc-ms/ms检测,并根据标准品浓度计算出红细胞悬液或红细胞裂解液中叶酸的浓度;[0025](3)叶酸浓度计算[0026]根据以下公式计算叶酸浓度[0027]红细胞叶酸浓度=红细胞悬液中叶酸浓度/红细胞悬液的红细胞压积;或[0028]红细胞叶酸浓度=红细胞裂解液中叶酸浓度/(红细胞裂解液血红蛋白浓度*0.0029)。[0029]本发明步骤(1)中,所述等渗无毒性液体是指能够用于红细胞润洗过程的ph中性的等渗无毒性液体。优选地,所述等渗无毒性液体包括但不限于,生理盐水、磷酸缓冲液等。[0030]在一个实施方式中,s1包括以下步骤:将空腹静脉血样置于抗凝管(例如,edta-k2抗凝管)中,置于0至4℃避光暂存,72小时内0至4℃下避光运输至检测实验室;检测实验室收到样本后,完成以下操作:常规离心分离血浆(例如,2000g,10min),弃上清,加入等渗无毒性液体(优选生理盐水);混匀,离心(例如,2000g,10min),弃上清,加入两倍红细胞体积的等渗无毒性液体(优选生理盐水),制作成红细胞等渗无毒性液体悬液。[0031]在一个实施方式中,s1’包括以下步骤:将空腹静脉血样置于抗凝管(例如,edta-k2抗凝管)中,置于0至4℃避光暂存,72小时内0至4℃下避光运输至本地样本处置点:处置点收到样本后,完成以下操作:常规离心分离血浆(例如,2000g,10min),弃上清,加入等渗无毒性液体(优选生理盐水);混匀,离心(例如,2000g,10min),弃上清,收集红细胞,在-40至-80℃(优选在-80℃或在干冰中)冻存;样本干冰内运输至检测实验室;检测实验室收到样本后,完成以下操作:向冻存的红细胞中加入两倍红细胞体积的1%抗坏血酸溶液,使红细胞解冻混悬,制成红细胞裂解液;检测红细胞裂解液的血红蛋白浓度。[0032]本发明步骤(2)中,所述叶酸,包括叶酸代谢路径中各种中间形态,包括但不限于叶酸(folicacid),5甲基四氢叶酸(5-methyltetrahydrofolicacid),四氢叶酸(tetrahydrofolicacid),5-甲酰基四氢叶酸(5-formyltetrahydrofolicacid),5,10-亚甲基四氢叶酸(5,10-methenyltetrahydrofolicacid)等。[0033]本发明步骤(2)中所述叶酸提取液是指能提供抗氧化环境,并且含有能将叶酸多聚谷氨酸盐水解为叶酸单谷氨酸盐的酶的水溶液。在一个实施方式中,所述叶酸提取液包含1%抗坏血酸(或dtt,tcep,β-巯基乙醇),1μg/mlggh重组酶(或含有ggh酶的动物血浆或组织提取液,或从动物组织中纯化的ggh酶),同位素标记的5-甲基四氢叶酸内标。[0034]本发明步骤(2)中,对上清液进行叶酸lc-ms/ms检测的过程为本领域技术人员已知的。例如,它由基于反相色谱柱的(超)高效液相色谱,联用三重四极杆质谱检测完成。具体色谱分离和质谱检测参数在多篇文献中有报导,不同的实例参数设置略有不同,但基本类似。[0035]在一个实施方式中,lc-ms/ms检测条件如下:[0036]仪器:sciex6500 lc-ms/ms[0037]色谱条件:色谱柱使用acquityuplcbehc18column,1.7μm,2.1mmx50mm进行分离,流动相用水(0.1%甲酸)作为a相,甲醇(0.1%甲酸)作为b相,柱温40℃;进样量为5μl,流速0.5ml/min,进行梯度洗脱;[0038]质谱条件:采用电喷雾离子源,以正离子采集模式通过多反应监测模式进行质谱扫描。[0039]本发明步骤(2)中,所述能够沉淀蛋白质的化学试剂是指能导致蛋白沉淀的有机或无机溶剂。优选地,所述能够沉淀蛋白质的化学试剂包括但不限于,三氯乙酸(tca),甲醇,乙腈,硫化锌溶液,氯仿-甲醇混合液等。[0040]在一个实施方式中,步骤(2)包括:分别向s1中得到的红细胞悬液或s1’中得到的红细胞裂解液和叶酸标准品溶液中加入叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h;再加入三氯乙酸(tca)溶液(例如,10%tca溶液),静置(例如,30分钟),离心(例如,13000rpm,4℃,10min),取上清液进行叶酸lc-ms/ms检测,并根据标准品浓度计算出红细胞悬液或红细胞裂解液中叶酸的浓度。[0041]经验证,本发明的检测有更高的准确度和临床价值。[0042]在上文中已经详细地描述了本发明,但是上述实施方式本质上仅是例示性,且并不欲限制本发明。此外,本文并不受前述现有技术或
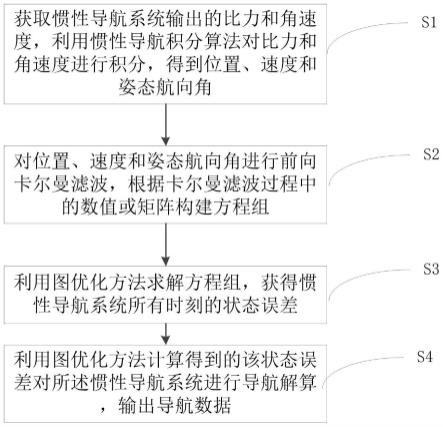
发明内容或以下实施例中所描述的任何理论的限制。[0043]除非另有明确说明,在整个申请文件中的数值范围包括其中的任何子范围和以其中给定值的最小子单位递增的任何数值。除非另有明确说明,在整个申请文件中的数值表示对包括与给定值的微小偏差以及具有大约所提及的值以及具有所提及的精确值的实施方案的范围的近似度量或限制。除了在详细描述最后提供的工作实施例之外,本技术文件(包括所附权利要求)中的参数(例如,数量或条件)的所有数值在所有情况下都应被理解为被术语“大约”修饰,不管“大约”是否实际出现在该数值之前。“大约”表示所述的数值允许稍微不精确(在该值上有一些接近精确;大约或合理地接近该值;近似)。如果“大约”提供的不精确性在本领域中没有以这个普通含义来理解,则本文所用的“大约”至少表示可以通过测量和使用这些参数的普通方法产生的变化。例如,“大约”可以包括小于或等于10%,小于或等于5%,小于或等于4%,小于或等于3%,小于或等于2%,小于或等于1%或者小于或等于0.5%的变化。附图说明[0044]图1为本发明的一个实施方式的检测方法的流程示意图。[0045]图2为本发明的另一个实施方式的检测方法的流程示意图。[0046]图3为实施例1中使用本发明检测方法与beckmancoulteraccessfolateassay红细胞叶酸检测方法的检测结果的对比图。[0047]图4为实施例1中使用本发明检测方法检测的红细胞叶酸分布与使用商业试剂盒accessfolatekit[a98032](beckmancoulter)检测结果和微生物法进行对比的图。其中,左图为本发明检测;中图为贝克曼试剂盒检测,右图为微生物法检测。[0048]图5为显示比较实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸结果的影响的图。具体实施方式[0049]在下文中,将通过实施例详细描述本发明。然而,在此提供的实施例仅用于说明目的,并不用于限制本发明。[0050]下述实施例所使用的实验方法如无特殊说明,均为常规方法。[0051]下述实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。[0052][0053]实施例[0054]实施例1:[0055]本发明检测方法[0056](1)标准红细胞准备程序[0057]用2mledta-k2抗凝管抽取1管空腹静脉血,轻缓颠倒5次摇匀,置于4℃冰箱避光暂存,72小时内4℃运输至处理点完成红细胞准备。处理点收到血液样本后,在常温2000g下离心10min,吸弃血浆,加入4ml预冷的生理盐水,充分摇匀,在2000g下离心10min,吸弃上清液。再加入大约两倍红细胞体积的预冷生理盐水,轻轻摇匀使红细胞混悬,制作成红细胞生理盐水悬液(以下简称红细胞悬液)。取出500μl红细胞悬液进行血常规检测,或离心法测得hct(红细胞压积)。再取出100μl红细胞悬液进行叶酸提取,或-80℃冻存直到叶酸提取。[0058](2)叶酸提取和检测[0059]分别向100μl红细胞悬液和叶酸标准品溶液中加入400μl叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h。再加入500μl10%三氯乙酸(tca),静置30分钟,13000rpm,4℃离心10min,取100μl上清液进行叶酸lc-ms/ms检测。[0060]lc-ms/ms检测条件如下:[0061]仪器:sciex6500 lc-ms/ms[0062]色谱条件:色谱柱使用acquityuplcbehc18column,1.7μm,2.1mmx50mm进行分离,流动相用水(0.1%甲酸)作为a相,甲醇(0.1%甲酸)作为b相,柱温40℃。进样量为5μl,流速0.5ml/min,进行梯度洗脱。[0063]质谱条件:采用电喷雾离子源,以正离子采集模式通过多反应监测模式进行质谱扫描。分析物离子对信息:americanjournalofclinicalnutrition2011,93(6):1365-1372)。[0074]本项研究检测了75名育龄妇女的基础红细胞叶酸(未进行叶酸增补),并对她们的mthfr677位点进行测序,从而得出mthfr677c/c,c/t,t/t三种基因型人群的红细胞叶酸分布。nietal(2017.80(3):p.147-153.)使用蛋白结合法的商业试剂盒accessfolatekit[a98032](beckmancoulter)分析了330人的红细胞叶酸,并同时检测了他们的mthfr677位点的多态性,从而得出红细胞叶酸在三种基因型中的分布状态。crideretal(2011)使用微生物法检测了932育龄妇女的基础红细胞叶酸水平,并同时检测了她们的mthfr677位点的多态性。[0075]图4为实施例1中使用本发明检测方法检测的红细胞叶酸分布与使用商业试剂盒accessfolatekit[a98032](beckmancoulter)和微生物法检测结果进行对比的图。其中,左图为本发明方法检测;中图为贝克曼试剂盒检测,右图为微生物法检测。[0076]从图4可以看出,本发明方法检测的结果显示叶酸代谢酶mthfr677t/t基因型的人群红细胞5-mthf水平比c/c型和c/t型人群显著降低,存在显著差别。微生物法也能检测出mthfr677t/t基因型人群的红细胞叶酸5-mthf水平相对于c/c型和c/t型人群的差别,表明mthfr677t/t对红细胞叶酸5-mthf水平具有降低作用。红细胞5-mthf水平降低与mthfrc677t突变导致其酶活性降低吻合。而现有的商业试剂盒不能检出上述差别。因为mthfr677t/t导致的5-mthf水平降低已知和神经管缺陷风险升高相关(yan,l.,etal.,associationofthematernalmthfrc677tpolymorphismwithsusceptibilitytoneuraltubedefectsinoffsprings:evidencefrom25case-controlstudies.plosone,2012.7(10):p.e41689.),因此本发明的检测有更高的准确度和临床价值。[0077]实施例2:[0078]本发明检测方法[0079](1)红细胞替代准备程序[0080]对于偏远地区冬季无4℃冷链运输条件的,可以采用干冰冷冻运输的替代程序。用2mledta-k2抗凝管抽取1管空腹静脉血,轻缓颠倒5次摇匀,置于4℃冰箱避光暂存,2小时内在常温2000g下离心10min,吸弃血浆,加入4ml预冷的生理盐水,充分摇匀,在2000g下离心10min,吸弃上清液。剩余红细胞立即冻存于-80℃或干冰中,干冰运输至处理点。处理点收到冷冻的血液样本后在样本还未解冻前加入大约两倍红细胞体积的1%抗坏血酸,充分摇匀使红细胞解冻混悬,制作成红细胞裂解液。取出100μl红细胞裂解液用吸光光度法进行血红蛋白检测。再取出100μl红细胞裂解液进行叶酸提取,或-80℃冻存直到叶酸提取。[0081](2)叶酸提取和检测[0082]分别向100μl红细胞裂解液和叶酸标准品溶液中加入400μl叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h。再加入500μl10%三氯乙酸(tca),静置30分钟,13000rpm,4℃离心10min,取100μl上清液进行叶酸lc-ms/ms检测(lc-ms/ms检测方法同实施例1)。根据标准品浓度计算出红细胞悬液中叶酸的浓度。[0083](3)叶酸浓度计算[0084]红细胞叶酸浓度=红细胞裂解液中叶酸浓度/(红细胞裂解液血红蛋白浓度*0.0029)[0085]注:0.0029为红细胞血红蛋白与红细胞压积的换算系数,即hct=hg*0.0029。[0086]结果:[0087]研究了实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸检测结果的影响[0088]发明人采集了9个人的血液,每份样本平分为两份,其中一份按实施例1操作,4℃运输,另一份将红细胞按实施例2润洗后干冰冷冻运输。收到样本后按各自程序提取叶酸,进行lc-ms/ms检测和计算。[0089]图5为显示比较实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸结果的影响的图。[0090]从图5可以看出,显示二者检测结果高度线性相关(r2=0.95,p《0.0001)。与4℃标准运输程序相比,干冰冷冻运输程序测得的红细胞叶酸平均误差9.2%。当前第1页12当前第1页12
背景技术:
::2.叶酸水平与生殖健康密切相关。叶酸水平临床检测分血清(血浆)检测和红细胞检测两种。3.目前血清(血浆)检测技术比较成熟,其检测方法有三种:微生物法、蛋白结合法和液相色谱-串联质谱法(lc-ms/ms)。4.微生物法利用乳杆菌生长速度对叶酸敏感的原理,通过测量经过一定时长生长后的细菌的浑浊度来反映培养液中添加的叶酸的浓度(grossowicz,n.,etal.,determinationoffolicacidmetabolitesinnormalsubjectsandinpatientswithnutritionalmegaloblasticanemia.procsocexpbiolmed,1962.109:p.770-3.)。5.微生物法被临床营养学界公认为叶酸检测的金标准,常被新方法用来进行性能对比(yetley,e.a.,etal.,biomarkersoffolatestatusinnhanes:aroundtablesummary.amjclinnutr,2011.94(1):p.303s-312s)。微生物法的主要缺点是检测耗时长,一般需要3天时间,对无菌操作要求高,不利于商业推广。6.自从上世纪70年代,基于蛋白结合原理的商业检测试剂盒得到广泛应用一直到今天。国际上主要的试剂盒厂家包括rochefolateiii和beckmancoulteraccessfolateassay等,其检测主要是基于内源性叶酸和外源性标记的叶酸对叶酸结合蛋白的竞争性结合原理,利用化学发光产生信号的蛋白结合法(proteinbindingassay)。7.近年来基于液相色谱-串联质谱(lc-ms/ms)的检测方法也逐渐被广泛用于血清叶酸检测,并显示出非常好的特异性和敏感度(verstraete,j.,etal.,clinicaldeterminationoffolates:recentanalyticalstrategiesandchallenges.analbioanalchem,2019.411(19):p.4383-4399.)。8.血清学检测的主要缺点在于其反映的是近期叶酸摄入量,容易受一过性膳食因素的影响,波动性大,其浓度对避免出生缺陷的参考价值并没有得到学术界的广泛认可。who在一份预防神经管缺陷的营养学指南中指出育龄妇女的血清或血浆叶酸阈值对预防神经管缺陷是不充分的;红细胞叶酸浓度必须达到906nmol/l以上才能最大化的预防神经管缺陷(cordero,a.m.,etal.,optimalserumandredbloodcellfolateconcentrationsinwomenofreproductiveageforpreventionofneuraltubedefects:worldhealthorganizationguidelines.mmwrmorbmortalwklyrep,2015.64(15):p.421-3.)。9.相对血清叶酸,红细胞叶酸反映了体内叶酸长期存储水平,不易受近期叶酸摄入的影响,被很多学者认为是更好的叶酸指标(farrell,c.j.,s.h.kirsch,andm.herrmann,redcellorserumfolate:whattodoinclinicalpractice?clinchemlabmed,testingforfolatedeficiency:newfeatures?europeanjournalofhaematology,2014.92(4):p.354-359.)。这种方法由于忽略了血浆叶酸的贡献及占比的差异性,会造成红细胞叶酸浓度高估和不准确。第二种方法是先测得红细胞压积和全血叶酸浓度,再将同一管血离心取得血浆,测得血浆叶酸浓度,再根据公式“红细胞叶酸=[全血叶酸-血浆叶酸(1-红细胞压积)]/红细胞压积”估算出红细胞叶酸(hoffbrand,a.v.,b.f.a.newcombe,andd.l.mollin,methodofassayofredcellfolateactivityandthevalueoftheassayasatestforfolatedeficiency.journalofclinicalpathology,1966.19(1):p.17-28;huang,y.,etal.,quantificationofkeyredbloodcellfolatesfromsubjectswithdefinedmthfr677c》tgenotypesusingstableisotopedilutionliquidchromatography/massspectrometry.rapidcommunmassspectrom,2008.22(16):p.2403-12.)。这种方法的缺陷是需要分别做血浆和全血的叶酸检测,增加了检测误差和成本。[0016]在全血叶酸提取方面,目前常规做法是往一份edta全血中加入4-9倍体积的1%抗坏血酸,37℃或常温孵育30-120分钟左右后,将之加入固相萃取柱子中,经过洗涤后用含有甲醇、乙腈、乙酸、抗坏血酸的溶液将叶酸洗脱下来。这样经过纯净和浓缩后的叶酸可直接(fazili,z.andc.m.pfeiffer,measurementoffolatesinserumandconventionallypreparedwholebloodlysates:applicationofanautomated96-wellplateisotope-dilutiontandemmassspectrometrymethod.clinicalchemistry,2004.50(12):p.2378-2381.)或氮气吹干再复溶后进入液相色谱-串联质谱进行检测(huang,y.,etal.,quantificationofkeyredbloodcellfolatesfromsubjectswithdefinedmthfr677c》tgenotypesusingstableisotopedilutionliquidchromatography/massspectrometry.rapidcommunmassspectrom,2008.22(16):p.2403-12.)。这些提取方法程序繁琐,即增加了成本,降低了效率,也有可能因步骤多而增加了检测误差。技术实现要素:[0017]针对现有技术的不足,本发明人进行了广泛深入的研究,并完成了本发明。[0018]本发明的目的是提供一种新的红细胞叶酸的检测方法。本发明方法主要包括质谱检测前的红细胞准备,运输,叶酸提取和浓度计算的新方法,使红细胞中的叶酸可以被lc-ms/ms方法测量。[0019]一方面,本发明提供了一种红细胞叶酸的检测方法,该方法包括以下步骤:[0020](1)红细胞准备程序[0021]s1,将空腹静脉血样置于抗凝管中,置于0至4℃保存和运输,最长72小时内进行如下操作:使用0至4℃等渗无毒性液体润洗红细胞至少1次并制成红细胞悬液;检测红细胞悬液的红细胞压积(hct);或者,[0022]s1’,将空腹静脉血样置于抗凝管中,置于0至4℃保存或运输,最长72小时内进行如下操作:使用0至4℃等渗无毒性液体润洗红细胞至少1次,离心,收集红细胞,在-40至-80℃(优选在-80℃或在干冰中)冻存(按此条件冻存后可长时间保存和运输);向冻存的红细胞中加入两倍红细胞体积的1%抗坏血酸溶液,使红细胞解冻混悬,制成红细胞裂解液;检测红细胞裂解液的血红蛋白浓度;[0023](2)叶酸提取和检测[0024]分别向s1中得到的红细胞悬液或s1’中得到的红细胞裂解液和叶酸标准品溶液中加入叶酸提取液,37℃孵育30min-2h;再使用能够沉淀蛋白质的化学试剂去蛋白,得到上清液,直接对上清液进行叶酸lc-ms/ms检测,并根据标准品浓度计算出红细胞悬液或红细胞裂解液中叶酸的浓度;[0025](3)叶酸浓度计算[0026]根据以下公式计算叶酸浓度[0027]红细胞叶酸浓度=红细胞悬液中叶酸浓度/红细胞悬液的红细胞压积;或[0028]红细胞叶酸浓度=红细胞裂解液中叶酸浓度/(红细胞裂解液血红蛋白浓度*0.0029)。[0029]本发明步骤(1)中,所述等渗无毒性液体是指能够用于红细胞润洗过程的ph中性的等渗无毒性液体。优选地,所述等渗无毒性液体包括但不限于,生理盐水、磷酸缓冲液等。[0030]在一个实施方式中,s1包括以下步骤:将空腹静脉血样置于抗凝管(例如,edta-k2抗凝管)中,置于0至4℃避光暂存,72小时内0至4℃下避光运输至检测实验室;检测实验室收到样本后,完成以下操作:常规离心分离血浆(例如,2000g,10min),弃上清,加入等渗无毒性液体(优选生理盐水);混匀,离心(例如,2000g,10min),弃上清,加入两倍红细胞体积的等渗无毒性液体(优选生理盐水),制作成红细胞等渗无毒性液体悬液。[0031]在一个实施方式中,s1’包括以下步骤:将空腹静脉血样置于抗凝管(例如,edta-k2抗凝管)中,置于0至4℃避光暂存,72小时内0至4℃下避光运输至本地样本处置点:处置点收到样本后,完成以下操作:常规离心分离血浆(例如,2000g,10min),弃上清,加入等渗无毒性液体(优选生理盐水);混匀,离心(例如,2000g,10min),弃上清,收集红细胞,在-40至-80℃(优选在-80℃或在干冰中)冻存;样本干冰内运输至检测实验室;检测实验室收到样本后,完成以下操作:向冻存的红细胞中加入两倍红细胞体积的1%抗坏血酸溶液,使红细胞解冻混悬,制成红细胞裂解液;检测红细胞裂解液的血红蛋白浓度。[0032]本发明步骤(2)中,所述叶酸,包括叶酸代谢路径中各种中间形态,包括但不限于叶酸(folicacid),5甲基四氢叶酸(5-methyltetrahydrofolicacid),四氢叶酸(tetrahydrofolicacid),5-甲酰基四氢叶酸(5-formyltetrahydrofolicacid),5,10-亚甲基四氢叶酸(5,10-methenyltetrahydrofolicacid)等。[0033]本发明步骤(2)中所述叶酸提取液是指能提供抗氧化环境,并且含有能将叶酸多聚谷氨酸盐水解为叶酸单谷氨酸盐的酶的水溶液。在一个实施方式中,所述叶酸提取液包含1%抗坏血酸(或dtt,tcep,β-巯基乙醇),1μg/mlggh重组酶(或含有ggh酶的动物血浆或组织提取液,或从动物组织中纯化的ggh酶),同位素标记的5-甲基四氢叶酸内标。[0034]本发明步骤(2)中,对上清液进行叶酸lc-ms/ms检测的过程为本领域技术人员已知的。例如,它由基于反相色谱柱的(超)高效液相色谱,联用三重四极杆质谱检测完成。具体色谱分离和质谱检测参数在多篇文献中有报导,不同的实例参数设置略有不同,但基本类似。[0035]在一个实施方式中,lc-ms/ms检测条件如下:[0036]仪器:sciex6500 lc-ms/ms[0037]色谱条件:色谱柱使用acquityuplcbehc18column,1.7μm,2.1mmx50mm进行分离,流动相用水(0.1%甲酸)作为a相,甲醇(0.1%甲酸)作为b相,柱温40℃;进样量为5μl,流速0.5ml/min,进行梯度洗脱;[0038]质谱条件:采用电喷雾离子源,以正离子采集模式通过多反应监测模式进行质谱扫描。[0039]本发明步骤(2)中,所述能够沉淀蛋白质的化学试剂是指能导致蛋白沉淀的有机或无机溶剂。优选地,所述能够沉淀蛋白质的化学试剂包括但不限于,三氯乙酸(tca),甲醇,乙腈,硫化锌溶液,氯仿-甲醇混合液等。[0040]在一个实施方式中,步骤(2)包括:分别向s1中得到的红细胞悬液或s1’中得到的红细胞裂解液和叶酸标准品溶液中加入叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h;再加入三氯乙酸(tca)溶液(例如,10%tca溶液),静置(例如,30分钟),离心(例如,13000rpm,4℃,10min),取上清液进行叶酸lc-ms/ms检测,并根据标准品浓度计算出红细胞悬液或红细胞裂解液中叶酸的浓度。[0041]经验证,本发明的检测有更高的准确度和临床价值。[0042]在上文中已经详细地描述了本发明,但是上述实施方式本质上仅是例示性,且并不欲限制本发明。此外,本文并不受前述现有技术或
发明内容或以下实施例中所描述的任何理论的限制。[0043]除非另有明确说明,在整个申请文件中的数值范围包括其中的任何子范围和以其中给定值的最小子单位递增的任何数值。除非另有明确说明,在整个申请文件中的数值表示对包括与给定值的微小偏差以及具有大约所提及的值以及具有所提及的精确值的实施方案的范围的近似度量或限制。除了在详细描述最后提供的工作实施例之外,本技术文件(包括所附权利要求)中的参数(例如,数量或条件)的所有数值在所有情况下都应被理解为被术语“大约”修饰,不管“大约”是否实际出现在该数值之前。“大约”表示所述的数值允许稍微不精确(在该值上有一些接近精确;大约或合理地接近该值;近似)。如果“大约”提供的不精确性在本领域中没有以这个普通含义来理解,则本文所用的“大约”至少表示可以通过测量和使用这些参数的普通方法产生的变化。例如,“大约”可以包括小于或等于10%,小于或等于5%,小于或等于4%,小于或等于3%,小于或等于2%,小于或等于1%或者小于或等于0.5%的变化。附图说明[0044]图1为本发明的一个实施方式的检测方法的流程示意图。[0045]图2为本发明的另一个实施方式的检测方法的流程示意图。[0046]图3为实施例1中使用本发明检测方法与beckmancoulteraccessfolateassay红细胞叶酸检测方法的检测结果的对比图。[0047]图4为实施例1中使用本发明检测方法检测的红细胞叶酸分布与使用商业试剂盒accessfolatekit[a98032](beckmancoulter)检测结果和微生物法进行对比的图。其中,左图为本发明检测;中图为贝克曼试剂盒检测,右图为微生物法检测。[0048]图5为显示比较实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸结果的影响的图。具体实施方式[0049]在下文中,将通过实施例详细描述本发明。然而,在此提供的实施例仅用于说明目的,并不用于限制本发明。[0050]下述实施例所使用的实验方法如无特殊说明,均为常规方法。[0051]下述实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。[0052][0053]实施例[0054]实施例1:[0055]本发明检测方法[0056](1)标准红细胞准备程序[0057]用2mledta-k2抗凝管抽取1管空腹静脉血,轻缓颠倒5次摇匀,置于4℃冰箱避光暂存,72小时内4℃运输至处理点完成红细胞准备。处理点收到血液样本后,在常温2000g下离心10min,吸弃血浆,加入4ml预冷的生理盐水,充分摇匀,在2000g下离心10min,吸弃上清液。再加入大约两倍红细胞体积的预冷生理盐水,轻轻摇匀使红细胞混悬,制作成红细胞生理盐水悬液(以下简称红细胞悬液)。取出500μl红细胞悬液进行血常规检测,或离心法测得hct(红细胞压积)。再取出100μl红细胞悬液进行叶酸提取,或-80℃冻存直到叶酸提取。[0058](2)叶酸提取和检测[0059]分别向100μl红细胞悬液和叶酸标准品溶液中加入400μl叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h。再加入500μl10%三氯乙酸(tca),静置30分钟,13000rpm,4℃离心10min,取100μl上清液进行叶酸lc-ms/ms检测。[0060]lc-ms/ms检测条件如下:[0061]仪器:sciex6500 lc-ms/ms[0062]色谱条件:色谱柱使用acquityuplcbehc18column,1.7μm,2.1mmx50mm进行分离,流动相用水(0.1%甲酸)作为a相,甲醇(0.1%甲酸)作为b相,柱温40℃。进样量为5μl,流速0.5ml/min,进行梯度洗脱。[0063]质谱条件:采用电喷雾离子源,以正离子采集模式通过多反应监测模式进行质谱扫描。分析物离子对信息:americanjournalofclinicalnutrition2011,93(6):1365-1372)。[0074]本项研究检测了75名育龄妇女的基础红细胞叶酸(未进行叶酸增补),并对她们的mthfr677位点进行测序,从而得出mthfr677c/c,c/t,t/t三种基因型人群的红细胞叶酸分布。nietal(2017.80(3):p.147-153.)使用蛋白结合法的商业试剂盒accessfolatekit[a98032](beckmancoulter)分析了330人的红细胞叶酸,并同时检测了他们的mthfr677位点的多态性,从而得出红细胞叶酸在三种基因型中的分布状态。crideretal(2011)使用微生物法检测了932育龄妇女的基础红细胞叶酸水平,并同时检测了她们的mthfr677位点的多态性。[0075]图4为实施例1中使用本发明检测方法检测的红细胞叶酸分布与使用商业试剂盒accessfolatekit[a98032](beckmancoulter)和微生物法检测结果进行对比的图。其中,左图为本发明方法检测;中图为贝克曼试剂盒检测,右图为微生物法检测。[0076]从图4可以看出,本发明方法检测的结果显示叶酸代谢酶mthfr677t/t基因型的人群红细胞5-mthf水平比c/c型和c/t型人群显著降低,存在显著差别。微生物法也能检测出mthfr677t/t基因型人群的红细胞叶酸5-mthf水平相对于c/c型和c/t型人群的差别,表明mthfr677t/t对红细胞叶酸5-mthf水平具有降低作用。红细胞5-mthf水平降低与mthfrc677t突变导致其酶活性降低吻合。而现有的商业试剂盒不能检出上述差别。因为mthfr677t/t导致的5-mthf水平降低已知和神经管缺陷风险升高相关(yan,l.,etal.,associationofthematernalmthfrc677tpolymorphismwithsusceptibilitytoneuraltubedefectsinoffsprings:evidencefrom25case-controlstudies.plosone,2012.7(10):p.e41689.),因此本发明的检测有更高的准确度和临床价值。[0077]实施例2:[0078]本发明检测方法[0079](1)红细胞替代准备程序[0080]对于偏远地区冬季无4℃冷链运输条件的,可以采用干冰冷冻运输的替代程序。用2mledta-k2抗凝管抽取1管空腹静脉血,轻缓颠倒5次摇匀,置于4℃冰箱避光暂存,2小时内在常温2000g下离心10min,吸弃血浆,加入4ml预冷的生理盐水,充分摇匀,在2000g下离心10min,吸弃上清液。剩余红细胞立即冻存于-80℃或干冰中,干冰运输至处理点。处理点收到冷冻的血液样本后在样本还未解冻前加入大约两倍红细胞体积的1%抗坏血酸,充分摇匀使红细胞解冻混悬,制作成红细胞裂解液。取出100μl红细胞裂解液用吸光光度法进行血红蛋白检测。再取出100μl红细胞裂解液进行叶酸提取,或-80℃冻存直到叶酸提取。[0081](2)叶酸提取和检测[0082]分别向100μl红细胞裂解液和叶酸标准品溶液中加入400μl叶酸提取液(1%抗坏血酸,1μg/mlggh重组酶,同位素标记的5-甲基四氢叶酸内标),37℃孵育1h。再加入500μl10%三氯乙酸(tca),静置30分钟,13000rpm,4℃离心10min,取100μl上清液进行叶酸lc-ms/ms检测(lc-ms/ms检测方法同实施例1)。根据标准品浓度计算出红细胞悬液中叶酸的浓度。[0083](3)叶酸浓度计算[0084]红细胞叶酸浓度=红细胞裂解液中叶酸浓度/(红细胞裂解液血红蛋白浓度*0.0029)[0085]注:0.0029为红细胞血红蛋白与红细胞压积的换算系数,即hct=hg*0.0029。[0086]结果:[0087]研究了实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸检测结果的影响[0088]发明人采集了9个人的血液,每份样本平分为两份,其中一份按实施例1操作,4℃运输,另一份将红细胞按实施例2润洗后干冰冷冻运输。收到样本后按各自程序提取叶酸,进行lc-ms/ms检测和计算。[0089]图5为显示比较实施例1中的4℃标准运输程序和实施例2中的干冰冷冻运输程序对红细胞叶酸结果的影响的图。[0090]从图5可以看出,显示二者检测结果高度线性相关(r2=0.95,p《0.0001)。与4℃标准运输程序相比,干冰冷冻运输程序测得的红细胞叶酸平均误差9.2%。当前第1页12当前第1页12
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。