含有酪氨酸激酶抑制剂的眼用植入物
1.相关申请的交叉引用
2.本发明要求2020年3月25日提出申请的美国临时申请第62/994,391号、2020年4月24日提出申请的国际申请pct/us2020/029827、2020年10月27日提出申请的美国临时申请第63/106,276号和2021年2月11日提出申请的美国临时申请第63/148,463号的优先权,所述申请全部以引用的方式并入本文中。
发明领域
3.本发明涉及眼部疾病,例如新血管性年龄相关黄斑退化(amd),也称为“湿性amd”的治疗。根据本发明,通过施用生物可降解并持续释放诸如阿西替尼(axitinib)的酪氨酸激酶抑制剂的植入物的(例如玻璃体内)注射来治疗眼部疾病。
4.发明背景
5.包括amd在内的黄斑疾病为全世界50岁以上人士的视觉障碍和不可逆性失明的主要原因之一。特定来说,amd为2019年美国(us)最常见的视网膜疾病之一,约1690万人受影响,预计2024年将增长至1880万人(market scope.ophthalmic comprehensive reports.2019retinal pharmaceuticals market report:a global analysis for 2018to2019,2019年9月)。amd可再分为不同的疾病阶段。早期amd以存在少许(《20个)中等大小的玻璃疣或视网膜色素异常为特征。中期amd以至少一个大玻璃疣、许多中等大小的玻璃疣或不延伸至黄斑中心的地区性萎缩为特征。晚期或后期amd可为非新血管性(干性、萎缩性或非渗出性)或新血管性(湿性或渗出性)。晚期非新血管性amd以玻璃疣和延伸至黄斑中心的地区性萎缩为特征。晚期新血管性amd以脉络膜新血管形成和其后遗症为特征(jager等人,age-related macular degeneration.n engl j med.2008;358(24):2606-17)。
6.湿性amd的更晚期形式以血管内皮生长因子(vegf)增加,从而促使视网膜下长出并且使血液和体液渗漏至黄斑和视网膜下空间中和下方的新血管的生长(血管生成)为特征。随着最初用于治疗各种癌症的血管内皮生长因子亚型抑制剂(即,vegf抑制剂)的开发,已成功地干扰了此途径。光动力疗法与抗vegf和类固醇施用组合目前仍为对抗vegf剂单一疗法无反应的患者的第二线疗法(al-zamil等人,recent developments in age-related macular degeneration:a review.clin interv aging.2017;12:1313-30)。
7.其他常见视网膜疾病为糖尿病性黄斑水肿(dme)和视网膜静脉阻塞(rvo)。dme为2019年美国最常见的视网膜疾病之一,约800万人受影响,预计2024年将增长至880万人(market scope 2019,同上)。根据由vegf上调引起的视网膜张力降低和血管压力升高、视网膜血管自体调节(browning等人,diabetic macular edema:evidence-based management.2018indian journal of ophthalmology,66(1),第1736页)和发炎细胞因子和趋化因子(miller等人,diabetic macular edema:current understanding,pharmacologic treatment options,and developing therapies.2018,asia-pacific journal of ophthalmology,7(1):28-35)对所述疾患进行分类。这些发炎和血管生成介体
所发生的变化破坏了血管内皮中的血液视网膜屏障(brb)(miller等人,同上)。硬性渗出物进入细胞外空间,导致中心视觉模糊和扭曲,从而造成患者视敏度下降(schmidt-erfurth等人,guidelines for the management of diabetic macular edema by the european society of retina specialists(euretina).2017,ophthalmologica.237(4):185-222)。平均而言,患者的视敏度在所述疾患开始后3年之后会下降8%。
8.dme的所有可用治疗的基础皆试图控制高血糖症的代谢功能和血压(browning等人,同上)。抗vegf疗法目前被视为dme护理治疗标准中的第一线疗法,因为其经证明与其他治疗方法相比具有较弱破坏性和损害性(schmidt-erfurth等人,同上)。药理学途径为有益的,因为制造药物以特异性靶向vegf途径并抑制伴随dme出现的上调(miller等人,同上)。其他治疗选择包括玻璃体内皮质类固醇注射、聚焦激光光凝和玻璃体切除术(browning等人,同上)。
9.rvo在2019年影响了美国大约130万人,且预计在2024年将影响美国140万人(market scope 2019,同上)。rvo为一种慢性疾患,其中视网膜循环含有导致渗漏、视网膜增厚和视觉障碍的阻塞(ip和hendrick,retinal vein occlusion review.2018,asia-pacific journal of ophthalmology,7(1):40-45;pierru等人,occlusions veineuses r
é
tiniennes retinal vein occlusions.2017,journald'ophtalmologie,40(8):696-705)。所述疾患通常出现在具有诸如高血压、糖尿病和青光眼的既有疾患的55岁和以上的患者中。rvo无预计过程,因为其可能使患者视觉快速恶化或保持无症状。rvo的预后和相关治疗选择视疾病的分类而定,因为尽管表现相似,但不同的变异形式存在不同的风险因素。依据视网膜循环障碍的位置对疾病进行分类:分支视网膜静脉阻塞(brvo)、半视网膜静脉阻塞(hrvo)和中心视网膜静脉阻塞(crvo)。brvo更普遍,影响着0.4%世界人口,而crvo影响着0.08%世界人口。研究显示,brvo在亚裔和西班牙裔族群中比在高加索人中更为盛行(ip和hendrick,同上)。
10.rvo的治疗目前包括对所述疾患进行症状维持以避免其他并发症、黄斑水肿和新生血管性青光眼。抗vegf治疗目前为护理治疗标准,且可暂时改良视觉。其他治疗选择包括激光、类固醇和手术(pierru等人,同上)。
11.抗vegf剂目前被视为湿性amd、dme和rvo的护理治疗标准。2004年被fda批准用于湿性amd的第一治疗为(bausch&lomb的哌加他尼(pegaptanib)钠注射剂)。自彼时起,(genentech公司的雷尼珠单抗(ranibizumab)注射剂)和(regeneron pharmaceuticals公司的阿柏西普(aflibercept)注射剂)分别于2006年和2011年获批用于治疗湿性amd,以及dme和rvo继发性黄斑水肿。另外,在2019年10月,(novartis pharmaceuticals公司的布洛珠单抗(brolucizumab)注射剂)被fda批准用于治疗湿性amd。其他进展报道于以下文献中:amadio等人,targeting vegf in eye neovascularization:what's new?:a comprehensive review on current therapies and oligonucleotide-based interventions under development.2016,pharmacological research,103:253-69。
12.然而,尽管已取得这些进步,但抗vegf治疗仍存在局限性。由于快速玻璃体清除之故,大部分患者目前基本上在余生需要多次注射(诸如每月一次)。此外,并非所有患者皆响
应于抗vegf治疗。另外,这些治疗选择还具有与施用相关的潜在风险,包括感染、黄斑萎缩、视觉随时间下降、视网膜脱落和眼内压升高(iop)。患者的病苦包括不适、眼痛、视力下降和光敏感性增加。除了给患者带来负担和与频繁注射相关的风险以外,还存在已知与当前抗vegf治疗相关的其他局限性,诸如潜在免疫原性风险、生物制剂的复杂制造要求、黄斑萎缩和视网膜血管炎。重要的是,无论药物数目如何,目前皆预期患者可无限期地保持治疗。
13.开发了酪氨酸激酶抑制剂作为抑制酪氨酸蛋白激酶家族的受体酪氨酸激酶(rtk)的信号传导的化学治疗剂。rtk跨越细胞膜,具有细胞内(内部)和细胞外(外部)部分。在配位体结合至细胞外部分后,受体酪氨酸激酶二聚并启动由使用辅酶信使三磷酸腺苷(atp)的自磷酸化驱动的细胞内信号传导级联。许多rtk配位体为生长因子,诸如vegf。vegf是关于结合至诸多vegf受体(vegfr)类型,即,vegfr1-3(所有rtk),从而诱导血管生成的蛋白家族。结合至vegfr2的vegf-a为以上描述的抗vegf药物的标靶。vegfr1-3除外,已知若干其他rtk诱导血管生成,诸如由pdgf活化的血小板衍生生长因子受体(pdgfr)或由干细胞因子活化的干细胞生长因子受体/iii型受体酪氨酸激酶(c-kit)。
14.已经由不同的施用途径针对amd的治疗对一些tki进行评估,所述tki包括帕唑帕尼(pazopanib)(glaxosmithkline:nct00463320)、瑞戈菲尼(regorafenib)(bayer:nct02348359)和pan90806(panoptica:nct02022540)(皆呈滴眼剂形式施用),以及口服tkix-82(tyrogenex;nct01674569、nct02348359)。然而,由于倾向于具有低水溶解度的tki的溶液浓度低且tki在眼表面上停留时间短之故,局部施加的滴眼剂导致向玻璃体中渗透不良且向视网膜分布受限。此外,由于冲洗或使用者失误,局部施用后的药物浓度难以控制。此外,全身施用tki不可行,因为需要高剂量方能使药物在眼中、尤其在所要组织中达到有效浓度。此由于高全身暴露而导致不可接受的副作用。另外,药物浓度难以控制。另选地,已进行tki悬浮液的玻璃体内注射。然而,此种施用方式导致药物快速清除,且因此必须频繁地重复注射,诸如每天一次或至少每月一次。另外,若干tki溶解度不佳,导致玻璃体内注射后形成聚集物,其可能迁移或沉降至视网膜上并导致局部接触毒性和孔,诸如黄斑或视网膜孔。
15.因而,迫切需要用tki对诸如amd、dme和rvo的眼部疾病的改良治疗,所述改良的治疗在较长时间段内有效,从而避免了目前常用抗vegf疗法,尤其对抗vegf疗法无反应的个体(例如,多达33%的dme受试者)所需的频繁(每个月乃至每天)注射的需要。
16.本文中所公开的所有参考文献皆出于所有目的以引用的方式整体并入本文中。
技术实现要素:
17.本发明的某些实施方案的目标为提供一种包含诸如阿西替尼的酪氨酸激酶抑制剂(tki)的眼用植入物,其在较长时间段内对治疗患者的诸如新血管性年龄相关性黄斑退化(amd)、dme和rvo的眼部疾病有效。
18.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的酪氨酸激酶抑制剂(tki)的眼用植入物,其将tki持续释放至眼中。
19.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其预先装载至注射器中,从而避免在注射前污染所述植入物,因为不需要其他制备步骤。
20.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其为充分生物可降解的,即,在与tki释放一致的时间内自眼清除,从而避免在患者眼内产生漂浮物(空植入物媒剂残余物)和/或避免在治疗时段后需要自眼移除空植入物。
21.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其为生物可降解的,其中在植入物降解期间避免所述植入物分解成可能例如影响视觉的较小粒子。
22.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其中与注射之后在原位形成的水凝胶相比,所述眼用植入物的稳定性不太受眼中的变化环境,诸如玻璃体液粘度、玻璃体液ph、玻璃体液组成和/或眼内压(iop)影响。
23.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,所述植入物由于不含或实质上不含动物或人类来源的组分而为生物相容性的和非免疫原性的。
24.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其不含防腐剂(诸如抗微生物防腐剂)。
25.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其易于注射,特定来说,经玻璃体内。
26.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其含有治疗有效量的所述tki但其长度和/或直径相对较小。
27.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在干燥状态下尺寸稳定,但在水合时,例如在施用眼后改变其尺寸。
28.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在干燥状态下具有较小直径以安装至细直径针头(例如22至30号针头)的内腔,且在水合时,例如在施用眼后直径增大但长度减小;因而,提供一种微创施用方法。
29.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其呈干燥形式注射且在注射时原位(即,在眼中)水合。
30.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在置于眼中时在植入物表面具有低tki浓度,从而在所述植入物与眼细胞或组织(诸如视网膜)接触时避免tki毒性。
31.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在注射前的干燥状态和注射后(即,在眼内部)的水合状态下皆为稳定的并且具有限定的形状和表面积。
32.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其易于操纵,特定来说,不易溢出或破碎。
33.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其使得能够施用精确剂量(在宽剂量范围内),从而避免剂量过量和剂量不足的风险。
34.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其一般停留在施用其的眼区域中。
35.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其中所述植入物在施用后引起最低限度的视觉障碍或不造成视觉障碍。
36.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其为安全的且耐受良好。
37.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其不诱导重度不良事件,诸如重度眼不良事件。
38.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放治疗有效量的诸如阿西替尼的tki。
39.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放诸如阿西替尼的tki,从而避免需要频繁植入物施用。
40.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放诸如阿西替尼的tki,从而在此时段内抑制血管生成。
41.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放tki,其中在此时段内,诸如视网膜和脉络膜以及玻璃体液的眼组织中的tki水平始终维持在治疗有效水平,特定来说,足以抑制血管生成的水平。
42.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放诸如阿西替尼的tki,其中在此时段内,诸如视网膜和脉络膜以及玻璃体液的眼组织中未观测到tki的毒性浓度。
43.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放诸如阿西替尼的tki,其中所述tki未积聚在眼的前房中。
44.本发明的某些实施方案的另一目标为提供一种包含诸如阿西替尼的tki的眼用植入物,其在较长时段内,诸如在多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月的时段内持续释放tki,其中所述tki并未或实质上并未全身再吸收,从而实质上避免全身毒性。
45.本发明的某些实施方案的另一目标为提供一种治疗有需要的患者的诸如amd、dme和rvo的眼部疾病的方法,治疗时段多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月。
46.本发明的某些实施方案的另一目标为提供一种治疗有需要的患者的诸如amd、dme和rvo的眼部疾病的方法,治疗时段多达3个月或更久,诸如至少6个月、至少9个月、至少11个月或至少13个月,在所述治疗时段期间不需要施用救援药物,或其中在所述治疗时段期间仅需要偶尔施用救援药物,诸如1、2或3次。
47.本发明的某些实施方案的另一目标为提供一种在有需要的患者,诸如之前已用抗vegf治疗的患者或未进行过抗vegf治疗的患者中治疗诸如amd、dme和rvo的眼部疾病的方法。
48.本发明的某些实施方案的另一目标为提供一种在有需要的患者,诸如之前已用抗
vegf治疗且未响应先前抗vegf治疗的患者中治疗诸如amd、dme和rvo的眼部疾病的方法。
49.本发明的某些实施方案的另一目标为提供一种在有需要的患者,诸如诊断有继发于amd的原发性窝下新血管形成(sfnv)的患者中治疗诸如amd、dme和rvo的眼部疾病的方法。
50.本发明的某些实施方案的另一目标为提供一种在有需要的患者,诸如先前已用抗vegf治疗的诊断有先前经治疗的继发于新血管性amd的窝下新血管形成(sfnv)合并累及眼窝的渗漏的患者中治疗诸如amd、dme和rvo的眼部疾病的方法。
51.本发明的某些实施方案的另一目标为提供一种制造包含诸如阿西替尼的tki的眼用植入物的方法。
52.本发明的某些实施方案的另一目标为提供一种防止眼用植入物在储存和处理期间过早水合的方法,其中所述眼用植入物对水分敏感,以致其例如在水合时改变其尺寸。
53.本发明的某些实施方案的另一目标为提供一种减小注射眼用植入物期间的潜在组织损伤的方法。
54.本发明的某些实施方案的另一目标为提供一种药盒,其包括一个或多个包含诸如阿西替尼的tki的眼用植入物且任选地包括用于注射所述眼用植入物的构件。
55.本发明的某些实施方案的另一目标为提供一种在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中通过例如减少视网膜液来降低中心子场厚度(如通过光学相干断层扫描所测量)的方法。
56.本发明的某些实施方案的另一目标为提供一种在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中基本上维持中心子场厚度或预防中心子场厚度临床显著的增加(如通过光学相干断层扫描所测量)同时不增加视网膜液的方法。
57.本发明的某些实施方案的另一目标为提供一种在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中降低、基本上维持中心子场厚度或预防中心子场厚度临床显著的增加(如通过光学相干断层扫描所测量)同时改良或至少不削弱所述患者的视敏度(如例如通过最佳矫正视敏度所测量)的方法。
58.本发明的某些实施方案的另一目标为提供一种改良视觉由于涉及血管生成的眼部疾病而被削弱的患者的视觉的方法。
59.本发明的某些实施方案的另一目标为提供一种对视力由于存在视网膜液(例如由涉及血管生成的眼部疾病引起)而削弱的患者通过减少所述患者的视网膜液来改良视力(如例如通过以光学相干断层扫描所测量的中心子场厚度降低所证明)的方法。
60.本发明的这些目标和其他目标中的一个或多个是通过如本文中所公开和要求的一个或多个实施方案来解决。
61.在本说明书中公开且在独立权利要求中要求保护本发明的个别方面,而从属权利要求要求保护本发明的这些方面的特定实施方案和变化形式。以下详细描述中提供本发明的各个方面的细节。
62.贯穿本技术,引用了各种参考文献。这些参考文献的公开内容以引用的方式并入本发明中。在有冲突的情况下,以本技术中的公开内容为准。
附图说明
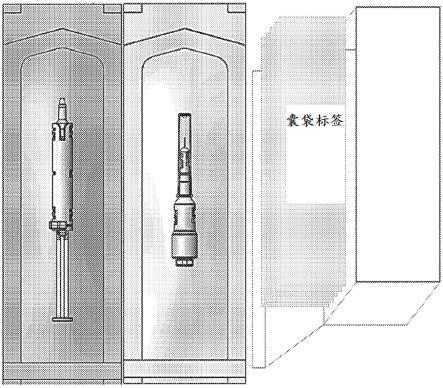
63.图1植入物包装的一个实施方案的示意性图示。在此实施方案中,植入物预先装载至与注射装置分开包装的薄壁针头中。针头已连接至注射装置的多合一装置也是可能的。
64.图2植入物定位的一个实施方案的示意性图示。注射之后,植入物在维持圆柱形状的同时原位水合。所述植入物被定位于眼后部。
65.图3水凝胶随时间生物降解的示意性图示。在药物释放时,随着低溶解度药物粒子(白色)逐渐溶解且药物自水凝胶扩散至周围水状液(例如玻璃体液),形成清除区(黑色)。随时间推移,凝胶降解并被再吸收,同时药物扩散出去。在降解过程中,凝胶逐渐溶胀,直至降解进行至收缩变形点。
66.图4不同的植入物的每天体外阿西替尼释放的一个实施方案。(a)在非漏槽溶解条件下来自包含625、716、245和490(2x245)μg阿西替尼剂量的不同植入物的体外阿西替尼释放。(b)来自556μg植入物的体外加速阿西替尼释放。
67.图5在兔中进行的低剂量研究的一个实施方案。(a)注射后一个月,兔中的1、2和3个植入物的红外反射(ir)。植入物的总体形状保持完整,与所施用的植入物数目无关。(b)1个月后,所有三种剂量(15、30和45μg)的血管渗漏皆得到有效抑制,而无植入物的对照动物的血管渗漏较高。误差棒表示标准偏差(sd;仅呈现上误差棒)。
68.图6兔眼的红外反射(ir)和光学相干断层扫描(oct)成像的一个实施方案。分别在植入物注射后1、3和6个月之后的视网膜形态的ir/oct图像。视网膜形态正常。
69.图7植入物生物降解和发炎的一个实施方案。(a)随时间推移在兔眼中观测到植入物的水凝胶组分显著生物降解。在注射后第4周和第8周,植入物仍为完整的,而在第12周,可见水凝胶降解的早期阶段。在第16周,植入物由于水凝胶结构丧失而进一步变窄。最终,在20和26周后不存在水凝胶,且在先前植入部位附近可见游离(未溶解)阿西替尼粒子(白色样本)。(b)组织病理学分析显示,26周之后在未溶解的阿西替尼区域中无发炎。图像以20倍放大率(标度:1000μm)和200倍放大率(标度:100μm)呈现。
70.图8在以227μg剂量施用阿西替尼植入物后用vegf攻击的兔中抑制血管渗漏的一个实施方案。对于有和无植入物的动物,在vegf攻击后,随时间(月)变化呈现血管渗漏评分(0(正常)至4(重度渗漏))。对于具有植入物的动物,在6个月的持续时间内观测到对血管渗漏的有效抑制。误差棒表示标准偏差(sd;仅呈现上误差棒)。
71.图9兔眼中两个植入物的红外反射(ir)成像的一个实施方案。植入物显示随时间降解。在第27天至第117天,植入物为完整的,而由于在第141天和第195天观测到水凝胶降解,故观测到植入物变窄。其余阿西替尼粒子在第141天和第195天合并至单一整体结构中。在水凝胶降解后,在先前植入部位附近注意到游离阿西替尼粒子(白色样本)。
72.图10兔眼中两个植入物的红外反射(ir)成像的一个实施方案。注射后0.5至3个月期间,植入物为完整的。6个月后,植入物由于水凝胶降解而变窄,且其余阿西替尼粒子合并至单一整体结构中。在24个月直至38个月,水凝胶降解后,在先前植入部位附近注意到游离阿西替尼粒子(白色样本)。
73.图11在无(第1组)和有(第2组)共同施用的情况下以290μg总剂量施用两种阿西替尼植入物后,用vegf攻击的兔中对血管渗漏的抑制的一个实施方案。第1组和第2组的动物以及无植入物的动物在vegf攻击之后随时间(月)变化呈现血管渗漏评分(0(正
常)至4(重度渗漏))。对于具有植入物的动物的所有组皆观测到对血管渗漏的显著抑制。误差棒表示标准偏差。
74.图12荧光素血管摄影术(fa)图像的一个实施方案显示显著渗漏,对照动物中在vegf攻击后48小时注射荧光素后,立即可见荧光素主动自血管系统渗漏(上图)和对自包括植入物的兔眼的血管渗漏的完全抑制(下图)。图像是在植入物注射后1个月,在vegf攻击之后收集。
75.图13对于未用植入物或抗vegf治疗剂治疗的兔(白色正方形和虚线)、仅用治疗的兔(黑色三角形,曲线拟合直至3个月)、有植入物的兔(黑色正方形、实线,直至12个月)以及有植入物和的兔(带条纹正方形和虚线,直至12个月)的平均血管渗漏评分的一个实施方案。对于接受植入物的所有动物,血管渗漏皆得到有效抑制,持续12个月。仅用抗vegf治疗剂治疗的动物在前2至4周内显示快速开始渗漏抑制,但3个月后再次发生渗漏。值表示平均值和平均值标准误差(sem)。
76.图14来自200μg植入物的体外阿西替尼释放的一个实施方案。(a)如通过体外即时分析所观测,在225天后,阿西替尼自200μg植入物完全释放。(b)如通过体外加速分析所观测,12天之后,阿西替尼自200μg植入物完全释放。体外资料不适用于所观测的体内释放。
77.图15来自第2组(2个植入物,每眼总计400μg阿西替尼)的第1号受试者的ir图像的一个实施方案。在注射当天,植入物清晰可见且形状良好。9个月后,植入物完全降解,而未溶解的阿西替尼保留在先前植入物位置。未溶解的阿西替尼继续释放药物,而11个月后几乎无未溶解的阿西替尼余留。
78.图16来自第1组(1个植入物,每眼总计200μg阿西替尼)的第1号受试者的研究眼的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。对于未进行过此治疗的受试者,观测到中心子场厚度(csft)显著降低,而最佳矫正视敏度(bcva)在10.5个月内未削弱。
79.图17用阿西替尼植入物治疗的罹患新血管性年龄相关性黄斑退化(湿性amd)的患者的研究眼中的中心子场厚度(csft)的一个实施方案(一个植入物,总剂量为200μg:第1组;两个植入物,总剂量为400μg:第2组;三个植入物,总剂量为600μg:第3a组;两个植入物,总剂量为400μg,和并行初始抗vegf:第3b组)。此图表中呈现与基线值相比的csft平均变化和平均值标准误差(sem)。对于此图表:对第1组中的六名患者随访直至第9个月。对第2组中的七名患者随访直至第12个月,五名直至第14个月,且两名直至第16个月。对第3a组中的六名患者随访直至第14天,五名直至第2个月,两名直至第4.5个月且一名直至第6个月和第7.5个月。对第3b组中的两名患者随访直至第3个月,且一名直至第4.5个月。随访正在进行中。
80.图18用阿西替尼植入物治疗的罹患新血管性年龄相关性黄斑退化(湿性amd)的患者的研究眼中的最佳矫正视敏度(bcva)的一个实施方案(一个植入物,总剂量为200μg:第1组;两个植入物,总剂量为400μg:第2组;三个植入物,总剂量为600μg:第3a组;两个植入物,总剂量为400μg,和并行初始抗vegf:第3b组)。此图表中呈现与糖尿病性视网膜病变早期治疗研究(etdrs)字母评分(可在一定距离准确读取的字母的代表值)基线值相比的bcva平均变化与平均值标准误差(sem)。对于此图表(如同针对以上图17):对第1组中的六名患者随访直至第9个月。对第2组中的七名患者随访直至第12个月,五名直至第14个月,且两名直至第16个月。对第3a组中的六名患者随访直至第14天,五名直至第2个月,两名直至第4.5个月
且一名直至第6个月和第7.5个月。对第3b组中的两名患者随访直至第3个月,且一名直至第4.5个月。随访正在进行中。
81.图19a和图19b来自第2组(2个植入物,每眼总计400μg阿西替尼)的在右眼(od)中注射植入物前有16个月阿柏西普治疗史的第1号受试者的研究眼的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。基线时(治疗前)视网膜下液清晰可见。重要的是,在植入物注射后2至3个月之后,视网膜下液消失,且此阶段基本上维持超过15.5个月(图19b中显示15.5个月,图19a中为更早期访视)。最佳矫正视敏度(bcva)未削弱。
82.图20来自第2组(2个植入物,每眼总计400μg阿西替尼)的第7号受试者的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。在研究开始前已接受阿柏西普6年的第7号受试者显示在植入物注射后9个月内,csft显著降低而bcva未削弱。
83.图21来自第3a组(3个植入物,每眼总计600μg阿西替尼)的第1号受试者的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。在来自第3a组的未进行过amd治疗的第1号受试者中,在2个月时观测到csft显著降低且维持7.5个月。bcva未削弱。
84.图22来自第3b组(2个植入物,每眼总计400μg阿西替尼,包括共同施用的抗vegf剂)的未进行过抗vegf治疗的第1号受试者的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。csft在7天内快速降低,且进一步降低并维持低值直至第3个月。
85.图23来自第3b组(2个植入物,每眼总计400μg阿西替尼,包括最初共同施用的抗vegf剂)的在植入物注射前已接受7个月抗vegf治疗的第2号受试者的谱域光学相干断层扫描(sd-oct)图像的一个实施方案。csft在7天内快速降低。维持低csft值直至第2个月。
86.图24当使用微粉化对比非微粉化阿西替尼在其他方面相同的条件下制备和浇注根据本发明的实施方案的水凝胶植入物时阿西替尼的聚集倾向的一个实施方案。
87.图25a和图25b用于将植入物注入患者的玻璃体液中的根据本发明的注入器的一个实施方案。注入器的此描绘实施方案包括hamilton注射器主体和nitinol推丝以部署植入物。图25a显示在射出成形外壳内部的hamilton注射器主体。图25b显示注入器的此实施方案的部件的示意性视图。
88.图26a由射出成形体制造的根据本发明的注入器的一个实施方案的分解视图。图26b显示完全组装的注入器的像片。图26c显示根据本发明的注入器的第一组件的分解视图。图26d显示根据本发明的注入器的第二组件的分解视图。图26e显示第一组件和第二组件可对准。图26f显示第二组件的外罩固定至第一组件的主体。图26g显示自第二组件的外罩移出的针头防护件和自第一组件的主体和柱塞移出的柱塞夹。图26h显示启动第一组件的柱塞以部署来自第二组件的针头的内腔的植入物。
89.图27利用根据本发明的一个实施方案的含有200μg阿西替尼的植入物的1期研究设计。
90.图28利用根据本发明的一个实施方案的含有600μg阿西替尼的植入物的建议2期研究设计。
91.定义
92.如本文中所用,术语“植入物”(有时也称为“贮存物”)是指一种物体,其含有活性剂,特定来说,诸如阿西替尼的酪氨酸激酶抑制剂(tki)和如本文中所公开的其他化合物,且施用人类或动物体内,例如眼睛的玻璃体液(也称为“玻璃体腔”或“玻璃体”)内,在其将
活性剂释放至周围环境中时在其中保留一段时间。植入物在注射之前可具有任何预定形状(诸如本文中所公开),所述形状在植入物置放于所要位置时在一定程度上得以维持,但施用之后,植入物的尺寸(例如长度和/或直径)可由于如本文中所进一步公开的水合而改变。换句话说,注射至眼中者并非溶液或悬浮液,而是已成形的凝聚物体。因此,在施用之前,植入物已如本文中所公开完全形成,且在本发明的实施方案中,植入物并非在眼中的所要位置原位产生(若有适合的配方一般也有可能)。一旦施用,随着时间推移,植入物会在生理环境中生物降解(如下文所描述),从而可改变其形状,同时减小尺寸,直至其完全溶解/吸收。在本文中,术语“植入物”用于指含有水时,处于水合(在本文中也称为“润湿”)状态的植入物,例如在植入物一旦施用眼睛或以其他方式浸入水性环境(例如体外)中而水合或再水合后,以及指处于其/干燥(干燥/去水)状态的植入物,即在植入物已生产并干燥之后且即将装载于针头中之前,或在装载于如本文中所公开针头中之后,或其中植入物已以干燥状态制得而无需去水。因此,在某些实施方案中,在本发明的上下文中处于干燥/干燥状态的植入物可含有不超过约1重量%的水。可例如通过卡尔费舍尔电量分析法测量处于干燥/干燥状态的植入物的水含量。每当本文中报告水合状态的植入物的尺寸(即长度、直径或体积)时,均应在将植入物浸入37℃的磷酸盐缓冲盐水中24小时之后来测量这些尺寸。每当本文中报告干燥状态的植入物的尺寸时,均应在植入物完全干燥(且因此,在某些实施方案中,含有不超过约1重量%的水)且植入物处于装载于针头中以便随后施用的状态之后来测量这些尺寸。在某些实施方案中,使植入物保持于含有低于20ppm的氧气与水分的惰性氛围手套箱中至少约7天。尺寸测量的实施方案的细节报告于实施例6.1中。
93.如本发明中所使用的术语“眼”一般是指眼睛,或眼睛的任何部分(如根据本发明的“眼用植入物”原则上可施用眼睛的任何部分)或任何眼病(如在一方面中,本发明一般是指治疗各种起源和性质的任何眼病(“眼部疾病”)。在某些实施方案中,本发明涉及眼用植入物的玻璃体内注射(在此情况下,“眼用植入物”因此为“玻璃体内植入物”),且涉及影响眼睛后段的眼部疾病的治疗,如下文所进一步公开。
94.本文中的术语“患者”包括人类与动物患者。因此,根据本发明的植入物适用于人类或兽医医学应用。实施例6中报告的在临床研究中招募且治疗的患者称为“受试者”。一般而言,“受试者”为(诸如在临床研究期间)施用了根据本发明的植入物的(人类或动物)个体。“患者”为由于特定的生理或病理条件而需要治疗的受试者。
95.术语“生物可降解的”是指在体内(即,当置于人体或动物体内时)降解的材料或物体(诸如根据本发明的眼用植入物)。在本发明的上下文中,如在下文中所详细公开,包含其中分散有tki粒子,诸如阿西替尼粒子的水凝胶的植入物一旦沉积于眼内,例如玻璃体液内,即随时间缓慢生物降解。在某些实施方案中,生物降解至少部分经由在玻璃体的水性环境中酯水解而发生。植入物缓慢溶解直至完全吸收,且在玻璃体中不再可见。
[0096]“水凝胶”为亲水性天然或合成聚合物(如本文中所公开)的三维网路,其可在水中膨胀且固持一定量的水,同时由于例如单个聚合物链的化学或物理交联而保持或基本上保持其结构。由于其高水分含量,故水凝胶柔软且有弹性,由此使其与天然组织非常相似。在本发明中,术语“水凝胶”用于指在其含有水时处于水合状态的水凝胶(例如,在水溶液中形成水凝胶之后,或在水凝胶一旦植入眼睛或身体其他部位或以其他方式浸入水性环境中(再)水合之后),且指在其干燥至例如不超过1重量%的低水含量时处于干燥(干燥/去水)
状态的水凝胶。在本发明中,其中活性成分含(例如分散)于水凝胶中,所述水凝胶也可称为“基质”。
[0097]
术语“聚合物网络”描述由彼此交联的(具有相同或不同的分子结构和具有相同或不同的分子量的)聚合物链形成的结构。本文中公开适用于本发明目的的聚合物类型。也如本文中所公开,聚合物网络还可通过交联剂形成。
[0098]
术语“非晶”是指在x射线或电子散射实验中不展示结晶结构的聚合物或聚合物网络或其他化学物质或实体。
[0099]
术语“半结晶”是指具有某种结晶特征,即在x射线或电子散射实验中展示某些结晶特性的聚合物或聚合物网络或其他化学物质或实体。
[0100]
术语“结晶”是指如通过x射线或电子散射实验所证明具有结晶特征的聚合物或聚合物网络或其他化学物质或实体。
[0101]
术语“前体”在本文中是指彼此反应且因此经由交联连接以形成聚合物网络且因此形成水凝胶基质的那些分子或化合物。虽然水凝胶中可能存在其他物质,诸如活性剂或缓冲剂,但并不将其称为“前体”。
[0102]
仍存在于最终聚合物网络中的前体分子部分在本文中也称为“单元”。因此,“单元”为形成水凝胶的聚合物网络的构筑嵌段或组分。举例来说,适用于本发明的聚合物网络可含有相同或不同的聚乙二醇单元,如本文中所进一步公开。
[0103]
如用于本发明目的且如本文中所公开的聚合物前体的分子量可通过本领域中已知的分析方法来确定。聚乙二醇的分子量可例如通过本领域中已知的任何方法来确定,包括凝胶电泳,诸如sds-page(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳),凝胶渗透层析法(gpc),包括具有动态光散射(dls)的gpc,液相层析法(lc)以及质谱法,诸如基质辅助激光脱附/离子化-飞行时间(maldi-tof)质谱法或电喷洒离子化(esi)质谱法。包括如本文中所公开的聚乙二醇前体的聚合物的分子量为平均分子量(基于聚合物的分子量分布),且因此可藉助于各种平均值来指示,包括重量均分子量(mw)和数量均分子量(mn)。在如用于本发明的聚乙二醇前体的情况下,本文中所指示的分子量为数量均分子量(mn)。
[0104]
在本发明的某些实施方案中,术语“纤维”(在本文中与术语“棒”可互换使用)表示一般具有细长形状的物体(即,在本例中为根据本发明的植入物)的特征。本文中公开了本发明的植入物的特定尺寸。植入物可具有圆柱形或基本上圆柱形的形状,或可具有非圆柱形的形状。纤维或植入物的横截面可为圆形或基本上圆形的,但在某些实施方案中也可为椭圆形或长方形,或在其他实施方案中可具有不同的几何形状,诸如十字形、星形或如本文中所公开的其他形状。
[0105]
如本文中所用,术语“释放”(和相应的术语“释放(released)”,“释放(releasing)”等)是指从本发明的植入物向周围环境提供诸如api的剂。周围环境可为如本文中所描述的体外或体内环境。在某些特定实施方案中,周围环境为玻璃体液和/或眼组织,诸如视网膜和脉络膜。因此,每当在本文中陈述植入物“释放”或“提供(持续)释放”tki(诸如阿西替尼)时,此情况不仅指在水凝胶尚未(完全)生物降解时直接自植入物中提供tki(诸如阿西替尼),且也指在水凝胶完全降解之后,在周围环境中仍然存在剩余tki(例如,如本文中所进一步公开的聚集形式)时,在较长时段内继续向周围环境提供tki(诸如阿西替尼)且继续发挥其治疗作用。因此,即使在植入物/水凝胶已如本文中所进一步公开完
全生物降解之后,本文中所指的“治疗期”(即,达到如本文中所描述的一定治疗效果的时期)还可延长一段时间。
[0106]
就本发明的目的而言,术语“持续释放”定义为指经调配以使药物在较长时段内可用的产品(在本发明的情况下,所述产品为植入物),由此使得与立即释放剂型(诸如注入眼睛的活性成分溶液)相比,给药频率降低。本文中可与“持续释放”互换使用的其他术语为“延续释放”或“控释”。因此,“持续释放”表示含于根据本发明的植入物中的api,特定来说tki,诸如阿西替尼的释放的特征。术语“持续释放”本身不与(体外或体内)释放的特定速率相关或限于所述特定释放速率,但在本发明的某些实施方案中,植入物可以一定平均释放速率(体外或体内)或如本文中所公开的一定释放形态为特征。由于本发明的植入物(无论在本文中明确称为“持续释放”植入物,或简称为“植入物”)提供了api的持续释放,因此本发明的植入物也可称为“贮存物”。
[0107]
每当在本文中陈述某种施用或注射与根据本发明的植入物的施用或注射“并行”或“同时”或“同一时间”进行时,此情况意谓两个或更多个植入物的分别注射或一个或多个植入物的注射以及例如如本文中所公开的抗vegf剂的悬浮液或溶液的注射,通常一个紧接一个地,即无任何明显延迟地进行。举例来说,若对一只眼睛施用总剂量约400μg阿西替尼,且所述总剂量包含于两个根据本发明的植入物中,各植入物含有约200μg阿西替尼,则通常在同一治疗过程内将此两个植入物一个紧接一个地注入玻璃体腔中,当然,应遵守所有注意事项,以确保在所需部位安全准确地注射,而无任何不必要的延迟。此举同样适用于一种或多种根据本发明的植入物的施用与如本文中所描述的另一抗vegf剂的施用并行/同时/同一时间进行。若另一抗vegf药物通过玻璃体内注射含有所述抗vegf药物的悬浮液或溶液来施用,则通常也意图在玻璃体内注射一种或多种根据本发明的植入物之前或之后立即,即理想地在一个治疗过程期间进行所述注射(如上文所描述)。
[0108]
然而,在特定情况下,例如若在施用第一植入物的过程中遇到并发症和/或进行注射的医师得出结论,建议不要在同一天或在之后的几天内在同一疗程中进行第二次注射,则也可例如在第一植入物之后一周或两周施用第二植入物。由于,如将在本文中所更详细公开,植入物可在人眼的玻璃体中持续较长时段,诸如约9至约12个月,因此在本发明的上下文中,例如相隔一或两周施用两个植入物仍视为“同时”。类似的考量也适用于根据本发明的植入物和抗vegf剂的“并行”施用。因此,可与玻璃体内施用本发明的植入物并行,即与本文中所描述同一时间或大约同一时间施用抗vegf剂。
[0109]
然而,在某些其他实施方案中,抗vegf剂也可与本发明的玻璃体内植入物组合施用,使得随后施用抗vegf剂,诸如在玻璃体内注射根据本发明的植入物之后1个月或2个月或3个月施用。
[0110]
术语“救援药物”一般指可在预定条件下(例如,在研究期间,若患者对研究治疗无足够反应的情况下)施用患者的药物,或指管理紧急状态的药物。本文实施例6中所公开的临床研究中用于施用救援药物的条件在实施例6的描述中的小标题“救援药物”下指示(关于救援药物施用百分比,具体参见表27)。在本发明的某些实施方案中,“救援药物”是指以玻璃体内注射抗vegf剂的溶液或悬浮液的形式施用的一剂量如本文中所公开的抗vegf剂。在某些特定实施方案中,救援药物为藉助于玻璃体内注射施用的一剂量(2mg)阿柏西普。
[0111]
如本文中所用,与测量数量相关的术语“约”是指所述测量数量的正常变化,如本
领域普通技术人员在进行测量和执行与测量目标和测量设备的精度相称的护理水平时所期望。
[0112]
与测量数量相关的术语“至少约”是指测量数量的正常变化,如本领域普通技术人员在进行测量和执行与测量目标和测量设备的精度相称的护理水平时所期望,和高于所述数量的任何数量。
[0113]
如本文中所用,术语“平均值”是指一组数据(点)中的中心值或典型值,其为通过将所述组中的数据(点)的总和除以其数量来计算(即,一组数据的平均值)。
[0114]
除非上下文另外明确指示,否则如本文中所用,单数形式“一(a)”、“一(an)”和“所述”包括多个提及物。
[0115]
如本文中在诸如“a和/或b”的短语中所用的术语“和/或”意图包括“a和b”和“a或b”。
[0116]
如本文中所用的开放术语,诸如“包括(include)”、“包含(including)”、“含有(contain)”、“含有(containing)”和其类似物欲指要素、方法步骤或其类似物的开放式列表或枚举,且因此不欲指限于所列举的要素、方法步骤或其类似物,且也包括其他未引用的要素、方法步骤或其类似物。
[0117]
术语“至多”在本文中与一定值或数字一起使用时意谓包括各别值或数字。
[0118]
术语“由a至b”、“由a至b的”和“a至b的”在本文中可互换使用,且均指由a至b的范围,包括上限和下限a和b。
[0119]
术语“api”、“活性(药物)成分”、“活性(药物)剂”、“活性(药物)成分”、“(活性)治疗剂”、“活性剂”和“药物”在本文中可互换使用,且是指用于最终药物产品(fpp)的物质以及用于制备所述最终药物产品、旨在提供药理活性或对诊断、治愈、缓解、治疗或预防疾病产生直接影响,或对恢复、纠正或改变患者的生理功能产生直接影响的物质。
[0120]
在某些实施方案中,根据本发明使用的tki为阿西替尼。阿西替尼为用于治疗晚期肾细胞癌的(pfizer,ny)中的活性成分。其为小分子(386.47道尔顿(dalton))合成酪氨酸激酶抑制剂。作用的主要机制为通过抑制受体酪氨酸激酶来抑制血管生成(新血管的形成),所述受体酪氨酸激酶主要为:vegfr-1、vegfr-2、vegfr-3、pdgfr-β和c-kit(keating.axitinib:a review in advanced renal cell carcinoma.2015,drugs,75(16):1903-13;kernt等人,inhibitory activity of ranibizumab,sorafenib,and pazopanib on light-induced overexpression of platelet-derived growth factor and vascular endothelial growth factor a and the vascular endothelial growth factor receptors 1 and 2 and neuropilin 1and 2.2012,retina,32(8):1652-63),其参与病理性血管生成、肿瘤生长和癌症进展。因此,阿西替尼为抑制vegf与pdgf途径的多标靶抑制剂。
[0121]
阿西替尼的分子式为c
22h18
n4os,且其iupac名称为n-甲基-2-[3-((e)-2-吡啶-2-基-乙烯基)-1h-吲唑-6-基硫基]-苯甲酰胺。其具有以下化学结构:
[0122][0123]
已确定阿西替尼在生物相关介质(pbs,37℃下的ph 7.2)中的溶解度低,约为0.4至0.5μg/ml。其分配系数(正辛醇/水)为4.2(logp;参见drugbank条目“阿西替尼”)。
[0124]
为了本发明的目的,可使用所有可能形式的活性剂(包括阿西替尼),包括任何活性剂多晶型物或活性剂的任何药学上可接受的盐、无水物、水合物、其他溶剂合物或衍生物。每当在本说明书中或在申请专利范围中,活性剂名称为例如“阿西替尼”时,即使未明确说明,其还指活性剂的任何所述多晶型物、药学上可接受的盐、无水物、溶剂合物(包括水合物)或衍生物。
[0125]
如本文中所用的术语“多晶型物”是指诸如阿西替尼的活性剂的任何结晶形式。通常,在室温下为固体的活性剂以多种不同的结晶形式存在,即多晶型物,其中一种多晶型物在既定温度和压力下为热力学上最稳定的。
[0126]
关于阿西替尼,阿西替尼的适合固体形式和多晶型物,包括无水形式和溶剂合物,例如描述于a.m.campeta等人,journal of pharmaceutical sciences,第99卷,第9期,2010年9月,3874-3886中。所有阿西替尼多晶型物(无水形式或溶剂合物)均可用于制备根据本发明的某些实施方案的植入物,包括阿西替尼的热力学最稳定的多晶型物,例如在us 8,791,140 b2中称为xli。xli为阿西替尼的无水结晶形式。在本发明的某些实施方案中,用于制备根据本发明的植入物的阿西替尼为无水结晶形式xli。在某些其他实施方案中,适用于本发明的阿西替尼的结晶无水形式包括(但不限于)多晶型物i、iv、vi和xxv。除了无水形式外,还存在许多阿西替尼与各种溶剂的溶剂合物,如也在引用的领域中所描述,其也可全部用于制备根据本发明的植入物。所有上述形式均特征明显且在业内,诸如在上文所引用的campeta等人的论文或专利文献(包括但不限于us 8,791,140 b2、us 2006/0094763和wo 2016/178150 a1)中有所描述。本领域中,特定来说(但不限于)本文所引用的参考文献中已知且公开的任何阿西替尼多晶形式均可用于本发明。
[0127]
在某些特定实施方案中,用于制备根据本发明的植入物和/或存在于根据本发明的植入物中的阿西替尼以包含至少五个选自以下的特征2θ峰的xrd图案为特征:8.3、9.3、13.7、15.6、16.1、16.5、17.6、18.6、21.0、22.6、23.1、23.4、24.1和26.0,各值
±
0.2 2θ
°
。特定来说,用于制备根据本发明的植入物和/或存在于根据本发明的植入物中的阿西替尼以包含至少五个选自8.3、9.3、15.6、16.5、17.6、21.0、24.1和26.0(各值
±
0.2 2θ
°
)的特征2θ峰的xrd图案,和/或包含26.1、114.7、154.8和167.8(各位移
±
0.2ppm)的化学位移的dmso溶剂中的
13
c nmr,和/或包含171.1、153.2、142.6、139.5、131.2、128.1和126.3(各位移
±
0.2ppm)的化学位移的
13
c固态nmr为特征,和/或以包含范围介于213℃至217℃(峰1)之间和219℃至224℃(峰2)之间的两个吸热峰的dsc等温线为特征。在一个特定实施方案中,wo 2016/178150中所公开的阿西替尼的非溶剂化结晶形式sab-i可用于制备根据本发明的植入物。
[0128]
阿西替尼抑制vegf信号传导,且也抑制pdgf信号传导。除抑制vegf/pdgf外,其还
抑制c-kit,一种血管发育的存活因子,清除半衰期(t
1/2
)为数小时(rugo等人,phase i trial of the oral antiangiogenesis agent ag-013736in patients with advanced solid tumors.2005,j clin oncol.,23(24):5474-83),而雷尼珠单抗和阿柏西普在人眼中的t
1/2
各为数天。这些大分子抗体的较长t
1/2
使其能够维持有效的组织浓度达数周,而小分子清除得更快。然而,由于阿西替尼的溶解度低且其包含在保留于玻璃体液(vh)中较长时段(诸如数月)的本发明的水凝胶植入物中,因此在植入物持续存在于vh中的时段内传递治疗有效量的阿西替尼。因此,阿西替尼的玻璃体内持续递送提供多标靶抑制剂,其原则上无需联合疗法且也无需频繁玻璃体内注射即可抑制vegf与pdgf途径。
[0129]
如本文中所用,术语“治疗有效的”是指在施用后产生一定所要治疗结果所需的药物或活性剂的量。举例来说,在本发明的上下文中,一种所要治疗结果将为在患有新血管性amd的患者中通过光学相干断层扫描降低中心子场厚度(csft),因为患有新血管性amd的患者的csft升高。在本发明的上下文中,“治疗有效”量的活性剂也可为所述活性剂针对特定底物提供的ic
50
的倍数,诸如ic
50
的50倍或更多倍。举例来说,表12中列出了tki阿西替尼对血管生成相关rtk的ic
50
值。
[0130]
当在本文中使用时,缩写“pbs”意谓磷酸盐缓冲盐水。
[0131]
当在本文中使用时,缩写“peg”意谓聚乙二醇。
具体实施方式
[0132]
i.植入物
[0133]
活性成分:
[0134]
本发明的一个方面为一种持续释放生物可降解眼用植入物,其包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki),其中tki粒子分散在所述水凝胶内。在一个实施方案中,本发明提供一种持续释放生物可降解眼用植入物,其包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki),其中tki粒子分散在所述水凝胶内,且其中所述植入物在其干燥状态下的长度小于约17mm。
[0135]
本发明的此方面的植入物中所含的活性成分为tki。适合tki的实施例为阿西替尼、索拉非尼(sorafenib)、舒尼替尼(sunitinib)、尼达尼布(nintedanib)、帕唑帕尼、瑞戈菲尼、卡博替尼(cabozantinib)和凡德他尼(vandetanib)。在特定实施方案中,本发明的这个和其他方面中所用的tki为阿西替尼。关于阿西替尼、其化学结构、多晶型物、溶剂合物、盐等和其性质(诸如溶解度)的细节提供于以上定义部分中。
[0136]
本文所公开的关于根据本发明的植入物的所有特征(个别地或特征的任何组合)可用于描述包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki)的所述持续释放生物可降解眼用植入物的特征,其中tki粒子分散在所述水凝胶内,且其中所述植入物在其干燥状态下的长度小于约17mm。
[0137]
在特定实施方案中,本发明的植入物为玻璃体内植入物,即向玻璃体液施用(在本文中也称为“经玻璃体内施用”)。
[0138]
tki(诸如阿西替尼)以如本文中所公开的至少150μg的剂量范围包含在本发明的植入物中,诸如约150μg至约1800μg、约150μg至约1200μg、或约200μg至约800μg。可使用这些范围内的量的任何tki(诸如阿西替尼),诸如约150μg、约200μg、约300μg、约400μg、约500
μg、约600μg、约700μg、约800μg、约900μg、约1000μg、约1100μg、或约1200μg。在替代实施方案中,本发明的植入物中所含有的tki(诸如阿西替尼)的剂量也可高达约1800μg,诸如约1300μg、约1400μg、约1500μg、约1600μg、约1700μg、或约1800μg。在其他替代实施方案中,本发明的植入物中所含有的tki(诸如阿西替尼)的剂量甚至可高于约1800μg或高于约2000μg,诸如高达约3000μg、高达约6000μg或高达约10000μg。所有提及的值也包括 25%和-20%的变异数,或 /-10%的变异数。
[0139]
在某些特定实施方案中,本发明的植入物中所含有的阿西替尼的剂量为:
[0140]-约160μg至约250μg、或约180μg至约220μg的范围,或约200μg(即,包括200μg的 25%和-20%的变异数,或 /-10%的变异数)
[0141]-约320μg至约500μg、或约360μg至约440μg的范围,或约400μg(即,包括400μg的 25%和-20%的变异数,或 /-10%的变异数)
[0142]-约375μg至约600μg、或约450μg至约550μg的范围,或约500μg(即,包括500μg的 25%和-20%的变异数,或 /-10%的变异数)
[0143]-约480μg至约750μg、或约540μg至约660μg的范围,或约600μg(即,包括600μg的 25%和-20%的变异数,或 /-10%的变异数)
[0144]-约640μg至约1000μg、或约720μg至约880μg的范围,或约800μg(即,包括800μg的 25%和-20%的变异数,或 /-10%的变异数)
[0145]-约800μg至约1250μg、或约900μg至约1100μg的范围,或约1000μg(即,包括1000μg的 25%和-20%的变异数,或 /-10%的变异数)
[0146]-约960μg至约1500μg、或约1080μg至约1320μg的范围,或约1200μg(即,包括1200μg的 25%和-20%的变异数,或 /-10%的变异数)
[0147]-约1440μg至约2250μg、或约1620μg至约1980μg的范围,或约1800μg(即,包括1800μg的 25%和-20%的变异数,或 /-10%的变异数)。
[0148]
在一个优选实施方案中,本发明的一种植入物中所含有的阿西替尼的剂量为约480μg至约750μg、或约540μg至约660μg,或在特定实施方案中为约600μg。
[0149]
tki(诸如阿西替尼)的所公开量,包括所提及的变异数,既指植入物中的活性成分的最终含量,也指制造植入物时用作每种植入物起始组分的活性成分的量。
[0150]
如将在下文中更详细地公开且自实施例部分将显而易见地,在本发明的某些实施方案中,向患者施用的tki(诸如阿西替尼)的总剂量可含于同时施用的两个、三个或更多个植入物中。举例来说,约400μg tki(诸如阿西替尼)的剂量可以含有约400μg阿西替尼的一个植入物施用,或以例如各自含有约200μg阿西替尼的两个植入物施用,等。当然,不仅可组合两个或更多个相同的植入物(或含有相同剂量的植入物),而且可组合两个或更多个不同的植入物(或含有不同剂量的植入物)以达到所需的总剂量。在一特定实施方案中,约480μg至约750μg、或约540μg至约660μg、或约600μg的总阿西替尼剂量含于一个植入物中,且仅将一个所述植入物向需要根据本发明的所述治疗的患者施用。在另一实施方案中,高于约600μg,诸如约800μg至约1250μg、或约900μg至约1100μg、或约1000μg的总剂量,或约960μg至约1500μg、或约1080μg至约1320μg、或约1200μg的总剂量,或约1440μg至约2250μg、或约1620μg至约1980μg、或约1800μg的总剂量含于一个植入物中,且仅将一个所述植入物向需要根据本发明的所述治疗的患者施用。在其他实施方案中,根据本发明向患者施用的总剂量可含
于同时施用的两个或更多个植入物中(含有相同或不同量的api)。
[0151]
tki(诸如阿西替尼)含于本发明的植入物中,且分散或分布于由聚合物网络组成的水凝胶中。在某些实施方案中,粒子均质或基本上均质分散于水凝胶中。水凝胶可防止粒子聚集,且可向粒子提供基质,所述基质将其保持在眼中的所需位置,同时缓慢释放药物。
[0152]
在本发明的某些实施方案中,tki粒子(诸如阿西替尼粒子)可经微囊封。术语“微囊”(也称为“微粒”)有时定义为大小在例如约50nm至约2mm之间变化的大致球形的粒子。微囊具有至少一个囊封在周围材料(有时也称为壳)中的活性剂的离散域(或核心)。为了本发明的目的,一种用于微囊封tki(诸如阿西替尼)的适合剂(并非将本公开限制于此)为聚(乳酸-共-乙醇酸)。
[0153]
在其他实施方案中,tki粒子(诸如阿西替尼粒子)未经微囊封且因此原样分散于水凝胶中且因此分散于本发明的植入物中,即,不会与另一材料诸如(但不限于)聚(乳酸-共-乙醇酸)混合或邻接所述另一材料或由所述另一材料微囊封。
[0154]
在一个实施方案中,tki粒子(诸如阿西替尼粒子)可为微粉化粒子。在另一实施方案中,tki粒子(诸如阿西替尼粒子)可能不经微粉化。微粉化是指减小固体材料粒子的平均直径的工艺。直径减小的粒子尤其可具有更高的溶解和侵蚀速率,此增加活性药物成分的生物利用度,且在某些实施方案中可对释放动力学具有积极影响。此外,微粉化粒子在制造操作期间可能具有降低的聚集倾向(也参见图24)。在复合材料领域,已知当与基质组合时,粒径会影响机械性质,对于既定质量分数,较小的粒子可提供出色的增强作用。因此,与类似质量分数的较大tki粒子相比,填充有微粉化tki粒子的水凝胶基质可具有改良的机械性质(例如,脆性、破坏应变等)。所述性质在植入物的制造中、植入期间和降解期间为重要的。微粉化也可促进活性成分在所选剂型或基质中的更均质分布。粒径分布可通过本领域中已知的方法来测量,包括筛分、激光衍射或动态光散射。在本发明的某些实施方案中,如通过激光衍射所测定,制备本发明的植入物中所用的tki(诸如阿西替尼)粒子可具有小于约100μm的d90和/或小于约50μm的d50,或小于约75μm的d90和/或小于约20μm的d50。在特定实施方案中,如通过激光衍射所测定,tki(诸如阿西替尼)的d90可为小于约30μm,小于约20μm。在极特定实施方案中,如通过激光衍射所测定,tki(诸如阿西替尼)的d90小于约10μm。在这些或其他实施方案中,如通过激光衍射所测定,制备本发明的植入物中所用的tki(诸如阿西替尼)粒子的d50可为小于约5μm。在这些或其他实施方案中,如通过激光衍射所测定,本发明中所用的tki(诸如阿西替尼)粒子的d10可为小于约3μm。在某些实施方案中,如通过激光衍射所测定,制备本发明的植入物中所用的tki(诸如阿西替尼)粒子的d100可为小于约20μm。“d90”(在本文中也称为“d90”)值意指,所测量的块状材料(具有一定的粒径分布)内90体积%的所有粒子的粒径低于指示值。举例来说,小于约10μm的d90粒径意指,所测量的块状材料中90体积%的粒子的粒径低于约10μm。相应的定义适用于其他“d”值,诸如“d10”、“d50”或“d100”值(在本文中分别也称为“d10”、“d50”和“d100”值)。在某些其他实施方案中,也可使用直径超过此规格的tki(诸如阿西替尼)粒子。
[0155]
微粉化tki(诸如阿西替尼)粒子可按照规格自供应商处购买,或可例如根据以下例示性程序制备(公开于wo 2016/183296 a1,实施例13中):将1800ml无菌注射用水(wfi)量入2l烧杯中且置于带有搅拌棒、以600rpm搅拌的搅拌盘上,在烧杯中心产生大的wfi涡流。将一个含有于乙醇中的阿西替尼的60ml bd注射器置于注射泵上,所述注射泵夹钳于
wfi烧杯上方。皮下针(21g,bd)连接至注射器,且直接对准涡流中心以分散阿西替尼溶液。随后以7.5ml/min运作注射泵,以便将阿西替尼溶液逐滴添加至wfi,以使微粉化阿西替尼沉淀。微粉化后,将阿西替尼例如经由0.2μm真空过滤器过滤,且用wfi冲洗。过滤后,例如通过使用刮勺自过滤器收集阿西替尼粉末,且真空干燥较长时间段,诸如约12或约24小时,以便移除过量溶剂。使阿西替尼微粉化的另一例示性方法公开于wo 2017/091749的实施例9中。所描述的微粉化方法并非限制性的,且可同等地使用使活性剂(诸如阿西替尼)微粉化的其他方法。所公开的微粉化方法(或其他方法)也可用于阿西替尼以外的其他活性剂。
[0156]
本发明的另一方面为一种持续释放生物可降解眼用植入物,其包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki),其中tki粒子分散在所述水凝胶内,且其中所述植入物在其干燥状态下的总重量为约0.2mg至约1.5mg。在某些实施方案中,所述tki为阿西替尼或如本文公开的另一tki。
[0157]
在某些实施方案中,根据本发明的植入物在其干燥状态下的总重量(在本文中也称为“总质量”)可为约400μg至约1.2mg。在某些特定实施方案中,根据本发明的植入物在其干燥状态下的总重量可为约0.3mg至约0.6mg,诸如约0.4mg至约0.5mg,或可为约0.8mg至约1.1mg,诸如约0.9mg至约1.0mg。
[0158]
本文所公开的关于根据本发明的植入物的所有特征(个别地或特征的任何组合)可用于描述包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki)的所述持续释放生物可降解眼用植入物的特征,其中tki粒子分散在所述水凝胶内,且其中所述植入物在其干燥状态下的总重量为约0.2mg至约1.5mg。
[0159]
聚合物网络:
[0160]
在某些实施方案中,水凝胶可由具有形成交联以产生聚合物网络的官能团的前体形成。聚合物股绳或臂之间的这些交联本质上可为化学的(即,可为共价键)和/或物理的(诸如离子键、疏水性缔合、氢桥等)。
[0161]
聚合物网络可自前体制备,自一种类型的前体或自两种或更多种类型的允许反应的前体制备。前体是考虑所得水凝胶所需的性质来选择。存在用于制备水凝胶的各种适合前体。一般而言,形成水凝胶的任何药学上可接受和可交联的聚合物可用于本发明的目的。水凝胶和因此并入其中的组分,包括用于制备聚合物网络的聚合物,在生理学上应为安全的,以使其不会引起例如免疫反应或其他不良反应。水凝胶可由天然、合成或生物合成的聚合物形成。
[0162]
天然聚合物可包括糖胺聚糖、多糖(例如,葡聚糖)、聚氨基酸和蛋白质或其混合物或组合。
[0163]
合成聚合物一般可为通过不同类型的聚合,包括自由基聚合、阴离子或阳离子聚合、链增长或加成聚合、缩合聚合、开环聚合等,由多种原料合成制备的任何聚合物。聚合可由某些引发剂、光和/或热引发,且可由触酶介导。
[0164]
一般而言,出于本发明的目的,可使用包含一种或多种以下的单元的组的一种或多种合成聚合物:聚烷二醇诸如聚乙二醇(peg)、聚丙二醇、聚(乙二醇)-嵌段-聚(丙二醇)共聚物、或聚环氧乙烷、聚环氧丙烷、聚乙烯醇、聚(乙烯基吡咯烷酮)、聚乳酸、聚乳酸-共-乙醇酸,所述中任一种的无规或嵌段共聚物或组合或混合物,但此清单并非意图进行限制。
[0165]
为形成共价交联的聚合物网络,前体可彼此共价交联。在某些实施方案中,具有至
少两个反应中心的前体(例如,在自由基聚合中)可用作交联剂,因为各反应基团可参与形成不同的增长聚合物链。
[0166]
前体可具有生物惰性和亲水性部分,例如核心。在具支链聚合物的情况下,核心是指分子连接至自核心延伸的臂的连续部分,其中臂带有官能团,所述官能团通常在臂或支链的末端。多臂peg前体为所述前体的实例,且在下文进一步公开。
[0167]
因此,用于本发明的水凝胶可例如由具有第一(组)官能团的一种多臂前体和具有第二(组)官能团的另一多臂前体制备。举例来说,多臂前体可具有经一级胺(亲核体)封端的亲水性臂,例如聚乙二醇单元,或可具有活化的酯端基(亲电体)。根据本发明的聚合物网络可含有彼此交联的相同或不同的聚合物单元。
[0168]
某些官能团可通过使用活化基团而更具反应性。所述活化基团包括(但不限于)羰基二咪唑、磺酰氯、芳基卤化物、磺基琥珀酰亚胺基酯、n-羟基琥珀酰亚胺基酯、琥珀酰亚胺基酯、环氧化物、醛、马来酰亚胺、亚胺酯、丙烯酸酯等。n-羟基琥珀酰亚胺酯(nhs)为用于交联亲核聚合物,例如一级胺封端或硫醇封端的聚乙二醇的有用基团。nhs-胺交联反应可在水溶液中,且在缓冲液,例如磷酸盐缓冲液(ph 5.0-7.5)、三乙醇胺缓冲液(ph 7.5-9.0)、硼酸盐缓冲液(ph 9.0-12)或碳酸氢钠缓冲液(ph 9.0-10.0)存在下进行。
[0169]
在某些实施方案中,各前体可仅包含亲核或亲电子官能团,只要亲核和亲电子前体两者均用于交联反应中。因此,举例来说,若交联剂仅具有亲核官能团,诸如胺,则前体聚合物可具有亲电子官能团,诸如n-羟基琥珀酰亚胺。另一方面,若交联剂具有亲电子官能团,诸如磺基琥珀酰亚胺,则官能聚合物可具有亲核官能团,诸如胺或硫醇。因此,官能聚合物,诸如蛋白质、聚(烯丙基胺)或胺封端的二或多官能聚(乙二醇)也可用于制备本发明的聚合物网络。
[0170]
在一个实施方案中,第一反应性前体各自具有约2至约16个亲核官能团(称为官能度),且允许与第一反应性前体反应以形成聚合物网络的第二反应性前体各自具有约2至约16个亲电子官能团。反应性(亲核或亲电子)基团的数目为4的倍数,因此例如具有4、8和16个反应性基团的反应性前体特别适用于本发明。官能团的任何数目,诸如包括2、3、4、5、6、7、8、9、10、11、12、13、14、15或16个基团中的任一者,对于根据本发明使用的前体均为可能的,同时确保官能度足以形成充分交联的网状结构。
[0171]
peg水凝胶:
[0172]
在本发明的某些实施方案中,形成水凝胶的聚合物网络含有聚乙二醇(peg)单元。在本领域中已知peg在交联时形成水凝胶,且这些peg水凝胶适合于药物应用,例如作为意图向人类或动物身体所有部位施用的药物的基质。
[0173]
本发明的水凝胶植入物的聚合物网络可包含一个或多个具有2至10个臂,或4至8个臂,或4、5、6、7或8个臂的多臂peg单元。peg单元可具有不同或相同数目的臂。在某些实施方案中,本发明的水凝胶中所用的peg单元具有4和/或8个臂。在某些特定实施方案中,使用4臂和8臂peg单元的组合。
[0174]
所使用的peg的臂数有助于控制所得水凝胶的柔性或柔软性。举例来说,与由相同分子量的8臂peg形成的水凝胶相比,通过使4臂peg交联形成的水凝胶一般更柔软且柔性更大。特定来说,若需要如下文在与植入物的制造有关的部分中所公开在干燥之前或之后拉伸水凝胶,则可使用柔性更大的水凝胶,诸如4臂peg,任选地与另一多臂peg,诸如上文公开
的8臂peg组合。
[0175]
在本发明的某些实施方案中,用作前体的聚乙二醇单元的平均分子量在约2,000至约100,000道尔顿的范围内,或在约10,000至约60,000道尔顿的范围内,或在约15,000至约50,000道尔顿的范围内。在某些特定实施方案中,聚乙二醇单元的平均分子量在约10,000至约40,000道尔顿的范围内,或为约20,000道尔顿。可使用具有相同平均分子量的peg前体,或可将具有不同平均分子量的peg前体彼此组合。本发明中所用的peg前体的平均分子量以数均分子量(mn)给出,其在某些实施方案中可通过maldi确定。
[0176]
在4臂peg中,各臂的平均臂长(或分子量)可为peg的总分子量除以4。因此,作为可用于本发明的一种前体的4a20kpeg前体具有4个臂,各臂的平均分子量为约5,000道尔顿。因此,除了本发明中的4a20kpeg前体以外,还可使用的8a20k peg前体具有8个臂,各臂的平均分子量为2,500道尔顿。与较短的臂相比,较长的臂可提供增加的柔性。与臂较短的peg相比,臂较长的peg可能溶胀更大。与具有较高臂数的peg相比,具有较低臂数的peg也可能溶胀更大且柔性更大。在某些特定实施方案中,在本发明中可使用具有不同臂数的peg前体的组合,诸如4臂peg前体和8臂前体的组合。另外,较长的peg臂在干燥时具有较高的熔融温度,此可在储存期间提供更大的尺寸稳定性。举例来说,与三赖氨酸交联的分子量为15,000道尔顿的8臂peg可能无法在室温下维持拉伸配置,而与8臂20,000道尔顿peg交联的4臂20,000道尔顿peg可能在室温下在拉伸配置下尺寸稳定。
[0177]
当提及具有一定平均分子量的peg前体(诸如15kpeg前体或20kpeg前体)时,所指示平均分子量(即分别为15,000或20,000的mn)是指前体在添加端基之前的peg部分(此处“20k”意指20,000道尔顿,且“15k”意指15,000道尔顿
–
相同的缩写在本文用于peg前体的其他平均分子量)。在某些实施方案中,前体的peg部分的mn是通过maldi确定。如本文所公开的经端基取代的程度可在端基官能化之后藉助于1h-nmr确定。
[0178]
在某些实施方案中,用于制备本发明的水凝胶的peg前体所用的亲电子端基为n-羟基琥珀酰亚胺基(nhs)酯,包括但不限于:“saz”,其是指壬二酸琥珀酰亚胺酯端基;“sap”,其是指己二酸琥珀酰亚胺酯端基;“sg”,其是指戊二酸琥珀酰亚胺酯端基;和“ss”,其是指琥珀酸琥珀酰亚胺酯端基。
[0179]
在某些实施方案中,用于制备本发明的水凝胶的peg前体所用的亲核端基为胺(表示为“nh
2”)端基。硫醇(-sh)端基或其他亲核端基也是可能的。
[0180]
在某些优选实施方案中,平均分子量为约20,000道尔顿且具有如上文所公开的亲电子端基的4臂peg和平均分子量也为约20,000道尔顿且具有如上文所公开的亲核端基的8臂peg交联以形成聚合物网络,且因此形成根据本发明的水凝胶。
[0181]
含亲核基团的peg单元和含亲电子基团的peg单元(诸如含胺端基的peg单元和含活化酯基的peg单元)的反应产生多个由具有下式的可水解连接基交联的peg单元:其中m为0至10的整数,且具体地为1、2、3、4、5、6、7、8、9或10。在一个特定实施方案中,m为6,例如在使用含saz端基的peg的情况下。对于sap端基,m将为3,对于sg端基,m将为2,且对于ss端基,m将为1。聚合物网络内的所有交联可为相同的,或可为不同的。
[0182]
在某些优选实施方案中,saz端基用于本发明。此端基可增加在眼中的持续时间,且包括包含peg-saz单元的水凝胶的本发明的某些实施方案的植入物仅在较长时间段(例如,如下文进一步公开的9至12个月)后,才在眼中,诸如在人眼的玻璃体液中生物降解,且在某些情况下可持续甚至更久。saz基比例如sap、sg或ss端基的疏水性更高,因为链中的碳原子数更大(m为6,酰胺基与酯基之间的碳原子总数为7)。
[0183]
在某些优选实施方案中,4臂20,000道尔顿peg前体与8臂20,000道尔顿peg前体组合,诸如具有saz基(如上文所定义)的4臂20,000道尔顿peg前体与具有胺基(如上文所定义)的8臂20,000道尔顿peg前体组合。这些前体在本文中也分别缩写为4a20kpeg-saz和8a20kpeg-nh2。4a20kpeg-saz的化学结构为:
[0184][0185]
其中r表示新戊四醇核心结构。8a20kpeg-nh2(具有六甘油核心)的化学结构为:
[0186][0187]
在上式中,n由各别peg臂的分子量确定。
[0188]
在某些实施方案中,彼此反应的亲核端基和亲电子端基的莫耳比为约1:1,即,每一个saz基团提供一个胺基。在4a20kpeg-saz和8a20kpeg-nh2的情况下,此导致重量比约为2:1,因为8臂peg所含端基量为4臂peg的两倍。然而,可使用过量的亲电子(例如nhs端基,诸如saz)端基或亲核(例如胺)端基。特定来说,可使用过量的亲核体,诸如含胺端基的前体,即4a20kpeg-saz和8a20kpeg-nh2的重量比也可小于2:1。
[0189]
本文公开的含亲电子基团和亲核基团的peg前体的每一个和任何组合可用于制备根据本发明的植入物。举例来说,任何4臂或8臂peg-nhs前体(例如具有saz、sap、sg或ss端基)可与任何4臂或8臂peg-nh2前体(或具有亲核基团的任何其他peg前体)组合。此外,含亲电子基团和亲核基团的前体的peg单元可具有相同或可具有不同的平均分子量。
[0190]
可使用另一种含亲核基团的交联剂替代基于peg的交联剂。举例来说,可使用低分子量的胺连接基,诸如三赖氨酸(或三赖氨酸盐或衍生物,诸如乙酸三赖氨酸)或其他低分子量的多臂胺。
[0191]
在某些实施方案中,含亲核基团的交联剂可与显像剂结合或结合。显像剂为含有荧光团或其他实现显像的基团的试剂。诸如荧光素、玫瑰红(rhodamine)、香豆素和花青的荧光团可例如用作显像剂。显像剂可例如经由交联剂的一些亲核基团与交联剂结合。因为交联需要足够量的亲核基团,因此“结合(conjugated/conjugation)”一般包括部分结合,意指仅一部分亲核基团用于与显像剂结合,诸如交联剂的约1%至约20%、或约5%至约10%、或约8%的亲核基团可与显像剂结合。在其他实施方案中,显像剂也可例如经由聚合
物前体的某些反应性(诸如亲电子)基团与聚合物前体结合。
[0192]
额外成分:
[0193]
除了如以上所公开的形成聚合物网络的聚合物单元和活性成分以外,本发明的植入物还可含有其他额外成分。所述额外成分为例如来源于水凝胶制备过程中所使用的缓冲液的盐,诸如磷酸盐、硼酸盐、碳酸氢盐或其他缓冲剂,诸如三乙醇胺。在本发明的某些实施方案中,使用磷酸钠缓冲液(特定来说,磷酸二氢钠和磷酸氢二钠)。
[0194]
任选地,防腐剂可用于本发明的植入物。然而,在某些实施方案中,本发明的植入物,包括含有阿西替尼作为活性剂的植入物,不含防腐剂,诸如抗微生物防腐剂(包括但不限于氯化苄二甲烃铵(bak)、氯丁醇、过硼酸钠和稳定氯氧复合物(soc)),或实质上不含此种防腐剂。
[0195]
在本发明的一实施方案中,若原位胶化优选,则可能的额外成分可为水凝胶制造过程中所使用的其他剂,诸如(但不限于)粘度影响剂(诸如透明质酸等)、表面活性剂等。
[0196]
在某些实施方案中,本发明的插入物可含有显像剂。可用于本发明的上下文中的显像剂为可与水凝胶的组分结合或可包埋在水凝胶内且可见或可在暴露于例如某一波长的光时可见或为造影剂的所有剂。用于本发明的适合显像剂为(但不限于)例如荧光素、若丹明、香豆素、花青素、铕螯合物、二吡咯并亚甲基硼(boron dipyromethene)、苯并呋喃、丹酰、bimane、吖啶、三氮杂并环戊二烯、芘和其衍生物。显像剂可与如以上所公开的形成聚合物网络的含亲核或亲电子基团的前体结合,或显像剂可为植入物制造过程中添加且存在于水凝胶中的单独(未结合)剂。
[0197]
配方:
[0198]
在某些实施方案中,根据本发明的植入物包含tki、由一种或多种如本文中在以上所公开的聚合物前体制成且呈水凝胶形式的聚合物网络,以及任选的额外组分,诸如生产过程中剩在植入物中的盐等(诸如用作缓冲液的磷酸盐等)。在某些优选实施方案中,tki为阿西替尼。
[0199]
在某些实施方案中,根据本发明的植入物在其干燥状态下可含有以重量计占约15%至约80%,诸如约25%至约75%的tki和以重量计占约15%至约80%,诸如约20%至约60%的聚合物单元,或在特定实施方案中,以重量计约35%至约65%的tki和以重量计约25%至约50%的聚合物单元(干组合物)。在特定实施方案中,根据本发明的植入物可含有以重量计占约45%至约55%的tki和以重量计占约37%至约47%的聚合物单元(干组合物),其中tki和聚合物单元是选自本文中在以上公开的那些tki和聚合物单元。在其他特定实施方案中,根据本发明的植入物在其干燥状态下可含有以重量计占约55%至约75%的tki和以重量计占约20%至约40%的聚合物单元(干组合物),其中tki和聚合物单元是选自本文中在以上公开的那些tki和聚合物单元。在其他特定实施方案中,根据本发明的植入物在其干燥状态下可含有以重量计占约30%至约45%的tki和以重量计占约47%至约70%的聚合物单元(干组合物),其中tki和聚合物单元是选自本文中在以上公开的那些tki和聚合物单元。
[0200]
在一个特定实施方案中,根据本发明的植入物在其干燥状态下可含有以重量计占约25%至约75%的阿西替尼和以重量计占约20%至约60%的peg单元,或以重量计占约35%至约65%的阿西替尼和以重量计占约25%至约50%的peg单元,或以重量计占约45%
至约55%的阿西替尼和以重量计占约37%至约47%的peg单元,或以重量计占约48%至约52%的阿西替尼和以重量计占约40%至约44%的peg单元(干组合物)。在其他特定实施方案中,根据本发明的植入物在其干燥状态下可含有以重量计占约55%至约75%的阿西替尼和以重量计占约20%至约40%的peg单元,或以重量计占约60%至约75%的阿西替尼和以重量计占约21%至约31%的peg单元(干组合物)。
[0201]
在另一个特定实施方案中,以干重计,根据本发明的植入物中阿西替尼与peg比率可为以重量计大约50%或更多阿西替尼至以重量计大约40%或更少peg,其余为磷酸盐。另选地,以干重计,根据本发明的植入物中阿西替尼与peg比率可为约1:1至约3:1。
[0202]
在某些实施方案中,植入物在其干燥状态下的余量(即,当已考虑tki(诸如阿西替尼)和聚合物水凝胶(诸如peg水凝胶)时配方的其余部分)可为自如以上所公开的缓冲溶液剩余的盐。在某些实施方案中,此种盐为磷酸盐、硼酸盐或碳酸(氢)盐。在一个实施方案中,缓冲液盐为磷酸钠(磷酸二氢纳或磷酸氢二钠)。
[0203]
tki和一种或多种聚合物的量可变化,且其他量的tki和聚合物水凝胶可用于制备根据本发明的植入物。
[0204]
在某些实施方案中,配方内药物的最大量为聚合物(例如,peg)单元的量的约两倍,但在某些情况下可能更高,但期望包含例如前体、缓冲液和药物的混合物(在水凝胶完全凝胶化前的状态下)可均匀浇注至模具或管中。
[0205]
在本发明的一个实施方案中,在形成后且在干燥前,即,呈湿润状态的水凝胶可包含以聚乙二醇重量除以流体重量x100表示占约3%至约20%的聚乙二醇。在一个实施方案中,呈湿润状态的水凝胶包含以聚乙二醇重量除以流体重量x100表示占约5%至约15%,诸如约7.5%至约15%或约5%至约10%的聚乙二醇。
[0206]
在本发明的一个实施方案中,湿水凝胶组合物(即,在已形成水凝胶组合物,即,已混合形成水凝胶的所有组分之后)包含以重量计占约5%至约50%的活性成分(诸如阿西替尼)和以重量计占约5%至约50%或约5%至约30%的peg单元。
[0207]
在某些实施方案中,在形成用于根据本发明的植入物的水凝胶时,湿组合物中可利用约10%至约50%或约25%至约50%(w/v)的固体含量(其中“固体”意谓溶液/悬浮液中聚合物前体、盐和药物的总重量)。因而,在某些实施方案中,拟浇注至模具或管中以使水凝胶成形的湿水凝胶组合物的总固体含量可为不超过约60%、或不超过约50%、或不超过约40%,诸如等于或低于约35%(w/v)。tki(诸如阿西替尼)的含量可占湿组合物的不超过约40%或不超过约30%,诸如等于或低于约25%(w/v)。固体含量可能影响粘度,因而也可能影响湿水凝胶组合物的可浇注性。
[0208]
在某些实施方案中,水凝胶植入物在其干(去水/干燥)状态下,例如在装载至针头中之前或在装载于针头中时的水含量可能极低,诸如以重量计不超过1%的水。在某些实施方案中,水含量也可能低于所述值,可能以重量计不超过0.25%或甚至以重量计至多0.1%。在本发明中,术语“植入物”用于指当其含有水时呈水合状态的植入物(例如,在植入物施用眼睛后已(再)水合或浸入水性环境中之后),以及呈其干(干燥/去水)状态的植入物,例如当其已干燥至例如以重量计不超过约1%的低水含量时或当制备产生此种低水含量植入物以致无需干燥步骤时。在某些实施方案中,呈其干燥状态的植入物为在生产后保持在手套箱中的惰性氮气氛围(含有少于20ppm的氧气和水分)下至少约7天,随后装载至针
头中的植入物。植入物的水含量可例如使用karl fischer电量法进行测量。
[0209]
在某些实施方案中,根据本发明的植入物的总重量(本文中也称为“总质量”)在其干燥状态下可为约200μg(即,0.2mg)至约1.5mg或约400μg至约1.2mg。在某些特定实施方案中,根据本发明的植入物的总重量在其干燥状态下可为约0.3mg至约0.6mg,诸如约0.4mg至约0.5mg,例如在植入物含有约160μg至约250μg的量的阿西替尼的情况下。在某些其他特定实施方案中,根据本发明的植入物的总质量在其干燥状态下可为约0.75mg至约1.25mg,或约0.8mg至约1.1mg,或约0.9mg至约1.0mg,例如在植入物含有约480μg至约750μg的量的阿西替尼的情况下。
[0210]
在某些实施方案中,根据本发明的植入物在其干燥状态下每mm3(即,每1mm3体积的干植入物)可含有约200μg至约1000μg tki,诸如阿西替尼。在某些特定实施方案中,根据本发明的植入物在其干燥状态下每mm3可含有约200μg至约300μg阿西替尼,例如在植入物含有约160μg至约250μg的量的阿西替尼的情况下。在某些其他特定实施方案中,根据本发明的植入物在其干燥状态下每mm3可含有约500μg至约800μg阿西替尼,例如在植入物含有约480μg至约750μg的量的阿西替尼的情况下。
[0211]
本发明的植入物因而可具有不同的密度。可通过各种因素来控制和测定最终植入物的密度(即,在其干燥状态下),包括但不限于当形成水凝胶时湿组合物中的成分的浓度以及制造植入物过程中的某些条件。举例来说,在某些实施方案中,可通过在制造过程中的某些点进行音波处理或脱气,例如使用真空来增大最终植入物的密度。
[0212]
在某些实施方案中,根据本发明的植入物含有治疗有效量的tki,诸如阿西替尼,以在较长时段内释放,但长度和/或直径相对较小。此就容易施用(注射)而言以及就减少对眼组织的可能损害和减小植入物在适当位置时对患者视力的可能影响而言皆为有利的。本发明的植入物结合了适当高剂量的tki(即,根据特定患者需要调节的治疗有效剂量)与相对较小植入物尺寸的益处。
[0213]
在实施例部分表1、表6、表21.1、表21.2和表29中公开根据本发明的例示性植入物(包括表29中所公开的含有大量tki的根据本发明的植入物的预见性实施例)。
[0214]
植入物的尺寸和水合后由拉伸所致的尺寸变化:
[0215]
干燥植入物可具有不同的几何形状,视制造方法而定,诸如使用将包含水凝胶前体(包括tki)的混合物在完全胶化前浇注至其中的模具或管。根据本发明的植入物也称为“纤维”(所述术语在本文中与术语“杆”可互换使用),其中纤维为一般具有细长形状的物体。植入物(或纤维)可具有不同的几何形状,其特定尺寸如本文中所公开。
[0216]
在一个实施方案中,植入物为圆柱形或具有基本圆柱形的形状。在此情况下,植入物具有圆形或基本圆形的横截面。
[0217]
在本发明的其他实施方案中,植入物为非圆柱形,其中植入物在其干燥状态下任选地伸长,其中植入物的长度大于植入物的宽度,其中宽度为实质上垂直于长度的最大横截面尺寸。在某些实施方案中,宽度可为约0.1mm至约0.5mm。外部植入物形状或其横截面的不同的几何形状可用于本发明。举例来说,替代圆形直径纤维(即,圆柱形植入物),可使用十字形纤维(即,其中横截面几何形状为十字形)。一般可使用其他横截面几何形状,诸如椭圆形或长方形、矩形、三角形、星形等。在某些实施方案中,也可对纤维进行扭绞。在通过针头将植入物施用眼睛的实施方案中,植入物的尺寸(即,其长度和直径)和其横截面几何形
状必须使得能够将植入物装载至针头中,尤其细直径针头,诸如本文中进一步公开的25号或27号针头。
[0218]
根据本发明的某些实施方案的水凝胶植入物的聚合物网络(诸如peg网状结构)在干燥状态下在室温或低于室温时可为半结晶的,而在湿润状态下可为非晶的。即使在拉伸形式下,干植入物在室温或低于室温时在尺寸上也稳定,此可能有利于将植入物装载至针头中和质量控制。
[0219]
植入物在眼中水合(此可通过将植入物浸入37℃的ph 7.2pbs中来模拟)后,根据本发明的植入物的尺寸可能变化:一般而言,植入物的直径可能增大,而其长度可能减小或至少可保持基本上相同。此尺寸变化的优势为尽管植入物在其干燥状态下足够细以装载至细直径针头(诸如25或27号针,或在一些情况下甚至更小直径的针头,诸如30号针头)中,以便注射至眼中,一旦其已置于眼中后,例如在玻璃体液中,植入物便可变短以更好地安装在眼的有限小体积内。用于注射如本文中所公开的本发明植入物的针头,诸如在某些实施方案中的25或27号针头的直径较小(且例如内径可为约0.4mm)。由于植入物在水合后也可能变得更软,因此即使植入物与此种组织接触,也可防止或减少对任何眼组织的损伤。在某些实施方案中,尺寸变化至少部分通过在其制造过程中在纵向方向上拉伸植入物而将“形状记忆”效应引入植入物中来实现(也如以下“制造方法”部分中所公开)。在某些实施方案中,拉伸可在干燥或湿润状态下进行,即,在干燥水凝胶植入物之后或在干燥之前。应注意,若未进行拉伸,且仅将水凝胶植入物干燥并切成所要长度,则植入物的直径和长度在水合后皆增大。若无需如此,则可对水凝胶纤维进行干式拉伸或湿式拉伸。
[0220]
在预先形成的干燥水凝胶中,可通过对材料进行干式拉伸,随后使其固化以锁定分子取向来赋予分子取向度。在某些实施方案中,此可通过对材料进行拉拔(任选地在将材料加热至材料可结晶区的熔点以上的温度时),随后使可结晶区结晶来实现。另选地,在某些实施方案中,干燥水凝胶的玻璃转移温度可用于锁定具有适合玻璃转移温度的聚合物(诸如pva)的分子取向。另一替代方案为在完全干燥前拉伸凝胶(也称为“湿式拉伸”),随后当在张力下时干燥材料。分子取向提供了一种在引入诸如玻璃体的水合介质中后各向异性溶胀的机制。在水合后,某些实施方案的植入物将仅在径向尺寸上溶胀,而长度将减小或基本上维持不变。术语“各向异性溶胀”意谓在一个方向上相对于另一方向优先溶胀,如在主要于径向上膨胀但在纵向尺寸上无明显增大(或甚至相反)的圆柱体中。
[0221]
水合后的尺寸变化程度可尤其取决于拉伸因数。举例来说,以约1.3的拉伸因数拉伸(例如通过湿式拉伸)可能具有不太明显的效果,或可能在水合期间基本上不改变长度。相比之下,以例如约1.8的拉伸因数拉伸(例如通过湿式拉伸)可能导致水合期间长度明显缩短。以例如拉伸因数4拉伸(例如通过干式拉伸)可导致水合后长度短得多(例如,长度自约15mm减至约8mm)。本领域技术人员应理解,除拉伸以外,其他因素也可能影响溶胀特性。
[0222]
影响拉伸水凝胶和在水合后引发植入物尺寸变化的可能性的其他因素有聚合物网络的组成。在使用peg前体的情况下,与具有较高臂数目者(诸如8臂peg前体)相比,具有较低臂数目者(诸如4臂peg前体)有助于在水凝胶中提供更高柔性。若水凝胶含有更多较低柔性组分(例如,较大量的含有较大臂数目的peg前体,诸如8臂peg单元),则水凝胶可能更坚硬且不太容易在不破裂的情况下拉伸。另一方面,包含更大柔性组分的水凝胶(诸如含有较少臂数目的peg前体,诸如4臂peg单元)可能更容易拉伸和变软,而且在水合后溶胀更大
程度。因而,可通过改变结构特征以及通过已初步形成植入物之后修改其加工来调整植入物放入眼中后(即,水凝胶(再)水合后)的特性和性质。
[0223]
本文中在以下实施例中使用的植入物的例示性尺寸尤其提供于实施例部分的表6、表21.1和表21.2中。含有约200μg和约600μg阿西替尼的特定植入物公开于表21.1和表21.2中。然而,含有约200μg或约600μg阿西替尼的植入物也可具有不同于这些表中所公开的尺寸的尺寸(即,长度和/或直径)。干燥植入物尺寸尤其取决于所并入的tki的量以及tki与聚合物单元的比率,且也可通过水凝胶于其中胶化的模具或管的直径和形状来控制。此外,尤其通过形成后对水凝胶股绳进行(湿式或干式)拉伸来进一步测定植入物的直径。将经干燥的股绳(拉伸后)切成所要长度的区段以形成植入物;因而可视需要选择长度。
[0224]
在下文中,公开具有特定尺寸的植入物的实施方案。只要本文中所公开的尺寸范围或值是关于植入物的长度和直径,植入物便为圆柱形或基本圆柱形的。然而,本文中针对圆柱形植入物的长度和直径所公开的所有值和范围分别可同样用于如本文中也公开的非圆柱形植入物的长度和宽度。
[0225]
在某些实施方案中,本发明的植入物在其干燥状态下的长度可小于约17mm。在特定实施方案中,植入物在其干燥状态下的长度可小于约15mm、或小于或等于约12mm、或小于或等于约10mm、或小于或等于约8.5mm。在特定实施方案中,本发明的植入物在其干燥状态下的长度可为约12至约17mm,或在其干燥状态下的长度可为约6mm至约10mm或特定来说,约6mm至约9mm。
[0226]
在某些实施方案中,本发明的植入物在其干燥状态下的直径可为约0.1mm至约0.5mm。在某些其他实施方案中,植入物在其干燥状态下的直径可为约0.2mm至约0.5mm。在特定实施方案中,植入物在其干燥状态下的直径可为约0.2mm至约0.4mm或约0.3mm至约0.4mm。在特定实施方案中,本发明的植入物在干燥状态下的直径可为约0.2mm至约0.3mm或约0.3mm至约0.4mm。
[0227]
在特定实施方案中,植入物在其干燥状态下的长度可为约6mm至约10mm且直径为约0.2mm至约0.4mm。
[0228]
在某些实施方案中,本发明的植入物在其湿润/水合状态下的长度可为约6mm至约12mm。在某些其他实施方案中,本发明的植入物在其湿润/水合状态下的长度可等于或小于约10mm、或约6mm至约10mm。在特定实施方案中,本发明的植入物在其湿润/水合状态下的长度可为约6mm至约8mm。
[0229]
在某些实施方案中,本发明的植入物在其湿润/水合状态下的直径可等于或小于约0.8mm、或约0.5mm至约0.8mm、或约0.65mm至约0.8mm。在特定实施方案中,本发明的植入物在其湿润/水合状态下的直径可为约0.7mm至约0.8mm。
[0230]
在特定实施方案中,植入物在其湿润/水合状态下的长度可等于或小于约10mm且直径等于或小于约0.8mm。
[0231]
在本发明的实施方案中,植入物在其干燥状态下的直径必须使得植入物可装载至如本文中所公开的细直径针头,诸如25号或27号针头中。特定来说,在一个实施方案中,含有约480μg至约750μg阿西替尼的植入物的直径可使得其可装载至25号针头中或使得其可装载至27号针头中而在装载时未对植入物造成任何破坏,并且使得植入物在进一步处理(包括包装、灭菌、运输等)过程中稳定保留在针头中。
[0232]
只要本文中公开本发明的植入物在湿润/水合状态下的长度或直径(mm)时,本发明便分别是指在37℃、ph 7.2下24小时之后测定的植入物长度或直径。应理解,在本文中,ph 7.2包括约7.2至约7.4的ph范围。
[0233]
当植入物保留在这些条件下时,植入物的尺寸可随时间推移(即,24小时之后)而进一步改变(例如,长度可能再次稍微增加)。然而,只要本文中报告植入物的水合尺寸,这些尺寸便如以上所公开在37℃、ph 7.2下24小时之后测量。
[0234]
在对一个植入物的长度或直径进行若干次测量或在测量过程中收集若干个数据点的情况下,报告如本文中所定义的平均值(即,均值)。根据本发明的植入物的长度和直径可例如通过显微术或通过如实施例6.1中所描述的(任选地自动化)摄影机系统来测量。
[0235]
在某些实施方案中,本发明植入物的水合状态下直径与干燥状态下直径的比率可小于约5mm、或小于约4mm、或小于约3.25mm、或小于约2.5mm、或小于约2.25mm、或小于约2.10mm。
[0236]
在某些相同或其他实施方案中,本发明植入物的干燥状态下长度与水合状态下长度的比率大于约0.7、或大于约0.8、或大于约0.9、或大于约1.0。在某些特定实施方案中,植入物在干燥状态下的长度与植入物在水合状态下的长度的比率可大于约1.5,或甚至大于约2.0。除以上所公开的水合状态下直径与干燥状态下直径的比率以外或与其无关,可应用此干燥状态下长度与水合状态下长度的比率。
[0237]
在干燥状态下的小直径可能为有利的,因为植入物可装配至如本文中所公开的注射用小直径针头,诸如25号或27号针头中。水合后仅适度溶胀也有利于植入物在玻璃体液中不占据过多空间。植入物的相对较短长度可能有利于减少与视网膜接触的潜在可能性。
[0238]
在一个实施方案中,本发明的植入物含有约160μg至约250μg、或约180μg至约220μg、或约200μg阿西替尼,呈纤维(或圆柱体)形式,且在干燥状态下长度为约14.5mm至约17mm或约15mm至约16.5mm且直径为约0.20mm至约0.30mm。此种植入物在眼中体内(诸如玻璃体液中)或体外水合后可能在长度方面减小并且在直径方面增大(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合),达至长度为约6.5mm至约8mm或约7mm至约8.5mm且直径为约0.65mm至约0.8mm或约0.70至约0.80mm。在一个实施方案中,可通过如本文中所公开以约2至约5的拉伸因数或约3至约4.5的拉伸因数进行干式拉伸来达成尺寸变化。
[0239]
在另一实施方案中,含有约480μg至约750μg、或约540μg至约660μg、或约600μg阿西替尼、呈纤维(圆柱体)形式且在其干燥状态下的本发明植入物的长度可在约6mm或约7mm至约12mm范围内且直径为约0.25mm至约0.50mm,或长度为约7mm至约10mm或约8mm至约11mm且直径为约0.3mm至约0.4mm。在特定实施方案中,含有约480μg至约750μg、或约540μg至约660μg、或约600μg阿西替尼、呈纤维(圆柱体)形式且在其干燥状态下的本发明植入物的长度可为约7mm至约10mm,诸如约7mm至约9mm,且直径为约0.3mm至约0.4mm,诸如约0.35mm至约0.39mm。
[0240]
此种植入物在眼中,诸如在玻璃体液中体内或在体外水合后可在直径方面增大(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合),而在其水合状态下,其长度可基本上维持或可减小,或仅稍微增加至例如在约6mm或约9mm至约12mm范围内的长度和约0.5mm至约0.8mm的直径,或约9.5mm至约11.5mm的长度和约0.65mm至约
0.75mm或约0.8mm的直径。在特定实施方案中,含有约480μg至约750μg、或约540μg至约660μg、或约600μg阿西替尼且呈纤维(圆柱体)形式的本发明植入物在其水合状态(即,如以上所阐述,在37℃、ph 7.2下24小时之后)的长度可为约6mm至约10.5mm,诸如约6.5mm至约8.5mm,且直径为约0.7mm至约0.8mm。
[0241]
在一个实施方案中,含有约480μg至约750μg、或约540μg至约660μg、或约600μg阿西替尼的本发明植入物的长度在干燥状态下不超过10mm,且在水合状态下(如在磷酸盐缓冲生理盐水中在ph7.2、37℃下24小时之后所测量)也不超过或实质上不超过约10mm,或不超过约9mm,或不超过约8mm。
[0242]
在一个或多个实施方案中,上述尺寸变化可通过以约0.5至约5的拉伸因数、或约1至约4的拉伸因数、或约1.3至约3.5的拉伸因数、或约1.7至约3的拉伸因数、或约2至约2.5的拉伸因数进行湿式拉伸来达成。在其他实施方案中,含有约480μg至约750μg、或约540μg至约660μg、或约600μg阿西替尼的本发明植入物在干燥状态下可能比约12mm长,但最终在水合状态下可能比约10mm或约9mm短。
[0243]
在某些实施方案中,拉伸因而产生形状记忆,意谓植入物在施用眼睛,例如玻璃体腔中时,在水合后将在长度方面收缩并在直径方面变宽,直至其接近(或多或少)其平衡尺寸,其平衡尺寸是由起始成形尺寸和组成变数决定。尽管狭窄干燥尺寸有利于经由小号针头施用产品,但施用之后直径加宽且长度缩短可在眼睛后房中产生相对于眼直径而言较短的植入物(诸如约9至10mm长,或至少不超过所述值),从而减少与周围眼组织的潜在接触。因而,在一个方面中,本发明还涉及一种通过在纵向方向上拉伸水凝胶纤维而赋予水凝胶纤维形状记忆的方法,所述水凝胶纤维包含分散在水凝胶中的活性剂,诸如tki,例如阿西替尼。在另一方面中,本发明涉及一种制造包含水凝胶的眼用植入物的方法,所述水凝胶包含分散于其中的活性剂,诸如tki,例如阿西替尼,其中所述植入物在施用眼睛后改变其尺寸,所述方法包括制备所述水凝胶的纤维和在纵向方向上拉伸所述纤维。
[0244]
体外释放:
[0245]
可通过实施例2中详细公开的各种方法测定tki自本发明植入物的体外释放:
[0246]
简单来说,一种测定tki自植入物体外释放的方法为在非漏槽模拟生理条件下在37℃的pbs(磷酸盐缓冲生理盐水,ph 7.2)中,以相当于人眼中玻璃体体积的体积每日替换pbs。例示性植入物的结果示于图4a中。如实施例2中所描述,在peg水凝胶基质中包含阿西替尼的测试植入物中,较高剂量强度导致释放介质中的较高阿西替尼浓度。
[0247]
一般而言,在本发明的实施方案中,根据本发明的植入物可平均释放约0.1μg至约3μg、或约0.25μg至约2.5μg、或约0.1μg至约2μg,或可在ph 7.2和37℃的pbs中每天体外释放约0.25μg至约1.5μg,持续30天的时段。
[0248]
在一个实施方案中,含有约200μg阿西替尼的根据本发明的植入物在磷酸盐缓冲生理盐水中在ph 7.2和37℃下可平均每天体外释放约0.01μg至约0.15μg阿西替尼,持续30天的时段。
[0249]
在一个实施方案中,含有约600μg阿西替尼的根据本发明的植入物在磷酸盐缓冲生理盐水中在ph 7.2和37℃下可平均每天体外释放约0.3μg至约0.5μg阿西替尼,持续30天的时段。
[0250]
在也详细描述于实施例2中的加速体外测试中,可在37℃下在25:75乙醇/水混合
物(v/v)中测定tki自植入物的释放。此加速体外测试可在约2周内完成。图14b显示含有约200μg阿西替尼的根据本发明的植入物的加速体外释放资料,且图4b显示含有约556μg阿西替尼的根据本发明的植入物的加速体外释放资料。
[0251]
在一个实施方案中,在37℃下、在25:75乙醇/水混合物(v/v)中,含有约200μg阿西替尼的根据本发明的植入物在3天内体外释放约35%至约45%阿西替尼,在7天内体外释放约65%至约75%阿西替尼,且在12至13天内体外释放约90%至约100%阿西替尼。
[0252]
在一个实施方案中,在37℃下、在25:75乙醇/水混合物(v/v)中,含有约600μg阿西替尼的根据本发明的植入物在2天内体外释放约40%至约60%阿西替尼,在4天内体外释放约65%至约85%阿西替尼,且在6天内体外释放约75%至约90%阿西替尼。在37℃下、在25:75乙醇/水混合物(v/v)中,含有约600μg阿西替尼的根据本发明的植入物在2天内体外释放约45%至约55%阿西替尼,在4天内体外释放约70%至约80%阿西替尼,且在6天内体外释放约80%至约90%阿西替尼。
[0253]
最后,还可也如实施例2中详细描述在即时漏槽模拟生理条件下测定本发明植入物的tki释放。对于此即时测试,在37℃下,在pbs(ph 7.2)/0.01% naf中,在pbs上有辛醇顶层的情况下测定tki的释放。此为定性模拟tki自植入物释放至玻璃体液中和tki自其中再吸收至眼组织中的一种方法。根据本发明的含有约200μg阿西替尼的植入物的例示性即时释放概况示于图14a中。
[0254]
在一个实施方案中,根据本发明的含有约200μg阿西替尼的植入物在磷酸盐缓冲生理盐水中、在ph 7.2、37℃下且在有辛醇顶层的情况下在2个月内体外释放约25%至约35%阿西替尼,在3个月内体外释放约47%至约57%阿西替尼,在5个月内体外释放约70%至约80%阿西替尼,且在7个月内体外释放约90%至约100%阿西替尼。
[0255]
体外释放测试,尤其本文中所描述的加速体外释放测试,可尤其用于将不同的植入物(例如,不同的生产批次、不同的组成和不同的剂量强度等)相互比较,例如出于质量控制或其他定性评定的目的。
[0256]
体内释放和持久性:
[0257]
在本发明的一个实施方案中,当本发明的干燥植入物施用眼睛,诸如玻璃体液时,其发生水合,并如以上所公开改变其尺寸,随后随时间推移而生物降解直至其已完全再吸收。当植入物生物降解,诸如经由酯水解时,其可逐渐溶胀并软化,随后变得更小、更柔软且更具液体性,直至其完全溶解且不再可见。如发明者根据本文中在以下实施例部分中所提供的动物研究中所认识,根据本发明的植入物可在兔眼中持续约2至约6个月或约5至约6个月(参见图7a、图9和图10)。在植入物完全降解之后,未溶解的阿西替尼粒子可保留在植入物的先前部位,并且已观测到聚集,即,并入整体结构中。这些剩余未溶解阿西替尼粒子可以足以提供治疗有效阿西替尼含量的速率继续缓慢溶解。若在某些实施方案中施用两个或更多个植入物以达成所要总剂量,则其同样随时间生物降解,且剩余阿西替尼粒子也并入一个单一整体结构中(参见图9)。
[0258]
在人眼中,诸如在玻璃体液中,本发明的植入物在某些实施方案中在施用之后约2至约15个月内、或在施用之后约4至约13个月内、或在施用之后约9至约12个月内,特定来说在施用之后约9至约10.5个月内生物降解。此已在利用一个或两个各自包含约200μg阿西替尼的植入物的临床试验中得到证明。参见实施例部分,特定来说实施例6和图15。
[0259]
在一个实施方案中,植入物在施用玻璃体液之后在至少约3个月、至少约6个月、至少约9个月、至少约10个月、至少约11个月、或至少约12个月、或至少约13个月或更久的时段内释放(如本文中所定义)tki,诸如治疗有效量的tki,诸如阿西替尼。在特定实施方案中,植入物释放tki,诸如阿西替尼,持续约6至约9个月的时段。
[0260]
在本发明的一个实施方案中,所述植入物在所述(即,单一)植入物施用患者的玻璃体液中之后提供至少约3个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月或至少约13个月或更久的治疗时段。
[0261]
在本发明的一个实施方案中,在至少3个月、或至少6个月、或至少9个月、或至少11个月、或至少12个月、或至少13个月的时段内在玻璃体液中以约0.1μg/天至约10μg/天、或约0.5μg/天至约7μg/天、或约0.5μg/天至约2μg/天、或约1μg/天至约5μg/天的平均速率自植入物释放tki,诸如阿西替尼。在特定实施方案中,在施用植入物之后维持tki(诸如阿西替尼)释放约6至约9个月。
[0262]
如本文中的实施例部分中所呈现,在动物中的临床前研究以及在人类中的临床研究已显示本发明的植入物可在较长时段内连续释放治疗有效量的tki,直至植入物完全生物降解。任何剩余未溶解tki粒子(若存在)皆可基本上保留在先前植入物的部位,并且可能聚集形成基本整体结构(参见图7a、图9和图10),由此以足以达成治疗效果的程度继续向玻璃体中释放tki。然而,在某些实施方案中,植入物中所含有的全部量的tki在植入物完全生物降解前自植入物释放。在此情况下,在植入物完全生物降解之后,未溶解的tki粒子不会保留(和/或聚集)在先前植入物的部位附近或眼中其他位置。
[0263]
在一个实施方案中,水凝胶在水性环境内和在人眼中的持久性尤其取决于可降解酯基附近的碳链的疏水性。在本文中的实施例中所使用的植入物中,此碳链包含7个碳原子,因为其源自4a20k peg前体的saz官能团。此可在人眼中提供长达约9至约12个月或约9至约10.5个月的较长持久性。在其他实施方案中,与4a20kpeg-saz和8a20kpeg-nh2不同的前体可用于制备在人眼中生物降解且具有与实施例中所例示的植入物类似或不同的持久性的水凝胶植入物。
[0264]
在某些实施方案中,水凝胶植入物在其降解时随时间推移而软化,此可能尤其视使水凝胶中的peg单元交联的连接基的结构而定。如本技术的实施例中所使用的由4a20kpeg-saz和8a20kpeg-nh2形成的植入物随时间推移相当缓慢地软化。
[0265]
释放机制:
[0266]
不希望受理论束缚,可如下理解tki自本发明植入物释放的机制:在本发明的实施方案中,tki向眼中和玻璃体液中释放是由扩散和药物清除率决定。根据本发明的例示性tki为阿西替尼。经测定阿西替尼在生理介质中的溶解度极低(在ph 7.2pbs中为约0.4至约0.5μg/ml)。根据本发明,tki(诸如阿西替尼)局限于具有特定几何形状和表面的生物可降解水凝胶中。眼睛后房中的液体为粘性的,具有缓慢清除率和相对停滞流动(至少与眼睛前房相比)。
[0267]
在某些实施方案中,本发明的植入物包含由聚合物网络制成的水凝胶和分散在所述水凝胶内的药物。药物逐渐溶解并且自水凝胶扩散至眼中。此可能首先发生在与玻璃体的液体环境接触的水凝胶外部区域(即,位于水凝胶最外部区域中的药物粒子首先溶解并扩散出去,位于最内部区域中者最后溶解并扩散出去)。因此,在某些实施方案中,水凝胶的
外部区域变得缺乏药物粒子。此区域因此也称为“清除区”,其仅限于溶解的药物,其中浓度等于或低于药物的溶解度。在某些实施方案中,此低表面浓度可在植入物与此种组织接触时通过物理分隔组织与药物粒子来防止组织(视网膜或其他细胞)免受潜在药物毒性影响。在其他实施方案中,水合后,“清除区”为外部区域,其活性剂浓度低于水合水凝胶的内部区域中的活性剂。
[0268]
在具有清除区的实施方案中,由于药物已溶解并且扩散出清除区,故水凝胶的此区域形成空隙并变得更软且更弱。与药物自水凝胶扩散出来的同时,水凝胶也可通过例如在眼睛的水性环境中酯水解而缓慢降解。此降解在整个水凝胶体积中均匀发生。在降解的晚期阶段,水凝胶开始发生变形和侵蚀。在此发生时,水凝胶变得更软且更具液体性(且因而其形状变形),直至水凝胶最终溶解并完全再吸收。此过程示意性地示于图3上,并通过红外反射(ir)成像所证明,例如图10中所证明。
[0269]
由于阿西替尼为相对低溶解度药物,故在某些实施方案中,在植入物已完全降解之后,未溶解的阿西替尼粒子可保留在植入物的先前部位。由于这些剩余未溶解阿西替尼粒子不再被水凝胶固定并隔开,故其可能聚集并形成基本整体结构。此整体阿西替尼结构可仍以足以达成治疗效果(特定来说,降低csft)的速率继续释放阿西替尼。
[0270]
然而,在一个实施方案中,在水凝胶完全降解之前释放全部量的阿西替尼。由于水凝胶可将阿西替尼粒子保持在适当位置并防止其聚集,故只要水凝胶尚未完全降解,阿西替尼便可较快地自水凝胶释放。当水凝胶完全降解时,剩余阿西替尼粒子可形成整体结构,阿西替尼可自其中缓慢溶解。因此,在本发明的一个实施方案中,期望在水凝胶完全降解前完全释放阿西替尼。
[0271]
在某些实施方案中,此整个过程使得有可能在较长时段,诸如至少3个月、或至少6个月、或至少9个月、或至少11个月、或至少12个月、或至少13个月、或至少14个月、或甚至更久,诸如长达15个月内有利地维持本发明植入物的治疗效果。发明者已证明,此对于接受新血管性年龄相关性黄斑退化治疗的患者为一大优势,所述治疗先前涉及非常频繁地经玻璃体内注射抗vegf剂。相比之下,根据本发明的植入物可能仅需要以大得多的时间间隔注射,此出于如以上在“目标和概述”部分中已公开的多种原因而对患者有利。
[0272]
含有约160μg至约250μg,诸如约200μg阿西替尼的特定植入物:
[0273]
在一个特定实施方案中,本发明涉及一种持续释放生物可降解眼用植入物,其含有以约160μg至约250μg或约180μg至约220μg范围内且特定来说约200μg的量分散在水凝胶中的阿西替尼,其中所述水凝胶包含包括聚乙二醇单元的聚合物网络,且其中所述植入物呈干燥状态。在此实施方案中,所述聚合物网络含有聚乙二醇单元,包括多臂聚乙二醇单元,诸如平均分子量在约10,000道尔顿至约60,000道尔顿范围内的4臂和/或8臂聚乙二醇单元。在此实施方案中,此植入物的聚合物网络是通过使4a20kpeg-saz与8a20kpeg-nh2以约2:1的重量比反应而形成。在此实施方案中,所述水凝胶在形成时和干燥前(即,湿组合物)含有以聚乙二醇重量除以流体重量x100表示占约6.5%至约7.5%的聚乙二醇。此外,在此实施方案中,所述植入物在干燥状态下含有以重量计占约45%至约55%的阿西替尼和以重量计占约37%至约47%的聚乙二醇单元,或以重量计占约47%至约52%的阿西替尼和以重量计占约40%至约45%的聚乙二醇单元,诸如以重量计占约49%至约50%的阿西替尼和以重量计占约42%的peg单元,或以重量计占约47%的阿西替尼和以重量计占约44%的peg
单元(干组合物),其余为磷酸钠。此外,植入物在其干燥状态下可含有以重量计不超过约1%的水或以重量计不超过约0.25%的水。
[0274]
在此实施方案中,含有约160μg至约250μg或约180μg至约220μg范围内且特定来说约200μg的量的阿西替尼的植入物在磷酸盐缓冲生理盐水中在37℃下每天体外释放约0.01μg至约0.15μg阿西替尼,持续30天的时段。此外,在此实施方案中,植入物在37℃下、在25:75乙醇/水(v/v)混合物中在3天内体外释放约35%至约45%阿西替尼,在7天内体外释放约65%至约75%阿西替尼,且在12至13天内体外释放约90%至约100%阿西替尼。在此实施方案中,植入物在磷酸盐缓冲生理盐水中,在ph 7.2、37℃下且在有辛醇顶层的情况下也可在2个月内体外释放约25%至约35%阿西替尼,在3个月内体外释放约47%至约57%阿西替尼,在5个月内体外释放约70%至约80%阿西替尼,在7个月内体外释放约90%至约100%阿西替尼。
[0275]
在此实施方案中,含有约200μg阿西替尼的植入物可呈纤维(或圆柱体)形式,且在干燥状态下,长度可小于约20mm、或小于约17mm、或为约15mm至约16.5mm且直径为约0.20mm至约0.30mm,并且在玻璃体液中体内或在体外水合后,长度可能减小而直径增加(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合),达至在水合状态下长度约为6.5mm至8mm且直径约为0.70mm至0.80mm。水合后的此尺寸变化可通过如本文其他部分更详细解释以约2至约5的拉伸因数或约3至约4.5的拉伸因数在纵向方向上对植入物进行干式拉伸来赋予植入物形状记忆。在其他实施方案中,植入物可为非圆柱形的。
[0276]
在此实施方案中,含有约200μg阿西替尼的植入物的水合状态下直径与干燥状态下直径的比率小于约3.25mm,和/或干燥状态下长度与水合状态下长度的比率大于约1.5。
[0277]
如此实施方案中所公开的植入物在其干燥状态下的总重量可为约0.3mg至约0.6mg,诸如约0.4mg至约0.5mg。此种植入物在干燥状态下每1mm最终长度可含有约10μg至约15μg阿西替尼,且每mm3可含有约200μg至约300μg阿西替尼。
[0278]
在此实施方案中,在施用前,将含有约200μg阿西替尼剂量的植入物装载至25号针头或27号针头(或甚至更小号针头,诸如30号针头)中以供注射至玻璃体液中。
[0279]
为了汇总并例示,关于此部分中所描述的实施方案所公开的含有约200μg剂量的本发明植入物(包括实施例6中所呈现的临床研究中所使用的植入物)的个别特征提供于实施例部分中的表21.1中,所述表也再现于此处:
[0280]
[0281][0282]
如权利要求1的持续释放生物可降解眼用植入物,其中所述植入物为玻璃体内植入物且包含约180μg至约220μg阿西替尼,为圆柱形,并且在其干燥状态下长度小于约17mm且直径为约0.2mm至约0.3mm,并且在其水合状态下(在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后)长度为约6.5mm至约8mm且直径为约0.7mm至约0.8mm,且其中所述水凝胶包含交联的4a20k和8a20k peg单元,其中所述peg单元之间的交联包括由下式表示的基团,
[0283][0284]
其中m为6。
[0285]
另选地,此特定实施方案的植入物也可如本文中所公开为非圆柱形的。
[0286]
含有约480μg至约750μg,诸如约600μg阿西替尼的特定植入物:
[0287]
在另一特定实施方案中,本发明涉及一种持续释放生物可降解眼用植入物,其含有以约480μg至约750μg的量分散在水凝胶中的阿西替尼,其中所述水凝胶包含包括交联聚乙二醇单元的聚合物网络。所述植入物中阿西替尼的量也可在约540μg至约660μg的范围内,且特定来说可为约600μg。
[0288]
在此植入物中,所述聚乙二醇单元包括多臂聚乙二醇单元,诸如平均分子量在约10,000道尔顿至约60,000道尔顿范围内的4臂和/或8臂聚乙二醇单元。在此实施方案中,所述植入物的聚合物网络包含4a20kpeg和8a20kpeg单元,并且是通过使4a20kpeg-saz与8a20kpeg-nh2以约2:1的重量比反应而形成。
[0289]
在此实施方案中,植入物在干燥状态下可含有以重量计占约45%至约55%的阿西替尼和以重量计占约37%至约47%的聚乙二醇单元,或可含有以重量计占约60%至约75%的阿西替尼和以重量计占约21%至约31%的聚乙二醇单元,诸如以重量计占约63%至约72%的阿西替尼和约23%至约27%的聚乙二醇单元(干组合物),其余为磷酸钠。在某些特
定实施方案中,植入物可含有约68%至约69%阿西替尼和约26%聚乙二醇单元(干组合物),其余为磷酸钠。植入物可含有以重量计不超过约1%的水或以重量计不超过约0.25%的水。
[0290]
在此实施方案中,阿西替尼含量在约480μg至约750μg或约540μg至约660μg范围内或特定来说为约600μg的此植入物在磷酸盐缓冲生理盐水中在37℃下每天体外释放约0.3μg至约0.5μg阿西替尼,持续30天的时段。此外,此植入物在25:75(v/v)乙醇/水混合物中在37℃下在2天内体外释放约40%至约60%阿西替尼,在4天内体外释放约65%至约85%阿西替尼,且在6天内体外释放约75%至约90%阿西替尼。在此实施方案中,此植入物也可在25:75乙醇/水(v/v)混合物中在37℃下在2天内体外释放约45%至约55%阿西替尼,在4天内体外释放约70%至约80%阿西替尼,且在6天内体外释放约80%至约90%阿西替尼。
[0291]
在此实施方案中,含有约600μg阿西替尼的植入物可呈纤维(或圆柱体)形式,且在其干燥状态下的长度可小于约20mm、或小于约17mm、或小于约15mm、或小于或等于约12mm,诸如约7mm至约12mm,且直径为约0.25mm至约0.50mm,或者长度为约7mm或约8mm至约11mm且直径为约0.3mm至约0.4mm,并且可在玻璃体液中体内或在体外水合后在直径方面有所增大(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合)。在特定实施方案中,在其干燥状态下含有约600μg阿西替尼的植入物的长度可小于或等于约10mm、或小于或等于约8.5mm、或为约7mm至约9mm或约7mm至约8.5mm,且直径为约0.3mm至约0.4mm,诸如约0.35mm至约0.39mm。
[0292]
此植入物在体内或体外水合之后的尺寸(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合)可为长度小于或等于约10mm,诸如约6mm或约9mm至约12mm,且直径为约0.5mm至约0.8mm,或长度为约9.5mm至约11.5mm,或长度不超过约10mm或不超过约9mm且直径为约0.65mm至约0.75mm或至约0.80mm。在特定实施方案中,在其水合状态下含有约600μg阿西替尼的植入物(其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合)的长度可为约6mm至约10.5mm,诸如约6.5mm至约8.5mm,且直径为约0.7mm至约0.8mm。在特定实施方案中,鉴于眼睛的有限体积,当在眼睛的玻璃体液中水合时,约10mm或更短,诸如约9mm或更短的长度为可接受的长度。
[0293]
水合后的此尺寸变化可通过如以下更详细公开在干燥前在纵向方向上以约0.5至约5的拉伸因数、或约1至约4的拉伸因数、或约1.3至约3.5的拉伸因数、或约1.7至约3的拉伸因数、或约2至约2.5的拉伸因数进行湿式拉伸来达成。
[0294]
在此实施方案中,含有约600μg阿西替尼的植入物的水合状态下直径与干燥状态下直径的比率可小于约2.25mm和/或干燥状态下长度与水合状态下长度的比率大于0.75。
[0295]
如本文中所公开的含有约600μg阿西替尼的植入物在干燥状态下的总重量可为约0.8mg至约1.1mg,诸如约0.9mg至约1.0mg。此种植入物在干燥状态下每1mm最终长度可含有约70μg至约85μg阿西替尼,且每mm3可含有约500μg至约800μg阿西替尼。
[0296]
在此实施方案中,植入物的优选形状为圆柱形或基本圆柱形(且也可称为纤维)。在其他实施方案中,植入物可为非圆柱形。在施用前,将含有约600μg阿西替尼剂量的此植入物装载至25号(或更小号,诸如27号)针头中以注射至眼中,例如玻璃体液中。
[0297]
为了汇总,关于此部分中所描述的实施方案所公开的含有约600μg阿西替尼剂量的本发明植入物的个别特征提供于实施例部分中的表21.2中,所述表也再现于此处:
[0298]
[0299][0300]
在一特定实施方案中,本发明的持续释放生物可降解眼用植入物为玻璃体内植入物且包含约540μg至约660μg阿西替尼,为圆柱形,并且在其干燥状态下长度小于或等于
10mm且直径为约0.3mm至约0.4mm,并且在其水合状态下(在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后)长度为约6mm至约10.5mm且直径为约0.6mm至约0.8mm,且其中所述水凝胶包含交联的4a20k和8a20k peg单元,其中所述peg单元之间的交联包括由下式表示的基团,
[0301][0302]
其中m为6。
[0303]
另选地,此特定实施方案的植入物也可如本文中所公开为非圆柱形的。
[0304]
ii.植入物的制造
[0305]
制造工艺:
[0306]
在某些实施方案中,本发明还涉及一种制造如本文中所公开的持续释放生物可降解眼用植入物的方法。一般而言,所述方法包括以下步骤:形成水凝胶,所述水凝胶包含聚合物网络和分散于所述水凝胶内的tki粒子;使所述水凝胶成形;和干燥所述水凝胶。在某些实施方案中,所述方法包括以下步骤:形成水凝胶,所述水凝胶包含由含反应性基团的前体(例如,包含peg单元)形成的聚合物网络和分散在所述水凝胶中的tki粒子;使所述水凝胶成形;和干燥所述水凝胶,更特定来说,所述聚合物网络是通过在存在tki粒子的情况下使含亲电子基团的多臂peg前体与含亲核基团的多臂peg前体或另一含亲核基团的交联剂(如本文中“聚合物网络”和“peg水凝胶”部分所公开的前体和交联剂)在缓冲溶液中混合并反应且允许所述混合物胶化以形成水凝胶而形成。在本发明的实施方案中,通过在水凝胶完全胶化前将混合物浇注至管中而将水凝胶成形为如本文中所公开的水凝胶股绳。在某些实施方案中,在干燥之前或之后如本文中进一步公开在纵向方向上拉伸水凝胶股绳。
[0307]
在某些实施方案中,根据本发明的制造方法中的tki在所有其方面中皆为阿西替尼。在一个实施方案中,诸如阿西替尼的tki可呈微粉化形式用于制备如本文中所公开的植入物,且可具有也如本文中“活性成分”部分中所公开的粒径。在某些特定实施方案中,阿西替尼的d90可小于约30μm或小于约10μm。如图24中所显示,使用微粉化tki(尤其是微粉化阿西替尼)可能有降低tki(尤其是阿西替尼)粒子在浇注水凝胶股绳过程中聚集的倾向的作用。在另一实施方案中,tki(诸如阿西替尼)可呈非微粉化形式用于制备植入物。
[0308]
以上已在与植入物本身有关的部分中详细公开用于形成某些实施方案的水凝胶的前体。在使用peg前体制备交联peg网状结构的情况下,在某些实施方案中,制造植入物的方法可包括通过在存在酪氨酸激酶抑制剂的情况下使含亲电子基团的聚合物前体(诸如含亲电子基团的多臂聚乙二醇,诸如4a20kpeg-saz)与含亲核基团的聚合物前体或其他交联剂(诸如含亲核基团的多臂聚乙二醇,诸如8a20kpeg-nh2)在缓冲溶液中混合并反应,并且允许所述混合物胶化。在某些实施方案中,peg前体中亲电子基团与亲核基团的莫耳比为约1:1,但也可使用超过亲电子基团的亲核基团(诸如胺基)。如本文中“聚合物网络”部分和“peg水凝胶”部分中所公开,可使用其他前体,包括其他含亲电子基团的前体和其他含亲核基团的前体或交联剂。
[0309]
在某些实施方案中,制备含亲电子基团的前体、含亲核基团的前体或其他交联剂、tki和任选的缓冲液(和任选的额外成分,如“额外成分”部分中所公开)的混合物。此可按多
种顺序发生,包括但不限于首先制备含亲电子基团的前体和含亲核基团的前体各自在缓冲溶液中的单独混合物,随后将缓冲液/前体混合物之一,诸如缓冲液/含亲核基团的前体混合物与tki合并,随后将此含tki的缓冲液/前体混合物与另一缓冲液/前体混合物(在此情况下为缓冲液/含亲电子基团的前体混合物)合并。在已制备所有组分的混合物之后(即,在合并所有组分并且已形成湿组合物之后),在水凝胶完全胶化之前将混合物浇注至适合的模具或管中,以提供水凝胶的所要最终形状。随后使混合物胶化。随后干燥所得水凝胶。
[0310]
拟浇注至模具或管中的湿水凝胶组合物的粘度尤其可取决于水凝胶组合物的浓度和固体含量,但也可取决于外部条件,诸如温度。可通过降低湿组合物的粘度,包括(但不限于)降低溶剂中的成分浓度和/或降低固体含量或其他措施,诸如增高温度等来改良湿组合物的可浇注性,尤其在将组合物浇注至细直径管中的情况下。本文在“配方”部分中公开适合的固体含量。
[0311]
在植入物将具有纤维的最终形状(诸如圆柱体)的情况下,可将反应混合物浇注至细直径管(例如,内径为约1.0mm至约1.5mm)中,诸如pu或硅酮管,以提供伸长的圆柱形状。可使用不同几何形状和直径的管,视水凝胶纤维的所要最终横截面几何形状、其初始直径(其仍可通过拉伸来减小)而定,且也视反应混合物均匀填充管子的能力而定。
[0312]
因而,管内部可具有圆形几何形状或非圆形几何形状,诸如十字形(或其他)几何形状。通过十字形几何形状可增大植入物的表面。此外,在某些实施方案中,可用此种十字形几何形状来增加并入植入物中的tki的量。总体上,在某些实施方案中,可通过使用十字形几何形状来增加api自植入物释放。如本文中所公开,可使用植入物的其他横截面几何形状。
[0313]
在某些实施方案中,在已形成水凝胶并且已使其固化至完全胶化之后,可如本文中例如在关于植入物在水合后的尺寸变化的部分中已详细公开,在湿润或干燥状态下纵向拉伸水凝胶股绳。在某些实施方案中,拉伸因数(在本文中也称为“拉伸因数”)可在约1至约4.5、或约1.3至约3.5、或约2至约2.5的范围内,或在也如本文中(例如在但不限于“植入物的尺寸和水合后由拉伸所致的尺寸变化”部分中)所公开的其他范围内。拉伸因数指示某种水凝胶股绳在拉伸后的长度与所述水凝胶股绳在拉伸前的长度的比率。举例来说,对于干式拉伸而言,拉伸因数为2意谓干燥水凝胶股绳在(干式)拉伸后的长度为干燥水凝胶股绳在拉伸前的长度的两倍。同样适用于湿式拉伸。在某些实施方案中,当进行干式拉伸时,首先干燥水凝胶,随后拉伸。在某些实施方案中,当进行湿式拉伸时,在湿润(未干燥)状态下拉伸水凝胶,随后留在张力下干燥。任选地,可在拉伸时施加热。更任选地,另外可对水凝胶纤维进行扭绞。在某些实施方案中,当水凝胶仍在管中时,可进行拉伸和/或干燥。另选地,可在拉伸前将水凝胶自管中移出。在某些实施方案中,植入物即使在拉伸后也维持其尺寸,只要其呈干燥状态保持在室温或低于室温下即可。
[0314]
在拉伸并干燥之后,将水凝胶股绳自管中移出(若仍位于管内),并切成具有最终植入物在其干燥状态下所期望的长度的片段,诸如本文中所公开(若在管内切割,则在切割之后自管中移出切割区段)。出于本发明的目的,植入物在干燥状态下的尤其期望长度为例如等于或小于约12mm、或者等于或小于约10mm的长度,如本文中所公开。
[0315]
在某些实施方案中,随后将最终制备的植入物装载至细直径针头中。在某些实施方案中,针头的规格尺寸为22至30号,诸如22号、23号、24号、25号、26号、27号、28号、29号或
30号。在特定实施方案中,针头为25或27号针头,或甚至更小号针头,诸如30号针头,视干燥(且任选地拉伸)植入物的直径而定。
[0316]
在某些实施方案中,随后将含有植入物的针头分开包装并例如通过γ辐照灭菌。
[0317]
在某些实施方案中,诸如注射器的注射装置或另一注射装置可分开包装并灭菌,例如通过如以下针对药盒所公开的γ辐照(其为本发明的另一方面,参见“注射装置和药盒”部分)。
[0318]
实施例1中详细公开根据本发明的制造工艺的特定实施方案。
[0319]
对针头进行(peg)尖端覆盖:
[0320]
在一个实施方案中,在植入物已装载至针头中之后,将针头的尖端浸入熔融低分子量peg中。另选地,可将熔融peg注射或置放/滴入针尖内腔中。此低分子peg在体温下为液体(熔融),但在室温下为固体。在熔融peg通过浸渍或滴注施加至针尖之后,在针头冷却后,peg的硬化小滴或部分(本文中也称为“尖端”)保留在针头和针头顶部,从而阻塞针头内腔。此尖端/塞子的位置示于图25b中。
[0321]
此实施方案中所使用的低分子量peg可为线性peg,且平均分子量可为至多约1500或至多约1000,或平均分子量可为约400、约600、约800或约1000。也可使用如所公开的不同平均分子量的peg的混合物。在特定实施方案中,用于此尖端覆盖针头目的的peg的平均分子量为约1000。此1k(1000)分子量peg的熔点在约33℃与约40℃之间,并且当针头注射至眼中时在体温下熔融。
[0322]
作为peg材料的替代物,可使用具有水溶性和生物相容性(即,可与人类或动物身体接触使用而且不会引发局部或全身不利作用,例如不具刺激性)且在室温下为固体或硬化,但在体温下为液体或实质上为液体或至少柔软的任何其他材料来尖端覆盖注射针头。作为peg的替代物,也可使用以下材料(但不限于这些材料):在体温下熔融/为液体的泊洛沙姆或泊洛沙姆掺合物;结晶糖或盐(诸如海藻糖或氯化钠)、琼脂糖、纤维素、聚乙烯醇、聚(乳酸-乙醇酸)共聚物、紫外线固化聚合物、壳聚糖或其混合物的组合。
[0323]
塞子或尖端有助于在包装、储存和运输过程中保持植入物在针头内处于适当位置,并且还进一步防止植入物在处理期间由于其阻塞针头内腔而过早水合。其也防止在施用程序过程中,即在医师准备针头和注入器以进行施用时,以及在将要注射植入物且针头刺入眼中时,由于湿气进入而导致针头内的植入物过早再水合(因为眼中的正压可能会致使植入物在其即将实际注射之前发生至少一定程度的过早水合)。当升温至体温并暴露于湿气时,尖端或塞子另外提供光滑性,从而允许成功部署植入物。此外,通过阻塞针头内腔,针头尖端覆盖将组织损伤的可能性减至最小,即,组织取芯,即当针头穿过组织时通过其移出组织碎片的过程。
[0324]
为了将peg(或其他材料)尖端/塞子施加至针头内腔,在一个实施方案中,含有植入物的针头可手动或通过自动化装置浸入熔融peg(或各别其他材料)的容器中。可握持针头浸入熔融材料中数秒,以使熔融材料通过毛细作用向上流入针头中。停留时间、浸渍深度和熔融材料温度决定尖端/塞子的最终尺寸或长度。在某些实施方案中,针头顶端的peg(或其他)尖端/塞子的长度可为约1至约5mm,诸如约2至约4mm。在某些实施方案中,在使用1k peg的情况下,尖端/塞子的重量可为约0.1mg至约0.6mg,诸如约0.15mg至约0.55mg。证明根据本发明的植入物可自携带如本文所公开的具有1k peg尖端的针头的注入器在体内和体
外成功地部署。
[0325]
尖端覆盖如本文中所公开的注射针头也可用于注射拟通过针头注射至人类或动物体内(包括眼内的其他位置,或身体的其他区域或组织)的其他植入物或其他药物或疫苗,其中防止植入物(或药物或疫苗)受湿气影响的保护作用以及对向其中注射植入物(或药物或疫苗)的组织的保护作用为理想的并且为有利的。
[0326]
拉伸:
[0327]
以上已关于植入物的性质详细公开拉伸的形状记忆作用。在某些实施方案中,水合后收缩程度尤其取决于如以上所公开的拉伸因数。
[0328]
在某些实施方案中,本发明因而还涉及一种通过在纵向方向上拉伸水凝胶股绳而赋予水凝胶股绳形状记忆的方法,所述水凝胶股绳包含分散在水凝胶中的活性剂。
[0329]
同样,在某些实施方案中,本发明因而还涉及一种制造眼用植入物的方法,所述眼用植入物包含水凝胶,所述水凝胶包含分散于其中的活性剂,其中所述植入物在施用眼睛后改变其尺寸,所述方法包括制备水凝胶股绳和在纵向方向上对其进行拉伸。
[0330]
可如以上所公开利用供用于本发明的这些方法中的拉伸因数。所描述的制造方法(包括拉伸方法)不局限于包含tki抑制剂或阿西替尼的植入物,而是也可用于包含其他活性药物剂的水凝胶,或包含并非由peg单元而是由如本文中在以上公开的能够形成水凝胶的其他聚合物单元形成的水凝胶的植入物。
[0331]
在植入物含有约160μg至约250μg范围内的量或约200μg的量的阿西替尼的实施方案中,可在干燥水凝胶之后以约2至约5的拉伸因数、或约3至约4.5的拉伸因数进行拉伸(干式拉伸)。
[0332]
在植入物含有约480μg至约750μg范围内的量或约600μg的量的阿西替尼的某些实施方案中,可在干燥水凝胶之前在湿润状态下以约0.5至约5的拉伸因数、或约1至约4的拉伸因数、或约1.3至约3.5的拉伸因数、或约1.7至约3的拉伸因数、或约2.0至2.5的拉伸因数进行拉伸(湿式拉伸)。
[0333]
iii.注射装置和药盒
[0334]
在某些实施方案中,本发明还涉及一种药盒(其也可称为“系统”),其包括一个或多个如以上所公开或者根据如以上所公开的方法制造的持续释放生物可降解眼用植入物,和一个或多个注射用针头,其中所述一个或多个针头各自预先装载有一个呈干燥状态的持续释放生物可降解眼用植入物。在某些实施方案中,针头的规格尺寸为22至30,诸如22号、23号、24号、25号、26号、27号、28号、29号或30号。在特定实施方案中,针头可为25或27号针头,或可为更小规格,诸如30号针头。针头直径是基于植入物在干燥(且任选地拉伸)的状态下的最终直径来选择。植入物中所含有的活性物质一般为tki,诸如阿西替尼。
[0335]
在一个实施方案中,药盒包括一个或多个,诸如两个或三个22至30号,诸如25或27号针头,各自装载有含有量在约180μg至约220μg范围内或量为约200μg的阿西替尼的植入物。
[0336]
在又一实施方案中,药盒包括一个装载有含有量在约540μg至约660μg范围内或量为约600μg的阿西替尼的植入物的25号针头。在另一实施方案中,药盒包括一个装载有含有量在约540μg至约660μg范围内或量为约600μg的阿西替尼的植入物的27号针头。
[0337]
若药盒中含有两个或更多个植入物,则这些植入物可能相同或不同,并且可含有
相同或不同剂量的tki。
[0338]
在某些实施方案中,含有植入物的针头的内腔可通过在室温下为固体但在体温下软或为液体的材料(诸如1k peg材料)阻塞,如本文在“植入物的制造”部分且尤其是其子部分“(peg)尖端覆盖针头”中详细公开。
[0339]
药盒可进一步含有用于将植入物注射至患者的眼中,诸如注射至患者的玻璃体液中的注射装置。在某些实施方案中,注射装置与一个或多个装载有植入物的针头分开提供和/或包装。在此种实施方案中,注射前必须将注射装置连接至一个或多个装载有植入物的针头。
[0340]
在某些实施方案中,药盒中分开提供的注射装置的数目等于药盒中提供的装载有植入物的针头的数目。在这些实施方案中,注射装置仅用于一次注射一个植入物。
[0341]
在其他实施方案中,药盒含有一个或多个用于将植入物注射至患者的眼中,诸如注射至患者的玻璃体液中的注射装置,其中各注射装置预先连接或未预先连接至装载有植入物的针头。因而,在一个方面中,本发明还涉及一种药物产品,其包括装载于针头中的持续释放生物可降解眼用植入物和注射装置,其中所述针头预先连接至所述注射装置。在针头未预先连接至注射装置的情况下,则施用植入物的医师需要自包装中移出含有植入物的针头和注射装置,并且将针头连接至注射装置以便能够将植入物注射至患者的眼中。
[0342]
在一些实施方案中,注射装置含有推丝,以便将植入物自针头部署至玻璃体液中。推丝可为nitinol推丝或可为不锈钢/teflon推丝。推丝允许更容易地自针头部署植入物。
[0343]
在其他实施方案中,注射装置和/或注射针头可含有控制注射深度的终止特征件。
[0344]
在一些实施方案中,注射装置为或包括改进型hamilton玻璃注射器,其可置放在塑胶注射器外壳中,诸如在射出成形外壳内部。诸如nitinol丝的推丝插入注射器中,并且在部署植入物期间与注射器的柱塞一起推进。为了促进镍钛合金推丝进入针头中,可向针头接口添加接口插入物。图25a和图25b显示用于将植入物注射至患者的玻璃体液中的根据本发明的注入器的一个实施方案。注入器的此描绘实施方案包括hamilton注射器主体和nitinol推丝以部署植入物。图25a显示在射出成形外壳内部的hamilton注射器主体。图25b显示此注入器实施方案的部件的示意性视图。在某些实施方案中,包括hamilton注射器主体和塑胶外壳部件的注入器预先组装在根据本发明的药盒中,且所述注入器为即用型(有或无含植入物的安装针头)。在其他实施方案中,在安装含有植入物的针头前,必须由医师组装注入器。
[0345]
在其他实施方案中,注射装置为射出成形注入器。此种射出成形注入器的实施方案的示意性分解视图示于图26中。在此情况下,植入物即将施用患者前由医师进行的组装步骤的数目有所减少。
[0346]
所述药盒还可包括一个或多个剂量,尤其一个剂量的抗vegf剂以供注射。抗vegf剂可选自由阿柏西普、贝伐珠单抗(bevacizumab)、哌加他尼(pegaptanib)、雷尼珠单抗和布洛珠单抗组成的组。在某些实施方案中,抗vegf剂为贝伐珠单抗。在其他实施方案中,抗vegf剂为阿柏西普。抗vegf剂可提供于连接至针头的单独注射装置中,或可呈溶液或悬浮液形式提供于密封小瓶中,施用前可通过针头将溶液或悬浮液自其中吸出至注射器或其他注射装置中。
[0347]
所述药盒还可包括供注射眼用植入物的医师用的操作手册。所述药盒还可包括具
有产品相关信息的包装插页。
[0348]
除药盒以外,在一个方面中,本发明还涉及一种适合将根据本发明的持续释放生物可降解眼用植入物注射至眼中的注射装置本身。注射装置可含有用于将注射装置连接至针头的构件,其中所述针头预先装载有植入物。注射装置可进一步含有推丝以便在注射装置已连接至针头时将植入物自针头部署至眼中,所述推丝可由nitinol或不锈钢/teflon或另一适合材料制成。所述注射装置可进一步通过将所述丝固定至柱塞并将其封装在两个锁扣配合型注入器主体部分之间并且用夹子固定柱塞而获得。根据本发明的某些实施方案的注射装置和预先装载有植入物的针头描绘于图1中。
[0349]
如图1中所说明,在一些实施方案中,注射装置(例如植入物注入器装置)可包括分开包装(例如在单独外壳中)的第一组件和第二组件。图26c为第一组件的分解视图且图26d为第二组件的分解视图。
[0350]
参考图26c,第一组件包括形成第一内部体积的主体、包括部署在所述第一内部体积内的第一远端的柱塞、包括固定至所述柱塞的所述第一远端的第一远端的丝和柱塞夹。柱塞夹经配置以便与柱塞和主体相接以防止柱塞启动。主体可包括经配置以彼此互连的第一半主体和第二半主体。主体可包括与响应于柱塞启动的柱塞突起相接的活动铰链。活动铰链可响应于施加临限值力而允许柱塞启动。
[0351]
参考图26d,第二组件包括形成第二内部体积的外罩、包括基部和内腔的针头、部署在基部内的外罩帽以及经配置以固定至外罩并部署在内腔的一部分周围的针头防护件。植入物经配置以部署在针头内腔内。外罩可包括经配置以彼此互连的第一半外罩和第二半外罩。第二组件还可包括部署在所述内腔的第二远端上的聚合物尖端(例如peg尖端)。植入物固定在外罩帽与聚合物尖端之间的内腔中。聚合物尖端经配置以使用者体内液化(例如溶解)从而允许植入物注射至使用者中。
[0352]
在一些实施方案中,第二组件由包括较少湿气的材料制成和/或在密封于外壳中之前进行调理(例如,氮气调理)以防止植入物吸收湿气。在一些实施方案中,第一组件由包括较多湿气的材料制成和/或在密封于外壳中之前不进行调理,因为植入物不与第一组件一起包括在外壳中。
[0353]
第一组件可自图1的第一外壳移出且第二组件可自图1的第二外壳移出。参考图26e,第一组件和第二组件可对准。第一组件的一个或多个外部凹穴可与第二组件的一个或多个内部突起对准。第一组件和第二组件可包括标记(例如箭头)以指示如何对准第一组件和第二组件。参考图26f,第二组件的外罩固定至第一组件的主体(例如经由外罩的内部突起进入主体的外部凹穴)。参考图26g,自第二组件的外罩移除针头防护件,并且自第一组件的主体和柱塞移除柱塞夹。参考图26h,启动第一组件的柱塞(例如,推入第一组件的主体中)以便自第二组件的针头的内腔部署植入物。在一些实施方案中,主体具有活动铰链,从而允许响应于施加至柱塞的临限值力而启动柱塞。在一些实施方案中,针头内腔具有阻止植入物自内腔部署的聚合物尖端(例如,至少部署在内腔的远端的聚合物,诸如peg)。将具有聚合物尖端的内腔插入使用者体内可防止对使用者的组织取芯(例如,由内腔内部直径切割一块组织以稍后部署至使用者体内)。可将内腔插入使用者体内持续临限值量的时间量(例如1至5秒)以使聚合物尖端液化(例如溶解)。在聚合物尖端液化之后,可经由启动柱塞而自内腔部署植入物。
[0354]
iv.疗法
[0355]
在某些实施方案中,本发明还涉及一种治疗有需要的患者的眼部疾病的方法,所述方法包括向患者施用包含水凝胶和酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物。
[0356]
在特定实施方案中,本发明涉及一种治疗有需要的患者的眼部疾病的方法,所述方法包括向所述患者施用持续释放生物可降解眼用植入物,所述持续释放眼用植入物包含水凝胶和至少约150μg酪氨酸激酶抑制剂(tki),其中所述tki粒子分散在所述水凝胶内。
[0357]
在此治疗中,在至少3个月的治疗时段内每眼施用一次的剂量为至少约150μg,诸如约150μg至约1800μg或约150μg至约1200μg的酪氨酸激酶抑制剂。在某些优选实施方案中,酪氨酸激酶抑制剂为阿西替尼。
[0358]
在某些实施方案中,在治疗时段内(即,期间)每眼施用一次的tki且特定来说阿西替尼的剂量在约200μg至约800μg的范围内。在某些实施方案中,所述剂量在约160μg至约250μg或约180μg至约220μg的范围内或为约200μg。在其他特定实施方案中,此剂量在约320μg至约500μg或约360μg至约440μg的范围内或为约400μg。在其他实施方案中,此剂量在约480μg至约750μg或约540μg至约660μg的范围内或为约600μg。在其他实施方案中,此剂量在约640μg至约1000μg或约720μg至约880μg的范围内或为约800μg。在其他实施方案中,此剂量在约800μg至约1250μg或约900μg至约1100μg的范围内或为约1000μg。在其他实施方案中,此剂量在约960μg至约1500μg或约1080μg至约1320μg的范围内或为约1200μg。在特定实施方案中,治疗时段内每眼施用一次的剂量为约600μg阿西替尼。在特定实施方案中,此600μg剂量含有在一个单一植入物中。
[0359]
在某些实施方案中,用本发明植入物治疗如本文中公开的眼部疾病的治疗时段为至少3个月、至少4.5个月、至少6个月、至少9个月、至少11个月、至少12个月、至少13个月、至少14个月或甚至更久,且可例如为约6至约9个月。
[0360]
在某些实施方案中,眼部疾病涉及血管生成。
[0361]
在其他实施方案中,眼部疾病可由一种或多种受体酪氨酸激酶(rtk),诸如vegfr-1、vegfr-2、vegfr-3、pdgfr-α/β和/或由c-kit介导。
[0362]
在一些实施方案中,眼部疾病为视网膜疾病,包括脉络膜新血管形成、糖尿病性视网膜病、糖尿病性黄斑水肿、视网膜静脉阻塞、急性黄斑神经视网膜病、中心浆液性脉络膜视网膜病和囊状黄斑水肿;其中所述眼部疾病为急性多灶性斑状色素上皮病、behcet氏病、鸟枪弹样视网膜脉络膜病、传染病(梅毒病、莱姆病、结核病、弓形体病)、中性葡萄膜炎(睫状体扁平部炎)、多灶性脉络膜炎、多发性一过性白点综合征(mewds)、眼类肉瘤病、后巩膜炎、蛇形脉络膜炎、视网膜下纤维化、葡萄膜发炎候群或vogt-koyanagi-harada综合征;其中所述眼部疾病为血管疾病或渗出性疾病,包括coat氏病、窝旁毛细血管扩张症、乳头状静脉炎、结霜性支脉管炎、镰状细胞视网膜病和其他血红素病、血管样纹和家族性渗出性玻璃体视网膜病变;或其中所述眼部疾病是由外伤或手术引起,包括交感性眼炎、葡萄膜视网膜病、视网膜脱落、外伤、光动力激光治疗、光凝、手术过程中灌注不足、放射性视网膜病或骨髓移植性视网膜病。
[0363]
在替代实施方案中,本发明的包含水凝胶和酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物可用于治疗与肿瘤相关的眼部疾患。此种疾患包括例如与肿瘤、实体肿瘤、
肿瘤转移、良性肿瘤(例如血管瘤)、神经纤维瘤、沙眼和化脓性肉芽肿、rpe先天性肥大、后葡萄膜黑色素瘤、脉络膜血管瘤、脉络膜骨瘤、脉络膜转移、组合视网膜和视网膜色素上皮错构瘤、视网膜母细胞瘤、眼底血管增生性肿瘤、视网膜星形细胞瘤或眼内淋巴样肿瘤相关的视网膜疾病。
[0364]
一般而言,本发明的眼用植入物也可应用于治疗涉及血管渗漏的任何眼部疾病。
[0365]
在某些实施方案中,眼部疾病为选自由新血管性年龄相关性黄斑退化(amd)、糖尿病性黄斑水肿(dme)和视网膜静脉阻塞(rvo)组成的清单中的一种。在特定实施方案中,眼部疾病为新血管性年龄相关性黄斑退化。
[0366]
在一些实施方案中,所述治疗在中心子场厚度升高的患者中降低中心子场厚度(csft)方面为有效的,如通过光学相干断层扫描所测量。所述上下文内的升高意谓患者的csft当与未患特定眼部疾病的其他个体相比时更高。csft升高可能由视网膜液(诸如视网膜下或视网膜内液)引起。患者的csft降低可相对于在治疗开始之前,即,施用本发明植入物之前在所述患者中测量的基线csft来确定。本发明植入物在较长时间段内在患者群组中降低csft并维持或实质上维持降低的csft的能力示于实施例6.3和实施例6.4中。在其他实施方案中,通过根据本发明的治疗,包括施用根据本发明的植入物,csft由于涉及血管生成的眼部疾病而升高的患者的csft基本上维持在某一指定水平,或防止患者的csft出现临床显著的增高,同时视网膜下或视网膜内液实质上未增加,即,也基本上维持。
[0367]
在一特定实施方案中,在施用本发明植入物之后至少3个月、至少4.5个月、至少6个月、至少9个月、至少11个月、至少12个月、至少13个月、至少14个月或甚至更久的时段内降低患者的csft并维持在降低的水平。在一极特定实施方案中,在施用植入物之后至少6个月或至少9个月或至少12个月内,csft相对于所述患者在施用植入物之前的基线csft有所降低。在其他特定实施方案中,在施用本发明植入物之后至少3个月、至少4.5个月、至少6个月、至少9个月、至少11个月、至少12个月、至少13个月、至少14个月或甚至更久的治疗时段内维持减少量的视网膜液和/或降低的csft,而无需施用救援药物(诸如注射抗vegf剂),或其中仅偶尔施用救援药物,诸如在治疗时段期间施用1、2或3次。因而,在此实施方案中,在利用根据本发明的植入物的治疗时段期间,接受治疗的患者可能不需要任何救援药物,或仅极少需要施用救援药物,诸如在治疗时段期间1、2或3次。
[0368]
在某些实施方案中,救援药物为呈悬浮液或溶液形式通过玻璃体内注射施用的抗vegf剂,诸如阿柏西普或贝伐珠单抗。在某些特定实施方案中,救援药物为通过玻璃体内注射施用的一个剂量(2mg)的阿柏西普。根据本文中的定义,抗vegf剂与本文中所公开的根据本发明的另一实施方案的植入物同时(即,计划)施用不构成“救援药物”。在更特定实施方案中,在不施用救援药物(或仅极少施用救援药物)的情况下维持或基本上维持体液和/或csft的水平(如通过施用根据本发明的植入物而降低)的治疗时段为施用植入物之后约6至约9个月。在某些实施方案中,用根据本发明的植入物治疗的患者不需要在治疗时段期间伴随施用类固醇(例如地塞米松(dexamethasone)或泼尼松龙(prednisolone)滴剂)。
[0369]
在另一实施方案中,通过包括施用根据本发明的植入物的根据本发明的治疗来降低、基本上维持csft由于血管生成而升高的患者的csft,或防止csft出现临床显著的增高,同时不削弱或不显著削弱患者的视力(例如,通过最佳矫正视敏度表示,在本文中也称为“bcva”)。在某些实施方案中,通过包括施用根据本发明的植入物的根据本发明的治疗,可
在至少3个月、至少6个月、至少9个月、至少11个月、至少12个月、至少13个月或至少14个月的治疗时段期间改良如例如通过bcva表示的患者的视力(其中患者的视力由于涉及血管生成的眼部疾病而削弱)。
[0370]
因而,在某些实施方案中,本发明提供一种改良视力例如由于由涉及血管生成的眼部疾病引起的视网膜液而被削弱的患者的视力的方法,其中所述方法包括向所述患者施用根据根据本发明的植入物,诸如通过玻璃体内注射。患者视力的改良可例如通过bcva加以评定。视力改良可通过患者的bcva增加例如至少10个、或至少15个、或至少20个etdrs字母来体现。
[0371]
在某些实施方案中,在治疗时段内施用一次的tki(诸如阿西替尼)的每眼总剂量可包含在一个或多个植入物中。在某些实施方案中,在治疗时段内施用一次的每眼剂量包含在一个植入物中,例如在包含约600μg或约200μg阿西替尼的剂量的一个植入物中。在其他实施方案中,在治疗时段内施用一次的每眼总剂量包含在例如两个植入物中,其中各植入物包含例如约200μg阿西替尼的剂量(在所述情况下,总剂量为约400μg)。在其他实施方案中,在治疗时段内施用一次的每眼剂量包含在例如三个植入物中,其中各植入物包含例如约200μg阿西替尼的剂量(在所述情况下,总剂量为约600μg)。在本发明的治疗方法的特定实施方案中,施用一只眼睛的阿西替尼的剂量为约600μg,并且包含在一个植入物中。
[0372]
为了在治疗诸如视网膜病(包括amd)的眼部疾病的过程中将根据本发明的植入物注射至患者眼中,诸如玻璃体液中,一般需要使用在相对较小的植入物中具有治疗有效剂量的tki的植入物(即,鉴于特定患者类型和疾患严重程度而适当的植入物),以便有助于投药(注射)以及在植入物在适当位置时减少对眼部组织的可能损伤以及对患者视力的可能影响。本发明的植入物有利地组合适当高剂量的tki(即,根据特定患者需要调节的治疗有效剂量)与相对较小植入物尺寸的益处。
[0373]
在某些实施方案中,植入物可通过连接至预先装载有如本文中所公开的植入物的针头的根据本发明的注射装置或可通过适合连接至预先装载有如本文中所公开的植入物的针头的另一注射装置,诸如(改进型)hamilton注射器来施用。在其他实施方案中,中空微针可用于脉络膜上施用,如us 8,808,225中所公开,所述美国专利以引用的方式并入本文中。
[0374]
在其中施用两个或更多个植入物的实施方案中,一般如本文中在以上所公开同时施用植入物。同时施用的植入物可相同或不同。在不可能在同一时段施用的情况下,例如由于施用并发症或患者相关原因,可替代地应用在两个或更多个不同期间相继施用,例如相隔7天施用两个植入物。在本发明的上下文中,此仍可被视为“同时”施用。
[0375]
在某些实施方案中,将干燥植入物装载于针头,诸如规格尺寸为22至23的针头,诸如25号或27号针头,或更小规格针头中以用于注射,并且经由此针头施用眼睛,例如玻璃体液。在一个实施方案中,用于将植入物注射至眼中的注入器为如以上所公开的根据本发明的另一方面的注射装置。适合根据本技术的治疗应用的分别含有200μg和600μg的植入物例示性地呈现于表21.1和表21.2中。
[0376]
所述植入物一般可通过玻璃体内、结膜下、肌腱下、脉络膜上或前房内注射来施用。在某些实施方案中,将植入物施用玻璃体液,例如将植入物经玻璃体内施用玻璃体液后部。在其他实施方案中,植入物通过中空微针施用,诸如us 8,808,225中所公开在进入眼脉
络膜上空间的插入部位处进入眼巩膜中,所述美国专利以引用的方式并入本文中。
[0377]
在某些实施方案中,治疗时段为至少3个月,但可为至少4.5个月、至少6个月、至少9个月、至少11个月、或至少12个月。在特定实施方案中,治疗时段为至少6个月、至少9个月、至少11个月、至少12个月、至少13个月、或至少14个月。在某些实施方案中,治疗时段也可更久,诸如长达约15个月。根据本发明的一个实施方案的“治疗时段”意谓本发明的植入物在施用后的某种治疗效果在所述时段内得以维持、基本上维持或部分维持。换句话说,在某些实施方案中,仅需要一次注射(本发明的植入物)来维持在本文中称为“治疗时段”的较长时间段内降低或基本上维持csft或防止其临床显著的增加的治疗效果。此相对于目前用于amd的需要更频繁施用的抗vegf治疗为相当大的优势,从而改良患者的生活质量。另一优势为在治疗时段期间施用救援药物的必要性和/或频率极低。在某些实施方案中,在治疗时段,诸如施用植入物之后约6至约9个月的治疗时段期间,不必需救援药物。在某些其他实施方案中,仅需要极少施用救援药物,诸如在治疗时段期间1、2或3次。可改良患者的视力,如例如通过施用本发明的植入物后bcva增加(诸如至少10个、至少15个或至少20个etdrs字母)所证明。
[0378]
在一个特定实施方案中,本发明涉及一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用包含水凝胶的持续释放生物可降解眼用植入物,所述水凝胶包含聚合物网络和约200μg酪氨酸激酶抑制剂,其中一次施用每眼一个植入物,持续至少9个月的治疗时段,并且其中所述患者有抗vegf治疗史。在此实施方案中,如治疗时段期间通过光学相干断层扫描所测量,治疗降低中心子场厚度(csft)或至少维持csft。在此实施方案中,tki可进一步为阿西替尼,其分散在水凝胶中,所述水凝胶包含通过使4a20kpeg-saz与8a20kpeg-nh2反应而形成的聚合物网络,且其中所述植入物在施用前呈干燥状态。在此实施方案中,所述水凝胶在形成时和干燥前含有以聚乙二醇重量除以流体重量x100表示占约7.5%的聚乙二醇。另选地,所治疗的患者也可能无抗vegf治疗史(未进行过amd治疗)。
[0379]
在另一特定实施方案中,本发明涉及一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用包含包括聚合物网络的水凝胶和约200μg酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其中形成约400μg总剂量的每眼两个植入物在至少3个月或至少9个月的治疗时段内施用一次,且其中所述患者有抗vegf治疗史或无抗vegf治疗史(未进行过amd治疗)。在此实施方案中,如治疗时段期间通过光学相干断层扫描所测量,治疗降低(或至少维持)中心子场厚度(csft)。在此实施方案中,tki可进一步为阿西替尼,其分散在水凝胶中,所述水凝胶包含通过使4a20kpeg-saz与8a20kpeg-nh2反应而形成的聚合物网络,且其中所述植入物在施用前呈干燥状态。在此实施方案中,所述水凝胶在形成时和干燥前含有以聚乙二醇重量除以流体重量x100表示占约7.5%的聚乙二醇。
[0380]
在另一特定实施方案中,本发明涉及一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用包含包括聚合物网络的水凝胶和约200μg酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其中形成约600μg总剂量的每眼三个植入物在至少3个月或至少9个月的治疗时段内施用一次,且其中所述患者有抗vegf治疗史或无抗vegf治疗史(未进行过amd治疗)。在此实施方案中,如治疗时段期间通过光学相干
断层扫描所测量,治疗降低(或至少维持)中心子场厚度(csft)。在此实施方案中,tki可进一步为阿西替尼,其分散在水凝胶中,所述水凝胶包含通过使4a20kpeg-saz与8a20kpeg-nh2反应而形成的聚合物网络,且其中所述植入物在施用前呈干燥状态。在此实施方案中,所述水凝胶在形成时和干燥前含有以聚乙二醇重量除以流体重量x100表示占约7.5%的聚乙二醇。
[0381]
在其他实施方案中,本发明涉及一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用包含以约480μg至约750μg范围内的量分散在包含聚合物网络的水凝胶中的阿西替尼的持续释放生物可降解眼用植入物,其中所述植入物在至少3个月的治疗时段内施用一次。在某些这些实施方案中,阿西替尼以约560μg至约660μg或约600μg的量包含在植入物中。对于植入物的特定性质,参考以上针对根据本发明的以约480μg至约750μg范围内的量或以约560μg至约660μg或约600μg的量含有阿西替尼的植入物的部分。可例如通过细直径,诸如25号针头将植入物施用玻璃体液中。如以上所定义的治疗时段可为至少4.5个月、或至少6个月、或至少9个月、或至少11个月、或至少12个月、或至少13个月、或至少14个月或甚至更久,诸如长达约15个月。在特定实施方案中,治疗时段为至少6个月、或至少9个月、或至少12个月、或为约6至约9个月。
[0382]
在一些实施方案中,与用含有tki的持续释放生物可降解眼用植入物治疗或用根据本发明的含有阿西替尼的持续释放生物可降解眼用植入物治疗同时向患者施用抗vegf剂。抗vegf剂可选自由阿柏西普、贝伐珠单抗、哌加他尼、雷尼珠单抗和布洛珠单抗。在某些实施方案中,抗vegf剂为贝伐珠单抗。在特定实施方案中,抗vegf剂为阿柏西普。在某些实施方案中,抗vegf剂通过玻璃体内注射与持续释放生物可降解眼用植入物同时(如以上所定义),任选地在同一时间,即,如以上已详细公开在一个时段内施用。在不可能在同一时段中施用抗vegf剂和本发明的植入物的情况下,例如由于施用并发症或患者相关原因,可替代地应用在两个或更多个不同时段相继施用,例如相隔7天施用两个植入物。在本发明的上下文中,此仍可被视为“同时”施用。
[0383]
在其他实施方案中,抗vegf剂可与本发明的植入物组合但不在同一时间(即,并非同时),而是在本发明植入物的治疗时段期间较早或较晚的时间点施用。在某些实施方案中,抗vegf剂可在距施用植入物约1、约2或约3或更多个月内施用,即,与植入物相比可前施用或后施用。抗vegf剂的此组合(和计划)共同施用不同于如本文中所定义的救援药物。
[0384]
在本发明的某些实施方案中,患者被诊断有继发于amd的原发性窝下(诸如活动性窝下或窝旁cnv伴随涉及眼窝的渗漏)新血管形成(sfnv)。
[0385]
在本发明的某些实施方案中,患者被诊断有继发于新血管性amd的先前治疗过的窝下新血管形成(sfnv)伴随涉及眼窝的渗漏。在此种患者中,先前治疗利用抗vegf剂。
[0386]
在一些实施方案中,患者为至少50岁或至少60岁。患者可为男性或女性。患者可存在视网膜液,诸如视网膜内液或视网膜下液。
[0387]
在一些实施方案中,接受植入物的患者有抗vegf治疗史,例如,诸如用和/或治疗。在某些实施方案中,接受植入物的患者有抗vegf治疗史,但不响应此抗vegf治疗,即,抗vegf治疗未改良患者的疾病状态。在患者开始用根据本发明的植入物治疗前有抗vegf治疗史的实施方案中,施用本发明的植入物可延长先前抗vegf治疗的作用超过较长时间段,诸如超过以上所定义的治疗时段。在其他实施方案中,接
受植入物的患者无抗vegf治疗史(未进行过抗vegf、未进行过amd治疗)。
[0388]
在某些实施方案中,tki(诸如阿西替尼)的全身血浆浓度低于1ng/ml、或低于0.5ng/ml、或低于0.3ng/ml、或低于0.1ng/ml(或低于定量极限)。由于tki的全身浓度保持在最低程度,因此,药物与药物相互作用或全身毒性的风险也保持在最低程度。因此,在一个实施方案中,患者服用的一种或多种额外药物不提供显著风险。此对于往往受眼部疾病困扰且另外服用其他药物的年长患者尤其有益。
[0389]
一旦注射后,本发明的某些实施方案的植入物(包含水凝胶和药物)便在如以上所公开的较长时间段,例如约9至12个月内生物降解。在某些实施方案中,可能一旦水凝胶完全降解,未溶解的阿西替尼粒子便保持定位在植入物所处的位置。当水凝胶降解时,这些未溶解的粒子可进一步维持足以达成治疗效果(即,抑制血管渗漏)的tki递送速率。图15例示性地呈现一名患者中水凝胶和剩余阿西替尼粒子在先前植入位置处的再吸收直至施用后11个月。然而,在某些实施方案中,在水凝胶完全降解之前溶解全部量的tki。
[0390]
在某些实施方案中,治疗时段内仅观测到轻度或中度不良事件,诸如眼部不良事件。在某些实施方案中,未观测到严重眼部不良反应,且未观测到治疗有关的严重眼部不良事件。表23和表25分别显示临床研究的第1组和第2组以及第3a组和第3b组受试者的不良事件发生率,其结果(迄今为止可利用者)呈现于实施例6.4中。
[0391]
在某些实施方案中,本发明还涉及一种在中心子场厚度由于涉及血管生成的眼部疾病升高的患者中降低、基本上维持中心子场厚度(如通过光学相干断层扫描所测量)或预防中心子场厚度临床显著的增加的方法,所述方法包括向所述患者施用如本文中所公开的包含本发明的酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物。在某些实施方案中,涉及血管生成的眼部疾病为新血管性年龄相关性黄斑退化。在其他实施方案中,在施用中心子场厚度由于涉及血管生成的眼部疾病,诸如新血管性年龄相关性黄斑退化而升高的患者之后至少3个月、至少4.5个月、至少6个月、至少9个月、至少11个月、至少12个月、至少13个月或至少14个月或甚至更久,诸如至少15个月的时段期间降低、基本维持中心子场厚度或防止中心子场厚度临床显著的增加。在某些实施方案中,例如通过bcva表示的患者视力在治疗期间实质上未被削弱。在某些其他实施方案中,例如通过bcva表示的患者视力甚至可能有所改良。因此,在某些实施方案中,本发明还涉及一种在视力例如由于由涉及血管生成的眼部疾病引起的视网膜液而被削弱的患者中改良视力的方法,其中所述方法包括诸如通过玻璃体内注射向患者施用根据本发明的植入物。
[0392]
额外公开内容
[0393]
除以上公开内容以外,本发明还公开以下项目和项目清单:
[0394]
项目的第一清单
[0395]
1.一种持续释放生物可降解眼用植入物,其包含水凝胶和约150μg至约1200μg酪氨酸激酶抑制剂。
[0396]
2.如第1项的持续释放生物可降解眼用植入物,其中所述酪氨酸激酶抑制剂为阿西替尼。
[0397]
3.如权利要求1或2的持续释放生物可降解眼用植入物,其以约200μg至约800μg范围内的量包含所述酪氨酸激酶抑制剂。
[0398]
4.如第1项或第2项的持续释放生物可降解眼用植入物,其以约160μg至约250μg范
围内的量包含所述酪氨酸激酶抑制剂。
[0399]
5.如权利要求4的持续释放生物可降解眼用植入物,其以约180μg至约220μg范围内的量包含所述酪氨酸激酶抑制剂。
[0400]
6.如第5项的持续释放生物可降解眼用植入物,其包含约200μg的量的所述酪氨酸激酶抑制剂。
[0401]
7.如权利要求1或2的持续释放生物可降解眼用植入物,其以约320μg至约500μg范围内的量包含所述酪氨酸激酶抑制剂。
[0402]
8.如第7项的持续释放生物可降解眼用植入物,其以约360μg至约440μg范围内的量包含所述酪氨酸激酶抑制剂。
[0403]
9.如权利要求8的持续释放生物可降解眼用植入物,其包含约400μg的量的所述酪氨酸激酶抑制剂。
[0404]
10.如第1项或第2项的持续释放生物可降解眼用植入物,其以约480μg至约750μg范围内的量包含所述酪氨酸激酶抑制剂。
[0405]
11.如权利要求10的持续释放生物可降解眼用植入物,其以约540μg至约660μg范围内的量包含所述酪氨酸激酶抑制剂。
[0406]
12.如第11项的持续释放生物可降解眼用植入物,其包含约600μg的量的所述酪氨酸激酶抑制剂。
[0407]
13.如第1项或第2项的持续释放生物可降解眼用植入物,其以约640μg至约1000μg范围内的量包含所述酪氨酸激酶抑制剂。
[0408]
14.如第13项的持续释放生物可降解眼用植入物,其以约720μg至约880μg范围内的量包含所述酪氨酸激酶抑制剂。
[0409]
15.如第14项的持续释放生物可降解眼用植入物,其包含约800μg的量的所述酪氨酸激酶抑制剂。
[0410]
16.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物用于施用眼的后部。
[0411]
17.如第16项的持续释放生物可降解眼用植入物,其中所述施用为向玻璃体液施用。
[0412]
18.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述酪氨酸激酶抑制剂粒子分散在所述水凝胶内。
[0413]
19.如第18项的持续释放生物可降解眼用植入物,其中所述酪氨酸激酶抑制剂粒子为微粉化粒子。
[0414]
20.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在施用前呈干燥状态且一旦施用眼中后便水合。
[0415]
21.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述水凝胶包含聚合物网络,所述聚合物网络包含一个或多个聚乙二醇、聚环氧乙烷、聚环氧丙烷、聚乙烯醇、聚(乙烯基吡咯烷酮)、聚乳酸、乳酸乙醇酸共聚物、所述中任一种的无规或嵌段共聚物或组合或混合物的单元,或者一个或多个聚氨基酸、糖胺聚糖、多糖或蛋白质的单元。
[0416]
22.如第21项的持续释放生物可降解眼用植入物,其中所述水凝胶包含包括相同或不同的交联聚合物单元的聚合物网络。
[0417]
23.第22项的持续释放生物可降解眼用植入物,其中交联聚合物单元为一个或多个交联聚乙二醇单元。
[0418]
24.如第21项至第23项中任一项的持续释放生物可降解眼用植入物,其中所述聚合物网络包含平均分子量在约2,000至约100,000道尔顿范围内的聚乙二醇单元。
[0419]
25.如第24项的持续释放生物可降解眼用植入物,其中所述聚乙二醇单元的平均分子量在约10,000至约60,000道尔顿的范围内。
[0420]
26.如第25项的持续释放生物可降解眼用植入物,其中所述聚乙二醇单元的平均分子量在约20,000至约40,000道尔顿的范围内。
[0421]
27.如第26项的持续释放生物可降解眼用植入物,其中所述聚乙二醇单元的平均分子量为约20,000道尔顿。
[0422]
28.如第21项至第27项中任一项的持续释放生物可降解眼用植入物,其中所述聚合物网络包括一个或多个交联多臂聚合物单元。
[0423]
29.如第28项的持续释放生物可降解眼用植入物,其中所述多臂聚合物单元包括一个或多个2至10臂聚乙二醇单元。
[0424]
30.如第29项的持续释放生物可降解眼用植入物,其中所述多臂聚合物单元包括一个或多个4至8臂聚乙二醇单元。
[0425]
31.如第30项的持续释放生物可降解眼用植入物,其中所述多臂聚合物单元包括一个或多个4臂聚乙二醇单元。
[0426]
32.如第21项至第31项中任一项的持续释放生物可降解眼用植入物,其中所述聚合物网络包括4臂和8臂聚乙二醇单元。
[0427]
33.如第21项至第32项中任一项的持续释放生物可降解眼用植入物,其中所述聚合物网络是通过使含亲电子基团的多臂聚合物前体与含亲核基团的多臂聚合物前体反应而形成。
[0428]
34.如第21项至第33项中任一项的持续释放生物可降解眼用植入物,其中所述亲核基团为胺基。
[0429]
35.如第21项至第34项中任一项的持续释放生物可降解眼用植入物,其中所述亲电子基团为活性酯基。
[0430]
36.如第35项的持续释放生物可降解眼用植入物,其中所述亲电子基团为n-羟基琥珀酰亚胺基(nhs)基团。
[0431]
37.如第36项的持续释放生物可降解眼用植入物,其中所述亲电子基团为壬二酸琥珀酰亚胺酯(saz)基团。
[0432]
38.如第32项至第37项中任一项的持续释放生物可降解眼用植入物,其中所述4臂聚乙二醇单元为4a20kpeg单元且所述8臂聚乙二醇单元为8a20kpeg单元。
[0433]
39.如第38项的持续释放生物可降解眼用植入物,其中所述聚合物网络是通过使4a20kpeg-saz与8a20kpeg-nh2以约2:1或更小的重量比反应而获得。
[0434]
40.如第1项至第39项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计约25%至约75%的所述酪氨酸激酶抑制剂和以重量计约20%至约60%的聚合物单元。
[0435]
41.如第40项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下
含有以重量计约35%至约65%的所述酪氨酸激酶抑制剂和以重量计约25%至约50%的聚合物单元。
[0436]
42.如第41项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计约45%至约55%的所述酪氨酸激酶抑制剂和以重量计约37%至约47%的聚合物单元。
[0437]
43.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物含有一种或多种磷酸盐、硼酸盐或碳酸盐。
[0438]
44.如第43项的持续释放生物可降解眼用植入物,其中所述植入物含有来源于制备所述水凝胶期间所使用的磷酸盐缓冲液的磷酸盐。
[0439]
45.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述水凝胶在湿润状态下含有以聚乙二醇重量除以流体重量x100表示占约3%至约20%的聚乙二醇。
[0440]
46.如第45项的持续释放生物可降解眼用植入物,其中所述水凝胶含有以聚乙二醇重量除以流体重量x100表示占约7.5%至约15%的聚乙二醇。
[0441]
47.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计不超过约1%的水。
[0442]
48.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物具有基本上为圆柱形的形状或诸如十字形的另一形状。
[0443]
49.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物呈纤维形式。
[0444]
50.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是通过针头施用至眼。
[0445]
51.如第50项的持续释放生物可降解眼用植入物,其中所述针头为25或27号针头。
[0446]
52.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中在眼中体内或在体外水合后,所述植入物的直径增加,或所述植入物的长度减小,而其直径增加。
[0447]
53.如第52项的持续释放生物可降解眼用植入物,其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后体外测量水合。
[0448]
54.如第17项至第53项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在施用后约2至约15个月内在玻璃体液中生物降解。
[0449]
55.如第54项的持续释放生物可降解眼用植入物,其中所述植入物在施用后约4至约13个月内在玻璃体液中生物降解。
[0450]
56.如第55项的持续释放生物可降解眼用植入物,其中所述植入物在施用后约9至约12个月内在玻璃体液中生物降解。
[0451]
57.如第2项至第56项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在施用玻璃体液后在施用后至少约3个月、至少约6个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约13个月或至少约14个月的时段内释放治疗有效量的阿西替尼。
[0452]
58.如第57项的持续释放生物可降解眼用植入物,其中所述植入物在施用玻璃体液后在至少约6个月的时段内释放治疗有效量的阿西替尼。
[0453]
59.如第57项的持续释放生物可降解眼用植入物,其中所述植入物在施用玻璃体
液后在至少约9个月的时段内释放治疗有效量的阿西替尼。
[0454]
60.如第17项至第59项中任一项的持续释放生物可降解眼用植入物,其中阿西替尼在施用后以约0.1μg/天至约10μg/天的平均速率自所述植入物释放。
[0455]
61.如第60项的持续释放生物可降解眼用植入物,其中阿西替尼是以约0.5μg/天至约7μg/天的平均速率自所述植入物释放。
[0456]
62.如第61项的持续释放生物可降解眼用植入物,其中阿西替尼是以约1μg/天至约5μg/天的平均速率自所述植入物释放。
[0457]
63.如第17项至第62项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在所述植入物中所含有的所述酪氨酸激酶抑制剂粒子完全溶解之前在玻璃体液中生物降解。
[0458]
64.如第17项至第63项中任一项的持续释放生物可降解眼用植入物,其中所述植入物中所含有的所述酪氨酸激酶抑制剂的全部量在所述植入物于玻璃体液中完全降解前释放。
[0459]
65.如前述诸项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是通过制备含有水凝胶前体和酪氨酸激酶抑制剂的混合物,将所述混合物填充至管中,使所述水凝胶在所述管中胶化以提供成形为纤维的水凝胶,和拉伸所述水凝胶纤维而获得。
[0460]
66.如第65项的持续释放生物可降解眼用植入物,其中所述纤维在干燥之前或之后已经拉伸和/或扭绞。
[0461]
67.如第66项的持续释放生物可降解眼用植入物,其中所述纤维已在纵向方向上以约1.0至约4.5的拉伸因数拉伸。
[0462]
68.一种持续释放生物可降解眼用植入物,其包含量为160μg至约250μg或约180μg至约220μg、或约200μg且分散在水凝胶中的阿西替尼,其中所述水凝胶包含包括聚乙二醇单元的聚合物网络,且其中所述植入物在施用前呈干燥状态。
[0463]
69.如第68项的持续释放生物可降解眼用植入物,其中所述聚合物网络是通过使4a20kpeg-saz与8a20kpeg-nh2反应而形成。
[0464]
70.如第69项的持续释放生物可降解眼用植入物,其中所述水凝胶在形成时和干燥前含有以聚乙二醇重量除以流体重量x100表示占7.5%的聚乙二醇。
[0465]
71.如第68项至第70项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计约45%至约55%的阿西替尼和以重量计约37%至约47%的聚乙二醇单元。
[0466]
72.如第68项至第71项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计不超过约1%的水。
[0467]
73.如第68项至第72项中任一项的持续释放生物可降解眼用植入物,其中所述聚合物网络是通过使4a20kpeg-saz与8a20kpeg-nh2以约2:1或更小的重量比反应而形成。
[0468]
74.如第68项至第73项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在37℃磷酸盐缓冲生理盐水中每天体外释放约0.01μg至约0.15μg阿西替尼,持续30天的时段。
[0469]
75.如第68项至第74项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在25:75乙醇/水混合物(v/v)中在37℃下在3天内体外释放约35%至约45%的所述阿
西替尼、在7天内体外释放约65%至约75%的所述阿西替尼且在12至13天内体外释放约90%至约100%的所述阿西替尼。
[0470]
76.如第68项至第75项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在37℃且具有辛醇上层的ph 7.2磷酸盐缓冲生理盐水中在2个月内体外释放约25%至约35%的所述阿西替尼、在3个月内体外释放约47%至约57%的所述阿西替尼、在5个月内体外释放约70%至约80%的所述阿西替尼且在7个月内体外释放约90%至约100%的所述阿西替尼。
[0471]
77.如第68项至第76项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在其干燥状态下呈平均长度为约15mm至约16.5mm且平均直径为约0.20mm至约0.30mm的纤维形式。
[0472]
78.如第77项的持续释放生物可降解眼用植入物,其在眼中体内或在体外水合后长度减小且直径增大,其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后体外测量水合。
[0473]
79.如第77项或第78项的持续释放生物可降解眼用植入物,其中所述植入物在其水合状态下平均长度为约6.5至约8mm且平均直径为约0.70至约0.80mm。
[0474]
80.如第68项至第79项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是通过制备含有水凝胶前体和阿西替尼的混合物,将所述混合物填充至管中,使所述水凝胶在所述管中胶化以提供成形为纤维的水凝胶,和拉伸所述水凝胶纤维而获得。
[0475]
81.如第80项的持续释放生物可降解眼用植入物,其中所述纤维在干燥后以约2至约5的因数拉伸。
[0476]
82.如第81项的持续释放生物可降解眼用植入物,其中所述纤维在干燥后以约3至约4.5的因数拉伸。
[0477]
83.如第68项至第82项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是在干燥状态下装载于针头中,诸如25号针头或27号针头,以注射至玻璃体液中。
[0478]
84.一种持续释放生物可降解眼用植入物,其含有量在约480μg至约750μg的范围内且分散在水凝胶中的阿西替尼,其中所述水凝胶包含聚合物网络。
[0479]
85.如第84项的持续释放生物可降解眼用植入物,其中所述聚合物网络包含交联聚乙二醇单元。
[0480]
86.如第85项的持续释放生物可降解眼用植入物,其中所述阿西替尼的含量在约540μg至约660μg的范围内。
[0481]
87.如第86项的持续释放生物可降解眼用植入物,其中所述阿西替尼的含量为约600μg。
[0482]
88.如第84项至第87项中任一项的持续释放生物可降解眼用植入物,其中所述聚乙二醇单元包括平均分子量在约10,000道尔顿至约60,000道尔顿范围内的4臂和/或8臂聚乙二醇单元。
[0483]
89.如第88项的持续释放生物可降解眼用植入物,其中所述聚乙二醇单元包括4a20kpeg单元。
[0484]
90.如第89项的持续释放生物可降解眼用植入物,其中所述聚合物网络是通过使4a20kpeg-saz与8a20kpeg-nh2反应而形成。
[0485]
91.如第90项的持续释放生物可降解眼用植入物,其中4a20kpeg-saz与8a20kpeg-nh2的重量比为约2:1或更小。
[0486]
92.如第84项至第91项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计约45%至约55%的阿西替尼和以重量计约37%至约47%的聚乙二醇单元。
[0487]
93.如第84项至第92项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在干燥状态下含有以重量计不超过约1%的水。
[0488]
94.如第84项至第93项中任一项的持续释放生物可降解眼用植入物,其中所述植入物呈在其干燥状态下平均长度为约7mm至约12mm且平均直径为约0.25mm至约0.50mm的纤维形式。
[0489]
95.如第94项的持续释放生物可降解眼用植入物,其中所述植入物呈在其干燥状态下平均长度为约8mm至约11mm且平均直径为约0.3mm至约0.4mm的纤维形式。
[0490]
96.如第84项至第95项中任一项的持续释放生物可降解眼用植入物,其中所述植入物用于施用玻璃体液。
[0491]
97.如第94项至第96项的持续释放生物可降解眼用植入物,其在眼中体内或在体外水合后直径增大,其中在磷酸盐缓冲生理盐水中在ph 7.2、37℃下24小时之后测量体外水合。
[0492]
98.如第97项的持续释放生物可降解眼用植入物,其中所述植入物在其水合状态下平均长度为约9mm至约12mm且平均直径为约0.5mm至约0.8mm。
[0493]
99.如第98项的持续释放生物可降解眼用植入物,其中所述植入物在其水合状态下平均长度为约9.5mm至约11.5mm且平均直径为约0.65mm至约0.75mm,或者在其水合状态下平均长度不超过约10mm或不超过约9mm。
[0494]
100.如第84项至第99项中任一项的持续释放生物可降解眼用植入物,其中所述植入物含有约600μg阿西替尼且在37℃磷酸盐缓冲生理盐水中每天体外释放约0.3μg至约0.5μg阿西替尼,持续30天的时段。
[0495]
101.如第84项至第100项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在25:75乙醇/水混合物(v/v)中在37℃下在2天内体外释放约40%至约60%的所述阿西替尼,在4天内体外释放约65%至约85%的所述阿西替尼,且在6天内体外释放约75%至约90%的所述阿西替尼。
[0496]
102.如第101项的持续释放生物可降解眼用植入物,其中所述植入物在25:75乙醇/水混合物(v/v)中在37℃下在2天内体外释放约45%至约55%的所述阿西替尼,在4天内体外释放约70%至约80%的所述阿西替尼,且在6天内体外释放约80%至约90%的所述阿西替尼。
[0497]
103.如第84项至第102项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是通过制备含有水凝胶前体和阿西替尼的混合物,将所述混合物填充至管中,使所述水凝胶在所述管中胶化以提供成形为纤维的水凝胶,和拉伸所述水凝胶纤维而获得。
[0498]
104.如第103项的持续释放生物可降解眼用植入物,其中所述纤维在干燥前以约0.5至约5的因数进行湿式拉伸。
[0499]
105.如第104项的持续释放生物可降解眼用植入物,其中所述纤维在干燥前以约1
至约4的因数进行湿式拉伸。
[0500]
106.如第105项的持续释放生物可降解眼用植入物,其中所述纤维在干燥前以约1.5至约3.5的因数进行湿式拉伸。
[0501]
107.如第106项的持续释放生物可降解眼用植入物,其中所述纤维在干燥前以约1.7至约3的因数进行湿式拉伸。
[0502]
108.如第84项至第107项中任一项的持续释放生物可降解眼用植入物,其中所述植入物是在干燥状态下装载于针头中,以注射至玻璃体液中。
[0503]
109.如第108项的持续释放生物可降解眼用植入物,其中所述植入物是在干燥状态下装载于25号或27号针头。
[0504]
110.如第1项至第109项中任一项的持续释放生物可降解眼用植入物,其中所述水凝胶包含在干燥状态下在室温或低于室温时为半结晶而在湿润状态下为非晶的聚合物网络。
[0505]
111.如第1项至第110项中任一项的持续释放生物可降解眼用植入物,其中所述植入物在制造期间已进行湿式或干式拉伸,且其中呈经拉伸形式的所述植入物在室温或低于室温时在干燥状态下尺寸稳定。
[0506]
112.一种治疗有需要的患者的眼部疾病的方法,所述方法包括向所述患者施用根据前述诸项中任一项的包含水凝胶和酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其中在至少3个月的治疗时段内每眼施用一次的剂量为约150μg至约1200μg酪氨酸激酶抑制剂。
[0507]
113.如第112项的方法,其中所述酪氨酸激酶抑制剂为阿西替尼。
[0508]
114.如第112项或第113项的方法,其中在治疗时段内每眼施用一次的剂量在约200μg至约800μg的范围内。
[0509]
115.如第112项或第113项的方法,其中所述剂量在约160μg至约250μg或约180μg至约220μg的范围内。
[0510]
116.如第115项的方法,其中所述剂量为约200μg。
[0511]
117.如第112项或第113项的方法,其中所述剂量在约320μg至约500μg或约360μg至约440μg的范围内。
[0512]
118.如第117项的方法,其中所述剂量为约400μg。
[0513]
119.如第112项或第113项的方法,其中所述剂量在约480μg至约750μg或约540μg至约660μg的范围内。
[0514]
120.如第119项的方法,其中所述剂量为约600μg。
[0515]
121.如第112项或第113项的方法,其中所述剂量在约640μg至约1000μg或约720μg至约880μg的范围内。
[0516]
122.如第121项的方法,其中所述剂量为约800μg。
[0517]
123.如第112项至第122项中任一项的方法,其中所述眼部疾病涉及血管生成。
[0518]
124.如第112项至第123项中任一项的方法,其中所述眼部疾病是由一种或多种受体酪氨酸激酶(rtk),特定来说vegfr-1、vegfr-2、vegfr-3、pdgfr-α/β和/或c-kit介导的。
[0519]
125.如第112项至第124项中任一项的方法,其中所述眼部疾病为视网膜疾病,包括脉络膜新血管形成、糖尿病性视网膜病、糖尿病性黄斑水肿、视网膜静脉阻塞、急性黄斑
神经视网膜病、中心浆液性脉络膜视网膜病和囊状黄斑水肿;其中所述眼部疾病为急性多灶性斑状色素上皮病、behcet氏病、鸟枪弹样视网膜脉络膜病、传染性(梅毒病、莱姆病、结核病、弓形体病)、中性葡萄膜炎、多灶性脉络膜炎、多发性一过性白点综合征(mewds)、眼类肉瘤病、后巩膜炎、蛇形脉络膜炎、视网膜下纤维化、葡萄膜发炎候群或vogt-koyanagi-harada综合征;其中所述眼部疾病为血管疾病或渗出性疾病,包括coat氏病、窝旁毛细血管扩张症、乳头状静脉炎、结霜性支脉管炎、镰状细胞视网膜病和其他血红素病、血管样纹和家族性渗出性玻璃体视网膜病变;或其中所述眼部疾病是由外伤或手术引起,包括交感性眼炎、葡萄膜视网膜病、视网膜脱落、外伤、光动力激光治疗、光凝、手术过程中灌注不足、放射性视网膜病或骨髓移植性视网膜病。
[0520]
126.如第112项至第124项中任一项的方法,其中所述眼部疾病为新血管性年龄相关性黄斑退化、糖尿病性黄斑水肿或视网膜静脉阻塞。
[0521]
127.如第126项的方法,其中所述疾病为新血管性年龄相关性黄斑退化。
[0522]
128.如第112项至第127项中任一项的方法,其中所述治疗在中心子场厚度升高的患者中减轻、基本上维持或预防中心子场厚度临床上显著增加方面为有效的,所述中心子场厚度如通过光学相干断层扫描所测量。
[0523]
129.如第112项至第128项中任一项的方法,其中在治疗时段内每眼施用一次的剂量包含在一个植入物中或者在同时施用的两个、三个或更多个植入物中。
[0524]
130.如第112项至第129项中任一项的方法,其中所述植入物是通过注射至玻璃体液中来施用。
[0525]
131.如第112项至第130项中任一项的方法,其中所述治疗时段为至少约3个月、至少约4.5个月、至少约6个月、至少约9个月、至少约11个月、至少约12个月、至少约13个月或至少约14个月。
[0526]
132.如第131项的方法,其中所述治疗时段为至少6个月、至少约9个月或至少约12个月。
[0527]
133.如第112项至第132项中任一项的方法,其中与用所述持续释放眼用植入物治疗同时向所述患者施用抗vegf剂,或其中在施用所述植入物后约1、约2或约3个月内施用抗vegf剂。
[0528]
134.如第133项的方法,其中所述抗vegf剂选自由阿柏西普、贝伐珠单抗、哌加他尼、雷尼珠单抗和布洛珠单抗组成的组。
[0529]
135.如第134项的方法,其中所述抗vegf剂为贝伐珠单抗。
[0530]
136.如第133项至第135项中任一项的方法,其中所述抗vegf剂通过玻璃体内注射来施用。
[0531]
137.如第112项至第136项中任一项的方法,其中接受所述植入物的所述患者有抗vegf治疗史。
[0532]
138.如第112项至第136项中任一项的方法,其中接受所述植入物的所述患者无抗vegf治疗史(未进行过抗vegf)。
[0533]
139.一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用持续释放生物可降解眼用植入物,所述眼用植入物包含包括聚合物网络的水凝胶和约200μg酪氨酸激酶抑制剂,其中每眼一个植入物在至少9个月的治疗时段内施
用一次,且其中所述患者有抗vegf治疗史。
[0534]
140.一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用持续释放生物可降解眼用植入物,所述眼用植入物包含包括聚合物网络的水凝胶和约200μg酪氨酸激酶抑制剂,其中形成约400μg总剂量的每眼两个植入物在至少3个月的治疗时段内施用一次,且其中所述患者有或无抗vegf治疗史。
[0535]
141.如第139项或第140项的方法,其中所述治疗导致中心子场厚度(csft)减小,如在治疗时段期间通过光学相干断层扫描所测量。
[0536]
142.如第139项至第141项中任一项的方法,其中所述酪氨酸激酶抑制剂为阿西替尼且分散在所述水凝胶中,所述水凝胶包含由使4a20kpeg-saz与8a20kpeg-nh2反应而形成的聚合物网络,且其中所述植入物在施用前呈干燥状态。
[0537]
143.如第142项的方法,其中所述水凝胶在形成时和干燥前含有以聚乙二醇重量除以流体重量x100表示占约7.5%的聚乙二醇。
[0538]
144.如第140项至第143项中任一项的方法,其中所述治疗时段为至少9个月。
[0539]
145.一种治疗有需要的患者的新血管性年龄相关性黄斑退化的方法,所述方法包括向所述患者施用持续释放生物可降解眼用植入物,所述眼用植入物包含量在约480μg至约750μg范围内且分散在包括聚合物网络的水凝胶中的阿西替尼,其中所述植入物在至少3个月的治疗时段内施用一次。
[0540]
146.如第145项的方法,其中所述植入物中的所述阿西替尼的含量为约560μg至约660μg。
[0541]
147.如第146项的方法,其中所述植入物中的所述阿西替尼的含量为约600μg。
[0542]
148.如第145项至第147项中任一项的方法,其中所述植入物如第84项至第111项中所定义。
[0543]
149.如第145项至第148项中任一项的方法,其中所述植入物是施用玻璃体液中。
[0544]
150.如第145项至第149项中任一项的方法,其中所述治疗时段为至少约3个月、至少约6个月、至少约9个月、至少约11个月、至少约12个月、至少约13个月或至少约14个月。
[0545]
151.如第145项至第150项中任一项的方法,其中所述植入物是用25或27号针头通过注射施用玻璃体液中。
[0546]
152.如第145项至第151项中任一项的方法,其中接受所述植入物的所述患者有抗vegf治疗史或无抗vegf治疗史(未进行过抗vegf)。
[0547]
153.如第145项至第152项中任一项的方法,其中与所述植入物同时向所述患者施用抗vegf剂。
[0548]
154.如第153项的方法,其中所述抗vegf剂选自由阿柏西普、贝伐珠单抗、哌加他尼、雷尼珠单抗和布洛珠单抗组成的组。
[0549]
155.如第154项的方法,其中所述抗vegf剂为贝伐珠单抗。
[0550]
156.如第153项至第155项中任一项的方法,其中所述抗vegf剂通过玻璃体内注射来施用。
[0551]
157.如第112项至第156项中任一项的方法,其中在施用所述持续释放生物可降解眼用植入物期间,不良事件数目较低。
[0552]
158.如第157项的方法,其中在施用所述持续释放生物可降解眼用植入物期间,治
疗相关的眼部不良事件数目较低。
[0553]
159.一种制造根据第1项至第111项中任一项的包含水凝胶和约150μg至约1200μg酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物的方法,所述方法包括以下步骤:形成水凝胶,所述水凝胶包含聚合物网络和分散在所述水凝胶中的酪氨酸激酶抑制剂粒子;使所述水凝胶成形;和干燥所述水凝胶。
[0554]
160.如第159项的方法,其中所述酪氨酸激酶抑制剂为阿西替尼。
[0555]
161.如第159项或第160项的方法,其中所述酪氨酸激酶抑制剂粒子经微粉化和/或均质分散在所述水凝胶内。
[0556]
162.如第159项至第161项中任一项的方法,其中所述聚合物网络是通过在缓冲溶液中使多臂聚乙二醇单元交联而形成。
[0557]
163.如第159项至第162项中任一项的方法,其中所述水凝胶包含通过在所述酪氨酸激酶抑制剂存在下使含亲电子基团的多臂聚乙二醇与含亲核基团的多臂聚乙二醇在缓冲溶液中混合并反应且允许所述混合物胶化而形成的聚合物网络。
[0558]
164.如第163项的方法,其包括使4a20kpeg-saz与8a20kpeg-nh2以约2:1的重量比反应。
[0559]
165.如第163项或第164项的方法,其中所述方法包括以下步骤:将所述混合物填充至模具或管中,随后完全胶化以提供所述水凝胶的所要最终形状;使所述混合物胶化;和干燥所述水凝胶。
[0560]
166.如第165项的方法,其中所述混合物填充至细直径管中以制备水凝胶纤维。
[0561]
167.如第166项的方法,其中所述管的内部具有圆形几何形状。
[0562]
168.如第166项的方法,其中所述管的内部具有非圆形几何形状。
[0563]
169.如第168项的方法,其中所述管的内部具有十字形几何形状。
[0564]
170.如第166项至第169项中任一项的方法,其中所述方法还包括拉伸所述纤维和/或扭绞所述纤维。
[0565]
171.如第170项的方法,其中所述拉伸是在干燥所述水凝胶之前或之后进行。
[0566]
172.如第171项的方法,其中所述纤维以约1至约4.5的拉伸因数拉伸。
[0567]
173.如第171项的方法,其中所述植入物含有约200μg的量的阿西替尼,且所述拉伸在干燥所述水凝胶之后以约2至约5的拉伸因数或约3至约4.5的拉伸因数进行。
[0568]
174.如第171项的方法,其中所述植入物含有约600μg的量的阿西替尼,且所述拉伸在干燥所述水凝胶之前在湿润状态下以约0.5至约5的拉伸因数或约1至约4的拉伸因数或约1.3至约3.5的拉伸因数或约1.7至约3的拉伸因数进行。
[0569]
175.如第159项至第174项中任一项的方法,其中所述方法还包括将呈干燥状态的所述植入物装载至针头中。
[0570]
176.如第175项的方法,其中所述针头为25或27号针头。
[0571]
177.一种通过在纵向方向上拉伸水凝胶纤维来赋予所述水凝胶纤维以形状记忆的方法,所述水凝胶纤维包含分散在所述水凝胶中的活性剂。
[0572]
178.一种制造包含水凝胶的眼用植入物的方法,所述水凝胶包含分散于其中的活性剂,其中所述植入物在施用眼后改变其尺寸,所述方法包括制备所述水凝胶的纤维并且在纵向方向上拉伸所述纤维。
[0573]
179.如第177项或第178项的方法,其中所述方法包括干燥所述水凝胶的步骤,其中所述纤维在所述干燥之前或之后在纵向方向上拉伸(湿式或干式拉伸)。
[0574]
180.如第177项至第179项中任一项的方法,其中所述纤维以约0.5至约5的因数、或约1至约4.5的因数、或约3至约4.5的因数或约1至约2的因数拉伸。
[0575]
181.如第177项至第180项中任一项的方法,其中所述活性剂为酪氨酸激酶抑制剂,诸如阿西替尼。
[0576]
182.如第177项至第181项中任一项的方法,其中所述水凝胶包含包括交联聚乙二醇单元的聚合物网络。
[0577]
183.如第177项至第182项中任一项的方法,其中所述纤维在水合后完全或部分恢复至大约其在拉伸之前具有的其原始长度和/或原始直径。
[0578]
184.如第177项至第183项中任一项的方法,其中所述尺寸变化为直径增大或直径增大连同长度减小。
[0579]
185.一种药盒,其包括一个或多个根据第1项至第111项中任一项或根据第159项至第176项中任一项的方法制造的持续释放生物可降解眼用植入物和一个或多个针头,其中所述一个或多个针头各自预先装载有一个呈干燥状态的持续释放生物可降解眼用植入物。
[0580]
186.如第185项的药盒,其中所述一个或多个针头为25或27号针头。
[0581]
187.如第185项或第186项的药盒,其中所述药盒包括一个或多个25或27号针头,所述一个或多个针头各自装载有含有在约180μg至约220μg范围内的量的阿西替尼的植入物。
[0582]
188.如第187项的药盒,其中所述植入物含有约200μg的量的阿西替尼。
[0583]
189.如第185项或第186项的药盒,其中所述药盒包含一个25号或27号针头,所述针头负载有含有在约540μg至约660μg范围内的量的阿西替尼的植入物。
[0584]
190.如第189项的药盒,其中所述植入物含有约600μg的量的阿西替尼。
[0585]
191.如第185项至第190项中任一项的药盒,其进一步含有用于将所述植入物注射至患者眼中的注射装置。
[0586]
192.如第191项的药盒,其中所述注射装置与装载有植入物的一个或多个针头分开提供于所述药盒中。
[0587]
193.如第191项的药盒,其中所述注射装置是预先连接至负载有植入物的针头。
[0588]
194.如第191项或第192项的药盒,其中所述注射装置含有推丝,以便将所述植入物自所述针头部署至眼中。
[0589]
195.如第185项至第194项中任一项的药盒,其还包括一个剂量的抗vegf剂以供注射。
[0590]
196.一种注射装置,其适用于将根据第1项至第111项的持续释放生物可降解眼用植入物注射至眼中。
[0591]
197.如第196项的注射装置,其含有用于连接所述注射装置与针头的构件。
[0592]
198.如第196项或第197项的注射装置,其中所述针头预先装载有所述植入物。
[0593]
199.如第196项至第198项中任一项的注射装置,其含有当所述注射装置已连接至所述针头时将所述植入物自所述针头部署至眼中的推丝。
[0594]
200.如第199项的注射装置,其中所述推丝由nitinol或不锈钢/teflon制成。
[0595]
201.如第199项或第200项的注射装置,其是通过将所述线固定至柱塞并将其封装在两个锁扣配合型注入器主体部分之间并且用夹子固定所述柱塞而获得。
[0596]
202.一种药物产品,其包含装载于针头中的如第1项至第111项中任一项的持续释放生物可降解眼用植入物和根据第196项至第201项中任一项的注射装置,其中所述针头预先连接至所述注射装置。
[0597]
203.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其用于根据第112项至第138项中的任一项治疗有需要的患者的眼部疾病或用于根据第139项至第158项、第210项或第211项中的任一项治疗有需要的患者的新血管性年龄相关性黄斑退化。
[0598]
204.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物用于制备用以根据第112项至第138项中的任一项治疗有需要的患者的眼部疾病或用以根据第139项至第158项、第210项或第211项中的任一项治疗有需要的患者的新血管性年龄相关性黄斑退化的药物的用途。
[0599]
205.一种在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中降低、基本上维持中心子场厚度或预防中心子场厚度临床显著的增加(如通过光学相干断层扫描所测量)的方法,所述方法包括向所述患者施用根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物。
[0600]
206.如第205项的方法,其中所述眼部疾病为新血管性年龄相关性黄斑退化。
[0601]
207.如第205项或第206项的方法,其中相对于施用所述植入物之前在所述患者中测量的基线中心子场厚度,在施用所述植入物之后至少约3个月、至少约6个月、至少约9个月、至少约11个月、至少约12个月、至少约13个月或至少约14个月的时段期间在患者中降低、基本上维持中心子场厚度或预防中心子场厚度临床上显著增加。
[0602]
208.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其根据第205项至第207项、第210项或第211项中的任一项在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中降低、基本上维持中心子场厚度或预防中心子场厚度临床显著的增加(如通过光学相干断层扫描所测量)。
[0603]
209.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物用于制备用以根据第205项至第207项、第210项或第211项中的任一项在中心子场厚度由于涉及血管生成的眼部疾病而升高的患者中降低、基本上维持中心子场厚度或预防中心子场厚度临床显著的增加(如通过光学相干断层扫描所测量)的药物的用途。
[0604]
210.如第128项至第158项中任一项或如第205项至第207项中任一项的方法,其中由最佳矫正视敏度表示的所述患者的视力未削弱或有所改良。
[0605]
211.如第128项至第158项中任一项、第205项至第207项中任一项或第210项的方法,其中在所述治疗时段期间不需要施用救援药物,或其中在所述治疗时段期间仅需要偶尔施用救援药物,诸如1、2或3次。
[0606]
212.如第211项的方法,其中所述治疗时段的持续时间为施用所述持续释放生物可降解眼用植入物之后约6至约9个月。
[0607]
213.一种改良视力由于涉及血管生成的眼部疾病而削弱的患者的视力的方法,所
述方法包括向所述患者施用如第1项至第111项中任一项的包含酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物。
[0608]
214.如第213项的方法,其中所述眼部疾病为新血管性年龄相关性黄斑退化、糖尿病性黄斑水肿或视网膜静脉阻塞。
[0609]
215.如第213项或第214项的方法,其中所述患者的视力由于存在视网膜液而受损。
[0610]
216.如第213项至第215项中任一项的方法,其中视力改良由最佳矫正视敏度增加来体现。
[0611]
217.如第216项的方法,其中所述最佳矫正视敏度增加至少10、至少15或至少20个etdrs字母。
[0612]
218.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物,其用于根据如第213项至第217项中任一项的方法改良视力由于涉及血管生成的眼部疾病而削弱的患者的视力。
[0613]
219.根据第1项至第111项中任一项的含有酪氨酸激酶抑制剂的持续释放生物可降解眼用植入物用于制备用以根据第213项至第217项中任一项的方法改良视力由于涉及血管生成的眼部疾病而削弱的患者的视力的药物的用途。
[0614]
项目的第二清单
[0615]
1.一种持续释放生物可降解眼用水凝胶植入物,其包含酪氨酸激酶抑制剂、聚合物网络和清除区,其中所述清除区在tki释放前不含tki。
[0616]
2.如第1项的眼用水凝胶,其中当所述tki包含在所述水凝胶植入物内部时,所述tki不与视网膜细胞接触。
[0617]
3.如第1项或第2项的眼用水凝胶,其中所述tki以或接近其饱和水平存在于所述水凝胶植入物中。
[0618]
4.如第1项至第3项中任一项的眼用水凝胶植入物,其中所述清除区的大小随tki释放量而增大。
[0619]
5.如第1项至第4项中任一项的眼用水凝胶植入物,其中所述眼用水凝胶植入物在释放所述tki后或在释放至少90%的所述tki后完全降解。
[0620]
6.如第1项至第5项中任一项的眼用水凝胶植入物,其中所述眼用水凝胶植入物在完全释放所述tki后约30天之后或约3个月之后完全降解。
[0621]
7.如第1项至第4项中任一项的眼用水凝胶植入物,其中所述眼用水凝胶的降解发生在释放所述tki之前。
[0622]
8.如第1项至第7项中任一项的眼用水凝胶植入物,其中所述聚合物网络包含多个聚乙二醇(peg)单元。
[0623]
9.如第1项至第8项中任一项的眼用水凝胶植入物,其中所述聚合物网络包含多个多臂peg单元。
[0624]
10.如第1项至第9项中任一项的眼用水凝胶植入物,其中所述聚合物网络包含多个4臂或8臂peg单元。
[0625]
11.如第1项至第9项中任一项的眼用水凝胶植入物,其中所述聚合物网络包含多个具有下式的peg单元:
[0626][0627]
其中n表示环氧乙烷重复单元且波状线表示所述聚合物网络的重复单元的点。
[0628]
12.如第1项至第11项中任一项的眼用水凝胶植入物,其中所述聚合物网络是通过使选自4a20k peg-saz、4a20k peg-sap、4a20k peg-sg、4a20k peg-ss、8a20k peg-saz、8a20k peg-sap、8a20k peg-sg和8a20k peg-ss的多个聚乙二醇(peg)单元与选自4a20k peg-nh2、8a20k peg-nh2和三赖氨酸的一个或多个基于peg或赖氨酸的胺基或其盐反应而形成。
[0629]
13.如第1项至第12项中任一项的眼用水凝胶植入物,其中所述聚合物网络是通过使4a20k peg-saz与8a20k peg-nh2反应而形成。
[0630]
14.如第1项至第13项中任一项的眼用水凝胶植入物,其中所述聚合物网络为非晶的(在水性条件下)。
[0631]
15.如第1项至第14项中任一项的眼用水凝胶植入物,其中所述聚合物网络在不存在水时为半结晶的。
[0632]
16.如第1项至第15项中任一项的眼用水凝胶植入物,其中所述酪氨酸激酶抑制剂均质分散在所述聚合物网络内。
[0633]
17.如第1项至第16项中任一项的眼用水凝胶植入物,其中所述酪氨酸激酶抑制剂在至少15天的时段内释放。
[0634]
18.如第1项至第17项中任一项的眼用水凝胶植入物,其中所述酪氨酸激酶抑制剂在至少30天的时段内释放。
[0635]
19.如第1项至第18项中任一项的眼用水凝胶植入物,其中所述酪氨酸激酶抑制剂
harada综合征、coat氏病、窝旁毛细血管扩张症、乳头状静脉炎、结霜性支脉管炎、镰状细胞视网膜病、血管样纹、家族性渗出性玻璃体视网膜病变、交感性眼炎、葡萄膜视网膜病、视网膜脱落、增殖性糖尿病性视网膜病、眼组织胞浆菌病、眼弓蛔虫病、病毒性视网膜炎、急性视网膜坏死、眼梅毒病、眼结核病、先天性静止性夜盲、锥形体营养不良、视网膜脱落、黄斑裂孔、巨大视网膜撕裂、实体肿瘤、后部葡萄膜黑色素瘤、脉络膜血管瘤、脉络膜骨瘤、脉络膜转移、视网膜母细胞瘤、眼底血管增生性肿瘤、视网膜星形细胞瘤和眼内淋巴瘤。
[0647]
31.如第29项或第30项的方法,其中所述疾患为年龄相关性黄斑退化。
[0648]
32.如第29项至第31项中任一项的方法,其中所述受试者先前用抗vegf疗法治疗。
[0649]
实施例
[0650]
包括以下实施例以说明如申请专利范围中所描述的本发明的某些方面和实施方案。然而,本领域技术人员应了解,以下描述仅为说明性的,而绝不应被视为以任一方式限制本发明。
[0651]
实施例1:阿西替尼植入物的制备
[0652]
本技术的阿西替尼植入物(基本上)为圆柱形的(且在本文中也称为“纤维”),其中阿西替尼均质分散并包埋在基于peg的水凝胶基质内,以基于其在眼玻璃体液中的低水溶解度而持续释放阿西替尼。
[0653]
通过使2份4a20k peg-saz(具有4个含n-羟基琥珀酰亚胺基反应性端基,有时也称为“nhs”端基的臂的20kda peg)与1份8a20k peg nh2(具有8个含胺端基的臂的20kda peg)反应来形成植入物的聚合物网络。因此,将聚胺基甲酸酯管切成适当长度片段。此后,制备8a20k peg nh2磷酸氢二钠溶液,并且经0.2μm(过滤器的孔隙大小)无菌过滤以移除内毒素以及其他粒子。随后称取所要体积的peg胺溶液至注射器中。接下来,将视植入物中的所要最终阿西替尼剂量来称取相应量的固体阿西替尼至另一注射器中。将粉状阿西替尼注射器和peg胺注射器小心地混合以悬浮并分散粒子。随后对包括悬浮液混合物的注射器进行音波处理以破碎任何粉末聚集物。此后,制备4a20k peg saz磷酸二氢钠溶液,并且如针对peg胺溶液所描述进行无菌过滤。随后称取所要体积的peg saz溶液至另一注射器中。在下一步骤中,将两个注射器的成分(4a20k peg saz磷酸二氢钠溶液和阿西替尼-8a20k peg nh2混合物)混合以引发反应,从而引起胶化。经由所制备的聚胺基甲酸酯管浇注液体悬浮液,随后材料交联并固化。通过进行凝胶轻敲试验来确认胶化时间。随后将包含凝胶的管置入高湿度固化腔室中2小时,以防止水凝胶在水凝胶胶化之前过早干燥。在腔室内,使管中的水凝胶阿西替尼悬浮液交联至完全,从而产生高度反应且均匀的凝胶,从而形成水凝胶股绳。
[0654]
固化之后,如本文中所公开进行不同的植入物拉伸方法。如以下所概述,对植入物进行干式拉伸或湿式拉伸。对于干式拉伸,在固化之后将股绳切成较短区段,并且将股绳干燥48至96小时。干燥之后,自管中移出经干燥的股绳区段并置于定制拉伸器的夹钳中。随后以受控速率缓慢干式拉伸股绳直至达到适合小号针头的所要直径(约2至约5或约3至约4.5的拉伸因数)。在无氧气和水分的环境中进行拉伸步骤以保护产物。对于湿式拉伸,将股绳置于定制拉伸器的夹钳上。随后以受控速率缓慢湿式拉伸股绳直至达到适合小号针头的所要直径(约1至约3或约1.3至约2.6的拉伸因数)。拉伸之后,在如针对干式拉伸工艺所描述的条件下在张力下干燥股绳。
[0655]
拉伸产生形状记忆,意谓当施用眼玻璃体腔中时,植入物在水合后将快速缩短长
度并加宽直径,直至其达到其原始湿式浇注尺寸。尽管狭窄干燥尺寸有利于经由较小号针头施用产品,但施用之后直径加宽且长度缩短可在后房中产生相对于眼直径而言较短的植入物(在某些实施方案中,长度不超过约10mm),从而减少与周围眼组织的潜在接触。一般而言,水合后的收缩程度尤其取决于拉伸因数。举例来说,以约1.3的拉伸因数拉伸(湿式拉伸)将具有不太明显的效果,或在水合期间基本上不会改变长度。相比之下,以例如约1.8的拉伸因数拉伸(湿式拉伸)将导致水合期间长度明显缩短。以例如约4的拉伸因数拉伸(干式拉伸)可导致水合后长度短得多(例如,长度自约15mm减至约8mm)。
[0656]
自拉伸器移出经拉伸的水凝胶股绳,随后切至所要最终长度。随后将植入物纤维置于检查站上。若植入物通过质量控制,则使用定制的真空装置将其装载至25或27号针头(例如,内径为约0.4mm的fda批准的25g utw1/2”或25g utw 1”或27g tw 1.25”针头)中,并安全盖好,以避免任何针尖损坏。
[0657]
将装载的针头置于手套箱中6至9天以移出任何水分(意图植入物中的剩余水含量不超过1%水)。自那时起,在手套箱中进行所有步骤。将装载的针头浸入熔融低分子量1k peg中以尖端覆盖针头。冷却后,保留一小滴硬化peg可提供光滑性,保持植入物在针头内的适当位置,允许成功部署,并防止针头内的植入物在施用期间过早再水合。此外,peg尖端覆盖减少组织损伤,即组织取芯,即在针头穿过组织时通过其移出组织碎片的过程。随后再次检查peg尖端覆盖的针头,丢弃不满足质量要求的针头。再次盖好合格的针头,以确保针头不遭受任何其他损坏。随后将针头单独囊封并密封,以防止其受潮并保持其无菌。注射装置(例如改进hamilton玻璃注射器)具有允许更容易自针头部署植入物的推丝(例如nitinol推丝)。注射针头可含有控制注射深度的终止特征件。可用与针对针头所描述相同的方式将注射装置分开包装,并且在氮气下密封于箔袋中(图1),或可与装载植入物的针头预先组装在一起或预先组装在预先装载型注入器内。自手套箱中移出包装的针头和注射装置并冷藏储存(2-8℃),随后使用γ辐照灭菌。灭菌之后,包装在使用前冷藏(2-8℃)或冷冻避光储存,并在注射前平衡30分钟至室温。
[0658]
经由玻璃体内注射施用植入物,其中植入物定位于眼后段(图2)。注射之后,植入物原位水合。与玻璃体接触后水合后,植入物软化并在直径方面增大,且也可在长度方面收缩。通过将阿西替尼截留至水凝胶中,可提供阿西替尼在眼中的确定和有限的定位。植入物的水凝胶基质经调配以便在玻璃体的水性环境中经由酯水解而生物降解。阿西替尼由于所述药物在生理条件下的低溶解度而通过扩散至玻璃体中随后扩散至周围眼组织,从而自水凝胶释放持久时段(图3)。药物自植入物的释放速率尤其受扩散、药物清除率、玻璃体粘度、植入物内和附近的浓度梯度、植入物剂量、植入物表面积和几何形状以及植入物数目和其在玻璃体内的定位影响。
[0659]
实施例2:体外阿西替尼释放
[0660]
在下一步中,通过体外测试来测定不同配方的植入物的阿西替尼释放速率。可另外使用体外分析对植入物进行质量控制。
[0661]
在非漏槽模拟生理条件下的体外阿西替尼释放
[0662]
在一个体外分析设置中,在非漏槽模拟生理条件下以与人眼中玻璃体液的体积相当的每日置换体积评估阿西替尼释放。
[0663]
检查三种例示性选择的植入物配方(表1)。使用一个植入物检查第1号和第2号植
入物变体,使用一个和两个植入物检查第3号植入物变体(共四个条件)。以一式两份进行所有条件。
[0664]
表1三个例示性选择的阿西替尼植入物的配方、配置和干燥尺寸。配方百分比表示重量/重量(w/w)。
[0665][0666]
在进行体外释放分析前,使用乙醇作为萃取溶剂,通过液相层析联合基于片段化的质谱法(lc-ms/ms)检查植入物的起始药物含量(表2;关于植入物溶解和lc-ms/ms的细节,参见实施例3.5)。所测定的阿西替尼量与调配量良好匹配。
[0667]
表2如通过lc-ms/ms所测定的植入物中起始阿西替尼含量。
[0668]
[0669][0670]
在无(对照组)和有每天释放介质取样的情况下测定各组的体外释放和未释放的阿西替尼。
[0671]
对于对照植入物释放,将样品置放于管中。在第0天,向各管添加5ml pbs(ph 7.2),并用盖覆盖各管。随后将样品置放在37℃培育箱中并轻轻摇晃20天(1x第3号植入物)或30天(第1号和第2号植入物、2x第3号植入物)。在测试时段结束时,移除pbs(保存1ml pbs以供测试)。向残余样品中添加1ml乙醇。测试pbs样品和残余样品的阿西替尼释放量。
[0672]
对于每日植入物释放,将样品置放于管中。在第0天向各管添加5ml pbs,并用盖覆盖诸管。随后将样品置放在37℃培育箱中并轻轻摇晃。24小时之后,自各样品移出4ml pbs,使用其中1ml进行测试并处置剩余3ml。将4ml新鲜pbs添加回各管中。重复此过程20天(1x第3号植入物)或30天(第1号和第2号植入物、2x第3号植入物)。在研究最后一天,使用1ml pbs测试各样品并处置剩余4ml。向剩余残余植入物添加1ml乙醇,并测试总剩余阿西替尼。
[0673]
来自20或30天之后对照植入物释放测量的pbs中阿西替尼浓度分别表示在释放介质中长时间培育之后的阿西替尼最大溶解度测定(表3)。剂量强度越高,释放介质中的阿西替尼浓度越高。表观最大阿西替尼溶解度在0.24至0.40μg/ml的范围内,与文献中针对[nda 202324]所报道的结果一致。
[0674]
表3控制释放资料。阿西替尼量和浓度呈现为平均值和标准偏差(sd)。
[0675][0676][0677]
测试结果显示与较低剂量组相比,两个高剂量样品(第1号和第2号植入物)每天释放更多阿西替尼(表4)。研究持续时间内每天释放的阿西替尼的量呈现于图4a中。与无pbs交换(对照组)相比,每天移出并置换pbs的群组中的总阿西替尼释放量更高。与第3号植入物的两个植入物相比,第1号和第2号植入物每天释放更多阿西替尼。在两个高剂量组中,总阿西替尼释放平均值稍有不同,但中值每日释放量相当,表明两个较高剂量组之间无明显差异。
[0678]
表4.每日取样资料。阿西替尼量呈现为平均值和标准偏差(sd)。
[0679][0680]
研究结果显示,与一个或两个较低剂量总强度相比,单次施用含有大约0.6至0.7mg阿西替尼的植入物在模拟生理条件下在非漏槽条件下每天向代表眼玻璃体液体积的体积的溶液中释放更多阿西替尼。在这些条件下,两个植入物(各自含有大约0.2mg)未释放与单一较高剂量植入物同样多的阿西替尼。这些体外结果指示,与较低总剂量的两个植入物相比,较高剂量的单一植入物在眼的非漏槽条件下每天可在眼中释放更多阿西替尼。
[0681]
在即时漏槽模拟生理条件下的体外阿西替尼释放
[0682]
在另一体外设置中,在即时漏槽模拟生理条件下评估阿西替尼释放。
[0683]
因此,将植入物置放在5ml生理学相关介质中,即,含0.01% naf的ph 7.2pbs,溶液顶部有1-辛醇层以提供渗漏相,从而允许阿西替尼转移至辛醇层中。在37℃空气室中在轻微搅拌下培育植入物。在预定取样时间点在辛醇层中通过获取333nm处的uv吸光度来测量阿西替尼。相对于由阿西替尼参考物制备的标准曲线确定各时间点释放的阿西替尼的量。加速体外释放概况确定为阿西替尼累积释放百分比。完成药物释放的持续时间为数月。
[0684]
关于即时漏槽条件下的例示性释放概况,参考图14a。
[0685]
在加速条件下的体外阿西替尼释放
[0686]
在另一体外设置中,在加速条件下评估阿西替尼释放。
[0687]
因此,在37℃空气室中随轻微搅拌将植入物置放于乙醇与水混合物(25:75比率,v/v)中以增加阿西替尼溶解度。阿西替尼在纯乙醇中的溶解度为1.4mg/ml,且在25%乙醇/75%水混合物(v/v;生理学不相关介质)中为大约19μg/ml。在预定取样时间点,移出等分试样并通过获取332nm处的uv来分析阿西替尼。相对于由阿西替尼参考物制备的标准曲线确定各时间点释放的阿西替尼的量。加速体外释放概况确定为阿西替尼累积释放百分比。加速条件下的释放持续时间为大约两周。
[0688]
关于加速条件下的例示性释放概况,参考图14b(200μg植入物)和图4b(556μg植入物)。
[0689]
实施例3:在兔中评估阿西替尼植入物
[0690]
为了评估阿西替尼植入物的安全性、耐受性、药物释放以及效力,在荷兰黑带兔(dutch belted rabbit)中进行若干临床前研究。检查通过一个或多个植入物递送的一系列剂量。所进行的不同的兔研究的概述呈现于表5中。在米格鲁犬(beagle dog)和非洲绿猴中进行进一步研究。
[0691]
表5在兔中用阿西替尼植入物进行的临床前研究的概述。
[0692][0693][0694]
表6提供动物研究中所使用的植入物的配方、配置和尺寸的例示性概述(参见实施例3.2至6)。在生物相关介质(pbs,ph 7.2,37℃)中24小时之后检查水合植入物的尺寸。尽管第5号植入物的长度稍有增加,但水合的长度仍小于10mm。
[0695]
表6动物研究中所使用的不同植入物(第1号至第5号)的配方、配置和尺寸。举例来说,第4号植入物用于非洲绿猴研究(参见实施例5)。配方百分比表示重量/重量(w/w)。
[0696]
[0697][0698]
植入物施用前,利用肌肉内注射盐酸克他明(20mg/kg)和甲苯噻嗪(5mg/kg)将动物麻醉。用5% betadine溶液清洁眼睛和周围区域,并用平衡盐溶液冲洗。施加一至两滴局部盐酸丙美卡因(proparacaine hydrochloride)麻醉剂(0.5%)。遮住眼睛并置放无菌丝窥器以缩回眼睑。将注射针头置放在距眼缘约3至5mm处并在单冲程中部署。
[0699]
总之,阿西替尼植入物显示良好安全性概况,良好耐受且高度有效,而与剂量或递送方式(通过一个或多个植入物)无关。此外,药物在靶组织中有效释放,而血液中的全身浓度保持极低或不可侦测。
[0700]
实施例3.1:阿西替尼植入物的初级低剂量筛检
[0701]
对于含阿西替尼的植入物的主要安全性、耐受性和效力研究,在兔(包括接受生理盐水的对照动物)中使用30g 0.5”针头将15μg阿西替尼/植入物的低剂量经由玻璃体内注射以双侧每眼一个(第1组,n=5)、两个(第2组,n=5)或三个植入物(第3组,n=5)的形式施用。此研究中所使用的植入物在干燥状态下直径为0.15
±
0.13mm且长度为6.9
±
0.1mm。在生物相关介质(pbs,ph 7.2,37℃)中水合24小时之后,直径为0.42
±
0.02mm且长度为10.6
±
0.4mm。
[0702]
在1个月的时间内,记录一般健康状况、体重和眼内压(iop)。根据改进版mcdonald-shadduck评分系统(mcdonald,t.o.和shadduck,j.a.“eye irritation”.advances in mondern toxicology,iv:dermatotoxicology and pharmacology,1977),在基线时和1个月时对临床眼科检查进行评分。在1个月时收集红外反射(ir)成像,以获取玻璃体中的一个、两个和三个植入物的代表性图像。使用lc-ms/ms,基本上如实施例3.5下所描述来检查阿西替尼的眼部分布。为了评估植入物的效力,基本上如实施例3.2下所描述,通过反复玻璃体内注射vegf来攻击有和无植入物的兔,以诱导视网膜血管渗漏。
[0703]
所有组中皆未观测到对体重无显著影响。此外,iop值正常且在所有组之间相当。眼部健康未受影响或仅受轻度影响,指示总体安全性和耐受性。一个月时的临床眼科检查显示对施用单一植入物的任何动物皆无眼部发现。在施用两个或三个植入物的动物的一只眼中观测到轻度角膜混浊。在施用三个植入物的动物的两只眼睛中观测到轻度和中度结膜排出物。
[0704]
ir成像显示与施用的数目无关,植入物的总体形状保持完整(图5a)。
[0705]
各组在1个月时的眼组织中阿西替尼浓度的药物动力学结果呈现于表7中。由于第2组中的视网膜组织样品中的一只眼睛和第3组中脉络膜/rpe(视网膜色素上皮)样品中的一只眼睛可能包括植入物的一部分,由于优先溶解在lc-ms/ms分析前所采用的萃取有机溶剂体系中而在那两个组织样品中错误地产生高浓度,因此将两只眼睛排除在分析之外(参见实施例3.5)。阿西替尼在37℃的ph 7.2pbs中的溶解度测定为约0.5μg/ml,且明显高于此值的任何组织值皆可能指示组织积聚或样品污染。与其他眼组织相比,ah中阿西替尼浓度较低或不存在,指示阿西替尼极少自后房向前房迁移。眼分布结果显示,单一植入物剂量(第1组)似乎在1个月时几乎完全耗尽,vh中仅剩余0.3μg。在第一个月内自30μg引发剂量(两个植入物,第2组)释放25.5μg,每日释放速率为大约0.8μg/天。在第一个月内自45μg引发剂量(三个植入物,第3组)释放33.8μg,每日释放速率为大约1.1μg/天。视网膜中的中值阿西替尼含量对于第1组为31ng/g,对于第2组为65ng/g,对于第3组为148ng/g,显示剂量依赖性释放至视网膜组织中。此研究中未达成饱和。
[0706]
表7自1、2和3个具有15μg/植入物的阿西替尼剂量的植入物(分别为第1组、第2组和第3组)释放的阿西替尼的眼组织分布。1个月之后,将ah、视网膜和脉络膜/rpe中的阿西替尼浓度以及植入物中的剩余阿西替尼(自vh回收)呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。
[0707][0708]
应注意,与无植入物的对照动物(n=3)相比,所有三个剂量在一个月时的vegf攻击之后皆显示对血管渗漏的抑制,指示即使最低剂量(15μg),即使在1个月的短时间之后也展现良好效力(图5b)。
[0709]
总之,在初级低剂量研究中,成功地验证以每眼一个、两个或三个植入物形式施用的tki植入物的安全性、耐受性以及阿西替尼释放和效力。
[0710]
实施例3.2:利用一个阿西替尼植入物的耐受性、安全性和效力研究
[0711]
为了研究每眼一个具有较高阿西替尼剂量的植入物的耐受性、安全性和效力,经
由玻璃体内注射用25g超薄壁针头对兔双侧施用每眼一个具有227μg阿西替尼剂量的植入物。关于植入物尺寸,参考表6(第3号植入物类型)。
[0712]
耐受性和安全性
[0713]
关于耐受性和安全性研究,在6个月内监测9只动物的一般健康状况(每日)、体重(0、1、3、6个月)以及iop和眼科检查(各间隔0.5个月)。根据改进版mcdonald-shadduck评分系统,对临床眼科检查进行评分。分别在1、3和6个月时进行视网膜电描记术(erg)和荧光素血管摄影术(fa),以评估视网膜功能并评估眼血管系统。每月进行光学相干断层扫描(oct),以获得视网膜的横截面图像。每月进行ir成像,以监测植入物在所述时间内的生物降解以及阿西替尼在玻璃体中的持久性。
[0714]
处死后(在1、3和6个月时的3只动物),准备将整眼用于组织病理学分析。因此,在12点钟位置置放缝合线以进行定向和收集。通常,在12点钟至6点钟的平面中沿中线通过晶状体和视神经将眼睛修剪成两半。此举可在一个平面中捕获尽可能多的光结构。全面检查经修剪的眼并指出异常。制备苏木精和伊红(h&e)染色的载玻片,相隔1mm。各载玻片含有2个连续切片。各时间点的组织病理学评定包括注射区域周围的玻璃体、视网膜、巩膜或巩膜外发炎、视网膜破坏和纤维化。对于任何异常,以0-5的半定量标度进行评分,其中0表示无变化(正常),1表示偶见变化灶(最低程度),2表示轻度弥漫性变化或更明显病灶变化,3表示中度弥漫性变化,4表示明显弥漫性变化,且5表示重度弥漫性变化。
[0715]
未观测到对日常健康或体重有显著影响。在整个研究持续时间内,iop正常。基于视网膜电描记术(erg)测量,未发现来自植入物的显著影响。荧光素血管摄影术(fa)和oct成像显示所述研究期间无病变。举例来说,正常视网膜形态保持6个月以上(图6)。另外,眼科检查发现为正常或轻度。第4周和第8周时的ir成像显示完整植入物,而第12周时的图像显示水凝胶降解的早期阶段(图7a)。第16周时的图像显示植入物由于水凝胶结构丧失而变窄。最后,第20周和第26周时的图像显示不存在水凝胶,而未溶解的阿西替尼粒子保留在先前植入部位附近并形成单一整体结构。然而,保留在植入部位的任何未溶解的阿西替尼显示以足以抑制血管渗漏的程度继续释放阿西替尼(如例如vegf攻击研究中截至21个月所显示,参见实施例3.4)。另外,在未溶解的阿西替尼粒子区域中未观测到发炎(图7b)。
[0716]
组织病理学切片中阿西替尼的量随时间减少指示注射物质的生物再吸收。在研究持续时间内,切片中未观测到宏观病变。平均组织病理学结果与标准偏差呈现于表8中。平均发炎评分显示,在研究持续时间内,视网膜、巩膜或巩膜外、玻璃体腔和慢性角膜下(角膜边缘的淋巴细胞和吞噬细胞)发炎评分为正常至最低程度。在研究持续时间内,所注射的测试物周围的平均纤维化评分为正常至最低程度。在研究持续时间内,平均视网膜破坏评分为最低程度。在研究持续时间内,平均视网膜空泡形成评分为最低程度。临床上未观测到但在第1个月、第3个月和第6个月时,分别在1/68、5/71和1/72个组织学切片中注意到视网膜脱落。脱落的位置通常与视网膜破裂部位有关,且与针头穿刺部位位置一致,指示其可能与程序有关。
[0717]
表8具有一个植入物(每个植入物227μg阿西替尼)的兔的组织病理学分析结果。以0-5的标度对结果进行评分,其中0表示无变化(正常),1表示偶见变化灶(最低程度),2表示轻度弥漫性变化或更明显病灶变化,3表示中度弥漫性变化,4表示明显弥漫性变化,且5表示重度弥漫性变化。结果呈现为平均值和标准偏差(sd)。
[0718][0719][0720]
效力
[0721]
对于效力研究,12只动物(有和无植入物)在所选时间点(植入物注射后1、2、3和6个月;在各时间点对3只动物施以安乐死)之前48小时接受静脉内vegf攻击(1μg),以诱导血管增生和渗漏。自施用植入物起对兔随访6个月。在静脉内注射荧光素之后,使用荧光素血管摄影术(fa)在vegf攻击后48小时对眼睛成像,并以0至4的标度分等级(表9)。对各眼的左侧和右侧进行评分,以说明发炎反应的不均匀性。随后对各眼的fa评分求取平均值。
[0722]
表9通过荧光素血管摄影术(fa)成像的评分方法的描述。
[0723][0724]
当与在6个月的时段内接受生理盐水而不是植入物的对照动物相比时,具有植入物的动物的血管渗漏有效减少(图8)。空白对照眼在所有时间点皆显示高度扭曲和渗漏。
[0725]
总的来说,资料显示一个较高剂量植入物的良好耐受性和安全性,以及适合的生物降解速率和植入物在体内抑制新血管形成的潜能。
[0726]
实施例3.3:利用两个阿西替尼植入物的耐受性和安全性研究
[0727]
在下一步骤中,研究两个具有较高阿西替尼剂量的植入物(128μg/植入物,总剂量256μg/眼)的耐受性和安全性。因此,兔(n=9)经由用27g超薄壁针头经玻璃体内注射双侧接受两个植入物(表6中的第1号植入物类型),其中总阿西替尼剂量为256μg(128μg/植入物)。
[0728]
在6.5个月的研究时段内,每日监测兔的健康状况、iop和体重。根据改进版mcdonald-shadduck评分系统,对临床眼科检查(每日)进行评分。进行光学相干断层扫描(oct),以获得视网膜的横截面图像(每月)。进行红外(ir)成像,以监测植入物和阿西替尼在玻璃体中的持久性和降解(每月)。在1、3和6.5个月时,进行视网膜电描记术(erg)以评估
视网膜功能,并进行荧光素血管摄影术(fa)以评估眼血管系统。在1、3和6.5个月时,各处死3只兔。处死之后,准备将整眼用于组织病理学分析(参见实施例3.2)。
[0729]
未观测到异常一般健康观测结果。在研究持续时间内,所有兔皆增加或维持体重。眼健康发现仅限于偶发性、一般轻微且暂时性的刺激、肿胀和/或排出物。临床眼科检查显示在研究过程中无眼部异常,但第14天时半数动物有轻度结膜排出物(可能与程序有关,截至第27天已消退),投药后立即出现轻度视网膜出血的单一情况(截至第27天已消退),在投药后七周出现轻度结膜充血,以及在第195天时由于植入物附着至一只眼中的晶状体而导致晶状体混浊。在研究持续时间内,iop正常。oct成像显示研究持续时间内无视网膜异常。所有研究眼睛的erg皆正常,指示视网膜功能正常。fa发现正常血管形成,且无扩张或渗漏的证据。
[0730]
ir成像显示两个植入物随时间推移的水凝胶降解,且在阿西替尼粒子自水凝胶边界释放时形成更具整体性的形态,如第117天后所见(图9)。这些观测结果与实施例3.2中的植入物特性类似(图7a)。
[0731]
组织病理学指出切片中测试物的量随时间下降,指示注射物质的生物再吸收。在研究持续时间内,不存在或仅有最低程度的评定发炎和纤维化的组织病理学发现。平均组织病理学结果与标准偏差呈现于表10中。平均组织病理学发炎评分显示,在研究持续时间内,视网膜、巩膜或巩膜外、玻璃体腔和慢性角膜下(角膜边缘的淋巴细胞和吞噬细胞)发炎评分为正常至最低程度。在研究持续时间内,所注射的测试物周围的平均纤维化评分为正常至最低程度。在研究持续时间内,平均视网膜破坏评分为正常至最低程度。在研究持续时间内,平均视网膜空泡形成评分为最低程度。临床上未观测到但在第1个月、第3个月和第6个月时,分别在2/192个组织学切片中注意到视网膜脱落。脱落的位置通常与视网膜破裂部位有关,且与注射位置处针头穿过视网膜一致,指示其可能与程序有关。
[0732]
表10具有两个植入物(总剂量256μg阿西替尼/眼)的兔的组织病理学分析结果。以0-5的标度对结果进行评分,其中0表示无变化(正常),1表示偶见变化灶(最低程度),2表示轻度弥漫性变化或更明显病灶变化,3表示中度弥漫性变化,4表示明显弥漫性变化,且5表示重度弥漫性变化。结果呈现为平均值和标准偏差(sd)。
[0733][0734]
实施例3.4:在有或无共同施用的情况下利用两个阿西替尼植入物的耐受性、安全性和效力研究
[0735]
在下一步骤中,在有和无共同施用1.25mg(贝伐珠单抗)的情况下评定
用27g超薄壁针头经由玻璃体内注射双侧施用两个阿西替尼植入物(145μg阿西替尼,每眼剂量为290μg)的耐受性、安全性和效力。对于接受的动物,经玻璃体内施用抗vegf治疗剂,继而施用两个植入物。关于此研究中所应用的植入物的配方和尺寸,参考表6(第2号植入物类型)。
[0736]
耐受性和安全性
[0737]
对于耐受性和安全性研究,监测30只兔(n=15只/组,其中第1组未接受而第2组接受1.25mg),持续长达38个月的研究时间。每日检查一般健康状况直至第31个月,且每日检查体重直至第21个月。另外,在38个月内进行ir成像以监测植入物和阿西替尼在玻璃体中的持久性和降解。监测眼科检查和iop,持续21个月。根据改进版mcdonald-shadduck评分系统,对眼科检查进行评分。
[0738]
总之,未观测到对体重的影响。每日一般健康状况观测结果显示仅限于可自行消退的轻度眼部发现。在整个研究中,iop和眼部检查皆为正常的。就玻璃体耀斑、脉络膜/视网膜发炎和结膜排出物而言,眼科发现一般本质上为轻度的。在有或无共同施用的情况下应用的植入物之间,所有发现皆为相当的,显示植入物适合与其他治疗剂(诸如抗vegf药物)组合。
[0739]
ir成像证实植入物在研究持续时间内解离且显示两个植入物随时间推移的水凝胶降解,并且随着阿西替尼粒子在6至9个月之间并入单一整体结构中观测到更具整体性的形态,其中截至研究完成,所述结构显示在尺寸方面有所减小(图10)。这些观测结果也与实施例3.2和实施例3.3的图像一致(图7a和图9)。
[0740]
效力
[0741]
关于效力研究,将52只兔分为4组,其中第1组接受两个植入物但未接受(n=15),第2组接受两个植入物并接受(n=15),第3组仅接受(n=9),且第4组为无植入物且接受生理盐水的对照组兔(n=13)。在所选时间点(0.5、1、3、6、9、12、14、16、19、20和21个月)之前48小时用vegf(1μg)经静脉内攻击各组的动物,以诱导血管增殖和渗漏。如实施例3.2下所描述,使用荧光素血管摄影术(fa)在vegf攻击时间点后48小时对眼睛成像,并且按0(正常)至4(重度渗漏)的标度分等级。
[0742]
说明在有和无共同施用的情况下在重复vegf攻击下预防血管渗漏长达21个月(图11)。植入物注射后1个月时的代表性fa图像清楚显示第2组动物在植入物注射后1个月的有效渗漏抑制(图12)。应注意,仅接受的动物(第3组)在前2周和4周内显示快速渗漏抑制,然而,在3个月之后,血管渗漏复发至与在对照动物(第4组;图13)中所观测类似的程度。空白对照眼在所有时间点皆显示高度扭曲和渗漏(评分3至4)。
[0743]
总的来说,vegf攻击资料显示植入物体内抑制新血管形成的潜能,与一个植入物产生良好效力一致(参见实施例3.2)。与仅接受的动物相比,植入物显示有益作用。与作用仅持续至注射后3个月的抗vegf治疗剂相反,植入物能够长期抑制新血管形成,多达21个月。
[0744]
实施例3.5:植入物的阿西替尼释放和兔中的阿西替尼分布
[0745]
最后,已进行药物动力学研究以评估药物自植入物的释放以及阿西替尼自植入物持续释放后随时间向眼组织,特定来说视网膜、脉络膜/视网膜色素上皮(rpe)、玻璃体液
(vh)和水状液(ah)的分布。另外,监测全身阿西替尼浓度。因此,将兔分成4个群组。2个群组双侧接受一个包含109μg阿西替尼(第1组,n=14)或227μg阿西替尼(参见实施例3.2,第2组,n=24)的植入物。第3组(参见实施例3.4;n=15)双侧接受两个植入物,各自包含145μg(即,总剂量为290μg)阿西替尼。第4组(参见实施例3.4;n=15)双侧接受两个植入物,所述两植入物如同第3组包含290μg阿西替尼的总剂量(2x145μg)加上1.25mg玻璃体内(贝伐珠单抗)。具有相应阿西替尼剂量的植入物的配方、配置和尺寸呈现于表6中。
[0746]
为了研究药物释放,第1组在每个时间点对两只兔施以安乐死(第1天和第1.5、3、4.5、6、7.5和9个月),第2组在每个时间点对六只兔施以安乐死(第1、3、6和7个月),且第3组和第4组在每个时间点对3只(第0.5、1、3和6个月)和1只(第9和38个月)兔施以安乐死。另外,在安乐死之前,在表11中所指示的时间点自兔获取血液样品。
[0747]
方法:测定血浆中的阿西替尼
[0748]
为了测定血浆中的阿西替尼,进行两种等效定量方法。通过支撑型液体萃取(sle)自血浆萃取阿西替尼,并且在氮气下干燥。短期基质(血浆)稳定性长达4小时,而萃取物稳定性长达116小时。
[0749]
在甲醇/水(50:50v/v;方法1)或替代地在甲醇/水/甲酸(75:25:0.01v/v/v;方法2)中复原之后,通过液相层析-串联质谱法(lc-ms/ms;api 4000,applied biosystems),使用水/甲酸/甲醇梯度分析样品。ymc-pack pro c4管柱(50x3.0mm内径;方法1)或phenomenex luna c18管柱(方法2)上分离阿西替尼和内标物(is;阿西替尼-d3用于方法1且帕唑帕尼用于方法2),并使用电喷洒离子化(esi)选择性反应监测模式进行定量,总运行时间为大约6分钟。为了进行定量,测定阿西替尼的峰面积(m/z 387.2至356.0)和is(阿西替尼-d3为m/z 390.2至356.0且帕唑帕尼为m/z 438.2至357.1),并且与标准曲线相比较,其在所要浓度范围内显示线性性质且相关系数(r2)》0.99。定量下限(lloq)在约0.01ng/ml至约0.36ng/ml的范围内,视研究组和取样时间点而定(表11)。
[0750]
表11血浆或血清中阿西替尼的取样时间点和相应lloq(通过异构体)。对于第1组,在第1天以及1.5、3、4.5、6、7.5和9个月分析血浆样品。对于第2组,在3、6和7个月之后分析血浆样品。
[0751]
对于第3组和第4组,在6个月之后分析血清样品。
[0752]
[0753]
方法:测定眼组织中的阿西替尼
[0754]
为了测定眼组织中的阿西替尼浓度,在所选时间点摘除眼睛并在液氮中冷冻(表13)。将眼睛冷冻保存,随后进行冷冻解剖和后续生物分析。为了测定眼组织中的阿西替尼,进行两种等效定量方法。定量过程中显示两种方法用于测定ah、vh、视网膜和脉络膜匀浆中的阿西替尼浓度的等效性。
[0755]
在含有陶瓷珠粒的管中在甲醇/水稀释剂(50:50,v/v;方法1)或在磷酸盐缓冲生理盐水(pbs;方法2)中将视网膜和脉络膜的眼组织样品匀浆化。用甲醇/水稀释剂(50:50,v/v)直接自样品稀释vh和ah中的可溶性阿西替尼,并用乙醇萃取含有植入物(未溶解的阿西替尼)的玻璃体液样品(方法1)。在方法2中,用甲醇/水/甲酸(75:25:0.01v/v/v)稀释匀浆化组织、vh和ah中的可溶性阿西替尼。分别通过蛋白质沉淀(方法1)或sle(方法2)自基质萃取分析物。短期基质稳定性可长达5小时(ah)、长达5.5小时(vh)、长达6.6小时(视网膜)和长达4.5小时(脉络膜)。萃取物稳定长达171小时(ah)、长达153小时(vh)、长达115小时(视网膜)和长达114小时(脉络膜)。
[0756]
在氮气下干燥样品且用甲醇/水(50:50v/v)复原,并经由lc-ms/ms(api 4000,applied biosystems)用水/甲酸/乙腈梯度(方法1)或水/甲酸/甲醇梯度(方法2)进行分析。在ymc-pack pro c4管柱(50x3.0mm内径;方法1)或phenomenex luna c18管柱(方法2)上分离阿西替尼和内标物(is;阿西替尼-d3用于方法1且帕唑帕尼用于方法2),并使用esi选择性反应监测模式进行定量,总运行时间为大约6分钟。为了进行定量,测定阿西替尼的峰面积(m/z 387.2至356.0)和is(阿西替尼-d3为m/z 390.2至356.0且帕唑帕尼为m/z 438.2至357.1),并且与标准曲线相比较,其在所要浓度范围内显示线性性质且相关系数(r2)》0.99。lloq为0.100ng/ml。
[0757]
结果:测定血浆中的阿西替尼
[0758]
在所指示的时间点在不同的群组中测定血浆和血清中的阿西替尼浓度(表11)。所有组在研究持续时间期间的测定浓度皆低于定量下限(lloq),与阿西替尼剂量(在109至290μg/眼的范围内)无关,显示即使在高达580μg阿西替尼(290μg阿西替尼/眼,累加达总计580μg/兔)的总剂量下,也接近不存在阿西替尼全身暴露。此进一步强调即使对于较高剂量而言植入物的安全性。
[0759]
结果:测定眼组织中的阿西替尼
[0760]
水凝胶降解之后,观测到未溶解的阿西替尼形成局部化结构,从而继续释放阿西替尼(参见实施例3.2至3.4)。这些未溶解的阿西替尼粒子可能由于优先溶解在lc-ms/ms分析前用于萃取的有机溶剂中而在组织样品中错误地产生高浓度。因此,由于存在未溶解的阿西替尼粒子因在组织附近迁移还是组织解剖过程中的污染而污染组织样品导致水凝胶降解之后阿西替尼的组织浓度升高为可能的。阿西替尼在生物相关介质中的溶解度(pbs,ph 7.2,37℃;lorget等人,2016;characterization of the ph and temperature in the rabbit,pig,and monkey eye:key parameters for the development of long-acting delivery ocular strategies.molecular pharmaceutics,13(9),第2891-2896页)测定为大约0.5μg/ml,且明显高于此值的任何组织值皆可能指示组织积聚和/或阿西替尼粒子在萃取过程中溶解在有机溶剂中。然而,一般而言,基于ir成像,所测量的眼组织阿西替尼含量与可视存在或不存在充分相关(图7a、图9和图10)。
[0761]
所述研究的目的在于证明对于所有施用剂量,所要靶组织(脉络膜/rpe、视网膜和玻璃体液)中的阿西替尼浓度远高于所靶向的酪氨酸激酶受体的ic50(gross-goupil等人,clinical medicine insights:oncology,2013,7:269-277)且高于用于如在资助下研究的在新生大鼠模型中抑制眼血管生成(auspar 2013,nda202324;表12)的游离阿西替尼半最大有效浓度(ec50),以验证有效药物释放。
[0762]
表12阿西替尼结合至血管内皮生长因子受体2(vegfr2)、血小板衍生生长因子受体β(pdgfr-β)和干细胞生长因子受体/iii型受体酪氨酸激酶(c-kit)的ic
50
值,以及阿西替尼在大鼠模型中抑制眼血管生成的ec
50
值。
[0763][0764]
第1组中的眼组织分布(1个植入物,109μg阿西替尼)
[0765]
所指示的时间点的眼组织浓度呈现于表13中。
[0766]
表13自1个阿西替尼剂量为109μg阿西替尼的植入物释放的阿西替尼的眼组织分布。ah、vh(可溶性部分)、视网膜和脉络膜/rpe中的阿西替尼浓度视分析时间点而定呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。
[0767]
[0768][0769]
在研究持续时间内,ah样品中的阿西替尼浓度被视为较低。相对于vh、视网膜和脉络膜中所观测的浓度,指示阿西替尼自后房向前房迁移的程度较低。
[0770]
在研究持续时间内,vh样品中的可溶性阿西替尼的中值阿西替尼浓度在6个月时最大(264.0ng/ml)。个体样品在2.9ng/ml的最小值(7.5和9个月)至571.0ng/ml的最大值(6个月)的范围内。最大值与阿西替尼在生物相关介质中的溶解度极限类似,证明未溶解的阿西替尼不干扰测量。
[0771]
自第1天(147.4ng/g)至6个月(147.1ng/g),视网膜中的中值阿西替尼浓度类似,随后在7.5个月时显著降至14.6ng/g。此指示投药后1天至大约6个月内,阿西替尼自植入物快速持续转运至目标视网膜组织。自6至7.5个月,视网膜组织样品中的阿西替尼浓度降低大约10倍(147.1至14.6ng/g)。截至6个月时,视网膜中的平均中值阿西替尼浓度为175ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为2184、282和265倍),且因此在有望抑制新血管形成的浓度下。
[0772]
自第1天(119.6ng/g)至6个月(98.4ng/g),脉络膜/rpe中的中值阿西替尼浓度为类似的。此指示投药后1天至大约6个月内,阿西替尼通过植入物快速持续转运至眼后部的组织。自6至7.5个月,脉络膜/rpe组织样品中的阿西替尼浓度降低大约3倍(98.4至33.3ng/g)。截至6个月时,脉络膜/rpe中的平均中值阿西替尼浓度为207ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为2589、334和314倍),且因此在有望抑制新血管形成的浓度下。
[0773]
第2组中的眼组织分布(1个植入物,227μg阿西替尼)
[0774]
所指示的时间点的眼组织浓度呈现于表14中。
[0775]
表14自1个阿西替尼剂量为227μg阿西替尼的植入物释放的阿西替尼的眼组织分布。ah、vh(可溶性部分)、视网膜和脉络膜/rpe中的阿西替尼浓度视分析时间点而定呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。
[0776][0777]
截至研究完成(7个月)时,ah中的阿西替尼浓度较低,中值为0.0ng/ml,指示阿西替尼极少自后房向前房迁移。
[0778]
vh中的阿西替尼浓度表示溶解于vh中的可溶性阿西替尼。水凝胶降解前1和3个月时的中值与在37℃的ph 7.2pbs中测定的溶解度极限(0.4至0.5μg/ml)类似。6和7个月时的高中值可能体现vh样品被萃取过程中溶解的未溶解阿西替尼粒子污染。
[0779]
1和3个月时视网膜中的中值阿西替尼浓度与阿西替尼的溶解度极限类似。在前三个月内,视网膜中的平均中值阿西替尼浓度为341ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为4264、569和487倍),且因此在有望抑制新血管形成的浓度下。与vh值类似,6和7个月时的中值可能体现视网膜样品被萃取过程中溶解的未溶解阿西替尼粒子污染。
[0780]
脉络膜/rpe组织中在1、3和6个月时的中值阿西替尼浓度与阿西替尼溶解度类似。在前六个月内,脉络膜/rpe中的平均中值阿西替尼浓度为274ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为3426、457和391倍),且因此在有望抑制新血管形成的浓度下。与vh和视网膜值类似,7个月时的中值可能体现脉络膜样品被萃取过程中溶解的未溶解阿西替尼粒子污染。
[0781]
尽管6和/或7个月时的阿西替尼浓度可能体现被未溶解的阿西替尼污染,但显而
易见,植入物部位在研究持续时间内持续释放阿西替尼。
[0782]
第3组和第4组(2个植入物,总剂量为290μg阿西替尼,有或无)的眼组织分布
[0783]
所指示的时间点的眼组织浓度呈现于表15中。
[0784]
表15在无(第3组)或有(第4组)的情况下自总阿西替尼剂量为290μg阿西替尼的2个植入物释放的阿西替尼的眼组织分布。ah、vh(可溶性部分)、视网膜和脉络膜/rpe中的阿西替尼浓度视分析时间点而定呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。(g=群组;av.=平均值)
[0785]
[0786]
[0787][0788]
1.25mg的剂量在兔中的半衰期为6.6天(sinapis等人,2011;pharmacokinetics of intravitreal bevacizumabin rabbits.clinical ophthalmology(auckland,nz),5,第697页),且截至1个月时,剩余质量接近0.05mg。与此一致,最早时间点0.5个月显示,第3组与第4组之间在眼组织浓度方面无明显差异,指示当预期兔模型中的vh中的浓度最高时,药物释放类似。
[0789]
截至研究完成时,两组的ah中的阿西替尼浓度皆较低,中值为0.2ng/ml或更低,指示阿西替尼极少自后房向前房迁移。除38个月时的一个值以外,研究持续时间内的其他值皆《1ng/ml。
[0790]
vh中的阿西替尼浓度为溶解于vh中的可溶性阿西替尼。vh中的中值最大浓度在第3组中为553ng/ml且在第4组中为672ng/ml。这些值与在生物相关介质中测定的阿西替尼溶解度极限类似。两组中截至9个月时的中值浓度皆显示阿西替尼自植入物持续释放。即使在38个月时,也在vh中侦测到阿西替尼。
[0791]
在第3组中,视网膜组织中的阿西替尼中值浓度在6个月时最大(623ng/g),且在0.5至9个月之间在94至623ng/g的范围内。38个月时浓度较低(28ng/g),但仍在生物学有效浓度下。在前三个月内,视网膜中的平均中值阿西替尼浓度为184ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为2300、307和263倍),且因此在有望抑制新血管形成的浓度下。截至3个月时,第4组中的值与第3组相当,但6和9个月时含量较高且可能体现被萃取过程中溶解的未溶解阿西替尼粒子污染。在第2组与第3组之间,38个月时的视网膜组织阿
西替尼浓度相当。
[0792]
在第3组中,前三个月内脉络膜/rpe组织中的平均中值阿西替尼浓度为231ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为2888、386和330倍),且因此在有望抑制新血管形成的浓度下。6和9个月时的中值可能体现被萃取过程中溶解的未溶解阿西替尼粒子污染。在38个月时,脉络膜/rpe中的阿西替尼浓度较低(19ng/g),但仍在生物学有效浓度下。在第4组中,脉络膜/rpe中的阿西替尼浓度在0.5个月时与第3组相当,但在随后时间点高得多。考虑到各时间点内在最小样品浓度与最大样品浓度之间可见较宽范围,较高值可能体现被萃取过程中溶解的未溶解阿西替尼粒子污染。
[0793]
眼分布资料的汇总
[0794]
表16提供在所有四组荷兰黑带兔的不同组织中观测的中值阿西替尼浓度的概述。
[0795]
表16在水状液(ah)、玻璃体液(vh)、视网膜和脉络膜/rpe样品中测量的阿西替尼浓度取决于阿西替尼剂量(中值)。在所指示的时间点使用lc-ms/ms对不同的群组测量阿西替尼浓度(分别为ng/ml或ng/g)。
[0796][0797]
与低剂量(109μg)相比,对于中剂量(227μg)和高剂量(290μg),玻璃体液组织中的阿西替尼浓度存在剂量相关性增加。在水凝胶降解前,视网膜和脉络膜的靶组织中无剂量相关性差异。另外,当与第3组相比时,在第4组中共同施用不改变药物释放。即使在38个月之后,阿西替尼也以高于ic50和ec50的剂量存在于vh、视网膜和脉络膜/rpe中,显
示持续持久性。对于所有剂量强度,在整个研究持续时间中,在水状液中未侦测到阿西替尼或仅以低浓度存在,指示植入物定位后阿西替尼自后房向前房迁移的程度较低。
[0798]
结果:阿西替尼释放速率
[0799]
另外,也通过lc-ms/ms分析评定含有植入物的vh中的不溶性阿西替尼,以测定处死时间点的剩余阿西替尼量。通过对掺入十个牛vh样品中的十个植入物的值求平均来确定施用时的阿西替尼剂量。
[0800]
在低剂量组(第1组,109μg阿西替尼)和中剂量组(第2组,227μg阿西替尼)中,通过lc-ms/ms分析评定含有植入物的vh中的未溶解阿西替尼,以测定处死时间点的剩余阿西替尼量。随后将剩余量与初始剂量相比较并计算随时间的体内释放速率。在兔中,6个月内自植入物释放的平均阿西替尼量估计为0.52μg/天。水凝胶降解后,由于阿西替尼形成局部化结构,释放速率看似减缓。然而,所释放的阿西替尼含量仍足以抑制血管渗漏(参见实施例3.4)。
[0801]
实施例3.6:对阿西替尼推注剂量的短期暴露
[0802]
为了测试对阿西替尼粒子的短期暴露,经由50μl注射使用27g薄壁针头注射器向荷兰黑带兔(n=3只动物,6只眼)施用阿西替尼于(alcon;1%2000kda透明质酸钠)中的600μg(1.2%)悬浮液的玻璃体内双侧推注剂量。
[0803]
1个月时,将兔处死并准备将整眼用于组织病理学分析。固定眼睛,垂直切成12等份,用苏木精和伊红(h&e)染色,并由委员会认证的兽医病理学家进行检查。各时间点的组织病理学评定包括注射区域周围的玻璃体、视网膜、巩膜或巩膜外发炎、视网膜破坏和纤维化。对于任何异常,以0-5的半定量标度对组织进行评分,其中0表示无变化(正常),1表示偶见变化灶(最低程度),2表示轻度弥漫性变化或更明显病灶变化,3表示中度弥漫性变化,4表示明显弥漫性变化,且5表示重度弥漫性变化。
[0804]
每周测定的iop保持在正常范围内。一般可耐受600μg阿西替尼的玻璃体内推注投药(表17)。任何眼中皆未注意到宏观病变。在阿西替尼注射部位周围观测到最低程度的组织细胞性和多核巨细胞性发炎。在邻近穿刺位置的两眼中观测到轻度局灶性视网膜破坏,并认为与程序有关。在1/6只眼中观测到最低程度的视网膜破坏,在感光受体层中有少许巨噬细胞。在来自4/6只眼的许多切片中观测到最低程度的视网膜空泡形成。在4/6只眼中观测到最低程度至轻度慢性角膜下发炎。
[0805]
表17阿西替尼推注组织病理学研究结果。以0-5的标度对结果进行评分,其中0表示无变化(正常),1表示偶见变化灶(最低程度),2表示轻度弥漫性变化或更明显病灶变化,3表示中度弥漫性变化,4表示明显弥漫性变化,且5表示重度弥漫性变化。结果呈现为平均值和标准偏差(sd)。
[0806][0807]
总之,推注注射被良好耐受且为安全的。注射剂量导致兔眼中单位隔室体积的急
性局部化阿西替尼剂量较高(1.3ml/眼),如同其将在人眼中导致的情况一样(4.5ml/眼)。
[0808]
实施例4:在米格鲁犬中评估阿西替尼植入物
[0809]
为了在米格鲁犬中研究来自植入物的阿西替尼释放,使用27g超薄壁针头经由玻璃体内注射使12只犬每眼(双侧)各接受一个含109μg阿西替尼的植入物来施用植入物。所注射的植入物的配方和尺寸呈现于表6中(第5号植入物类型)。
[0810]
植入物施用前,利用肌肉内注射盐酸克他明(20mg/kg)和甲苯噻嗪(5mg/kg)将动物麻醉。用5% betadine溶液清洁眼睛和周围区域,并用平衡盐溶液(bss)冲洗。施加一至两滴局部盐酸丙美卡因麻醉剂(0.5%)。遮住眼睛并置放无菌丝窥器以缩回眼睑。将注射针头置放在距眼缘约3至5mm处并在单冲程中部署。
[0811]
在预定处死时间点(植入物施用后1.5、3、4.5和6个月分别各3只动物),收集眼睛,急骤冷冻,随后对脉络膜、视网膜、玻璃体液和水状液的靶组织进行解剖并称重。另外在所选时间点收集血浆。评定ah、vh(可溶性阿西替尼)、脉络膜/rpe和视网膜中以及血浆中的阿西替尼浓度。另外,也通过lc-ms/ms分析评定含有植入物的vh中的不溶性阿西替尼,以测定处死时间点的剩余阿西替尼量(方法描述于实施例3.5下)。
[0812]
据报告血浆中的所有值皆低于lloq(两种异构体皆为0.05ng/ml),指示在植入物施用(总施用剂量为218μg)后米格鲁犬接近不存在阿西替尼全身暴露。
[0813]
研究持续时间内靶组织中的阿西替尼浓度的药物动力学资料呈现于表18中。4.5个月内米格鲁犬ah样品中的阿西替尼浓度被视为相对于在vh、视网膜和脉络膜中所观测的浓度而言较低,指示在水凝胶降解前,阿西替尼自后房向前房迁移的程度较低。在6个月时(水凝胶降解之后),阿西替尼以较高浓度存在于ah中。此可能由于自降解水凝胶释放的未溶解阿西替尼粒子自后房向前房迁移,或由于组织解剖过程中vh对ah造成样品污染。在任何兔研究中皆未曾观测到ah中的高阿西替尼浓度。
[0814]
在研究持续时间内,vh中的中值阿西替尼浓度为类似的(范围为11.9至27.1ng/ml)。这些值与在猴研究中在类似剂量(138μg;参见实施例5)下观测的值类似。
[0815]
在研究持续时间内,视网膜中的中值阿西替尼浓度为类似的(范围为15.4至31.0ng/ml),指示自植入物向视网膜组织连续持续递送阿西替尼。六个月内视网膜中的平均中值阿西替尼浓度为23ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为288、37和35倍),且因此在有望抑制新血管形成的浓度下。另外,此浓度是在眼血管生成新生大鼠模型中针对游离阿西替尼测定的ec50的121倍。
[0816]
在研究持续时间内,脉络膜/rpe中的中值阿西替尼浓度为类似的(范围为16.2至39.8ng/g),指示截至研究完成时自植入物向脉络膜组织持续递送阿西替尼。六个月内脉络膜/rpe中的平均中值阿西替尼浓度为31ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为388、50和47倍),且因此在有望抑制新血管形成的浓度下。另外,此浓度是在眼血管生成新生大鼠模型中针对游离阿西替尼测定的ec50的163倍。
[0817]
表18在米格鲁犬中的药物动力学研究结果。ah、vh(可溶性部分)、视网膜和脉络膜/rpe中的阿西替尼浓度视分析时间点而定呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。
[0818][0819][0820]
米格鲁犬中在6个月内自植入物释放的平均阿西替尼量估计为大约0.52μg/天(表19),与在相同剂量下在兔中所见的释放速率类似(参见实施例3.5)。通过对掺入十个牛vh样品中的十个植入物的值求平均来确定施用时的阿西替尼剂量。
[0821]
表19含有植入物的vh中的不可溶阿西替尼。基线值是指施用前植入物中的阿西替尼量。
[0822][0823]
实施例5:在非人类灵长类动物中评估阿西替尼植入物
[0824]
为了在非洲绿猴中研究安全性和药物释放,使用27g超薄壁针头经由玻璃体内注射使动物在右眼或左眼(用于药物释放研究)或双侧(用于安全性和耐受性研究)接受一个
植入物,所述植入物包含138μg的阿西替尼剂量。所注射的植入物的配方和尺寸呈现于表6中(第4号植入物类型)。
[0825]
植入物施用前,利用肌肉内注射盐酸克他明(20mg/kg)和甲苯噻嗪(5mg/kg)将动物麻醉。用5% betadine溶液清洁眼睛和周围区域,并用平衡盐溶液(bss)冲洗。施加一至两滴局部盐酸丙美卡因麻醉剂(0.5%)。遮住眼睛并置放无菌丝窥器以缩回眼睑。将注射针头置放在距眼缘约3至5mm处并在单冲程中部署。
[0826]
药物释放
[0827]
为了评估药物释放,在植入物施用后3个月将6只猴处死,并收集眼睛,急骤冷冻,随后对脉络膜、视网膜、玻璃体液和水状液的靶组织进行解剖并称重。另外在所选时间点收集血清。自组织提取阿西替尼(必要时)并稀释后进行后续分析,继之以lc-ms/ms以测定样品中的阿西替尼浓度(方法描述于实施例3.5下)。
[0828]
靶组织中的中值阿西替尼浓度的药物动力学资料呈现于表20中。如针对兔和米格鲁犬所观测,ah中的阿西替尼浓度较低,指示阿西替尼极少自猴眼后房向前房移动。vh中的可溶性阿西替尼浓度与在兔中所观测的浓度相比较低(12ng/ml),但其与在米格鲁犬中所观测的浓度类似。
[0829]
在前三个月内,视网膜中的平均中值阿西替尼浓度为39ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为488、63和59倍),且因此在有望抑制新血管形成的浓度下。另外,此浓度为针对眼血管生成新生大鼠模型中的游离阿西替尼所测定的半最大有效浓度(ec50=0.19ng/ml)的205倍。
[0830]
在前三个月内,脉络膜/rpe组织中的平均中值阿西替尼浓度为940ng/g,远高于vegfr2、pdgfr-β和c-kit的ic50值(分别为11750、1516和1424倍),且因此在有望抑制新血管形成的浓度下。另外,此浓度为针对眼血管生成新生大鼠模型中的游离阿西替尼所测定的ec50的4947倍。
[0831]
与兔(分别为240、656和307ng/g)和米格鲁犬(16ng/g)相比,猴(940ng/g)在3个月时的脉络膜/rpe阿西替尼浓度显著更高。因为发现阿西替尼结合至小鼠(资助,nda202324)眼睛的葡萄膜中的黑色素,故此可能是由于中心和外周脉络膜/rpe中的眼黑色素含量与兔和米格鲁犬相比增加所致(durairaj等人,2012,intraocular distribution of melanin in human,monkey,rabbit,minipig,and dog eyes.experimental eye research,98,第23-27页)。另外,玻璃体体积变化也可能促成组织浓度差异(荷兰黑带兔=1.3ml,米格鲁犬=2.2ml,且非洲绿猴=2.4ml;glogowski等人,2012,journal of ocular pharmacology and therapeutics,28(3),第290-298页;struble等人,2014,acta ophthalmologica,92)。
[0832]
此外,血清中来自植入物的阿西替尼的全身暴露低于lloq(反式阿西替尼为0.088ng/ml,而顺式阿西替尼为0.012ng/ml)。
[0833]
表20非洲绿猴中的药物动力学研究结果。ah、vh(可溶性部分)、视网膜和脉络膜/rpe中的阿西替尼浓度视分析时间点而定呈现为平均值(均值),包括均值的标准偏差、变异系数(cv)以及信赖区间(ci)。另外,呈现各数据点的最小值、中值和最大值。
[0834][0835]
安全性和耐受性
[0836]
为了评估安全性和耐受性,植入物施用后监测6只猴,持续3个月。眼科检查经由眼科裂隙灯检查进行,并根据改进版hackett-mcdonald评分系统分等级。眼科检查未显示明显发现,包括研究持续时间内无眼内发炎或视网膜变化。研究持续时间内未出现iop或瞳孔直径变化。
[0837]
得自临床前动物研究的结论
[0838]
总之,药物动力学结果显示在长达38个月的持续时间内所检查的所有动物(犬、米格鲁犬、猴)中,相关眼组织(vh、视网膜、脉络膜/rpe)中自植入物递送的阿西替尼含量显著高于酪氨酸激酶的ic50和在大鼠模型中抑制血管生成的ec50(表12)。一般而言,基于ir成像,所测量的眼组织阿西替尼含量与后房中可视存在或不存在植入物和药物相关。相比之下,与vh、视网膜和脉络膜/rpe相比,ah中的阿西替尼浓度不存在或极低,证明所有三个动物物种中皆发生植入物定位后仅少量阿西替尼自后房向前房迁移。然而,由于在玻璃体体积、玻璃体粘度和与视网膜色素上皮(rpe)的表面积直接相关的小分子药物清除率方面动物与人类之间存在相当的差异,因此人类药物释放可能与非临床研究有所不同。
[0839]
所有动物研究皆显示血浆/血清含量低于lloq,指示接近不存在阿西替尼全身暴露。因此,由本技术的植入物产生的血浆/血清含量远低于文献中针对报告的血清含量。因为阿西替尼后续未分布在眼内区室外,因此任何药物-药物相互作用风险皆可被视为最低程度。
[0840]
通过ir的成像分析显示,水凝胶随时间在后房中发生可视生物降解,在大约6个月之后完全降解。先前植入物位置上的剩余阿西替尼药物粒子形成整体结构,以足以持续抑制血管渗漏的水平继续释放阿西替尼。在兔vegf攻击研究中,显示在抑制血管渗漏方面的效力持续6个月和21个月。当与施用单独阿西替尼植入物相比时,共同施用贝伐珠单抗在前3个月内甚至更快速地抑制血管渗漏。
[0841]
总的来说,资料显示本发明的阿西替尼植入物为安全的且被良好耐受,以及在兔、犬和非洲绿猴中显示充分药物释放和良好效力。
[0842]
实施例6:利用阿西替尼植入物的人类临床试验
[0843]
在下一步骤中,在人类中检查本技术的阿西替尼植入物。施加阿西替尼植入物以减少脉络膜/视网膜新血管形成和渗出,减少血管渗透,降低中心子场厚度(或基本上维持或防止临床显著的增加),而在某些实施方案中不削弱乃至改良视敏度。由于植入物持续释放阿西替尼且因而向玻璃体液和周围组织长期提供阿西替尼,因此用本技术的植入物进行治疗减轻患者和护理人员的负担,以及与频繁注射抗vegf治疗剂相关的不良反应的风险。
[0844]
招募存在视网膜液的新血管性年龄相关性黄斑退化(湿性amd)受试者参与开放标签型剂量递增研究,以评估本发明的阿西替尼植入物在人类受试者中的安全性、耐受性和效力。患者未进行过或进行过治疗。
[0845]
实施例6.1:配方
[0846]
表21.1和表21.2提供含有约200μg和约600μg阿西替尼的植入物的配方和尺寸的概述,其中一些已应用于人类临床试验(或计划或适合应用于未来人类临床试验)。在已生产植入物且已干燥之后以及紧临其装载至针头中之前,测量植入物在干燥状态下的尺寸。植入物保留在保持氧气和水分皆低于20ppm的惰性手套箱中至少约7天,随后包装。在生物相关介质(pbs,ph 7.2,37℃)中24小时之后测量这些表中所指示的水合植入物的尺寸。
[0847]
通过定制三摄影机keyence检验系统测量植入物尺寸(在干燥和湿润状态下)。使用2台摄影机测量直径,公差为
±
0.002mm(获取所有数据点,记录平均值(=均值),并使用1台摄影机测量长度,公差为
±
0.04mm(若干数据点,记录最长测量长度)。
[0848]
表21.1实施例6.3和实施例6.4中所报告的临床研究中所使用的阿西替尼剂量为约200μg的植入物的配方、配置和尺寸。
[0849]
[0850][0851]
表21.2阿西替尼剂量为约600μg的植入物的配方、配置和尺寸。
[0852]
[0853]
[0854][0855]
也在体外即时和加速分析(如实施例2中所描述的分析)中研究表21.1中用于以下进一步描述的临床研究中的200μg植入物的阿西替尼释放。体外即时资料表明225天之后完成阿西替尼释放,而加速释放在约2周之后完成(图14)。
[0856]
实施例6.2:临床研究的细节
[0857]
根据研究方案使用200μg植入物(以上表21.1中的第1号植入物)进行临床研究,以下再现所述研究方案(尽管研究已开始且已进行一部分,且结果报告于本文中的实施例6.3和实施例6.4中,但如研究方案所常见的,所述研究方案仍以现在和将来时态书写)。研究方案中称为“otx-tki”的植入物为以上表21.1的第1号植入物。如本文中所描述,视剂量而定,同时施用一个(200μg剂量)、两个(400μg剂量)或三个(600μg剂量)植入物。在研究方案结尾处(即,在实施例6.2结尾处)提供以下研究方案以及本文中所提及的附录a至g中所使用的任何缩写。
[0858]
研究目标
[0859]
主要研究目标为评估otx-tki(阿西替尼植入物)经玻璃体内用于患有新血管性年龄相关性黄斑退化(nvamd)的受试者的安全性、耐受性和效力。
[0860]
研究设计
[0861]
此为多中心开放标签剂量递增1期安全性研究。此安全性研究将在澳大利亚在大约5个现场招募大约26名受试者。在此研究期间将评估三个群组:200μg(第1组)和400μg(第2组)剂量组,继而为第三个群组(第3组),由旨在测试单一疗法(6名受试者接受600μg otx-tki)和利用抗vegf的组合疗法(6名受试者用400μg otx-tki连同单次抗vegf注射进行治疗)的两个不同治疗组组成。在下一组开始前将由dsmc评估第1组和第2组中治疗的受试者的安全性资料。所述研究将持续大约9个月;将进行筛检/基线访视,继之以注射日访视,另外有大约10次访视(参见附录a)。
[0862]
筛检访视(第1次访视)可在注射访视(第2次访视;第1天)之前至多14天进行。在第2次访视时,受试者将注射otx-tki植入物(对于第3组,可依据研究人员的判断,在1至4周内间隔注射otx-tki植入物和抗vegf)。受试者将在2至3天后返回进行随访,以便在第3次访视时进行术后评估。受试者随后将在大约一周内返回(第4次访视),随后在大约两周时再次返回(第5次访视)以进行安全性评估。此后,受试者将在以下时间点返回进行安全性评估:第6次访视(第1个月),第7次访视(第2个月),第8次访视(第3个月),第9次访视(第4.5个月),第10次访视(第6个月),第11次访视(第7.5个月)和第12次访视(第9个月),以进行最终安全性评估并退出研究。依据研究人员的判断,应对第9个月仍有生物学活性证据的受试者每月随访一次,直至cnv渗漏已恢复基线水平或直至研究人员认为受试者已临床稳定。
[0863]
第1组计划包括6名受试者。他们将每眼各接受一个200μg植入物,据估计由此可提供每周大致约7μg的药物递送。
[0864]
第2组计划包括6至8名受试者。他们将每眼各接受两个200μg植入物,据估计由此可共同提供每周大致约14μg的药物递送。
[0865]
第3a组(单一疗法)计划包括6名受试者。他们将每眼各接受三个200μg植入物,据估计由此可共同提供每周大致约21μg的药物递送。
[0866]
第3b组(组合治疗疗法)计划包括6名受试者。他们将每眼各接受两个200μg植入物,据估计由此可共同提供每周大致约14μg的药物递送,加单次剂量的抗vegf剂。
[0867]
第1组将全部参与,并且将在任何受试者也进入下一组之前评定otx-tki对各受试者的所有安全性和耐受性资料(最少随访资料为两周)。将对第2组重复相同方法。下一组的剂量递增将基于dsmc推荐且由mm确认。
[0868]
若第1组、第2组或第3a组中鉴定一个dlt,则将继续招募直至所述群组已全部参与。若第1组、第2组或第3a组中鉴定第二dlt,则招募将终止。若第3a组中发现第二dlt,则将终止所述组招募,且将宣告先前较低剂量为mtd。
[0869]
除安全性和耐受性评估以外,此第一临床研究还将通过评定中心子场厚度(csft)、fa和bcva与基线评估相比随时间变化来确定是否存在任何生物学活性证据。
[0870]
受试者可仅用otx-tki治疗1只眼。对侧眼睛将在需要时由研究人员酌情治疗。此应为护理标准,且在任何情况下皆不应将另一研究药物用于对侧眼睛。
[0871]
若两眼皆合格,则将选择具有最差bcva的眼睛作为研究眼睛。若两眼皆合格且两者bcva相同,则研究人员将决定选择作为研究眼睛的眼睛。
[0872]
安全性结果量度
[0873]
将在注射植入物后立即评定安全性。在注射后即刻时间内,将监测受试者的视敏度和iop升高。
[0874]
安全性结果量度将包括对以下诸项的评定:
[0875]
·
治疗期出现的眼部不良事件的发生率
[0876]
·
治疗期出现的全身不良事件的发生率
[0877]
·
生命体征
[0878]
·
眼部舒适度评分(将由受试者评定)
[0879]
·
bcva
[0880]
·
眼科检查与基线评定相比的变化(例如裂隙灯活组织镜检、眼底检查)
[0881]
·
前房细胞和耀斑评分
[0882]
·
玻璃体细胞和混浊评分
[0883]
·
iop的临床显著的增高
[0884]
·
潜在注射相关并发症(例如内眼炎、视网膜脱落等)
[0885]
·
地区性萎缩的生长或发展
[0886]
·
安全性实验室值的临床显著的变化
[0887]
·
将在筛检/基线访视(第1次访视)、第1天(第2次访视)、第3天(第3次访视)和第3个月(第8次访视)时获取血浆样品以供用于药物动力学分析。
[0888]
效力结果量度
[0889]
将在整个研究进行中观测效力量度。效力结果量度将包括对以下诸项的评定:
[0890]
·
在6个月和所有访视时通过sd-oct测量的中心子场厚度(csft)随时间推移相对
于基线的平均变化
[0891]
·
在6个月和所有访视时bcva随时间推移相对于基线的变化
[0892]
·
通过fa和oct-a测定的临床显著的渗漏变化
[0893]
·
截至第9个月时各研究访视的csft与基线相比降低≥50μm
[0894]
·
各研究访视时不存在任何srf和irf(个别和共同)
[0895]
·
需要救援疗法
[0896]
受试者选择-研究群体
[0897]
参与此研究的受试者将诊断为继发于amd的原发性窝下(活动性窝下或窝旁cnv伴随涉及眼窝的渗漏)新血管形成(sfnv)。具有经典为主性、经典为最低性或潜隐性病变的受试者皆将包括在内。
[0898]
若两眼皆合格(即,满足所有纳入和排除准则),则具有更差bcva的眼睛将为研究眼睛。若两眼皆合格且两眼bcva相同,则研究人员将决定选择哪只眼睛作为研究眼睛。
[0899]
受试者选择-纳入准则
[0900]
若任一性别的个体存在以下情况,则其将适合参与研究:
[0901]
1.至少50岁
[0902]
2.适合标准疗法
[0903]
3.通过fa和sd-oct证明研究眼睛中有新诊断或先前曾治疗过且证明对抗vegf疗法有反应的继发于amd的活动性原发性cnvm[继发于amd的原发性窝下cnv,包括影响眼窝的窝旁病变]
[0904]
4.研究眼睛中病变区域《30.5mm2(12倍视盘面积)(根据黄斑光凝研究方案测量)
[0905]
5.依据荧光素血管摄影术(fa)和眼底摄影术,研究眼睛中cnv总面积≥总病变的50%
[0906]
6.依据sd-oct,研究眼睛中存在眼窝视网膜内液或视网膜下液且csft》300μm
[0907]
7.研究眼睛中有足够眼介质和足够瞳孔扩张,从而允许优质眼底成像
[0908]
8.第1天(注射日)前12周内进行过心电图,未显示临床明显异常
[0909]
9.为在筛检前停经后至少12个月或手术不育的女性;或自筛检直至退出研究皆愿意使用两种形式适当避孕的有生育能力的男性或女性
[0910]
10.能够且愿意顺应所有研究要求和访视
[0911]
11.提供书面知情同意书。
[0912]
受试者选择
–
排除准则
[0913]
若个体存在以下情况,则其不适合参与研究:
[0914]
1.单眼有视觉
[0915]
2.研究眼睛中有涉及眼窝中心的重度疤痕、纤维化或萎缩(不排除轻度纤维化或萎缩)
[0916]
3.证明研究眼睛中疤痕或纤维化占总病变的》50%
[0917]
4.在研究眼睛中对眼窝中心进行过在先激光光凝
[0918]
5.距筛检3个月内研究眼睛中有眼内手术史,包括白内障手术或角膜屈光手术(lasik、prk等)或另一治疗
[0919]
6.研究眼睛中无晶状体
[0920]
7.期望在研究时段期间在研究眼睛中进行穿透性角膜移植术、玻璃体切除术、白内障手术或lasik或任何其他眼内手术
[0921]
8.研究眼睛中有玻璃体视网膜手术(包括玻璃体切除术)或其他眼部手术(包括巩膜扣或青光眼滤过/分流手术)病史。允许除cnv治疗以外的在先激光治疗
[0922]
9.研究眼睛中存在可能影响视力或安全性评估的除nv(湿性)amd以外的疾病
[0923]
10.先前3个月内有严重眼部感染史(细菌、病毒或真菌),或任一眼中有疱疹性眼部疾病(包括单纯疱疹病毒、水痘带状疱疹或巨细胞病毒性视网膜炎)或弓形体病或慢性/复发性发炎眼病(即,巩膜炎、葡萄膜炎、角膜水肿)
[0924]
11.有研究眼睛中的黄斑中存在孔源性视网膜脱落或显著可见视网膜上膜(重度erm)或黄斑裂孔或视网膜色素上皮(rpe)撕裂的证据
[0925]
12.研究眼睛中患有增生性糖尿病性视网膜病变、分支视网膜静脉阻塞或中心视网膜静脉阻塞
[0926]
13.研究眼睛中有糖尿病性黄斑水肿(dme)病史
[0927]
14.研究眼睛中有玻璃体出血病史或存在。若既往出血性pvd病史已消退,则受试者仍合格
[0928]
15.在研究眼睛中进行晚期青光眼(尽管治疗但不受控制的iop≥25mmhg)或青光眼滤过手术
[0929]
16.研究眼睛中有病理性近视
[0930]
17.研究眼睛中有》10近视屈光度的屈光不正等效球面
[0931]
18.进行用酪氨酸激酶抑制剂的任何先前治疗
[0932]
19.任一眼中患有眼部恶性病,包括脉络膜黑色素瘤
[0933]
20.正在接受用已知对视网膜、晶状体或视神经有毒的药物(例如氯丙嗪、吩噻嗪、他莫昔芬(tamoxifen)等)同时治疗
[0934]
21.需要用全身或局部眼用皮质类固醇长期治疗(若有需要,则研究期间允许《7天的短疗程),或已知对荧光素过敏(例如支气管痉挛、皮疹等)或对研究产品中的任何组分过敏
[0935]
22.在注射植入物的过去30天内患有症状性或不稳定冠状动脉疾病、心绞痛、充血性心脏衰竭或需要积极医疗处理的心律不整
[0936]
23.患有不受控制型高血压(定义为尽管进行医学治疗但》160/100mm hg)
[0937]
24.有不受控制型全身性疾病或衰弱性疾病(例如不受控制型糖尿病)的病史或存在。
[0938]
25.先前6个月内发生过心肌梗塞或其他心血管事件(例如中风)
[0939]
26.过去30天内曾在美国或美国以外地区参与过任何涉及研究药物的研究
[0940]
27.为直接参与研究管理、施用或支持的现场雇员,或为其直系亲属。
[0941]
研究资料收集
–
研究方案
[0942]
研究时间和事件时间表呈现于附录a中。研究评定程序可见于本文中研究方案末尾(即,实施例6.2末尾)的附录b至g中。
[0943]
研究观测结果和程序-受试者筛检和知情同意书
[0944]
将在研究招募之前确定潜在资格。研究人员和研究工作人员将确定受试者满足随
访要求的意愿和能力。若受试者希望参与研究,则将在进行任何研究特异性检查之前获得书面知情同意书。完成所有筛检和基线评估后,研究人员和研究工作人员将决定受试者是否满足所有资格准则。若受试者满足资格准则并同意参与,则将招募所述受试者。
[0945]
一旦受试者有资格参与研究并已接受otx-tki,则其必须遵循,直至研究时段结束。
[0946]
若注射otx-tki植入物不成功,则在crf上将注射失败的原因记录为注射失败而非ae。
[0947]
一旦植入物置放在玻璃体中,则研究人员将通过间接检眼镜检查验证位置。根据研究人员的判断,可在整个研究持续时间中获取植入物的图像。
[0948]
若otx-tki植入物注射不成功,则将根据相同群组分配另一受试者至研究。
[0949]
研究观测结果和程序-筛检失败
[0950]
已签署知情同意书但在筛检评定期间或在基线访视时被确定为不合格但在分配至群组前将被视为筛检失败的受试者将退出研究,并且将不需要额外研究随访。筛检失败的原因将记录在crf中。
[0951]
若不符合资格准则的受试者在筛检/基线期间经历ae,则将对其进行跟踪,直至ae消退或稳定。
[0952]
研究观测结果和程序-受试者退出
[0953]
将要求研究中治疗的所有受试者遵守此方案中所描述的随访时间表。
[0954]
受试者可在任何时间以任何理由退出临床研究,而不会受研究人员刁难或偏见,并且不会损害其临床护理。倘若出于间发疾病、ae、违反方案和/或行政原因,研究人员也有权使受试者退出试验。
[0955]
对于在注射otx-tki后撤回其同意书的任何受试者,将在研究crf末尾记录退出原因。
[0956]
若退出研究是由于ae或死亡,则也将完成ae表。若受试者由于ae退出研究,则研究人员应尽一切努力对受试者进行随访,直至ae消退或稳定。
[0957]
将尽一切努力联系不顺应或失去随访的受试者,并且此种努力将记录在受试者的研究记录中。
[0958]
将不会替换在接受供玻璃体内使用的otx-tki(阿西替尼植入物)后退出研究的受试者。
[0959]
研究观测结果和程序-产品故障
[0960]
注射后,研究人员将评估(即,分级)注射容易性,包括是否存在技术问题,诸如注射装置无法注射植入物。供玻璃体内使用的otx-tki(阿西替尼植入物)的所有故障皆将记录在适当crf上,并在24小时内报告给ocular therapeutix。ocular therapeutix将建议是否将注射装置退回以供分析。故障发生率将包括在最终分析中。
[0961]
研究观测结果和程序-群组分配
[0962]
此为开放标签剂量递增1期研究。主要研究人员将基于纳入和排除准则决定各受试者的资格。
[0963]
对于第1组,第一受试者将在治疗任何其他受试者之前在研究眼睛中接受otx-tki植入物。一旦已评估第1组中的第一受试者达两周并且mm支持继续,便将对第1组中的其他
五名受试者进行治疗。
[0964]
一旦第1组已全部参与并且已收集otx-tki对各受试者的所有安全性和耐受性资料(为期两周的最少随访资料),dsmc和mm将对所有可利用临床资料进行审查。
[0965]
第2组中的受试者将仅在以下情况之后接受治疗:
[0966]
1.第1组中的所有受试者皆已接受otx-tki植入物,并且已随访至少2周
[0967]
2.确认不超过1/6名受试者经历dlt
[0968]
3.dsmc完成对所有可利用临床资料的安全性审查,并建议剂量递增。
[0969]
一旦第1组和第2组全部参与并且已收集otx-tki对各受试者的所有安全性和耐受性资料(为期两周的最少随访资料),dsmc和mm将对所有临床资料进行安全性审查,并将提供有关剂量递增和持续的建议。
[0970]
第3组将由大约12名受试者组成。六名受试者将接受600μg otx-tki(第3a组:单一疗法治疗组),且6名将接受400μg otx-tki连同单次抗vegf注射(第3b组:组合治疗组)。第3a组(单一疗法治疗组:600μg otx-tki)将在第3b组组合治疗组(400μg otx-tki连同单次抗vegf注射)之前招募。
[0971]
研究观测结果和程序-遮蔽
[0972]
此为开放标签非遮蔽安全性研究。
[0973]
研究观测结果和程序-救援疗法
[0974]
需要时,任何治疗组中的任何受试者皆可依据研究人员的判断接受救援疗法(即,抗vegf)。接受救援疗法的适当性将依据研究人员的判断,并且应在治疗3天内尽快传达至医疗监护人。若所述时间段内未安排依方案研究访视,则接受救援疗法的受试者在治疗后7至10天应返回以进行计划外访视加sd-oct成像。将对接受救援疗法的受试者随访至最后一次研究访视。将使用以下准则鉴定可能需要救援疗法的受试者:
[0975]
i.由于armd,相对于最佳先前bcva损失≥15个字母,其中当前bcva并不比基线更优选;或
[0976]
ii.由于amd,2次连续访视相对于最佳先前bcva损失≥10个字母,其中当前bcva并不比基线更优选。
[0977]
iii.相对于先前最佳值,疾病活动性恶化的证据由大于75微米csft体现
[0978]
研究观测结果和程序
–
禁用药物
[0979]
注射植入物前14天开始必须避免与otx-tki伴随使用禁用药物且在注射之后持续9个月。
[0980]
由于玻璃体内施用后阿西替尼的血浆生物利用度未知,因此必须避免共同施用otx-tki和强cyp3a4/5抑制剂。已显示与口服酮康唑(ketoconazole)共同施用后,阿西替尼暴露(即,c
max
)增加。自首次筛检访视开始,任何时间皆不允许以下药物:酮康唑、伊曲康唑(itraconazole)、克拉霉素(clarithromycin)、阿扎那韦(atazanavir)、茚地那韦(indinavir)、奈法唑酮(nefazodone)、奈非那韦(nelfinavir)、利托那韦(ritonavir)、沙奎那韦(saquinavir)、泰利霉素(telithromycin)、伏立康唑(voriconazole)。
[0981]
必须避免共同施用otx-tki和强cyp3a4/5诱导剂,因为已证明与雷福霉素(rifamycin)共同施用后,阿西替尼暴露(即,c
max
)降低。以下是不允许的:雷福霉素、雷福布汀(rifabutin)、雷福喷汀(rifapentine)、苯妥英(phenytoin)、卡巴马平、本巴比妥
(phenobaribital)、金丝桃(hypercium)(贯叶连翘(st.john’s wort))。允许间歇使用局部和口服类固醇。
[0982]
研究观测结果和程序-眼底成像、荧光素血管摄影术、光学相干局部记载术
[0983]
在对任何研究受试者成像之前,摄影师必须获得中央阅读中心(central reading center)认证。成像将遵循标准方案。
[0984]
oct技术人员也必须获得中央阅读中心认证。将使用cirrus oct,遵循标准方案获得谱域(sd)oct图像。
[0985]
这些程序的说明书将提供于单独成像手册中。
[0986]
研究观测结果和程序-评定药物动力学分析
[0987]
也将测定阿西替尼的血浆水平;在筛检、基线、第3天(第3次访视)和第3个月(第8次访视)时获取样品。对于第3组中可依据研究人员的判断在1至4周内接受可能隔开的三次单独otx-tki注射的受试者(600μg组),可在注射第三个即最后一个植入物的相同研究访视时获得用于药物动力学分析的第3天(第3次访视)样品。说明书提供于实验室手册中。
[0988]
研究观测结果和程序-医疗史和同时药物治疗
[0989]
受试者amd药物治疗史全部应记录在受试者原始文件表和相应crf上。另外,自筛检访视开始至研究结束,自筛检访视前长达3年的任何其他同时眼科药物和全身药物连同服用药物的原因皆应记录在受试者的原始文件表和相应crf上。
[0990]
受试者的所有眼科和心脏医疗史也应记录在受试者的原始文件表和相应crf上。自筛检访视前长达5年的其他重要医疗史应记录在受试者的原始文件表和相应crf上。
[0991]
研究评定:
[0992]
筛检评估:第-14天至第0天
[0993]
在筛检访视时,主要研究人员将通过检查所有纳入和排除准则初步确定受试者的研究参与资格。若受试者不满足所有纳入准则和/或满足任何排除准则,则受试者将筛检失败且不再进行其他评定。这些评定的程序的细节可见于此部分的附录b至附录g中。
[0994]
以下程序和评定可在计划注射日之前14天内开始,并且必须在注射日(第2次访视/第1天)之前按以下建议顺序完成:
[0995]
·
获得书面知情同意书
[0996]
·
人口统计信息,包括年龄、性别、人种、种族
[0997]
·
医疗史和眼科史,包括治疗和程序
[0998]
·
纳入和排除准则
[0999]
·
先前和伴随药物
[1000]
·
生命体征(脉搏率、血压和体温)
[1001]
·
心电图
–
第1天注射前12周内显示临床不显著的异常的心电图证据(参见附录g)必须记录在crf中
[1002]
·
bcva(etdrs)
[1003]
·
裂隙灯活组织镜检和外眼检查
[1004]
·
通过压平式(goldmann)压力测量术进行iop测量
[1005]
·
眼底扩张检查,包括眼底成像
[1006]
·
sd-oct
[1007]
·
oct-a
[1008]
·
荧光素血管摄影术
[1009]
·
用于pk分析的血浆样品
[1010]
·
安全性实验室测试
[1011]
·
不良事件评定
[1012]
·
尿液妊娠试验:若女性有生育潜能,则自筛检至研究结束,受试者在注射植入物后必须利用两种形式适当避孕且尿液妊娠试验呈阴性
[1013]
注意:所有检查皆需要对双眼进行。
[1014]
对于由于预期为暂时性的原因而筛检失败,可进行一次重新筛检访视。重新筛检访视应安排在第1次筛检访视之后至少14天。重新筛检的受试者将获得新的受试者编号,并且需要重复所有筛检程序(包括签署新的知情同意书)。在crf上应指出此受试者为重新筛检。
[1015]
对于合格受试者,所有信息必须记录在受试者的crf中。对于不满足合格准则的受试者,记录在crf中的最少信息如下:筛检日期、受试者编号和筛检失败的原因。
[1016]
注射日,第2次访视(第1天)
[1017]
在注射之前
[1018]
在注射otx-tki植入物之前,主要研究人员和研究工作人员必须确认受试者和研究眼睛的资格。
[1019]
将在注射otx-tki之前进行以下程序和评定:
[1020]
·
纳入和排除准则确认
[1021]
·
不良事件(注射前)
[1022]
·
伴随药物
[1023]
·
生命体征(脉搏率、血压和体温)
[1024]
·
bcva(etdrs)
[1025]
·
裂隙灯活组织镜检和外眼检查
[1026]
·
通过压平式(goldmann)压力测量术进行iop测量
[1027]
·
眼底扩张检查
[1028]
·
sd-oct
[1029]
·
眼部舒适度评分(将由受试者评定)(注射前)
[1030]
注意:所有检查皆需要对双眼进行。
[1031]
注射程序
[1032]
如以上所指出,在第2次访视、第1天的所有评定结束时,研究人员将确认受试者继续有资格参与研究且未经历任何方案定义的排除准则。
[1033]
受试者可仅有一只眼用otx-tki治疗。若两眼皆合格,则将选择具有更差bcva的眼睛作为研究眼睛。若两眼皆合格且两眼bcva相同,则研究人员将决定选择作为研究眼睛的眼睛。
[1034]
需要时,将依据研究人员的判断用局部疗法,例如局部或玻璃体内施用的疗法,而非全身疗法来治疗被指定为非研究眼睛(nse)的对侧眼睛。此应为护理标准,且在任何情况下皆不应将另一研究药物用于对侧眼睛。对侧眼睛不能用otx-tki治疗。nse的治疗在研究
持续时间内应保持一致。
[1035]
otx-tki仅供玻璃体内使用且应仅由在注射程序方面有经验的合格眼科医师施用。
[1036]
研究药物治疗将由研究人员根据研究参考手册中所描述和详述的程序施用。对于接受3次单独注射的第3组受试者,依据研究人员的判断,可在1至4周内间隔施用otx-tki植入物和抗vegf。
[1037]
注射后程序
[1038]
在注射otx-tki之后,应监测受试者的视敏度。在注射otx-tki后30至60分钟内:
[1039]
·
将抽取血浆样品以用于pk分析
[1040]
·
应监测受试者的升高iop。
[1041]
·
应监测受试者,直至iop稳定且《25mmhg。倘若iop持续升高,则研究人员应准备提供疗法。
[1042]
·
研究人员此时应观察视神经头,以验证注射后即刻时段的灌注情况。
[1043]
在退出访视之前,研究人员和研究工作人员应负责确保:
[1044]
·
视觉已稳定,并且iop稳定且《25mmhg
[1045]
·
注射后不良事件已记录在crf中
[1046]
·
研究人员已记录注射程序容易性(即,
‘
实用’);研究人员将玻璃体内植入物的注射容易程度分级为“容易”(1)、“中等”(2)或“困难”(3)
[1047]
·
指导受试者勿揉搓其眼睛,并且在其经历持续超过数小时的剧烈疼痛、眼睛发红、畏光、过度不适或视力丧失的情况下联系研究人员。
[1048]
·
指导受试者在注射otx-tki后次日通过电话联系研究工作人员的成员以评定其是否经历不良事件。也应告知受试者可能会要求其在第3天(第3次访视)之前便返回门诊。
[1049]
投药后随访安全性电话(第2天)
[1050]
研究工作人员中的合格成员将在注射程序次日给各受试者打电话,以评定受试者是否已经历不良事件。若疑似有不良事件,可能要求受试者在第3天(第3次访视)研究访视前便返回门诊。
[1051]
第3次随访(第3天 1天)
[1052]
将在注射otx-tki后第3天( 1天)进行第3次访视。在此次访视时,研究人员和研究工作人员将执行以下程序和评定:
[1053]
·
不良事件
[1054]
·
伴随药物
[1055]
·
眼部舒适度评分(将由受试者评定)
[1056]
·
bcva(etdrs)
[1057]
·
裂隙灯活组织镜检和外眼检查
[1058]
·
通过压平式(goldmann)压力测量术进行iop测量
[1059]
·
眼底扩张检查(包括记录otx-tki植入物的存在或不存在)
[1060]
·
sd-oct
[1061]
·
用于pk分析的血浆样品
[1062]
注意:对于第3组中依据研究人员的判断在1至4周内接受可能隔开的三次单独
otx-tki注射的受试者(600μg组),可在注射第三个即最后一个植入物的相同研究访视时获得用于药物动力学分析的第3天(第3次访视)样品(在注射第三个即最后一个otx-tki植入物后30至60分钟内,将抽取用于pk分析的血浆样品)。
[1063]
注意:所有检查皆需要对双眼进行。
[1064]
第4次随访(第7天
±
2天)
[1065]
将在注射otx-tki后第7天(
±
2天)进行第4次访视。在此次访视时,研究人员和研究工作人员将执行以下程序和评定:
[1066]
·
不良事件
[1067]
·
伴随药物
[1068]
·
眼部舒适度评分(将由受试者评定)
[1069]
·
bcva(etdrs)
[1070]
·
裂隙灯活组织镜检和外眼检查
[1071]
·
通过压平式(goldmann)压力测量术进行iop测量
[1072]
·
眼底扩张检查(包括记录otx-tki植入物的存在或不存在)
[1073]
·
sd-oct
[1074]
注意:所有检查皆需要对双眼进行。
[1075]
第5次随访(第14天
±
2天)
[1076]
将在注射otx-tki后第14天
±
2天进行第5次访视。在此次访视时,研究人员和研究工作人员将执行以下程序和评定:
[1077]
·
不良事件
[1078]
·
伴随药物
[1079]
·
生命体征(仅血压)
[1080]
·
眼部舒适度评分(将由受试者评定)
[1081]
·
bcva(etdrs)
[1082]
·
裂隙灯活组织镜检和外眼检查
[1083]
·
通过压平式(goldmann)压力测量术进行iop测量
[1084]
·
眼底扩张检查(包括记录otx-tki植入物的存在或不存在)
[1085]
·
sd-oct
[1086]
注意:所有检查皆需要对双眼进行。
[1087]
随访评定:第6次访视(第1个月
±
2天)、第7次访视(第2个月
±
3天),第9次访视(第4.5个月
±
3天)和第11次访视(第7.5个月
±
3天)
[1088]
在所述访视时,研究人员和研究工作人员将执行以下程序和评定:
[1089]
·
不良事件
[1090]
·
伴随药物
[1091]
·
眼部舒适度评分(将由受试者评定)
[1092]
·
bcva(etdrs)
[1093]
·
裂隙灯活组织镜检和外眼检查
[1094]
·
通过压平式(goldmann)压力测量术进行iop测量
[1095]
·
眼底扩张检查(包括记录otx-tki植入物的存在或不存在)
[1096]
·
sd-oct
[1097]
注意:所有检查皆需要对双眼进行。将对已连续两次错过经期的所有有生育潜能的女性进行妊娠试验。
[1098]
第8次随访(第3个月
±
3天)和第10次访视(第6个月
±
3天)
[1099]
将在注射otx-tki后3个月
±
3天进行第8次访视,并且将在6个月
±
3天进行第10次访视。在此次访视时,研究人员和研究工作人员将执行以下程序和评定:
[1100]
·
不良事件
[1101]
·
伴随药物
[1102]
·
眼部舒适度评分(将由受试者评定)
[1103]
·
生命体征(仅血压)
[1104]
·
bcva(etdrs)
[1105]
·
裂隙灯活组织镜检和外眼检查
[1106]
·
通过压平式(goldmann)压力测量术进行iop测量
[1107]
·
眼底扩张检查,包括眼底成像和记录otx-tki植入物的存在或不存在
[1108]
·
sd-oct
[1109]
·
oct-a
[1110]
·
用于pk分析的血浆样品(仅在第8次访视时)
[1111]
·
安全性实验室测试
[1112]
·
另外,仅在第10次访视(第6个月)时:
[1113]
·
荧光素血管摄影术
[1114]
·
尿液妊娠试验:若女性有生育潜能,则自筛检至研究结束,受试者在注射植入物后必须利用两种形式适当避孕且尿液妊娠试验呈阴性
[1115]
注意:所有检查皆需要对双眼进行。在第8次访视(第3个月)时,将对已连续两次错过经期的所有有生育潜能的女性进行妊娠试验。
[1116]
最终第12次随访(第9个月
±
3天)
[1117]
此为最终随访,不包括跟踪未消退或稳定的ae可能需要的任何计划外访视。此访视将在注射otx-tki之后9个月(
±
3天)进行。在此次访视时,研究人员应确认otx-tki植入物在检查时不再可见。若植入物仍可见,则应对受试者大致每月随访一次,直至植入物不再可见。依据研究人员的判断,应对第9个月仍有生物学活性证据的受试者每月随访一次,直至cnv渗漏已恢复基线水平或直至研究人员认为受试者已临床稳定。
[1118]
将进行所有以下程序和评定:
[1119]
·
不良事件评定
[1120]
·
伴随药物
[1121]
·
眼部舒适度评分(将由受试者评定)
[1122]
·
生命体征(仅血压)
[1123]
·
心电图(附录g)
[1124]
·
bcva(etdrs)
[1125]
·
裂隙灯活组织镜检和外眼检查
[1126]
·
通过压平式(goldmann)压力测量术进行iop测量
[1127]
·
眼底扩张检查,包括眼底成像和记录otx-tki植入物的存在或不存在
[1128]
·
sd-oct
[1129]
·
oct-a
[1130]
·
荧光素血管摄影术
[1131]
·
安全性实验室测试
[1132]
·
尿液妊娠试验:若女性有生育潜能,则自筛检至研究结束,受试者在注射植入物后必须利用两种形式适当避孕且尿液妊娠试验呈阴性
[1133]
注意:所有检查皆需要对双眼进行。
[1134]
计划外访视
[1135]
在研究人员判定有必要在研究访视窗口以外查看受试者的任何时间皆可能进行计划外访视。依据研究人员的判断,对于接受3次单独注射的第3组受试者,可使用计划外访视来将在1至4周内进行的otx-tki植入物和抗vegf的施用隔开。可视需要安排多次这些访视。任何计划外访视皆将与访视原因一起记录在“计划外”访视crf上。
[1136]
检查和评定由研究人员基于访视的原因作出判断。计划外访视时可进行所有检查和评定,包括以下列出者:
[1137]
·
不良事件评定
[1138]
·
伴随药物
[1139]
·
眼部舒适度评分(将由受试者评定)
[1140]
·
bcva(etdrs)
[1141]
·
裂隙灯活组织镜检和外眼检查
[1142]
·
通过压平式(goldmann)压力测量术进行iop测量
[1143]
·
眼底扩张检查(包括记录otx-tki植入物的存在或不存在)
[1144]
不良事件
[1145]
在整个研究过程中,将尽一切努力对可能的ae或不良发现保持警惕。若ae发生,则首先考虑受试者的安全性和福祉。应进行适当医疗干预。研究人员或研究工作人员观测或受试者报告的任何ae,无论是否归因于研究治疗,皆应记录在受试者的不良事件crf上。
[1146]
应就医师观测或受试者报告的任何病征或症状的性质、发作日期、结束日期、严重程度、与研究药物的关系、所采取的行动、严重性和结果进行关于ae的记录。
[1147]
不良事件的定义
[1148]
ae为在施用药物产品的患者或临床研究受试者中的任何不良医疗事件,且未必与治疗有因果关系。
[1149]
因此,ae可为在时间上与使用医学(研究)产品相关的任何不适宜和不希望的征象(包括异常实验室发现)、症状或疾病,无论是否与医学(研究)产品有关。
[1150]
严重不良事件(sae)的定义
[1151]
sae为在任何剂量下发生以下情况的任何不良医疗事件:
[1152]
·
导致死亡
[1153]
·
危及生命
[1154]
ο术语“危及生命”是指在事件发生时受试者有死亡风险的事件;其并非是指假定在其更严重时可能导致死亡的事件
[1155]
·
要求住院患者住院治疗或延长现有住院治疗
[1156]
·
导致永久性或重大失能/无能
[1157]
·
为先天性异常/出生缺陷
[1158]
在决定其他情况是否应被视为sae时,应做出医学和科学判断,诸如可能不会立即危及生命或导致死亡或住院但可能危害受试者或可能需要干预以预防以上所列出的其他结果之一的重大医疗事件。
[1159]
此种事件的实例为在急诊室或在家中对不会导致住院的过敏性支气管痉挛、血液恶液质、赘瘤或抽搐的强化治疗。
[1160]
评定为
‘
重度’的ae不应与sae混淆。术语“重度”通常用于描述特定事件的强度(即,严重程度)(如轻度、中度或重度心肌梗塞);然而,事件本身可能具有相对次要的医学重要性(诸如重度头痛)。此与“严重”不同,“严重”是基于通常与对生命或功能造成威胁的事件相关的结果或作用标准。严重性(并非严重程度)和因果性充当定义监管报告义务的指南。
[1161]
严重程度
[1162]
ae的严重程度定义为对如由研究人员确定或由受试者向研究人员报告的ae的强度程度的定性评定。在不考虑与研究药物的关系或事件的严重性的情况下进行严重程度评定,且应根据以下标度进行评估:
[1163]
·
轻度事件对受试者而言值得注意,但容易耐受且不干扰受试者的日常活动
[1164]
·
中度事件造成困扰,可能需要额外治疗,且可能干扰受试者的日常活动
[1165]
·
重度事件不可耐受,有必要进行额外治疗或改变疗法,并且干扰受试者的日常活动
[1166]
对于强度改变的ae,应记录各强度的开始和停止日期。
[1167]
与玻璃体内植入物、程序或研究药物的关系
[1168]
对于各(s)ae,研究人员必须确定所述事件是否与研究药物、注射程序或玻璃体内植入物有关。为此,研究人员必须基于其医学判断确定是否有所述事件可能由研究药物、注射程序或玻璃体内植入物引起的合理可能性。
[1169]
以下为研究人员在评定(s)ae的因果关系时用作指南的指导方针。将在crf中确定与注射程序、玻璃体内植入物或研究药物的因果关系的归属。
[1170]
·
无疑似关系此类别适用于经仔细考虑后为清楚且无可争议地归于外部原因(疾病、环境等)的那些(s)ae;不存在(s)ae可能由研究药物、注射程序或玻璃体内植入物引起的合理可能性
[1171]
·
疑似关系在考虑包括此类别中的(s)ae时将应用以下准则:
[1172]
1)其与注射程序或玻璃体内植入物或研究药物的存在有合理时间关系。
[1173]
2)其无法通过受试者临床状态、环境或毒性因素或其他因素(例如,正在研究的疾病、并发疾病和伴随用药)的已知特征和疗法施用受试者的模式来合理地解释
[1174]
3)其在移除玻璃体内植入物后消失或减轻
[1175]
4)其遵循对注射程序或玻璃体内植入物或研究药物的已知反应模式。
[1176]
在尚未确定或未知ae与注射程序或玻璃体内植入物的因果关系时,出于监管报告的目的,将ae处理为疑似关系。
[1177]
疑似ae为有研究药物引起ae的合理可能性的任何事件。“合理可能性”意谓有证据表明研究药物与ae之间有因果关系。将表明研究药物与ae之间有因果关系的证据类型包括:单次发生罕见且已知与药物暴露密切相关的事件;一或多次发生通常与药物暴露不相关但在暴露于药物的群体中罕见的事件(例如,肌腱断裂);对临床试验中观测到的特定事件(诸如,潜在疾病或研究中疾病的已知后果或通常发生在研究群体中的与药物治疗无关的其他事件)的综合分析指示那些事件在药物治疗组中的发生频率高于同期或历史对照组。
[1178]
预期性
[1179]
应使用这些指导方针基于关于研究药物的现有安全性信息来确定(s)ae的预期性:
[1180]
·
非预期:或在研究方案、ib或阿西替尼注册调配物的处方信息中未列出,或未以已观测到的特异性或严重程度列出的ae
[1181]
·
预期:研究方案、ib或阿西替尼的处方信息中以已观测到的特异性和严重程度列出的ae
[1182]
ib中提及随一类药物发生或因药物的药理学性质而预见到但未明确提及随研究中的特定药物发生的ae被视为预期的。
[1183]
研究人员应对ae的预期性进行初步分类,但最终分类服从医疗监管机构的决定。
[1184]
说明
[1185]
住院治疗
[1186]
为了选择性治疗研究过程中未恶化的既有疾患(即,受试者签署知情同意书之前存在的疾患)的住院治疗不被视为sae。住院期间出现的并发症为ae。若并发症延长住院治疗,或满足任何其他sae标准,则并发症为sae。
[1187]
既有疾患
[1188]
在研究期间恶化的既有疾患(即,在研究开始时存在或侦测到的疾患)、既有疾患恶化或者既有发作事件或疾患的频率或强度增加为(s)ae。未恶化的既有疾患相对于基线的预期日常波动不为(s)ae。
[1189]
湿性amd恶化或进展被视为“缺乏效力”或“预期药理作用失败”符合方案,并且已记录为效力评定的一部分,因此不需要记录为(s)ae。然而,若研究人员认为满足(s)ae的定义,则由缺乏效力导致的病征和症状和/或临床后遗症可报告为(s)ae。
[1190]
医疗或手术程序
[1191]
医疗或手术程序(例如结肠镜检查)不为(s)ae;然而,引起所述程序的疾患可被视为(s)ae。
[1192]
在针对研究期间未恶化的既有疾患(即,受试者签署知情同意书之前存在的疾患)进行选择性医疗或手术程序或者研究前计划医疗或手术程序的情况下,引起所述程序的疾患不需要报告为(s)ae。
[1193]
死亡
[1194]
死亡不为sae;导致死亡的疾患是sae。
[1195]
异常实验室值
[1196]
在不存在诊断时,被研究人员判断为临床显著的的异常实验室值必须记录为(s)
ae。存在于基线处且在研究开始后显著恶化的临床显著的异常实验室发现也将报告为(s)ae。
[1197]
报告不良事件的程序
[1198]
应irb/iec、当地法规和主管卫生部门的要求,向ocular therapeutix和irb报告所有“疑似”和“意外”ae。
[1199]
不考虑严重程度或与研究药物或玻璃体内植入物的关系,自受试者签署知情同意书开始,在此研究过程中观测到的所有ae皆将记录在适当的crf上。在可能的程度上,应记录和报告的事件为事件诊断,而非事件症状。
[1200]
任何严重不良事件或任何危及视力的重度ae,无论归因于研究治疗与否,皆应在24小时内通过电话传达给ocular therapeutix或其指定人员。研究人员必须自协助受试者治疗和随访的同事获取所有相关医疗记录、信息和医学判断并保存在其档案中;向ocular therapeutix或其指定人员提供完整病历,其中包括关于事件是否疑似与使用研究药物有关的陈述;并且在关于报告sae的irb/iec指导方针内将ae告知irb/iec。由研究人员签署的详述事件的书面报告应在5个工作日内提交至资助方或其指定人员。必须对所有经历sae的受试者随访直至事件消退或稳定,并且在crf中报告结果。
[1201]
不良事件随访类型和持续时间
[1202]
将对ae进行随访,直至:
[1203]
·
事件消退,即,恢复至基线值或状态或至
‘
正常’[1204]
ο可确定ae已完全消退或消退后有后遗症
[1205]
·
对于未结束的事件(例如转移),调查人员确定为慢性疾患;所述事件可确定为消退或消退后有后遗症
[1206]
·
事件已稳定,即,研究人员预期不会恶化。所有ae皆将记录在crf中。
[1207]
对于达到最终计划访视(即,第12次访视[第9个月])的受试者,此后可进行计划外访视,以便对研究人员认为尚未消退或稳定的任何ae进行随访。
[1208]
剂量递增准则和终止准则
[1209]
由于人类对otx-tki植入物的经验有限,因此第1组中的第一受试者将在研究眼睛中接受otx-tki植入物,随后对任何其他受试者进行治疗
[1210]
一旦已评估第1组中的第一受试者达2周并且若mm支持继续,则将对第1组中的其他5名受试者进行治疗。
[1211]
将仅在以下情况之后对第2组中的试者进行治疗:
[1212]
1.第1组中的所有受试者皆已接受otx-tki植入物,并且已随访至少2周
[1213]
2.确认不超过1/6名受试者经历dlt
[1214]
3.dsmc完成对所有可利用临床资料的安全性审查,并建议剂量递增。
[1215]
若第1组、第2组或第3a组中鉴定一个dlt,则将继续招募直至所述群组已全部参与。若第1组或第2组中发现第二dlt,则将终止参与。若第3a组中发现第二dlt,则将终止所述组招募,且将宣告先前较低剂量为mtd。
[1216]
将遵循方案对决定终止研究招募前给药的所有受试者继续随访。mm将基于dsmc的建议决定终止特定群组的进一步招募。
[1217]
可批准终止进一步招募的特定dlt包括(但不限于):
[1218]
·
眼部发炎4 或眼部发炎2-3 ,在发作30天内不降至≤1
[1219]
·
由于研究药物之故,连续多次访视时与治疗前相比bcva降低》15个字母
[1220]
·
iop增加》10mmhg或iop》30mmhg,在治疗7天内不返回注射前水平
[1221]
统计方法
[1222]
统计和分析计划
[1223]
此研究并非旨在显示统计显著性,因此,不会完成统计分析。将会有简要汇总如何呈现资料的通用统计计划,即,描述性统计等。
[1224]
样品大小的确定
[1225]
对于此i期研究,尚未进行正式样品大小计算。所述研究将在第一组中招募多达6名受试者,并且将由dsmc对累积资料进行审查,随后继续招募第二组。第二组多达8名受试者已入组之后,dsmc和mm将审查累积资料,并且为将招募多达12名受试者的第3组提供关于剂量递增和继续的建议。
[1226]
分析资料集
[1227]
安全性群体将由接受otx-tki植入物的所有受试者组成。将对安全性群体进行所有安全性和效力分析。
[1228]
人口统计资料和基线资料
[1229]
将呈现受试者处置,包括筛检、招募和治疗的受试者数目。将汇总完成研究的受试者数目和中止原因。资料将依据群组和总体提供。
[1230]
将汇总人口统计和基线特征(包括疾病和医疗史)。资料将依据群组和总体提供。
[1231]
安全性分析
[1232]
将通过眼部和全身不良事件、眼部舒适度评分评定和其他眼部相关结果来评定安全性。
[1233]
不良事件将使用药事管理医学字典(meddra)依据系统器官类别和优先项进行编码。将对于与研究药物、注射程序和otx-tki植入物有关的不良事件进行分开汇总。另外,将汇总严重不良事件。
[1234]
将提供其他安全性相关结果的汇总。所有安全性资料皆依据群组和总体提供。
[1235]
效力分析
[1236]
将通过csft相对于基线的平均变化、bcva相对于基线的平均变化、具有临床显著的渗漏变化的受试者的百分比、csft降低≥50μm的受试者的百分比、具有srf、irf和srf与irf二者的受试者的百分比,以及需要救援疗法的受试者的百分比来评定效力。将按治疗组和总体呈现资料。
[1237]
药物动力学资料
[1238]
将在各时间点汇总如在血液样品中所测量的全身otx-tki暴露。将按治疗组和总体来汇总血浆浓度和药物动力学参数。测量浓度和药物动力学参数将呈现于资料清单中。
[1239]
缩写
[1240]
用于描述研究细节的缩写的列表:
[1241]
[1242][1243]
研究方案附录
[1244]
附录a:时间和事件时间表
[1245]
[1246]
[1247]
[1248]
[1249]
[1250][1251]
a:对于任何计划外访视,研究人员应基于计划外访视的原因来确定需要进行的评定;并非所有评定皆需要执行(关于所需评定的清单,参见8.12部分)。
[1252]
b:将在注射后30至60分钟监测受试者(关于注射后监测的细节,参见8.5部分);对于第3组,可依据研究人员的判断在1至4周内间隔注射otx-tki植入物和抗vegf。
[1253]
c:生命体征将涵盖仅在第1次访视和第2次访视时评定血压、脉搏率和体温。在所有其他访视时,将仅进行血压测量。
[1254]
d:安全性实验室评定包括:cbc、chem-7、lft和tft。
[1255]
e:眼部舒适度评分将在第2次访视(第1天)时在otx-tki注射前由受试者评定。
[1256]
f:将在筛检/基线访视(第-14天至第0天)、第10次访视、第12次访视时对所有有生育潜能的女性以及在任何时间对连续2次错过经期的受试者进行妊娠试验。
[1257]
g:第2次访视(第1天)时在otx-tki注射后30至60分钟进行血浆样品pk。
[1258]
h:对于第3组中依据研究人员的判断在1至4周内接受可能隔开的三次单独otx-tki注射的受试者(600μg组),可在注射第三个即最后一个植入物的相同研究访视时获得用于药物动力学分析的第3天(第3次访视)样品(在注射第三个即最后一个otx-tki植入物后30至60分钟内,将抽取用于pk分析的血浆样品)。
[1259]
附录b:眼部舒适度评分(将由受试者评定)
[1260]
将通过询问受试者以下问题来要求其对其舒适程度进行分级:“按0至10的标度,0为非常舒适而10为非常不适,此时您眼睛的舒适程度如何?”[1261]
检查人员将在适当crf上记录由受试者在全部数值中选择的数值。
[1262]
附录c:最佳矫正视敏度(bcva)的推荐程序
[1263]
应在各研究访视开始时评估视敏度,随后进行其他测试,诸如goldmann压力测量术和前房角镜检查,随后为瞳孔扩张。在整个研究时段中,应尽一切努力利用同一bcva评定员。应以最近的矫正开始进行视敏度测试。
[1264]
bcva应使用诸如precision vision或等效机构的背光式etdrs表来测量。建议现场使用背光式、壁挂式或脚轮直立式etdrs距离视力表,其亮度为85cd/m2,设置在距受试者4米处。将使用设定在12.0mm顶距的试验镜架或验光仪来获得显性折射测量值。若有可能,
将使用试验镜片集在4米处对球体进行最终精化。
[1265]
视力表
[1266]
所有远距离视敏度测量皆使用设定在距受试者4米处的照明灯箱(或等效物)进行。将根据针对1米测试所提供的说明书在1米处对在4米处不能读出etdrs表上至少20个或更多个字母的任何受试者进行测试。应周期性检查灯箱中的荧光管以确保其正常工作。
[1267]
应作出最大努力以识别所述表上的各字母。当受试者称其不能读出字母时,应鼓励其猜测。若受试者将一个字母识别为两个字母之一,则应要求其选择一个字母且必要时进行猜测。当明显无法给出其他有意义读数时,尽管鼓励读取或猜测,但检查人员将终止测试所述眼。然而,应尝试最后一行上的所有字母,因为字母难度变化且最后一个可能为惟一被正确读出的字母。应指出缺失或未正确读出的字母的数目。
[1268]
logmar视敏度计算
[1269]
字母被正确读出的最后一行将作为基础logmar读数。将此值加上数字“n x 0.02”,其中
‘
n’表示直至且包括最后一行读数所缺失的字母的总数。此总和表示所述眼睛的logmar视敏度。
[1270]
举例来说:受试者正确读出0.2行上5个字母中的4个和0.1行上5个字母中的2个。
[1271]
基础logmar=0.1n(0.2行以及0.1行上不正确字母的总数)=4n x t(t=0.02)=0.08基础logmar (n x t)=0.1 0.08logmar va=0.18
[1272]
bcva检查将自右眼(od)开始。将对左眼(os)重复所述程序。
[1273]
1米测试
[1274]
受试者必须坐下以进行1米测试。在此测试期间,避免任何头部向前或向后移动尤为重要。
[1275]
附录d:裂隙灯活组织镜检检查
[1276]
将在暗室中使用最高灯电压、0.3mm孔径、30度照射角和16倍放大率来评定裂隙束观测结果。
[1277]
临床医生将使用裂隙灯将以下各项评定为正常、异常临床显著或异常临床不显著:
[1278]
·
外部附件-存在或不存在眼睑红斑、水肿或其他异常,评估睫毛是否有鳞屑或其他异常
[1279]
·
结膜-存在或不存在水肿、红斑或其他异常
[1280]
·
虹膜-存在或不存在基质或其他异常
[1281]
·
角膜-澄清、存在或不存在浅表性点状角膜病变或其他异常,辅以荧光素染色
[1282]
·
前房-形成深度适当性、细胞评分和耀斑计数
[1283]
·
晶状体-存在或不存在白内障,和混浊严重程度、存在或不存在假晶状体
[1284]
对于任何异常观测结果,将在crf上提供说明/注解。若观测到角膜水肿,则应添加关于其为总体性还是局部性的注释。
[1285]
前房细胞和耀斑
[1286]
将如下进行前房细胞评定:
[1287]
·
低环境照明
[1288]
·
1x1mm裂隙光束
[1289]
·
最高裂隙灯电压
[1290]
·
45度照射角
[1291]
·
高倍放大率
[1292]
将检查前房是否存在眼部发炎征象。前房细胞计数和耀斑将使用sun*工作组分级方案进行分级:尽管在sun工作组分级方案中将前房细胞等级“0”报告为“《1个细胞”,但此研究中将其表征为场中存在0个细胞。
[1293]
若见到少于16个细胞,则将前房细胞计数评定为在以上所描述的1.0mm高x1.0mm宽裂隙束内计数的实际细胞数目。将仅对白血球进行计数。(红血球和色素细胞将不计在内)。依据以下标度计数的细胞数目和相应等级皆将记录在crf中。
[1294][1295]
*葡萄膜炎标准化命名(sun)1[1296]
若存在前房积脓,则将在原始文件和ecrf中注明。
[1297]
___________________________________________________________
[1298]
1jabs da,nussenblatt rb,rosenbaum jt.standardization of uveitis nomenclature(sun)working group.standardization of uveitis nomenclature for reporting clinical data.results of the first international workshop.am j ophthalmol.2005sep;140(3):509-16.
[1299]
附录e:iop测量
[1300]
若使用适当技术,则作为压力测量术国际金标准的goldmann压力测量术相当准确且可再现。当进行goldmann压力测量术时,将遵循以下程序:
[1301]
1.压力测量术前程序:将眼压计设定在正确位置,并确保棱镜在裂隙灯上处于水平位置。张力设定在1mmhg。使用裂隙光束开放程度最大的钴滤光片,照明与显微镜之间的角度在大约60度。
[1302]
2.滴注一滴局部麻醉剂且润湿的荧光素试条可稍微触碰各眼的下眼睑的睑板结
膜,注意勿用荧光素染料淹没眼表面。另选地,可将一滴局部麻醉剂-荧光素(例如fluress)溶液滴入各眼的下结膜穹,注意勿用荧光素染料淹没眼表面。要求受试者紧临压力测量术前眨眼数次。
[1303]
3.将受试者安置在可调节椅上,使下巴可舒适地安放在裂隙灯下巴托上,且前额可贴在前额挡板上。
[1304]
4.在受试者直视前方时将眼压计施加至受试者的眼睛,并增大压平力,直至观测者看见两个荧光素半圆的内部部分相接触。将压力记录在crf上。
[1305]
附录f:眼底扩张检查
[1306]
将使用间接检眼镜检查进行评定。将对以下各项进行评估并记录为正常、异常临床显著或异常临床不显著:
[1307]
·
玻璃体:当检查玻璃体时,研究人员也将记录黄斑、外周视网膜、脉络膜和视神经上otx-tki植入物的存在或不存在。
[1308]
也将测量视杯与视盘(c/d)比率。对于任何异常病变,将在crf上提供说明/注解。
[1309]
将使用以下标度定义玻璃体混浊程度2:
[1310][1311]
___________________________________________________________
[1312]
2nussenblatt rb,palestine ag,chan cc,roberge f.standardization of vitreal inflammatory activity in intermediate and posterior uveitis.ophthalmology 92:467-471,1985.
[1313]
附录g:心电图(ecg)
[1314]
12导联ecg
[1315]
在筛检阶段期间将进行12导联ecg。将在受试者仰卧大约3分钟之后进行ecg。现场将使用自有本地ecg机器用于研究,且研究人员(或受委托的合格指定人员)将通过临床关联受试者的疾患来解读ecg读数。
[1316]
研究人员的解读将在ecg ecrf中记录为:正常;异常,临床不显著;或异常,临床显著。结果必须在正常界限内或临床不显著,以允许受试者继续进行研究。
[1317]
实施例6.3:初步研究结果
[1318]
在人类受试者中进行初步研究,如下:招募患有新血管性年龄相关性黄斑退化的受试者(namd,未接受过治疗和有抗vegf治疗史者),以便在单一研究眼中施用本发明的水凝胶。两组皆完成招募且正在评估中:含200μg阿西替尼的7.5% peg水凝胶(由2份4a20k peg-saz与1份8a20k peg胺形成),其中7.5%表示peg重量除以流体重量x100(1个植入物;n=6)和400μg阿西替尼(2个植入物;n=7)。在基线时使用谱域光学相干断层扫描(sd-oct)
成像评定视网膜液和中心子场厚度(csft)。在第3、7和14天以及第1、2、3、4.5、6、7.5、9个月且大致每月一次进行注射访视,直至植入物不再可见为止。在每次访视时观测本发明的植入物。安全性评估包括:不良事件收集、生命体征、最佳矫正视敏度(bcva)、裂隙灯活组织镜检、压力测量术、间接和直接检眼镜检查以及安全性实验室。
[1319]
在400μg群组中,截至2个月时观测到中心子场厚度(csft)平均降低89.8
±
22.5μm(平均值
±
sem),且通常维持至3个月时间点(随访正在进行中)。对于有抗vegf治疗史的若干受试者,抗vegf治疗的持久性在200μg组中延长至》9个月且在400μg组中延长至》3个月(随访正在进行中)。维持最佳矫正视敏度(bcva),未报告严重眼部不良事件。研究眼睛中观测到的最常见不良事件包括植入物注射后微小色素性角膜沉淀物(3/13)、视网膜下出血(2/13)和结膜下出血(3/13)和疼痛(2/13)。在200μg组中,植入物在玻璃体中展现极少移动且在9至10.5个月后不再可见。
[1320]
本发明植入物一般被良好耐受,具有良好安全性概况。在长达10.5个月时,观测到植入物的最低程度移动和持续再吸收。
[1321]
利用200μg(1个植入物)和400μg(2个植入物)阿西替尼剂量的这些初始研究和利用600μg(3个植入物)阿西替尼剂量以及400μg(2个植入物)阿西替尼剂量同时施用抗vegf剂的其他研究继续进行的详细结果详细报告于实施例6.4中。
[1322]
实施例6.4:研究的综合结果
[1323]
对200和400μg阿西替尼剂量的评估
[1324]
如以上再现的研究方案中所解释,第1组(n=6)的参与者每位患者在一只眼睛中接受一个包含200μg阿西替尼剂量的植入物,且第2组(n=7)的参与者每位患者在一只眼睛中接受两个各自包含200μg阿西替尼剂量的植入物,产生400μg总剂量/眼。使用27g针头经玻璃体内施用植入物。即使在水合状态下,植入物由于其紧凑尺寸和形状也不会造成视觉影响。第2组的患者在同一天接受两个植入物,但第2号受试者隔1周接受植入物。关于此研究中所使用的200μg植入物的配方细节和尺寸,参见表21.1(第1号植入物)。呈现关于第1组和第2组中迄今招募并分析的所有受试者的中心子场厚度(csft)和最佳矫正视敏度(bcva)的汇总资料的概述图表分别提供于图17和图18中。另外,为了例示性地说明第1组和第2组的受试者的csft和bcva的过程,本文中更详细地论述某些特定受试者,并且将显示这些受试者在例示性访视时的csft和bcva的图像提供于图中。论述这些例示性受试者以说明参与研究但为奇异受试者的受试者/患者的csft和bcva测量和发展。关于第1组和第2组的所有受试者的csft和bcva的平均变化,参见图17和图18。关于图17和图18,随访第1组中的六位患者直至第9个月。对第2组中的七名患者随访直至第12个月,五名直至第14个月,且两名直至第16个月。
[1325]
第1组和第2组中31%(4/13)患者为女性,69%(9/13)为男性,中值年龄为75.2岁(标准偏差,sd:4.5),其中最年轻患者为67岁且最年长患者为83岁。两组的参与者先前皆用抗vegf治疗剂(诸如雷尼珠单抗或阿柏西普)治疗或未治疗过。第1组和第2组的受试者的概述进一步提供于表22中。第1组中6名治疗受试者的基线csft为680
±
159μm(平均值
±
se),且基线bcva(snellen当量)为0.73
±
0.26(平均值
±
se)。第2组中7名治疗受试者的基线csft为450
±
29μm(平均值
±
se),且基线bcva(snellen当量)为0.47
±
0.17(平均值
±
se)。
[1326]
表22来自两个群组(第1组和第2组)的受试者的概述。呈现年龄、性别(男性m、女性
f)以及先前治疗和研究眼睛。关于研究眼睛(右眼(od)或左眼(os)),治疗前bcva以logmar(最小角度分辨率对数)和snellen当量形式提供。自edts字母评分转换至logmar值和snellen当量的转换表可见于beck等人,am j ophthalmol 2003,135:194-205中。另外,呈现治疗前csft。所有治疗前结果皆来自研究的第1天,但第1组中受试者3、4和5的资料取自筛检访视。
[1327][1328]
在治疗前(基线值-第1天)、第3天、第7天和第14天以及第1个月、第2个月、第3个月、第4.5个月、第6个月、第7.5个月、第9个月、第10.5个月、第11个月、第12个月、第13.5个月、第14天个月和/或第15.5月通过谱域光学相干断层扫描(sd-oct)评估参与者的中心子场厚度(csft)和视网膜液变化、最佳矫正视敏度(bcva)和使用荧光素血管摄影术(fa)和/或oct评估临床显著的渗漏,并且对于仍在研究中的受试者,大致每月一次,直至植入物不再可见。另外,在研究访视时进行裂隙灯活组织镜检、压力测量术(用于测量iop)以及间接和直接检眼镜检查。在所有研究访视时皆监测患者的不良事件。
[1329]
生物降解
[1330]
植入物在玻璃体中展现极少移动。一般而言,在两个群组中,植入物在9至12个月之后不再可见。图15例示性地显示第2组的第1号受试者的ir图像。
[1331]
视觉质量和中心子场厚度
[1332]
一般而言,在9个月研究持续时间内对第1组的受试者未观测平均csft显著增加(图17)。在第1组的一些受试者中,在200μg剂量下观测到csft降低。第1组的第1号受试者
(未治疗过)显示研究眼睛的csft自1252μm(第1天基线值)显著降至936μm(10.5个月之后),同时研究眼睛的视敏度(是指视觉清晰度)未被削弱(图16)。在第1号受试者的整个研究持续时间(10.5个月)内无需任何救援疗法。在第1组患者中,平均视敏度(bcva)未被显著削弱(图18),意谓bcva仍在距基线(在施用植入物之前测定)15个etdrs字母以内。
[1333]
在14个月内,第2组的受试者的平均中心子场厚度(csft)有所降低(图17)。此外,第2组的患者的平均视敏度(bcva)未被显著削弱(图18)。
[1334]
图19a和图19b以及图20例示性地显示第2组的两名受试者的sd-oct评估的图像。第2组中的第1号受试者在右眼(右眼,od)中注射阿西替尼植入物之前已用阿柏西普治疗超过一年(16个月)。基线时(治疗前)视网膜下液清晰可见。重要的是,在植入物注射之后2至3个月之后,视网膜下液消失,且此阶段在整个15.5个月研究持续时间内在无救援疗法的情况下基本上得以维持(图19a和图19b)。直至第12.5个月为止,可见两个植入物,此后可见一个植入物。第2组的第7号受试者在植入物施用之前已用阿柏西普治疗6年。在无救援疗法的情况下,截至第9个月,csft有效地自335μm基线降低(例如,第9个月时csft为271μm)(图20)。在第10个月时,csft开始再次增大。直至第12个月为止,存在两个植入物。随访正在进行中。
[1335]
总之,临床资料显示在某些受试者中,植入物在眼中的效力和持久性长达约或甚至超过14个月。未曾预料到这些观测结果。在体外即时释放实验中,大约8个月之后释放全部阿西替尼剂量(参见图14a)。
[1336]
血浆浓度
[1337]
阿西替尼的血浆浓度在所有受试者中、在所有样品时间点皆低于定量下限(lloq《0.1ng/ml),指示施用植入物并未引起全身药物暴露。此进一步验证本技术的阿西替尼植入物的总体安全性。
[1338]
耐受性和不良事件
[1339]
一般而言,治疗为安全的且被良好耐受。对于大部分受试者,注射过程并不复杂。在整个研究持续时间中,fa和oct皆未显示任何受试者的临床显著的渗漏。在研究持续时间内,与剂量无关,所有受试者的iop皆正常。对任何受试者皆未观测到发炎。受试者不需要眼用类固醇。
[1340]
所有报告不良事件皆为轻度至中度,未报告重度不良事件或重度眼部不良事件(表23)。
[1341]
表23第1组和第2组报告的不良事件。
[1342][1343][1344]
在研究眼睛中观测到的不良事件包括微小色素性角膜沉淀物(3/13)、注射后结膜下出血(3/13)和注射后疼痛(2/13)。重要的是,仅报告3个疑似与研究产品有关的不良事件。举例来说,一位患者的植入物周围有不透明物,一位患者有玻璃体漂浮物,三位患者有微小色素性角膜沉淀物(无需治疗),且一位有外来物质(纤维和反射性粒子)。其他具体不良事件列出于以下表2)中。
[1345]
表24针对第1组和第2组的研究眼睛报告的具体不良事件。
[1346][1347][1348]
总之,本发明的阿西替尼植入物为安全的且被良好耐受。对比施用植入物之前测定的基线,植入物显示有效降低或显示基本上维持csft。
[1349]
评估600μg阿西替尼剂量和400μg阿西替尼剂量与抗vegf共同施用
[1350]
为了进一步探索植入物在人类中的效力,正在进行进一步临床研究,其中一个群组(第3a组)的受试者罹患湿性amd(计划n=6),接受三个200μg植入物(表21.1,第1号植入物),单独注射,使得每眼的总阿西替尼剂量为600μg,以及另一群组(第3b组),受试者罹患湿性amd(计划:n=6),接受两个200μg植入物(表21.1,第1号植入物),单独注射,使得每眼的总阿西替尼剂量为400μg,并且另外接受单次抗vegf注射(avastin或),在与置放植入物相同的时段施用。对每位的一只眼睛进行治疗。
[1351]
对于第3a组,所有6名受试者皆已开始治疗且当前正在治疗,对于第3b组,计划数目的6名受试者中有2名受试者已开始治疗且当前正在治疗。当前治疗的8名受试者中有两名为女性,6名为男性。第3组中当前治疗的8名受试者的基线csft为518
±
53μm(平均值
±
se),且基线bcva(snellen当量)为0.88
±
0.12(平均值
±
se)。一般而言,植入物在玻璃体中展现有限移动。表25提供第3a组和第3b组中迄今招募的受试者的概述。呈现关于第3a组和
第3b组中迄今招募并分析的所有受试者的中心子场厚度(csft)和最佳矫正视敏度(bcva)的汇总资料的概述图表分别提供于图17和图18中。另外,为了例示性地说明第3a组和第3b组的受试者的csft和bcva的过程,本文中更详细地论述某些特定受试者,并且将显示这些受试者在例示性访视时的csft和bcva的图像提供于图中。论述这些例示性受试者以说明参与研究但为奇异受试者的受试者/患者的csft和bcva测量和发展。关于第3a组和第3b组的所有受试者的csft和bcva的平均变化,参见图17和图18。关于这些图17和图18中的图表:对第3a组中的六名患者随访直至第14天,五名直至第2个月,两名直至第4.5个月且一名直至第6个月和第7.5个月。对第3b组中的两名患者随访直至第3个月,且一名直至第4.5个月。随访正在进行中。
[1352]
表25来自两个群组(第3a组和第3b组)的受试者的概述。呈现年龄、性别(男性m、女性f)以及先前治疗和研究眼睛。关于研究眼睛(右眼(od)或左眼(os)),治疗前bcva以logmar(最小角度分辨率对数)和snellen当量形式提供。自edts字母评分转换至logmar值和snellen当量的转换表可见于beck等人,am j ophthalmol 2003,135:194-205中。另外,呈现治疗前csft。所有治疗前结果皆来自研究第1天。
[1353][1354]
视觉质量和中心子场厚度
[1355]
第3a组(3x200μg植入物)的第一位患者为79岁男性,其未进行过amd治疗。注射过程不复杂。在一周内(第1天(基线)和第7天)将植入物置放在左眼(os)中。注意,在前7.5个月内,csft有效降低,同时bcva保持不受影响(图21)。第3a组的第二位患者(3x200μg植入物;图中未示)为84岁男性,其未进行过治疗。注射过程不复杂。三个植入物皆在一天(第1天,基线)内置放。csft基本上稳定4.5个月,即,不会发生临床显著的增加。随访正在进行中。
[1356]
一般而言,在第3a组患者中,在插入植入物之后6个月时,平均csft大大降低(图
17)。对于第3a组,在3个月之后,平均bcva显著增加(图18)。
[1357]
第3b组(2x200μg植入物和抗vegf)的第一位患者为71岁男性,其未进行过amd治疗。注射过程不复杂。植入物和抗vegf注射皆在第1天(基线)置放于右眼(od)中。已7天之后,可见csft明显降低,而bcva不受影响。csft进一步降低,随后在3个月治疗时段内基本上维持,并且在第4.5个月开始增加(图22)。第3b组的第二位患者在插入植入物之前已接受抗vegf疗法7个月。即使在仅7天的短治疗时段之后,csft仍降低2/3(基线时为599μm,而第7天时为188μm),而bcva不受影响(图23)。截至第2个月维持低csft值,但在第3个月开始增加。所述受试者在第4.5个月接受救援疗法。随访正在进行中。
[1358]
在第3b组患者中,在插入植入物之后前3个月期间,平均csft有效降低(图17)。平均bcva稍有增加(图18)。
[1359]
耐受性和不良事件
[1360]
一般而言,植入物在第3a组和第3b组中也为安全的且被良好耐受。对于大部分受试者,注射过程并不复杂。在研究持续时间内,与剂量无关,所有受试者的iop皆正常。对任何受试者皆未观测到发炎。受试者不需要眼用类固醇。
[1361]
所有报告不良事件皆为轻度,未报告中度或重度(眼)不良事件(表26.1)。重要的是,迄今仅报告一例疑似与研究产品有关的不良事件(参见表26.1)。具体不良事件报告于表26.2中。针对第3a组和第3b组的随访正在进行中。
[1362]
表26.1针对第3a组和第3b组报告的不良事件(随访正在进行中)。
[1363][1364]
表26.2迄今为止针对第3a组和第3b组的研究眼睛报告的具体不良事件(随访正在进行中)。
[1365][1366][1367]
另选地,替代提供600μg总剂量的三个植入物,可注射一个包括600μg阿西替尼剂量的植入物。注意,在兔中注射600μg推注剂量(参见实施例3.6)未引起显著组织变化,且发炎反应正常。表21.2中呈现适用于临床研究的600μg植入物的配方和尺寸。
[1368]
救援药物
[1369]
若需要,则根据以上再现的研究方案,第1组、第2组、第3a组和第3b组中的任何受试者已依据研究者的判断接受救援疗法(抗vegf剂,特定来说,玻璃体内注射2mg阿柏西普)。使用以下标准鉴定可能需要救援疗法的受试者:
[1370]-由于amd,相对于最佳先前bcva损失≥15个字母,其中当前bcva并不比基线更优选;或
[1371]-由于amd,2次连续访视相对于最佳先前bcva损失≥10个字母,其中当前bcva并不
比基线更优选;或
[1372]-相对于先前最佳值,疾病活动性恶化的证据由大于75微米csft体现。
[1373]
迄今为止,来自第1组、第2组、第3a组和第3b组的受试者中不超过50%在治疗开始(植入物注射)之后的前6个月内需要如本文中所定义的呈抗vegf治疗形式的救援药物(表27)。举例来说,在第2组中,71.4%的受试者在植入物插入之后3个月未接受救援药物,且57.1%的受试者在植入物插入之后6个月未接受救援药物。第2组中即使在11或13.5个月的长治疗时段之后,也分别有28.6%或20%的受试者不需要救援药物(尤其在第3a组和第3b组中,研究仍在进行中)。需要救援药物的受试者的此低百分比显示,通过本发明的植入物达成的减少体液的治疗效果得以维持,且患者在体液减少的状态下稳定较长时间段,诸如至少3个月、至少6个月、至少9个月或至少12个月。特定来说,表27中第1组和第2组(分别200μg和400μg阿西替尼)的资料显示,通过施用植入物达成的患者体液水平可维持6至9个月的时段而无需任何救援药物,同时视力(通过bcva表示)未被明显削弱(参见图18)。
[1374]
表27所有群组中不需要救援疗法的受试者的百分比。*=随访正在进行中。tbd=待测定。注意:在第3a组中,一名受试者在第1个月时接受救援药物,然而此并未体现在表27中,因为第3a组中总计六名受试者中仅三名已达到3个月,且此三位无一接受过救援药物(在第1个月时接受救援药物的受试者尚未达到第3个月)。
[1375]
[1376][1377]
应用于人类的植入物中的阿西替尼的剂量(200-600μg)与批准的剂量(2x5mg/天)相比明显更低。即使一次可全身递送全部600μg阿西替尼剂量,此与每日剂量相比仍然超过此全部剂量的15倍安全边界,从而进一步强调植入物的安全性。
[1378]
以上结果显示本发明的植入物施用诊断有新血管性amd的患者能够稳定这些患者的视网膜液(即,降低、维持或至少不显著增加视网膜液)(如通过csft所证明),同时不削弱患者的视力(如通过bcva所证明),持续约6至约9个月甚至更久的治疗时段,且植入物被良好耐受。
[1379]
实施例6.5:利用600μg阿西替尼植入物的提议人类临床试验
[1380]
提议研究为前瞻性多中心双掩蔽随机平行组研究,以评估otx-tki(600μg阿西替尼植入物)经玻璃体内用于先前治疗过新血管性年龄相关性黄斑退化(namd)的受试者的效力和安全性。研究目标为评估otx-tki(0.6mg阿西替尼植入物)经玻璃体内用于先前治疗过新血管性年龄相关性黄斑退化(amd)的受试者的效力和安全性。
[1381]
主要效力终点将为:
[1382]
·
截至7个月时bcva相对于基线的平均变化
[1383]
次要效力终点将为:
[1384]
·
在所有研究访视时bcva随时间相对于基线的平均变化
[1385]
·
7个月和所有研究访视时通过sd-oct测量的中心子场厚度(csft)随时间相对于基线的平均变化,以及截至第12个月所有研究访视时与基线相比不存在csft增加≥50μm的受试者的百分比
[1386]
·
截至第12个月所有研究访视时皆不存在视网膜液(依据sd-oct上,csft≤300μ
m)的受试者的比例,7个月和所有研究访视时通过fa测定的渗漏相对于基线在临床上不显著的增加的受试者的比例,所有研究访视时按体液类型(视网膜下液(srf)或视网膜内液(irf);依据sd-oct,csft≤300μm)不存在体液的患者的比例
[1387]
·
截至第4个月、第7个月和第12个月接受救援疗法的受试者的比例、救援疗法的平均时间和救援疗法注射的平均次数。
[1388]
安全性终点将为:
[1389]
·
发生治疗期出现的不良事件(ae)
[1390]
·
生命体征随时间变化
[1391]
·
眼部舒适度评分随时间变化
[1392]
·
临床相关视力损失定义为随时间推移与基线相比视力下降6行
[1393]
·
随时间推移眼科检查与基线评定(例如裂隙灯活组织镜检、眼底检查和iop)相比发生临床显著的变化。
[1394]
将招募大约100名≥50岁受试者,并且用0.6mg otx-tki(玻璃体内植入物)或2mg阿柏西普(玻璃体内注射)治疗。在第1次访视(筛检/基线)确认合格后,将受试者1:1随机分至两组之一。随机分至otx-tki的受试者将接受0.6mg otx-tki单次注射(0.6mg阿西替尼),而随机分至阿柏西普的受试者将接受假(即,仅媒剂)注射。在第2次访视(第1个月)时,随机分至otx-tki的受试者将接受单次注射2mg阿柏西普,而随机分至阿柏西普的受试者将接受单次注射2mg阿柏西普(即,所有受试者将在第2次访视/第1个月时接受注射2mg阿柏西普)。随后,随机分至阿柏西普组的受试者将每两个月接受单次注射2mg阿柏西普,而随机分至otx-tki组的受试者将每两个月接受假注射。计划研究设计设计示于图28中。
[1395]
研究群体将为诊断有继发于新血管性amd的先前治疗过的窝下新血管形成(sfnv)伴随涉及眼窝的渗漏的受试者,其在先前1至4周内接受其最近抗vegf注射。
[1396]
实施例7:利用各种tki进行的发炎研究
[1397]
tki样品制备:制备含有若干tki的水凝胶,以便在兔眼中进行耐受性测试:舒尼替尼、阿西替尼、尼达尼布和瑞格法尼(regorefanib)。首先,制备80% provisc(alcon,inc.)和20%0.5mg/ml硼酸钠溶液(ph6.8)的稀释剂溶液。接下来,制备含有9.6% api、77.8%稀释剂、8.4%4a20kpeg saz和4.2%8a20kpeg nh2的混合物。在胶化前(发生在混合之后3.5与8分钟之间),使用hamilton注射器在新西兰白兔眼中经玻璃体内注射10μl。
[1398]
研究设计:简单来说,在第0天,向兔的左眼和右眼注射如以下研究设计表中所列出的测试物品。在2周时对动物施以安乐死。收集眼睛,并且固定在davidson氏溶液中以用于组织病理学分析。
[1399]
表28发炎研究中所使用的tki的列表。
[1400][1401]
检查组织:将来自5只兔的总计10只左眼和右眼提交至mass histology,并由委员会认证的兽医病理学家进行修剪。
[1402]
结论:在研究条件下,在注射后14天时用含酪氨酸激酶抑制剂的水凝胶贮库调配物对兔眼进行玻璃体内注射导致各组中至少一只眼睛的玻璃体腔中继续存在水凝胶,但第1组和第3组除外,其中任一眼睛中皆未注意到水凝胶材料。
[1403]
在第2组、第4组和第5组的任一眼睛中观测到的任何注射材料周围皆不存在发炎。在第1组和第3组的临时样品中观测到最低程度的发炎,其主要由玻璃体腔中的巨噬细胞组成和/或附着至视网膜。再次,在来自第1组或第3组的任一眼睛中皆未观测到注射材料。
[1404]
在来自第3组和第4组的数个载玻片样品中观测到最低程度的发炎和纤维化。这些通常为较小线性区域的纤维化,其中混有少许巨噬细胞。其被解释为针头注射后遗症。
[1405]
在来自第1组、第3组、第4组和第5组的至少1只眼睛中观测到一或数个较小区域的视网膜破裂或视网膜褶皱。这些可为由于针头注射造成的视网膜内陷。一只眼睛中在小视网膜破裂位置存在极小视网膜脱落,长度测量为100微米(第3组)。任一组的任一眼睛中皆未注意到其他视网膜脱落。
[1406]
在来自第3组的一只眼睛的玻璃体腔中的晶状体纤维的小移位灶周围观测到轻度组织细胞灶和多核性发炎。此被视为晶状体诱导的肉芽肿性内眼炎,且可能是由于注射时注射针头对晶状体造成的轻微刻痕。在任一组的任一眼睛中皆未观测到其他此种病变。
[1407]
实施例8:其他实施例
[1408]
在某些实施方案中,本发明还涉及如本文中所公开的植入物,其含有大量tki,诸如阿西替尼,诸如超过约1200μg或超过约1800μg的阿西替尼剂量。含有此种高剂量阿西替尼的某些例示性预见性植入物公开于以下表29中。
[1409]
表29含有高剂量阿西替尼(即,1200μg以上)的预见性植入物
[1410]
[1411]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。