1.本发明属于生物医学水凝胶技术领域,具体涉及一种酶光双交联水凝胶的制备方法及采用酶光双交联水凝胶负载细胞的方法。
背景技术:
2.随着组织工程领域的发展和再生医学的进步,对于力学性能优异并且与生物体组织相容性良好的生物医学材料的需求也日益增长。细胞外基质在控制细胞各项活动方面起关键作用,水凝胶作为与细胞质基质相似的交联网络,其溶胀过程可以迅速吸收并包含大量水分子,在结构和功能上可以满足各种动态生物过程的需要。
3.细胞质基质的硬化在发育、伤口愈合、以及疾病过程中尤其具有决定性作用,并在很大程度上影响受损器官和组织的修复和再生。生物医学水凝胶作为单独的修复基质,或者与某种细胞及生长因子结合起来使用,已经广泛应用于组织工程领域和再生医学中。
4.明胶由动物胶原蛋白链部分水解而形成的产物,其来源广泛具有良好的生物相容性、优良的力学性能及可调控的降解性能,因此在生物组织工程领域有着广阔的应用前景。但是,对于单纯使用明胶溶液制备的水凝胶材料,其力学性能较差,降解迅速且不易调控,从而限制了其在某些生物材料领域中的实际应用,例如人体中承重较大的骨和软骨等的病变部位的修复,在37℃下极易降解。针对这个问题,有研究报道对明胶进行改性,如在明胶分子链上接枝某一种分子,使改性后的明胶分子链具有更强的力学性能,例如在明胶分子链上接枝对羟基苯丙酸,得到的gelhpa在辣根过氧化物酶的作用下可以进行酶交联反应。这种化学交联方式可以有效提高所得水凝胶的力学性能,但很难实现水凝胶的动态硬化,限制了动态生物过程的研究。
技术实现要素:
5.本发明的目的在于提供一种酶光双交联水凝胶的制备方法,所得水凝胶具备动态力学性能、硬度可调节且稳定性良好。
6.本发明的第二个目的在于提供一种采用酶光双交联水凝胶负载细胞的方法,可以实现水凝胶基质的动态硬化。
7.为实现上述目的,本发明酶光双交联水凝胶的制备方法的技术方案是:
8.一种酶光双交联水凝胶的制备方法,包括以下步骤:改性明胶溶液在(a)双氧水以及辣根过氧化物酶条件下进行酶交联,以及在(b)光引发剂条件下进行光交联;所述改性明胶溶液中的改性明胶为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶,或者为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶和对羟基苯丙酸接枝改性明胶组成的混合明胶;
9.其中,先进行在(a)条件下的酶交联,后进行在(b)条件下的光交联;或者先进行在(b)条件下的光交联,后进行在(a)条件下的酶交联;或者同时进行在(a)条件下的酶交联以
及在(b)条件下的光交联。
10.本发明的酶光双交联水凝胶的制备方法,通过向明胶分子链上接枝对羟基苯丙酸和甲基丙烯酸脱水甘油酯两种聚合物基团,使其既可以进行酶交联,又能够进行光交联。通过调整辣根过氧化物酶和双氧水的浓度,可以调节酶交联得到的水凝胶硬度,通过调整uv光照的时间,可以调节光交联得到的水凝胶硬度。明胶双改性得到的这种酶光双交联水凝胶可以实现水凝胶基质的动态硬化,具有可调节的动态力学性能和可控的降解性能,同时具有良好的生物相容性。除此之外,其制备原料来源丰富,方法简单易行,重复性好,能满足细胞各种生命活动所需的二维和三维生物环境,在组织工程领域和再生医学及载药控制释放等方面具有广阔的应用前景。
11.优选的,所述改性明胶溶液中,改性明胶的质量分数为5-30%;所述混合明胶中,羟基苯丙酸接枝改性明胶的质量占比不大于90%。更优选的,改性明胶的质量分数为10%-20%,更优选10-15%。所述混合明胶中,羟基苯丙酸接枝改性明胶的质量占比为30-70%。
12.优选的,酶交联反应时,辣根过氧化物酶在体系中的终浓度为0.1-10u/ml,h2o2在体系中的终浓度为1~10mm;酶交联反应的时间为5s-60min。更优选的,辣根过氧化物酶在体系中的终浓度为0.4~0.6u/ml。h2o2在体系中的终浓度为2~3mm。酶交联反应的时间为5s~30min。
13.光交联反应时,光引发剂选自irgacure 2959或lap,光引发剂在体系中的浓度为0.1-50mg/ml,光交联反应的时间为1s~60min。光引发剂在体系中的浓度优选为1-10mg/ml,更优选为4-6mg/ml,光交联反应的时间优选为5s-30min。光引发剂均为市售品种,均可按照推荐波长的光照条件进行,如irgacure 2959可在365nm的uv光条件下交联,光引发剂lap(lithium acylphosphinat)可在405nm的可见光条件下交联。
14.优选的,对羟基苯丙酸接枝改性明胶的制备方法包括以下步骤:明胶和对羟基苯丙酸在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺存在的条件下进行接枝反应,经透析处理,得到羟基苯丙酸接枝改性明胶溶液,冷冻干燥。更优选的,明胶和对羟基苯丙酸的质量比为100:1-1:100。更优选为5:1~1:2。接枝反应时,维持反应体系的ph在3-6,室温下搅拌反应过夜。
15.优选的,对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶的制备方法包括以下步骤:向羟基苯丙酸接枝改性明胶溶液中加入甲基丙烯酸脱水甘油酯,在ph=3-4、温度为45-60℃条件下进行接枝反应,然后进行透析和冷冻干燥处理。更优选的,每3-4g明胶,对应对羟基苯丙酸的用量为0.6-8g,对应甲基丙烯酸脱水甘油酯的用量为0.01-100g,优选为1-10g。
16.本发明的采用酶光双交联水凝胶负载细胞的方法的技术方案是:
17.一种采用酶光双交联水凝胶负载细胞的方法,包括以下步骤:
18.1)改性明胶溶液和细胞均匀混合,得到细胞预混液;所述改性明胶溶液中的改性明胶为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶,或者为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶和对羟基苯丙酸接枝改性明胶组成的混合明胶;
19.2)将细胞预混液先在双氧水以及辣根过氧化物酶条件下进行酶交联,得到酶交联水凝胶;
20.将酶交联水凝胶在光引发剂条件下进行光交联,得到负载细胞的酶光双交联水凝
胶;或者将酶交联水凝胶浸泡于缓冲液或细胞培养基中预定时间,然后再在光引发剂条件下进行光交联,得到动态硬化的负载细胞的酶光双交联水凝胶。缓冲液如pbs等。
21.一种采用酶光双交联水凝胶负载细胞的方法,包括以下步骤:
22.1)改性明胶溶液和细胞均匀混合,得到细胞预混液;所述改性明胶溶液中的改性明胶为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶,或者为对羟基苯丙酸-甲基丙烯酸脱水甘油酯混合接枝改性明胶和对羟基苯丙酸接枝改性明胶组成的混合明胶;
23.2)将细胞预混液条件下进行光交联,得到光交联水凝胶;
24.将光交联水凝胶在双氧水以及辣根过氧化物酶条件下进行酶交联,得到负载细胞的酶光双交联水凝胶;或者将光交联水凝胶浸泡于缓冲液或细胞培养基中预定时间,然后再在双氧水以及辣根过氧化物酶条件下进行酶交联,得到动态硬化的负载细胞的酶光双交联水凝胶。
25.本发明的采用酶光双交联水凝胶负载细胞的方法,采用上述酶光双交联水凝胶对细胞进行二维或三维的动态培养。该方法操作简单易行,反应迅速且可调节,可用于制备多种组织工程支架和受损或病变的骨和软骨组织的替代修复水凝胶。
26.酶光双交联水凝胶负载细胞的动态培养技术方案中,水凝胶制备过程中的优选方案与上述酶光双交联水凝胶的优选方案相同,在此不再赘述。
27.本发明中,动态力学性能的含义为:在时间顺序上能够进行两次硬化,比如可以在进行酶交联后溶胀1天或3天或7天再进行第二次交联(光交联)。
附图说明
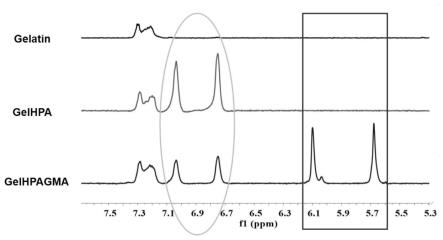
28.图1为对羟基苯丙酸(gelhpa)和对羟基苯丙酸与甲基丙烯酸脱水甘油酯改性后的明胶(gelhpa-gma)h1nmr示意图;
29.图2为gelhpa-gma的结构示意图;
30.图3为实施例1中质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶交联水凝胶和酶光双交联水凝胶的压缩模量示意图;
31.图4为实施例1中质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶交联水凝胶的sem图;
32.图5为实施例1中质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶光双交联水凝胶的sem图;
33.图6为实施例1中质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶交联水凝胶和酶光双交联水凝胶的流变示意图;
34.图7为实施例1中质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶交联水凝胶和酶光双交联水凝胶的溶胀示意图;
35.图8为实施例5中人脐带干细胞在质量分数12%的gelhpa-gma和gelhpa混合溶液制备的酶光双交联水凝胶内培养第7天的细胞活性;
36.图9为质量分数为10%-15%的gelhpa-gma和gelhpa混合溶液制备的酶交联水凝胶的压缩模量示意图;
37.图10为质量分数为10%-15%的gelhpa-gma和gelhpa混合溶液制备的酶光双交联水凝胶的压缩模量示意图;
38.图11为质量分数为10%的gelhpa-gma和gelhpa混合溶液制备的酶光双交联水凝胶(先光交联后酶交联)的压缩模量示意图。
具体实施方式
39.本发明通过使用酶、光两种化学交联方式,得到可以进行动态硬化的水凝胶,同时提供了一种利用这种酶光双交联水凝胶负载细胞进行三维培养的方式。本发明使用辣根过氧化物酶(hrp)进行催化交联,形成酶交联网络;在光引发剂存在的情况下进行uv光照,产生自由基诱导交联形成光交联网络。酶交联网络与光交联网络互穿且互不影响。这种方法可以通过调整gelhpa-gma和gelhpa的比例、gelhpa-gma和gelhpa混合溶液的质量分数、光引发剂的量、辣根过氧化物酶的浓度、双氧水的浓度及uv光照的时间来调控酶光双交联水凝胶的力学性能,从而达到实现动态硬化的目的。
40.1.gelhpa-gma的合成包括以下步骤:
41.(1)称取1-2g的对羟基苯丙酸(hpa),溶于40ml二甲基亚砜(dmso)中,室温下密封搅拌至完全溶解,再向完全溶解后的溶液中加入60ml超纯水。
42.(2)分别称取1-2g的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和1-2g的n-羟基琥珀酰亚胺(nhs),加入上述溶液后调节ph值为3-6,室温下搅拌反应2-5小时。
43.(3)配置质量分数5-8%的纯明胶溶液60ml,50℃水浴加热搅拌1-3小时,完全溶解后倒入上述含有hpa与edc/nhs的溶液中,维持反应体系的ph在3-6,室温下高速搅拌反应过夜。
44.(4)反应结束后转移至透析袋内(mwco=12-14k),用100mm的nacl溶液、25%的乙醇溶液和纯水分别透析至除去反应物质和副产物。
45.(5)向透析完成后的溶液(约为250ml)中加入7-9ml甲基丙烯酸脱水甘油酯,调节溶液ph在3-4范围内,45-60℃加热,高速搅拌过夜。
46.(6)将反应结束后的溶液转移至透析袋(mwco=12-14k)中,用纯水透析至除去反应物质及副产物。
47.(7)透析完成后使用冷冻干燥机抽干水分,低温避光储存备用。
48.作为进一步的优选,步骤(1)中,对羟基苯丙酸的质量为1.32g。
49.作为进一步的优选,步骤(2)中,edc的质量为1.52g。nhs的质量为1.28g。调节溶液ph值为4.7。溶液在室温下搅拌反应3.5小时。
50.作为进一步的优选,步骤(3)中,纯明胶溶液的质量分数为6.6%。纯明胶溶液搅拌时间为2.5小时。加入纯明胶溶液后反应体系的ph值为4.7。
51.作为进一步的优选,步骤(5)中,加入甲基丙烯酸脱水甘油酯的量为8ml,控制滴加的速率1滴/秒为宜。调节溶液的ph值为3.5。反应温度为50℃。
52.2.酶光双交联水凝胶的合成方法包括:将单独的gelhpa-gma或合成的gelhpa-gma和gelhpa的混合溶液按照一定比例配制成质量分数为10-15%(优选范围,可以在5-30%范围内调整)的溶液,并加入一定量的光引发剂和辣根过氧化物酶,30-50℃加热搅拌至完全溶解后得到前体溶液,与过氧化氢混合均匀,凝胶后得到酶交联水凝胶;再将得到的酶交联水凝胶进行uv光照适当时长,得到酶光双交联水凝胶。
53.也可以将前体溶液和过氧化氢混合的预混液未凝胶前进行uv光照,得到酶光双交
联水凝胶。
54.也可以将前体溶液与过氧化氢混合均匀后,凝胶得到的酶交联水凝胶浸泡在去离子水、pbs缓冲液或者细胞培养基中一段时间(1h-7d)后,再在含有一定量光引发剂的pbs溶液中浸泡30min-1h,用uv光照适当时长,即可得到动态硬化的酶光双交联水凝胶。
55.也可以将合成的gelhpa-gma和gelhpa按照一定比例配制成质量分数为10-15%的溶液,30-50℃加热搅拌至完全溶解后得到前体溶液,先进行uv光照适当时长,得到光交联的水凝胶;再将得到的光交联水凝胶浸泡在适当浓度的hrp酶溶液和过氧化氢溶液中,得到酶光双交联水凝胶。
56.在具体实施中,以上涉及的溶液的混合可以在ep管中进行。优选的,将gelhpa-gma和gelhpa按照一定比例配制成质量分数为10-15%的溶液,并加入一定量的光引发剂,将所得溶液分为两份,一份添加辣根过氧化物酶混合均匀(辣根过氧化酶预混溶液),另一份添加双氧水混合均匀(双氧水预混溶液),分别将辣根过氧化物酶预混溶液和双氧水预混溶液加入到y型注射器的两个筒中进行混合注射,在凝胶模具中等待酶交联水凝胶形成;再用uv光照适当时长,得到酶光双交联水凝胶。
57.其中的凝胶模具可选自聚四氟乙烯模板,uv光照透过的模具为薄石英板。
58.3.酶光双交联水凝胶负载细胞的动态培养
59.主要过程如下:
60.将合成的gelhpa-gma和gelhpa按照一定比例配制成质量分数为5-30%的溶液,并加入一定量的光引发剂加热搅拌均匀至完全溶解后得到前体溶液。用前体溶液将离心后去除上清液的细胞团打散至均匀混合,得到细胞预混液。
61.适当调整辣根过氧化物酶和双氧水的浓度。将细胞预混液与辣根过氧化物酶和双氧水混合均匀,等待凝胶后用uv光照适当时长,得到三维负载细胞的酶光双交联水凝胶。将水凝胶浸泡于细胞所需培养基中,37℃和5%co2培养箱中培养。
62.或者将细胞预混液与辣根过氧化物酶和双氧水混合均匀,凝胶后得到的酶交联水凝胶浸泡于细胞所需培养基中,37℃和5%co2培养箱中培养1d-7d;将酶交联水凝胶浸泡在含有适量光引发剂的pbs溶液中30min-1h,用uv光照适当时长,即可得到动态硬化的三维培养细胞的酶光双交联水凝胶。
63.下面结合具体实施例对本发明的实施方式作进一步说明。
64.一、本发明的酶光双交联水凝胶的制备方法的具体实施例
65.实施例1
66.本实施例的酶光双交联水凝胶的制备方法,包括以下步骤:
67.(1)对羟基苯丙酸和甲基丙烯酸脱水甘油酯改性明胶(gelhpa-gma)的合成:
68.1)在常温下,将明胶(gelatin)溶解于纯水中,加热50℃磁力搅拌2.5h得到质量分数为6.6%的纯明胶溶液60ml;
69.2)在常温下,将1.32g对羟基苯丙酸溶于40ml二甲基亚砜(dmso),室温25℃磁力搅拌至完全溶解后加入60ml纯水继续搅拌;将1.52g 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和1.28g n-羟基琥珀酰亚胺(nhs)加入溶液中,调节其ph=4.7后,室温25℃磁力搅拌3.5h;在常温下,将1)中的纯明胶溶液缓慢倒入2)中的溶液里,高速搅拌,调节混合溶液的ph=4.7,1h后测量混合溶液的ph=4.7,室温25℃磁力高速搅拌过夜;用100mm的
nacl溶液透析三天,再分别用25%乙醇溶液和纯水透析一天,得到溶液a;
70.3)向溶液a(约为250ml)中缓慢滴加8ml甲基丙烯酸脱水甘油酯,控制滴加速度,使其以1滴/s的速度逐滴滴加至溶液a中,调节溶液ph=3.5,1h后再次测量溶液ph=3.5;磁力搅拌器加热50℃高速搅拌过夜;充分反应后去离子水透析,除去未反应的反应物和反应所得副产物,冻干得到对羟基苯丙酸和甲基丙烯酸脱水甘油酯改性的明胶(gelhpa-gma)。
71.将溶液a冻干即可得到对羟基苯丙酸接枝改性的明胶(gelhpa)。
72.(2)酶光双交联水凝胶的制备
73.a)用pbs溶液配置质量分数为12%的gelhpa和gelhpa-gma的混合溶液1ml,其中gelhpa和gelhpa-gma的比例为3:7,称取5mg光引发剂(名称为2-羟基-4
’‑
2-(羟基乙氧基)-2-甲基苯乙酮((irgacure 2959))加入溶液中,加热至45℃磁力搅拌3h,完全溶解后37℃保温备用。
74.b)各抽取0.5ml的溶液分别混入辣根过氧化物酶(hrp)和双氧水(h2o2),混合均匀后加入到1ml的y型双筒注射器中,以便使两种溶液混合并进行注射。其中,加入辣根过氧化物酶的溶液与加入双氧水的溶液混合后得到的溶液中,辣根过氧化物酶的终浓度为0.4units/ml,双氧水的终浓度为2mm。
75.c)终溶液在凝胶模具上成型,同时用计时器记录凝胶完成所需的时间。凝胶模具包括聚四氟乙烯底板、石英玻璃顶板以及夹在底板、顶板之间的硅胶垫,将硅胶垫中部挖空,该挖空空间形成水凝胶的成型空间。水凝胶的成型厚度即为硅胶垫厚度(2mm)。聚四氟乙烯板和石英玻璃表面平整且水平,有利于成型后的水凝胶进行性能的表征。
76.终溶液在板上形成1ml的液滴,使聚四氟乙烯板上的液滴不与周围空气接触,以免影响下一步光交联效果。凝胶成型所用时间小于30s,凝胶完成需要30min。
77.d)酶交联完成后用uv透过石英玻璃光照液滴10min,全程避光操作。酶交联完成后的水凝胶呈透明状,光交联完成后的水凝胶中部变白,周围有一圈透明带,显示与空气接触的地方未完成光交联。透明带的宽度不超过1mm。
78.在本实施例的基础上,步骤c)中,也可以在酶交联进行时对凝胶使用uv光照,效果与上述步骤无明显不同。通过这种方式也可以得到酶光双交联水凝胶。
79.实施例2
80.本实施例的酶光双交联水凝胶的制备方法,与实施例1基本相同,不同之处仅在于,步骤(2)-(a)中,混合溶液的质量分数为10%。
81.实施例3
82.本实施例的酶光双交联水凝胶的制备方法,与实施例1基本相同,不同之处仅在于,步骤(2)-(a)中,混合溶液的质量分数为15%。
83.实施例4
84.本实施例的酶光双交联水凝胶的制备方法,与实施例1基本相同,不同之处仅在于,步骤(2)先光交联再酶交联制备酶光双交联水凝胶:
85.a)用pbs溶液配置质量分数为10%的gelhpa和gelhpa-gma的混合溶液1ml,其中gelhpa和gelhpa-gma的比例为3:7,称取5mg光引发剂(名称为2-羟基-4
’‑
2-(羟基乙氧基)-2-甲基苯乙酮((irgacure 2959))加入溶液中,加热至45℃磁力搅拌3h,完全溶解后37℃保温备用。
86.b)抽取1ml的溶液置于凝胶模具上,使用uv光照射10min使水凝胶成型。然后放入辣根过氧化物酶(hrp)和双氧水(h2o2)混合溶液中进行酶交联,酶交联时间为20min。其中,加入辣根过氧化物酶与双氧水混合溶液中,辣根过氧化物酶的终浓度为0.4units/ml,双氧水的终浓度为2mm。终溶液在板上形成1ml的液滴,避光操作以免影响下一步酶交联效果。
87.终溶液在凝胶模具上成型。凝胶模具包括聚四氟乙烯底板、石英玻璃顶板以及夹在底板、顶板之间的硅胶垫,将硅胶垫中部挖空,该挖空空间形成水凝胶的成型空间。水凝胶的成型厚度即为硅胶垫厚度(2mm)。
88.在实施例1的基础上,参照步骤(1),按以下比例调整明胶、对羟基苯丙酸、甲基丙烯酸脱水甘油酯的相对用量,可得到相应双改性明胶gelhpa-gma:
89.每3g明胶对应使用0.6g对羟基苯丙酸和1g甲基丙烯酸脱水甘油酯;
90.每3g明胶对应使用8g对羟基苯丙酸和10g甲基丙烯酸脱水甘油酯;
91.每3g明胶对应使用0.6g对羟基苯丙酸和10g甲基丙烯酸脱水甘油酯;
92.每4g明胶对应使用8g对羟基苯丙酸和1g甲基丙烯酸脱水甘油酯;
93.每4g明胶对应使用5g对羟基苯丙酸和5g甲基丙烯酸脱水甘油酯。
94.在实施例1的基础上,步骤(2)中,混合溶液的组成以及酶交联、光交联条件可按照以下方式进行调整:
95.混合溶液为质量分数20%的gelhpa-gma溶液,不含gelhpa。可控制辣根过氧化物酶的终浓度为0.5u/ml,双氧水的终浓度为2mm。酶交联5s后,光照50min,可完成酶/光双交联水凝胶的制备。
96.混合溶液为质量分数20%的gelhpa-gma溶液,不含gelhpa。可控制辣根过氧化物酶的终浓度为0.5u/ml,双氧水的终浓度为3mm。酶交联30min后,使用lap光引发剂光照5s,可完成酶/光双交联水凝胶的制备。
97.混合溶液中gelhpa和gelhpa-gma的总质量分数为10%,gelhpa、gelhpa-gma的质量比为3:7。可控制辣根过氧化物酶的终浓度为0.6u/ml,双氧水的终浓度为2mm。酶交联15min后使用i2959光引发剂光照30min,可完成酶/光双交联水凝胶的制备。
98.在实施例4的基础上,步骤(2)中,混合溶液的组成以及酶交联、光交联条件可按照以下方式进行调整:混合溶液中gelhpa和gelhpa-gma的总质量分数为15%,gelhpa、gelhpa-gma的质量比为7:3。使用i2959光引发剂光照15min进行光交联,然后浸泡辣根过氧化物酶0.4u/ml、双氧水2mm的溶液进行酶交联,酶交联15min可完成光酶/双交联水凝胶的制备。
99.二、本发明的采用酶光双交联水凝胶负载细胞的方法的具体实施例
100.实施例5
101.本实施例的采用酶光双交联水凝胶负载细胞的方法,包括以下步骤:
102.(1)gelhpa和gelhpa-gma的合成同实施例1。
103.(2)动态硬化的酶光双交联水凝胶负载人脐带干细胞的三维培养:
104.a)用无菌pbs缓冲溶液配置2ml质量分数为12%的gelhpa和gelhpa-gma的混合溶液a,其中gelhpa和gelhpa-gma的比例为6:4,称取10mg光引发剂加入溶液中,加热至45℃磁力搅拌2-4h,完全溶解后在生物安全柜里灭菌后,放入2ml离心管中37℃避光保温备用。
105.b)配置10units/ml的辣根过氧化物酶溶液(实验中使用的溶剂未经特殊说明,均
为磷酸盐缓冲液(pbs)),在生物安全柜里灭菌后-20℃密封避光保存。配置100mm的双氧水溶液,在生物安全柜里灭菌后室温下密封避光保存。
106.c)抽取0.5ml的步骤a)的混合溶液a与离心后去上清液的人脐带干细胞混合并吹打散细胞团,分别加入辣根过氧化物酶(hrp)和双氧水(h2o2),得到混合人脐带干细胞的前体溶液b,快速吹打均匀。溶液状态下转移至灭菌后的聚四氟乙烯板上,隔绝空气避光等待凝胶完成。前体溶液b中,辣根过氧化物酶(hrp)的终浓度为0.6units/ml,双氧水(h2o2)的终浓度为3mm。前体溶液b在凝胶模具上成型,同时用计时器记录凝胶完成所需的时间(约为30min)。凝胶模具为聚四氟乙烯板,终溶液在板上形成0.5ml的液滴,在未成型前使用厚度为2mm中部挖空的硅胶垫隔绝四周空气,并在上面覆盖石英玻璃,使聚四氟乙烯板上的液滴不与周围空气接触,以免影响下一步光交联效果。所有物品均经过严格的灭菌处理。
107.d)将酶交联完成后的水凝胶用刀具(软骨刀(biopsy punch))切成直径6mm高2mm的圆柱块放入24孔板中,每孔加入1ml配置好的培养液,放入37℃5%co2培养箱中培养,两天换一次液。3天后使用灭菌pbs溶液清洗干净培养基后,泡在灭菌后含有光引发剂的pbs缓冲液中,使用波长为365nm的uv光照10min。此时光交联后的水凝胶没有透明带。这样就得到了可以进行三维细胞培养的动态硬化的酶光双交联水凝胶。将水凝胶继续放入所需培养基中,再放入37℃5%co2培养箱中培养。
108.在本发明的采用酶光双交联水凝胶负载细胞的方法的其他实施例中,通过不同的交联方式(使用酶或光或酶光交联)、控制第二次交联的时间(如酶交联后溶胀1天或3天或7天再进行光交联)、改变水凝胶前体溶液的质量分数(5%、25%等)、改变hrp和h2o2的浓度、改变uv光照的时间等手段,可以制备出不同弹性模量和硬度的水凝胶样品。
109.根据具体组织工程的不同需求,所得酶光双交联水凝胶的软硬可调,压缩模量可以在几k~几百kpa的较大范围内调整,从而使所得水凝胶与实际的生物过程更加吻合。
110.三、实验例
111.实验例1
112.对实施例1步骤(1)所得对羟基苯丙酸改性明胶,对羟基苯丙酸与甲基丙烯酸脱水甘油酯改性明胶以及未改性明胶进行nmr分析,三种物质的h1nmr示意图如图1所示。
113.由图1可知,步骤(1)实现了对羟基苯丙酸与甲基丙烯酸脱水甘油酯对明胶的接枝改性,其改性后的改性明胶gelhpa-gma的结构式如图2所示。
114.实验例2
115.实施例1中,步骤c)所得酶交联水凝胶以及步骤d)所得酶光双交联水凝胶的压缩模量对比如图3所示。使用万能试验机(utm 2203,深圳三思纵横科技股份有限公司)进行压缩测试,将直径6mm厚2mm的水凝胶样品放在实验台上,用力学传感器对其施加压力。根据应力应变曲线,取应变范围5%-10%进行线性拟合,得到的斜率即为压缩模量。
116.由图3可知,酶光双交联水凝胶的压缩模量为酶交联水凝胶的4倍左右。
117.实验例3
118.实施例1中,对步骤c)所得酶交联水凝胶以及步骤d)所得酶光双交联水凝胶进行sem检测,结果分别如图4和图5所示。
119.图4为仅进行酶交联的水凝胶的sem图像,图5为酶光双交联后的水凝胶sem图像。两种水凝胶都具有均匀的多孔结构,由于交联密度的不同孔径大小也有所不同。酶光双交
联水凝胶具有较高的交联密度而使孔径变小。
120.实验例4
121.针对实施例1,本实验例测试酶交联水凝胶和酶光双交联水凝胶的流变性能,结果如图6所示。酶交联水凝胶和酶光双交联水凝胶的储能模量(g’)和损耗模量(g”)是通过装有直径为40mm平板的旋转流变仪进行测量的。直径40mm,厚度1mm水凝胶样品在37℃下的pbs溶液中浸泡1天至溶胀平衡状态。将溶胀平衡后的水凝胶样品在37℃恒温条件下,用动态振荡模式进行测量。设置动态振荡模式的恒定变形为1%,频率为1~100hz。
122.由图可知,酶光双交联水凝胶的储能模量(g’)大于酶交联水凝胶,显示出不同的流变性能,采用实施例的动态硬化方式可以使水凝胶的流变性能发生显著变化,从而可以为不同的组织工程需求留下较大的调整空间。
123.实验例5
124.实施例1中,本实验例测试步骤c)所得酶交联水凝胶以及步骤d)所得酶光双交联水凝胶的溶胀性能,结果如图7所示。
125.溶胀性能的测试条件:直径为6mm厚度为2mm的酶交联水凝胶样品和酶光双交联水凝胶样品浸泡在pbs溶液中,放置于37℃恒温培养箱进行溶胀。当所有样品都达到溶胀平衡时,用称量药匙小心取出样品,并用无尘纸吸干水分以除去残留的液体,然后在分析天平上称重以获得指定时间点的平衡湿重(ws)。在每组水凝胶样品溶胀至7天后,除去多余的pbs溶液并将样品放入-80℃冰箱中冷冻过夜,然后使用冷冻干燥机将水凝胶样品冻干2天。测量每个样品的干重(wd)并记录。
126.由图7可知,酶交联水凝胶具有更大的溶胀吸水性能。
127.实验例6
128.实施例5制备得到了动态硬化的酶光双交联水凝胶,并以其3d载体培养细胞。图8为人脐带干细胞在酶光双交联水凝胶内培养第7天的细胞活性(绿色为活细胞,红色是死细胞)。
129.由图可知,该三维水凝胶载体具有良好的生物相容性,动态硬化后可以诱导人脐带干细胞分化成骨细胞或软骨细胞。细胞在混合过程、凝胶化过程、培养过程中的生物相容性良好。
130.实验例7
131.本实验例示例说明酶光双交联水凝胶的性能调节,如图9-图11所示。
132.图9-图10中,对应实施例2-3,将混合溶液的质量分数由10%增加到15%,酶交联水凝胶的压缩模量示意图相应增加,酶光双交联水凝胶的压缩模量相应增加。
133.图11中,对应实施例4,先光交联后酶交联后,水凝胶的压缩模量增加。
134.本发明中,将对羟基苯丙酸和甲基丙烯酸脱水甘油酯接枝到明胶上,两种接枝基团互不影响。改性后的明胶既可以进行酶交联,又可以进行光交联,两种交联方式互不影响,即先酶交联后光交联和先光交联后酶交联的结果无明显差别,酶交联时可以同时进行光交联;也可以酶交联后直接进行光交联,也可以酶交联后溶胀1-7天后再进行光交联。
135.酶光双交联增加了交联程度(交联位点密度),增强了水凝胶的力学性能。通过改变凝胶前体溶液浓度、辣根过氧化物酶浓度、双氧水的浓度、光引发剂浓度、酶交联时间和uv光照时间中的一种或几种可以控制所形成水凝胶的弹性模量和硬度,得到可调控机械性
能的酶光双交联水凝胶。
136.本发明酶交联中使用辣根过氧化物酶催化交联,对细胞无毒副作用且浓度易于控制;光交联操作简单易行,凝胶迅速且可通过uv光照时间调控水凝胶硬度。y型注射器的使用提高了酶交联的简便性,可以使凝胶前体溶液充分混合。光引发剂作为小分子易于从周围溶液中获取,使动态硬化切实可行。此外,本发明在酶光双交联水凝胶中负载人脐带干细胞进行三维培养,提供了体外构建三维细胞分化水凝胶载体,实验证明该水凝胶载体具有良好的生物相容性。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。