1.本发明属于微流控生物芯片技术领域,具体涉及一种用于细胞筛选的微流控芯片及其应用。
背景技术:
2.单克隆抗体,是由单个b细胞克隆产生的相同抗体,识别同一抗原的同一抗原表位。单克隆抗体具有高特异性、靶向性强的特点,目前,单克隆抗体是当今最大的生物药物类别,被用作治疗多种疾病(例如,炎症、心血管、传染性、自身免疫性疾病和癌症) 。目前,单抗的生产主要是以哺乳动物细胞系生产为主,因为其相较于其他细胞系在翻译后修饰或生物相容性等方面有更好的优势。用于生产单抗的细胞系有cho细胞,nso细胞,杂交瘤细胞等其他细胞系。但是分泌单抗的细胞在长期培养过程中,染色体上表达抗体重链和轻链的基因会发生基因的缺失或者是重排,导致异质性细胞的产生,在进化的角度来看,异质性细胞的产生增加了种群对环境的适应能力,但是在生物技术过程中,这种适应性的变化会导致特异性单抗产量的下降。
3.目前常用于制备单抗的方法有杂交瘤技术、抗体库技术以及免疫库技术。其中,(1)杂交瘤技术是最为经典的技术,杂交瘤技术是利用骨髓瘤细胞能够无限增殖的特点,将产生特异性抗体的b淋巴细胞与骨髓瘤细胞融合,得到既能只分泌一种特异性抗体又可以迅速增殖的杂交瘤细胞。介导两者融合的方法有通过聚乙二醇(peg)融合、仙台病毒等病毒诱导以及电穿孔融合等方法。然后利用hat培养基初步筛选b淋巴细胞与骨髓瘤细胞融合的细胞,排除同类融合或未融合的细胞。(2)抗体库技术包含噬菌体展示技术和酵母展示技术等。噬菌体展示技术是从b细胞中分离出抗体的基因序列,将该基因片段插入到噬菌体载体中时,其编码的抗体蛋白与噬菌体外壳蛋白融合表达出来,然后展示在噬菌体表面。酵母展示技术是将抗体中重链和轻链的可变区由linker连接成单链可变区抗体,与酵母表面细胞壁上的aga2p蛋白融合,结合荧光素标记的抗原,以facs方法分选结合活性的酵母细胞,然后体外细胞表达抗体。(3)免疫库技术,是基于二代测序技术,实现b细胞群体的全转录组测序分析。利用mrna反转录扩增抗体基因,获得所有的抗体基因,利用测序技术分析重链和轻链的频次推测配对抗体,提高抗体的多样性。
4.上述诸多的制备方法均会产生含有异质性细胞的细胞群体,整个细胞群体中包含了分泌特异性抗体的细胞以及分泌其他抗体的细胞;另外在分泌特异性抗体的细胞群体中,不同的b细胞分泌的特异性抗体的亲和力活性高低以及功能活性高低也不同。因此,从大量的细胞群体中筛选出高产量、高亲和力、以及功能活性强的b细胞成为抗体生产的难点。
5.目前基于抗体筛选的方法主要有酶联免疫吸附实验(elisa),流式细胞术,免疫荧光技术等,或者在微流控芯片上包被抗原特异性结合单克隆抗体与生物素-亲和素系统结合,又或是利用磁珠作为反应载体对单抗进行检测。
6.elisa方法采用有限稀释方法,使得每个微孔只包含单个或几个细胞,待单个细胞
繁殖形成克隆群体,收集上清液,然后通过elisa检测杂交瘤细胞分泌抗体的浓度。该方法筛选周期长,经过多次的循环筛选,长达数个月才能得到稳定细胞,该方法分析的细胞数量有限,筛选细胞量级在103个细胞。该方法通常需要与流式细胞术以及免疫荧光等方法联合使用,才能更加全面地、准确地评估抗体亲和力活性强弱。
7.流式细胞术的筛选方法是基于荧光探针,根据每个细胞检测信号利用介电泳力对细胞进行分选。流式细胞术可实现高通量的筛选,数分钟内完成106个细胞的筛选,但是与其他单细胞分析方法相比,需要大样本量,并且其前期的样品制备十分耗时。因此对于罕见细胞或者是少量细胞样本并不适用。
8.液滴微流控系统通常采用油包水的模式,细胞被捕获在水中,物理上与其他液滴分离,实现了单细胞捕获降低了交叉污染的风险。当前液滴的形成可以与电场、磁场或者声场结合提高单细胞捕获效率。微液滴的用途主要有两类:单细胞分析,通过在液滴中加入荧光探针来检测单细胞分泌的细胞因子和抗体等物质;单细胞分选,通过荧光激活液滴分选系统对液滴分选。相对于流式细胞术,液滴微流控系统并不需要大量的细胞样本,克服了流式细胞术不能检测分泌产物的局限性,可以进行高通量的筛选,能全面检测尽可能多的癌细胞,并且可以利用多个液滴融合的方法将试剂添加到液滴中,实现单细胞的裂解扩增等操作。但是微液滴的不足也十分明显,液滴的空间有限,不能实现长时间的细胞培养;其次,液滴空间密闭,多余的检测单抗的荧光探针不能被洗掉,会产生非特异性的背景干扰,降低检测精度;以及,随着液滴内单抗分泌的增多,抗体在一定浓度之后容易引起钩状效应,造成假阴性结果的出现。
9.微阵列系统是通过微加工技术制作与细胞尺寸相匹配微升或纳升体积的几何腔室来捕获细胞。微阵列系统与微液滴系统用途相近,可用于单细胞分析和单细胞分选,其相较于液滴微流控系统解决了细胞周围环境封闭的缺点,细胞产物和副产物通过层流不断灌注而不断冲刷出来,可对捕获的细胞进行精准实时控制,及时更换新鲜培养液为细胞生长提供充足的营养,也能通过排除多余的荧光探针降低非特异性背景干扰,但是该方法仅能实现确定抗体与抗原是否结合。
10.综上,目前对于杂交瘤细胞筛选方法均是基于单抗亲和力活性进行筛选,尚未有提出基于单抗功能活性对细胞筛选的方法,基于此,本发明提出一种用于细胞筛选的微流控芯片及其应用,既具有亲和力筛选的功能,还可实现细胞功能筛选,以及其他筛选功能。
技术实现要素:
11.本发明旨在至少解决现有技术中存在的技术问题之一,提供一种用于细胞筛选的微流控芯片及其应用。
12.本发明的一方面,提供一种用于细胞筛选的微流控芯片,包括:由下至上依次层叠设置的基板层、多细胞捕获层、多孔薄膜层以及单细胞捕获层;其中,所述单细胞捕获层朝向所述多孔薄膜层的一侧设置有至少一组单细胞流体通道,所述单细胞流体通道上设置有多个用于捕获任一个第一细胞的单细胞捕获单元;所述多细胞捕获层朝向所述多孔薄膜层的一侧设置有至少一组多细胞流体通道,所述多细胞流体通道上设置有多个用于捕获多个第二细胞的多细胞捕获单元;所述多孔薄膜层上设置有连通多个所述单细胞捕获单元、多个所述多细胞捕获单
元的多个微孔阵列。
13.可选的,所述单细胞捕获层包括两组对称设置的单细胞流体通道,每组所述单细胞流体通道包括多个平行设置且首尾相连的单细胞流道,每个所述单细胞流道上设置有多个单细胞捕获单元;所述多细胞捕获层包括两组对称设置的多细胞流体通道,每组所述多细胞流体通道包括多个平行设置且首尾相连的多细胞流道,每个所述多细胞流道上设置有与所述多个单细胞捕获单元相对应的多个多细胞捕获单元。
14.可选的,所述单细胞捕获单元包括位于所述单细胞流道上的单细胞培养区域与单细胞捕获窄口,以及跨接在所述单细胞流道上的单细胞流通区域;所述单细胞捕获窄口设置在所述单细胞培养区域背离流体流通方向的一侧。
15.可选的,每个所述多细胞流道包括两条平行设置且相连通的多细胞子流道,所述多个单细胞捕获单元位于两条多细胞子流道连通区域处;其中,所述多细胞捕获单元包括与其中一条多细胞子流道连接的多细胞培养区域、设置在所述多细胞培养区域朝向另一条所述多细胞子流道一侧的多细胞捕获窄口、以及连接所述多细胞捕获窄口与另一条所述多细胞子流道的多细胞连接区域。
16.可选的,所述单细胞捕获窄口的尺寸小于所述第一细胞的尺寸;和/或,所述多细胞捕获窄口的尺寸小于所述第二细胞的尺寸。
17.可选的,所述多孔薄膜层上设置贯穿其厚度的多个物质交换孔,所述多个物质交换孔形成所述微孔阵列;所述物质交换孔的尺寸小于所述第一细胞与所述第二细胞的尺寸。
18.可选的,所述物质交换孔的尺寸范围为5微米~20微米,所述物质交换孔之间的间距范围为5微米~20微米;和/或,所述单细胞流体通道的宽度范围为25微米~50微米,深度范围为25微米~50微米;和/或,所述多细胞流体通道的宽度范围为25微米~50微米,深度范围为25微米~50微米。
19.可选的,所述单细胞捕获层上设置有至少一个单细胞入口、至少一个单细胞出口、至少一个多细胞引入口、至少一个多细胞引出口以及单细胞入口通道与单细胞出口通道,所述单细胞流体通道的入口端通过所述单细胞入口通道与所述单细胞入口连接,所述单细胞流体通道的出口端通过所述单细胞出口通道与所述单细胞出口连接;和,所述多细胞捕获层上设置有多细胞入口、多细胞出口,多细胞入口通道、多细胞出口通道,所述多细胞流体通道的入口端通过所述多细胞入口通道与所述多细胞入口连接,所述多细胞流体通道的出口端通过所述多细胞出口通道与所多细胞出口连接;以及,所述多孔薄膜层上设置有多细胞连接入口与多细胞连接出口,所述多细胞引入口、所述多细胞连接入口以及所述多细胞入口依次对应连接,所述多细胞出口、所述多细胞连接出口以及所述多细胞引出口依次对应连接。
20.本发明的另一方面,提出一种用于细胞功能筛选的微流控芯片的应用,将前文记载的微流控芯片应用于第一细胞的捕获、培养、亲和力筛选、功能筛选和释放中至少一者。
21.可选的,所述应用包括下述步骤:
将检测蛋白包被于单细胞捕获层中;向所述单细胞捕获层中加入第一细胞,在多细胞捕获层中加入第二细胞;向所述单细胞捕获层中加入荧光探针;根据所述单细胞捕获层中的第一细胞的荧光结果评估所述第一细胞对所述第二细胞的影响结果,以对所述第一细胞的亲和力和/或功能进行筛选。
22.本发明提出一种用于细胞筛选的微流控芯片及其应用,通过引入微加工技术和微流控技术,开发出一款多层、多功能的微流控芯片,基于该微流控芯片结构实现了对杂交瘤细胞的细胞捕获、培养,以及还基于单细胞捕获单元与多细胞捕获单元可发生物质交换,通过对单细胞捕获单元中杂交瘤细胞分析,可获取杂交瘤细胞对癌细胞的亲和力以及功能影响结果,进而实现对杂交瘤细胞等其他对癌细胞有杀伤功能细胞的亲和力筛选、功能筛选以及释放,为细胞的功能筛选提供了一种新方法,能够更加快速准确,更方便的获取功能活性强的细胞。
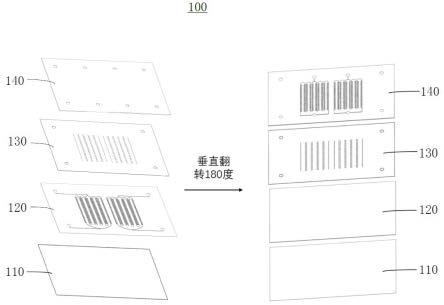
附图说明
23.图1为本发明一实施例的微流控芯片的结构分解示意图;图2为本发明另一实施例的微流控芯片中多细胞捕获层的结构示意图;图3为本发明图2中a处的局部放大图;图4为本发明另一实施例的微流控芯片中多孔薄膜层的结构示意图;图5为本发明图4中b处的局部放大图;图6为本发明另一实施例的微流控芯片中单细胞捕获层的结构示意图;图7为本发明图6中c处的局部放大图图8为本发明另一实施例的单细胞捕获层、多孔薄膜层以及多细胞捕获层俯视角度封装后的结构示意图;图9为本发明图8中d处的局部放大图。
具体实施方式
24.为使本领域技术人员更好地理解本发明的技术方案,下面结合附图和具体实施方式对本发明作进一步详细描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护范围。
25.除非另外具体说明,本发明中使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。本发明中使用的“包括”或者“包含”等既不限定所提及的形状、数字、步骤、动作、操作、构件、原件和/或它们的组,也不排除出现或加入一个或多个其他不同的形状、数字、步骤、动作、操作、构件、原件和/或它们的组。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示技术特征的数量与顺序。
26.在发明的一些描述中,除非另有明确的规定和限定,术语“安装”、“连接”、“相连”或者“固定”等类似的词语并非限定于物理的或者机械的连接,而是可以包括电性的连接,不管是直接的还是通过中间媒体间接连接,可以是两个元件内部的连通或者两个元件的互
相作用关系。以及,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”、等指示的方位或位置关系为基于附图所示的方位或位置关系,仅用于表示相对位置关系,当被描述对象的绝对位置改变后,则该相对位置关系也可能相应地改变。
27.如图1至图9所示,本发明的一方面,提供一种用于细胞筛选的微流控芯片100,包括:由下至上依次层叠设置的基板层110、多细胞捕获层120、多孔薄膜层130以及单细胞捕获层140,四层结构可依次叠放相互密封形成微流控芯片;其中,单细胞捕获层140朝向多孔薄膜层130的一侧设置有至少一组单细胞流体通道141,该单细胞流体通道141上设置有多个用于捕获任一个第一细胞(例如,杂交瘤细胞220)的单细胞捕获单元142;多细胞捕获层120朝向多孔薄膜层130的一侧设置有至少一组多细胞流体通道121,该多细胞流体通道121上设置有多个用于捕获多个第二细胞(例如,癌细胞210)的多细胞捕获单元122;多孔薄膜层130上设置有连通多个单细胞捕获单元142、多个多细胞捕获单元122的多个微孔阵列131。也就是说,单细胞捕获单元142、多细胞捕获单元122与微孔阵列131一一对应,单细胞捕获单元142与多细胞捕获单元122通过微孔阵列131实现物质交换。
28.本实施例通过引入微加工和微流控技术,开发出了一款多层、多功能的微流控芯片,设计有相对应的单细胞捕获单元与多细胞捕获单元,通过物质交换可以评估第一细胞对第二细胞的影响结果,例如,杂交瘤细胞分泌的单抗对癌细胞的杀伤功能性筛选,基于影响结果进而筛选出亲和力较好与杀伤功能较强的杂交瘤细胞,即本发明的微流控芯片除了实现细胞的捕获、培养外,还可同时实现亲和力筛选、功能筛选以及释放等,可以更加准确快速的获取活性强的第一细胞。
29.需要说明的是,本实施例的微流控芯片不局限于杂交瘤细胞分泌的单抗的功能性筛选,还可应用于其他细胞分泌的细胞因子的对细胞杀伤功能的筛选。
30.进一步需要说明的是,本实施例对于多细胞流体通道、单细胞流体通道的结构及数量不作具体限定,例如,可以仅设置一组,也可以设置两组、三组或者更多组,也就是说,可以为弯曲或折线布设的单条通道,或者是平行排布的多条通道。
31.具体地,为了形成对照示例,优选为两组弯曲布设通道平行排布,如图6和图7所示,单细胞捕获层140包括两组对称设置的单细胞流体通道141,每组单细胞流体通道141包括多条平行设置且首尾相连的单细胞流道141a,即实质上为一条连通的单细胞流道,将该一条单细胞流道经多次弯折后形成多组单细胞流道,每个单细胞流道141a上设置有多个单细胞捕获单元142。
32.进一步地,本实施例对于单细胞流道的数量以及单细胞捕获单元设置在每个单细胞流道上的位置均不作具体限定,例如,可以在单细胞子流道的任一侧上设置有多个单细胞捕获单元。
33.示例性的,如图6和图7所示,每组单细胞流体通道141包括十条单细胞流道141a,其中相邻的两条单细胞流道141a为一组,多个单细胞捕获单元142等间隔分布在一组单细胞流道141a的相对侧上。其中,单细胞捕获单元142包括位于单细胞流道141a上的单细胞培养区域142a与单细胞捕获窄口142b,以及跨接在单细胞流道141a上的单细胞流通区域142c,单细胞捕获窄口142b设置在单细胞培养区域142a背离流体流通方向一侧(图6中箭头所指方向为液体流动方向)。也就是说,单细胞培养区域142a与单细胞捕获窄口142b形成单
细胞捕获结构,单细胞流通区域142c设置在单细胞捕获结构的两侧,并与单细胞流道141a连通,通过该单细胞捕获结构捕获其中的一个杂交瘤细胞220,其余的杂交瘤细胞220通过单细胞流通区域142c流动至下一个单细胞捕获结构,以此类推,最终实现对杂交瘤细胞的捕获。
34.需要说明的是,本实施例的单细胞捕获窄口的宽度尺寸小于杂交瘤细胞尺寸,以将杂交瘤细胞拦截在单细胞培养区域中,实现对杂交瘤细胞的捕获。
35.进一步需要说明的是,本实施例对于单细胞培养区域不作限定,例如,可以为直径20~30微米的圆形单细胞培育区域和宽度5微米长为10微米的单细胞捕获窄口。
36.仍需要说明的是,本实施例对于单细胞流通区域的形状不作具体限定,只要能确保第一细胞通过即可,如图7所示,可以将该单细胞流通区域142c设置为“u”型结构,便于第一细胞的流动。
37.更进一步地,如图1和图6、图7所示,单细胞捕获层140上设置有两个单细胞入口143,以作为样品入口,两个单细胞出口144,以作为样品出口,用于样品的收集,两个单细胞入口通道145与两个单细胞出口通道146,单细胞流体通道141的入口端通过单细胞入口通道145与单细胞入口143连接,单细胞流体通道141的出口端通过单细胞出口通道146与单细胞出口144连接。
38.需要说明的是,本实施例对于单细胞入口与单细胞出口的位置不作具体限定,可以将单细胞入口与单细胞出口单细胞流体通道的中央位置,即单细胞入口通过单细胞入口通道与位于中间的单细胞流道入口端相连接,单细胞出口通过单细胞出口通道与两侧的单细胞流道出口端相连接,这样,杂交瘤细胞通过单细胞入口进入分别向两侧的单细胞流道流动,再经两侧的单细胞出口通道流出至单细胞出口。
39.更进一步地,本实施例的单细胞捕获结构上的单细胞流道宽度为25~50微米,深度为25~50微米,单细胞捕获层厚度为2~5毫米,用于对杂交瘤细胞的单细胞捕获。
40.需要说明的是,单细胞捕获层主要应用于杂交瘤细胞的捕获,在单细胞捕获层可以通过荧光检测对杂交瘤细胞亲和力鉴定,所以这一层所选用的单细胞捕获层材料应具有透光性良好、对多肽或蛋白质的吸附性强以及表面可修饰性强的特点,以及需易于制作样品进出口。再者,为实现单细胞的捕获,该材料能够兼容微加工技术;此外细胞被捕获后仍可在捕获单元中生长,该材料要有良好的生物相容性;最后单细胞捕获层需与多孔薄膜层连接密封起来,所以材料上的选择兼容性较强的材料。
41.示例性的,单细胞捕获层可选自生物相容性好、蛋白吸附性好的透明材料,优选pdms。
42.同样的,为了形成对照示例,如图2和图3所示,多细胞捕获层120也包括两组对称设置的多细胞流体通道121,每组多细胞流体通道121包括多个平行设置且首尾相连的多细胞流道,即实质上为一条连通的多细胞流道,将该一条多细胞流道经多次弯折后形成多个多细胞流道,每个多细胞流道上设置有与多个单细胞捕获单元相对应的多个多细胞捕获单元122。
43.进一步地,本实施例对于多细胞流道的数量以及多细胞捕获单元设置在每个多细胞流道上的位置均不作具体限定。
44.示例性的,如图2和图3所示,每组多细胞流体通道121包括有十个多细胞流道,同
样的,相邻的两个多细胞流道为一组,每个多细胞流道包括两条平行设置且相连通的多细胞子流道,分别为第一多细胞子流道121a与第二多细胞子流道121b,在第一多细胞子流道121a与第二多细胞子流道121b之间的连通区域设置有多个多细胞捕获单元122。
45.更进一步地,请继续参考图2和图3,多细胞捕获单元122包括与第一多细胞子流道121a连接的多细胞培养区域122a、设置在多细胞培养区域122a朝向第二多细胞子流道121b一侧的多细胞捕获窄口122b、以及连接多细胞捕获窄口122b与第二多细胞子流道121b的多细胞连接区域122c。也就是说,多细胞培养区域122a与多细胞捕获窄口122b形成多细胞捕获结构,多细胞培养区域122a自第一多细胞子流道121a向第二多细胞子流道121b方向延伸(即背离流体流动方向的一侧,图2中箭头所指方向为液体流动方向),形成半圆形结构,在该半圆形结构朝向第二多细胞子流道的一侧开设有多细胞捕获窄口122b,这样,通过该多细胞捕获结构捕获其中的多个癌细胞,其余的癌细胞通过第一多细胞子流道121a流动至下一个多细胞捕获结构,以此类推,最终实现对癌细胞210的捕获。
46.需要说明的是,本实施例的多细胞捕获窄口的宽度尺寸小于癌细胞尺寸,以将癌细胞拦截在多细胞培养区域中,实现对癌细胞的捕获。
47.更进一步地,如图2和图3所示,多细胞捕获层120上设置有两个多细胞入口123,以作为样品入口、两个多细胞出口124,以作为样品出口,用于样品的收集、两组多细胞入口通道125与两组多细胞出口通道126,多细胞流体通道121的入口端通过多细胞入口通道125与多细胞入口123连接,多细胞流体通道121的出口端通过多细胞出口通道126与多细胞出口124连接。
48.应当理解的是,由于多细胞捕获层位于下层,这样,需要在位于上层的单细胞捕获层设置样品引入口,样品引出口,以及在中间的多孔薄膜层上设置连接入口与连接出口。
49.示例性的,如图2至图7所示,单细胞捕获层140上设置有两个多细胞引入口147、两个多细胞引出口148,多孔薄膜层130上设置有多细胞连接入口132与多细胞连接出口133,多细胞引入口147、多细胞连接入口132以及多细胞入口123按流体流动方向依次对应连接,多细胞出口124、多细胞连接出口133以及多细胞引出口148按流体流动方向依次对应连接。
50.需要说明的是,本实施例对于多细胞入口与多细胞出口的位置不作具体限定,可以将其设置在多细胞捕获层的边缘区域,以分别通过多细胞入口通道,多细胞出口通道实现与多细胞流体通道的连接。
51.本实施例的多细胞捕获结构流道中的多细胞子流道宽度为25~50微米,深度为25~50微米,多细胞捕获层厚度为2~5毫米,用于对癌细胞捕获。
52.需要说明的是,本实施例的多细胞培养区域为半圆形多细胞培养区域,半圆的直径为50~100微米,可容纳多个癌细胞的生长。多细胞捕获窄口为宽5微米、长10微米。
53.进一步需要说明的是,多细胞捕获层是检测杂交瘤细胞功能活性的关键,是检测杂交瘤细胞对癌细胞的杀伤功能的主要场所。多细胞捕获层的功能主要是对癌细胞的捕获、癌细胞的培养以及对癌细胞染色,所以多细胞捕获的材料需有良好的生物相容性、兼容微加工技术。
54.示例性地,多细胞捕获层可选自生物相容性好、蛋白吸附性好的透明材料,优选pdms。
55.更进一步地,如图1至图9所示,多孔薄膜层130上设置贯穿其厚度的多个物质交换
孔131a,其中的多个物质交换孔131a形成微孔阵列131,微孔阵列131与单细胞捕获单元142、多细胞捕获单元122相对应(请参考图8和图9),起到连通单细胞捕获单元142和多细胞捕获单元122的作用,作为两单元物质交换的通道。
56.本实施例多孔薄膜层微孔单元有4~100个正方形或长方形或者是圆形微孔等距排布成正方形微孔单元;其中,正方形或呈长方形微孔边长5~20微米,圆形微孔直径5~20微米,微孔之间间距为5~20微米,以及,多孔薄膜层的厚度为30~1000微米。
57.需要说明的是,多孔薄膜层上含有若干微孔,起到连接单细胞捕获层和多细胞捕获层的作用,微孔起到单细胞捕获层捕获单元与多细胞捕获层捕获单元物质交换的作用。所以多孔薄膜层需有很好的生物相容性;同时为了不影响单细胞捕获层和多细胞捕获层的观察,其要有很好的透光性质。
58.示例性地,多孔薄膜层的材质选自延展性好、伸缩性强的透明柔性材料,优选pdms。
59.需要说明的是,本实施例的单细胞捕获层、多孔薄膜层以及多细胞捕获层均采用pdms(聚二甲基硅氧烷)材料,通过软光刻技术获得需要的单细胞捕获通道的厚度以及与癌细胞相匹配的多细胞捕获层,采用键合的方式使单细胞捕获层、多细胞捕获层分别与多孔薄膜层密接连接起来,其通道端与多孔薄膜区域密接连接起来,形成与多孔薄膜和单细胞捕获层、多细胞捕获层的密闭结构,其优点在与加工精度可控,加工便捷。
60.仍需要说明的是,本实施例的基板优选为玻璃基板,其厚度为1毫米~5毫米,大小与芯片大小相同,对芯片起到支撑作用。
61.本发明针对细胞的功能活性筛选设计出一款全新的微流控芯片,其目的在于在单细胞水平上,从大量细胞中检测出抗体亲和力强、功能活性高的细胞;实现方法是采用微流控芯片技术和微加工方法,将单细胞捕获、培养、亲和力鉴定、功能活性筛选和释放的功能集合在同一芯片上,达到快速筛选细胞的目的。
62.本发明的另一方面,提供一种用于细胞功能筛选的微流控芯片的应用,将前文记载的微流控芯片应用于杂交瘤细胞捕获、培养、亲和力筛选、功能筛选和释放中至少一者。
63.具体地,本实施例的微流控芯片用于单细胞的捕获、培养、亲和力筛选、功能筛选和释放,例如,可用于筛选可分泌特定抗体的杂交瘤细胞、可分泌特定细胞因子的细胞、对癌细胞有杀伤功能的杂交瘤细胞以及对癌细胞有杀伤功能的细胞因子分泌细胞,对此不作具体限定。
64.进一步地,利用前文记载的微流控芯片对杂交瘤细胞功能筛选的步骤包括:第一、向微流控芯片中通入酒精、磷酸盐缓冲液及进行预处理,然后向单细胞捕获层中加入检测蛋白溶液,使检测蛋白包被于所述单细胞捕获层的捕获通道上。
65.第二、向微流控芯片中通入待选的细胞悬浮液,在单细胞捕获层通入具有杀伤或者抑制癌细胞生长功能的杂交瘤细胞,在多细胞捕获层通入癌细胞;杂交瘤细胞在单细胞捕获层的单细胞捕获单元被捕获,癌细胞在多细胞捕获层的多细胞捕获单元被捕获。
66.第三、向单细胞捕获层中通入带有荧光的分子探针,用荧光显微镜从芯片正面观察单细胞捕获单元。
67.第四、根据单细胞捕获单元中的第一细胞(例如,杂交瘤细胞)是否有荧光以及荧光的强弱,通过荧光强弱说明杂交瘤细胞对癌细胞的影响大小,进一步实现对杂交瘤细胞
进行单抗亲和力上筛选和功能评估。
68.具体地,选定亲和力强的杂交瘤细胞后,定位其所在的单细胞捕获单元以及对应的多细胞捕获单元,然后用显微镜从芯片正面观察,并对多细胞捕获单元中的细胞计数。放入细胞培养箱中培养,在此期间每隔4h对多细胞捕获单元计数一次,检测细胞生长趋势。在培养72h后,向多细胞捕获单元通入区分细胞死活荧光分子探针,检测多细胞捕获单元中的细胞生长状态,细胞死亡数量比例大、细胞生长受到抑制作用强则说明其对应的杂交瘤细胞功能活性越强。
69.需要说明的是,本实施例的细胞悬浮液可以来自血液、活体组织以及人工培养的细胞溶液。样本为异质性的细胞群体,所用试剂为商品化产品,或自行配制或生物公司代加工生产。
70.进一步需要说明的是,荧光探针包括结合荧光分子的抗体、多肽,生物素亲和素及其衍生物,可以单独使用一种荧光探针对一种蛋白鉴定,也可联合使用多种荧光探针对一种蛋白鉴定。
71.基于上述应用,本发明还包括用于单细胞捕获、培养、亲和力筛选、功能筛选和释放的微流控芯片系统,该系统包括有微流控芯片、荧光探针、荧光显微镜、图像处理软件、注射泵以及循环泵装置。
72.具体地,应用过程如下:首先,用75%乙醇和无菌磷酸缓冲溶液(pbs)预先处理单细胞捕获层和多细胞捕获层。然后在单细胞捕获层泵入可特异性结合目标分子的检测蛋白,在4℃下包被过夜或者37℃下包被两个小时,将蛋白吸附在单细胞捕获层。然后在单细胞捕获层和多细胞捕获层通入细胞悬浮液,细胞浓度为1
×
106个/毫升左右,单细胞捕获层通入杂交瘤细胞,多细胞捕获层通入癌细胞。在单细胞捕获层中细胞被捕获单元捕获后,孵育0.5~4小时,然后用pbs清洗游离的单抗,泵入荧光探针,荧光探针会与单抗结合形成复合物,孵育0.5~4小时。最后泵入pbs除去未结合的荧光探针,使用荧光显微镜对微流控芯片的捕获单元扫描,记录荧光信号,泵入培养基继续培养。多细胞捕获层中癌细胞被捕获后,显微镜下观察拍照计数,然后继续培养。每隔4小时对多细胞捕获层中细胞计数,观察细胞数量的变化趋势,培养24~72小时后,向多细胞捕获层中泵入细胞死活染色试剂,检测细胞死亡率,对杂交瘤细胞功能活性评估。结合前面亲和力活性筛选结果,得到最理想的杂交瘤细胞。
[0073] 下面将结合具体实施例进一步说明微流控芯片的形成及其应用:实施例 1第一、提供单细胞捕获层与多孔薄膜层如图1至图9所示,单细胞捕获层140和多孔薄膜层130均采用pdms(聚二甲基硅氧烷)材料,通过软光刻技术获得需要的单细胞捕获通道的厚度,二者采用键合的方式密接连接起来。单细胞捕获层上设有两个贯穿整个单细胞捕获层140和多孔薄膜层130的孔作为多细胞捕获层120进出样孔,另外两个孔为单细胞捕获层的入样口和出样口。单细胞捕获层和多孔薄膜层的外廓尺寸与基板相匹配。
[0074]
其中,单细胞捕获层140的厚度为5毫米,流体通道包含两部分:连接出入口过度通道(单细胞入口通道和单细胞出口通道)宽度为100微米,分为两个捕获区域通道(单细胞流体通道)宽度变为25~30微米,整体通道的深度为25~30微米。在流道中,每隔100~300微米布
设一个单细胞捕获单元,单细胞捕获结构是由直径20~30微米的圆形单细胞培育区域和宽度5微米长为10微米的单细胞捕获窄口构成。多孔薄膜层的厚度为30~50微米。当需要单细胞捕获层的流道长度、宽度、深度以及单细胞捕获单元的数量发生变化时,可由本领域的技术人员根据自身所需来调整尺寸。
[0075]
第二、提供多细胞捕获层和玻璃基板如图1至图9所示,多细胞捕获层120和多孔薄膜层130均选择pdms作为多细胞捕获层的材料,通过软光刻技术制备出与细胞相匹配的多细胞捕获层,其优点在与加工精度可控,加工便捷。其通道端与多孔薄膜区域密接连接起来,形成与多孔薄膜和单细胞捕获层的密闭结构。
[0076]
其中,多细胞捕获层的流道排布平行于上述单细胞捕获层的流道,多细胞捕获层的厚度为5毫米,流体通道包含两部分:连接出入口的过度通道(多细胞入口通道和多细胞出口通道)宽度为100微米,多细胞捕获区域流道(多细胞流体通道)宽度为25~30微米,整个多细胞捕获层的流道深度为25~30微米。在多细胞捕获区域的流道中,每隔100~300微米布设一个多细胞捕获单元,共有300个多细胞捕获单元。多细胞捕获单元与单细胞捕获单元是上下对应的结构;多细胞捕获单元是指在流道的一侧存在一个半圆形多细胞培养区域,半圆的直径为50~100微米,可容纳多个癌细胞的生长,半圆形的多细胞培养区域连接宽5微米、长10微米的多细胞捕获窄口。多细胞捕获窄口的数量有3~20个,多细胞捕获窄口连接上溶液排出通道。当需要多细胞捕获层的流道长度、宽度、深度以及多细胞捕获单元的数量发生变化时,可由本领域的技术人员根据自身所需来调整尺寸。
[0077]
第三、封装如图1至图9所示,单细胞捕获层140、多孔薄膜层130、多细胞捕获层120和基板层110的材料分别是pdms、pdms、pdms和玻璃。采用氧等离子体辅助键合的方法,可以实现pdms和pdms、pdms和玻璃的密封连接。
[0078]
当然,在其他的实施方法中,可以根据单细胞捕获层、多孔薄膜层、多细胞捕获层、基板的材料选择合适的封接方法。
[0079]
第四、提供芯片应用的配套系统除了微流控芯片之外,本发明还需要荧光探针(probe)、细胞死活染色剂、荧光显微镜、imagej图像分析软件和微量注射泵共同构成完整的系统,完成对细胞捕获、培养、亲和力筛选、功能筛选以及释放。
[0080]
其中,荧光探针用于抗体分子的鉴定,本实施例采用了标记绿色荧光的山羊抗小鼠ig作为荧光探针,用于抗体亲和力的筛选。在其他的实施方法中,也可以针对不同的检测方法,选择不同的抗体、多肽或者生物素~亲和素反应系统及其衍生物作为探针。
[0081]
细胞死活染色剂用于多细胞捕获单元中细胞死活鉴定,本实施例采用了7~aad (7~氨基放线菌素d)染色区分正常细胞和坏死细胞,可以进入坏死细胞,与dna的gc区域结合,将坏死细胞染成红色。
[0082]
荧光显微镜用于检测单细胞捕获单元中和多细胞捕获单元中的细胞是否会产生荧光。并对单细胞捕获单元和多细胞捕获单元扫描成像,获取荧光图片。
[0083]
imagej图像分析软件用于分析荧光显微镜获取的图像并获得相应的荧光细胞的单细胞捕获单元数量。该软件通过对图像中荧光的强度进行计算,筛选出亲和力活性强的
细胞;对多细胞捕获单元的荧光图像中死亡细胞计数,获得功能活性强的细胞。
[0084]
微量注射泵用于驱动液体样品、液体培养基和相关试剂。
[0085]
第五、芯片的具体制作方法本实施例采用以下的制作工艺可成功制备出本发明中的微流控芯片。应当理解的是,下述给出的具体方法是为了协助本领域技术人员理解本发明的制作方法和要点,而不是对本发明所述器件的材料、尺寸和制作方法做出限定。
[0086]
制备过程如下:1)单细胞捕获层:采用n型4英寸硅片,使用半导体常用的icp干法刻蚀(感应等离子刻蚀,即使用六氟化硫和四氟化碳的高能等离子来刻蚀硅)加工,刻蚀出对应单细胞捕获层模具,然后将配置好的pdms胶状物浇筑到加工完成芯片模具上,经过加热交联反应,使其成为具有弹性的固体结构。带起凝固后脱模取出,切除pdms没有流道的部分,按照长3厘米,宽2厘米的外形尺寸切成长方形小片,使用打孔器在进样口和出样口打孔,获得单细胞捕获层。
[0087]
2)多孔薄膜层:采用n型4英寸硅片,使用半导体常用的icp干法刻蚀加工,刻蚀出对应多空薄膜层模具,然后通过旋涂仪器在其表面涂上一层15微米厚的pdms液体,待其凝固后脱模取出,按照长3厘米,宽2厘米的外形尺寸切成长方形薄膜。
[0088]
3)多细胞捕获层:采用n型4英寸硅片,使用半导体常用的icp干法刻蚀加工,刻蚀出对应多细胞捕获层模具,然后将配置好的pdms胶状物浇筑到加工完成芯片模具上,经过加热交联反应,使其成为具有弹性的固体结构。带起凝固后脱模取出,切除pdms没有流道的部分,按照长3厘米,宽2厘米的外形尺寸切成长方形小片,获得多细胞捕获层。
[0089]
4)基板:采用长度3厘米,宽度2厘米的玻璃片。
[0090]
5)芯片的组装和键合:将芯片的四个层经过蒸馏水、酒精或异丙醇超声清洗处理后,利用plasma等离子处理表面,按次序将单细胞捕获层、多孔薄膜层、多细胞捕获层以及基板键合封装起来,置于高温下待芯片完全密封后,最终形成完整芯片。
[0091]
6)芯片系统:在微流控芯片的基础上,使用聚四氟乙烯管连接泵和单细胞捕获层的样品进出口,将芯片放置在荧光显微镜下,并在imagej图像处理软件用于荧光图像的自动分析处理,即可完成整套系统的搭建。
[0092]
第六、微流控芯片的应用将本发明微流控芯片及相应系统成功应用于杂交瘤细胞的功能筛选。应当理解的是,下述给出具体方法是为了帮助本领域技术人员理解本发明的功能及应用方法,而不是对本发明所述装置的适用范围做出限定。
[0093]
应用过程如下:1)芯片使用之前,对芯片灭菌处理,将整个芯片浸入到75%酒精溶液中,同时利用注射泵和注射器将75%酒精溶液泵入到芯片内,静置30分钟后,泵入pbs,去除酒精,即本实施例用75%乙醇和无菌磷酸缓冲溶液(pbs)预先处理单细胞捕获层和多细胞捕获层。
[0094]
2)将检测蛋白通入单细胞捕获层中,放置4℃中,孵育过夜。次日,注入3%的bsa,孵育1小时,封闭未结合检测蛋白的位点。
[0095]
3)亲和力活性筛选:将异质性杂交瘤细胞群体调整至细胞浓度为1
×
105个/毫升,通过注射泵泵入到单细胞捕获层中,同时将癌细胞以细胞浓度为1
×
106个/毫升注入多细
胞捕获层中。放入细胞培养箱中孵育2小时,然后在单细胞捕获层中注入标记绿色荧光的山羊抗小鼠ig荧光二抗,孵育1小时,然后用pbs清洗未结合的二抗。使用荧光显微镜对单细胞捕获层中的捕获单元自动扫描,获取荧光图像后,泵入完全培养基培养。
[0096]
4)功能活性筛选:培养48小时后,向多细胞捕获层中泵入7~aad (7~氨基放线菌素d)染色试剂区分死细胞和活细胞,表征出相对应的单细胞捕获单元中第一细胞的杀伤功能活性。
[0097]
本发明提出一种用于细胞筛选的微流控芯片及应用,具有以下有益效果:第一、本发明通过引入微加工和微流控技术,开发出了一款多层、多功能的微流控芯片,实现了单细胞的捕获、培养、亲和力筛选、功能筛选以及释放,可以更加准确快速的获取功能活性强的细胞。
[0098]
第二、本发明通过设计微捕获单元,其大小与细胞大小尺寸相匹配,可用于捕获单细胞,并且在微结构上利用检测蛋白和荧光探针在细胞原位对细胞分泌的单抗亲和力活性进行筛选。并且对多细胞捕获单元中的细胞计数与染色,可评估细胞分泌单抗的功能活性能力,即本发明的芯片在细胞筛选领域中,对异质性的细胞群体中单细胞的筛选具有显著优势。
[0099]
第三、本发明利用微流控技术将繁琐的单细胞的捕获、培养、亲和力筛选、功能筛选以及释放集成在一个微流控芯片上,与原有技术相比,大大减少了操作步骤,从而也提高了实验成功率和可靠性,实现了多个实验步骤的高度集成化。同时,依赖于高度集成化的芯片和简化的操作步骤,缩短了实验时间,提高了样品处理效率。
[0100]
第四、本发明设计的微流控芯片的适用范围很广,本发明中所涉及的微流道、细胞捕获单元、微孔单元大小是可以根据不同细胞大小调整,也可以增加细胞捕获单元来增加筛选通量。并且本发明设计的微流控芯片不局限于杂交瘤细胞分泌的单抗的功能性筛选,还应用于其他细胞分泌的细胞因子的对细胞杀伤功能的筛选。
[0101]
可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。