1.本发明涉及益生菌领域,具体涉及一种用于预防龋齿、调节肠道菌群和免疫力的复合益生菌后生元组合物及制备方法和应用。
背景技术:
2.后生元(postbiotics)是近年来出现的一种干预肠道生态系统的新手段。2013年,tsilingiri k 等人提出后生元是指益生菌代谢活动释放的,并且能够以直接或间接的方式对宿主产生有益影响的因子。此后,不同的研究者又先后三次重新定义了后生元的概念。直到 2021年,国际益生菌和益生元科学会(isapp)发表了后生元的共识声明,首次提出了后生元的官方概念为“对宿主健康有益的无生命微生物和/或其成分的制剂”。由于后生元“无生命”等特征,使其拥有了巨大的应用前景。目前,后生元已然被产业界视为继益生菌、益生元和合生制剂之后的第四代微生态产品。
3.后生元的作用机制主要包括调节常驻菌群、增强上皮屏障功能、调节局部和全身免疫、调节系统代谢和通过神经系统发出系统信号。虽然后生元对微生物组的影响可能是暂时的,但它们仍然可能具有重要的作用。目前,后生元的热点研究主要集中于五个方面:第一,基于益生菌(如乳酸杆菌和双歧杆菌)控制生物被膜形成、调控基因表达、减少炎症细胞因子调节免疫力;第二,胞外多糖作为后生元的成分可以通过尚不明确的信号机制减少炎症,以促进屏障功能;第三,灭活乳酸菌对治疗肥胖的作用,其中干酪乳杆菌研究较多;第四,后生元改善细胞凋亡,调节肠道菌群的平衡,促进白细胞介素产生,对炎症性肠病产生作用;第五,后生元对肠道菌群、过敏性皮肤炎的健康作用研究。
技术实现要素:
4.因此,本发明要解决的技术问题在于一种用于预防龋齿、调节肠道菌群和免疫力的复合益生菌后生元组合物及制备方法和应用。
5.为此,本发明提供了如下的技术方案:一种复合益生菌后生元组合物,包括复合益生菌的灭活菌体和复合益生菌的代谢产物;所述复合益生菌包括干酪乳杆菌zhang(lactobacillus caseizhang)、动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9)和植物乳杆菌p-8(lactobacillus plantarum p-8);可选的,所述干酪乳杆菌zhang、动物双歧杆菌乳亚种v9和植物乳杆菌p-8按照菌落形成单位数目之比为(2-3):(2-3):(2-3)复合;可选的,所述干酪乳杆菌zhang、动物双歧杆菌乳亚种v9和植物乳杆菌p-8按照菌落形成单位数目之比为1:1:1或2:3:2复合;可选的,灭活复合益生菌之前,复合益生菌的总活菌数≥3.0
×
10
10
cfu/g。
6.可选的,所述代谢产物包括有机酸;可选的,所述有机酸包括乳酸、柠檬酸、草酸、苹果酸、苯乳酸、琥珀酸、4-羟基苯乳酸、水杨酸、香草酸、苯甲酸、苯丙氨酸和短链脂肪酸中的至少一种;可选的,所述短链脂肪酸包括乙酸、丙酸、丁酸和戊酸中的至少一种。
7.可选的,所述代谢产物还包括大豆皂苷、大豆异黄酮、γ-氨基丁酸、d-阿洛酮糖、3-吲哚丙烯酸、黄豆苷元、丁酸甘油酯、(e)-9-十八碳烯酰胺、preaustinoid a、活性短肽分子、三羟基黄酮、鸢尾酮、染料木黄酮、月桂基二乙醇胺和丙二酰染料木苷中的至少一种。
8.可选的,活性短肽分子如glu-phe-trp(谷氨酸-苯丙氨酸-色氨酸)。
9.一种所述的复合益生菌后生元组合物的制备方法,由复合益生菌经发酵、灭活得到的产物;可选的,将复合益生菌接种到料液中,添加乳糖酶,30-38℃进行恒温发酵,至ph 4.5-4.6停止发酵,加入辅料,然后预热、均质,随后灭活;可选的,乳糖酶的添加量为0.1ml/kg料液-1.0ml/kg料液;可选的,辅料包括麦芽糊精,添加量为5-25g/kg发酵料液;可选的,预热至55-60℃,经一级压力18~20.0 mpa、二级压力4.0-5.0 mpa均质;可选的,灭活的条件为温度为75-95℃,时间为15-30min;可选的,所述料液的制备方法包括:称取发酵原料、化料、均质、杀菌和/或冷却;可选的,所述发酵原料包括有机氮源、有机碳源和ph调节剂;可选的,有机氮源包括全脂豆粉、脱脂乳粉、乳清蛋白粉或大豆分离蛋白粉等;可选的,有机碳源包括脱脂乳粉、全脂豆粉、脱脂乳粉或乳清蛋白粉;可选的,所述ph调节剂包括柠檬酸钠;可选的,发酵原料包括全脂豆粉1.5-7重量份、脱脂乳粉11-18重量份、柠檬酸钠0.05-0.5重量份和水74.5-87.45重量份;可选的,所述化料的温度为55-60℃,时间为10-30min;可选的,所述料液的制备方法中,所述均质的条件为:55-60℃,一级压力18~20.0 mpa、二级压力4.0-5.0 mpa;可选的,所述料液的制备方法中,所述杀菌的条件为:90-95℃,15-45min。
10.一种制剂,以所述的复合益生菌后生元组合物或所述的复合益生菌后生元组合物的制备方法制备得到的复合益生菌后生元组合物为活性成分;可选的,还包括制剂允许的赋形剂或载体;可选的,所述制剂的形式包括液体制剂和固体制剂;可选的,所述制剂的形式包括注射剂、片剂、胶囊剂、粉剂、颗粒剂或膏剂。
11.所述的复合益生菌后生元组合物、所述的复合益生菌后生元组合物的制备方法制备得到的复合益生菌后生元组合物或所述的制剂具有如下任意一项中的用途:1)调节宿主肠道菌群;2)调节宿主免疫力;3)抑制口腔潜在病原菌;4)预防、缓解、辅助治疗或治疗龋齿和/或牙周病;5)调节口腔微生物多样性和/或口腔菌群结构;
6) 制备调节宿主肠道菌群的产品中的应用;7)制备调节宿主免疫力的产品中的应用;8)制备抑制口腔潜在病原菌的产品中的应用;9)制备预防、缓解、辅助治疗或治疗龋齿和/或牙周病的产品中的应用;10)制备调节口腔微生物多样性和/或口腔菌群结构的产品中的应用;11)制备预防、缓解、辅助治疗或治疗结肠炎的产品中的应用;12)制备提高体重的产品中的用途。
12.可选的,制备调节宿主il-1β、tnf-α和/或il-6水平的产品中的应用;或制备抑制口腔中链球菌属(streptococcus)、孪生球菌属(gemella)以及卟啉单胞菌属(porphyromonas)的产品中的应用;或制备改善宿主结肠组织损伤的产品中的应用;或制备保护宿主肠道上皮屏障的产品中的应用。
13.可选的,所述产品为食品、保健品或药品;可选的,所述产品为功能性烘焙食品、奶制食品、口腔护理制品或功能性保健品。
14.本发明技术方案,具有如下优点:本发明提供的一种复合益生菌后生元组合物,包括复合益生菌的灭活菌体和复合益生菌的代谢产物;复合益生菌包括干酪乳杆菌zhang(lactobacillus caseizhang)、动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9)和植物乳杆菌p-8(lactobacillus plantarum p-8);上述复合益生菌的灭活菌体具有较好抑制口腔潜在病原菌能力,可以起到预防、缓解、辅助治疗或治疗龋齿的效果,并且有效调节肠道菌群、保护肠道上皮屏障,免疫调节。除了益生菌菌体之外,复合益生菌的代谢产物还富含有机酸、短链脂肪酸等生物活性物质,它们可以进入宿主肠道被利用进一步调节机体代谢,在维持肠道健康、调节免疫反应和抑制口腔潜在病原菌方面发挥了重要作用。
附图说明
15.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
16.图1为实验例1中后生元调节与龋齿相关的口腔菌群研究中实验设计图;图2为实验例1中后生元调节与龋齿相关口腔微生物的多样性结果分析图; p《0.05表示具有显著差异;图3为实验例1中后生元调节与龋齿相关主要口腔微生物群的分类分布图;图中,a图为属水平分布,b图为物种水平分布;图中平均相对丰度低于 1% 的分类群被归类为“其它”;图4为实验例1中第 0 天和第 14 天不同组的口腔微生物群的主坐标分析(pcoa;bray-curtis 距离);图5为实验例1中adonis 测试结果评估第 0 天和第 14 天特定组之间的 β 多样
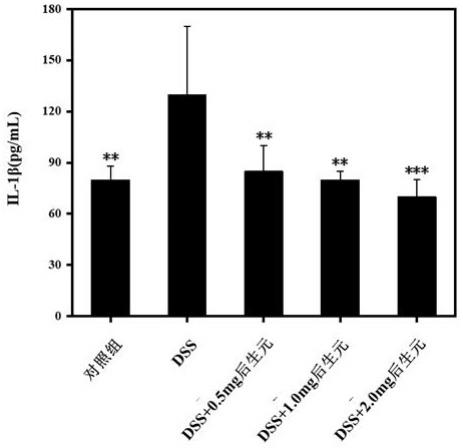
性差异;p《0.05表示具有显著差异;图6为实验例1中后生元联合充填治疗组与健康组和龋病充填治疗组与健康组之间 bray-curtis 距离的组间差异;p《0.05表示具有显著差异;图7为实验例1中后生元调节与龋齿相关口腔微环境中的重要致龋菌结果分析图;p《0.05表示具有显著差异;图8为实验例1中后生元调节与龋齿相关口腔微环境中的重要致龋菌相对丰度结果分析图;p《0.05表示具有显著差异;图9为实验例1中后生元联合充填治疗组与龋齿相关口腔微环境中的重要致龋菌相关性结果分析图;图10为实验例1中龋病充填治疗组与龋齿相关口腔微环境中的重要致龋菌相关性结果分析图;图11为实验例1中后生元调节与龋齿填充治疗结果分析图;图中,a图为各组口腔微生物群中好氧菌、厌氧菌、兼性厌氧菌的相对丰度;b图为各组口腔微生物群中含移动元件的菌、革兰氏阴性菌、革兰氏阳性菌的相对丰度;c图为各组口腔微生物群中的形成生物膜菌、潜在致病性菌、抗氧化胁迫菌的相对丰度;p《0.05表示具有显著差异;图12-1为实验例1中通过未观察状态重建社区系统发育调查2(picrust2)预测受试者口腔微生物群的功能特征,并通过wilcoxon检验比较各组第0天和第14天的数据;其中,a图表示c0 和 d0之间存在显著差异的丰富途径,b图表示a14 和 b14 之间存在显著差异的丰富途径;p《0.05表示具有显著差异;图12-2为实验例1中通过未观察状态重建社区系统发育调查2(picrust2)预测受试者口腔微生物群的功能特征,并通过wilcoxon检验比较各组第0天的数据;其中,表示a0、b0 和 d0之间存在显著差异的丰富途径;p《0.05表示具有显著差异;图12-3为实验例1中通过未观察状态重建社区系统发育调查2(picrust2)预测受试者口腔微生物群的功能特征,并通过wilcoxon检验比较各组第0天和第14天的数据;其中,a图为京都基因和基因组百科全书(kegg)正位学(ko),b图为预测a14和b14之间的酶;p《0.05表示具有显著差异;图13为实验例中摄入复合益生菌后生元21天后,大鼠结肠he染色结果;control为正常组;dss为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg 后生元为高剂量后生元组;图14为实验例中的摄入复合益生菌后生元21天后,不同处理组对ibd大鼠免疫因子il-1β的影响;对照组为正常组;硫酸葡聚糖钠盐(dss)为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg后生元为高剂量后生元组;图15为实验例中的摄入复合益生菌后生元21天后,不同处理组对ibd大鼠免疫因子tnf-α的影响;对照组为正常组;dss为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg后生元为高剂量后生元组;图16为实验例中的摄入复合益生菌后生元21天后,不同处理组对ibd大鼠免疫因子il-6的影响;对照组为正常组;dss为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg后生元为高剂量后生元组;图17为实验例中的摄入复合益生菌后生元21天后,大鼠体重变化水平;对照组为
正常组;dss为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg后生元为高剂量后生元组;图18为实验例中的摄入复合益生菌后生元21天后,大鼠组织学损伤评分;对照组为正常组;dss为模型组;dss+0.5mg后生元为低剂量后生元组;dss+1mg 后生元为中剂量后生元组;dss+2mg后生元为高剂量后生元组;上述图中,a_0(或a0)表示a组第0天采集的样本,a_14(或a14)表示a组第14天采集的样本;b _0(或b0)表示b组第0天采集的样本,b_14(或b14)表示b组第14天采集的样本;c_0(或c0)表示c组第0天采集的样本,c_14(或c14)表示c组第14天采集的样本;d表示d组第0天采集的样本。
具体实施方式
17.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
18.实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
19.下述实施例中:干酪乳杆菌zhang(lactobacillus caseizhang),其保藏编号为cgmcc no.5469;动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9),其保藏编号为cgmcc no.5470;植物乳杆菌p-8(lactobacillus plantarum p-8),其保藏编号为cgmcc no.6312;上述的干酪乳杆菌zhang、动物双歧杆菌乳亚种v9和植物乳杆菌p-8均已经公开在专利文献cn114432346a中。
20.实施例1 复合益生菌后生元组合物本实施例提供了一种复合益生菌后生元组合物,包括复合益生菌的灭活菌体和复合益生菌的代谢产物;所述复合益生菌包括干酪乳杆菌zhang(lactobacillus caseizhang)、动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9)和植物乳杆菌p-8(lactobacillus plantarum p-8)。
21.上述复合益生菌后生元组合物的制备方法,包括如下步骤:1)称料:将全脂豆粉4wt%、脱脂乳粉14.5wt%、柠檬酸钠2.5wt%和余量为水,按比例需求混合;2)化料: 58℃化料15min,得到料液;3)均质:58℃,一级压力19 mpa、二级压力5.0 mpa;4)杀菌:均质后的料液进行93℃、30 min杀菌;5)冷却:杀菌后的料液冷却至35℃;6)添加菌种和乳糖酶:料液中加入复合益生菌:干酪乳杆菌zhang、动物双歧杆菌
乳亚种v9和植物乳杆菌p-8按照菌落形成单位数目之比为1:1:1加入,总接种量为6
×
106cfu/g(料液),并按生产需求添加乳糖酶(酶活为5000u/g)0.5ml/kg(料液);7)恒温发酵:35℃进行恒温发酵,至ph 4.5-4.6停止,大约18-19 h (复合益生菌总活菌数≥3.0
×
10
10
cfu/g);8)灭活:按生产需求混合麦芽糊精18g/kg(发酵料液),预热至58℃,经一级压力19 mpa、二级压力5.0 mpa均质后,进行杀菌灭活(灭活条件85℃,15min);9)喷雾干燥:将灭活的菌悬液经喷雾干燥得到后生元粉(即复合益生菌后生元粉剂)。
22.检测复合益生菌后生元粉剂中代谢物质。
23.将后生元样品与水1:4(质量比例)混合均匀后,吸取0.1ml于1.5ml管中,加入0.4ml提取液(甲醇:乙腈=1:1(v/v)),充分振荡后放入超声波冷水浴10min;将水浴后的1.5ml管放置-40℃低温冰箱中孵育1h;取出试样后,12000
×
g离心20min;吸取上清过膜后转移至上样瓶中,另外将全部样品等量吸取上清制成质控样本,跟随试验样本上机检测。使用vanquish (thermo fisher scientific)超高效液相色谱仪,通过waters acquity uplc beh amide (2.1 mm
ꢀ×ꢀ
100 mm, 1.7 μm)液相色谱柱对目标化合物进行色谱分离。样品盘温度:4℃,进样体积:2μl。经proteo wizard将原始数据转换成mzxml格式,使用r语言并基于xcms的内部程序完成峰检测、提取、对齐和积分处理,获取最终代谢物质名称,检测结果为最终代谢产物中含有有机酸,所述有机酸包括乳酸、柠檬酸、草酸、苹果酸、苯乳酸、琥珀酸、4-羟基苯乳酸、水杨酸、香草酸、苯甲酸、苯丙氨酸和短链脂肪酸中的至少一种;所述短链脂肪酸包括乙酸、丙酸、丁酸和戊酸中的至少一种,还包括大豆皂苷、大豆异黄酮、γ-氨基丁酸、d-阿洛酮糖、3-吲哚丙烯酸、黄豆苷元、丁酸甘油酯、(e)-9-十八碳烯酰胺、preaustinoid a、活性短肽分子、三羟基黄酮、鸢尾酮、染料木黄酮、月桂基二乙醇胺和丙二酰染料木苷中的至少一种。
24.实施例2复合益生菌后生元组合物本实施例提供了一种复合益生菌后生元组合物,包括复合益生菌的灭活菌体和复合益生菌的代谢产物;所述复合益生菌包括干酪乳杆菌zhang(lactobacillus caseizhang)、动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9)和植物乳杆菌p-8(lactobacillus plantarum p-8)。
25.上述复合益生菌后生元组合物的制备方法,包括如下步骤:1)称料:将全脂豆粉1.5wt%、脱脂乳粉11wt%、柠檬酸钠0.05wt%和余量为水,按比例需求混合;2)化料: 55℃化料30min,得到料液;3)均质:55℃,一级压力18 mpa、二级压力4.0 mpa;4)杀菌:均质后的料液进行90℃、45 min杀菌;5)冷却:杀菌后的料液冷却至35℃;6)添加菌种和乳糖酶:料液中加入复合益生菌:干酪乳杆菌zhang、动物双歧杆菌乳亚种v9和植物乳杆菌p-8按照菌落形成单位数目之比为2:3:2加入,接种量为6
×
106cfu/g(料液),并按生产需求添加乳糖酶(酶活为5000u/g)0.1ml/kg(料液);
7)恒温发酵:35℃进行恒温发酵,至ph 4.5-4.6停止,大约18-19 h (复合益生菌总活菌数≥3.0
×
10
10
cfu/g);8)灭活:按生产需求混合麦芽糊精5g/kg(发酵料液),预热至55℃,经一级压力18 mpa、二级压力4.0 mpa均质后,进行杀菌灭活(灭活条件75℃,30min);9)喷雾干燥:将灭活的菌悬液经喷雾干燥得到后生元粉(即复合益生菌后生元粉剂)。
26.检测复合益生菌后生元粉剂中代谢物质。
27.实施例3复合益生菌后生元组合物本实施例提供了一种复合益生菌后生元组合物,包括复合益生菌的灭活菌体和复合益生菌的代谢产物;所述复合益生菌包括干酪乳杆菌zhang(lactobacillus caseizhang)、动物双歧杆菌乳亚种v9(bifidobacteriumanimalissubsp.lactisv9)和植物乳杆菌p-8(lactobacillus plantarum p-8)。
28.上述复合益生菌后生元组合物的制备方法,包括如下步骤:1)称料:将全脂豆粉7wt%、脱脂乳粉18wt%、柠檬酸钠0.5wt%和余量为水,按比例需求混合;2)化料:60℃化料10min,得到料液;3)均质:60℃,一级压力20.0 mpa、二级压力5.0 mpa;4)杀菌:均质后的料液进行95℃、15 min杀菌;5)冷却:杀菌后的料液冷却至35℃;6)添加菌种和乳糖酶:料液中加入复合益生菌:干酪乳杆菌zhang、动物双歧杆菌乳亚种v9和植物乳杆菌p-8按照菌落形成单位数目之比为2.5:2.5:2.5加入,接种量为6
×
106cfu/g(料液),并按生产需求添加乳糖酶(酶活为5000u/g)1.0ml/kg(料液);7)恒温发酵:35℃进行恒温发酵,至ph 4.5-4.6停止,大约18-19 h (复合益生菌总活菌数≥3.0
×
10
10
cfu/g);8)灭活:按生产需求混合麦芽糊精25g/kg(发酵料液),预热至60℃,经一级压力20.0 mpa、二级压力5.0 mpa均质后,进行杀菌灭活(灭活条件95℃,15min);9)喷雾干燥:将灭活的菌悬液经喷雾干燥得到后生元粉(即复合益生菌后生元粉剂)。
29.检测复合益生菌后生元粉剂中代谢物质。
30.实验例1 后生元调节与龋齿相关的口腔菌群研究1实验方法1.1实验制剂:实施例1制备得到的复合益生菌后生元粉剂。
31.1.2试验分组试验分组设计图见图1,共招募98名志愿者(18-30岁),龋病充填治疗组(40人,其中2人试验过程中退出,图1中(b)组)、后生元联合充填治疗组(41人,其中3人试验过程中退出,图1中(a)组)、龋病组(8人,图1中(d)组)和健康组(9人,图1中(c)组)。后生元联合充填治疗组,在充填治疗的过程中,复合益生菌后生元粉剂每天两次(中餐、晚餐后食用),每次0.6g,连续服用14天。在龋病充填治疗后第0、14天采集各组唾液样本,16s rrna全长测序用
于菌群后续分析(qiime2)。
32.1.3实验结果1.3.1口腔微生物多样性结果分析在香农指数(shannon index)分析结果和辛普森指数(simpsonindex)中,龋病组口腔菌群的样本内多样性(alpha多样性)显著高于健康组(p=0.001和p=0.036),充填治疗组显著降低了患者口腔菌群alpha多样性(p《0.05),治疗14天后,相比单独充填治疗,后生元联合充填治疗组的复合益生菌后生元粉剂辅助治疗更显著地降低了alpha多样性,如图2所示。所述后生元干预能更有效地调节口腔微生物多样性。
33.1.3.2 口腔菌群结构变化结果分析如图3-图6所示,治疗后第0天,发现龋病充填治疗组、后生元联合充填治疗组与健康组口腔菌群结构无显著差异,但与龋病组均存在显著差异(p《0.05),说明从无龋到龋齿的转变可能会导致口腔菌群结构的发生显著变化;与第0天相比,充填治疗14天后(龋病充填治疗组、后生元联合充填治疗组)口腔菌群结构会发生显著改变,而健康志愿者菌群结构则相对稳定;治疗14天后,后生元联合充填治疗组的bray-curtis距离虽然与健康组仍有显著差异,但比充填治疗组与健康组的距离更近,说明后生元联合充填治疗更有利于调节龋病患者口腔菌群结构的恢复。
34.1.3.3 口腔微环境中的重要致龋菌结果分析龋病组患者口腔中链球菌属(streptococcus)、孪生球菌属(gemella)以及卟啉单胞菌属(porphyromonas)的相对丰度显著高于健康组(p《0.05),这些属可能是口腔微环境中重要的致龋菌,如图7所示。
35.相比于龋病组,填充治疗后患者口腔中卟啉单胞菌属、链球菌属、孪生球菌属等相对丰度显著下降,简明弯曲菌(campylobacter concisus)和微好气戴阿利斯特菌(dialisterinvisus)的相对丰度显著增加( p《0.05 )。后生元联合充填治疗14天后,假单胞菌属(pseudomonas)的丰度显著增加,沙氏普雷沃菌(prevotellashahii)显著减少,如图8所示。
36.相比于充填治疗组,后生元联合充填治疗菌群间相关性更强(159 vs 114),提示后生元干预可能使患者口腔菌群趋于稳定,如图9-10所示。
37.1.3.4 龋病填充治疗结果分析与健康组相比,龋病组口腔菌群的生物膜形成能力显著增强(p=0.005),补牙后,菌群的生物膜形成能力明显减弱,但仍未恢复到健康组状态。龋病组口腔菌群中致病菌显著增加(p《0.05),仅填充治疗暂时不会显著降低潜在致病菌的相对丰度(p》0.05),无后生元干预,致病菌丰度在治疗14天后会再次显著增加(p《0.05);仅充填治疗14天后,抗氧化胁迫菌丰度显著降低,而后生元联合充填治疗组则可保持抗氧化胁迫菌丰度稳定。相比于填充治疗组,后生元联合填充治疗显著上调了甲醛同化、甲醛氧化通路及多种与能量相关的酶丰度(p《0.05)。综上,补充后生元可有效地调节患者口腔菌群多样性,促进相关能量酶的丰度,显著抑制潜在致病菌的丰度,提高菌群的抗氧化应激能力,进而加强龋病填充治疗效果。如图11以及图12-1、图12-2、图12-3所示。
38.1.4结论补充本发明的复合益生菌后生元组合物能够更有效的调节口腔微生物多样性,有
利于调节龋病患者口腔菌群结构的恢复,显著抑制潜在致病菌的丰度,起到预防或治疗龋齿的效果,使患者口腔菌群更加趋于稳定。
39.实验例2不同剂量益生菌后生元对ibd大鼠影响的临床研究1实验方法1.1实验制剂:实施例1制备得到的复合益生菌后生元粉剂(简称后生元)。
40.1.2试验分组本实验采用硫酸葡聚糖钠盐(dss)诱导炎症性肠炎(ibd)大鼠模型,具体分组如下:6周龄wistar雄性大鼠随机分成正常组(12只)、模型组(12只)、低剂量后生元组(12只)、中剂量后生元组(12只)、高剂量后生元组(12只)。正常组(0-21d:生理盐水,每天一次,每只灌胃2ml);模型组(0-7d:3%硫酸葡聚糖钠盐(dss),每天一次,每只灌胃2ml;7-21d:生理盐水,每天一次,每只灌胃2ml);低剂量后生元组(0-7d:3%dss,每天一次,每只灌胃2ml;7-21d:每天一次,每次0.5mg后生元/只,灌胃);中剂量后生元组(0-7d:3%dss,每天一次,每只灌胃2ml;7-21d:每天一次,每次1mg后生元/只,灌胃);高剂量后生元组(0-7d:3%dss,每天一次,每只灌胃2ml;7-21d:每天一次,每次2mg后生元/只,灌胃)。
41.分别在0、7、21天(d)收集大鼠粪便和血清样品,分别用于代谢组和宏基因组检测,分析大鼠结肠组织损伤水平、免疫因子指标(il-1β、tnf-α、il-6)水平和体重的变化。
42.1.3实验结果1.3.1 不同处理组大鼠结肠he染色结果分析21天后,收集各组大鼠的结肠组织进行he染色,与模型组(图13中硫酸葡萄糖钠盐(dss))比较,中剂量后生元组(图13中dss 1mg后生元)和高剂量后生元组(图13中dss 2mg后生元),粘膜层肠上皮结构基本完整,上皮细胞脱落和固有层与粘膜下层的水肿较少,未见明显炎症,如图13所示。
43.1.3.2不同处理组对炎症性肠炎(ibd)大鼠免疫因子的影响与模型组相比,中剂量后生元组(图14、图15、图16中dss 1mg后生元)和高剂量后生元组(图14、图15、图16中dss 2mg后生元)均可降低ibd大鼠血清中的il-1β、tnf-α和il-6含量。而低剂量后生元(图16中dss 0.5mg后生元)对il-6无作用,如图14、图15、图16所示。
44.1.3.3不同处理组对ibd大鼠体重和组织学评分的影响低剂量后生元对改善ibd大鼠结肠组织损伤和恢复体重没有效果;中和高剂量后生元可改善ibd大鼠结肠组织损伤,提高大鼠体重,如图17、图18所示。
45.1.4结论通过对ibd大鼠结肠组织损伤水平、免疫因子指标(il-1β、tnf-α、il-6)水平和体重的变化分析发现,后生元可以通过宿主调节肠道菌群和免疫因子,进而有效改善ibd大鼠炎症症状,改善结肠组织损伤,提高体重。
46.经过动物试验表明,该产品对于调节肠道菌群和免疫力,改善结肠组织损伤有显著的治疗功效。
47.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。