α-2-肾上腺素能受体激动剂的药物组合物和其用于改善视力的用途
1.相关申请的交叉引用
2.本技术要求于2020年2月20日提交的美国临时申请62/979,214的权益和/或优先权,所述临时申请通过引用以其全文并入本文。
技术领域
3.本发明总体上涉及化合物的药物组合物和其用于改善个体视力的用途。本发明具体涉及α-2肾上腺素能受体激动剂化合物、α-2肾上腺素能受体激动剂的药物组合物以及其用于改善视力,如在治疗如老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如,夜间近视)等眼部病状中的用途。
背景技术:
4.老花眼是眼睛逐渐失去聚焦近处物体的能力,这可能干扰如阅读、操作智能手机或平板电脑或在计算机上工作等日常任务。随着年龄的增长,晶状体失去其柔性,这会导致逐渐失去调节能力,并且因此失去其聚焦近处物体的能力。这种晶状体柔性的降低会导致图像模糊和敏度丧失,这由于瞳孔扩张而加剧(如在低光条件下发生的情况)。老花眼开始出现在人四十多岁早期到中期,并且会恶化到65岁左右。为了矫正阅读视力,患有老花眼的患者通常会寻求若干种治疗选项(如老花镜、隐形眼镜和人工晶状体)以及如屈光性晶状体置换术等外科手术替代方案。虽然老花镜可以既简单又便宜,但可能会带来不便和审美问题,而且戴双焦眼镜会增加老年人跌倒相关联的风险。与眼镜相关联的不便和问题以及用于治疗老花眼的侵入性外科手术选项的一种替代方案是用缩瞳剂收缩瞳孔大小。
5.另外,lasik外科手术的一个副作用是周边角膜曲率的像差,这可能使另外的光线进入眼睛,从而导致视觉障碍,如视觉眩光、视觉星爆和视觉光晕,尤其是在低光条件下瞳孔扩张时。通过收缩瞳孔,可以阻挡这种异常的周边光线并减少视觉障碍。事实上,溴莫尼定(brimonidine)(p),一种可减小患者的瞳孔大小的眼科α-2-肾上腺素能受体激动剂,用于减少lasik外科手术后患者的眩光和星爆。以类似的方式,一些人由于瞳孔扩张而仅在夜间出现近视,这可能使另外的周边未聚焦光线进入眼睛,从而导致远距离视力模糊。此类个体也可能从瞳孔大小减小中受益。
6.然而,尽管溴莫尼定偶尔用于减小瞳孔大小,但其在长期使用后往往会失去功效,对深虹膜的个体效果较差而且作用时间短。因此,需要改进的和长效的药物组合物和减小瞳孔大小的方法,如本文所描述的那些药物组合物和方法,以治疗眼部病状,如老花眼、夜间视力低下、视觉眩光、视觉星爆和视觉光晕以及一些形式的近视(例如,夜间近视)。
技术实现要素:
7.本文公开了药物组合物和其在改善有需要的受试者的视力的方法中的用途,以及治疗有需要的个体的眼部病状的方法。
8.在第一方面,本文描述了包括式i的化合物的药物组合物:
[0009][0010]
或其药学上可接受的盐、缓冲剂(例如,柠檬酸盐和/或磷酸盐缓冲剂)、氯化钠和水。
[0011]
另一方面,本文描述了通过向所述个体施用本文所描述的组合物来治疗有需要的个体的眼部病状的方法。
[0012]
下面给出一些非限制性示例实施例。
[0013]
示例实施例1:一种药物组合物,其包括式i的化合物:
[0014][0015]
或其药学上可接受的盐、缓冲剂、氯化钠和水。
[0016]
示例实施例2:根据示例实施例1所述的药物组合物,其中所述式i的化合物以介于约0.003%与约1%(w/v)之间的量存在于所述组合物中。
[0017]
示例实施例3:根据示例实施例2所述的药物组合物,其中所述式i的化合物以约0.01%(w/v)的量存在于所述组合物中。
[0018]
示例实施例4:根据示例实施例2所述的药物组合物,其中所述式i的化合物以约0.03%(w/v)的量存在于所述组合物中。
[0019]
示例实施例5:根据示例实施例2所述的药物组合物,其中所述式i的化合物以约0.1%(w/v)的量存在于所述组合物中。
[0020]
示例实施例6:根据示例实施例2所述的药物组合物,其中所述式i的化合物以约0.3%(w/v)的量存在于所述组合物中。
[0021]
示例实施例7:根据示例实施例1至6中任一项所述的药物组合物,其中所述缓冲剂是柠檬酸盐缓冲剂和磷酸盐缓冲剂。
[0022]
示例实施例8:根据示例实施例7所述的药物组合物,其中所述柠檬酸盐缓冲剂包括柠檬酸,并且所述磷酸盐缓冲剂包括磷酸氢二钠。
[0023]
示例实施例9:根据示例实施例8所述的药物组合物,其中所述柠檬酸以介于约0.01%与1%(w/v)之间的量存在于所述组合物中。
[0024]
示例实施例10:根据示例实施例8或9中任一项所述的药物组合物,其中所述柠檬酸以约0.1%(w/v)的量存在于所述组合物中。
[0025]
示例实施例11:根据示例实施例8或9中任一项所述的药物组合物,其中所述柠檬酸以约0.09%(w/v)的量存在于所述组合物中。
[0026]
示例实施例12:根据示例实施例8至11中任一项所述的药物组合物,其中所述磷酸
氢二钠以介于约0.01%与2%(w/v)之间的量存在于所述组合物中。
[0027]
示例实施例13:根据示例实施例8至12中任一项所述的药物组合物,其中所述磷酸氢二钠以约0.5%(w/v)的量存在于所述组合物中。
[0028]
示例实施例14:根据示例实施例8至12中任一项所述的药物组合物,其中所述磷酸氢二钠以约1%(w/v)的量存在于所述组合物中。
[0029]
示例实施例15:根据示例实施例1至14中任一项所述的药物组合物,其中所述氯化钠以至少0.6%(w/v)的量存在于所述组合物中。
[0030]
示例实施例16:根据示例实施例1至14中任一项所述的药物组合物,其中所述氯化钠以约0.6%(w/v)的量存在于所述组合物中。
[0031]
示例实施例17:根据示例实施例1至16中任一项所述的药物组合物,其中所述组合物的ph介于约4.5与约8之间。
[0032]
示例实施例18:根据示例实施例1至17中任一项所述的药物组合物,其中所述组合物的ph介于约6.5与约7.6之间。
[0033]
示例实施例19:根据示例实施例1至18中任一项所述的药物组合物,其中所述组合物的ph为约7。
[0034]
示例实施例20:根据示例实施例1所述的药物组合物,其中所述式i的化合物以约0.01%(w/v)的量存在于所述组合物中,所述氯化钠以至少0.6%的量存在于所述组合物中,所述缓冲剂是包括柠檬酸的柠檬酸盐缓冲剂以及包括磷酸氢二钠的磷酸盐缓冲剂。
[0035]
示例实施例21:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.1%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以1%(w/v)的量存在于所述组合物中。
[0036]
示例实施例22:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.09%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以0.5%(w/v)的量存在于所述组合物中。
[0037]
示例实施例23:根据示例实施例1所述的药物组合物,其中所述式i的化合物以约0.03%(w/v)的量存在于所述组合物中,所述氯化钠以至少0.6%的量存在于所述组合物中,所述缓冲剂是包括柠檬酸的柠檬酸盐缓冲剂以及包括磷酸氢二钠的磷酸盐缓冲剂。
[0038]
示例实施例24:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.1%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以1%(w/v)的量存在于所述组合物中。
[0039]
示例实施例25:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.09%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以0.5%(w/v)的量存在于所述组合物中。
[0040]
示例实施例26:根据示例实施例1所述的药物组合物,其中所述式i的化合物以约0.1%(w/v)的量存在于所述组合物中,所述氯化钠以至少0.6%的量存在于所述组合物中,所述缓冲剂是包括柠檬酸的柠檬酸盐缓冲剂以及包括磷酸氢二钠的磷酸盐缓冲剂。
[0041]
示例实施例27:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.1%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以1%(w/v)的量存在于所述组合物中。
[0042]
示例实施例28:根据示例实施例20所述的药物组合物,其中所述柠檬酸以约0.09%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以0.5%(w/v)的量存在于所述组合物中。
[0043]
示例实施例29:根据示例实施例1所述的药物组合物,其中所述式i的化合物以约0.3%(w/v)的量存在于所述组合物中,所述氯化钠以至少0.6%的量存在于所述组合物中,所述缓冲剂是包括柠檬酸的柠檬酸盐缓冲剂以及包括磷酸氢二钠的磷酸盐缓冲剂。
[0044]
示例实施例30:根据示例实施例16所述的药物组合物,其中所述柠檬酸以约0.1%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以1%(w/v)的量存在于所述组合物中。
[0045]
示例实施例31:根据示例实施例16所述的药物组合物,其中所述柠檬酸以约0.09%(w/v)的量存在于所述组合物中,并且所述磷酸氢二钠以0.5%(w/v)的量存在于所述组合物中。
[0046]
示例实施例32:一种治疗需要此类治疗的个体的眼部病状的方法,所述方法包括向所述个体施用根据示例实施例1至31中任一项所述的药物组合物,并且其中所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕和夜间近视。
[0047]
示例实施例33:根据示例实施例32所述的方法,其中所述眼部病状是老花眼。
[0048]
示例实施例34:根据示例实施例32所述的方法,其中所述眼部病状是夜间视力低下。
[0049]
示例实施例35:根据示例实施例32所述的方法,其中所述眼部病状是视觉眩光。
[0050]
示例实施例36:根据示例实施例33所述的方法,其中所述眼部病状是视觉星爆。
[0051]
示例实施例37:根据示例实施例33所述的方法,其中所述眼部病状是视觉光晕。
[0052]
示例实施例38:根据示例实施例33所述的方法,其中所述眼部病状是夜间近视。
[0053]
示例实施例39:根据示例实施例32至38中任一项所述的方法,其中向所述个体的一只或两只眼睛施用所述药物组合物。
[0054]
示例实施例40:根据示例实施例39所述的方法,其中所述向所述眼睛施用是局部施用。
[0055]
示例实施例41:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述式i的化合物或其药学上可接受的盐对虹膜色素的结合小于由溴莫尼定展现出的对虹膜色素的结合。
[0056]
示例实施例42:根据示例实施例33至40中任一项所述的方法,其中所述式i的化合物或其药学上可接受的盐的量为比达到相同治疗效果所需的溴莫尼定的量小的量。
[0057]
示例实施例43:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到介于2mm与3mm之间的大小。
[0058]
示例实施例44:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到3mm或更小的大小。
[0059]
示例实施例45:根据示例实施例33至40中任一项所述的方法,其中在向所述个体
施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到2.5mm或更小的大小。
[0060]
示例实施例46:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述药物组合物引起近视敏度的改善。
[0061]
示例实施例47:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述药物组合物引起中间视敏度的改善。
[0062]
示例实施例48:根据示例实施例33至40中任一项所述的方法,其中在向所述个体施用时,所述药物组合物引起远视敏度的改善。
[0063]
示例实施例49:根据示例实施例46至48中任一项所述的方法,其中所述视敏度的改善是至少2行改善。
[0064]
示例实施例50:根据示例实施例46至48中任一项所述的方法,其中所述视敏度的改善是至少3行改善。
[0065]
示例实施例51:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少1小时。
[0066]
示例实施例52:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少2小时。
[0067]
示例实施例53:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少4小时。
[0068]
示例实施例54:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少6小时。
[0069]
示例实施例55:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少9小时。
[0070]
示例实施例56:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少10小时。
[0071]
示例实施例57:根据示例实施例43至50中任一项所述的方法,其中所述瞳孔大小的减小或视敏度的改善维持至少12小时。
[0072]
示例实施例58:根据示例实施例43至50中任一项所述的方法,其中当所述个体暴露于小于200cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0073]
示例实施例59:根据示例实施例43至50中任一项所述的方法,其中当所述个体暴露于小于150cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0074]
示例实施例60:根据示例实施例43至50中任一项所述的方法,其中当所述个体暴露于小于100cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0075]
示例实施例61:根据示例实施例43至60中任一项所述的方法,其中当所述个体暴露于小于50cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0076]
示例实施例62:根据示例实施例43至60中任一项所述的方法,其中当所述个体暴露于小于10cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0077]
示例实施例63:根据示例实施例43至60中任一项所述的方法,其中当所述个体暴露于小于5cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0078]
示例实施例64:根据示例实施例43至60中任一项所述的方法,其中当所述个体暴
露于小于2cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0079]
示例实施例65:根据示例实施例1至31中任一项所述的药物组合物,其在治疗有需要的个体的眼部病状的方法中使用,所述方法包括向所述个体施用所述药物组合物,并且其中所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕和夜间近视。
[0080]
示例实施例66:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是老花眼。
[0081]
示例实施例67:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是夜间视力低下。
[0082]
示例实施例68:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是视觉眩光。
[0083]
示例实施例69:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是视觉星爆。
[0084]
示例实施例70:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是视觉光晕。
[0085]
示例实施例71:根据示例实施例65所述的供使用的药物组合物,其中所述眼部病状是夜间近视。
[0086]
示例实施例72:根据示例实施例65至71中任一项所述的供使用的药物组合物,其中向所述个体的一只或两只眼睛施用所述药物组合物。
[0087]
示例实施例73:根据示例实施例72所述的供使用的化合物或其药学上可接受的盐,其中所述向所述眼睛施用是局部施用。
[0088]
示例实施例74:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述式i的化合物或其药学上可接受的盐的量对虹膜色素的结合小于由溴莫尼定展现出的对虹膜色素的结合。
[0089]
示例实施例75:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中所述式i的化合物或其药学上可接受的盐的量为比达到相同治疗效果所需的溴莫尼定的量小的量。
[0090]
示例实施例76:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到介于2mm与3mm之间的大小。
[0091]
示例实施例77:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到3mm或更小的大小。
[0092]
示例实施例78:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到2.5mm或更小的大小。
[0093]
示例实施例79:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述药物组合物引起近视敏度的改善。
[0094]
示例实施例80:根据示例实施例65至73中任一项所述的供使用的药物组合物,其
中在向所述个体施用时,所述药物组合物引起中间视敏度的改善。
[0095]
示例实施例81:根据示例实施例65至73中任一项所述的供使用的药物组合物,其中在向所述个体施用时,所述药物组合物引起远视敏度的改善。
[0096]
示例实施例82:根据示例实施例79至81中任一项所述的供使用的药物组合物,其中所述视敏度的改善是至少2行改善。
[0097]
示例实施例83:根据示例实施例79至81中任一项所述的供使用的药物组合物,其中所述视敏度的改善是至少3行改善。
[0098]
示例实施例84:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少1小时。
[0099]
示例实施例85:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少2小时。
[0100]
示例实施例86:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少4小时。
[0101]
示例实施例87:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少6小时。
[0102]
示例实施例88:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少9小时。
[0103]
示例实施例89:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少10小时。
[0104]
示例实施例90:根据示例实施例76至83中任一项所述的供使用的药物组合物,其中所述瞳孔大小的减小或视敏度的改善维持至少12小时。
[0105]
示例实施例91:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于200cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0106]
示例实施例92:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于150cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0107]
示例实施例93:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于100cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0108]
示例实施例94:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于50cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0109]
示例实施例95:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于10cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0110]
示例实施例96:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于5cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0111]
示例实施例97:根据示例实施例76至90中任一项所述的供使用的药物组合物,其中当所述个体暴露于小于2cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0112]
示例实施例98:根据示例实施例1至31中任一项所述的药物组合物在治疗有需要的个体的眼部病状的方法中的用途,所述方法包括向所述个体施用所述药物组合物,并且其中所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕和夜间近视。
[0113]
示例实施例99:根据示例实施例98所述的用途,其中所述眼部病状是老花眼。
[0114]
示例实施例100:根据示例实施例98所述的用途,其中所述眼部病状是夜间视力低下。
[0115]
示例实施例101:根据示例实施例98所述的用途,其中所述眼部病状是视觉眩光。
[0116]
示例实施例102:根据示例实施例98所述的用途,其中所述眼部病状是视觉星爆。
[0117]
示例实施例103:根据示例实施例98所述的用途,其中所述眼部病状是视觉光晕。
[0118]
示例实施例104:根据示例实施例98所述的用途,其中所述眼部病状是夜间近视。
[0119]
示例实施例105:根据示例实施例98至104中任一项所述的用途,其中向所述个体的一只或两只眼睛施用所述药物组合物。
[0120]
示例实施例106:根据示例实施例105所述的用途,其中所述向所述眼睛施用是局部施用。
[0121]
示例实施例107:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述式i的化合物或其药学上可接受的盐的量对虹膜色素的结合小于由溴莫尼定展现出的对虹膜色素的结合。
[0122]
示例实施例108:根据示例实施例98至106中任一项所述的供使用的用途,其中所述式i的化合物或其药学上可接受的盐的量为比达到相同治疗效果所需的溴莫尼定的量小的量。
[0123]
示例实施例109:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到介于2mm与3mm之间的大小。
[0124]
示例实施例110:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到3mm或更小的大小。
[0125]
示例实施例111:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到2.5mm或更小的大小。
[0126]
示例实施例112:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起近视敏度的改善。
[0127]
示例实施例113:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起中间视敏度的改善。
[0128]
示例实施例114:根据示例实施例98至106中任一项所述的用途,其中在向所述个体施用时,所述药物组合物引起远视敏度的改善。
[0129]
示例实施例115:根据示例实施例112至114中任一项所述的用途,其中所述视敏度的改善是至少2行改善。
[0130]
示例实施例116:根据示例实施例112至114中任一项所述的用途,其中所述视敏度的改善是至少3行改善。
[0131]
示例实施例117:根据示例实施例109至116中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少1小时。
[0132]
示例实施例118:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少2小时。
[0133]
示例实施例119:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少4小时。
[0134]
示例实施例120:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少6小时。
[0135]
示例实施例121:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少9小时。
[0136]
示例实施例122:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少10小时。
[0137]
示例实施例123:根据示例实施例109至114中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少12小时。
[0138]
示例实施例124:根据示例实施例109至123中任一项所述的用途,其中当所述个体暴露于小于200cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0139]
示例实施例125:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于150cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0140]
示例实施例126:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于100cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0141]
示例实施例127:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于50cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0142]
示例实施例128:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于10cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0143]
示例实施例129:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于5cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0144]
示例实施例130:根据示例实施例102至123中任一项所述的用途,其中当所述个体暴露于小于2cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0145]
示例实施例131:一种式i的化合物:
[0146][0147]
或其药学上可接受的盐在制造用于治疗有需要的个体的眼部病状的药物中的用
途,其中所述药物是示例实施例1至31中任一项所述的药物组合物,并且其中所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕和夜间近视。
[0148]
示例实施例132:根据示例实施例131所述的用途,其中所述眼部病状是老花眼。
[0149]
示例实施例133:根据示例实施例131所述的用途,其中所述眼部病状是夜间视力低下。
[0150]
示例实施例134:根据示例实施例131所述的用途,其中所述眼部病状是视觉眩光。
[0151]
示例实施例135:根据示例实施例131所述的用途,其中所述眼部病状是视觉星爆。
[0152]
示例实施例136:根据示例实施例131所述的用途,其中所述眼部病状是视觉光晕。
[0153]
示例实施例137:根据示例实施例131所述的用途,其中所述眼部病状是夜间近视。
[0154]
示例实施例138:根据示例实施例131至137中任一项所述的用途,其中在向所述个体施用时,所述药物施用于所述个体的一只或两只眼睛。
[0155]
示例实施例139:根据示例实施例138所述的用途,其中所述向所述眼睛施用是局部施用。
[0156]
示例实施例140:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物中的所述式i的化合物或其药学上可接受的盐的量对虹膜色素的结合小于由溴莫尼定展现出的对虹膜色素的结合。
[0157]
示例实施例141:根据示例实施例131至139中任一项所述的供使用的用途,其中所述药物中的所述式i的化合物或其药学上可接受的盐的量为比达到相同治疗效果所需的溴莫尼定的量小的量。
[0158]
示例实施例142:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到介于2mm与3mm之间的大小。
[0159]
示例实施例143:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到3mm或更小的大小。
[0160]
示例实施例144:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起瞳孔大小的一定量的减小,使得所述瞳孔被收缩到2.5mm或更小的大小。
[0161]
示例实施例145:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起近视敏度的改善。
[0162]
示例实施例146:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起中间视敏度的改善。
[0163]
示例实施例147:根据示例实施例131至139中任一项所述的用途,其中在向所述个体施用时,所述药物引起远视敏度的改善。
[0164]
示例实施例148:根据示例实施例145至147中任一项所述的用途,其中所述视敏度的改善是至少2行改善。
[0165]
示例实施例149:根据示例实施例145至147中任一项所述的用途,其中所述视敏度的改善是至少3行改善。
[0166]
示例实施例150:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大
小的减小或视敏度的改善维持至少1小时。
[0167]
示例实施例151:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少2小时。
[0168]
示例实施例152:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少4小时。
[0169]
示例实施例153:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少6小时。
[0170]
示例实施例154:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少9小时。
[0171]
示例实施例155:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少10小时。
[0172]
示例实施例156:根据示例实施例142至149中任一项所述的用途,其中所述瞳孔大小的减小或视敏度的改善维持至少12小时。
[0173]
示例实施例157:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于200cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0174]
示例实施例158:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于150cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0175]
示例实施例159:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于100cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0176]
示例实施例160:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于50cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0177]
示例实施例161:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于10cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0178]
示例实施例162:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于5cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0179]
示例实施例163:根据示例实施例142至156中任一项所述的用途,其中当所述个体暴露于小于2cd/m2的亮度水平时,实现了所述瞳孔大小的减小或视敏度的改善。
[0180]
示例实施例164:一种基本上如本文所描述的药物组合物。
[0181]
示例实施例165:一种药物组合物,其包括式i的化合物:
[0182][0183]
或其药学上可接受的盐、缓冲剂、氯化钠和水。
[0184]
示例实施例166:一种基本上如本文所描述的治疗眼部病状的方法,所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕和夜间近视。
[0185]
示例实施例167:一种基本上如本文所描述的用药物组合物治疗眼部病状的方法,所述眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕
和夜间近视。
[0186]
示例实施例168:一种基本上如本文所描述的使用药物组合物的方法,所述药物组合物包括式i的化合物:
[0187][0188]
或其药学上可接受的盐、缓冲剂、氯化钠和水。
附图说明
[0189]
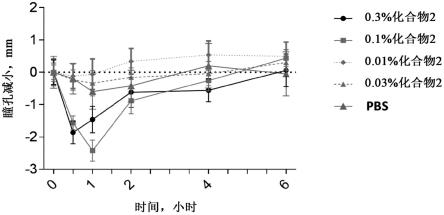
图1示出了当局部给药化合物2(参见实例1)时荷兰腰带兔(dutch belted rabbits)中的剂量缩瞳应答曲线图。百分比量为%w:v。
[0190]
图2示出了当局部给药溴莫尼定(化合物4;参见实例1)时荷兰腰带兔中的剂量缩瞳应答曲线图。百分比量为%w:v。
[0191]
图3示出了当局部给药式i的化合物(化合物1;参见实例1)时荷兰腰带兔中的剂量缩瞳应答曲线图。百分比量为%w:v。
[0192]
图4示出了当以0.1%w:v给药式i的化合物(化合物1)或溴莫尼定(化合物4)时具有》2.5mm瞳孔变化的受试者(兔)的应答者分析。
[0193]
图5示出了溴莫尼定(化合物4)和式i的化合物(化合物1;参见实例1)在室光条件下在db兔中局部给药后缩瞳作用持续时间的比较。百分比量为%w:v。
[0194]
图6示出了当局部给药式i的化合物(化合物1;参见实例1)时荷兰腰带兔中的剂量缩瞳应答曲线图(超过9小时)。百分比量为%w:v。
[0195]
图7示出了当局部给药式i的化合物(化合物1,参见实例1)或化合物3(参见实例1)时荷兰腰带兔中的剂量缩瞳应答曲线的比较图。百分比量为%w:v。
具体实施方式
[0196]
应当理解的是,前述概括描述和以下详细描述都仅是示例性和解释性的,并且不限制所要求保护的本发明。如本文所使用的,除非另外特别说明,否则单数的使用包含复数。如本文所使用的,除非另外说明,否则“或”意指“和/或”。此外,术语“包含(including)”以及如“包含(包含(includes)”和“包含(included)”等其它形式的使用不是限制性的。本文中使用的章节标题仅出于组织目的,而不应被解释为对所描述的主题进行限制。
[0197]
除非提供具体的定义,否则本文所描述的与分析化学、合成有机和无机化学的实验室程序和技术结合使用的命名是本领域已知的。标准化学符号可以与此类符号所代表的全名互换使用。因此,例如,术语“氢”和“h”被理解为具有相同的含义,“甲基”、“me”和“ch
3”也是如此。标准技术可以用于化学合成、化学分析和调配物。
[0198]
在一些实施例中,所描述的化合物(如式i的化合物)可以包含其药学上可接受的盐。此类盐可以包含例如酸加成盐,如盐酸盐、氢溴酸盐、硫酸盐、硝酸盐、磷酸盐、乙酸盐、丙酸盐、乙醇酸盐、丙酮酸盐、草酸盐、苹果酸盐、丙二酸盐、琥珀酸盐、马来酸盐、富马酸盐、
酒石酸盐、柠檬酸盐、苯甲酸盐、肉桂酸盐、扁桃酸盐、甲磺酸盐、乙磺酸盐、对甲苯磺酸盐、水杨酸盐等,以及碱加成盐,如钠、钾、钙、镁、锂、铝、锌、铵、乙二胺、精氨酸、哌嗪等以及本领域技术人员在阅读本公开内容时可识别的其它盐(参见例如,《药用盐手册(handbook of pharmaceutical salts)》,p.heinrich stahl和camille g.wermuth(编辑),verlag;《苏黎世瑞士化学学报(helvetica chimica acta-z
ü
rich)》,2002,329
–
345;以及berge等人,《药物科学杂志(journal of pharmaceutical science)》,1977,66:1
–
19)。
[0199]
本文所描述的某些化合物可以作为互变异构体存在,所述化合物之间可以相互转化。除非另有说明,否则本文对特定互变异构体的结构描述不应解释为将化合物限制为所描述的特定互变异构体(即使其可能不是特定条件下的主要互变异构体)。
[0200]
除非本文另有说明,术语“约”在用于提及值(例如,重量百分比)时旨在包含与所列举的值(和/或值的范围)相近的值,所述值在单个成分(例如,活性成分或赋形剂)、组合物或实施例的功能性方面是等效的(例如,生物等效的)。此外,如本领域技术人员将理解的,所有数字,包含那些表达成分的量、特性(如分子量、反应条件等)的数字都是近似值,并且被理解为在所有情况下任选地被术语“约”修改这些值可以根据本领域技术人员利用本文所描述的教导寻求获得的期望的特性而变化。还应理解,此类值固有地含有由在其各自的测试测量中发现的标准偏差必然导致的可变性,并且一些值和数量可以向上取整或向下取整,使得其将与另一个值或量“大致相同”。
[0201]
术语“治疗有效量”是指当向如人或非人患者等需要治疗眼部病状的个体施用以治疗眼部病状时有效的量。如本文所描述的,当向个体施用将治疗有效量的化合物和/或组合物时,眼部病状的治疗程度和/或成功对于技术人员来说将是容易识别的。
[0202]
本文描述了药物组合物和使用所述组合物改善有需要的个体的视力的方法,以及使用所述组合物治疗有需要的个体的眼部病状的方法。视力或视觉改善,包含但不限于近视敏度、中间视敏度和/或远视敏度,可以例如反映在给药后任何时间点正确阅读的字母数量的增加,平均字母变化的增加,或2线或3线(至少)改善,所有这些都是在不同照明水平(例如,小200cd/m2、小于150cd/m2、小于100cd/m2、小于50cd/m2、小于10cd/m2、小于5cd/m2、小于2cd/m2以及这些亮度水平之间的范围)下从基线(即,从预处理)开始的。夜间视力改善可以反映在昏暗或黑暗照明下(例如,在中视或暗视条件下)患者的视力改善。日间视力改善可以反映在患者在白天或阳光下(例如,明视条件下)的明亮照明下的视力改善。使用本文所描述的实施例的视力改善也可以与其它视觉辅助工具和装置(尤其是用于治疗老花眼的那些辅助工具和装置)组合或在使用时实现,包含但不限于老花镜、晶状体修饰药物和包含人工晶状体(iol)在内的外科手术老花眼选择。
[0203]
在一些实施例中,眼部病状是可以通过收缩瞳孔大小来治疗的病状。不希望受理论束缚,本发明人相信通过收缩瞳孔,实现了“针孔效应”,所述效应可以具有治疗效果,如改善焦深、视敏度,以及用于治疗眼科病状的其它效果,如本文描述的那些效果。在针孔效应中,减小瞳孔直径会增加焦深并通过阻挡一些周边光线进入眼睛来减少光散射,从而防止周边未聚焦的光线到达视网膜。例如,这些行动可以帮助改善老花眼的阅读视力和通勤者的夜间驾驶视力。因此,可以使用本文所描述的组合物通过本文所描述的方法治疗的病状可以包含例如老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视)。
[0204]
因此,本文描述了化合物、药物组合物和用于通过使用本文所描述的药物组合物来减小瞳孔大小以治疗需要此类治疗的个体的眼部病状的方法。
[0205]
在一个实施例中,所述药物组合物包括式i的化合物:
[0206][0207]
或其药学上可接受的盐、缓冲剂、氯化钠和水。在另一个实施例中,所述药物组合物基本上由式i的化合物或其药学上可接受的盐、缓冲剂、氯化钠和水组成。
[0208]
式i的化合物可以通过技术人员已知的方法合成(参见例如,美国专利6,495,583和5,478,858)。
[0209]
在一些实施例中,所述缓冲剂是柠檬酸盐缓冲剂。在一些实施例中,所述缓冲剂是磷酸盐缓冲剂。在一些实施例中,所述缓冲剂是柠檬酸盐和磷酸盐缓冲剂。
[0210]
在一些实施例中,所述柠檬酸盐缓冲剂包括柠檬酸并且所述磷酸盐缓冲剂包括磷酸氢二盐缓冲剂,如磷酸氢二钠或磷酸氢二钾。
[0211]
在一些实施例中,所述柠檬酸以介于约0.01%与约1%(w/v)之间,例如约0.1%或约0.09%(w/v)的量存在于所述组合物中。
[0212]
在一些实施例中,所述柠檬酸以介于约0.089%与约0.11%(w/v)之间、介于约0.079%与约0.13%(w/v)之间、介于约0.071%与约0.14%(w/v)之间、介于约0.063%与约0.16%(w/v)之间、介于约0.056%与约0.18%(w/v)之间、介于约0.050%与约0.20%(w/v)之间、介于约0.045%与约0.22%(w/v)之间、介于约0.040%与约0.25%(w/v)之间、介于约0.035%与约0.28%(w/v)之间、介于约0.032%与约0.32%(w/v)之间、介与约0.028%与约0.35%(w/v)之间、介于约0.025%与约0.40%(w/v)之间、介于约0.022%与约0.45%(w/v)之间、介于约0.020%与约0.50%(w/v)之间、介于约0.018%与约0.56%(w/v)之间、介于约0.016%与约0.63%(w/v)之间、介于约0.014%与约0.71%(w/v)之间、介于约0.013%与约0.79%(w/v)之间、介于约0.011%与约0.89%(w/v)之间、介于约0.010%与约1%(w/v)之间,以及介于任何这些所选的柠檬酸的量之间的范围的量存在于所述组合物中。
[0213]
制备药物组合物时柠檬酸的来源可以是无水柠檬酸,或者其可以是柠檬酸的水合形式(例如一水合物)或任何其它形式的适用于制备药物组合物的柠檬酸,例如柠檬酸一钠(无水)、柠檬酸二钠(倍半水合物)、柠檬酸三钠(无水,二水合物)以及技术人员在阅读本公开内容后可识别的其它形式,使得药物组合物中柠檬酸的最终量介于约0.01%与约1%(w/v)之间,例如约0.1%或约0.09%(w/v)。
[0214]
在一些实施例中,所述磷酸氢二钠以介于约0.01%与约2%(w/v)之间,例如约0.5%或约1%(w/v)的量存在于所述组合物中。
[0215]
在一些实施例中,所述磷酸氢二钠以介于约0.79%与约1.0%(w/v)之间、介于约0.63%与约1.1%(w/v)之间、介于约0.50%与约1.1%(w/v)之间、介于约0.40%与约1.1%(w/v)之间、介于约0.32%与约1.2%(w/v)之间、介于约0.25%与约1.2%(w/v)之间、介于约0.20%与约1.3%(w/v)之间、介于约0.16%与约1.3%(w/v)之间、介于约0.13%与约
1.4%(w/v)之间、介于约0.10%与约1.4%(w/v)之间、介与约0.079%与约1.5%(w/v)之间、介于约0.063%与约1.5%(w/v)之间、介于约0.050%与约1.6%(w/v)之间、介于约0.040%与约1.6%(w/v)之间、介于约0.032%与约1.7%(w/v)之间、介于约0.025%与约1.7%(w/v)之间、介于约0.020%与约1.8%(w/v)之间、介于约0.016%与约1.9%(w/v)之间、介于约0.013%与约1.9%(w/v)之间、介于约0.010%与约2%(w/v)之间,以及介于任何这些所选的磷酸氢二钠的量之间的范围的量存在于所述组合物中。
[0216]
在一些实施例中,所述磷酸氢二钠以介于约0.41%与约0.54%(w/v)之间、介于约0.34%与约0.58%(w/v)之间、介于约0.28%与约0.62%(w/v)之间、介于约0.23%与约0.66%(w/v)之间、介于约0.19%与约0.71%(w/v)之间、介于约0.15%与约0.76%(w/v)之间、介于约0.13%与约0.81%(w/v)之间、介于约0.10%与约0.87%(w/v)之间、介于约0.09%与约0.93%(w/v)之间、介于约0.071%与约1.0%(w/v)之间、介与约0.058%与约1.1%(w/v)之间、介于约0.048%与约1.1%(w/v)之间、介于约0.039%与约1.2%(w/v)之间、介于约0.032%与约1.3%(w/v)之间、介于约0.027%与约1.4%(w/v)之间、介于约0.022%与约1.5%(w/v)之间、介于约0.018%与约1.6%(w/v)之间、介于约0.015%与约1.7%(w/v)之间、介于约0.012%与约1.9%(w/v)之间、介于约0.010%与约2%(w/v)之间,以及介于任何这些所选的磷酸氢二钠的量之间的范围的量存在于所述组合物中。
[0217]
当制备药物组合物时,磷酸氢二钠的来源可以是无水磷酸氢二钠,或者其可以是磷酸氢二钠的水合形式(例如七水合物)或适用于制备药物组合物的任何其它形式的磷酸钠,例如,磷酸钠(无水、半水合物、六水合物、八水合物、十二水合物)和磷酸二氢钠(无水、一水合物、二水合物)和磷酸二钠(无水、二水合物、八水合物、十二水合物)以及技术人员在阅读本公开后可识别的其它形式,使得药物组合物中磷酸氢二钠的最终量介于约0.01%与约1%之间,例如约0.5%或约1%(w/v)。
[0218]
另外,在一些实施例中,可以使用磷酸氢二钾代替磷酸氢二钠。磷酸氢二钾的量可以类似于本文所描述的磷酸氢二钠的量(根据分子量差异进行调节),但最终可以由技术人员确定,使得包括磷酸氢二钾的药物组合物在药学上等同于包括本文所描述的磷酸氢二钠的那些药物组合物。
[0219]
在一些实施例中,所述氯化钠以介于约0.01%与约1%(w/v)之间的量存在,例如约0.6%(w/v)。
[0220]
在一些实施例中,所述氯化钠以介于约0.51%与约0.65%(w/v)之间、介于约0.42%与约0.66%(w/v)之间、介于约0.34%与约0.68%(w/v)之间、介于约0.28%与约0.69%(w/v)之间、介于约0.22%与约0.71%(w/v)之间、介于约0.18%与约0.72%(w/v)之间、介于约0.15%与约0.74%(w/v)之间、介于约0.12%与约0.76%(w/v)之间、介于约0.10%与约0.78%(w/v)之间、介于约0.079%与约0.79%(w/v)之间、介与约0.065%与约0.81%(w/v)之间、介于约0.052%与约0.83%(w/v)之间、介于约0.043%与约0.85%(w/v)之间、介于约0.035%与约0.87%(w/v)之间、介于约0.028%与约0.89%(w/v)之间、介于约0.023%与约0.91%(w/v)之间、介于约0.019%与约0.93%(w/v)之间、介于约0.015%与约0.95%(w/v)之间、介于约0.012%与约0.98%(w/v)之间、介于约0.010%与约1%(w/v)之间,以及介于任何这些所选的氯化钠的量之间的范围的量存在。
[0221]
在一些实施例中,如果例如在制备所述药物组合物期间使用如盐酸等酸或如氢氧
化钠等碱以调节ph,则所述药物组合物中氯化钠的量可以与最初添加以制备所述组合物的氯化钠的量不同。因此,本文所描述的氯化钠的量(包含范围内的那些量)可以是药物组合物中存在的氯化钠的最小量(例如至少0.6%(w/v)氯化钠)。
[0222]
在一些实施例中,可以使用除氯化钠之外的张力调节剂。其包含但不限于盐,特别是氯化钾、甘露醇、赤藓糖醇、肉碱和甘油,或任何其它合适的眼科可接受的张力调节剂。这些张力调节剂的量可以由技术人员确定,这样其将产生在药学上等同于如本文所描述的包括氯化钠的那些药物组合物的药物组合物。
[0223]
在一些实施例中,所述药物组合物呈适用于眼科应用的溶液形式。可以通过使用技术人员可识别的用于制备适用于眼科应用的药物组合物的方法合并成分来制备药物组合物,如用于无菌液体药物产品的良好制造程序(gmp)。
[0224]
在一个实施例中,使用生理盐水溶液作为主要媒剂来制备所述药物组合物。在另一个实施例中,所述主要媒剂是水(例如纯净水)。此类滴眼液的ph应该例如用适当的缓冲系统维持在约4.5至约8.0(例如约7的ph),中性ph是优选的但不是必需的。可以使用除了本文所描述的柠檬酸盐和磷酸盐缓冲剂之外的各种缓冲剂以及用于调节ph的手段,只要所得制剂是眼科可接受的。因此,添加缓冲剂包含但不限于乙酸盐缓冲剂和硼酸盐缓冲剂。这些缓冲剂的量可以由技术人员确定,这样其将产生在药学上等同于如本文所描述的包括柠檬酸盐和/或磷酸盐缓冲剂的那些药物组合物的药物组合物。另外,可以按照需要使用酸或碱(例如盐酸等酸或氢氧化钠等碱)来调节这些调配物的ph。
[0225]
在一些实施例中,所述药物组合物的ph介于约6.9与约7.1之间、介于约6.8与约7.1之间、介于约6.6与约7.2之间、介于约6.5与约7.2之间、介于约6.4与约7.3之间、介于约6.3与约7.3之间、介于约6.1与约7.4之间、介于约6.0与约7.4之间、介于约5.9与约7.5之间、介于约5.8与约7.5之间、介于约5.6与约7.6之间、介于约5.5与约7.6之间、介于约5.4与约7.7之间、介于约5.3与约7.7之间、介于约5.1与约7.8之间、介于约5.0与约7.8之间、介于约4.9与约7.9之间、介于约4.8与约7.9之间、介于约4.6与约8.0之间、介于约4.5与约8.0之间,以及这些值之间的范围。
[0226]
在一些实施例中,所述药物组合物的ph介于约7.0与约7.1之间、介于约6.9与约7.1之间、介于约6.9与约7.2之间、介于约6.8与约7.2之间、介于约6.8与约7.3之间、介于约6.7与约7.3之间、介于约6.7与约7.4之间、介于约6.6与约7.4之间、介于约6.6与约7.5之间、介于约6.5与约7.5之间、介于约6.5与约7.6之间、介于约6.4与约7.6之间、介于约6.4与约7.7之间、介于约6.3与约7.7之间、介于约6.3与约7.8之间、介于约6.2与约7.8之间、介于约6.2与约7.9之间、介于约6.1与约7.9之间、介于约6.1与约8.0之间、介于约6.0与约8.0之间,以及这些值之间的范围。
[0227]
药物组合物还可以含有常规的药学上可接受的防腐剂、稳定剂和表面活性剂。可用于药物组合物的示例性防腐剂包含但不限于苯扎氯铵、硫柳汞、乙酸苯汞、硝酸苯汞、氯丁醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯乙醇、依地酸二钠、抗坏血酸、聚氯铵(例如m)、稳定化的氧氯复合物/稳定化的二氧化氯(例如)和本领域技术人员已知的其它试剂。在眼科产品中,此类防腐剂的用量水平通常为0.004%至0.02%。稳定剂包含但不限于聚乙烯醇、聚维酮、羟丙基甲基纤维素、泊洛沙姆(poloxamer)、羧甲基纤维素和羟乙基纤维素环糊精。另外,调配物也可以缺少防腐剂。此类缺少防腐剂的调配物被称
为“不含防腐剂”。
[0228]
药物组合物还可以包含表面活性剂。表面活性剂可用于帮助溶解赋形剂或活性剂、在组合物中分散固体或液体、增强润湿、改变液滴大小等。有用的表面活性剂包含但不限于以下类别的表面活性剂:醇;氧化胺;嵌段聚合物;羧化醇或烷基酚乙氧基化物;羧酸/脂肪酸;乙氧基化醇;乙氧基化烷基酚;乙氧基化芳基酚;乙氧基化脂肪酸;乙氧基化;脂肪酯或油(动物和/或植物);脂肪酯;脂肪酸甲酯乙氧基化物;甘油酯;乙二醇酯;基于羊毛脂的衍生物;卵磷脂和卵磷脂衍生物;木质素和木质素衍生物;甲酯;甘油单酯及其衍生物;聚乙二醇;聚合物表面活性剂;丙氧基化和乙氧基化脂肪酸、醇或烷基酚;基于蛋白质的表面活性剂;肌氨酸衍生物;山梨糖醇衍生物;蔗糖和葡萄糖酯以及衍生物。
[0229]
可以包含眼科可接受的抗氧化剂,并且实例包含焦亚硫酸钠、硫代硫酸钠、乙酰半胱氨酸、丁基化羟基茴香醚和丁基化羟基甲苯。
[0230]
可包含在药物组合物中的其它赋形剂组分是螯合剂。示例性螯合剂是依地酸二钠,尽管其它螯合剂是已知的且合适的,单独或与依地酸二钠组合。
[0231]
药物组合物可以包括量介于约0.003%与约1%(w/v)之间的式i的化合物。除非另有说明,否则本文所描述组合物中存在的式i的化合物的量基于游离碱和非溶剂化(非水合)形式的化合物(分子量215.26),即使使用了盐和/或溶剂化(例如水合物)形式的化合物。因此,如果使用此类形式,当考虑盐和/或溶剂化物(例如水合物)的重量时,本文所描述的式i的化合物的所有量将具有对应的量。例如,如果使用分子量为306.19的化合物的二盐酸盐一水合物形式(参见实例8-11),则本文所描述的组合物包括量介于约0.0030%与约1.0%(w/v)之间的式i的化合物,由于化合物的游离碱与二盐酸盐一水合物形式之间的分子量差异,将被认为包括量介于0.0043%与1.4%之间的式i的化合物的二盐酸盐一水合物形式。类似地,本文所描述的组合物包括量为约0.010%(w/v)、约0.030%(w/v)、0.10%(w/v)、0.30%(w/v)或约1.0%(w/v)的式i的化合物,将分别对应于量为约0.014%(w/v)、约0.043%(w/v)、0.14%(w/v)、0.43%(w/v)或约1.4%(w/v)的式i的化合物的二盐酸盐一水合物形式。因此,技术人员将理解,如果使用盐和溶剂化(例如水合)形式的化合物,则本文所描述的式i的化合物的所有量将具有等量,即使由于如四舍五入和有效数字等因素,这些量在数字上可以与游离碱非溶剂化形式的量相同。例如,0.010%(w/v)量的式i的化合物将对应于0.014%(w/v)量的化合物的二盐酸盐一水合物形式到两位有效数字,但如果只考虑一个有效数字,所述二盐酸盐一水合物形式的量可以四舍五入到0.01%(w/v)。
[0232]
药物组合物还可以包括量介于约0.01%与约1%(w/v)之间、或介于约0.01%与约0.2%(w/v)之间、约0.01%与约0.3%(w/v)之间、约0.01%与约0.4%(w/v)之间、约0.01%与约0.5%(w/v)之间、约0.01%与约0.5%(w/v)之间、约0.01%与约0.6%(w/v)之间、约0.01%与约0.7%(w/v)之间、约0.01%与约0.8%(w/v)之间或约0.01%与约0.9%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i的化合物。
[0233]
药物组合物还可以包括量介于约0.01%与约0.02%(w/v)之间、介于约0.02%与约0.03%(w/v)之间、介于约0.03%与约0.04%(w/v)之间、介于约0.04%与约0.05%(w/v)之间、介于约0.05%与约0.06%(w/v)之间、介于约0.06%与约0.06%(w/v)之间、介于约0.06%与约0.07%(w/v)之间、介于约0.07%与约0.08%(w/v)之间、介于约0.08%与约0.09%(w/v)之间、介于约0.09%与约0.10%(w/v)之间的式i的化合物,以及介于任何这些
所选量之间的范围的式i的化合物。
[0234]
药物组合物还可以包括量介于约0.01%与约0.06%(w/v)之间、介于约0.06%与约0.11%(w/v)之间、介于约0.11%与约0.16%(w/v)之间、介于约0.16%与约0.21%(w/v)之间、介于约0.21%与约0.26%(w/v)之间、介于约0.26%与约0.31%(w/v)之间、介于约0.31%与约0.36%(w/v)之间、介于约0.36%与约0.41%(w/v)之间、介于约0.41%与约0.46%(w/v)之间、介于约0.46%与约0.51%(w/v)之间、介与约0.51%与约0.55%(w/v)之间、介于约0.55%与约0.60%(w/v)之间、介于约0.60%与约0.65%(w/v)之间、介于约0.65%与约0.70%(w/v)之间、介于约0.70%与约0.75%(w/v)之间、介于约0.75%与约0.80%(w/v)之间、介于约0.80%与约0.85%(w/v)之间、介于约0.85%与约0.90%(w/v)之间、介于约0.90%与约0.95%(w/v)之间或介于约0.95%与约1.00%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i的化合物。
[0235]
另外,药物组合物可以包括量介于约0.001%与约1%(w/v)之间、或介于约0.001%与约0.2%(w/v)之间、约0.001%与约0.3%(w/v)之间、约0.001%与约0.4%(w/v)之间、约0.001%与约0.5%(w/v)之间、约0.001%与约0.6%(w/v)之间、约0.001%与约0.7%(w/v)之间、约0.001%与约0.8%(w/v)之间或约0.001%与约0.9%(w/v)之间的式i的化合物,以及任何这些所选量之间的范围的式i的化合物。
[0236]
药物组合物还可以包括量介于约0.001%与约0.01%(w/v)之间、约0.001%与约0.02%(w/v)之间、约0.001%与约0.03%(w/v)之间、约0.001%与约0.04%(w/v)之间、约0.001%与约0.05%(w/v)之间、约0.001%与约0.06%(w/v)之间、约0.001%与约0.07%(w/v)之间、约0.001%与约0.08%(w/v)之间或约0.001%与约0.09%(w/v)之间、约0.001%与约0.01%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i的化合物。
[0237]
药物组合物还可以包括量介于约0.001%与约0.002%(w/v)之间、介于约0.002%与约0.003%(w/v)之间、介于约0.003%与约0.004%(w/v)之间、介于约0.004%与约0.005%(w/v)之间、介于约0.005%与约0.006%(w/v)之间、介于约0.006%与约0.006%(w/v)之间、介于约0.006%与约0.007%(w/v)之间、介于约0.007%与约0.008%(w/v)之间、介于约0.008%与约0.009%(w/v)之间、介于约0.009%与约0.010%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i的化合物。
[0238]
另外,药物组合物可以包括量介于约0.003%与约1%(w/v)之间、或介于约0.003%与约0.2%(w/v)之间、约0.003%与约0.3%(w/v)之间、约0.003%与约0.4%(w/v)之间、约0.003%与约0.5%(w/v)之间、约0.003%与约0.5%(w/v)之间、约0.003%与约0.6%(w/v)之间、约0.003%与约0.7%(w/v)之间、约0.003%与约0.8%(w/v)之间或约0.003%与约0.9%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i的化合物。
[0239]
药物组合物还可以包括量介于约0.003%与约0.01%(w/v)之间、约0.003%与约0.02%(w/v)之间、约0.003%与约0.03%(w/v)之间、约0.003%与约0.04%(w/v)之间、约0.003%与约0.05%(w/v)之间、约0.003%与约0.06%(w/v)之间、约0.003%与约0.07%(w/v)之间、约0.003%与约0.08%(w/v)之间、约0.003%与约0.09%(w/v)之间或约0.003%与约0.01%(w/v)之间的式i的化合物,以及介于任何这些所选量之间的范围的式i
的化合物。
[0240]
另外,药物组合物还可以包括量介于约0.1%与约0.2%(w/v)之间、约0.2%与约0.3%(w/v)之间、约0.3%与约0.4%(w/v)之间、约0.4%与约0.5%(w/v)之间、约0.5%与约0.6%(w/v)之间、约0.6%与约0.7%(w/v)之间、约0.7%与约0.8%(w/v)之间、约0.8%与约0.9%(w/v)之间或约0.9%与约1%(w/v)之间的式i的化合物,以及任何这些所选量之间的范围的式i的化合物。技术人员在阅读本公开后可识别用于本文所描述的组合物的式i的化合物的另外的量。
[0241]
另外,药物组合物还可以包括量介于约0.01%与约0.02%(w/v)之间、约0.02%与约0.03%(w/v)之间、约0.03%与约0.04%(w/v)之间、约0.04%与约0.05%(w/v)之间、约0.05%与约0.06%(w/v)之间、约0.06%与约0.07%(w/v)之间、约0.07%与约0.08%(w/v)之间、约0.08%与约0.09%(w/v)之间或约0.09%与约0.1%(w/v)之间的式i的化合物,以及任何这些所选量之间的范围的式i的化合物。技术人员在阅读本公开后可识别用于本文所描述的组合物的式i的化合物的另外的量。
[0242]
另外,药物组合物可以包括量为约0.01%(w/v)、约0.03%(w/v)、约0.1%(w/v)或约0.3%(w/v)的式i的化合物,以及除这些所选量之外的其它量的式i的化合物。技术人员在阅读本公开后可识别用于本文所描述的组合物的式i的化合物的另外的量。
[0243]
在一些实施例中,当式i的化合物是药物组合物的一部分时,式i的化合物是唯一具有治疗活性的活性成分,从而可用于眼部病状的治疗或控制(例如老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视))。如本文所使用的,术语“活性成分”是指药物组合物的组分,所述组分负责组合物的治疗效果,而组合物的其它组分(例如赋形剂、载体和稀释剂)对组合物的治疗效果不负责,即使其在组合物中具有作为调配物的一部分所必需或期望的其它功能(如润滑、调味、ph控制、乳化、稳定、保存和除本文所描述的组合物的治疗效果外的其它功能)。具体地,在一些实施例中,本文所描述的药物组合物(其中式i的化合物是唯一具有治疗活性的活性成分)是其中不存在被认为具有用于治疗或控制眼部病状(例如老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视))的治疗活性的其它组分的组合物。
[0244]
在另一个实施例中,可以将药物组合物包装成适于计量应用的形式,如装在配备有滴管的容器中,以便应用于眼睛。适于逐滴应用的容器通常由合适的惰性、无毒塑料材料制成,并且通常含有介于约0.5ml与约15ml之间的溶液。一个包装可以含有一个或多个单位剂量。不含防腐剂的溶液通常在不可重新密封的容器中调配,所述容器含有至多约十个,如至多约五个单位剂量,其中典型的单位剂量为一滴至约8滴,如一滴至约3滴。一滴的体积通常为约20μl至35μl。在一些实施例中,容器可以是多剂量不含防腐剂的(mdpf)容器(参见例如ong,s.等人《药物开发——基于案例研究的现代策略洞察力(drug development-a case study based insight into modern strategies)》2011的第20章)。
[0245]
另外,在一些实施例中,还设想了各种用于将本文所描述的组合物和/或化合物(例如,式i的化合物)施用于眼睛的眼部递送方法。例如,眼部施用方法可以包含例如玻璃体内施用、前房内施用和结膜下施用以及技术人员可识别的其它眼部施用方法。另外,还设想了用于递送本文所描述的化合物和/或组合物(例如以在数天、数周时间段或医师推荐的其它时间段内持续释放)的另外的施用方法,如使用眼部药物递送系统(例如,眼部植入物、
前房内植入物、玻璃体内植入物、结膜下植入物、眼球筋膜囊下植入物(sub-tenon's implant)、泪点塞、小管洗脱植入物和眼环),与可注射的持续释放调配物一样,从而产生贮库,如基于plga的微球中的式i的化合物,所述化合物也可以用于任何眼内隔室,如结膜下、眼球筋膜囊下、前房内和玻璃体腔(参见例如kuno《聚合物(polymers)》2011,3,193-221;美国专利9,289,413和9,504,653;美国专利申请公开2011/0182966、2016/0022695和2016/0296532;以及chee,s.-p.,《眼药理学与治疗学杂志(journal of ocular pharmacology and therapeutics)》2012,28(4),340-349以及tejpal,y.等人,《药物递送和治疗学杂志(j drug deliv.therap.)》2013,3,114-123)。
[0246]
还设想了一种试剂盒,所述试剂盒包括如本文所描述的药物组合物和用于向眼睛施用所述制剂的说明。在一个实施例中,所述药物组合物以多剂量形式提供或包装。在此实施例中,所述药物组合物优选地包括式i的化合物和药学上可接受的赋形剂。本文所讨论的任何赋形剂都适用于所述药物组合物。在一个实施例中,所述制剂包括防腐剂,所述防腐剂在使用(即,重复使用)期间防止微生物污染。
[0247]
施用说明通常提供给药说明。在各种实施例中,说明可以是每天一次、每天两次或每天三次施用所述药物组合物。在药物组合物是液体制剂的实施例中,施用可以是在一只眼睛或两只眼睛(例如,如果一只眼睛受到眼部病状的影响,可以治疗两只眼睛,或者如果两只眼睛都受到病状的影响)中放置一滴、两滴、三滴或更多滴,每天一次、每天两次、每天三次或更多次。
[0248]
鉴于前述内容,本文还描述了使用本文所描述的药物组合物治疗有需要的个体的眼部病状的方法。
[0249]
在一个实施例中,所述方法包括向个体施用本文所描述的药物组合物之一。
[0250]
在另一个实施例中,所治疗的眼部病状选自由以下组成的组:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视)。因此,本文描述了一种减小瞳孔大小以治疗需要此类治疗的个体的眼部病状的方法,所述方法包括向个体施用治疗有效量的式i的化合物或其药学上可接受的盐,其中所述眼部病状选自由以下组成的组中的一项或多项:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视)。
[0251]
在一些实施例中,所述眼部病状是老花眼。在其它实施例中,所述眼部病状是夜间视力低下。在其它实施例中,所述眼部病状是视觉眩光、视觉星爆、视觉光晕。在其它实施例中,所述眼部病状是一种形式的近视(例如夜间近视)。
[0252]
另外,因为本文所描述的药物组合物可用于收缩瞳孔,其可用于治疗眼部病状的方法,例如老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视)。
[0253]
因此,本文描述了治疗有需要的个体的眼部病状的方法,所述方法包括向所述个体施用本文所描述的药物组合物之一。在一些实施例中,所述眼部病状选自由以下组成的组中的一项或多项:老花眼、夜间视力低下、视觉眩光、视觉星爆、视觉光晕以及一些形式的近视(例如夜间近视)。
[0254]
在本文所描述的方法的一些实施例中,可以直接向所述个体的一只或两只眼睛施用所述药物组合物。在一些实施例中,可以向两只眼睛施用所述药物组合物。在其它实施例
中,可以只向一只眼睛施用所述药物组合物。
[0255]
在本文所描述的方法的一些实施例中,其中直接向所述个体的一只或两只眼睛施用所述药物组合物,可以对一只或两只眼睛进行局部施用。
[0256]
本发明人惊奇地发现,当与类似的α-2-肾上腺素能受体激动剂相比时,式i的化合物具有比基于式i的化合物的体外活性所预测的更大的体内活性,这可以导致与其它α-2-肾上腺素能受体激动剂相比,式i的化合物的治疗活性的持续时间更长。因此,在一些实施例中,药物组合物中式i的化合物的量是当向个体施用时,与其它α-2-肾上腺素能受体激动剂(例如,溴莫尼定)相比导致功效(包含起效)和/或效果持续时间增加的量。因此,在一些实施例中,与施用第二种化合物或组合物(例如其它α-2-肾上腺素能受体激动剂,例如溴莫尼定或类似毛果芸香碱的化合物)相比,本文所描述的化合物和组合物可以具有增加的功效(包含起效)和/或效果持续时间。
[0257]
具体地,当向个体施用药物组合物时,一种所关注的效果可以是瞳孔大小的减小(瞳孔收缩)。因此,在一些实施例中,当向个体施用药物组合物中特定量的式i的化合物时,可以引起瞳孔大小减小的量,使得瞳孔收缩到3mm或更小的大小,尤其是从大于3mm的自然基线大小到介于2mm与3mm之间的大小。如对本领域技术人员显而易见的,瞳孔的自然基线大小可以取决于特定的照明条件/亮度水平(例如,小于200cd/m2、小于150cd/m2、小于100cd/m2、小于50cd/m2、小于10cd/m2、小于5cd/m2、小于2cd/m2,以及介于这些亮度水平之间的范围)和患者的年龄。因此,基线瞳孔大小可以从低光下约6mm至约7mm到强光下约3mm至约4mm的范围内,并且在一些实施例中,式i的化合物的治疗有效量可以是将瞳孔大小从这些基线大小减小到3mm或更小的大小,尤其是介于2mm与3mm之间的大小的量。在一些实施例中,当个体暴露于例如以下的亮度水平时,可以实现瞳孔大小从基线大小的这些减小:小于200cd/m2、小于150cd/m2、小于100cd/m2、小于50cd/m2、小于10cd/m2、小于5cd/m2、小于2cd/m2,以及介于这些亮度水平之间的范围。
[0258]
例如,将瞳孔大小减小到3mm或更小,尤其是介于2mm与3mm之间的大小,可以改善老花眼的近处阅读能力,尤其是在较低光条件下(参见例如,xu等人“光线水平和小瞳孔对老花眼阅读表现的影响(the effect of light level and small pupils on presbyopic reading performance)”《眼科研究与视力学(investigative ophthalmology&visual science)》57,第13期(2016):5656-5664)。然而,溴莫尼定在不同光照条件下将老花眼患者的瞳孔大小减小到平均3.4mm(参见例如,mcdonald ii等人“0.2%酒石酸溴莫尼定滴眼液对不同亮度条件下正常眼睛瞳孔大小的影响(effect of brimonidine tartrate ophthalmic solution 0.2%on pupil size in normal eyes under different luminance conditions)”《白内障和屈光外科手术杂志(journal of cataract&refractive surgery)》27,第4期(2001):560-564.),因此对于改善焦深和改善阅读敏度并不理想。式i的化合物具有更大的峰值下降和更长的介于2mm与3mm之间的瞳孔大小持续时间,所述持续时间为至少约1小时到至少约9小时,而当施用如溴莫尼定等另一种α-2-肾上腺素能受体激动剂时,不会出现瞳孔收缩到2mm至3mm范围的此类持续时间。
[0259]
因此,在一些实施例中,当向个体施用药物组合物中特定量的式i的化合物时,可以具有瞳孔大小减小的持续时间,其中瞳孔收缩到3mm或更小的大小,并且尤其是到介于2mm与3mm之间的大小至少1小时、至少2小时、至少4小时、至少6小时或至少9小时、至少10小
时、至少12小时,以及介于这些时间之间的范围。在一些实施例中,当个体暴露于例如以下的亮度水平时,可以实现这些瞳孔大小减小:小于200cd/m2、小于150cd/m2、小于100cd/m2、小于50cd/m2、小于10cd/m2、小于5cd/m2、小于2cd/m2,以及介于这些亮度水平之间的范围。
[0260]
在其它实施例中,当向个体施用药物组合物中特定量的式i的化合物时,可以具有瞳孔大小减小的持续时间,其中瞳孔收缩到约2.0mm的大小至少1小时、至少2小时、至少4小时、至少6小时、至少9小时、至少10小时或至少12小时,以及介于这些时间之间的范围。在其它实施例中,当向个体施用药物组合物中特定量的式i的化合物时,可以具有瞳孔收缩的持续时间,其中瞳孔收缩到约2.5mm的大小至少1小时、至少2小时、至少4小时、至少6小时、至少9小时、至少10小时或至少12小时,以及介于这些时间之间的范围。
[0261]
本发明人还惊奇地发现,与市售的α-2-肾上腺素能受体激动剂溴莫尼定(其与虹膜黑色素色素的结合提高)不同,式i的化合物对虹膜黑色素色素的结合不明显。因此,可以在具有不同眼睛颜色/虹膜色素沉着的个体之间以更一致的剂量施用药物组合物。
[0262]
因此,在一些实施例中,药物组合物中式i的化合物的量是当向个体施用时,与另一种α-2-肾上腺素能受体激动剂(例如,溴莫尼定)相比导致与个体的虹膜色素的结合量减少的量。例如,在一些实施例中,当向个体施用药物组合物中特定量的式i的化合物时,可以导致与虹膜色素的结合比向个体施用大约相同量的溴莫尼定时与虹膜色素的结合少约8倍至约10倍,尤其是当个体具有被认为是深色虹膜的虹膜时(参见例如franssen,l.;coppens,j.e.;van den berg,t.j.,使用扩展的摄影参考集对虹膜颜色进行分级(grading of iris color with an extended photographic reference set).《验光杂志(journal of optometry)》2008,1(1),36-40)。
[0263]
此外,与使用溴莫尼定时相比,这种与虹膜色素结合的量的减少可以导致实现特定治疗效果所需的式i的化合物的量减少,尤其是当个体具有被认为是深色虹膜的虹膜时。因此,在一些实施例中,所需的式i的化合物的量将比实现与溴莫尼定相似的治疗效果(例如瞳孔收缩)所需的溴莫尼定的量少约30倍至约100倍。在一些实施例中,所需的式i的化合物的量将比实现与溴莫尼定相似的治疗效果(例如瞳孔收缩)所需的溴莫尼定的量少约30倍、约40倍、约50倍、约60倍、约70倍、约80倍、约90倍或约100倍。
[0264]
另外,由于减少了所需的式i的化合物的量,预计所需的式i的较低的潜在化合物将导致通常与α-2-肾上腺素能受体激动剂(例如镇静剂)相关的副作用/不良事件的发生率降低。因此,在一些实施例中,本文所描述的药物组合物降低至少一种不良事件的发生率,所述不良事件选自快速抗药反应、反跳充血、眼部充血、眼刺激、眼内压升高、眼痛、头晕、疲劳、头痛、低血压、鼻咽炎、鼻窦炎、心动过缓、虹膜炎、瞳孔缩小、皮肤反应、红斑、眼睑瘙痒、皮疹、血管扩张、心动过速、呼吸暂停、体温过低、张力减退、嗜睡、滴注部位疼痛、口腔干燥、灼热和刺痛、模糊、异物感、疲劳/嗜睡、结膜滤泡、眼部过敏反应、眼部瘙痒、角膜染色/糜烂、畏光、眼睑红斑、眼部疼/疼痛、眼部干燥、流泪、上呼吸道症状、眼睑水肿、结膜水肿、睑缘炎、眼部刺激、胃肠道症状、虚弱、视力异常和肌肉疼痛,尤其是与施用包括α-2-肾上腺素能受体激动剂(例如溴莫尼定)的第二组合物相比时。
[0265]
另外,不希望受理论束缚,与等量的如溴莫尼定等α肾上腺素能受体激动剂相比,式i的化合物与虹膜色素的结合减少可以导致式i的化合物的量的治疗益处持续时间增加,尤其是当个体具有被认为是深色虹膜的虹膜时。
[0266]
在本文所描述的方法的一些实施例中,所治疗的眼部病状是老花眼。老花眼是一种与年龄相关的病状,影响近17亿人。在老花眼中,眼睛聚焦近处物体(自动调焦)的能力随着年龄的增长而降低,据信这是由于个体随着年龄的增长眼睛晶状体硬化所致。
[0267]
可以通过本领域技术人员(例如医师和其它医务工作者)已知的方法来确定有需要的个体的老花眼治疗的程度和/或成功。例如,相对于不施用药物组合物时的视敏度,当施用药物组合物时未矫正的近视敏度、中间视敏度和/或远视敏度的改善。所述改善可以通过测量患者在本领域技术人员可识别的视力检查表上正确阅读的行数的改善来定量地测量。例如,与施用药物组合物前个体可以正确阅读的行数相比,当向个体施用药物组合物时,个体可以正确阅读一个或多个(例如,两个、三个或四个)行。改善可以在一只或两只眼睛中测量,在正常或低光条件下(例如,小于200cd/m2、小于150cd/m2、小于100cd/m2、小于50cd/m2、小于10cd/m2、小于5cd/m2、小于2cd/m2,以及介于这些亮度水平之间的范围)。另外,可以测量治疗的延长和/或成功的非定量(即定性)测量,如在施用药物组合物后对个体视力改善的个体的自我报告。例如,个体可能报告在施用药物组合物后阅读能力提高和/或不需要老花镜。另外,当向个体施用药物组合物时,个体还可以报告头痛和眼睛疲劳减轻(当老花眼没有通过如老花镜等其它方式治疗时,通常会出现在个体中)。
[0268]
对有需要的个体的老花眼治疗的程度和/或成功的另一种测量可以是当向个体施用药物组合物时,相对于施用药物组合物之前个体中的焦深,测量个体中焦深的改善(距离,可以用屈光度或技术人员可识别的其它单位来测量,在失去焦点之前可以将观察到的物体移离和移向个体)。焦深可以通过本领域技术人员可识别的方法来测量和确定,例如波前像差测量和本领域技术人员可识别的其它方法。
[0269]
治疗有需要的个体的老花眼的程度和/或成功的另一种测量可以是在向个体施用药物组合物时相对于施用药物组合物之前的个体瞳孔直径和外观的个体瞳孔直径和外观的测量。瞳孔直径和外观的测量可以通过技术人员可识别的方法(例如使用波前相差计)在技术人员可识别的各种照明条件下测量,以反映夜间户外和交通照明场景。
[0270]
治疗有需要的个体的老花眼的程度和/或成功的另一种测量可以是在向个体施用药物组合物时相对于施用药物组合物之前的个体视场的个体视场的测量。可以通过技术人员可识别的方法来确定个体的视场。例如,个体可以遮住一只眼睛,同时用未遮住的眼睛注视检查者的眼睛。然后可以要求个体指出检查者在四个象限(左、右、上和下)中每个象限中短暂闪烁的手指数量。
[0271]
在本文所描述的方法的一些实施例中,所治疗的眼部病状是夜间视力低下。许多个体患有夜间视力低下,这是一种在如夜间发生的情况等低光照条件下个体视力受损的情况。夜间视力低下的原因可以包含天然的角膜或晶状体像差,但也可能是由如激光外科手术(例如lasik)等眼部干预引起的。不希望受理论束缚,本发明人认为当瞳孔在低光条件下扩张时会导致夜间视力低下,例如如果存在角膜或晶状体像差,可以导致一些光线不聚焦在瞳孔上,并且因此如果瞳孔收缩(例如通过向患有夜间视力低下的个体施用药物组合物),可以实现夜间视力的改善。
[0272]
可以通过本领域技术人员(例如医师和其它医务工作者)已知的方法来确定有需要的个体的夜间视力低下治疗的程度和/或成功。例如,对个体的夜间视力低下的治疗程度和/或成功的一种测量可以是通过技术人员可识别的系统(如holladay自动化对比敏感系
统(holladay automated contrast sensitivity system)或hacss
tm
)测量的施用药物组合物时,相对于不施用药物组合物时的中视对比敏感度,中视对比敏感度(有或没有眩光)的改善。
[0273]
治疗的程度和/或成功的另一种测量可以是例如,施用式i的化合物时,相对于未施用化合物时的视敏度,低光条件下未矫正的近距离视敏度、中间距离视敏度和/或远距离视敏度(所有这些都可以是低对比敏度或高对比敏度,参见例如edwards,j.d.;burka,j.m.;bower,k.s.;stutzman,r.d.;sediq,d.a.;rabin,j.c.,酒石酸溴莫尼定0.15%对屈光外科手术后夜间视力困难和对比测试的影响(effect of brimonidine tartrate 0.15%on night-vision difficulty and contrast testing after refractive surgery).《白内障和屈光外科手术杂志(journal of cataract&refractive surgery)》2008,34(9),1538-1541)的改善。所述改善可以通过测量患者在低光条件下在本领域技术人员可识别的视力检查表上正确阅读的行数的改善来定量地测量。例如,与施用药物组合物前个体可以正确阅读的行数相比,当向个体施用药物组合物时,个体可以在低光条件下正确阅读一个或多个(例如,两个、三个或四个)行。改善可以在一只或两只眼睛中衡量。
[0274]
另外,可以测量治疗的延长和/或成功的非定量(即定性)测量,如在施用药物组合物后对低光条件下个体视力改善的个体的自我报告。例如,个体可能报告在施用药物组合物后夜间视力得到改善(例如在驾驶时)和/或在低光条件下(例如在低光条件下的餐厅中)不需要老花镜。
[0275]
在本文所描述的方法的一些实施例中,所治疗的眼部病状是视觉眩光。视觉眩光是一些眼科外科手术的副作用,如激光外科手术(例如lasik),其特征在于通常在夜间看到的视觉像差,其中光线进入眼睛并干扰视力。不希望受理论束缚,本发明人相信在低光条件下在视觉眩光中看到的视觉像差是由当瞳孔扩张时进入眼睛的另外的光引起和/或加剧的,因此可以通过向经历视觉眩光的人施用药物组合物以收缩瞳孔来治疗。
[0276]
在本文所描述的方法的一些实施例中,所治疗的眼部病状是视觉星爆。视觉星爆是一种视觉障碍(这可能是如lasik等一些眼科外科手术的副作用),其中光源(如路灯和汽车前灯)似乎以从源自光源的星爆图案发出光,并且在一些情况下,可能会遮挡靠近光源的物体,如靠近前灯的行人或骑自行车者(参见例如,网页lasikcomplications.com/starbursting.htm)。在本文所描述的方法的其它实施例中,所治疗的眼部病状是视觉光晕。视觉光晕是另一种视觉障碍(这可能是如lasik等一些眼科外科手术的副作用),表现为可以在如路灯、前灯和照明反射路标等光源周围看到的漫射环(参见例如,网页lasikcomplications.com/halos.htm和londonvisionclinic.com/post-lasik-patients-risk-of-halos-and-starbursts-around-bright-lights-at-night)。
[0277]
可以通过本领域技术人员(例如医师和其它医务工作者)已知的方法来确定有需要的个体的视觉眩光、视觉星爆和/或视觉光晕治疗的程度和/或成功。例如,可以通过使用技术人员已知的测试来确定治疗的程度,以评估在施用式i的化合物之前和之后的视觉眩光、视觉星爆和/或视觉光晕的程度。例如,可以在施用药物组合物之前测量个体看到的视觉眩光、视觉星爆和/或光晕的严重性,并与施用药物组合物之后个体看到的视觉眩光、视觉星爆和/或光晕的严重性进行比较。测量可以是定性的(例如基于问卷调查)或定量的(例如通过让个体测量可以产生光晕和星爆的计算机化光学系统上的星爆和/或光晕的大小),
取决于所使用的特定测试,所述测试将是技术人员可识别的(参见例如,lee,j.h.;you,y.s.;choe,c.m.;lee,e.s.,0.2%酒石酸溴莫尼定滴眼液在减少激光原位角膜磨镶术后光晕方面的功效(efficacy of brimonidine tartrate 0.2%ophthalmic solution in reducing halos after laser in situ keratomileusis).《白内障和屈光外科手术杂志》2008,34(6),963-967和xu,r.;kollbaum,p.;thibos,l.;lopez-gil,n.;bradley,a.,通过瞳孔缩小减少高度像差眼睛中的星爆(reducing starbursts in highly aberrated eyes with pupil miosis).《眼科和生理光学(ophthalmic and physiological optics)》2018,38(1),26-36;以及hunkeler,j.d.;coffman,t.m.;paugh,j.;lang,a.;smith,p.;tarantino,n.,使用array多焦点人工晶状体表征视觉现象(characterization of visual phenomena with the array multifocal intraocular lens).《白内障和屈光外科手术杂志》2002,28(7),1195-1204)。另外,治疗的程度也可以是已经向患者施用药物组合物并且患者已经能够在其治疗作用下在夜间开车后由患者自我报告。
[0278]
在本文所描述的方法的一些实施例中,所治疗的眼部病状是一种形式的近视(例如夜间近视)。例如,夜间近视是一种倾向于在夜间和/或低光条件下表现出来的近视(即“近视”,无法聚焦于远处的物体)。不希望受理论束缚,本发明人认为夜间近视可能是由在较低光条件下瞳孔扩大时进入眼睛的另外的未聚焦光线引起的,因此可以通过向患有夜间近视的人施用药物组合物以减小瞳孔大小来治疗。
[0279]
可以通过本领域技术人员(例如医师和其它医务工作者)已知的方法来确定有需要的个体的夜间近视治疗的程度和/或成功。例如,治疗的程度和/或成功的一种测量可以是例如施用药物组合物时,相对于未施用药物组合物时的视敏度,低光条件下中间距离敏度和/或远敏度的改善。所述改善可以通过测量患者在低光条件下在本领域技术人员可识别的视力检查表上正确阅读的行数的改善来定量地测量。例如,与施用药物组合物前个体可以正确阅读的行数相比,当向个体施用药物组合物时,个体可以在低光条件下正确阅读一个或多个(例如,两个、三个或四个)行。改善可以在一只或两只眼睛中衡量。
[0280]
另外,可以测量治疗的延长和/或成功的非定量(即定性)测量,如在施用药物组合物后对低光条件下个体视力改善的个体的自我报告。例如,个体可以报告在施用药物组合物后夜间远距离视力(例如在驾驶时)的改善。
[0281]
虽然眼部病状的治疗持续时间(例如视力改善的时间量)可能不是永久性的,并且可能在个体与个体之间有差别,但可以以此类方式施用式i的化合物以延长老花眼的治疗。例如,根据药物组合物中特定剂量的式i的化合物的视力改善作用的持续时间(可由如医师等技术人员确定),所述化合物可以一天一次、一天两次、一天三次、一天四次,或以如医师等技术人员可以确定的任何其它频率施用。
[0282]
在一些实施例中,与施用包括如毛果芸香碱等眼科活性化合物的第二组合物相比,本文所描述的药物组合物可以显示出相似或更高的安全性和/或功效特性。
[0283]
具体地,在一些实施例中,与施用包括如毛果芸香碱等眼科活性化合物的第二组合物相比,本文所描述的药物组合物可以通过降低一种或多种选自由以下组成的组的不良事件的发生率来显示出更大的比较安全性特性:头痛、眉痛、调节变化、眼睛刺激、眼痛、模糊视力、视力障碍、眼部模糊、眼部不适、视力模糊、光敏感、刺痛和瘙痒。
[0284]
具体地,在一些实施例中,本文所描述的药物组合物可以通过展示本文所描述的
一种或多种参数的改善来显示更大的比较功效特性以确定与施用包括如毛果芸香碱等眼科活性化合物的第二组合物相比,本文所描述的眼部病状,例如瞳孔大小减小,在不同照明水平下视敏度(例如近、中间和远)的改善、焦深的改善、视场的改善、中视对比敏感度的改善以及实例13中描述的临床功效参数的改善。与施用包括如毛果芸香碱等眼科活性化合物的第二组合物相比,改善可以是幅度上的改善(例如瞳孔大小减小的量或敏度测试中阅读行数更多)。与施用包括如毛果芸香碱等眼科活性化合物的第二组合物相比,改善还可以是持续时间的改善(例如在更长的时间段内瞳孔大小减小类似或更大的量,或在施用后的稍后时间点在敏度测试中阅读行数类似或更多)。
[0285]
实例
[0286]
以下实例仅旨在说明本公开的方法并且绝不应解释为限制本公开的方法。
[0287]
实例1
[0288]
α肾上腺素能受体激动剂的体外活性
[0289]
对若干种化合物(包含式i的化合物(表1中的条目1))进行体外flipr(荧光图像板读数器)测定。
[0290]
具体地,在flipr测定中使用了四种hek293稳定细胞系。稳定表达牛α肾上腺素能1a受体的hek293细胞系用于表征α1药理学。α-2肾上腺素能受体家族是g偶联g蛋白受体。因此,为了在基于钙的flipr测定中使用这些细胞系,使用嵌合g蛋白gqi5来强制人α-2a、α-2b和α-2c受体与钙通路偶联。将细胞以每孔25,000个细胞一式三份铺板在涂覆有聚-d-赖氨酸的384孔板中,并在补充有10%胎牛血清的dmem中生长过夜。对于flipr评估,在添加钙敏感染料fluo-4-am(4um fluo-4-am,0.04%普朗尼克酸(pluronic acid),于hbss/hepes缓冲剂中)之前,用hbss/hepes缓冲剂(1x汉克氏缓冲盐溶液(hanks buffered salt solution),20mm hepes,ph 7.4)将细胞洗涤两次。细胞在37℃下上样染料40分钟,并且然后用hbss/hepes缓冲剂洗涤4次以去除多余的染料。使用四倍稀释因子在介于0.64nm与10,000nm之间的浓度下对测试化合物进行谱分析。去甲肾上腺素用作用于评估α-1受体相对功效的标准完全激动剂,并且溴莫尼定(化合物4)用作用于评估α-2受体相对功效的标准完全激动剂。使用四倍稀释因子在介于0.064nm与1000nm之间的浓度下测试去甲肾上腺素或溴莫尼定。
[0291]
通过添加适当稀释的化合物来启动受体激活,并捕获瞬态钙信号。使用activity base软件确定钙曲线的峰高度并用于计算ec
50
和相对功效值。ec
50
使用4参数逻辑方程计算:y=a ((b-a)/(1 ((c/x)^d))),其中a和b表示曲线的底部和顶部平台;c表示ec
50
值;d表示斜率因子;并且x和y表示原始x(药物浓度)和y(荧光信号,rfu)值。
[0292]
表1
[0293][0294]
基于体外药理学,预期如化合物2和3以及式i的化合物(化合物1)等α-2-肾上腺素能受体泛激动剂在兔中具有与溴莫尼定(化合物4)相似的缩瞳功效(峰和持续时间)。然而,发现式i的化合物在体内具有出乎意料的优越特性,如下一实例中所示。
[0295]
实例2
[0296]
体内兔缩瞳模型
[0297]
这些研究使用体重在2kg至4kg之间的雌性荷兰带腰带兔(新泽西州普林斯顿科文斯(covance,princeton,new jersey))。所有实验动物在右眼中以单次单侧局部剂量接受所选形式的式i的化合物(化合物1)、化合物2、溴莫尼定(化合物4)或媒剂。对于局部给药,将滴眼剂(体积=35μl)滴入测试眼的下结膜囊中。
[0298]
使用optistick测量治疗的和未治疗的眼睛的瞳孔直径,精确到0.5mm。在所有研究中,基线瞳孔直径测量在药物施用前进行,然后在给药后0.5小时、1小时、2小时、3小时和4小时进行。所有研究均在低光条件下进行,其中使用红色摄影灯提供2lux至10lux的光。在图1至图4中示出了结果。
[0299]
如实例1中所提及,预期如化合物2和3以及式i的化合物(化合物1)等α-2-肾上腺素能受体泛激动剂在兔中具有与溴莫尼定(化合物4)相似的缩瞳功效(峰和持续时间)。然而,条目2和条目3的化合物都具有远低于溴莫尼定的缩瞳功效,如从图1至图4中可以看到的。尽管在α-2a-肾上腺素能受体上具有与溴莫尼定类似的效力,但在兔模型中式i的化合物的效力出乎意料地是溴莫尼定的效力的约30至约100倍(例如,图3中式i的化合物的0.001%溶液在峰值瞳孔减少和减少持续时间方面具有与图2中溴莫尼定0.1%溶液相似的剂量缩瞳应答曲线,因此式i的化合物的0.001%组合物比溴莫尼定测试的0.1%剂量具有
更高的缩瞳功效)。与包含溴莫尼定在内的其它α肾上腺素能受体激动剂相比,式i的化合物具有最好的缩瞳作用。例如,如图3所示,式i的化合物(化合物1)在db兔-暗视条件(《10lux)中显示出非常有效的剂量缩瞳应答。此外,如图4所示,对具有》2.5mm瞳孔变化的受试者(兔)的应答者分析表明,在暗视条件(《10lux)下,式i的化合物比溴莫尼定(化合物4)在荷兰腰带兔(n=6)中更有效。具体地,图4还显示,与溴莫尼定相比,式i的化合物可以在更长的时间内实现更大量的瞳孔大小减小,因为在给药后两小时,几乎所有用式i的化合物给药的动物的瞳孔大小从基线的减小都大于2.5mm,超过一半的动物在6小时后瞳孔大小减小相同,而即使在给药后半小时,给药溴莫尼定的动物中也只有不到一半的动物表现出相同的瞳孔大小减小,并且实际上没有一只动物在6小时后表现出同样的瞳孔大小减小。
[0300]
另外,如从图4以及图2与3的比较重可以看到的,与溴莫尼定相比,式i的化合物显示出更大幅度的瞳孔大小减小和治疗活性。
[0301]
另外,在室内照明条件下进行的类似实验中,在峰值瞳孔收缩和作用持续时间方面,给药式i的化合物(化合物1)的兔仍然比溴莫尼定(化合物4)具有更大的收缩作用,如从图5中可以看到的。
[0302]
另外,如从图6中可以看到的,式i的化合物(化合物1)甚至在给药后9小时仍继续显示出显著的瞳孔收缩。另外,如图7所示,与化合物3相比,式i的化合物对瞳孔收缩的影响也更大。
[0303]
由于基于来自实例1的体外数据,预期所有化合物都具有非常相似的缩瞳活性,因此不会预料到此类结果。
[0304]
实例3
[0305]
黑色素结合
[0306]
进行测定,其中测量式i的化合物的黑色素结合并与包含溴莫尼定在内的另外的化合物的黑色素结合(其结合先前由本发明人确定)进行比较。
[0307]
具体地,测试了式i的化合物(化合物1)、化合物2和阳性对照(氯喹;化合物5)与合成黑色素的结合。式i的化合物(化合物1)和化合物2的测试浓度范围为1.29ng/ml至12,500ng/ml,氯喹的测试浓度范围为19.8ng/ml至8000ng/ml。在含有0.5%或0.6%(v/v)甲酸(分别为化合物1和化合物2)或水(氯喹)中的二甲亚砜中制备化合物储备溶液,然后在pbs中进一步稀释到指定的曲线范围并在37℃下与黑色素一起或不与黑色素一起温育1小时。仅pbs曲线的等分试样在零时间被淬灭以用作稳定性对照和校准标准。离心后,通过lc-ms/ms生物分析对样品进行分析。使用测定pbs曲线反向计算浓度用于结合和稳定性计算。黑色素结合测定的结果以及与先前确定的溴莫尼定黑色素结合的比较可以参见表2。
[0308]
表2
[0309][0310]
从表2中可以看出,式i的化合物显示出比包含溴莫尼定在内的其它α-2-肾上腺素能受体激动剂显著且出乎意料地更低的结合。具体地,在平均结合百分比约为10%或更低的情况下,可以认为式i的化合物没有显著的黑色素结合,与溴莫尼定显著得多的结合形成对比。
[0311]
实例4
[0312]
老花眼的治疗
[0313]
一位56岁的女性抱怨近距离阅读时无法聚焦于文本,这影响了她在工作中阅读文件以及阅读书籍和新闻文章的能力。在如餐厅的昏暗照明等较低的照明条件下,问题似乎更严重。随着时间的推移,视觉退化一直在发生,但最近几个月,这位女性在近距离阅读时无法聚焦于文本的情况更加明显,从而影响了她的生活质量。看诊这位女性的眼科医生进行了视敏度测试,要求她在没有眼镜或隐形眼镜(而两者她都不佩戴)帮助的情况下阅读视力检查表上的字母行。她发现她只能阅读表上的前四行,而视力正常的人应该能够阅读六行。基于这位女性的年龄和测试结果,她被诊断出患有老花眼。这位女性不愿获得老花镜或佩戴隐形眼镜,并且询问是否有任何其它医学治疗。指示她每天一次或两次向她的眼睛施用本文所描述的药物组合物中的一种。从前几剂量开始,患者报告近距离阅读文本时视力有所改善。在对眼科医生的后续拜访中,她再次被要求阅读视力检查表上的字母行(她仍然在向她的眼睛施用具有式i的化合物的组合物),这次她能够阅读前六行,比她在向她的眼睛施用药物组合物之前的先前结果改善了两行。
[0314]
一位48岁的男性注意到他的近视力在过去几年中一直在恶化,以至于他经常不得不将阅读材料保持在几乎一臂远处才能阅读印刷品,尤其是在环境光线暗淡的时候。这位男性拜访了他的眼科医生,眼科医生进行了基本的眼科检查和屈光度评估。基于检查,眼科
医生开具了包括溴莫尼定的组合物以收缩这位男性的瞳孔以治疗老花眼,并且指示这位男性根据需要每天向他的眼睛施用所述组合物。一周后,这位男性回到他的眼科医生处,并表示虽然溴莫尼定组合物对治疗老花眼有效(他不再需要将阅读文件保持在几乎一臂远处),但他发现他必须一天施用所述组合物三次或更多次。眼科医生将这位男性转换为本文所描述的药物组合物之一,并指示他根据需要向他的眼睛施用新组合物,就像他使用溴莫尼定组合物那样。大约一周后,眼科医生对这位男性进行了随访,这位男性报告说他改用的组合物与溴莫尼定组合物一样有效,但与溴莫尼定组合物不同,这位男性一天只需要向他的眼睛施用组合物一次(或有时两次),而不是一天三次或更多次。
[0315]
一位66岁的男性报告对他的双焦点眼镜不满意,由于镜片组成部分的两种不同的折射率,导致他在下楼梯时若干次几乎跌倒。他的眼科医生先前已诊断出他患有老花眼,指示他每天一次向他的眼睛施用本文所描述的药物组合物之一。施用后,患者发现他的近、远视力均有改善,并且他不再需要用眼镜进行近和远视力矫正。
[0316]
一位59岁的女性之前被诊断出患有老花眼,她希望寻找自诊断以来一直佩戴的眼镜和隐形眼镜的替代品。她的眼科医生向她开具了包括溴莫尼定的组合物并指示她根据需要向她的眼睛施用所述组合物。在向她的眼睛施用组合物几天后,她打电话给眼科医生并告诉她,尽管溴莫尼定组合物正在改善她的视力,使得她不需要眼镜或隐形眼镜就可以近距离阅读文本,但她发现她通常需要使用比处方信息表明通常需要的更多量的组合物才能获得满意的结果,并且她正在经历与溴莫尼定相关的一些副作用,如镇静。眼科医生注意到这位女性的虹膜非常深,并怀疑一定量的溴莫尼定(具有相当高的黑色素结合)可能与这位女性的虹膜中的黑色素结合,因此需要她施用更多的溴莫尼定组合物以提供足够的游离(不与黑色素结合)溴莫尼定以达到满意的效果。眼科医生将这位女性的处方改为本文所描述的药物组合物之一,并且指示她向她的眼睛施用所述组合物,就像她使用溴莫尼定组合物那样。大约一周后,眼科医生对这位女性进行了随访,这位女性表示她现在可以用比使用溴莫尼定组合物更少滴数的包括式i的化合物的组合物来获得她的近阅读视力的满意的改善,并且没有经历与α-2-肾上腺素能受体激动剂相关的副作用,如镇静。
[0317]
实例5
[0318]
视觉眩光、星爆和光晕的治疗
[0319]
一位45岁的男性决定接受lasik外科手术。将执行外科手术的外科医生对患者进行评估并确定他是外科手术的合适候选者,但被告知外科手术的副作用包含视觉眩光、视觉星爆和视觉光晕,尤其是在夜间。外科医生在没有任何明显问题的情况下进行了外科手术,患者出院。一天后,患者自外科手术以来第一次在晚上开车回家,并注意到其它汽车的前灯和尾灯以及路灯发出的似乎是星爆,并且有来自这些光源的干扰他视力的眩光。患者还观察到一些路灯和照亮的路牌周围的漫射环。经咨询,外科医生确认此类视觉障碍确实是lasik外科手术后经常出现的视觉眩光、视觉星爆和视觉光晕副作用,并且为患者开具了本文所描述的药物组合物之一,患者将按照包装说明向他的眼睛施用所述药物组合物。下一次患者晚上开车回家时,眩光、星爆和光晕显著减少,使得他不再受到它们的困扰。
[0320]
一位61岁的女性决定她希望接受lasik外科手术,以便不再需要佩戴眼镜。经过外科医生的评估后,她被认为是所述程序的可行候选者。这位女性接受了所述程序并被开具了包括溴莫尼定的组合物,并被指示在她出现任何视觉眩光、视觉星爆和视觉光晕(这是
lasik的常见副作用)时根据需要向她的眼睛施用所述组合物。她在手术后第一次夜间开车时确实注意到了视觉眩光,以及光源和一些照亮的标志周围的星爆和光晕。按照她的外科医生的建议,她在清晨和夜间通勤之前开始施用溴莫尼定组合物。然而,她发现她通常需要施用超过标准剂量才能在减少视觉障碍方面取得满意的效果,而且溴莫尼定量的增加会产生一些副作用,如镇静。这位女性拜访了她的外科医生并将情况告诉了她。外科医生指出,如溴莫尼定等α-2-肾上腺素能受体激动剂有时与如镇静等副作用相关。外科医生认为问题可能在于这位女性的深虹膜可能与溴莫尼定结合,因为已知溴莫尼定会与黑色素结合,并且由于这种结合作用,这位女性可能需要增加溴莫尼定的剂量。然后外科医生给这位女性开具了本文所描述的药物组合物之一,并指示她根据需要向她的眼睛施用新组合物,就像她使用溴莫尼定组合物那样。然后指示这位女性在下一次晚上开车后随访外科医生。这位女性按照指示进行操作并向外科医生报告,表明为了使视觉眩光、视觉星爆和视觉光晕消退,她需要的组合物的滴数比使用溴莫尼定组合物时少得多。
[0321]
一位59岁的男性被认为是lasik外科手术的可行候选者,他选择接受外科手术,而不是必须继续佩戴眼镜或隐形眼镜。这位男性是一名长途卡车司机,他的工作时间很长,他在夜间和清晨开车9小时至13小时(有时更长),并且在白天睡觉。由于这位男性的行车路线位于美国北部地区,这位男性9小时至13小时(或更长)的夜间驾驶几乎都处于黑暗中,尤其是在冬季。这位男性接受了外科手术,但被告知一些lasik患者可能会出现视觉障碍,如视觉眩光、视觉星爆和视觉光晕,尤其是在夜间。鉴于该男子的工作日程,他被给予了包括溴莫尼定的组合物的处方,并被告知如果他经历了夜间视觉障碍,则根据需要将向他的眼睛施用所述组合物。外科手术后不久,当这位男性返回夜间驾驶岗位时,他注意到来自如前灯和尾灯等光源以及照亮的高速公路标志的视觉眩光、视觉星爆和视觉光晕。这位男性按照他的外科医生的要求进行操作,并开始向他的眼睛施用溴莫尼定组合物。他发现,即使溴莫尼定组合物减少了视觉眩光、视觉星爆和视觉光晕,在他的长途驾驶期间,他必须施用所述组合物3次或4次。他联系了他的眼科医生,并询问是否有其它药物可以用来处理可能更持久的视觉障碍。眼科医生开具了本文所描述的药物组合物之一,并且告知这位男性使用该组合物代替。这位男性高兴地发现,在他的长途驾驶期间,他只需要施用一次(或有时两次)所述组合物。
[0322]
实例6
[0323]
夜间视力改善
[0324]
一位62岁的女性注意到,当她在夜间开车时,她很难看到街道标志上的具有良好对比度的街道名称。这位女性咨询她的眼科医生,眼科医生在听到患者的描述并在低光条件下进行视敏度测试后,开具了本文所描述的药物组合物之一,患者根据包装说明将向她的眼睛施用所述药物组合物。下次患者夜间开车时,患者发现她可以看到更好的对比度,从而更好地阅读街道标志。
[0325]
一位45岁的男性是一名夜间保安,他抱怨说他在夜间很难看到具有良好对比度的物体。因为这干扰了他的工作,他会见了一位眼科医生,眼科医生开具了包括溴莫尼定的组合物,并指导这位男性向他的眼睛施用所述组合物。然而,他发现为了获得满意的效果,他经常需要向他的眼睛施用相当大量的所述组合物,并且这些较大的量开始引起有时与溴莫尼定相关的副作用(特别是镇静)。他咨询了他的眼科医生,眼科医生认为问题可能是溴莫
尼定被这位男性虹膜中的黑色素所结合,这位男性的虹膜很深。眼科医生将这位男性转换为本文所描述的药物组合物之一,并指示他施用该组合物而不是溴莫尼定组合物,并将结果报告回眼科医生。这位男性这样做了,几天后当他向眼科医生报告时,他表示他可以用少得多的组合物获得满意的夜间视力改善,并且因此不会遭受他之前经历过的副作用。
[0326]
实例7
[0327]
夜间近视的治疗
[0328]
一位56岁的女性注意到,虽然她在白天的远视力方面没有明显问题,但在夜间,她似乎很难聚焦远处的物体(例如街道标志)。她去看了眼科医生,眼科医生在正常光照条件下和低光条件下都进行了一些视敏度测试。眼科医生确认,这位女性在正常光照条件下远视力没有任何明显问题,但在低光条件下她确实患有近视。她被开具了本文所描述的药物组合物之一,她根据包装说明向她的眼睛施用所述药物组合物。患者发现现在她在夜间聚焦于远处物体的能力与她在白天的能力一样好。
[0329]
一位61岁的男性几乎完全在夜间工作9小时到10小时,他注意到他在夜间无法聚焦于远处物体,而他同龄的同事则没有该问题。他还注意到,反过来,他在白天聚焦于远处物体时没有同样的问题。他拜访了眼科医生,眼科医生诊断出这位男性患有夜间近视并开具了包括溴莫尼定的组合物,并且指示他根据需要向他的眼睛施用所述组合物。这位男性向他的眼睛施用溴莫尼定组合物给他带来了明显改善,即他能够在夜间聚焦于远处物体,但其作用持续时间相当短,因此他经常需要在他的清醒时间期间向他的眼睛施用所述组合物三次或四次以保持满意的效果。他打电话给他的眼科医生,然后眼科医生开具了本文所描述的药物组合物之一并指示他改用该组合物。这位男性这样做了并且发现他现在只需要在他清醒时间期间施用所述组合物一次或两次。
[0330]
实例8
[0331]
调配物a
[0332]
下表3描述了如本文所描述的组合物(调配物a)的一个实例。
[0333]
表3
[0334][0335]
简而言之,将赋形剂(磷酸氢二钠七水合物、柠檬酸一水合物和氯化钠)在适当体积的水中混合直到完全溶解。然后化合物1,作为二盐酸盐一水合物形式:
[0336][0337]
(表中基于游离碱形式的量;参见表注)溶解于溶液中,并用1n盐酸或1n氢氧化钠将ph调节到靶标。最后,将足量的纯净水添加到适量批次。
[0338]
实例9
[0339]
调配物b
[0340]
下表4描述了如本文所描述的组合物(调配物b)的一个实例。
[0341]
表4
[0342][0343]
调配物以与实例8中所描述的相同的方式制备。
[0344]
实例10
[0345]
调配物c
[0346]
下表5描述了如本文所描述的组合物(调配物c)的一个实例。
[0347]
表5
[0348][0349]
调配物以与实例8中所描述的相同的方式制备。
[0350]
实例11
[0351]
调配物d
[0352]
下表6描述了如本文所描述的组合物(调配物d)的一个实例。
[0353]
表6
[0354][0355]
调配物以与实例8中所描述的相同的方式制备。
[0356]
实例12
[0357]
临床研究1:健康个体中的临床研究
[0358]
在此研究中,36名健康参与者(男性和女性;年龄40岁至65岁)随机参与单次递增剂量队列(指定队列1、2和3,如下表9所示),以评估式i的化合物的安全性、耐受性、药代动力学和靶标参与。在此研究的每个队列中,12名参与者以3:1的比例随机接受含有式i的化合物(9名参与者)或媒剂(3名参与者)的滴眼液。向随机接受含有式i的化合物的滴眼液的参与者施用单滴含有式i的化合物的滴眼液,剂量范围为0.01%(w/v)至0.1%(w/v)(调配物a至c;参见实例8至10),可选择在左眼中也使用0.3%(w/v)剂量(调配物d;参见实例11),如下表7所示(“sd”表意指单剂量,“os”意指左眼)。
[0359]
表7
[0360][0361]
三个队列的媒剂如下表8所示。
[0362]
表8
[0363]
组分浓度功能等级柠檬酸(一水合物)0.1(%w/v)缓冲剂usp磷酸氢二钠(七水合物)1.0(%w/v)缓冲剂usp氯化钠0.6(%w/v)张力调节usp盐酸和/或氢氧化钠到ph 7.0ph调节nf/ph eur纯净水到100(%w/v)qs调节ph eur/usp
[0364]
每位参与者在给药前一天晚上(第-1天)进入研究地点。参与者在第一天的早上(第1天)接受其单剂量,并在进行一整天的评估后过夜,并且在第二天(研究访问结束)继续进一步的安全性和药代动力学评估。在每个队列完成后,独立的数据监测委员会审查安全性、药代动力学和靶标参与数据,以确定是否可以接受继续进行下一个计划的给药队列。一
旦此研究的队列2完成,除了就是否启动此研究的最终队列(队列3)提出建议外,数据监测委员会还会就是否开始下一个研究(下方实例13中的队列4)提出建议。
[0365]
安全性和耐受性通过监测此研究的三个队列中的参与者来评估不良事件的表现/报告和监测特征/评估,如生命体征、心电图测量、临床实验室评估、研究干预耐受性和跌落舒适度评估、眼压测量、裂隙灯生物显微镜检查和扩张眼底镜检查。式i的化合物的全身和局部药代动力学通过测量参与者中式i的化合物的血浆和泪液浓度以及测定药代动力学参数,如曲线下面积、清除率、半衰期、最大浓度、达到最大浓度的时间来评估。靶标参与是通过在研究期间测量参与者的瞳孔大小来测量的。具体地,瞳孔直径是用瞳孔计测量中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)和明视(例如≥80cd/m2;靶标处251lux)条件下的近(40cm)和远(4米)靶标。
[0366]
在此研究结束时,在所有三个队列(或至少一个队列)中,作为单剂量施用的式i的化合物的滴眼液在参与者中显示出可接受的安全性和耐受性特性。另外,在所有三个队列(或至少一个队列)中,作为单剂量施用的式i的化合物的滴眼液导致参与者全身暴露,具有足够的安全性范围。另外,在所有三个队列(或至少一个队列)中,与媒剂相比,作为单剂量施用的式i的化合物的滴眼液显示参与者的瞳孔直径减小。
[0367]
实例13
[0368]
临床研究2:老花眼中的临床研究
[0369]
在此研究中,大约108名被诊断患有老花眼的参与者(男性和女性;年龄40岁至65岁)被选择参与。此研究进一步分为a部分和b部分,如下表9所示(“qd”意指每天一次,“ou”意指双眼,“tbd”意指基于a部分的结果确定;调配物a至c是指实例8至9中的那些调配物,并且可以选择使用实例11中的调配物d的调配物)。
[0370]
表9
[0371][0372]
三个队列的媒剂与上述实例12中的媒剂相同。下表10中示出了毛果芸香碱组合物。
[0373]
表10
[0374]
组分浓度功能等级盐酸毛果芸香碱1.25(%w/v)活性物ph eur/usp
苯扎氯铵0.0075(%w/v)防腐剂nf/ph eur/jp硼酸1.0(%w/v)缓冲剂nf/ph eur柠檬酸钠二水合物0.015(%w/v)缓冲剂ph eur/usp氯化钠0.08(%w/v)张力调节ph eur/usp盐酸和/或氢氧化钠到ph 5.0ph调节nf/ph eur用于注射的纯净水/水到100(%w/v)稀释剂ph eur/usp
[0375]
队列4、队列5和队列6(a部分)是多个递增剂量队列,其中参与者随机每天一次在双眼中接受剂量范围为0.01%至0.1%的式i的化合物或媒剂,持续14天。a部分中的每个队列由9名接受主动干预(式i的化合物)的参与者和3名接受媒剂的参与者组成,以评估式i的化合物的安全性、耐受性、药代动力学和临床功效。与实例8一样,在每个队列完成后,独立数据监测委员会审查安全性、药代动力学和靶标参与数据以确定是否可以接受继续进行下一个计划的给药队列。b部分(队列7和队列8)中式i的化合物的剂量由数据监测委员会在队列6完成后选择。
[0376]
队列7是一个单掩蔽、主动比较队列,包含约60名患有老花眼的掩蔽参与者,以1:1的比例随机接受1.25%(w/v)的毛果芸香碱滴眼液或按数据监测委员会推荐的剂量强度施用式i的化合物的滴眼液,持续14天。与1.25%的毛果芸香碱相比,在局部眼部施用式i的化合物后评估安全性、耐受性和功效。与毛果芸香碱相关的常见不良事件(特别是当向眼睛施用时)包含例如头痛、眉痛、调节变化、眼睛刺激、眼痛、模糊视力、视力障碍、眼部模糊、眼部不适、视力模糊、光敏感、刺痛和瘙痒。
[0377]
队列8是用于评估以数据监测委员会推荐的剂量强度施用的式i的化合物的安全性、耐受性、药代动力学和功效的队列,与施用媒剂的佩戴隐形眼镜的患有老花眼的参与者(9名参与者接受式i的化合物,并且3名参与者接受媒剂)进行14天的比较。
[0378]
在此研究的所有队列(队列4至队列8)中,参与者在第1天在诊所接受其第一剂量,并且在给药后10小时留在诊所进行安全性、药代动力学和功效评估。然后参与者从第2天到第7天每天返回一次进行给药和安全性评估。然后,其在第8天至第13天接受多剂量瓶,用于单一单位的在家给药,并在第14天返回诊所进行给药以及在给药后10小时进行安全性、耐受性、药代动力学(仅限队列4至队列6,以及队列8)和功效评估。在第30天,参与者返回进行安全性随访并结束访问。
[0379]
在此研究的a部分和b部分中,安全性和耐受性按照实例12进行评估(即通过监测三个队列中的参与者表现/报告不良事件并监测实例12中监测的特征/评估),其中对比度敏感度、明视(例如≥80cd/m2;靶标处251lux)和中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)、高对比度校正远视敏度(每只眼睛和双目),显然验光(中视和明视)的另外的特征/评估也在a部分中测量。式i的化合物的全身和局部药代动力学通过测量参与者中式i的化合物的血浆和泪液浓度以及测定药代动力学参数来评估,如在实例12中所做的。靶标参与是通过在研究期间测量参与者的瞳孔大小来测量的,如在实例12中所做的。
[0380]
此外,在此研究的a部分和b部分中,式i的化合物的临床功效(与a部分中与媒剂相比,并且在b部分中与1.25%(w/v)的毛果芸香碱相比)主要通过在第14天给药3小时后测量以下参与者的比例来确定:中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)中显示出3行改善、高对比度、双眼距离矫正近视敏度。其次,还通过测量以下参与者的比例来确定临
床功效:中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)中显示出3行或2行改善、高对比度、双眼距离校正近(a部分和b部分)和中间(b部分)视敏度;从基线中视的变化(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)、高对比度、双眼距离校正近视敏度字母;以及从中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)和明视(例如≥80cd/m2;靶标处251lux)瞳孔直径中基线的变化。
[0381]
另外,此研究a部分和b部分的临床功效还通过焦深测量(如用综合屈光检查仪测量的)和五个患者报告的结果问卷/问题确定:1)基于近视力老花眼任务的问卷(nvptq);2)基于电子近视力老花眼任务的问卷(e-nvptq);3)老花眼影响和应对问卷(picq);4)单项患者全局状态印象(pgis)问题;以及5)单项患者全局变化印象(pgic)问题。
[0382]
在包含12个问题的nvptq中,涉及四项阅读任务(具体地,阅读书中的一段、阅读报纸文章的摘录、阅读营养标签的一部分以及阅读餐厅菜单的一段),在没有任何近视力矫正的情况下,参与者在中视(例如3.2cd/m2至3.5cd/m2;靶标处10lux至11lux)条件下完成特定的阅读任务。然后,参与者回答每项任务的3个问题,从而评定其视觉相关阅读能力和对其视觉相关阅读能力的满意度。
[0383]
在包含3个涉及电子阅读任务(具体地在iphone上阅读文本)的问题的e-nvptq中,在没有任何近视力矫正的情况下,参与者在明视≥80cd/m2;靶标处251lux)条件下完成特定的阅读任务。然后,参与者回答任务的3个问题,从而评定其视觉相关阅读能力和对其视觉相关阅读能力的满意度。
[0384]
在picq中,参与者回答20个关于其受到其近距离观察困难的影响程度(例如,发现日常近视力任务困难或经历自我意识)或在之前7天期间有应对行为(例如,改变电子屏幕上的字体大小)的问题。
[0385]
在单问题pgis问题中,参与者回答关于其过去7天在中视条件下近视敏度状态的总体印象的单项问题。
[0386]
在单项pgic问题中,参与者回答关于其在中视条件下近视敏度变化的总体印象的单项问题。
[0387]
在此研究结束时,在a部分的所有三个队列(或至少一个队列)中,双侧施用式i的化合物的滴眼液持续14天在参与者中显示出可接受的(或改善的)安全性和耐受性特性。另外,在a部分的所有三个队列(或至少一个队列)中,双侧施用式i的化合物的滴眼液持续14天导致参与者以足够的安全裕度全身暴露。另外,在a部分的所有三个队列(或至少一个队列)中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的瞳孔直径减小。另外,在a部分的所有三个队列(或至少一个队列)中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的距离矫正近视敏度的数值改善(例如,两行或三行)。另外,在a部分的所有三个队列(或至少一个队列)中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的焦深改善。另外,在a部分的所有三个队列(或至少一个队列)中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出由参与者提供的五项患者报告的结果问卷/问题的回答更积极。
[0388]
同样在此研究结束时,在b部分的两个队列(或至少一个队列)中,双侧施用式i的化合物的滴眼液持续14天在参与者中显示出可接受的安全性和耐受性特性。另外,在b部分的队列7中,与1.25%(w/v)毛果芸香碱相比,式i的化合物的滴眼液在参与者中显示出可接
受的(或改善的,即与施用毛果芸香碱相关联的一种或多种不良事件的发生率相对降低)安全性和耐受性特性。另外,在b部分的队列7中,与1.25%(w/v)毛果芸香碱相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的距离矫正近(和/或中间)视敏度的类似(或更好)改善(例如,两行或三行)。另外,在b部分的队列7中,与1.25%(w/v)毛果芸香碱相比,双侧施用式i的化合物的滴眼液持续14天显示出由参与者提供的五项患者报告的结果问卷/问题的积极回答的数量类似。另外,在b部分的队列8中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的距离矫正近(和/或中间)视敏度的数值改善(例如,两行或三行)。另外,在b部分的队列8中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出参与者的焦深改善。另外,在b部分的队列8中,与媒剂相比,双侧施用式i的化合物的滴眼液持续14天显示出由参与者提供的五项患者报告的结果问卷/问题的积极回答更多。
[0389]
贯穿本说明书,参考了如美国和外国专利申请、期刊文章、书籍章节等出版物。除非另有说明,否则出于所有目的,所有此类出版物均明确通过全文引用并入,包含与对应参考文献一起公开的补充/支持信息部分。如果并入的参考文献中的任何叙述与本文中的任何叙述相冲突,则以本文中的叙述为准。
[0390]
前述描述详述了可用于治疗各种眼部病状的方法,并代表了所设想的最佳模式。其不应被解释为限制本文的整体范围;相反,本公开的范围仅受所附权利要求的合法解释的约束。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。