1.本发明涉及化学药物制剂技术领域,特别是涉及一种托法替布缓释片剂及 其制备方法和应用。
背景技术:
2.枸橼酸托法替布缓释片由辉瑞制药原研,于2016年02月在美国上市,为 jak抑制剂,商品名为xr,主要用于类风湿性关节炎成人患者的治疗, 缓释片较普通片主要优势为通过减少给药次数(普通片为每日用药2次,缓释 片为每日用药1次)增强患者可接受性和顺应性。
3.现有技术公开的枸橼酸托法替布缓释片药物组合物由片芯(活性成分、渗 透源、稠化剂、粘合剂、助流剂、润滑剂)及半透膜(致孔剂、成膜骨架)组 成,片芯由粉末直压工艺制备,半透膜通过致孔剂与成膜骨架协同作用,控制 水渗透速率,进而影响药物释放速度。但是,现有技术公开的枸橼酸托法替布 缓释片药物组合物半透膜强度较差,片剂边缘棱角处易出现破裂现象,药物进 入人体后极大可能“突释”,也使得临床治疗效果和安全性存在较大隐患。此外, 现有技术公开的枸橼酸托法替布缓释片药物组合物还存在批内、批间差异大的 问题。
技术实现要素:
4.基于此,有必要提供一种具有缓慢平稳的释放效果的托法替布缓释片剂及 其制备方法和应用。
5.本发明的一个方面,提供了一种托法替布缓释片剂,包括含有托法替布或 其药学上可接受的盐的片芯和半透膜包衣,所述半透膜包衣包括成膜聚合物、 致孔剂和增塑剂,所述增塑剂为三乙酸甘油酯。
6.在其中一个实施例中,所述半透膜包衣中,增塑剂的含量为5wt%~20wt%。
7.在其中一个实施例中,所述成膜聚合物为乙酸纤维素,和/或,所述致孔剂 为羟丙基纤维素。
8.在其中一个实施例中,所述半透膜包衣中,所述成膜聚合物和所述致孔剂 的质量比为(1~1.7):1。
9.在其中一个实施例中,所述片芯还包括渗透剂、粘合剂、稠化剂和润滑剂, 所述渗透剂为山梨糖醇,所述粘合剂为聚乙烯吡咯烷酮,所述稠化剂为羟乙纤 维素,所述润滑剂为硬脂酸镁。
10.在其中一个实施例中,所述半透膜包衣湿增重为所述片芯重量的9%~12%。
11.本发明的又一个方面,提供了一种所述的托法替布缓释片剂的制备方法, 包括以下步骤:
12.按比例将制备所述片芯的原料混合并采用湿法粒化得到均一颗粒;将所述 均一颗粒进行压片,得到所述片芯;
13.按比例将成膜聚合物、致孔剂和增塑剂溶解在包衣溶剂中形成半透膜包衣 溶液;
14.控制包衣锅在约25℃-30℃的排气温度下,将所述半透膜包衣溶液在所述片 芯表面进行半透膜包衣;
15.打孔,然后进行水溶膜包衣,其中水溶膜包衣液为将opadry包衣粉加 入纯化水溶解制备而成。
16.在其中一个实施例中,所述包衣溶剂为丙酮和水的混合物,其中,所述水 的质量百分比为5%~20%;优选为10%。
17.在其中一个实施例中,所述湿法粒化制备所述均一颗粒的步骤中,使用无 水乙醇作为润湿剂。
18.本发明的还一个方面,提供所述的托法替布缓释片剂或由所述的托法替布 缓释片剂的制备方法制得的托法替布缓释片剂在制备类风湿性关节炎药物中的 应用。
19.与现有技术相比,本发明具有的有益效果为:
20.本发明提供的托法替布缓释片剂,通过在半透膜包衣中加入三乙酸甘油酯 作为增塑剂来改善半透膜包衣的强度,可以避免片剂突释问题,实现缓慢平稳 的释放效果。
21.采用本技术提供的制备方法制备得到的托法替布缓释片剂,含量均匀,解 决了现有技术存在的批间差异的问题,有利于临床疗效和安全。
附图说明
22.图1为专利实施例1-1制备的托法替布缓释片剂和实施例1制备的托法替布 缓释片剂在水中静置释放8h后的释放情况照片,左边为专利实施例1-1制备的 托法替布缓释片释放情况,右边照片为本发明实施例1制备的托法替布缓释片 剂释放情况;
23.图2为参比制剂1~3制备的托法替布缓释片剂在ph为6.8条件下的溶出结 果曲线;
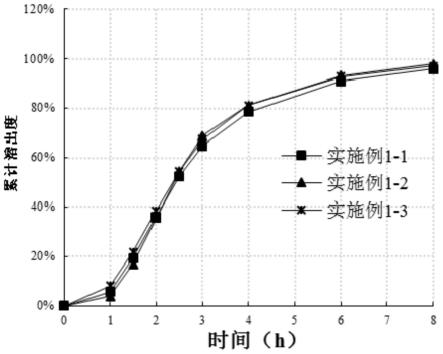
24.图3为实施例1-1、实施例1-2以及实施例1-3制备的托法替布缓释片剂在 ph为6.8条件下的溶出结果曲线;
25.图4为专利实施例1-1、专利实施例1-2以及专利实施例1-3制备的托法替 布缓释片剂在ph为6.8条件下的溶出结果曲线图;
26.图5为市售参比制剂2于ph1.0/20%乙醇和ph1.0/40%乙醇介质进行剂量倾 泻考察的释放曲线图;
27.图6为实施例1制备的托法替布缓释片剂于ph1.0/20%乙醇和ph1.0/40%乙 醇介质进行剂量倾泻考察的释放曲线图;
28.图7为实施例1制备的托法替布缓释片剂和参比制剂3进行be实验时的体 内药时曲线对比图。
具体实施方式
29.为了便于理解本发明,下面将参照相关实施例及附图对本发明进行更全面 的描述。具体实施方式中给出了本发明的较佳实施例。但是,本发明可以以许 多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施 例的目的是使对本发明的公开内容的理解更加透彻全面。
30.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术 领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术 语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的 术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0031]“药学上可接受的”指的是在可靠的医学判断范围内,适合用于与人类或 动物的组织接触而没有过度毒性、刺激或其他问题或并发症,与合理的收益/风 险比相应的那些化合物、材料以及组合物。
[0032]
除了在操作实施例中所示以外或另外表明之外,所有在说明书和权利要求 中表示成分的量、物化性质等所使用的数字理解为在所有情况下通过术语“约
”ꢀ
来调整。例如,因此,除非有相反的说明,否则上述说明书和所附权利要求书 中列出的数值参数均是近似值,本领域的技术人员能够利用本文所公开的教导 内容寻求获得的所需特性,适当改变这些近似值。用端点表示的数值范围的使 用包括该范围内的所有数字以及该范围内的任何范围,例如,1至5包括1、1.1、 1.3、1.5、2、2.75、3、3.80、4和5等等。
[0033]
本发明实施例提供一种托法替布缓释片剂,包括含有托法替布或其药学上 可接受的盐的片芯和半透膜包衣,所述半透膜包衣包括成膜聚合物、致孔剂和 增塑剂,所述增塑剂为三乙酸甘油酯。
[0034]
现有技术中托法替布缓释片剂半透膜包衣强度较差,药物进入人体后极大 可能发生突释,使得临床治疗效果和安全性存在较大隐患。本发明实施例提供 的托法替布缓释片剂,通过在半透膜包衣中加入三乙酸甘油酯作为增塑剂来改 善半透膜包衣的强度,可以避免片剂突释问题,实现缓慢平稳的释放效果。
[0035]
此外,现有技术中托法替布缓释片剂半透膜包衣增重均匀性难以控制,同 时现有技术采用的粉末直压或干法制粒工艺存在物料混合不均匀的问题,导致 药物制剂批内、批间差异大,从而使得临床治疗效果和安全性存在一定的隐患。 而本发明提供的托法替布缓释片剂通过优化颗粒的制备工艺,有效解决了混合 不均匀的问题,并且半透膜包衣增重均匀性更好,显著改善了批内、批间差异 的问题。
[0036]
所述托法替布应理解成所述化合物的任意药学上可接受的形式及盐。托法 替布可以结晶或非结晶形式存在。“药学上可接受的形式”是指任何药学上可接 受的形式,包括溶剂合物、水合物、同晶型体、多晶型物、共结晶、假同晶体、 中性形式、酸加成盐形式及前药。托法替布的药学上可接受的酸加成盐通过用 约一或两个化学当量的药学上可接受的酸处理游离碱的溶液或悬浮液,以常规 方式来制备。常规浓缩及重结晶技术用于分离盐。合适的酸的示例可以包括但 不限于,乙酸、乳酸、琥珀酸、马来酸、酒石酸、枸橼酸、葡萄糖酸、抗坏血 酸、甲磺酸、对甲苯磺酸、苯甲酸、肉桂酸、富马酸、硫酸、磷酸、盐酸、氢 溴酸、氢碘酸、氨基磺酸、磺酸(诸如甲磺酸、苯磺酸)及相关酸。所述托法替布 的一些优选形式包括游离碱及托法替布枸橼酸盐。
[0037]
在一些实施方式中,所述片芯还含有渗透剂。合适的渗透剂的典型类别为 水溶性盐、糖、有机酸及其它低分子量有机化合物,其能够吸水从而在周围包 衣的屏障两端形成渗透压梯度。所述片芯中渗透剂的质量百分含量可为0~75%, 优选60%~75%。渗透剂的具体实例包括但不限于,硫酸镁、氯化镁、氯化钙、 氯化钠、氯化锂、硫酸钾、碳酸钠、亚硫酸钠、硫酸锂、硫酸钠、木糖醇、甘 露糖醇、山梨糖醇、麦芽糖醇等。在一些优选实施方式中,所
述渗透源为山梨 糖醇。
[0038]
所述片芯还可包含粘合剂,包括但不限于,淀粉、羟丙基纤维素、羟丙基 甲基纤维素、甲基纤维素、聚乙烯吡咯烷酮(共聚维酮),优选为聚乙烯吡咯烷 酮;稠化剂,诸如羟乙基纤维素;以及润滑剂,诸如硬脂酸镁。
[0039]
所述片芯为混合托法替布与其他添加剂、赋形剂形成的均一混合物。为获 得均一的混合物,可以使用本领域技术人员已知类型的方法,例如粉末直接压 片法、湿法粒化或干法粒化。在一些优选实施方式中,所述片芯为通过湿法粒 化制备而成的均一颗粒。通过湿法粒化工艺制备片芯,可以使片芯中各物质的 混合均一性更好,有效保障了终产品的均匀性,从而避免了药品批间差异的问 题。所述湿法粒化需要使用润湿剂将混合物进行软化而得到湿颗粒。在一些优 选实施方式中,所述润湿剂为无水乙醇。
[0040]
进一步地,将上述形成的含托法替布的均一颗粒置于制片机中并压缩以完 成片芯的形状来制备片芯。
[0041]
本发明提供的所述半透膜包衣包括成膜聚合物、致孔剂和增塑剂,具有更 优异的强度,可以实现缓慢平稳的释放效果,避免药物进入人体后的突释问题。
[0042]
在部分实施方式中,所述成膜聚合物选自乙酸纤维素、乙酸丁酸纤维素及 乙基纤维素。在一些优选实施方式中,所述成膜聚合物为乙酸纤维素。
[0043]
所述致孔剂是指这样的材料,其被添加至相对溶剂具有低挥发性或无挥发 性的包衣溶液中,使其在包衣过程后仍作为半透膜包衣的一部分,但充分遇水 溶胀或可溶于水,使得其在水性使用环境中提供充满水或水溶胀的通道或“孔
”ꢀ
以允许水通过,由此增强半透膜包衣的透水性。在部分实施方式中,所述致孔 剂选自羟丙基纤维素、羟丙基纤维素和聚环氧乙烷。在一些优选实施方式中, 所述成孔剂为羟丙基纤维素。
[0044]
在部分实施方式中,本技术提供的半透膜包衣中,所述成膜聚合物和所述 致孔剂的质量比为(1~1.7):1,例如为1.25:1、1.5:1、1.6:1或1.65:1。
[0045]
在部分实施方式中,本技术提供的半透膜包衣中,所述增塑剂的含量以质 量百分比计为5wt%~20wt%,例如为6%、8%、10%、12%、14%、16%或18%。 在一些更优选的实施方式中,所述增塑剂的含量为8%~12%。
[0046]
首先通过使用包衣溶剂将上述成膜聚合物、致孔剂和增塑剂形成包衣溶液 且随后通过浸泡、流化床包衣或锅包衣等常规方式进行包衣使所述包衣溶液形 成在所述片芯表面而形成半透膜包衣。在部分实施方式中,所述包衣溶剂为丙 酮和水的混合物。该包衣溶剂体系对人体健康伤害更小,其废液、废气处理难 度更小、成本更低。
[0047]
在部分实施方式中,所述包衣溶剂中水的质量百分比为5%~20%。优选地, 所述包衣溶剂中水的质量百分比为8%~12%;更优选地,所述包衣溶剂中水的 质量百分比为10%。
[0048]
在一些实施方式中,所述半透膜包衣湿增重为9%~12%,例如为9.5%、10%、 10.5%、11%或11.5%。所述半透膜包衣湿增重值为包衣溶液用量和片芯重量的 比值。
[0049]
所述半透膜包衣还需要具有至少一个与包衣的内部及外部连通的递送口, 以使得片芯内容物可释放至片剂外部。在部分实施方式中,所述递送口为孔, 所述孔的尺寸为0.1mm~1mm,优选为0.6mm。
[0050]
本发明另一方面,提供一种所述的托法替布缓释片剂的制备方法,包括以 下步
骤:
[0051]
按比例将制备所述片芯的原料混合并采用湿法粒化得到均一颗粒;将所述 均一颗粒进行压片,得到所述片芯;
[0052]
按比例将成膜聚合物、致孔剂和增塑剂溶解在包衣溶剂中形成半透膜包衣 溶液;
[0053]
控制包衣锅在约25℃-30℃的排气温度下,将所述半透膜包衣溶液在所述片 芯表面进行半透膜包衣;
[0054]
打孔,然后进行水溶膜包衣,其中水溶膜包衣液为将opadry包衣粉加 入纯化水溶解制备而成。
[0055]
本发明再一方面,提供所述的托法替布缓释片剂或由所述的托法替布缓释 片剂的制备方法制得的托法替布缓释片剂在制备类风湿性关节炎药物中的应 用。
[0056]
以下为具体实施例。旨在对本发明做进一步的详细说明,以帮助本领域技 术及研究人员进一步理解本发明,有关技术条件等并不构成对本发明的任何限 制。在本发明权利要求范围内所做的任何形式的修改,均在本发明权利要求的 保护范围之内。
[0057]
实施例
[0058]
各实施例按照表1-1和表1-2所示的配料处方以及以下制备方法制备托法替 布缓释片剂:
[0059]
表1-1片芯处方
[0060][0061]
注:实施例1~8中片芯处方相同,均为表1-1所示。
[0062]
表1-2半透膜包衣处方
[0063][0064]
制备方法:
[0065]
(1)分散、混合:按表1-1所示的处方比例称取各内加物料,依次进行分 散,收集分散后物料,加入湿法制粒机中混合;
[0066]
(2)制粒:向湿法制粒机中加入无水乙醇得软材,进行湿法制粒得湿颗粒;
[0067]
(3)整粒,干燥,采用整粒机干整粒得干颗粒;
[0068]
(4)总混:按处方比例添加外加物料(硬脂酸镁),于混合机混合一定时 间得总混颗粒。
[0069]
(5)压片:控制片重为200mg
±
15mg,素片厚度为4.20
±
0.10mm,硬度 为130
±
20n,得片芯。
[0070]
(6)包衣溶液配制:称取表1-2所示处方量纯化水,在搅拌下缓慢加入羟 丙纤维素,继续搅拌至羟丙纤维素完全溶胀,加入表1-2所示处方量丙酮,搅拌 至溶胀物分散,在搅拌下缓慢加入醋酸纤维素,继续拌至完全溶解,再在搅拌 下加入甘油三乙酯至完全溶解,得3%固体(w/w)的包衣溶液。
[0071]
(7)半透膜包衣:控制包衣锅在约25℃-30℃的排气温度下进行包衣,控 制半透膜包衣湿增重达到9.0%-12.0%时停止喷液;调节包衣锅转速与温度,45℃ 条件下干燥24h干燥半透膜衣片。
[0072]
(8)打孔:采用高速激光打孔设备于椭圆形片剂带末端钻一尺寸为0.6mm 的单孔。
[0073]
(9)水溶膜包衣:称取表1-2所示的处方量纯化水,在搅拌下加入opadry 包衣粉,待分散完全后进行常规水溶膜包衣。
[0074]
制备工艺筛选
[0075]
对比例1粉末直接压片工艺
[0076]
按照表1-1所示的片芯处方和表1-2所示实施例1的半透膜包衣处方制备托 法替布缓释片剂,制备方法为:
[0077]
(1)将山梨糖醇、共聚维酮、羟乙纤维素、枸橼酸托法替布预混。
[0078]
(2)将步骤1中混合物料加入研磨机中研磨,再转移至混合机混合一定时 间,得混
201480015788.1的专利中记载的实施例1的处方和制备方法平行制备3次得到 的托法替布缓释片剂。
[0099]
1.1各实施例溶出效果
[0100]
将实施例1~8制备的托法替布缓释片剂分别作为样品,在ph为6.8条件下 的溶出结果如表2-1所示。
[0101]
表2-1各实施例样品溶出曲线检测结果(ph6.8,n=6)
[0102][0103]
结果显示,各实施例样品均满足1h≤13%;36%≤2.5h≤62%;6h≥85%的 溶出限度要求。
[0104]
另外,实施例1半透膜包衣湿增重9.5%,实施例2半透膜包衣湿增重9.1%, 实施例3半透膜包衣湿增重11.9%,实施例4半透膜包衣湿增重11.6%,实施例 5半透膜包衣湿增重9.3%,实施例6半透膜包衣湿增重10.6%,实施例7半透膜 包衣湿增重9.3%,实施例8半透膜包衣湿增重11.4%。
[0105]
1.2释放效果对比
[0106]
将本发明实施例1制备的托法替布缓释片剂和和专利实施例1-1制备的托法 替布缓释片,置于纯化水中,静置释放8h,结果如图1所示,图1中,左边图 片为专利实施例1-1制备的托法替布缓释片,右边图片为本发明实施例1制备的 托法替布缓释片剂,从附图1中可以看出,专利实施例1-1重现样品,片剂边缘 棱角处出现破裂现象,药物进入人体后很容易“突释”,使得临床治疗效果和安 全性存在较大隐患。而本发明实施例1制备的托法替布缓释片剂,片剂边缘棱 角无破裂现象,可以避免片剂突释。
[0107]
2、加速试验
[0108]
加速试验条件:温度为40℃、相对湿度rh 75%
±
5%。
[0109]
将实施例1制备的托法替布缓释片剂、参比制剂2和专利实施例1-1样品分 别进行加速试验测试,结果如表2-2所示。
[0110]
表2-2
[0111][0112]
结果显示,本发明实施例1制备的托法替布缓释片剂加速1、3、6月各检 查指标与0天相比无明显差异,表明本发明提供的托法替布缓释片剂在加速试 验条件下各项指标均未发生明显变化,质量稳定;而专利实施例1样品与参比 制剂2样品在放置过程中溶出度均明显降低,可见,本发明实施例1制备的托 法替布缓释片剂的质量更优。
[0113]
3.不同比例的成膜聚合物和致孔剂制备的托法替布缓释片剂的溶出效果对 比
[0114]
将实施例1~3制备的托法替布缓释片剂和参比制剂1分别作为样品,考察 其在ph为6.8条件下的溶出情况,结果如表2-3所示。
[0115]
表2-3 ph6.8介质释放曲线检测结果列表(n=6)
[0116][0117][0118]
结果显示,各实施例制备的托法替布缓释片剂与“参比制剂1”溶出曲线相 似因子(f2)均大于50,各实施例制备的托法替布缓释片剂溶出行为均与市售参 比品“参比制剂1”相似,表明成膜聚合物和致孔剂的比例在(1~1.7):1范围 内均满足要求。
[0119]
4.含不同比例的水的包衣溶剂制备的托法替布缓释片剂的溶出效果对比
[0120]
将实施例1、7、8制备的托法替布缓释片剂和参比制剂1分别作为样品, 在ph为6.8条件下的溶出结果如表2-4所示。实施例1纯化水溶剂占比10%, 实施例7纯化水溶剂占比5%,实施例8纯化水溶剂占比20%。包衣溶液透光率 采用紫外-可见光分光光度仪于700nm下检测。
[0121]
表2-4 ph6.8介质释放曲线检测结果列表(n=6)
[0122][0123]
结果显示,各实施例与市售“参比制剂1”溶出曲线相似因子(f2)均大于 50,各实施例制备的托法替布缓释片剂溶出行为均与市售参比品“参比制剂1
”ꢀ
相似,且包衣溶液透光率均大于90%,即成膜聚合物、致孔剂以及增塑剂均溶 解良好,同时避免使用二类溶剂
甲醇仍能满足半透膜包衣溶液配制要求。可见, 包衣溶剂中纯化水质量百分比在5%-20%范围内均满足要求。
[0124]
5.不同种类增塑剂制备的托法替布缓释片剂的溶出效果对比
[0125]
对比例3托法替布缓释片剂的处方配比和制备方法和实施例1基本相同, 不同之处在于,采用的增塑剂种类不同,其增塑剂为甘油。
[0126]
对比例4托法替布缓释片剂的处方配比和制备方法与实施例1基本相同, 不同之处在于,采用的增塑剂种类不同,其增塑剂为聚乙二醇。
[0127]
将实施例1和对比例3、4制备的托法替布缓释片剂分别作为样品,在ph 为6.8条件下的溶出结果如表2-5所示。
[0128]
表2-5
[0129]
样品增塑剂包衣溶液透光率溶出度(n=6)对比例3甘油92.2%1h:15.5%2.5h:62.3%6h:96.8%对比例4聚乙二醇92.7%1h:14.3%2.5h:60.7%6h:97.1%实施例1甘油三乙酯93.9%1h:6.8%2.5h:58.2%6h:95.1%
[0130]
溶出度限度要求为:1h≤13%;36%≤2.5h≤62%;6h≥85%。由此可知, 甘油、聚乙二醇、甘油三乙酯均能满足本发明增塑剂的要求,但甘油与聚乙二 醇在1h~2.5h达不到缓释溶出限度要求,因此,以甘油三乙酯做增塑剂。
[0131]
6.不同含量增塑剂制备的托法替布缓释片剂的溶出效果对比
[0132]
将实施例1、4、5、6制备的托法替布缓释片剂和参比制剂1分别作为样品, 在ph为6.8条件下的溶出结果如表2-6所示。实施例1半透膜处方中增塑剂固 含量占比(w/w)为10%,实施例4半透膜处方中增塑剂固含量占比(w/w)为 20%,实施例5半透膜处方中增塑剂固含量占比(w/w)为5%,实施例6半透 膜处方中增塑剂固含量占比(w/w)为15%。
[0133]
表2-6 ph6.8介质释放曲线检测结果列表(n=6)
[0134][0135][0136]
结果显示,各实施例样品溶出均符合限度要求,半透膜未出现破裂现象, 且与市售“参比制剂1”溶出曲线相似因子(f2)均大于50,其溶出行为均与“参 比制剂1”相似,能够达到与原研制剂一致的治疗效果,表明半透膜包衣中增塑 剂质量比分比在10.0%~20.0%范围内均满足要求,其中,实施例1具有最优的 溶出效果。
[0137]
7.本发明托法替布缓释片剂和现有技术中的托法替布缓释片剂批间差异效 果对比
[0138]
将实施例1-1、实施例1-2以及实施例1-3制备的托法替布缓释片剂、参比 制剂1~3以及专利实施例1-1、专利实施例1-2以及专利实施例1-3制备的托法 替布缓释片剂分别作为样品,在ph为6.8条件下的溶出结果如图2、图3和图 4所示。
[0139]
各样品批间差异统计结果见表2-7,其中溶出测试条件为ph为6.8,n=6。
[0140]
表2-7
[0141][0142][0143]
结果显示,本发明实施例1-1、实施例1-2、实施例1-3制备的托法替布缓 释片剂,采用湿法制粒制备片芯,且于半透膜处方中添加增塑剂,可以显著改 善颗粒流动性与包衣效果。实施例1-1、实施例1-2、实施例1-3制备的托法替 布缓释片剂溶出曲线各个时间点rsd均明显小于市售参比制剂与专利实施例 1-1、1-2以及1-3的样品,表明本发明提供的托法替布缓释片剂溶出批间差异得 到显著改善。
[0144]
8.剂量倾泻考察
[0145]
为考察本发明提供的托法替布缓释片剂在酒精作用下的用药安全性,参考 原研制剂化学审评资料,将本发明实施例1制备的托法替布缓释片剂及市售参 比制剂2分别于ph1.0/20%乙醇和ph1.0/40%乙醇介质进行剂量倾泻考察,释放 度检测结果见表2-8,释放曲线图见图5与图6。其中,纳入相似因子计算的时 间点为30、45、60、90、120min。
[0146]
表2-8剂量倾泻考察释放曲线检测结果(n=3)
[0147][0148][0149]
结果显示,实施例1提供的托法替布缓释片剂在ph1.0/20%乙醇和 ph1.0/40%乙醇介质中释放曲线与参比制剂2相似,且较ph1.0介质释放速率而 言并未出现剂量倾泻现象(剂量倾泻是指由于半透膜破损或溶解而出现溶出度 骤然升高的情况),产品在酒精存在的情形下安全性良好。
[0150]
9.be实验结果
[0151]
本发明实施例1制备的托法替布缓释片剂与原研市售参比制剂3进行生物 等效实验,证实该药物组合物与原研参比制剂生物等效,即临床治疗上两者具 有相同的安全性和有效性。本发明实施例1制备的托法替布缓释片剂的be实验 分析结果见表2-9,体内药时曲线对比图见图7。
[0152]
表2-9
[0153]
考察项相对生物利用度(%)ci-90%-lowci-90%-high判定标准结论c
max
(ng/ml)97.5981.16120.8080.00~125.00等效auc
all
(h*ng/ml)110.73102.97119.0780.00~125.00等效auc
inf-obs
(h*ng/ml)110.75102.93119.1680.00~125.00等效
[0154]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对 上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技 术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0155]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解 本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当 指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下, 还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领 域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或 者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此, 本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于 解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
