1.本专利申请涉及有机化合物合成技术领域,更具体地,涉及一种膦酰基二氢吡喃衍生物的制备方法。
背景技术:
2.有机磷化合物在有机制备,农药化学,材料和催化中起着关键作用,很多有机磷化合物具有抗菌、抗肿瘤、消炎镇痛等生理活性;二氢吡喃普遍存在于一些天然产物和药物分子中,也是重要的药物制备中间体。因此含膦酰基二氢吡喃类化合物的制备研究具有重要的意义。
3.现有技术中,通过二芳基氧磷化合物反应形成磷原子自由基启动自由基加成、环化的反应主要通过银、铜等过渡金属参与(org.lett.,2014,16,21,5616
–ꢀ
5619);上述反应不仅需要用到高温的反应条件,而且需要高价金属离子或过氧化物为氧化剂,因此制备得到的杂环化合物不可避免有重金属残留。
4.综上所述,开发从易得的原料出发,反应条件温和、适用范围广泛、产率高、成本低、符合绿色化学要求的膦酰基二氢吡喃衍生物制备方法非常重要。
5.专利申请内容
6.本专利申请的目的为克服上述现有技术存在的至少一个问题,提供了一种制备膦酰基二氢吡喃衍生物的简便方法。该方法操作简单,成本低廉,收益率高。
7.为了实现上述目的采用以下技术方案,本专利申请采用的技术方案是:
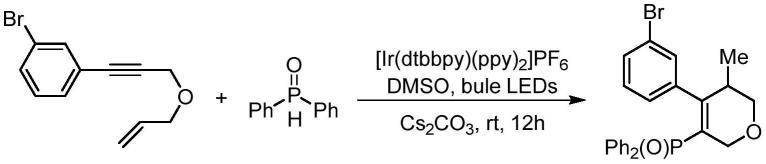
8.一种膦酰基二氢吡喃衍生物的制备方法包括:将1,6-烯炔类化合物、二芳基氧磷、无机碱和光催化剂溶解在溶剂中,且在空气中,室温光照搅拌下发生如下反应方程式的化学反应以制备目标产物,待反应完全后再经柱层析分离提纯即得产品:
[0009][0010]
其中,r为卤素或烷基。
[0011]
优选的,所述光催化剂为(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(iii) 六氟磷酸盐。
[0012]
优选的,所述溶剂选自乙腈、二氯甲烷、四氢呋喃和二甲基亚砜中任意一种或几种。
[0013]
更优选的,所述溶剂为二甲基亚砜。
[0014]
优选的,所述1,6-烯炔类化合物、二芳基氧磷的摩尔比例为1:(1.0~3.0)。
[0015]
优选的,所述无机碱选自cs2co3、na2co3和nahco3中任意一种或几种。
[0016]
更优选的,所述无机碱为cs2co3。
[0017]
优选的,所述反应在可见光照射下进行。
[0018]
优选的,所述可见光的光源为6w蓝光、9w蓝光、12w蓝光中的任意一种。
[0019]
更优选的,所述可见光的光源为12w蓝光。
[0020]
与现有技术相比,本专利申请具有以下有益效果:
[0021]
1、本专利申请中膦酰基二氢吡喃衍生物的制备方法使用极少量、低毒性的光催化剂替代了价格高昂、高毒性的过渡金属引发磷自由基,相对来说更加环保。
[0022]
2、本专利申请中膦酰基二氢吡喃衍生物的制备方法不需要高温,符合绿色环保理念。
[0023]
3、本专利申请中膦酰基二氢吡喃衍生物的制备方法操作简单,后处理方便。
附图说明
[0024]
图1为实施例1制备的(4-(3-溴苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振氢谱图。
[0025]
图2为实施例1制备的(4-(3-溴苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振碳谱图。
[0026]
图3为实施例1制备的(4-(3-溴苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振磷谱图。
[0027]
图4为实施例1制备的(4-(3-溴苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的高分辨质谱图。
[0028]
图5为实施例2制备的(4-(3-氯苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振氢谱图。
[0029]
图6为实施例2制备的(4-(3-氯苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振碳谱图。
[0030]
图7为实施例2制备的(4-(3-氯苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振磷谱图。
[0031]
图8为实施例2制备的(4-(3-氯苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的高分辨质谱图。
[0032]
图9为实施例3制备的(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的核磁共振氢谱图。
[0033]
图10为实施例3制备的(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基) 二苯基氧化膦的核磁共振碳谱图。
[0034]
图11为实施例3制备的(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基) 二苯基氧化膦的核磁共振磷谱图。
[0035]
图12为实施例3制备的(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基) 二苯基氧化膦的高分辨质谱图。
具体实施方式
[0036]
下面将结合实施例对本专利申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本专利申请,而不应视为限制本专利申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生
产厂商者,均为可以通过市售购买获得的常规产品。
[0037]
需要说明的是:
[0038]
本专利申请中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。
[0039]
本专利申请中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。
[0040]
本专利申请中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。
[0041]
本专利申请中,除非有其他说明,数值范围“a~b”表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围“1~3”表示本文中已经全部列出了“1~3”之间的全部实数,“1~3”只是这些数值组合的缩略表示。
[0042]
本专利申请所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。
[0043]
本专利申请中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以按照顺序进行。优选地,本文中的反应方法是顺序进行的。
[0044]
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本专利申请中。
[0045]
本专利申请的提供了一种膦酰基二氢吡喃衍生物的制备方法包括:将1,6
‑ꢀ
烯炔类化合物、二芳基氧磷、无机碱和光催化剂溶解在溶剂中,且在空气中,室温光照搅拌下发生如下反应方程式的化学反应以制备目标产物,待反应完全后再经柱层析分离提纯即得产品:
[0046][0047]
其中,r为卤素或烷基。
[0048]
本专利申请中膦酰基二氢吡喃衍生物的制备方法是将1,6-烯炔类化合物、二芳基氧磷、无机碱和光催化剂溶解在溶剂中,在空气气氛中,室温光照搅拌下发生分子间自由基加成、环化反应制备目标产物。具体的:在空气气氛中,在室温光照下光催化剂催化二芳基氧磷形成磷自由基,与1,6-烯炔类化合物的叁键发生分子间自由基加成后,与双键发生环化反应,制备目标产物。
[0049]
本专利申请中的膦酰基二氢吡喃衍生物的制备方法使用极少量、低毒性的光催化剂替代了价格高昂、高毒性的过渡金属引发磷自由基,相对来说更加环保;再者,本专利申请中的制备方法不需要高温,符合绿色环保理念;最后,本专利申请中膦酰基二氢吡喃衍生物的制备方法操作简单,后处理方便。
[0050]
在一些实施例中,所述光催化剂为(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基) 苯基]铱(iii)六氟磷酸盐。
[0051]
在一些实施例中,所述光催化剂的用量是1,6-烯炔类化合物的5mol%。
[0052]
在一些实施例中,所述溶剂选自乙腈、二氯甲烷、四氢呋喃和二甲基亚砜中任意一
种或几种。
[0053]
在一些更优实施例中,所述溶剂为二甲基亚砜。
[0054]
在一些实施例中,所述1,6-烯炔类化合物、二芳基氧磷的摩尔比例为1:(1.0~3.0)。
[0055]
在一些实施例中,所述无机碱选自cs2co3、na2co3和nahco3中任意一种或几种。
[0056]
在一些更优实施例中,所述无机碱为cs2co3。
[0057]
在一些实施例中,所述反应在可见光照射下进行。
[0058]
在一些实施例中,所述可见光的光源为6w蓝光、9w蓝光、12w蓝光中的任意一种。
[0059]
在一些更优实施例中,所述可见光的光源为12w蓝光。
[0060]
接下来,将以具体实施例说明本专利申请可以高效地合成膦酰基二氢吡喃衍生物。
[0061]
实施例1(4-(3-溴苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的制备和表征
[0062]
称取1-(3-(烯丙基氧基)丙-1-炔-1-基)-3-溴苯50.2mg(0.2mmol)、二苯基氧磷121.2mg(0.6mmol)和光催化剂(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(iii)六氟磷酸盐9.1mg(5%mol)于无色透明反应管中,加入2ml二甲基亚砜溶剂,空气下室温光照搅拌反应,薄层色谱法(tlc)检测反应进度,约12h后,待反应完全,经柱层析分离提纯(石油醚:乙酸乙酯=1:1),得到黄色油状物,该制备方法的产率:62%,该制备方法的收益率高。该实施例对应的化学反应方程式如下:
[0063][0064]
通过对实施例1制备的黄色油状物进行表征,其核磁共振氢谱图、核磁共振碳谱图、核磁共振磷谱图和高分辨质谱图分别如图1、图2、图3和图4所示。从图1可看出1hnmr(400mhz,cdcl3)δ7.66-7.58(m,2h),7.55-7.46(m,4h),7.42-7.35(m,3h),7.29(dd,j=7.6,3.0hz,2h),7.10(ddd,j=8.0,2.0,1.1hz,1h),7.02(dt,j=7.7,1.4hz,1h),6.95(t,j=1.8hz,1h),6.88(t,j=7.8hz,1h),4.29(ddd,j=16.7,4.2,1.6hz,1h),4.08(dt,j=16.7,2.6hz,1h),3.86(dd,j=11.2,4.0hz,1h),3.73(dd,j=11.2,3.4hz,1h),2.45(s,1h),0.96(d,j=7.1hz,3h);分子氢谱波峰能与目标产物一一对应,数量合理。从图2可看出:
13
cnmr(100mhz,cdcl3)δ154.8(d,j=3hz),140.6(d,j=7.9hz),132.1(d,j=102.3hz),131.8(d,j=105.5hz),131.7(d,j=2.5hz),131.5(d,j=2.9hz),131.32(d,j=9.8hz),131.27,131.2(d,j=9.9hz),130.5,129.1,128.5(d,j=11.9hz),128.4(d,j=94.7hz),128.2(d,j=12.2hz),127.7,121.7,70.2,68.0(d,j=18.5hz),36.3(d,j=9.5hz),16.9;分子碳谱波峰能与目标产物一一对应,数量合理。从图3可看出:
31
pnmr(162mhz,cdcl3)δ22.6。从图4可以看出,hrms(esi-orbitrap)m/z:[m h]
calcdforc
24h22
bro2p453.0614,found453.0608。结合以上核磁共振氢谱图、核磁共振碳谱图、核磁共振磷谱图和高分辨质谱图的结果可知,实施例1成功地合成了化合物(4-(3-溴苯基)-5-甲基-5,6-二
氢-二氢吡喃-3-基)二苯基氧化膦,且其分子结构式如下:
[0065][0066]
本实施例中的制备方法,首选使用极少量(只有9.1mg,5%mol)、低毒性的光催化剂(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(iii)六氟磷酸盐替代了价格高昂、高毒性的过渡金属引发磷自由基,相对来说更加环保;然后,该制备方法只需在空气下室温光照搅拌即可完成反应,不需要高的反应温度,避免过多能源消耗,符合绿色环保理念;最后本实施例中的制备方法只需在无色透明反应管在空气下室温光照搅拌即可完成反应,操作较为简单,后处理只需薄层色谱法(tlc)检测反应进度,然后通过柱层析分离提纯得到最终产物,即后处理方便。
[0067]
为了获取制备方法中的最佳实验条件,分别做了以下对比实验。
[0068]
1、溶剂的种类对比
[0069]
反应条件同实施例1,使用不同种类的反应溶剂时,产物产率如下表所示:
[0070]
表1不同种类的反应溶剂时产物的产率
[0071]
溶剂mecndcmthfdmso产率(%)37424462
[0072]
由上表可知,当其他反应条件不变,溶剂为二甲基亚砜时,产物的产率最高。
[0073]
本专利申请人经过进一步的分析发现,上述实验中的反应底物1,6-烯炔类化合物、二芳基氧磷、无机碱和光催化剂在二甲基亚砜(dmso)中的溶解性更好,使得制备反应在无色透明反应管中反应得更加彻底,因此当其他反应条件不变时,溶剂为二甲基亚砜时,产物膦酰基二氢吡喃衍生物的产率最高。
[0074]
2、磷试剂的反应当量对比
[0075]
反应条件同实施例1,使用不同当量的磷试剂,产物产率如下表所示:
[0076]
表2不同当量的二苯基氧磷时产物的产率
[0077]
二苯基氧磷(equiv)1.02.03.0产率(%)315062
[0078]
由上表可知,当其他反应条件不变,二苯基氧磷的用量为1,6-烯炔类化合物的3倍当量时,产物的产率最高。
[0079]
本专利申请人经过进一步的研究发现,上述制备方法中二苯基氧磷的用量增大到1,6-烯炔类化合物的3倍当量时,反应体系中的在室温光照下光催化剂催化二芳基氧磷形成的磷自由基产生的机会更大,更有利于反更有利于反应的向右进行;但如果继续增大用量,由于化学平衡的影响,过量的反应物则会抑制反应的向右进行。因此,当其他反应条件不变,二苯基氧磷的用量为1,6-烯炔类化合物的3倍当量时,产物膦酰基二氢吡喃衍生物的产率最高。
[0080]
3、无机碱的种类对比
[0081]
反应条件同实施例1,使用不同种类的无机碱,产物产率如下表所示:
128.4(d,j=94.4hz),128.1(d,j=12.1hz),127.6,127.2,70.2,68.0(d,j=18.6hz),36.3(d,j=9.5hz),16.9;分子碳谱波峰能与目标产物一一对应,数量合理。从图7可看出:
31
pnmr(162mhz,cdcl3)δ22.4。从图8可看出:hrms(esi-orbitrap)m/z:[m h]
calcdforc
24h22
clo2p409.1119,found409.1115。结合以上核磁共振氢谱图、核磁共振碳谱图、核磁共振磷谱图和高分辨质谱图的结果可知,实施例2成功地合成了化合物(4-(3-氯苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦,且其分子结构式如下:
[0097][0098]
本实施例中的制备方法,首选使用极少量(只有9.1mg,5%mol)、低毒性的光催化剂(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(iii)六氟磷酸盐替代了价格高昂、高毒性的过渡金属引发磷自由基,相对来说更加环保;然后,该制备方法只需在空气下室温光照搅拌即可完成反应,不需要高的反应温度,避免过多能源消耗,符合绿色环保理念;最后本实施例中的制备方法只需在无色透明反应管在空气下室温光照搅拌即可完成反应,操作较为简单,后处理只需薄层色谱法(tlc)检测反应进度,然后通过柱层析分离提纯得到最终产物,即后处理方便。
[0099]
实施例3(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦的制备和表征
[0100]
采用实施例1相同的方法和反应条件,当1,6-烯炔类化合物为1-(3-(烯丙基氧基)丙-1-炔-1-基)-4-叔丁基苯时,得到如下白色固体产物,该制备方法的产率:61%,该实施例中的制备方法的收益率较高。该实施例对应的化学反应方程式如下:
[0101][0102]
通过对实施例3制备的白色固体产物进行表征,经过测试得到该产物的熔点为201-205℃。另外经过测试,其核磁共振氢谱图、核磁共振碳谱图、核磁共振磷谱图和高分辨质谱图分别如图9、图10、图11和图12所示。从图9可看出1hnmr(400mhz,cdcl3)δ7.65-7.58(m,2h),7.52-7.44(m,3h),7.40-7.32(m,1h),7.19(dd,j=8.3,2.5hz,2h),6.95-6.87(m,4h),4.33(ddd,j=16.4,4.2,1.5hz,1h),4.10(dt,j=16.5,2.5hz,1h),3.88(dd,j=11.1,4.0hz,1h),3.75(dd,j=11.2,3.2hz,1h),2.52(s,1h),1.17(s,9h),0.97(d,j=7.1hz,3h);分子氢谱波峰能与目标产物一一对应,数量合理。从图10可看出:
13
cnmr(100mhz,cdcl3)δ156.5(d,j=3.7hz),150.0,135.7(d,j=8hz),132.8(d,j=101.3hz),132.6(d,j=103.5hz),131.4(d,j=9.5hz),131.3(d,j=2.8hz),131.2(d,j=9.8hz),130.9(d,j=2.7hz),128.34,128.28(d,j=11.7hz),127.9(d,j=12.2hz),126.7(d,j=96.6hz),124.3,70.4,68.1(d,j=18.9hz),36.4(d,j=9.8hz),34.3,31.1,17.2;分子碳谱波峰能与目标产物一一对应,数量合理。从图11可看出:
31
pnmr(162mhz,cdcl3)δ23.0。
从图12可看出:hrms(esi-orbitrap)m/z:[m h]
calcdforc
28h31
o2p431.2134,found431.2130。结合以上核磁共振氢谱图、核磁共振碳谱图、核磁共振磷谱图和高分辨质谱图的结果可知,实施例3成功地合成了化合物(4-(4-叔丁基苯基)-5-甲基-5,6-二氢-二氢吡喃-3-基)二苯基氧化膦,且其分子结构式如下:
[0103][0104]
本实施例中的制备方法,首选使用极少量(只有9.1mg,5%mol)、低毒性的光催化剂(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(iii)六氟磷酸盐替代了价格高昂、高毒性的过渡金属引发磷自由基,相对来说更加环保;然后,该制备方法只需在空气下室温光照搅拌即可完成反应,不需要高的反应温度,避免过多能源消耗,符合绿色环保理念;最后本实施例中的制备方法只需在无色透明反应管在空气下室温光照搅拌即可完成反应,操作较为简单,后处理只需薄层色谱法(tlc)检测反应进度,然后通过柱层析分离提纯得到最终产物,即后处理方便。
[0105]
综上所述,本专利申请公开了一种膦酰基取代的六元环状化合物的制备方法,将1,6-烯炔类化合物、二芳基氧磷、无机碱和光催化剂溶解在溶剂中,在空气气氛中,室温光照搅拌下发生分子间自由基加成/环化反应制备目标产物,待反应完全后再经柱层析分离提纯即得产品,并通过1hnmr、
13
cnmr、
31
pnmr和hrms对目标产品的结构进行了表征和分析。
[0106]
另外,本专利申请的制备方法不需要高温、有毒过渡金属催化等复杂的反应条件,只需在温和的反应条件(即在空气下室温光照搅拌)下即可得应用前景广泛的含膦酰基二氢吡喃衍生物。也即该制备方法具有反应条件温和、操作简单、后续处理方便、原料易得等优点,符合绿色环保理念。
[0107]
在本说明书的描述中,参考术语“一个实施方式”、“一些实施方式”、“示意性实施方式”、“示例”、“具体示例”、或“一些示例”等的描述意指结合实施方式或示例描述的具体特征、结构、材料或者特点包含于本专利申请的至少一个实施方式或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施方式或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施方式或示例中以合适的方式结合。
[0108]
尽管已经示出和描述了若干个本专利申请的实施方式,本领域的普通技术人员可以理解:在不脱离本专利申请的原理和宗旨的情况下可以对这些实施方式进行多种变化、修改、替换和变型,本专利申请的范围由权利要求及其等同物限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。